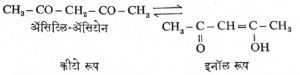कीटोने : > C=O या कार्बोनिल अगर कीटो-गटाला R आणि R’ हे दोन सारखे किंवा वेगवेगळे अल्किल (कार्बन अणूंची साखळी असलेले) अथवा अरिल (कार्बन अणूंचे द्वबंधयुक्त वलय असलेले) गट जोडले म्हणजे बनणाऱ्या सामान्य संयुगांना कीटोने म्हणतात.
त्यांची सामान्य संरचना 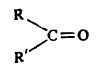 अशी आहे. R व R’ हे गट जर सारखे असतील तर त्यांना साधी कीटोने म्हणतात (उदा., ॲसिटोन, CH3— CO—CH3) व ते निरनिराळे असतील तर त्यांना मिश्र कीटोने म्हणतात (उदा.,ॲसिटोफेनोन, C6H5—CO—CH3). कीटोने ही ॲलिफॅटिक, ॲरोमॅटिक व ॲलिसायक्लिक वर्गांची असतात [→ ॲरोमॅटिक संयुगे; ॲलिफॅटिक संयुगे; ॲलिसायक्लिक संयुगे].
अशी आहे. R व R’ हे गट जर सारखे असतील तर त्यांना साधी कीटोने म्हणतात (उदा., ॲसिटोन, CH3— CO—CH3) व ते निरनिराळे असतील तर त्यांना मिश्र कीटोने म्हणतात (उदा.,ॲसिटोफेनोन, C6H5—CO—CH3). कीटोने ही ॲलिफॅटिक, ॲरोमॅटिक व ॲलिसायक्लिक वर्गांची असतात [→ ॲरोमॅटिक संयुगे; ॲलिफॅटिक संयुगे; ॲलिसायक्लिक संयुगे].
नामकरण : कमी कार्बन अणू असलेल्या कीटोनांतील कार्बोनिल गटाला जोडलेल्या अल्किल गटांच्या नावाला कीटोन हे अंत्य पद लावून कीटोनांची नावे बनवितात. जसे, CH3—CO—CH2—CH3 मिथील एथील कीटोन [CH3CH2CO—CH(CH3)2] एथिल आयसोप्रोपिल कीटोन. जोड साखळीचे अगर प्रतिष्ठापित (एक अणू किंवा अणुगट काढून त्याजागी दुसरा अणू वा अणुगट बसवलेल्या ) गटाचे α, β, ɤ इ. स्थान हे ग्रीक अक्षरांनी दर्शवितात. कार्बोनिल गटापासून सुरुवात करून त्याच्या शेजारच्या स्थानाचा α, त्यानंतरच्या स्थानाचा β इ. अक्षरांनी उल्लेख करतात. प्रतिष्ठापित गट कार्बोनिल गटाच्या दुसऱ्या बाजूसही असतील, तर याच पद्धतीने परंतु α’, β’, ɤ’ ही अक्षरे लावून त्यांचा स्थाननिर्देश केला जातो. उदा.,
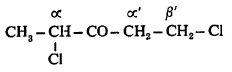 याचे नाव α, β’ -डाय क्लोरो डाय एथिल कीटोन असे आहे.
याचे नाव α, β’ -डाय क्लोरो डाय एथिल कीटोन असे आहे.
इंटरनॅशनल युनियन ऑफ केमिस्ट्री या संस्थेच्या पद्धतीनुसार कीटोनांची नावे, ज्या हायड्रोकार्बनांपासून ती बनविता येतील त्यांच्या नावातील पूर्वपदाला ‘ओन’ हे अंत्यपद जोडून तयार करतात. उदा., CH3—CO—CH2—CH3 ब्युटेनोन. अवश्य असेल तेथे कार्बोनिल गटाचे स्थान कार्बन अणूंना क्रमांक देऊन दर्शवितात. जसे, CH3—CO—CH2—CH2—CH3 पेंटान—२— ओन किंवा २— पेंटानोन.
वलयी कीटोनांची नावे याच पद्धतीने परंतु प्रारंभी ‘सायक्लो’ हे उपपद लावून तयार करतात.
बारा व त्यापेक्षा जास्त कार्बन अणू असलेली कीटोन घन स्वरूपाची असतात. कमी कार्बन अणू असलेली कीटोने द्रवरूप असून त्यांचे वि. गु. पाण्यापेक्षा कमी असते.
मिश्र कीटोनांपैकी सुरुवातीचे मिथील एथिल कीटोन CH3-CO- C2H5 हे संयुग लाकडाच्या ऊष्मीय अपघटनाने (उष्णतेच्या साहाय्याने मोठ्या रेणूंचे लहान रेणू बनविण्याने) मिळणाऱ्या पदार्थात सापडते. तसेच ते द्वितीयक ब्युटिल अल्कोहॉलाच्या 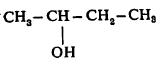 हायड्रोजननिरासाने (हायड्रोजन काढून टाकण्याने) तयार करतात. याचा उपयोग डायमिथिल ग्लायऑक्झाइम हा विक्रियाकारक (रासायनिक विक्रिया करणारे द्रव्य) तयार करण्यासाठी होतो. पिनॅकोलवर सौम्य सल्फ्यूरिक अम्लाची विक्रिया होऊन तयार झालेले पिनॅकोलोन CH3—CO—C(CH3)3 हे १०६० से. उकळबिंदू असलेले आणि कापरासारखा वास असलेले एक द्रवरूप कीटोन आहे.
हायड्रोजननिरासाने (हायड्रोजन काढून टाकण्याने) तयार करतात. याचा उपयोग डायमिथिल ग्लायऑक्झाइम हा विक्रियाकारक (रासायनिक विक्रिया करणारे द्रव्य) तयार करण्यासाठी होतो. पिनॅकोलवर सौम्य सल्फ्यूरिक अम्लाची विक्रिया होऊन तयार झालेले पिनॅकोलोन CH3—CO—C(CH3)3 हे १०६० से. उकळबिंदू असलेले आणि कापरासारखा वास असलेले एक द्रवरूप कीटोन आहे.
निर्मितीच्या सामान्य पद्धती : (१) ॲलिफॅटिक कीटोने: (अ) द्वितीयक अल्कोहॉलांच्या ऑक्सिडीकरणाने [→ ऑक्सिडीभवन] अगर हायड्रोजननिरास करून, ओपेनाऊर ऑक्सिडीकरणाने. (आ) कारबॉक्सिलिक अम्लाच्या कॅल्शियम लवणाच्या ऊर्ध्वपातनाने (उष्णतेने वाफ करणे आणि नंतर ती थंड करून पदार्थ जमवण्याने) अगर (इ) मँगॅनस ऑक्साइड या उत्प्रेरकावरून (विक्रियेची गती वाढविणाऱ्या पदार्थावरून) ३००० से. तापमानात कार्बॉक्सिलिक अम्लाच्या (फॉर्मिक अम्ल वगळून) वाफा सोडून व एखाद्या नायट्राइलावर ⇨ ग्रीन्यार विक्रियाकारकाची क्रिया करून मिळणाऱ्या संयुगाचे जलीय विच्छेदन (पाण्याच्या विक्रियेने मोठ्या रेणूचे लहान रेणू बनविणे) करून ॲलिफॅटिक कीटोने तयार करतात.
(२) ॲरोमॅटिक कीटोने : ह्या कीटोनांचे दोन प्रकार आहेत : (अ) ॲलिफॅटिक-ॲरोमॅटिक म्हणजेच एक अरिल गट असलेली कीटोने आणि (आ) शुद्ध म्हणजे
दोन्ही गट अरिल असलेली कीटोने. उदा., ॲसिटोफेनोन C6H5—CO—CH3 हे पहिल्या प्रकारचे व बेंझोफेनोन C6H5—CO—C6H5 हे दुसऱ्या प्रकारचे कीटोन आहे.
ही कीटोने फ्रीडेल-क्राफ्ट विक्रियेच्या साहाय्याने ॲरोमॅटिक हायड्रोकार्बन व ॲलिफॅटिक अगर ॲरोमॅटिक अम्ल क्लोराइडे यांपासून (निर्जल ॲल्युमिनियम क्लोराइडाच्या सान्निध्यात) बनविता येतात, वसाम्लाच्या कोबाल्ट लवणाच्या सान्निध्यात एथिल बेंझिनाचे हवेत ऑक्सिडीकरण करून तसेच पॉलिहायड्रिक फिनॉल आणि ॲलिफॅटिक किंवा ॲरोमॅटिक नायट्राइल यांच्या ईथर विद्रावातून हायड्रोजन क्लोराइड वायू जाऊ दिल्यास तयार होतात.
(३) वलयी कीटोने : सहा वा जास्त कार्बन अणुंची शृंखला असलेल्या डायकारबॉक्सिलिक अम्लांच्या कॅल्शियम अगर बेरियम लवणाच्या उत्ताप विच्छेदनाने (उच्च तापमानाच्या योगाने रेणूचे तुकडे करण्याने) वलयी कीटोने मिळतात. उदा., पिमेलिक अम्लाचे कॅल्शियम लवणाच्या उत्ताप विच्छेदनाने कॅल्शियम कार्बोनेट व सायक्लोहेक्झॅनोन हे कीटोन मिळते.
उच्च कारबॉक्सिलिक अम्लापासून वलयी कीटोनांची निर्मिती फारच कमी होते; परंतु थोरियम अगर सिरियम लवणे वापरून रूझिका यांनी ३४ कार्बन अणू असलेली कीटोने बनविली आहेत.
गुणधर्म : कमी कार्बन अणू असणारी कीटोने ही प्रवाही द्रव्ये असून त्यांना विशिष्ट वास येतो. ती पाण्यात चटकन मिसळतात पण जसजशी रेणूतील कार्बन अणूंची संख्या वाढत जाते तसतशी त्यांची पाण्यातील विद्राव्यता (विरघळण्याची क्षमता) कमी होत जाते. उच्च कीटोने ही घनरूप असतात. कीटोने क्षपणकारक [→ क्षपण] नाहीत. सामान्य ऑक्सिडीकारकांची त्यांच्यावर क्रिया होत नाही. पण प्रबल ऑक्सिडीकारक वापरल्यास कार्बन शृंखला तुटते व कार्बॉक्सिलिक अम्ले तयार होतात. ईथरामध्ये विरघळलेले सोडियम अगर सोडामाइड व कीटोने यांच्या विक्रियेने लवणसदृश पदार्थ मिळतात.
समावेशक व संघनन विक्रिया : कीटोनांच्या या विक्रिया आल्डिहाइडाप्रमाणेच होतात; परंतु कीटोने सामान्यत: आल्डिहाइडापेक्षा कमी विक्रियाशिल असल्यामुळे त्यांचे बहुवारिकीकरण (अनेक रेणू जोडले जाऊन मोठा रेणू बनणे) होत नाही.
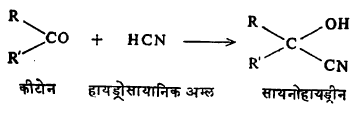
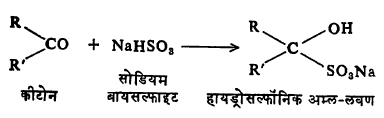
आल्डिहाइडाप्रमाणेच हायड्रोसायानिक अम्ल व सोडियम बायसल्फाइट व ग्रीन्यार विक्रियाकारक यांचे कीटोनांत समावेशन (इतर अणू वा अणुगट स्वत:मध्ये सामावून घेणे) होते. उदा.,
कीटोनांपासून हायड्रॉक्सिल अमाइन, सेमीकार्बाझाइड व प्रतिष्ठापित हायड्रॅझीन यांच्या संघनन (दोन वा अधिक रेणू जोडणाऱ्या) क्रियेने अनुक्रमे कॅटॉक्साइमे, सेमीकार्बाझोने आणि ती ती कीटोन-हायड्राझोने तयार होतात. उदा.,
कीटोनांचे विलगीकरण (मिश्रणातून वेगळे करणे), शुद्धीकरण व अभिज्ञान (अस्तित्व जाणणे) यांकरिता हे अनुजात (एका संयुगापासून रासायनिक विक्रियेने बनलेली दुसरी संयुगे) उपयोगी पडतात.
वायुरूप हायड्रोजन क्लोराइड अगर झिंक क्लोराइड यांच्या सान्निध्यात मरकॅप्टन व कीटोन यांच्यापासून मरकॅप्टॉले तयार होतात.
हॅलोजनाने प्रतिष्ठापन : कार्बोनिल गटाशेजारचे हायड्रोजन अणू हॅलोजन अणूंनी सहज प्रतिष्ठापित होतात. ही विक्रिया क्षारके (अम्लाशी विक्रिया झाल्यास लवणे देणारी संयुगे) अगर अम्ले यांनी उत्प्रेरित होते. एक हॅलोजन असलेली कीटोने अश्रुवायूमध्ये वापरतात. हॅलोजनी कीटोने विषमवलयी (कार्बन व शिवाय एक वा अधिक कार्बनेतर अणू यांचे बनलेले वलय असलेल्या) संयुगांच्या विश्लेषणासाठी उपयोगी पडतात.
कीटोनांचे क्षपण : क्षपणाच्या परिस्थितीनुसार कीटोनापासून विविध संयुगे तयार होतात. प्लॅटिनम उत्प्रेरित हायड्रोजनीकरण, नवजात (रासायनिक विक्रियेने तयार झालेल्या क्षणीच्या) हायड्रोजनाने किंवा ॲल्युमिनियम आयसोप्रोपॉक्साइडाच्या उपयोगाने क्षपण केल्याने द्वितीयक अल्कोहॉले (ज्यांमध्ये-CH-OH गट आहे अशी)तयार होतात (मीरवीन-पॉन्डॉर्फ व्हेर्ले पद्धत). क्लेमेनसेन क्षपणाने कार्बोनिल (CO) गटाचे मिथीलीन (CH2) गटात रूपांतर होते. व्होल्फ-किश्र्नर क्षपणाने हीच विक्रिया जास्त सुकरतेने होते. सोडियम अथवा मॅग्नेशियम यांच्या पारदमेलांनी (पारा व धातू यांच्या मिश्रधातूंनी) किंवा विद्युती क्षपण केल्यास पिनॅकोलाचे अनुजात मिळतात.
पिनॅकोलाचे ऊर्ध्वपातन केल्यास (३००० से. वर) त्यातून पाण्याचा एक रेणू बाहेर पडतो आणि पुनर्रचना होऊन पिनॅकोलोन तयार होते.
यालाच पिनॅकोल-पिनॅकोलोन पुनर्रचना म्हणतात व ती टर्पिन श्रेणीसाठी महत्त्वाची आहे. पिनॅकोलाचे निर्जलीकरण होऊन पाण्याचे दोन रेणू बाहेर पडले म्हणजे डायमिथिल ब्युटाडाइन बनते. ही विक्रिया ॲल्युमिनियम ऑक्साइड हा उत्प्रेरक वापरून करता येते.
ॲरोमॅटिक कीटोने ही रासायनिक दृष्टया सामान्यत: ॲलिफॅटिक कीटोनांसारखी आहेत. ॲसिटोफेनोन C6H5-CO-CH3 हे द्रवरूप किंवा स्फटिकरूपात असते. वितळबिंदू २०० से. असतो. हॅलोजनीकरणाने फेनॅसील क्लोराइड अगर ब्रोमाइड (C6H5-CO-CH2Br) तयार होतात. ही संश्लेषणामध्ये (कृत्रिम रीतीने रासायनिक संयुगे तयार करण्यामध्ये) वापरतात. ती प्रबल अश्रुकारी आहेत. बेंझाल्डिहाइडाशी संघनन केल्यास चाल्कोने (C6H5-CO-CH=CH-C6H5) तयार होतात.
बेंझोफेनोनाचे दोन प्रकार अस्तित्वात आहेत. एकाचा वितळबिंदू ४८०से. असून ते स्थिर आहे, तर दुसरे अस्थिर असून त्याचा वितळ बिंदू २६० से. आहे. हे बेंझोफेनोन पाण्यात अविद्राव्य असून कार्बनी विद्रावकांत (विरघळविणाऱ्या पदार्थांत) सहज विरघळते. सोडियम पारदमेलाने क्षपण केल्यास बेंझहायड्रॉल C6H5-CH.(OH)C6H5 तयार होते.
विलगेरॉट-विक्रिया : ॲलिफॅटिक-ॲरोमॅटिक कीटोने जलीय सल्फर- अमोनियम – सल्फाइड विद्रावाबरोबर दाबपात्रात सु. १६०० से. तापमानास तापविल्यास कीटोनात असलेल्या कार्बन अणूंइतके कार्बन अणू असलेले कार्बॉक्सिलिक अम्ल (R=OH) आणि त्याचे अमाइड (R=NH2) तयार होते.
एक्झाल्टोन (सायक्लोपेंटाडेकानोन) हे संश्लेषित वलयी कीटोनाचे एक उदाहरण आहे. याचा वास कस्तुरीसारखा आहे म्हणून नैसर्गिक कस्तुरीऐवजी सुगंधी पदार्थांच्या व्यवसायात हे वापरतात. सायक्लोहेक्झॅनोन नायलॉन निर्मितीत उपयोगी पडते.
 ज्या संयुगांच्या रेणूत दोन कीटो गट असतात त्यांना डायकीटोने म्हणतात. हे गट एकमेकांशेजारी असतात अथवा मध्ये एक किंवा अधिक कार्बन अणू सोडून असतात. कीटो गटांच्या अशा स्थान भिन्नत्वानुसार डायकीटोनाचे वेगवेगळे प्रकार होतात.
ज्या संयुगांच्या रेणूत दोन कीटो गट असतात त्यांना डायकीटोने म्हणतात. हे गट एकमेकांशेजारी असतात अथवा मध्ये एक किंवा अधिक कार्बन अणू सोडून असतात. कीटो गटांच्या अशा स्थान भिन्नत्वानुसार डायकीटोनाचे वेगवेगळे प्रकार होतात.
डाय-ॲसिटिल CH3-CO-CO-CH3 हे १, २ डायकीटोन अगर α-डायकीटोन वर्गातील पहिले संयुग आहे. हा पिवळसर हिरव्या रंगाचा द्रव पदार्थ असून तो ८८० से. तापमानाला उकळतो. पाणी, अल्कोहॉल व ईथर यांत हा विद्राव्य असून याच्या अतिविरल विद्रावाला लोण्याचा विशिष्ट वास येतो. मिथिल- एथिल कीटोनाच्या ऑक्सिडीकरणाने तो बनविता येतो.![]()
ॲसिटिल-ॲसिटोन हे १, ३ डायकीटोन अगर β- डायकीटोन वर्गापैकी एक संयुग आहे. तो एक वर्णहीन व विशिष्ट वासाचा द्रव पदार्थ असून १३९० से. ला उकळतो. त्याची कीटो-इनॉल अशी दोन चलसमघटकी [→ समघटकता] रूपे समतोल अवस्थेत (डावीकडून उजवीकडे व उजवीकडून डावीकडे होणाऱ्या विक्रियांचा वेग सारखा असलेल्या अवस्थेत) असतात.
संदर्भ : Beyer, H., Organic Chemistry, London, 1963.
लेखक : मिठारी, भू. चिं.