ॲलिसायक्लिक संयुगे: ज्यांचे गुणधर्म ॲलिफॅटिक संयुगांसारखे आहेत परंतु संरचना (अणूंची मांडणी) वलयी आहे, अशा संयुगांस ‘ॲलिसायक्लिक संयुगे’ म्हणतात. ‘ॲलि’ या पदाने त्यांचा ॲलिफॅटिकांशी असलेला संबंध व ‘सायक्लिक’ (वलयी) या पदाने संरचनेचे वैशिष्ट्य ध्वनित केले जाते.
वलयी संरचनेमुळे या संयुगांत त्रिमितीय मांडणीचा प्रश्न उद्भवतो. वलयीभवन (वलयी मांडणी तयार होणे) व वलयभंग (वलयी मांडणी फुटणे) घडविणाऱ्या विक्रियांवर आणि वलयातील किंवा वलयाला प्रत्यक्ष जोडलेल्या विक्रियाशील (विक्रिया करू शकतील अशा) गटांच्या गुणधर्मांवर तिचा परिणाम दिसून येतो.
ॲलिफॅटिक संयुगांप्रमाणेच या वर्गातही तृप्त (ज्यामध्ये मोकळ्या संयुजा नाहीत, → संयुजा) व अतृप्त हायड्रोकार्बने व त्यांचे विविध अनुजात (एका संयुगांपासून तयार केलेली दुसरी संयुगे) यांचा अंतर्भाव होतो. तृप्त ॲलिसायक्लिक हायड्रोकार्बनांना सायक्लोअल्कने, सायक्लोपॅराफिने किंवा पॉलिमिथिलिने असेही म्हणतात. अतृप्त ॲलिसायक्लिक हायड्रोकार्बनात सायक्लोअल्किने (सायक्लोओलेफिने) व सायक्लोअल्काइने यांचा अंतर्भाव होतो. सायक्लोअल्किनांत एक द्विबंध (दोन बंध असलेले) व सायक्लोअल्काइनांत एक त्रिबंध (तीन बंध असलेले) असतो.
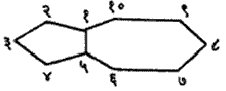
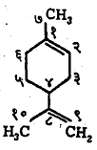 नामकरण : ॲलिफॅटिक वर्गातील संयुगांच्या नावामागे ‘सायक्लो’ हा उपसर्ग लावला म्हणजे तितकीच कार्बन संख्या असणाऱ्या ॲलिसायक्लिक संयुगाचे नाव बनते. प्रतिष्ठापित (संयुगातील एक अणू काढून त्या जागी दुसरा अणू घालणे) अणू, गट अथवा द्विबंध इत्यादींची स्थाने वलयी व वलयेतर कार्बन-अणूंना क्रमांक देऊन दर्शविली जातात. उदा., या संयुगाचे नाव १–मिथिल ४–आयसोप्रोपिटल सायक्लोहेक्झा–१, ८–डायीन असे आहे.
नामकरण : ॲलिफॅटिक वर्गातील संयुगांच्या नावामागे ‘सायक्लो’ हा उपसर्ग लावला म्हणजे तितकीच कार्बन संख्या असणाऱ्या ॲलिसायक्लिक संयुगाचे नाव बनते. प्रतिष्ठापित (संयुगातील एक अणू काढून त्या जागी दुसरा अणू घालणे) अणू, गट अथवा द्विबंध इत्यादींची स्थाने वलयी व वलयेतर कार्बन-अणूंना क्रमांक देऊन दर्शविली जातात. उदा., या संयुगाचे नाव १–मिथिल ४–आयसोप्रोपिटल सायक्लोहेक्झा–१, ८–डायीन असे आहे.
बहुवलयी संयुगातील वलये सामान्यत: पुढील चार प्रकारांनी जोडलेली असतात.
(१) एका वलयातील कार्बन अणू दुसऱ्या वलयातील कार्बन अणूला प्रत्यक्ष अथवा एखाद्या कार्बन अणूच्या द्वारे जोडलेला असतो.
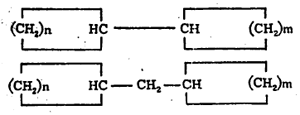
(२) एक कार्बन अणू दोन्ही वलयांना समाइक असतो.
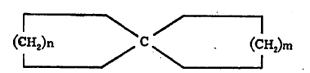
(३) शेजारचे दोन कार्बन अणू दोन्ही वलयांना समाइक असतात.
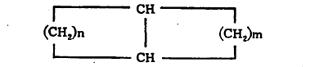
(४) एकमेकांशेजारी नसलेले दोन कार्बन अणू एक अथवा अधिक कार्बन अणूंच्या सेतूने जोडलेले असतात.
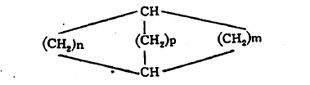
(वरील सूत्रांतीलn, m वp ही अक्षरे कार्बन-अणूंच्या संख्या दर्शवितात). संयुगात दोन जोडलेली वलये असल्यास त्या संयुगाच्या नावात ‘बायसायक्लो’ हे पद प्रथम येते. वलयांच्या समाइक कार्बन अणूंना जोडणाऱ्या रेषेस ‘सेतू’ म्हणतात. या सेतूवर कार्बन अणू असल्यास त्याची संख्याही व्यक्त करावी लागते. सेतुयुक्त संयुगांचे नामकरण करण्यासंबंधी संकेत असा आहे की, त्याचे नाव त्यातील सर्व कार्बन अणू मोजून तितकीच संख्या असणाऱ्या ॲलिफॅटिक संयुगाच्या नावापूर्वी ‘बायसायक्लो’ हा उपसर्ग लावून बनवावे. उदा., खाली दिलेल्या सूत्रांतील १ व २ ही संयुगे बायसायक्लोडेकेन आहेत. यांपैकी कोणता अभिप्रेत आहे हे निश्चित समजावे म्हणून प्रथम सेतूच्या डाव्या बाजूकडील वलयातील कार्बन अणूंची संख्या, नंतर उजव्या बाजूकडील वलयातील कार्बन अणूंची संख्या आणि अखेरीस सेतूवर असणाऱ्या कार्बन अणूंची संख्या ‘बायसायक्लो’ या पदानंतर कंसात वरील अनुक्रमाने देण्याचा प्रघात आहे.
|
|
बायसायक्लो (३, ५, ०) डेकेन |
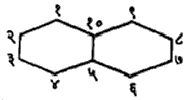 |
बायसायक्लो (४, ४, ०) डेकेन |
|
|
बायसायक्लो (२, २, १) हेप्टेन |
वलयामध्ये प्रतिष्ठापित अणू अथवा गट असल्यास त्याचे नाव व स्थान यांचाही अंतर्भाव नावात केला जातो.
एक कार्बन अणू समाईक असलेल्या द्विवलयी संयुगाचे नामकरण ‘स्पायरो’ या उपसर्गाने केले जाते. उदा.,
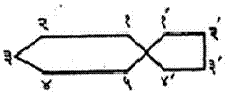 |
स्पायरो (५, ४) डेकेन |
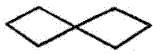 |
स्पायरो (३, ३) हेप्टेन |
कित्येकदा शास्त्रीय नावे लांबलचक झाल्यामुळे गैरसोयीची होतात. त्यामुळे घोटाळा होण्याचा संभव नसेल तेथे संयुगांची व्यावहारिक नावेही वापरली जातात.
उपस्थिती व प्राप्ती: ॲलिसायक्लिक हायड्रोकार्बने व त्यांचे अनुजात निसर्गात अनेक खनिज, वनस्पतिज व प्राणिज पदार्थांत आढळतात. सायक्लोपेंटेन, सायक्लोहेक्झेन इ. हायड्रोकार्बने व त्यांचे अनुजात खनिज तेलाच्या कित्येक खाणींतील अशुद्ध तेलात आढळतात. या हायड्रोकार्बनांना ‘नॅप्थिने’ असे म्हणतात. वनस्पतींपासून मिळणाऱ्या ⇨टर्पिने या संयुगवर्गात अनेक ॲलिसायक्लिक संयुगे आहेत. उदा., लिंबू, संत्रे इत्यादींत असणारे लिमोनीन, पाइन वृक्षापासून मिळणाऱ्या टर्पेंटाइनामधील आल्फा व बीटा पायनिने व यूकॅलिप्टस तेल इ. बाष्पनशील (कमी तापमानास बाष्प होणाऱ्या) तेलांतील घटक कापूर, कस्तुरीमृगापासून मिळणाऱ्या कस्तुरीतील मस्कोन (C15H30C=O), एका जातीच्या मांजरापासून मिळणाऱ्या ‘सिव्हेट’ या सुगंधाचा घटक सिव्हेटोन (C16H30 C=O) ही ॲलिसायक्लिक किटोनांची उदाहरणे होत.
उद्योगधंद्यात व सैद्धांतिक दृष्टीनेही ॲलिसायक्लिक संयुगास महत्त्व असून त्यांच्यापैकी कित्येक संश्लेषणाने (कृत्रिम रीतीने) तयार करण्यात आलेली आहेत. शृंखलायुक्त कार्बनी संयुगांचे वलयीकरण, वलयी रचना मूलत: असलेल्यांचा वलयविस्तार (वलयातील कार्बन अणूंची वाढ) अथवा वलयसंकोच (वलयातील कार्बन अणू कमी होणे) या क्रिया सामान्यतः या कामी वापरल्या जातात.
काही सामान्य ॲलिसाक्लिक हायड्रोकार्बनांची नावे, सूत्रे व गुणधर्म पुढील कोष्टकात दिली आहेत.
|
ॲलिसायक्लिक हायड्रोकार्बने |
|||||
|
शास्त्रीय नाव |
सूत्र |
वितळबिंदू °से. |
उकळबिंदू °से. |
वि.गु. |
|
|
सायक्लोप्रोपेन |
C3H6 |
-१२७ |
-३२ |
०·६८८ |
|
|
सायक्लोब्युटेन |
C4H8 |
-८० |
११ |
०·७०४ |
|
|
सायक्लोपेंटेन |
C5H10 |
-९४ |
४९·५ |
०·७४६ |
|
|
सायक्लोहेक्झेन |
C6H12 |
६·४ |
८०·८ |
०·७७८ |
|
|
सायक्लोहेप्टेन |
C7H14 |
-१३ |
११७ |
०·८१० |
|
|
सायक्लोहेक्झीन |
C6H10 |
-१०३·७ |
८३ |
०·८१० |
|
|
सायक्लोपेंटाडाइन |
C5H6 |
-८५ |
४०–४२ |
०·८०५ |
|
|
सायक्लोऑक्टाईन |
C8H12 |
– |
७२–७६* |
०·८४४ |
|
|
*१००मिमी. दाबाखाली. |
|||||
भौतिक गुणधर्म: ॲलिसायक्लिक हायड्रोकार्बने ही अनुरूप ॲलिफॅटिक हायड्रोकार्बनांपेक्षा १०°ते २०° से. अधिक तापमानास उकळतात. सामान्य (n) ॲलिफॅटिक संयुगांचे वितळबिंदू वाढत्या रेणूभाराबरोबर वाढत जातात, पण ॲलिसाक्लिक हायड्रोकार्बनांचे वितळबिंदू वाढत्या रेणुभाराबरोबर काही मर्यादेपर्यंच वाढत जातात व नंतर कमी होतात. त्यांची घनताही काही मर्यादेपर्यंत वाढत जाते व नंतर कमी होत जाते. गुणधर्मांतील या भेदांवरून असे दिसते की, ॲलिसायक्लिक वलयात चौदापर्यंत कार्बन अणू असणाऱ्या संयुगांचा रेणू स्थूल मानाने गोलाकार असतो व त्यापेक्षा अधिक कार्बन अणू असणाऱ्या संयुगांच्या वलयांच्या बाजू समांतर होत जातात. त्यामुळे त्यांचे गुणधर्म निर्वलयी (वलय नसलेली) शृंखला असणाऱ्या हायड्रोकार्बनांसारखे होऊ लागतात.
रासायनिक गुणधर्म: ॲलिफॅटिक हायड्रोकार्बनांप्रमाणे ॲलिसायक्लिक हायड्रोकार्बनांवर उष्णता आणि रासायनिक विक्रियाकारक यांचा परिणाम होत नाही. याला अपवाद ॲलिसायक्लिक मालेतील सुरुवातीची म्हणजे तीन व चार अणूंचे वलय असलेली संयुगे होत. विक्रियाकारकांचा परिणाम होऊन यांची वलये सुलभतेने भंगतात. उदा., उत्प्रेरक (विक्रियेत प्रत्यक्ष भाग न घेता ती जलद घडवून आणणारा पदार्थ) व हायड्रोजन यांच्या विक्रियेमुळे सायक्लोप्रोपेनाचे n–प्रोपेनात रूपांतर होते म्हणजेच समावेशी (दोन अणूंचा वा अणुगटांचा समावेश झाल्यामुळें द्विबंधाचे एकाच बंधात रूपांतर झालेले) संयुग तयार होते.
|
|
H2, Ni → १२० ° से. |
CH3–CH2–CH3 |
|
सायक्लोप्रोपेन |
n-प्रोपेन |
ब्रोमीन, हायड्रोजन ब्रोमाइड किंवा सल्फ्यूरिक अम्ल यांच्या विक्रियेनेही वलय सहज भंगते.
सायक्लोओलेफिनातील द्विबंध हा ॲलिफॅटिक संयुगातील द्विबंधापेक्षा अधिक विक्रियाशील असतो आणि त्याच्या भंगण्याने दोन विक्रियाशील गट असलेली संयुगे तयार होतात.
|
|
उष्ण व सांद्र → HNO3 |
HCOO–(CH2)4–COOH |
|
सायक्लोहेक्झेन |
ॲडिपिक अम्ल |
ॲलिसायक्लिक मालेतील उच्च सजातीय संयुगांची वलये सापेक्षत: अधिक स्थिर असतात.
इ.स. १८८० पर्यंत पाच व सहा कार्बन अणूंची वलयेच माहीत होती. परंतु त्यानंतर लवकरच तीन, चार व सात कार्बन अणू असलेली वलये संश्लेषणाने बनविण्यात आली. त्यांच्या स्थिरतेच्या तुलनेवरून असे दिसून आले की, सायक्लोपेंटेन व सायक्लोहेक्झेन ही सर्वांत स्थिर असून त्यांच्या खालोखाल सायक्लोब्युटेन स्थिर आहे. सायक्लोप्रोपेन सर्वांत अस्थिर असून त्याचे गुणधर्म अतृप्त हायड्रोकार्बनांसारखे असतात. स्थिरतेतील हा फरक कशामुळे पडतो, हे स्पष्ट करण्याकरिता फोन बायर यांनी १८८५ मध्ये ‘ताण सिद्धांत’ पुढे मांडला.
कार्बन अणूच्या संयुजा, नियमित चतुष्फलकाच्या (सर्व बाजू सारख्या असलेल्या पिरॅमिडसारख्या घनाकृतीच्या) कोनांच्या दिशांनी कार्य करतात, असे व्हांट हॉफ व ल बेल या संशोधकांनी अगोदरच (१८७४) दाखविले होते. त्यामुळे दोन संयुजांमधील स्वाभाविक कोन १०९°२८’ होतो. बायर यांच्या सिद्धांतानुसार जेव्हा कार्बन वलये बनतात तेव्हा या कोनात फरक पडतो व त्यामुळे संयुजांवर कमीजास्त ताण पडतो. हा ताण जितका जास्त तितके ते वलयी संयुग अस्थिर बनते, असे त्यांनी प्रतिपादन केले.
आकडेमोड केल्यास असे दिसून येईल की, सायक्लोप्रोपेनाच्या ३ कार्बनी वलयांचा संयुजा ताण +२४०४४’, सायक्लोब्युटेनाचा +९०४४’ सायक्लोपेंटेनाचा +००४४’ व सायक्लोहेक्झेनाचा -५०१६’ इतका आहे. वलयाचा संयुजाकोन स्वाभाविक कोनापेक्षा कमी असला म्हणजे पडणारा ताण + या चिन्हाने व मोठा झाला असता पडणारा ताण – या चिन्हाने दर्शविला आहे.
या सिद्धांताप्रमाणे पाचापेक्षा बरेच जास्त कार्बन अणू ज्यामध्ये असतील, अशी वलये अस्तित्वात येणे अशक्य आहे. बायर यांच्या काळी अशी वलये माहीत नव्हती व त्यामुळे हा सिद्धांत समाधानकारक वाटला. परंतु कालांतराने आठ, दहा, इतकेच नव्हे, तर तीस व त्यापेक्षाही जास्त कार्बन अणू ज्यांमध्ये आहेत अशी वलयेही संश्लेषणाने सिद्ध करता आली व ती स्थिर असतात असे दिसून आले. त्यामुळे या वस्तुस्थितीची संगती कशी लावावी हा प्रश्न पडला.
वलयातील कार्बन अणू एका प्रतलात (पातळीत) असतात असे बायर यांनी गृहीत धरले होते व ते या विसंगतीचे कारण आहे, असे प्रत्ययास आले. झाक्स यांनी १८९० मध्ये असे दाखविले की, वलयी कार्बन अणू जर वेगवेगळ्या प्रतलांत असतील, तर मोठमोठ्या वलयांतील कार्बन अणूंचे संयुजाकोन स्वाभाविक राहू शकतील व अशी वलये स्थिर होतील.
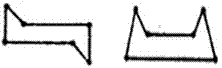 |
|
|
खुर्चीरूप |
नौकारूप |
संयुजाकोनात फरक न करता सायक्लोहेक्झेनाचे दोन प्रकार, कार्बन अणू वेगवेगळ्या प्रतलात जाऊ दिले तर, संभवतात असे त्यांनी सुचविले. त्यांपैकी एका प्रकारास ‘खुर्चीरूप’ व दुसऱ्यास ‘नौकारूप’ असे म्हणतात.
अशा दोन्ही रूपांचे अस्तित्व सिद्ध झालेले असून असमतल (एकाच पातळीत नसणाऱ्या) ताणरहित वलयांच्या कल्पनेला निःसंदिग्ध पुरावा मिळाला आहे.
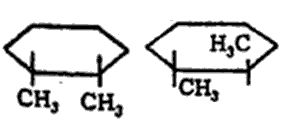
वलयी रचनेमुळे कार्बन अणूंच्या परिवलनास अटकाव होतो. त्यामुळे दोन अथवा अधिक प्रतिष्ठापित गट संयुगात असल्यास त्यांची अवकाशात मांडणी वेगवेगळी होऊ शकते व त्यामुळे त्रिमितीय समघटकता (रेणूतील अणूंची संख्या व प्रकार तेच परंतु संरचना निरनिराळी असणे) संभवते. उदा., डायमिथिल सायक्लोहेक्झेनाचे दोन प्रकार संभवतात. एकामध्ये दोन्ही मिथिल गट वलयाच्या एका बाजूला (समपक्ष) व दुसऱ्यात एकमेकांच्या विरूद्ध बाजूंना (विपक्ष) असतात.
|
|
|
|
समपक्ष १:२ डायमिथिल |
विपक्ष १:२ डायमिथिल |
|
सायक्लोहेक्झेन |
सायक्लोहेक्झेन |
उपयोग: शस्त्रक्रियेत प्रभावी शुद्धिहारक म्हणून सायक्लोप्रोपेनाचा उपयोग कित्येकदा केला जातो. बेंझिनापासून हायड्रोजनीकरणाने (हायड्रोजनाचा समावेश करून) मिळणारे सायक्लोहेक्झेन विद्रावक (विरघळवणारा पदार्थ) म्हणून वापरले जाते. फिनॉलाच्या हायड्रोजनीकरणाने बनणारे सायक्लोहेक्झेनॉल, नायलॉन तयार करण्याकरिता मध्यस्थ संयुग अंतिम पदार्थ मिळविण्यासाठी प्रक्रियेच्या मधल्या टप्प्यात वापरावे लागणारे संयुग) म्हणून उपयोगी पडते. मस्कोन, सिव्हेटोन इ. ॲलिसायक्लिक कीटोने व टर्पीन वर्गातील अनेक संयुगे सुगंधी द्रव्यांच्या व्यवसायात वापरली जातात. संश्लिष्ट कापूर प्लॅस्टिकच्या धंद्यात उपयोगी पडतो.
पहा : ॲरोमॅटिक संयुगे ॲलिफॅटिक संयुगे कार्बनी रसायनशास्त्र.
संदर्भ : 1.Bayer, H. Organic Chemistry, London, 1963.
2. Fieser, L. F. Fleser, M. Organic Chemistry, Bombay, 1962.
3. Finar, I. L. Organic Chemistry, Vols. 2, London, 1962.
केळकर, गो. रा.
“