फॉस्फरस : एक अधातवीय घनरूप बहुरूपी (संरचनेच्या दृष्टीने दोन वा अधिक रूपांत आढळणारे) मूलद्रव्य. रासायनिक चिन्ह P अणुक्रमांक (अणुकेंद्रातील प्रोटॉनांची संख्या) १५ अणूभार ३०·९७ ⇨ आवर्त सारणीतील (इलेक्ट्रॉन रचनेनुसार केलेल्या मूलद्रव्यांच्या कोष्टकरूप मांडणीतील) ५ ब गटातील मूलद्रव्य वि. गु. पांढरा १·८२, तांबडा २·३४ वितळबिंदू : पांढरा ४४·१° से., तांबडा ५९०° से. उकळबिंदू : पांढरा २८०° से. स्थिर समस्थानिकाचा (अणुक्रमांक तोच पण भिन्न अणूभार असलेल्या त्याच मूलद्रव्याच्या प्रकाराचा) द्रव्यमानांक (अणुकेंद्रातील प्रोटॉन व न्यूट्रॉन यांची एकूण संख्या) ३१ आहे २८, २९, ३०, ३२, ३३, व ३४ या द्रव्यमानांकांचे किरणोत्सर्गी (भेदक कण वा किरण बाहेर टाकणारे) समस्थानिक आहेत यांपैकी ३२ व ३३ द्रव्यमानांकांच्या समस्थानिकांची अर्धायुष्ये (किरणोत्सर्गाची मूळची क्रियाशिलता निम्मी होण्यास लागणारा कालावधी) अनुक्रमे १४·२२ दिवस व २४·४ दिवस आहेत आणि त्यांपासून बीटा किरण [⟶ किरणोत्सर्ग] निघतात इतर किरणोत्सर्गी समस्थानिकांची अर्धायुष्ये काही सेकंद किंवा मिनिटे इतकीच आहेत विद्युत् विन्यास (अणूकेंद्राभोवतील विविध कक्षांतील इलेक्ट्रॉनांची संख्या) २, ८, ५ संयुजा (इतर अणूंशी संयोग पावण्याची क्षमता दर्शविणारा अंक) प्रामुख्याने ३ व ५ रंग मुख्यत्वे पांढरा व तांबडा रुचिहीन कठिनता ०·५ मोस [⟶ कठिनता]. भूकवचातील प्रमाण ०·१३%.
इतिहास : १६६९ साली हेनिग ब्रांट या जर्मन किमयागारांनी पांढरी वाळू व आटवून कोरडे केलेले मूत्र एकत्र तापवून एक पांढरा घन पदार्थ मिळविला तो अंधारात चकाकतो व हवेत एकाएकी पेट घेतो असेही त्यांना दिसून आले. ब्रांट यांनी हा पदार्थ तयार करण्याची कृती प्रसिद्ध न करता ड्रेझ्डेन येथील योहान क्राफ्ट यांना विकली. क्राफ्ट यांनी या पदार्थांचे नमुने अनेक देशांत प्रदर्शित केले. १६७७ मध्ये त्यांनी इंग्लंडच्या रॉयल सोसायटीच्या सदस्यांपुढे या पदार्थाविषयी काही प्रयोग करून दाखविले. १६८० मध्ये रॉबर्ट बॉइल या रसायनशास्त्रज्ञांनीही ब्रांट यांच्या वर नमूद केलेल्या पद्धतीने पांढरा घन पदार्थ मिळविला परंतु १७७१ पर्यंत हा पांढरा पदार्थ म्हणजे फक्त एक कौतुकाचा विषयच राहिला. जे. जी. गान या शास्त्रज्ञांनी हाडात फॉस्फरस असतो हे १७७१ मध्ये शोधून काढले. १७७५ मध्ये कार्ल शेल या शास्त्रज्ञांनी हाडांची राख, वाळू व कोळसा तापवून मोठ्या प्रमाणावर हा पदार्थ मिळविला व आपली ही पद्धतीही त्यांनी जाहीर केली. १७७७ मध्ये ए. एल्. लव्हॉयझर यांनी हा पांढरा पदार्थ एक मूलद्रव्य आहे हे सिद्ध केले. ‘फॉस्फरस’ या शब्दाचा मूळ अर्थ ‘अंधारात चकाकणारा पदार्थ’ असा आहे. अँटोन फोन श्रोट्टे यांनी १८४५ मध्ये तांबड्या फॉस्फरसाचा शोध लावला.
आढळ : फॉस्फरस हा क्रियाशील असल्यामुळे निसर्गामध्ये मूलद्रव्य रूपात आढळत नाही. भूकवचामध्ये ०·१३% इतक्या प्रमाणात निरनिराळ्या संयुगांमध्ये हा अनेक ठिकाणी आढळून येतो व भूकवचातील विपुलतेच्या दृष्टीने त्याचा अकरावा क्रमांक आहे. एक घन किमी. इतक्या समुद्राच्या पाण्यात सु. ७८ टन इतका फॉस्फरस संयुग रूपाने असू शकतो. फॉस्फरसाच्या उत्पादनाच्या दृष्टीने सर्वांत महत्त्वाचा उद्गम फॉस्फेटी खडक हा आहे. फॉस्फरसाची काही सामान्य खनिजे वेव्हेलाइट [AI6(PO4)4 (OH)6, 9H2O], ॲपेटाइट [Ca5F(PO4)3 ] व व्हिव्हिॲनाइट [Fe3(PO4)2, 8H2O] ही आहेत [ ⟶ फॉस्फेटी निक्षेप ॲपेटाइट]. फॉस्फरस हे प्राण्यांच्या व वनस्पतींच्या वाढीस, विकासास व निर्वाहासाठी आवश्यक मूलद्रव्य आहे. त्यामुळे शेतजमिनीतील फॉस्फरस संयुगांचे प्रमाण टिकविणे आवश्यक असते. याकरिताच फॉस्फरस संयुगे मोठ्या प्रमाणात खते म्हणून वापरण्यात येतात [ ⟶ खते ग्वानो].सर्व जिवंत प्राण्यांत हाडे, दात व प्रथिने यांमध्ये फॉस्फरस हा एक आवश्यक व महत्त्वाचा घटक म्हणून गणला जातो. हाडांमध्ये ५८% व हस्तिदंतात ६७% कॅल्शियम फॉस्फेट असते. भाज्या, कडधान्ये, प्राण्यांची ऊतके (समान रचना व कार्य असलेल्या पेशींचे समूह), अंड्याचा पिवळा बलक यांमध्ये फॉस्फरस संयुगे आढळतात. अत्यंत सूक्ष्म प्रमाणात मेंदू व रक्त यांमध्येही फॉस्फरस आढळतो. सर्व प्रकारच्या सजीवांत चयापचय (सतत होणाऱ्या भौतिक व रासायनिक घडामोडी), ⇨ प्रकाशसंश्लेषण, तंत्रिका (मज्जा) कार्य व स्नायूंची क्रिया यांसारख्या ऊर्जा-अंतरणाच्या प्रक्रियांत फॉस्फेटे महत्त्वाचा भाग घेतात. ⇨ न्यूक्लिइक अम्ले व अनेक को-एंझाइमे [ ⟶ एंझाइमे] ही फॉस्फेटेच आहेत.
उत्पादन : एकोणिसाव्या शतकाच्या मध्यापासून वापरात आलेल्या फॉस्फरसाच्या उत्पादन क्रियेत प्रथम हाडांच्या राखेवर (नंतरच्या काळात फॉस्फेटी खडकावर) संहत (पाण्यातील विद्रावात जास्त प्रमाण असलेल्या) सल्फ्यूरिक अम्लाची विक्रिया करून फॉस्फोरिक अम्ल मिळवीत असत. या अम्लाचे संहतीकरण केल्यावर लाकडाचा भुस्सा, लोणारी कोळसा अथवा कोक यांत ते मिसळून मिश्रण शुष्क करण्यात येई. नंतर हे मिश्रण शुभ्रोष्ण होईपर्यंत तापसह मातीच्या बकपात्रात तापवून फॉस्फरसाचे उर्ध्वपातन करण्यात येई (बाष्परूपात मिळवून थंड करण्यात येई).
|
4HPO3 + |
12 C ⟶ |
12H2 ↑ + |
12CO ↑ + |
P4 |
|
फॉस्फोरिक अम्ल |
कार्बन |
हायड्रोजन |
कार्बन मोनॉक्साइड |
फॉस्फरस |
आता फॉस्फरसाचे विद्युत् भट्टी पद्धतीने मोठ्या प्रमाणावर उत्पादन करतात. यासाठी हाडांची राख अगर फॉस्फेटी खडक, वाळू व कोक यांचे मिश्रण विद्युत् भट्टीत १,५००° से.पर्यंत तापविले जाते. भट्टीच्या खालच्या भागात दोन आडवी विद्युत् अग्रे बसवून त्यांमध्ये विद्युत् प्रज्योत निर्माण करून हे तापमान मिळविले जाते. भट्टीच्या वरच्या बाजूस एक नळी असून तीमधून वायू व बाष्परूप पदार्थ भट्टीच्या बाहेर नेता येतात व तळाशी मळी काढण्यासाठी नळ बसविलेला असतो. भट्टीच्या तोंडातून वर उल्लेख केलेले मिश्रण सतत भट्टीत ओतण्याची व्यवस्था केलेली असते. त्यामुळे भट्टी अखंडपणे चालू ठेवता येते. भट्टीत होणारी रासायनिक विक्रिया दोन टप्प्यांनी दाखविता येते. पहिला टप्पा १,१५०° से.ला पुरा होतो व फॉस्फरस पेंटॉक्साइड तयार होते. दुसरा टप्पा १,५००° से.ला पुरा होतो. यात ऑक्साइडाचे ⇨ क्षपण होऊन फॉस्फरस तयार होतो. ही एकूण विक्रिया खालील समीकरणाने दाखविता येते.
|
4 Ca5 F(PO4)3 + |
18 SiO2 + |
30 C ⟶ |
|
फ्ल्युअरॲपेटाइट |
सिलिका |
कोक |
|
18 CaO·SiO2·1/9 CaF2 + |
30 CO↑ + |
3P4 ↑ |
|
मळी |
कार्बन मोनॉक्साइड |
फॉस्फरस |
मळी (कॅल्शियम सिलिकेट) खालच्या नळातून मधून मधून बाहेर काढली जाते. फॉस्फेटी खडकात लोहरूपी अशुद्धी असेल, तर लोह फॉस्फाइड (फेरोफॉस्फरस) तयार होऊन ते मळीपेक्षा जड असल्यामुळे तिच्यात तळाशी बसते. या फेरोफॉस्फरसाचा उपयोग लोह मिश्रधातू तयार करण्यासाठी होतो. बाष्परूप फॉस्फरस व कार्बन मोनॉक्साइड वरच्या बाजूला बसविलेल्या नळीतून एका थंड पाण्याच्या टाकीत सोडले जातात. बाष्परूप फॉस्फरसाचे घनीकरण होऊन तो पाण्याच्या तळाशी साठतो आणि कार्बन मोनॉक्साइड पाण्यात विरघळणारा नसल्यामुळे बाहेर पडतो. या पद्धतीने मिळविलेला फॉस्फरस पांढरा असून तो पोटॅशियम डायक्रोमेट व विरल सल्फ्यूरिक अम्ल यांच्या द्रवात वितळवून स्वच्छ करता येतो.
या विद्युत् भट्टी पद्धतीत वाळू न वापरता फक्त कॅल्शियम फॉस्फेट व कोक वापरल्यास फॉस्फरसाबरोबर कॅल्शियम कार्बाइड (CaC2) हा एक महत्त्वाचा व उपयुक्त पदार्थ मिळतो [⟶ कॅल्शियम].
किरणोत्सर्गी फॉस्फरस (३२) हा समस्थानिक प्रायोगिक अणुकेंद्रीय विक्रियकात (अणुभट्टीत) तयार करतात.
बहुरूपे व भौतिक गुणधर्म : फॉस्फरसाची महत्त्वाची अशी दोन बहुरूपे आहेत. एक पांढरा अथवा पिवळा फॉस्फरस व दुसरा तांबडा फॉस्फरस. पांढऱ्यात आल्फा व बीटा असे दोन प्रकार आहेत. उत्पादनात मिळणारा आल्फा प्रकार होय. त्याचे स्फटिक घनाकार असतात. आल्फा फॉस्फरस -७६·९°से. तापमानाच्या खाली थंड केल्यास बीटा फॉस्फरस मिळतो. त्याचे स्फटिक षट्कोणी असतात व वि. गु. १·८८ असते. काही कमी महत्त्वाची बहुरूपे म्हणजे जांभळा फॉस्फरस, काळा फॉस्फरस, शेंदरी फॉस्फरस वगैरे होत.
विद्युत् भट्टीतून मिळणारा आल्फा पांढरा फॉस्फरस जर लोखंडाच्या अंडाकृती भांड्यात अल्पशा आयोडीन या उत्प्रेरकाबरोबर (प्रक्रियेला मदत करणाऱ्या पदार्थाबरोबर) २५०° से.ला तापविला, तर त्याचे तांबड्या फॉस्फरसामध्ये रूपांतर होते. ही प्रक्रिया ऊष्मादायी आहे व त्यामुळे तांबडा फॉस्फरस कमी क्रियाशीलतेचा बनतो. मात्र भांड्याला उष्णता देण्यापूर्वी भांड्यातील हवा कार्बन डाय-ऑक्साइडाने अगर नायट्रोजनाने संपूर्णपणे काढून टाकावी लागते.
|
nP4 → |
(P4)n |
|
पिवळा फॉस्फरस |
तांबडा फॉस्फरस |
पांढरा फॉस्फरस नेहमीच्या तापमानाला ३५,००० वा दा.खाली (वातावरणीय दाबाच्या ३५,००० पट दाबाखाली) किंवा २००° से.ला १२,००० वा. दा. खाली ठेवल्यास काळा फॉस्फरस मिळतो. हा स्फटिकी असून ग्रॅफाइटासारखी दिसतो. वि. गु. २·६९९. तो विद्युत् वाहक आहे. पांढरा फॉस्फरस ज्या विद्रावकामध्ये (विरघळविणाऱ्या द्रवामध्ये) विरघळतो त्या कुठल्याही विद्रावकात हा विरघळत नाही. ५५०° से.ला त्याचे तांबड्या फॉस्फरसात रूपांतर होते. किंबहुना सर्व बहुरूप प्रकार तापविल्यावर तांबडा फॉस्फरस मिळतो.
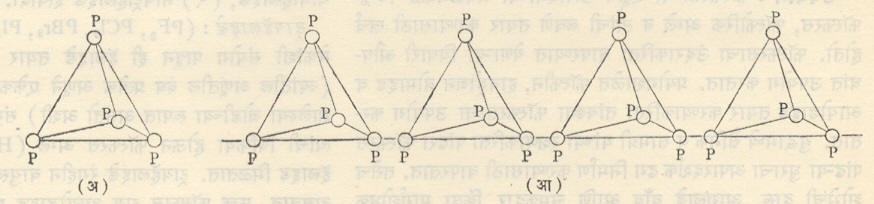
फॉस्फरसाचा रेणू चार अणूंचा बनलेला असतो म्हणून त्याच्या रेणूला चतुर्आणवीय रेणू (P4) म्हटले जाते. ७००° से.च्यावर अशा रेणूंचे विघटन व्हावयास लागते व द्विआणवीय रेणू तयार होऊ लागतात. P4 ⇌ 2 P2. १,७००° से.ला बाष्परूप फॉस्फरसामध्ये P4 आणि P2 हे रेणू जवळजवळ समसमान असतात. या तापमानालासुद्धा एक-आणवीय (P) फॉस्फरसाचे रेणू अत्यंत अल्प प्रमाणात असतात.
पांढऱ्या चतुर्आणवीय रेणूचा आकार चतुष्फलकीय असून त्याच्या प्रत्येक कोपऱ्याला फॉस्फरसाचा एक अणू असतो व तो तीन इतर अणूंना जोडलेला असतो. तांबड्या फॉस्फरसामध्ये असे चतुर्आणवीय रेणू साखळीच्या पद्धतीने एकमेकांस जोडलेले असतात. त्यामुळे तांबड्याचा वितळबिंदू पांढऱ्यापेक्षा जास्त आहे. पांढरा फॉस्फरस प्रकाशामुळे काही काळाने पिवळसर दिसू लागतो. त्या वेळी P4 रेणूंची आपापसातील रचना थोडीफार बदलते व त्यामुळे त्याच्या रंगातही थोडा बदल होतो. काळ्या फॉस्फरसातील स्फटिक जालकरूपात असून त्यांतील अणू एकमेकांना विस्तीर्ण पन्हळांसारख्या प्रतलांत एकमेकांना जोडलेले असतात.
पांढरा फॉस्फरस हा मेणाप्रमाणे मऊ असून साध्या चाकूनेही कापता येतो. त्याला लसणासारखा वास येतो व तो विषारी आहे. त्याचा ज्वलनबिंदू ३०° से. असल्यामुळे तो हवेत आपोआप पेट घेतो म्हणून तो नेहमी पाण्यात ठेवावा लागतो. तांबड्या फॉस्फरसाचा ज्वलनबिंदू २६०° से. असल्यामुळे तो पाण्यात ठेवावा लागत नाही. तो विषारी नाही. पांढरा फॉस्फरस पाण्यात अविद्राव्य (न विरघळणारा) असला, तरी तो कार्बन डायसल्फाइड, बेंझीन, टर्पेंटाइन इ. कार्बनी विद्रावकांत विद्राव्य आहे. तांबडा फॉस्फरस मात्र या विद्रावकांत अविद्राव्य आहे.
रासायनिक गुणधर्म : अंधारात पांढरा फॉस्फरस हवेत उघडा ठेवला, तर तो हिरवट रंगाने चकाकतो व त्या वेळी त्याचे सावकाश ऑक्सिडीभवन होऊन (ऑक्सिजनशी संयोग होऊन) फॉस्फरस ट्रायऑक्साइड (P4O6) मिळते. ह्याच चकाकण्याला ‘प्रस्फुरण’ असे म्हणतात परंतु हा जर हवेत तापविला, तर पांढऱ्या ज्योतीने जळतो व फॉस्फरस पेंटॉक्साइडाचा (P4O10) पांढरा ढग तयार होतो. संहत सल्फ्यूरिक अम्ल किंवा संहत नायट्रिक अम्ल या ऑक्सिडीकारक अम्लांनी फॉस्फरसाचे ऑक्सिडीकरण होऊन फॉस्फोरिक अम्ल मिळते. फॉस्फरस क्षपणकारक आहे. तो नायट्रिक अम्लाचे क्षपण करतो व नायट्रोजन डाय-ऑक्साइड मिळतो. तांबे, चांदी व सोने यांच्या लवणांच्या विद्रावांत फॉस्फरस घातल्यास, त्यांचे क्षपण होऊन त्या धातू मिळतात. दाहक (कॉस्टिक) सोड्याच्या विद्रावात पांढऱ्या फॉस्फरसाचे तुकडे घालून ते तापविल्यास फॉस्फीन (PH3) वायू मिळतो. मात्र तापविण्यापूर्वी भांड्यातील हवा हायड्रोजन अगर कोलगॅस आत सोडून काढून टाकावी लागते. तांबड्या फॉस्फरसावर दाहक सोड्याची विक्रिया होत नाही. पांढरा फॉस्फरस क्लोरिनामध्ये ताबडतोब पेटतो. तांबडा फॉस्फरस क्लोरिनामध्ये तापविल्याशिवाय पेट घेत नाही. गंधकाबरोबर याची विक्रिया होते व सल्फाइडे मिळतात. निरनिराळ्या धातूंबरोबर हा तापविल्यास त्या त्या धातूंची फॉस्फाइडे मिळतात. उदा., Mg3P2, Ca3P2 इत्यादी.
फॉस्फरस चक्र : प्राण्यांच्या व वनस्पतींच्या जीवनास थोड्या प्रमाणात का होईना फॉस्फरसाची आवश्यकता असते. वनस्पतींना तो जमिनीतून मिळतो. प्राण्यांना तो वनस्पती, धान्य व फळे यांपासून मिळू शकतो. प्राण्यांच्या मलमूत्राद्वारे अगर प्राणी मेल्यावर व वनस्पती कुजल्यावर हाच फॉस्फरस परत जमिनीत जातो. तेथून परत वनस्पतींत जातो. काही प्रमाणात पुढे तो पाण्याबरोबर नाले, नद्या व शेवटी समुद्रात जातो. त्यातून माशांच्या शरीरात व त्यांपासून खतांच्या रूपाने जमिनीत जातो. तेथून परत वनस्पतींत व प्राण्यांच्या शरीरात जातो. असे हे चक्र सतत चालू असते.
उपयोग : फॉस्फरसाच्या एकूण उत्पादनाच्या जवळजवळ ९०% फॉस्फरस, फॉस्फोरिक अम्ले व त्यांची लवणे तयार करण्यासाठी खर्च होतो. फॉफरसाचा उंदराकरिता वापरण्यात येणाऱ्या विषारी औषधांत उपयोग करतात. प्रयोगशाळेत फॉस्फीन, हायड्रोजन ब्रोमाइड व आयोडाइड तयार करण्याकरिता तांबड्या फॉस्फरसाचा उपयोग करतात. युद्धामध्ये सैनिक व सामग्री यांच्या रक्षणाकरिता पांढरा फॉस्फरस पांढऱ्या धुराचा अपारदर्शक ढग निर्माण करण्यासाठी वापरतात. तसेच शोभेची दारू, आगलावे बाँब आणि चमकदार किंवा मार्गशोधक बंदुकीच्या गोळ्या तयार करण्यामध्ये फॉस्फरसाचा उपयोग करतात. फॉस्फरस (३२) हा किरणोत्सर्गी समस्थानिक वैद्यकीय उपचारांत वापरतात. ⇨ श्वेतकोशिकार्बुद व संबंधित विकारांवरील उपचारांत या किरणोत्सर्गी फॉस्फरसाचा उपयोग केला जातो. शस्त्रक्रिया करण्यापूर्वी मेंदूमध्ये झालेल्या अर्बुदाची (पेशींच्या अत्याधिक वाढीमुळे निर्माण होणाऱ्या गाठीची) जागा नक्की समजावी यासाठीही किरणोत्सर्गी फॉस्फरसाचा उपयोग केला जातो. फॉस्फरस (३२) च्या उत्सर्जनाचा जीववैज्ञानिक संशोधनातही उपयोग करण्यात येतो. उदा., एखाद्या पेशीच्या वा व्हायरस कणाच्या जीवितेतील अथवा प्रजोत्पादनातील फॉस्फरसयुक्त रेणूंचे महत्त्व व त्यातील कार्य यांसंबंधी माहिती मिळविण्यासाठी फॉस्फरस (३२) चा उपयोग करतात. त्याचप्रमाणे एखादी वनस्पती वाढत आहे. अशा जमिनीतील मातीत फॉस्फरस (३२) समाविष्ट करून वनस्पतीने शोषलेल्या फॉस्फरसाचे प्रमाण व तिच्यातील फॉस्फरसाचे वितरण यांचा गायगर गणित्र व अन्य उपकरणाच्या [ ⟶ कण अभिज्ञातक] साहाय्याने अभ्यास करता येतो. [ ⟶ अणूऊर्जेचे शांततामय उपयोग]. मिश्रधातू तयार करण्यासाठीही फॉस्फरस वापरतात. फॉस्फर-कासे (ब्राँझ) ही मिश्रधातू (तांबे ९४%, कथिल ५%, फॉस्फरस ०·१ ते ०·३५% ) साध्या काशापेक्षा अधिक मजबूत व टणक असून फारशी झिजत नाही व गंजतही नाही [ ⟶ कासे]. तांबडा फॉस्फरस सुरक्षित आगपेट्यांच्या उत्पादनात महत्त्वाचा आहे. [⟶ आगकाड्या].
संयुगे : फॉस्फरसाची अकार्बनी व कार्बनी शी पुष्कळ संयुगे आहेत. कार्बनाच्या संयुगाची संख्या जितकी प्रचंड आहे तितकीच फॉस्फरसाचीही संयुगे असण्याची शक्यता दिसून आली. त्यामुळे फॉस्फरसाचे रसायनशास्त्र ही रसायनशास्त्राची एक महत्त्वाची शाखा होण्याची शक्यता आहे. फॉस्फरस अणूच्या अंतिम कवचामध्ये ५ इलेक्ट्रॉन असून त्यांतील २ s व ३ p या उपकवचांत आहेत [ ⟶ अणु व आणवीय संरचना]. त्यामुळे संयुगांमध्ये फॉस्फरसाची ऑक्सिडीकरण अवस्था [ ⟶ ऑक्सिडीभवन]– ३ पासून + ५ पर्यंत असू शकते. महत्त्वाची अकार्बनी व कार्बनी संयुगे खाली नमूद केली आहेत.
हायड्राइडे : फॉस्फरसाची मुख्य हायड्राइडे दोन आहेत. एक फॉस्फीन (PH3) व दुसरे फॉस्फोनियम डाय हायड्राइड (P2H4). फॉस्फीन वायू पांढऱ्या फॉस्फरसापासून मिळतो व याचा उल्लेख वर आलेलाच आहे. शिवाय तो फॉस्फरस अम्ल (H3PO3) तापवून अगर फॉस्फोनियम आयोडाइड सोडीयम हायड्रॉक्साइडाच्या विद्रावाबरोबर तापवून किंवा कॅल्शियम फॉस्फाइडावर पाण्याची विक्रिया करून मिळतो. फॉस्फीन रंगहीन, विषारी वायू आहे. त्याला कुजलेल्या माशासारखा वास येतो. तो १५०° से.ला ऑक्सिजनामध्ये पेट घेतो व त्यापासून फॉस्फरस पेंटॉक्साइड तयार होते. तो क्षपणकारक आहे. चांदी व सोने यांच्या लवणांच्या विद्रावात हा वायू सोडल्यास लवणांचे क्षपण होऊन चांदी व सोने या धातू मिळतात. अमोनियम लवणासारखी फॉस्फोनियम लवणे मिळतात. उदा., फॉस्फोनियम आयोडाइड PH4I.
हॅलाइडे : फॉस्फरसापासून विविध प्रकारची हॅलाइडे मिळतात : (१) ट्रायहॅलाइडे, (२) पेंटाहॅलाइडे, (३) ऑक्सिहॅलाइडे, (४) थायोहॅलाइडे, (५) नायट्रोहॅलाइडे इत्यादी.
ट्रायहॅलाइडे : (PF3, PCI3, PBr3, PI3). प्रत्यक्ष मूलद्रव्ये एकमेकांशी संयोग पावून ही हॅलाइडे तयार होतात. ती सहसंयुजी (ज्यांतील अणूंतील बंध प्रत्येक अणूने एकेक इलेक्ट्रॉन देऊन तयार झालेल्या जोडीच्या रूपात असतो अशी) संयुगे पाण्याबरोबर त्यांची विक्रिया होऊन फॉस्फरस अम्ल (H3PO3) व हायड्रोजन हॅलाइड मिळतात. ट्रायहॅलाइडे रंगहीन वायुरूप अगर रंगहीन द्रवरूप असतात. फक्त फॉस्फरस ट्राय आयोडाइड हा तांबड्या रंगाचा घन पदार्थ आहे. PF2CI, PFCI2, PF2 Br अशा तऱ्हेचे मिश्र ट्रायहॅलाइडेही तयार होतात.
पेंटाहॅलाइडे : (PF5, PCI5, PBr5). ट्रायहॅलाइडांवर अतिरिक्त हॅलोजनांची विक्रिया करून ही मिळतात. यांच्यावरही पाण्याची विक्रिया होऊन प्रथम ऑक्सिहॅलाइड मिळते व शेवटी फॉस्फोरिक अम्ल व हायड्रोजन हॅलाइड तयार होतात. PF5 हा रंगहीन वायू असून PCI5 हा पांढऱ्या रंगाचा घन पदार्थ आहे. PBr5 हा पिवळ्या रंगाचा घन पदार्थ आहे. PI5 तयार होत नाही. याचीही PF3CI2 PF3Br2 व PCIBr4 अशी मिश्र पेंटाहॅलाइडे होतात.
ऑक्सिहॅलाइड (POX3 X = हॅलोजन अणू). यांना फॉस्फोरिक हॅलाइडे अशीही संज्ञा आहे. ऑक्सिहॅलाइडे ही फॉस्फरस पेंटॉक्साइड व फॉस्फरस पेंटाहॅलाइडे यांपासून तयार करतात. POCI3 व POBr3 रंगहीन आणि द्रवरूप आहेत. POF3 हा रंगहीन वायू असून त्याला गुदमरून टाकणारा वास आहे.
ट्रायहॅलाइडे, पेंटाहॅलाइडे व ऑक्सिहॅलाइडे कार्बनी संश्लेषणात (कार्बनी संयुगे तयार करण्याच्या प्रक्रियेत) उपयोगी पडतात. त्यांनी OH गटाचे, C = O गटातील ऑक्सिजन अणूचे हॅलोजन अणूंनी प्रतिष्ठापन (एका अणूच्या वा अणुगटांच्या जागी दुसरा अणू वा अणुगट समाविष्ट करणे) करता येते.
थायोहॅलाइडे तयार करता येतात. PSF3 हा रंगहीन वायू असून बाकीची द्रव स्वरूपात असतात. त्यांचे रासायनिक गुणधर्म हे ऑक्सिहॅलाइडांप्रमाणेच आहेत. फॉस्फोनायट्रिलिक हॅलाइडे (PNX2)n यात n म्हणजे ३, ४, ५, ६ इ. होय. ही दाहक व विषारी आहेत. यांतील फॉस्फोनायट्रिलिक क्लोराइडे (PNCI2)n ही PCI5 व नवसागर (NH4CI) एका बंद नळीत १५०° से.ला तापवून तयार करता येतात.
ऑक्साइडे : फॉस्फरसाची प्रमुख अशी दोन ऑक्साइडे आहेत. (१) फॉस्फरस ट्राय-ऑक्साइड (P2O6), हे नेहमी P2O3 असे लिहितात व (२) फॉस्फरस पेंटॉक्साइड (P4O10), हे नेहमी P2O5 असे लिहितात. यांशिवाय फॉस्फरस टेट्रॉक्साइड (P2O4) व सबऑक्साइडे (P4O व P2O) आणि दोन पेरॉक्साइडेही फॉस्फरसापासून तयार करता येतात.
फॉस्फरस ट्राय-ऑक्साइड : (P2O3). मर्यादित हवेत फॉस्फरस तापविल्यास त्यापासून हे तयार होते. हे रंगहीन स्फटिकरूप असून त्याचा वितळबिंदू २३·८° से. व उकळबिंदू १७५·४° से. आहे. थंड पाण्याबरोबर याची विक्रिया होऊन फॉस्फरस अम्ल (H3PO3) तयार होते पण गरम पाण्याबरोबर याची विक्रिया झाल्यास फॉस्फरस, फॉस्फीन, फॉस्फोरिक अम्ल व इतर संयुगे तयार होतात. हवेत अगर ऑक्सिजनामध्ये हे उघडे ठेवल्यास पेंटॉक्साइड तयार होते.
फॉस्फरस पेंटॉक्साइड : (P2O5). कोरड्या व विपुल हवेत अगर ऑक्सीजनामध्ये फॉस्फरस जाळल्यास या पेंटॉक्साइडाचा धूर निघतो. काही वेळाने थंड झाल्यावर त्याची पांढरी पूड मिळते. याचे संप्लवन ६०° से.ला सुरू होते व २५०° से.ला ते फार वेगाने होते. पाण्याबरोबर याची विक्रिया होऊन फॉस्फोरिक अम्ले तयार होतात. [ ⟶ फॉस्फोरिक अम्ले]. हे सर्वांत प्रभावी असे निर्जलीकारक आहे. याच्या सान्निध्यात शर्करा, स्टार्च, कागद, लाकूड वगैरे कार्बोहायड्रेटे काळी पडतात. हे क्षपणकही नाही आणि ऑक्सिडीकारकही नाही. याचा उपयोग मुख्यतः निर्जलीकरणासाठी व फॉस्फोरिक अम्ले तयार करण्यासाठी होतो. याची संरचना फॉस्फरस रेणूच्या (P4) संरचनेशी मिळतीजुळती आहे.
सल्फाइडे : फॉस्फरसाची P4S3, P4S5, P4S7 आणि P4S10 अशी चार तरी सल्फाइडे निश्चितपणे माहीत आहेत. ती सर्व फॉस्फरस व गंधक सु. ३००° से.ला तापवून अगर कार्बन डायसल्फाइडामध्ये (CS2 मध्ये) विरघळवून तयार करतात. फॉस्फरस पेंटासल्फाइड (P4S10) हे महत्त्वाचे आहे. त्याची संरचना P4O10 सारखीच आहे. ही सर्व सल्फाइडे घनरूप, पिवळ्या रंगाची व स्फटिकी आहेत. या सर्वांवर पाण्याची विक्रिया होते व हायड्रोजन सल्फाइड वायू (H2S) बाहेर पडतो आणि फॉस्फरस किंवा फॉस्फोरिक अम्ल तयार होते. पेंटासल्फाइडामुळे कार्बनी संयुगांतील ऑक्सिजन अणूचे गंधकाच्या अणूने प्रतिष्ठापन करता येते. म्हणून अल्कोहॉल, अम्ल, अमाइड, कीटोन यांची त्या त्या प्रकारची थायो संयुगे बनवता येतात. कोठल्याही खरबरीत पृष्ठभागावर घासल्याने पेटणाऱ्या आगकाड्यांचे गूल तयार करण्यात फॉस्फरस सेस्क्विसल्फाइड (P4S3) वापरत असत [ ⟶ आगकाड्या].
नायट्राइडे: नायट्रोजनाबरोबर फॉस्फरसाची अनेक संयुगे तयार होतात. त्यांत P3N5, P2N5, आणि PN ही प्रमुख आहेत. काही संयुगांत या दोन मूलद्रव्यांव्यतिरिक्त हायड्रोजन, ऑक्सिजन व हॅलोजने ही असतात. त्यांची बहुवारिकेही (दोन वा अधिक साध्या रेणूंचा संयोग होऊन तयार होणारी जटिल रेणूयुक्त संयुगेही) होतात. (PNCI2)3 हे ३००° से.ला तापविल्यास (PNCI2)19 हे रबरासारखे बहुवारिक तयार होते.
फॉस्फाइडे: पुष्कळशा धातूंची फॉस्फाइडे माहीत आहेत. ती विविध प्रकारांनी तयार करता येतात. उदा., (१) प्रत्यक्ष धातू व फॉस्फरस यांच्या संयोगाने, (२) फॉस्फेटाचे उच्च तापमानाला कोकबरोबर क्षपण करून, (३) धातूंच्या लवणांच्या विद्रावात फॉस्फीन वायू सोडून.
क्षारीय धातूंच्या (लिथियम, सोडियम, पोटॅशियम इ. आवर्त सारणीतील पहिल्या गटातील धातूंच्या) व क्षारीय मृत्तिका धातूंच्या (कॅल्शियम, बेरियम इ. आवर्त सारणीतील दुसऱ्या गटातील धातूंच्या) फॉस्फाइडांवर पाण्याची विक्रिया होऊन फॉस्फीन वायू मिळतो व त्या धातूंची हायड्रॉक्साइडे तयार होतात.
कार्बनी संयुगे : नायट्रोजन व फॉस्फरस ही मूलद्रव्ये आवर्त सारणीत एकाच गटात असल्यामुळे फॉस्फरसाची कार्बनी संयुगे नायट्रोजनाच्या कार्बनी संयुगांप्रमाणे तयार करता येतात. फॉस्फिने व ⇨ अमाइने यांत संरचना, तयार करण्याची पद्धत व सर्वसाधारण गुणधर्म यांत बरेच साम्य आहे. मिथिल फॉस्फीन [ CH3PH2 (प्राथमिक)], डायमिथिल फॉस्फीन [( CH3)2·PH (द्वितीयक)] व ट्रायमिथिल फॉस्फीन [(CH3)3 P (तृतीयक)] ही सर्व फॉस्फिने PH3 पासून तयार करतात. अमाइनांपेक्षा फॉस्फिने कमी क्षारधर्मी (अम्लाबरोबर विक्रिया झाल्यास लवण देणाऱ्या पदार्थांचे गुणधर्म असणारी) असून त्यांना घाणेरडा वास येतो व ती विषारी आहेत. अमाइनांपेक्षा फॉस्फिनांचे ऑक्सिडीकरण जलद होते.
नायट्रोबेंझीन, ॲझोबेंझीन यासारखी फॉस्फोबेंझीन, फॉस्फोरोबेंझीन अशी फॉस्फरसाची संयुगे माहीत आहेत.
बहुतेक सर्व जैव प्रक्रियांत फॉस्फरसाची संयुगे भाग घेतात असे आढळून आले आहे. उदा., किण्वनाच्या (पदार्थ आंबविण्याच्या) प्रक्रियेत आवश्यक असणारी फॉस्फोग्लिसराइडे, ⇨ प्रकाशसंश्लेषणात व स्नायुक्रियेत आवश्यक असणारी ॲडिनोसीन फॉस्फेटे आणि न्यूक्लिओटाइडांतील [ ⟶ न्यूक्लिइक अम्ले] अतिशय जटिल फॉस्फरसयुक्त गट.
प्लॅस्टिकीकारके : प्लॅस्टिकामध्ये ⇨ प्लॅस्टिकीकारके मिसळल्यामुळे प्लॅस्टिकाची लवचिकता किंवा विस्तरणक्षमता वाढते व त्यास जरूर तो आकार देता येतो. या प्लॅस्टिकीकारकांमध्ये फॉस्फेट जातीची बरीच संयुगे आहेत व त्यांतील पुष्कळशी (RO)3 PO अशा प्रकारची आहेत. त्यांतील R म्हणजे अल्किल किंवा अरिल गट होय. प्लॅस्टिकीकारकेही अल्कोहॉल (R·OH) आणि फॉस्फरस ऑक्सिक्लोराइड पिरिडिनाबरोबर एकत्र वापरून तयार करता येतात. ट्रायएथिल फॉस्फेट [(C2H5O)3 PO], ट्रायब्युटिल फॉस्फेट [(C4H9O)8 PO] आणि ट्रायक्रेसिल फॉस्फेट [(C6H4CH3O)3 PO] ही संयुगे मोठ्या प्रमाणावर प्लॅस्टिकीकारके म्हणून वापरली जातात.
कीटकनाशके : पायरोफॉस्फेट जातीची ⇨ कीटकनाशके मोठ्या प्रमाणात तयार केली जातात. त्यांत टेप (TEPP), [(C2H5)4 P2O7, टेट्राएथिल पायरोफॉस्फेट] व ब्लँडन (हेक्झॅएथिल टेट्राफॉस्फेट) ही प्रमुख होत.
फॉस्फोरिक अम्ले व फॉस्फेटे : विविध प्रकारची फॉस्फोरिक अम्ले व त्यांची लवणे (फॉस्फेटे) यांच्या वर्णनासाठी व उपयोगासाठी ‘फॉस्फोरिक अम्ले’ ही नोंद पहावी.
अभिज्ञान : (परीक्षा करून अस्तित्व ओळखणे). फॉस्फरसाचे अस्तित्व असलेली सर्व संयुगे ‘मॉलिब्डेट कसोटी’ या नावाने ओळखण्यात येणारी कसोटी देतात. या कसोटीत अमोनियम मॉलिब्लेट [(NH4)6Mo7O24·4H2O] नायट्रिक अम्लाच्या सान्निध्यात, फॉस्फेटात किंवा फॉस्फेट विद्रावात बरेचसे घालून थोडे गरम केले असते (५०° – ६०° से.) कॅनरी पिवळ्या रंगाच्या फॉस्फोमॉलिब्डेटाचा [(NH4)3PO4 ·12MOO3 ·H2O] अवक्षेप (न विरघळणारा साका) मिळतो [⟶ वैश्लेषिक रसायनशास्त्र].
विषबाधा व औषधोपचार : बालवयात हाडांची वाढ होण्यास फॉस्फरस हा अत्यंत आवश्यक आहे. [⟶ पोषण]. मुडदूस झालेल्या मुलांना फॉस्फरस व कॅल्शियमयुक्त औषधे देतात. अस्थिमार्दवात, अर्धांगावस्थेत, नपुंसकावस्थेत, क्षयरोगात व एकंदर तंत्रिका तंतूंच्या (मज्जातंतूंच्या) कमजोरीमध्ये तंत्रिका तंतूंना बळकटी येण्यासाठी हा संयुग रूपाने अत्यंत गुणकारी आहे. असे जरी असले, तरी सुटा पिवळसर फॉस्फरस हा विषारी आहे. तो अन्नामधून वा अन्य तऱ्हेने पोटात गेल्यास काही वेळानंतर मळमळणे, ओकाऱ्या व पोटात आग होणे यांसारखी लक्षणे दिसू लागतात. अशा वेळी फॉस्फरसाचे शोषण होण्यापूर्वी ताबडतोब उलट्या होणारे व जुलाबाचे औषध देणे आवश्यक असते. ०·२५ ग्रॅ. मोरचूद (कॉपर सल्फेट) पेलाभर पाण्यात टाकून तो विद्राव थोड्या थोड्या वेळाने अशा माणसास दिल्यास कॉपर सल्फाइड हा बिनविषारी पदार्थ बनतो. कोमट पाणी पिण्यास देऊन नंतर २% पोटॅशियम परमँगॅनेटाच्या विद्रावाचा बस्तीही (एनिमाही) द्यावा. ०·१ ग्रॅम इतका पांढरा फॉस्फरस पोटात गेल्यास पांडुरोग, क्षुधानाश व वजनात घट होऊन अखेर मृत्यूही येऊ शकतो. पूर्वी पिवळा फॉस्फरस आगकाड्यांत वापरत असत. अशा कारखान्यांतील कामगारांना पिवळ्या फॉस्फरसाचा धूर सारखा हुंगल्यामुळे ‘फॉसीजॉ’ नावाचा जबड्याच्या हाडांचा रोग जडत असे. या रोगात जबड्याच्या हाडांच्या ऊतकांचा मृत्यू होतो व दात पडतात.
संदर्भ : 1. Finar, I. L. Organic Chemistry, 2 Vols., London, 1973.
2. Sidgwick, N. V. The Chemical Elements and Their Compounds, Vol. I, London, 1950.
3. Van Wazer, J. R. Ed., Phosphorous and Its Compounds, 2 Vol., New York, 1958, 1961.
थत्ते, मु. म. घाटे, रा. वि.
“