ॲलिफॅटिक संयुगे : ज्यांच्यात वलयी संरचना (अणूंची मांडणी) नाही, अशा कार्बनी संयुगांना ॲलिफॅटिक संयुगे ही संज्ञा व्यापक अर्थाने देण्यात येते. मर्यादित अर्थाने ही संज्ञा निर्बलयी (ज्यांची टोके जोडली नाहीत अशा) हायड्रोकार्बनी संयुगांना व त्या संयुगांपासून तयार होणाऱ्या अनुजात (एका संयुगापासून बनविलेल्या दुसऱ्या) संयुगांना लावली जाते.
ॲलिफॅटिक संयुगांपैकी काही संयुगे प्रथमत: चरबीपासून किंवा तेलांपासून उपलब्ध झाली म्हणून त्यांना व त्यांच्या सर्वच गटाला ॲलिफॅटिक (तेल किंवा चरबी या अर्थाच्या मूळच्या ग्रीक शब्दावरून) म्हणण्याची प्रथा पडली. चरबी व तेले यांचा समावेश ॲलिफॅटिक संयुगांत होतो हे खरे असले, तरी त्यांच्याशिवाय इतरही पुष्कळ संयुगे ॲलिफॅटिक गटात आहेत. अलीकडे या संयुगांना ‘असायक्लिक’ म्हणजे ‘निर्वलयी’ हे संरचनादर्शक नाव वापरण्यात येऊ लागले आहे. या विभागातील प्रमुख म्हणजे निर्वलयी हायड्रोकार्बन होत. ती फक्त कार्बन व हायड्रोजन यांची बनलेली असतात. त्यांच्याशिवाय पुढील संयुगांचा समावेशही ॲलिफॅटिक संयुगांत केला जातो : वलयी संरचना नाही अशी एस्टरे, ईथरे, कीटोने, आल्डिहाइडे, अमाइने, अमाइडे, अल्कोहॉले व कार्बोहायड्रेटे (या सर्व संयुगांवर स्वतंत्र नोंदी आहेत) आणि या संयुगांपासून प्रतिष्ठापनाने (एक अणू किंवा अणुगट काढून तेथे दुसरा बसविण्याने) तयार झालेली संयुगे.
हायड्रोकार्बने : यांचे तृप्त (ज्यामध्ये मोकळ्या संयुजा नाहीत, → संयुजा) व अतृप्त असे दोन वर्ग आहेत. ज्यांच्यात हायड्रोजनाचे प्रमाण कार्बन संयुजा-तृप्तीकरिता आवश्यक तेवढे असते, अशा म्हणजे तृप्त हायड्रोकार्बनांस ‘अल्केने’ किंवा ‘पॅराफिने’ म्हणतात. त्यांचे सामान्य सूत्र CnH2n+2 असे असते. कोष्टक क्र. १ मध्ये अशा हायड्रोकार्बनांपैकी काहींची नावे व सुत्रे दिलेली आहेत.
|
कोष्टक क्र. १ अल्केने, पॅराफिने किंवा तृप्त हायड्रोकार्बने (सामान्य सूत्र CnH2n+2) |
||
|
संयुगाचे नाव |
रेणवीय सूत्र |
संरचना सूत्र |
|
मिथेन |
CH4 |
CH4 |
|
एथेन |
C2H6 |
CH3·CH3 |
|
प्रोपेन |
C3H8 |
CH3·CH2·CH3 |
|
ब्युटेन |
C4H10 |
CH2·CH2·CH2·CH3 |
|
(n- म्हणजे सामान्य प्रकार) |
||
|
पेंटेन |
C5H12 |
CH3·(CH2)3·CH3 |
|
(n- प्रकार) |
||
|
हेक्झेन |
C6H14 |
CH3·(CH2)4·CH3 |
|
(n- प्रकार) |
||
|
हेप्टेन |
C7H16 |
CH3·(CH2)5·CH3 |
|
(n- प्रकार) |
||
|
ऑक्टेन |
C8H18 |
CH3·(CH2)6·CH3 |
|
(n- प्रकार) |
||
|
नोनेन |
C9H20 |
CH3·(CH2)7·CH3 |
|
(n- प्रकार) |
||
|
डेकेन |
C10H22 |
CH3·(CH2)8·CH3 |
|
(n- प्रकार) |
||
या कोष्टकातील संयुगांपैकी प्रत्येकातील कार्बन अणूंच्या संयुजा चार आहेत व त्या सहसंयुजी (दोन अणूंमध्ये इलेक्ट्रॉनांची भागीदारी असणारे बंध) आहेत. पहिली चार सोडून बाकी नावे त्यांच्यातील कार्बन अणूंची (ग्रीक व लॅटिन भाषेतील शब्दाने दिलेली) संख्या दर्शवितात. कोणतीही अनुक्रमाने असलेली दोन संयुगे घेतल्यास त्या दोहोंच्या सूत्रातील फरक CH2 असलेला आढळतो. अशा संयुगांना ‘सजातीय’ म्हणतात. कित्येक संयुगांतील कार्बन अणू सरळ रांगेने एकमेकांस जोडलेले असतात, परंतु काही संयुगांच्या संरचनेत शाखाही असू शकतात. उदा., हेक्झेन. CH3·CH2·CH2·CH2·CH2·CH3 या सूत्रात शाखा नाहीत. अशा संरचनेच्या संयुगाला ‘सामान्य (चिन्ह n) हेक्झेन’म्हणतात. पण या सूत्रात एक शाखा आहे.
|
CH3·CH·CH2·CH2·CH3 |
||
|
| |
||
|
CH3 |
||
अशा सूत्रांच्या नावापूर्वी ‘आयसो’ हे उपपद लावतात. म्हणून या संयुगाचे नाव ‘आयसो-हेक्झेन’ होते. याचेच सुधारलेल्या शास्त्रीय पद्धतीने दिलेले नाव ‘२-मिथिल पेंटेन’ असे आहे. या नावावरून हे संयुग पाच कार्बन अणूंच्या मालेचे असून दुसऱ्या क्रमांकाच्या कार्बन अणूस मिथिल गट जोडलेला आहे असे ओळखता येते. तसेच
|
CH3 |
||
|
| |
||
|
CH3·CH2·C·CH3 |
||
|
| |
||
|
CH3 |
||
याच्या संरचनेत चार कार्बन अणूंची रांग असून तिसऱ्या क्रमांकाच्या कार्बन अणूस दोन मिथिल गट जोडलेले आहेत. म्हणून याचे या पद्धतीतील नाव ‘३, ३ – डाय मिथिल ब्युटेन’ असे होते. वरील तिन्ही संयुगांचे रेणुसूत्र C6H14असून त्यांची संरचना मात्र वेगवेगळी आहे. अशी सारखीच रेणुसूत्रे असणाऱ्या पण निरनिराळी संरचना असणाऱ्या संयुगांस ‘समघटक (आयसोमर) संयुगे’ म्हणतात. प्रकाशीय समघटक (विशिष्ट प्रतलात कंपन पावणाऱ्या प्रकाशाचे म्हणजे ध्रुवित प्रकाशाचे प्रतल डावीकडे वा उजवीकडे वळविणारे समघटक) वगळले तर ब्युटेनांचे दोन, पेंटेनांचे तीन, हेक्झेनांचे पाच, ऑक्टेनांचे अठरा व नोनेनांचे पस्तीस समघटक असू शकतात. ते सर्व ज्ञात आहेत. कार्बन अणूंची संख्या वाढत गेल्यावर समघटकांची संख्याही वाढत जाते. उदा., सैद्धांतिक दृष्ट्या C20H44याचे तीन लक्ष समघटक असणे शक्य आहे. वरील कोष्टकात पहिल्या दहा अल्केनांचीच नावे दिलेली आहेत, पण सैद्धांतिक दृष्ट्या n ही संख्या कितीही असणे शक्य आहे. सामान्य व सशाख (ज्याच्या रेणू मांडणीत शाखा आहेत) मिळून होणाऱ्या अल्केनांची संख्या प्रचंड भरेल त्यांपैकी थोडीच तयार करण्यात आलेली आहेत.
भौतिक गुणधर्म : सामान्य दाब-तापमानाच्या परिस्थितीत एक ते चार कार्बन अणू असलेली अल्केने वायुरूप, पाच ते सतरा कार्बन अणू असलेली द्रवरूप व त्याच्यापेक्षा अधिक कार्बन अणू असलेली अल्केने अर्धवट द्रव अथवा मेणांसारखी घनरूप असतात. पाच ते आठ कार्बन अणू असलेली अल्केने खनिज तेलात व बारा ते सतरा कार्बन अणू असलेली वंगणाच्या तेलात व व्हॅसलिनात असतात. खनिज पॅराफिनी मेण हे मुख्यत: वीस ते तीस कार्बन अणू असलेल्या सामान्य अल्केनांचे बनलेले असते. सामान्य पॅराफिनांचा रेणुभार जो जो वाढत जातो, तो तो त्यांचे उकळबिंदू व वितळबिंदू वाढत जातात. सामान्य अल्केनांचे उकळबिंदू त्यांच्या समघटकांच्या वितळबिंदूंपेक्षा अधिक उच्च असतात. सामान्य द्रव अल्केनांचे वि.गु. ०·६२ ते ०·७७ व घन अल्केनांचे ०·७७ ते ०·७९ असते. तितकेच कार्बन अणू असलेल्या इतर हायड्रोकार्बनांच्या वि.गु. पेक्षा अल्केनांचे वि.गु. कमी असते. अल्केने ही पाण्यापेक्षा हलकी व पाण्यात जवळजवळ अविद्राव्य (न विरघळणारी) पण अल्कोहॉल, ईथर, यांसारख्या कार्बनी विद्रावकांत (विरघळविणाऱ्या पदार्थांत) विद्राव्य असतात.
रासायनिक गुणधर्म : मिथेन व कमी रेणुभार आणि सरळ शृंखला असणारी इतर अल्केने रासायनिक दृष्ट्या एकंदरीत अक्रिय (ज्यांच्यावर रासायनिक विक्रिया होत नाही अशी) असतात व सामान्य दाबाच्या व सामान्य किंवा मध्यम तापमानाच्या परिस्थितीत त्यांच्यावर प्रबल (पाण्यात लवकर विगमन म्हणजे रेणूचे साध्या रेणूंत वा अणूंत रूपांतर होणाऱ्या) अम्लांचा किंवा क्षारांचा (अल्कलींचा) परिणाम होत नाही. पण उच्च रेणुभार असणारी, विशेषतः ज्यांच्यात तृतीयक कार्बन अणू आहेत, अशी सशाख अल्केने सापेक्षतः बरीच विक्रियाशील असतात. ती हायड्रोकार्बने तृप्त असल्यामुळे विक्रिया झाल्यावर त्यांच्यातील हायड्रोजन-अणूच्या जागी इतर अणू किंवा अणूंचा एखादा गट येणे शक्य असते. तसेच विक्रियेमुळे त्यांच्यातील कार्बन-कार्बन व कार्बन-हायड्रोजन बंध तुटणेही शक्य असते. सर्व तृप्त अल्केने हवेत किंवा ऑक्सिजनात जळतात. काही विशिष्ट परिस्थितीत म्हणजे विशिष्ट विक्रियाकारक किंवा उत्प्रेरक (प्रत्यक्ष विक्रियेत भाग न घेता विक्रिया जलद घडवून आणणारा पदार्थ) वापरून अल्केनांपासून अनेक प्रकारची, विविध प्रतिष्ठापित गट व विविध गुणधर्म असलेली अनुजात संयुगे तयार करता येतात किंवा एखाद्या अल्केनापासून त्याची समघटक अल्केने बनविता येतात. अल्केने ही मुख्यतः खाणीतून मिळणार्या नैसर्गिक (इंधन) वायूपासून किंवा खनिज तेलापासून मिळविली जातात.
|
कोष्टक क्र. २ एथिलीन मालेतील काही संयुगे |
|||
|
नाव |
रेणवीय सूत्र |
संरचना सूत्र |
|
|
एथिलीन (एथीन) |
C2H4 |
H2C=CH2 |
|
|
प्रोपिलीन (प्रोपीन) |
C3H6 |
H3C·C=CH2 |
|
|
। |
|||
|
H |
|||
|
ब्युटीन-१ |
C4H8 |
H3C·CH2·CH=CH2 |
|
|
ब्युटीन-२ (सिस) |
C4H8 |
H3C·C=CH·CH3 |
|
|
। |
|||
|
H |
|||
|
आयसोब्युटिलीन |
C4H8 |
H3C·C=CH·CH3 |
|
|
। |
|||
|
H |
|||
|
पटीन-१ |
C5H10 |
H3C·C·C·C=CH2 |
|
|
। । । |
|||
|
H2 H2H |
|||
|
२-मिथिल ब्युटीन-१ |
C5H10 |
H3C·C·C=CH2 |
|
|
। । |
|||
|
H2 CH3 |
|||
|
३-मिथिल ब्युटीन-२ |
C5H10 |
H3C·CH·CH=CH2 |
|
|
। |
|||
|
CH3 |
|||
|
हेक्झीन-१ |
C6H12 |
H3C·CH2·CH2·CH2·CH=CH2 |
|
|
हेप्टीन-१ |
C7H14 |
H3C·CH2·CH2·CH2·CH2·CH=CH2 |
|
|
ऑक्टीन-१ |
C8H16 |
H3C·CH2·CH2·CH2·CH2·CH2·CH=CH2 |
|
अतृप्त हायड्रोकार्बने : (१) अल्किने किंवा ओलिफिने : यांची संरचना निर्वलयी असून त्यांच्यात द्विबंधाने (दोन बंधांनी) जोडलेल्या कार्बनांची एक जोडी असते. त्यांच्यात (CnH2n) असे सूत्र असणाऱ्या अनेक आनुक्रमिक (एकामागून एक येणाऱ्या) सजातीय संयुगांचा समावेश होतो. त्यांच्यापैकी सर्वांत साधे व पहिले म्हणजे एथिलीन (CH2 = CH2) होय. अल्किनांतील कार्बनांच्या शृंखला निर्वलयी व अशाख किंवा सशाख असू शकतात. एथिलीन मालेतील प्रारंभीच्या काही संयुगांची नावे, सूत्रे व संरचना कोष्टक क्र. २ मध्ये दिलेली आहेत. यांची नावे, तृप्त हायड्रोकार्बनांच्या नावांतील ‘एन’ या अंत्य पदाऐवजी ‘ईन’ हे पद योजून केली जातात.
सामान्य दाब तापमानाच्या परिस्थितीत दोन ते चार कार्बनांचे अणू असणारी अल्किने वायुरूप, पाच ते पंधरा कार्बन अणू असणारी अल्किने द्रवरूप व सोळा किंवा अधिक कार्बन अणू असणारी अल्किने घन असतात. ती सर्व पाण्याहून हलकी असून पाण्यात अविद्राव्य असतात. ती जाळल्यास धूम्रयुक्त व संदीप्त ज्योत मिळते. अल्किनांत द्विबंध असल्यामुळे त्यांच्यावर विक्रियाकारकांच्या क्रिया सहज होतात व त्या सामान्यतः समावेशक इतर अणू वा अणुगट सामावून घेणाऱ्या असतात. परंतु काही विशिष्ट परिस्थितींत त्यांच्या प्रतिष्ठापक (एका अणूच्या जागी दुसरा बसविला जाण्याच्या) विक्रिया घडून येतात. त्यांच्यात क्लोरिनाचे किंवा ब्रोमिनाचे सहज समावेशन होऊ शकते व पोटॅशियम परमँगॅनेटाचा रंग ती नाहीसा करतात. त्यांच्या द्विबंधाच्या जागी हॅलोजन अम्ले, सल्फ्यूरिक अम्ल व फॉर्मिक अम्ल यांचे समावेशन होऊ शकते. अल्किनांच्या द्वारे अनेक प्रकारचे व उपयुक्त असे कार्बनी पदार्थ तयार करता येत असल्यामुळे त्यांना रासायनिक उद्योगधंद्यात फार महत्त्व आलेले आहे. खनिज तेलाचे
भंजन (तापवून विघटन करणे) करून अलीकडे त्यांचे मोठ्या प्रमाणात उत्पादन केले जाते. क्वचित इतर रीतींनीही (उदा., अल्कोहॉलांचे निर्जलीकरण करून) ती मिळविली जातात. एथिलीन (CH2= CH2) हा वायू भारतात सध्या एथिल अल्कोहॉलापासून तयार करतात. त्याचा मुख्य उपयोग स्टायरीन, पॉलिस्टायरीन, पॉलिथीन इ. प्लॅस्टिक पदार्थ तयार करण्यात होतो.
(२) अल्काइने किंवा ॲसिटिलिने : या अतृप्त हायड्रोकार्बनांत त्रिबंधाने (तीन बंधांनी) जोडलेल्या कार्बन अणूंची एक जोडी असते व त्यांचे सामान्य सूत्र (CnH2n-2) असे असते. अल्काइनांची संरचना निर्वलयी व अशाख किंवा सशाख असू शकते. अल्काइनांच्या मालेतील सर्वांत साधे व पहिले संयुग ⇨ॲसिटिलीन C2H2 होय व त्या नावावरून अल्काइनांना ‘ॲसिटिलीन माला’ असे नावही दिले जाते. या मालेतील काही संयुगांची नावे व संरचना सूत्रेही कोष्टक क्र. ३ मध्ये दिलेली आहेत.
|
कोष्टक क्र. 3. ॲसिटिलीन मालेतील काही संयुगे |
|||
|
व्यवहारातील नाव |
शास्त्रीय नाव |
संरचना सूत्र |
|
|
ॲसिटिलीन |
एथाइन |
CH≡CH |
|
|
मिथिल ॲसिटिलीन |
प्रोपाइन |
CH3C≡CH |
|
|
एथिल ॲसिटिलीन |
ब्युटाइन-1 |
H3C–H2C–C≡CH |
|
|
डायमिथिल ॲसिटिलीन |
ब्युटाइन-2 |
CH3·C≡C·CH3 |
|
|
n-प्रोपिल ॲसिटिलीन |
पेंटाइन-1 |
H3C–CH2·CH2·C≡CH |
|
|
मिथिल इथिल ॲसिटिलीन |
पेंटाइन-1 |
H3C–CH2·C≡C·CH3 |
|
|
आयसो प्रोपिल ॲसिटिलीन |
3-मिथिल, ब्युटाइन-1 |
CH3·CH·C≡CH |
|
|
। |
|||
|
CH3 |
|||
सामान्य परिस्थितीत ॲसिटिलीन व मिथिल ॲसिटिलीन ही वायुरूप, चार व पाच कार्बन अणू असणारी संयुगे द्रवरूप व ऑक्टेडेसाइन C18H34 सारखी उच्च रेणुभाराची संयुगे घन असतात. विक्रियांच्या बाबतींत अल्काइने ही अल्किनांसारखी असतात व त्यांच्यापासून अनेक समावेशक संयुगे मिळतात. उदा., ॲसिटिलीन व क्लोरीन यांची विक्रिया होऊन ॲसिटिलीन डायक्लोराइड (C2H2Cl2) किंवा (CHCl:CHCl) व ॲसिटिलीन टेट्राक्लोराइड (C2H2Cl4) किंवा (CHCl2· CHCl2) अशी संयुगे तयार होतात.
अल्काइने ही सापेक्षतः विरळाच असून त्यांच्यापैकी सामान्य व सर्वांत महत्त्वाचे ॲसिटिलीन होय व प्रकाश देणारा वायू म्हणून त्याचा उपयोग बरेच दिवस होत आलेला आहे.सामान्य व युद्धोपयोगी वस्तू संश्लेषणाने बनविण्याच्या कामी ॲसिटिलीन हे मौलिक द्रव्य ठरलेले आहे. ॲसिटाल्डिहाइड व्हिनिल क्लोराइड व ॲक्रिलो नायट्राइल यांसारखी रासायनिक उद्योगात मोठ्या प्रमाणात वापरली जाणारी महत्त्वाची संयुगे तयार करण्यासाठी ॲसिटिलिनाचा उपयोग केला जातो.
हायड्रोकार्बनांचे अनुजात: हायड्रोकार्बनातील हायड्रोजनाच्या जागी निरनिराळ्या गटांची प्रतिष्ठापना करता येते व विविध आणि तदनुरूप गुणधर्मांची संयुगे मिळतात. उदा., हॅलाइडे, नायट्राइले, अमाइने, अल्कोहॉले, अम्ले, ईथरे, आल्डिहाइडे, कीटोने वगैरे. यांपैकी काहींचे वर्णन खाली दिले आहे. खालील सूत्रांत R म्हणजे तृप्त किंवा अतृप्त हायड्रोकार्बन गट समजावा.
अल्कोहॉले: सामान्य सूत्र R—OH. अल्केनांमधील एक किंवा अनेक हायड्रोजन अणू OH गटाने प्रतिष्ठापित होऊन तयार झालेल्या संयुगांचा समावेश अल्कोहॉलात करतात. मूळ संयुगातील अल्केनाला ‘ऑल’ प्रत्यय जोडून निरनिराळ्या अल्कोहॉलांची शास्त्रीय नावे बनविली जातात. उदा., मिथेनपासून मिथेनॉल, एथेनापासून एथेनॉल (यालाच एथिल अल्कोहॉल’ही म्हणतात). पिण्याच्या दारूत एथिल अल्कोहॉल हाच मुख्य घटक असतो [→अल्कोहॉल].
ईथरे: सामान्य सूत्रR–O–R. या वर्गातील संयुगे कार्बनी ऑक्साईडे असतात. अल्केनाच्या नावाचा उल्लेख करून व शेवटी ईथर हे उपपद लावून ईथराचे नाव बनते. उदा., एथिल-एथिल किंवा डायएथिल ईथर C2H5–O–C2H5हे ईथरांपैकी महत्त्वाचे व विद्रावक, इंधन किंवा संवेदनाहारी (बधिरता आणणारे) म्हणून वापरले जाणारे द्रव्य आहे. R–O–R’ असे सूत्र असणारी (उदा., मिथिल एथिल ईथर CH3–O–C2H5) अशी मिश्र ईथरेही असतात [→ ईथर –१].
आल्डिहाइडे: सामान्य सूत्रR–CHO. त्यांच्यात –CHO असा गट असतो. आल्डिहाइडांच्या ऑक्सिडीकरणाने [→ऑक्सिडीभवन] अम्ले मिळतात व ⇨क्षपणाने अल्कोहॉले मिळतात. अल्केनाला‘आल’ प्रत्यय लावून आल्डिहाइडांची शास्त्रीय नावे दिली जातात. मिथेनपासून मिथेनाल CH2O. परंतु अल्केन अम्लावरून दिलेली व परंपरेने चालत आलेली नावेही वापरली जातात. उदा., फॉर्मिक अम्लापासून फॉर्माल्डिहाइड CH2O (शास्त्रीय नाव मिथेनाल) ॲसिटिक अम्लापासून ॲसिटाल्टिहाइड C2H4O (शास्त्रीय नाव एथेनाल) [→ आल्डिहाइडे].
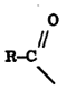 कीटोने: याचे सामान्य सूत्र शेजारी दाखविल्याप्रमाणे असून त्यांच्यात > C : O हा द्विसंयुजी कीटोन गट असतो. अल्केनाला ‘ओन’ प्रत्यय लावून किंवा R मूलकाच्या नावापुढे कीटोन -संज्ञा वापरून कीटोनांची नावे दिली जातात. उदा., CH3·CO·CH3याला ‘२-प्रोपेनोन’ किंवा ‘डाय मिथिल कीटोन’ अशी नावे दिली जातात. प्रोपेनोनाला ⇨ ॲसिटोन हेही नाव प्रचारात आहे [→ कीटोने].
कीटोने: याचे सामान्य सूत्र शेजारी दाखविल्याप्रमाणे असून त्यांच्यात > C : O हा द्विसंयुजी कीटोन गट असतो. अल्केनाला ‘ओन’ प्रत्यय लावून किंवा R मूलकाच्या नावापुढे कीटोन -संज्ञा वापरून कीटोनांची नावे दिली जातात. उदा., CH3·CO·CH3याला ‘२-प्रोपेनोन’ किंवा ‘डाय मिथिल कीटोन’ अशी नावे दिली जातात. प्रोपेनोनाला ⇨ ॲसिटोन हेही नाव प्रचारात आहे [→ कीटोने].
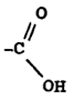 कार्बॉक्सिलिक अम्ले : सामान्य सूत्रR–COOH. यांच्यात शेजारी दाखविल्याप्रमाणे कार्बॉक्सिलिक गट असतो. कार्बॉक्सिलिक (विद्युत् भारित् अणू, रेणू वा अणुगट म्हणजे आयन तयार होणे) गटातील हायड्रोजनाचे आयनीभवन होत असल्यामुळे त्यांच्यात अम्लत्व येते. ॲलिफॅटिक अम्लांपैकी परिचित म्हणजे ॲसिटिक अम्ल व फॉर्मिक अम्ल ही होत.
कार्बॉक्सिलिक अम्ले : सामान्य सूत्रR–COOH. यांच्यात शेजारी दाखविल्याप्रमाणे कार्बॉक्सिलिक गट असतो. कार्बॉक्सिलिक (विद्युत् भारित् अणू, रेणू वा अणुगट म्हणजे आयन तयार होणे) गटातील हायड्रोजनाचे आयनीभवन होत असल्यामुळे त्यांच्यात अम्लत्व येते. ॲलिफॅटिक अम्लांपैकी परिचित म्हणजे ॲसिटिक अम्ल व फॉर्मिक अम्ल ही होत.
फॉर्मिक, ॲसिटिक, स्टिअरिक, ओलेइक, पामिटिक इ. विविध गुणधर्म असणाऱ्या अम्लांचा समावेश या वर्गांत होतो. अल्केनी अम्लांपासून एस्टरे, अम्ल हॅलाइडे व अमाइडे असे तीन प्रमुख अनुजात तयार होतात [→कार्बॉक्सिलिक अम्ले].
एस्टरे: एस्टरे म्हणजे अल्कोहॉल (क्षारक, अम्लाबरोबर विक्रिया झाल्यास लवण देणारा पदार्थ) व एखादे कार्बनी अम्ल यांच्या विक्रियेने पाणी निघून जाऊन तयार होणारी लवणे : उदा.,
ROH+R‘COOH= R‘COOR + H2O
एथिल अल्कोहॉल व ॲसिटिक अम्ल यांपासून एथिल ॲसिटेट मिळते. वनस्पतींपासून किंवा प्राण्यांपासून मिळणारी तेले, मेणे व चरबी ही एस्टरेच असतात [→ एस्टरे].
अम्ल हॅलाइडे : ज्यांच्यात एकसंयुजी –COX हा गट आहे अशा कार्बनी संयुगाच्या वर्गाचे नाव. या सूत्रातील X च्या जागी एखादे हॅलोजन असते. उदा., अम्ल ब्रोमाइडे R–COBr अम्ल क्लोराइडेR–COCI. कार्बनी संश्लेषणात अम्ल हलाइडांचा फार उपयोग होतो [→ अम्ल हॅलाइडे].
अमाइडे: ज्यांच्यात –CONH2हा एकसंयुजी गट आहे अशा कार्बनी संयुगांच्या वर्गाचे नाव. उदा., ॲसिटामाइड CH3–CO·NH2 [→अमाइडे].
अमाइने: अमोनियातील एक, दोन किंवा तिन्ही हायड्रोजनांच्या जागी कार्बनी गटांची स्थापना करून मिळणाऱ्या संयुगांच्या वर्गाचे नाव. उदा., मिथिल अमाइनCH3NH2, डाय मिथिल अमाइन (CH3)2 NH,ट्रायमिथिल अमाइन(CH3)3N [→ अमाईने].
नाइट्राइले: R–C ≡ N असे सामान्य सूत्र असणाऱ्या कार्बनी संयुगांचा गट. या संयुगांचे जलीय विच्छेदन (पाण्याच्या विक्रियेने घटक द्रव्ये वेगळी होणे) पुरे झाल्यावर कार्बॉक्सिलिक अम्ले मिळतात.
RCN + 2H2O → RCOOH + NH3
जलीय विच्छेदनाने जे अम्ल तयार होते, त्या अम्लाच्या नावाला ‘नाइट्राइल’ हा प्रत्यय जोडून नायट्राइलांना नावे दिली जातात. उदा., CH3CN पासून ॲसिटिक अम्ल मिळते, म्हणून त्याला ‘ॲसिटोनायट्राइल’ म्हणतात. अल्किन हॅलाइडे व सोडियम सायनाइड यांच्या विक्रियेने अल्किल वर्गातील नायट्राइले तयार करतात.
अल्किल-गंधक संयुगे: हायड्रोजन सल्फाइडामधील एका हायड्रोजनाच्या जागी अल्किल गट आल्यास मर्कॅप्टने व दोन्ही हायड्रोजनांच्या जागी अल्किल गट आल्यास सल्फाइडे तयार होतात.
मर्कॅप्टनेकिंवा थायो-अल्कोहॉले: सामान्य सूत्र R-SH. उदा., मिथिल मर्कॅप्टन (मिथेन थायॉल)CH3·SH एथिल मर्कॅप्टन (एथेन थायॉल) C2H5·SH. मिथिल मर्कॅप्टन हे वायुरूप आहे व इतर मर्कॅप्टने रंगहीन द्रव असतात. कमी रेणुभार असणाऱ्या संयुगांस लसणीसारखा वास असतो, पण नावापेक्षा अधिक कार्बन अणू असणाऱ्या संयुगांस चांगला वास असतो.
अल्किल सल्फाइडे किंवा थायोईथरे: सामान्य सूत्र R·S·R. ही द्रवरूप व दुर्गंधी असतात. उदा., मिथिल सल्फाइडCH3.S·CH3, एथिल सल्फाइड C2H5·S·C2H5· मिश्र ईथरांची नावे देताना ‘थायो’ ही संज्ञा वापरली जाते. उदा., मिथिल थायो एथेनCH3·S·C2H5.
सल्फॉनिक अम्ले : सामान्य सूत्रR–SO2·OH. अल्किल गटास सल्फॉनिक मूलक (विक्रियांमध्ये स्थिर राहणारा पण स्वतंत्र अस्तित्व नसलेला अणुगट) -SO2·OH जोडल्यास सल्फॉनिक अम्ले तयार होतात. उदा., मिथिल सल्फॉनिक अम्ल, CH–SO2·OH. ही अम्ले दाट, द्रवरूप असतात व पाण्यात विरघळतात. ती प्रबल असतात व धातूंच्या हायड्रॉक्साइडांशी किंवा कार्बोनेटांशी त्यांची विक्रिया होऊन लवणे तयार होतात.
तृप्त हायड्रोकार्बनांच्या अनुजातांचाच उल्लेख वर केलेला आहे, परंतु अतृप्त हायड्रोकार्बनांचेही असेच अनुजात होऊ शकतात.
पहा : ॲरोमॅटिक संयुगे ॲलिसायक्लिक संयुगे कार्बनी रसायनशास्त्र हायड्रोकार्बने.
संदर्भ : 1. Fieser, L. F. Fieser, M. Organic Chemistry, Bombay, 1962.
2. Finar, I. L. Organic Chemistry, Vols. 2, London, 1962.
कारेकर, न. वि.
“