थायोईथरे: (अल्किल सल्फाइडे). गंधकयुक्त कार्बनी संयुगांचा एक वर्ग. हायड्रोजन सल्फाइडातील (H2S) हायड्रोजन अणूंच्या जागी दोन अल्किल गटांची (हायड्रोकार्बनातून एक हायड्रोजन अणू काढून टाकून बनलेल्या गटांची) योजना केली म्हणजे थायोईथरांची संरचना बनते, म्हणून ह्या संयुगांना अल्किल सल्फाइडे असेही म्हणतात. थायोईथरांचे सामान्य सूत्र R–S–R′ असे आहे. यात R व R′ हे अल्किल गट आहेत. ते सारखे असतील (R = R′) तर त्यांना सममित (घटक रेणूंची एकसारखीव नियमितपणे मांडणी असणाऱ्या संरचनेची) अल्किल सल्फाइडे आणि भिन्न असतील, तर त्यांना असममित अल्किल सल्फाइडे म्हणतात.
 उपस्थिती: डायॲलिल सल्फाइड [(CH2 = CH–CH2)2S] हे लसणात असते. लाकडाचा लगदा तयार करण्याच्या सल्फाइड पद्धतीत अनेक बायसल्फाइटांच्या विद्रावाबरोबर लाकूड उकळतात. या संस्कारात मिळणाऱ्या टाकाऊ विद्रावात (सल्फाइट वेस्ट लिकरमध्ये) डायमिथिल सल्फाइड आढळते.
उपस्थिती: डायॲलिल सल्फाइड [(CH2 = CH–CH2)2S] हे लसणात असते. लाकडाचा लगदा तयार करण्याच्या सल्फाइड पद्धतीत अनेक बायसल्फाइटांच्या विद्रावाबरोबर लाकूड उकळतात. या संस्कारात मिळणाऱ्या टाकाऊ विद्रावात (सल्फाइट वेस्ट लिकरमध्ये) डायमिथिल सल्फाइड आढळते.
निर्मिती : (१) मरकॅप्टनांपासून पुढील विक्रियांनी थायोईथरे बनविता येतात.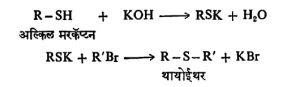 ही पद्धत अल्कोहॉलांपासून ईथरे बनविण्याच्या विल्यमसन संश्लेषण क्रियेसारखी आहे [⟶ ईथर –१].
ही पद्धत अल्कोहॉलांपासून ईथरे बनविण्याच्या विल्यमसन संश्लेषण क्रियेसारखी आहे [⟶ ईथर –१].
तसेच क्षार (अल्कली) धातूंच्या (उदा., पोटॅशियम) मरकॅप्टनांपासून अल्किल हॅलाइडे (X = CI, Br किंवा I), सल्फेटे (X = OSO2·OK) किंवा सल्फोनेटे (X = SO2·OK) यांच्या विक्रियांनी थायोईथरे बनतात.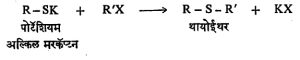 वरील दोन्ही पद्धतींनी सममित किंवा असममित थायोईथरे मिळू शकतात.
वरील दोन्ही पद्धतींनी सममित किंवा असममित थायोईथरे मिळू शकतात.
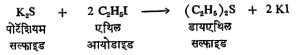
(२) क्षारीय सल्फाइडे अल्किल हॅलाइडाबरोबर तापविल्यास सममित थायोईथरे बनतात. उदा.,
(३) ईथरे व फॉस्फरस पेंटासल्फाइड यांच्या विक्रियेने सममित थायोईथरे बनविता येतात. उदा.,
गुणधर्म : ही संयुगे रंगहीन, द्रवरूप व बाष्पनशील (उडून जाणारी) असून त्यांना उग्र वास येतो. पाण्यात ती विरघळत नाहीत, पण कार्बनी विद्रावकांत (विरघळविणाऱ्या पदार्थांत) विरघळतात. त्यांचे उकळबिंदू अनुरूप ईथरांच्या उकळबिंदूपेक्षा उच्च असतात. धातूंच्या लवणांबरोबर त्यांची द्विलवणे (दोन साधी लवणे एकत्रित स्फटिकीभूत होऊन तयार होणारी लवणे मात्र विद्रावात ही साधी लवणे स्वतंत्र रीत्या अस्तित्वात असतात) बनतात. उदा., (C2H5)2S · HgCI2.हॅलोजनांबरोबर (फ्ल्युओरीन, क्लोरीन, ब्रोमीन वा आयोडीन) त्यांची समावेशक (रेणूमध्ये दुसरे अणू वा समूह यांचा समावेश होऊन बनणारी) संयुगे बनतात. त्यातील एक हॅलोजन अणू ऋणायनात (विद्रावातून विद्युत् प्रवाह नेला असता ऋण अग्राकडे जाणाऱ्या आयनात म्हणजे विद्युत् भारित अणू वा अणुगटात) व धनायनात (धन अग्राकडे जाणाऱ्या आयनात) असतो. उदा.,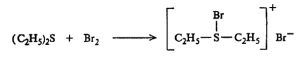
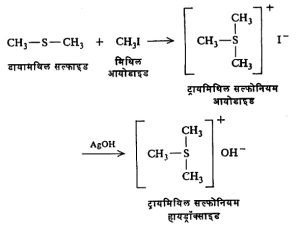
डायमिथिल सल्फाइड आणि मिथिल आयोडाइड यांच्या विक्रियेने ट्रायमिथिल सल्फोनियम आयोडाइड बनते. त्यावर ओल्या सिल्व्हर आयोडाइडाची क्रिया केल्यास ट्रायमिथिल सल्फोनियम हायड्रॉक्साइड हे प्रभावी क्षारकधर्मी (अम्लाशी विक्रिया होऊन लवणे देण्याचा गुणधर्म असणारे, बेसिक) संयुग मिळते.
सौम्य ऑक्सिडीकारकांमुळे (संयुगात ऑक्सिजनाचा समावेश करणाऱ्या पदार्थांमुळे), उदा., हायड्रोजन पेरॉक्साइड, त्यांची सल्फॉक्साइडे बनतात.
पोटॅशियम परमँगॅनेटासारख्या प्रभावी ऑक्सिडीकारकाची क्रिया केल्याने ‘सल्फोन’ वर्गाची संयुगे मिळतात.
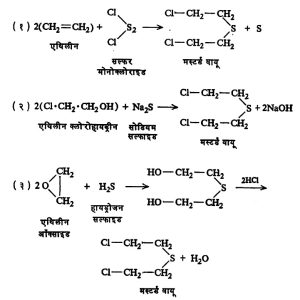
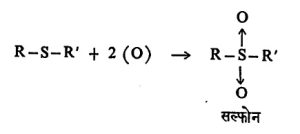 पहिल्या महायुद्धात वापरण्यात आलेला ‘मस्टर्ड वायू’ नावाचा विषारी वायू म्हणजे β – β – डायक्लोरोडायएथिल सल्फाइड होय. तो पुढील प्रकारांनी तयार करतात.
पहिल्या महायुद्धात वापरण्यात आलेला ‘मस्टर्ड वायू’ नावाचा विषारी वायू म्हणजे β – β – डायक्लोरोडायएथिल सल्फाइड होय. तो पुढील प्रकारांनी तयार करतात.
मस्टर्ड वायू हा एक तेलकट द्रव असून त्याचा उकळबिंदू २१६° से. आहे. याच्या वाफेच्या संपर्काने कातडीवर फोड येतात. हा रबराच्या आवरणातूनही आरपार जाऊ शकतो.
उपयोग: वंगण तेले व इंधन तेले यांच्यात मिसळण्यासाठी काही अल्किल सल्फाइडे उपयोगी पडतात. काही अल्किल सल्फाइडांचा उपयोग कृषी रसायनांतही होतो.
संदर्भ: 1. Finar, I. L. Organic Chemistry, Vol. I, London, 1962.
2. Parker, J. Vaughan, J. A Modern Approach to Organic Chemistry, Oxford, 1958.
देशपांडे, ज्ञा. मा.
“