रासायनिक संरचना : पृथ्वीवर नैसर्गिक स्वरूपात सापडणारे हिरा व ग्रॅफाइट हे पदार्थ शुद्ध कार्बन या मूलद्रव्याची रूपे आहेत परंतु त्यांच्या गुणधर्मांत मात्र फार भिन्नता आहे. हिरा हा जगातील सर्वांत कठीण पदार्थ आहे, तर ग्रॅफाइट इतके मृदू असते की, त्याचा उपयोग वंगण म्हणूनही केला जातो. कार्बन, हायड्रोजन, नायट्रोजन व ऑक्सिजन यांच्या अनुक्रमे एक, चार, दोन व एक इतक्या अणूंपासून अमोनियम सायनेट व यूरिया हे अगदी भिन्न गुणधर्मांचे पदार्थ निर्माण होतात. एवढेच नव्हे, तर अमोनियम सायनेटापासून यूरिया मिळू शकतो आणि तोही अगदी सरळ रीतीने. त्याचप्रमाणे बेंझिनासारख्या ॲरोमॅटिक कार्बनी पदार्थाचेच [⟶ ॲरोमॅटिक संयुगे] गुणधर्म असलेला बोरॅझीन (किंवा बोरॅझोल) नावाचा पदार्थ बोरॉन, नायट्रोजन व हायड्रोजन यांच्या अनुक्रमे तीन, तीन व सहा अणूंच्या संयोगाने बनविता येतो. बेंझीन किंवा तत्सम पदार्थांचा प्रमुख गुण म्हणजे ॲरोमॅटिकता (सहा अणूंनी बनलेली वलयी संरचना असणे). हा गुण अकार्बनी पदार्थातही असू शकतो. हे पाहून शास्त्रज्ञांची खात्री झाली की, पदार्थांचे विशिष्ट गुणधर्म त्यांच्या रेणूत असलेल्या अणूंवर अवलंबून नसून त्या अणूंची मांडणी कशी आहे यावरच अवलंबून असतात. पदार्थातील अणूंच्या या मांडणीला रेणूची संरचना किंवा रासायनिक संरचना म्हणतात.
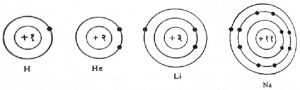
रेणू कसे उत्पन्न होतात तसेच त्यांचे घटक अणू विशिष्ट पद्धतीने कसे जोडले जातात म्हणजेच त्यांची मांडणी कशी होते हे जाणून घेण्यासाठी अणूंची संरचना कशी असते हे समजून घेणे महत्त्वाचे आहे. प्रत्येक अणूमध्ये धन विद्युत् भारित केंद्र व त्याभोवती फिरणारे ऋण विद्युत् भारित इलेक्ट्रॉन असतात. रासायनिक संरचना समजण्यासाठी अणुकेंद्राभोवतालच्या इलेक्ट्रॉनांचा विन्यास (मांडणी) माहीत करून घेणे अत्यावश्यक आहे. अणुकेंद्राभोवती इलेक्ट्रॉनांची एकावर एक अशी कवचे असतात. अणुकेंद्राच्या सर्वांत जवळचे कवच म्हणजे पहिल्या क्रमांकाचे कवच होय. प्रत्येक कवचात 2n2 या संख्येवढे (n– कवचाचा क्रमांक) इलेक्ट्रॉन असतात म्हणजेच पहिल्या कवचात २, दुसऱ्यात ८, तिसऱ्या १८ चवथ्यात ३२ इलेक्ट्रॉन असतील.
या कवचात s, p,d व f असे परिकक्ष त्यांची संख्या अनुक्रमे १, ३, ५ व ७ अशी आहे.
आ. १ मध्ये हायड्रोजन, हीलियम, लिथियम व सोडियम यांच्या अणूंमधील इलेक्ट्रॉनांची कवचे व त्यांत असलेले इलेकट्रॉन दाखविले आहेत परिकक्ष दाखविलेले नाहीत. [⟶ अणु व आणवीय संरचना].
मूलद्रव्यांचे अणू एकत्र येताना इलेक्ट्रॉनांमध्ये आंतरक्रिया होऊन संयुग निर्मिती होते. या आंतरक्रिया दोन प्रकारच्या असतात. पहिल्या प्रकारात एका अणूकडून एक किंवा अधिक इलेक्ट्रॉन पूर्णपणे दुसऱ्या अणूला दिले जातात. त्यामुळे एक अणू धन विद्युत् भारित व दुसरा ऋण विद्युत् भारित होतो, या प्रकारास विद्युत् संयुजी किंवा आयनी बंध म्हणतात. दुसऱ्या प्रकारात एकत्र येणाऱ्या. दोन अणूंपैकी प्रत्येकाचा एक इलेक्ट्रॉन मिळून दोन इलेक्ट्रॉनांचा एक रासायनिक बंध तयार होतो. या बंधातील दोन्ही इलेक्ट्रॉनांवर प्रत्येक अणूचा ताबा राहतो, याला सहसंयुजी बंध म्हणतात.
आयननिर्मिती : अणू स्वतः विद्युत् भारदृष्ट्या उदासिन असतो. तो जेव्हा स्वतःकडील एक किंवा अधिक इलेक्ट्रॉन दुसऱ्या अणूस देतो तेव्हा त्याचा धन विद्युत् भारित आयन म्हणजे ऋणायन बनतो. इलेक्ट्रॉन घेणाऱ्या ऋण विद्युत् भारित आयनास धनायन म्हणतात.
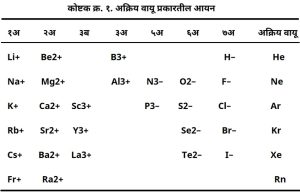 आयनांचे गुणधर्म त्यांच्यातील इलेक्ट्रॉनांच्या विन्यास पद्धतीवर अवलंबून असल्याचे दिसून येते. अणुकेंद्राभोवती असलेल्या सर्वांत बाहेरच्या कवचातील इलक्ट्रॉनच सामान्यपणे रासायनिक विक्रियेत भाग घेतात. या कवचाला संयुजी कवच आणि त्यातील इलेक्ट्रॉनांना संयुजी इलक्ट्रॉन म्हणतात. संयुग तयार होत असताना सर्वांत बाहेरील कवच जास्त महत्त्वाचे असते आणि या कवचात जास्तीत जास्त आठ इलेक्ट्रॉन असतात पण ज्या मूलद्रव्यांच्या अणूंचे d परिकक्ष भरले जात असते, त्यांना ⇨संक्रमणी मूलद्रव्ये म्हणतात व अशा अणूंपासून निर्माण झालेल्या आयनास हा नियम लागू पडतोच असे नाही. इलेक्ट्रॉनांचे d परिकक्ष संयुजी कवचाचा एक भाग म्हणूनच ओळखले जाते. अशा प्रकारच्या आयनांच्या बाह्यतम कवचात आठऐवजी अठरा इलेक्ट्रॉन असतात. आयनांच्या पहिल्या प्रकारातील आयनांना ⇨अक्रिय वायू प्रकारचे आयन म्हणतात. या आयनांना इलेक्ट्रॉन विन्यास ⇨आवर्त सारणीतील अनुक्रमे त्यांच्या आगोदरच्या अक्रिय वायूंप्रमाणे असतो. दुसऱ्या प्रकारच्या म्हणजे ज्यांच्या बाह्यतम कवचात आठऐवजी अठरा इलेक्ट्रॉन असतात त्यांना आभासी अक्रिय वायू प्रकारचे आयन म्हणतात.
आयनांचे गुणधर्म त्यांच्यातील इलेक्ट्रॉनांच्या विन्यास पद्धतीवर अवलंबून असल्याचे दिसून येते. अणुकेंद्राभोवती असलेल्या सर्वांत बाहेरच्या कवचातील इलक्ट्रॉनच सामान्यपणे रासायनिक विक्रियेत भाग घेतात. या कवचाला संयुजी कवच आणि त्यातील इलेक्ट्रॉनांना संयुजी इलक्ट्रॉन म्हणतात. संयुग तयार होत असताना सर्वांत बाहेरील कवच जास्त महत्त्वाचे असते आणि या कवचात जास्तीत जास्त आठ इलेक्ट्रॉन असतात पण ज्या मूलद्रव्यांच्या अणूंचे d परिकक्ष भरले जात असते, त्यांना ⇨संक्रमणी मूलद्रव्ये म्हणतात व अशा अणूंपासून निर्माण झालेल्या आयनास हा नियम लागू पडतोच असे नाही. इलेक्ट्रॉनांचे d परिकक्ष संयुजी कवचाचा एक भाग म्हणूनच ओळखले जाते. अशा प्रकारच्या आयनांच्या बाह्यतम कवचात आठऐवजी अठरा इलेक्ट्रॉन असतात. आयनांच्या पहिल्या प्रकारातील आयनांना ⇨अक्रिय वायू प्रकारचे आयन म्हणतात. या आयनांना इलेक्ट्रॉन विन्यास ⇨आवर्त सारणीतील अनुक्रमे त्यांच्या आगोदरच्या अक्रिय वायूंप्रमाणे असतो. दुसऱ्या प्रकारच्या म्हणजे ज्यांच्या बाह्यतम कवचात आठऐवजी अठरा इलेक्ट्रॉन असतात त्यांना आभासी अक्रिय वायू प्रकारचे आयन म्हणतात.
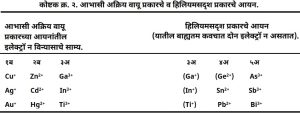 आवर्त सारणीतील १ ब (Cu+, Ag+, Au+) व २ब (Zn2+, Cd2+, Hg2+) या गटांतील मूलद्रव्यांपासून आभासी अक्रिय वायू प्रकारातील आयन मिळतात, तसेच ३अ (Ga+, In+, Ti+), ४अ (Ge2+, Sn2+, Pb2+) व ५अ (As3+,Sb3+, Bi3+) या गटांतील मूलद्रव्यांपासून हीलियमसदृश प्रकारचे आयन मिळतात.
आवर्त सारणीतील १ ब (Cu+, Ag+, Au+) व २ब (Zn2+, Cd2+, Hg2+) या गटांतील मूलद्रव्यांपासून आभासी अक्रिय वायू प्रकारातील आयन मिळतात, तसेच ३अ (Ga+, In+, Ti+), ४अ (Ge2+, Sn2+, Pb2+) व ५अ (As3+,Sb3+, Bi3+) या गटांतील मूलद्रव्यांपासून हीलियमसदृश प्रकारचे आयन मिळतात.
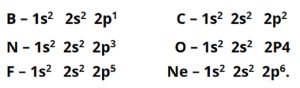 आवर्त सारणीतील काही मूलद्रव्यांच्या संयुजी कवचांचा विन्यास खाली दाखविला आहे.
आवर्त सारणीतील काही मूलद्रव्यांच्या संयुजी कवचांचा विन्यास खाली दाखविला आहे.
आयनीकरण वर्चस् : एखाद्या अणूतील वा रेणूतील इलेक्ट्रॉन काढून टाकण्यासाठी लागणाऱ्या ऊर्जेस आयनीकरण वर्चस् किंवा आयनीकरण ऊर्जा म्हणतात. इलेक्ट्रॉन बंधित असतानाच्या स्थितीतील उर्जा व शेवटच्या बंधमुक्त स्थितीतील ऊर्जा यांतील फरक म्हणजेच आयनीकरण वर्चस् होय. अणूतील किंवा रेणूतील पहिला इलेक्ट्रॉन काढून टाकण्यास लागणाऱ्या ऊर्जेस प्रथम आयनीकरण वर्चस् व दुसरा इलेक्ट्रॉन काढून टाकण्यास लागणाऱ्या ऊर्जेस द्वितीय आयनीकरण वर्चस् म्हणतात. संयुजी कवचातील इलेक्ट्रॉन काढून टाकण्यास कमी ऊर्जा लागते परंतु त्याच्या आतील कवचांमधील इलेक्ट्रॉन काढण्यास जास्त ऊर्जा लागते. धनायन मिळविण्यासाठी उदासिन अणूमध्ये एक अथवा अधिक इलेक्ट्रॉनांची भर घालावी लागते. या क्रियेत 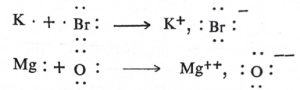 एका इलेक्ट्रॉनची भर घालताना ऊर्जा बाहेर टाकली जाते. उदासीन क्लोरीन अणूच्या बाह्यतम कवचात सात इलेक्ट्रॉन असतात. त्यात एका इलक्ट्रॉनाची भर घातली की, Cl– धनायन तयार होतो. त्याच्या बाह्य कवचात आठ इलेक्ट्रॉन असतात म्हणजेच अक्रिय वायूच्या बाह्यतम कवचात असतात तेवढेच इलेक्ट्रॉन असतात. साधे आयन असणारी संयुगे तयार होताना घातवीय अणूकडून इल्कट्रॉनांचे अधातवीय अणूकडे स्थलांतर होते व अनुक्रमे ऋणायन व धनायन तयार होतात. उदा.,
एका इलेक्ट्रॉनची भर घालताना ऊर्जा बाहेर टाकली जाते. उदासीन क्लोरीन अणूच्या बाह्यतम कवचात सात इलेक्ट्रॉन असतात. त्यात एका इलक्ट्रॉनाची भर घातली की, Cl– धनायन तयार होतो. त्याच्या बाह्य कवचात आठ इलेक्ट्रॉन असतात म्हणजेच अक्रिय वायूच्या बाह्यतम कवचात असतात तेवढेच इलेक्ट्रॉन असतात. साधे आयन असणारी संयुगे तयार होताना घातवीय अणूकडून इल्कट्रॉनांचे अधातवीय अणूकडे स्थलांतर होते व अनुक्रमे ऋणायन व धनायन तयार होतात. उदा.,
साधारणपणे ३– इतका ऋण विद्युत् भार असणारे धनायन अजूनपर्यंत माहीत आहेत.
बोर्न-हाबर चक्र : (माक्स बोर्न व फ्रिट्स हाबर या शास्त्रज्ञांच्या नावाने ओळखण्यात येणारे चक्र). विद्युत् संयुजी संयुगे तयार होणाऱ्यास विक्रिया बर्याटच गोष्टींच्या अनुकूलतेवर
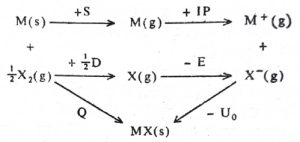
अवलंबून असतात. त्यात एकूण विक्रियेतील ऊर्जा-संबंध फार महत्त्वाचे असतात. लवण तयार होताना जी अनेक स्थित्यंतर होतात, त्यांचे ऊर्जाविज्ञान बोर्न-हाबर चक्रामध्ये दाखविले जाते. एक-संयुजी धातूचे हॅलाइड तयार होताना होणारी स्थित्यंतरे आ. २ मध्ये दाखविली आहेत. घनरूप लवणाच्या संभवन उष्णतेसाठी [⟶ उष्मारसायनशास्त्र] दिलेल्या खालील समीकरणात
जालक ऊर्जा (आयनी स्फटिकातील आयन परस्परांपासून अनंत अंतरापर्यंत अलग करण्यासाठी लागणारी ऊर्जा) व हॅलोजनाची इलेक्ट्रॉन आसक्ती ही पदे सोडल्यास बाकी सर्व पदे उष्माग्राही आहेत. ऊष्माग्राही परिमाण व ऊष्मादायी परिमाण यांची जर पूर्णपणे भरपाई झाली, तर स्थिर स्वरूपाची लवणे तयार होतात.
Q = S + IP + ½ D – E – U0
येथे Q = MX या घनरूप लवणाची संभवन उष्णता, S = M या धातूची संप्लवन ऊर्जा (स्थिर दाब व तापमान असताना एक मोल घन पदार्थाचे वायूत रूपांतर केल्यास अंतर्गत ऊर्जेत होणारी वाढ), IP = धातूचे आयनीकरण वर्चस्, D = हॅलोजनाची विगमन ऊर्जा (रेणूतील अणू पूर्णपणे अलग करण्यासाठी लागणारी ऊर्जा) E = हॅलोजनाची इलेक्ट्रॉन आसक्ती व U0= लवणाची जालक ऊर्जा होय.
क्षार धातूंची ( आवर्त सारणीतील १ अ गटातील मूलद्रव्यांची : Li, Na, K, Rb, Cs व Fr) संप्लवन ऊर्जा व आयनीकरण वर्चस हे दोन्ही कमी असल्याने त्यांची विद्युत् संयुजी लवणे सहज तयार होतात. क्षारीय मृत्तिका धातू (आवर्त सारणीतील २ अ गटातील सर्वात वजनदार मूलद्रव्ये : Ca, Sr, Mg व Ba) क्षार धातूंपेक्षा कमी क्रियाशील असतात. विद्युत् संयुजी लवणे तयार होण्यास काही मर्यादा आहेत. सिल्व्हर क्लोराइडामधील रेणूची संरचना सोडियम क्लोराइडाप्रमाणेच असून Ag+ आयन Na+ आयनापेक्षा थोडासाच मोठा आहे. जर हे दोन्ही पदार्थ गोलाकृती आयनांचे बनले आहेत असे समजल्यास सिल्व्हर क्लोराइड व सोडियम क्लोराइड यांच्या जालक ऊर्जेत फारसा फरक नसावा, अशी अपेक्षा करता येईल. AgCl च्या दोन विद्युत् भारित आयनांमधील अंतर थोडे जास्त असल्याने त्याची जालक ऊर्जा थोडी कमीच असावयास हवी पण प्रत्यक्षात तो Nacl पेक्षा ३०.६ किलोकॅलरी/मोल जास्तच आहे. क्षार धातूंच्या ऋणायनाचे आकारमान वाढत जाते तशी जालक ऊर्जा कमी होत जाते. याचे कारण AgCl च्या बाबतीत आयनांचे ध्रुवीकरण हेच होय. Ag + व Cl– हे आयन सहसंयुजी व विद्युत् संयुजी अशा दोन्ही बंधांमुळे एकत्र राहतात. Na+ व Cl− आयन केवळ विद्युत् संयुजी बंधामुळे एकत्र राहतात म्हणूनच विद्युत् संयुजी लवणाकडून अपेक्षिलेल्या गुणधर्मापेक्षा AgCl सारख्या लवणांचे गुणधर्म निराळे दिसून येतात.
बहुपृष्ठीय संरचना व सहसंबद्ध बहुपृष्ठके : एक-आणवीय आयन असणाऱ्याज संयुगापेक्षा जास्त जटिल स्वरूपाची संरचना म्हणजे अनेक अणूंचा (प्रतलीय बहुभुजाकृतींनी बनलेली अनेक पृष्ठके असलेल्या भूमीतीय आकृतीच्या स्वरूपातील) समुच्चय असणारी संरचना उदासीन अणू एकत्र येऊन त्यांचे जटिल विद्युत् भाररहित समुच्चय म्हणजेच जटिल रेणू तयार होतात परंतु हेच समुच्चय विद्युत् भारित असल्यास जटिल आयन निर्माण होतात परंतु हेच समुच्चय विद्युत् भारित असल्यास जटिल आयन निर्माण होतात. बहु-आणवीय रेणूंची संरचना सहसंबद्ध बहुपृष्ठकांच्या तत्वावर आधारलेली आहे. अनेक अणूंनी बनलेल्या साध्या समुच्चयामध्ये संयुक्त अणू अत्यंत सममितीय अशा बहुपृष्ठकांच्या स्वरूपात एकत्र आलेले आसतात. यांपैकी चतुःपृष्ठक, त्रिकोणीय द्विप्रसूची, अष्टपृष्ठक, पंचकोणीय द्विप्रसूची व धन (षट्पृष्ठक) हे महत्त्वाचे बहुपृष्ठक होत.
ज्या संयुगांच्या संरचनेमध्ये मध्यवर्ती अणू किंवा आयन असून तो आयनसमूहांनी किंवा रेणूसमूहांनी वेढलेला असतो, अशा संयुगांना साधारणपणे सहसंबद्ध संयुगे म्हणतात. अणूस जोडलेल्या समूहांना बंधक म्हणतात आणि बंधकांच्या संख्येला सहसंबद्धांक म्हणतात. सहसंबद्ध बहुपृष्ठकांचे गुणधर्म त्यांतील मध्यवर्ती अणूवर व त्यांच्या सहसंबद्धांकावर अवलंबून असतात. सर्वसाधारणपणे असे दिसून येते की, साध्या सहसंबंध बहुपृष्ठकांच्या बाबतीत सहसंबद्धांक म्हणजे बहुपृष्ठकाच्या शिरोबिंदूची संख्या होय, म्हणजेच ४ सहसंबद्धांक असलेले रेणू किंवा आयन चतुःपृष्ठकाच्या स्वरूपात आढळतील.
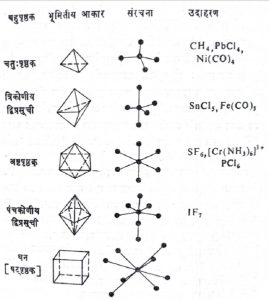
आ. ३ मध्ये सहसंबद्ध बहुपृष्ठकांचे भूमीतीय आकार, त्यांची संरचना व उदाहरणे दाखविली आहेत.
कमी सहसंबद्धांक असणारे रेणू बहुतेक बहुपृष्ठकांच्या ऐवजी एकाच पातळीतील असतात. ४ सहसंबद्धांक असणारे रेणू चतुःपृष्ठकीय किंवा
चौरस समतल संरचनेचे आढळतात. त्याचप्रमाणे सहसंबद्धांक ५, ६, ७, ८ यांच्या बाबतीतही दुसऱ्या संरचना आढळण्याची शक्यता असते. त्या अनुक्रमे त्रिकोणीय द्विप्रसूची, त्रिभुजीय लोलक, अनियमित रचना वगैरे परंतु या संरचना क्वचितच आढळतात.
जेव्हा रेणूंची किंवा जटिल आयनांची स्थिती बदलते, म्हणजेच ते विद्रावकात (विरघळविणाऱ्या पदार्थात) विरघळतात किंवा विद्रावकातून त्यांचे स्फटिकीकरण केले जाते किंवा त्यांवर रासायनिक विक्रिया होते तेव्हाही त्यांच्यातील अणूंची बहुपृष्ठकीय संरचना बदलत नाही. यावरून सहसंयुजी बंध हे एकाच पातळीत नसून अवकाशात निरनिराळ्या दिशांकडे गेलेले असतात, असा दृष्टिकोन ठेवणे जरूरीचे असते.
विद्युत् स्थितिकीय प्रतिरूप : एखाद्या संयुगाचे संघटन माहीत असल्यास विद्युत् स्थितिकीय प्रतिरूप सिद्धांतावरून त्यांतील अणूंची भूमितीय संरचना ठरविणे शक्य असते. ह्या सिद्धांतानुसार मध्यवर्ती अणू ऋणायन समजला जातो. त्यावरील धन-विद्युत् भार त्याच्या ऑक्सिडीकरण अवस्थेवर [⟶ ऑक्सिडीभवन] अवलंबून असतो. मध्यवर्ती अणूला जोडलेले बंधक धनायन किंवा उदासीन द्विध्रुवीय रेणू समजले जातात. मध्यवर्ती आयन व एकूण विद्युत् भार वेगळे असणाऱ्या रेणूंच्या किंवा आयनांच्या अशा बऱ्याच श्रेणी आहेत की, ज्यांचे संघटन सारखेच असते. उदा., (१) NO3−, CO32−, BO33−, CIO3−, SO32−, PO33− (२) AIF63−, SiF62−, PF6−, SF6−. या श्रेणीमध्ये दिसून येते की, प्रत्येक श्रेणीतील घटकांमध्ये अणुकेंद्राची व इलेक्ट्रॉनांची संख्या सारखीच आहे. अशा श्रेणींना समइलेकट्रॉनीय श्रेणी म्हणतात. अशा श्रेणीमधील घटकांची भूमितीय संरचनाही सारखीच असल्याने त्या समसंरचनात्मकही असतात. प्रत्यक्षात तसे सुटे आयन असतात व ते एकत्र येऊन अशा संरचना बनातात, असे मानन्याचे कारण नाही. कल्पित विद्युत् भार ऑक्सिडीकरण अवस्था दर्शवितात.
कोष्टक क्र. ३. आयन (समुच्चय) असलेले काही जटिल आयन व संयुगे.
जटिल आयन किंवा रेणू
| जटिल आयन किंवा रेणू | घटक आयन (औपचारिक प्रतिरूपन) | जटिल आयन किंवा रेणू | घटक आयन (औपचारिक प्रतिरूपन) |
| NO2– | N3+, 2O2– | SiF4 | Si4+, 4F– |
| NO3– | N5+, 3O2– | PF5 | P5+, 5F– |
| CO32– | C4+, 3O2– | SF6 | S6+, 6F– |
| BO33– | B3+, 3O2– | AlCl3 | Al3+, 3Cl– |
| ClO– | Cl+, O2– | BF4– | B3+, 4F– |
| ClO2– | Cl3+, 2O2– | BrF6– | Br5+, 6F– |
| ClO4– | Cl7+, 4O2– | PF6– | P5+, 6F– |
| SO42– | S6+, 4O2– | AlF63– | Al3+, 6F– |
| PO43– | P5+, 3O2– | CuCl42– | Cu2+, 4Cl– |
| SiO44– | Si4+, 4O2– | FeF63– | Fe3+ 6F– |
कोष्टक क्र. ३ वरून असेही दिसून येते की, आवर्त सारणीतील उभ्या गटातील सारख्याच विद्युत् भाराच्या आयनांचा सहसंबद्धांक निरनिराळा असतो. उदा., Al3+ व B3+ पासून अनुक्रमे AlCL3 व BF4 – मिळतात. काही रेणूंमध्ये त्यांचा सहसंबद्धांक वाढून ऋणभारित हॅलोजनयुक्त जटिले मिळतात. उदा., SiF4 पासून SiF62- हा धनायन मिळतो परंतु CF4 चा सहसंबद्धांक वाढत नाही (आणि त्याचा जटिल आयन बनत नाही).
आयन त्रिज्यांची गुणोत्तरे : MAn या सहसंबद्ध बहुपृष्ठकाची स्थिरता M या मध्यवर्ती अणूशी A या घनायनांचा संपर्क असतो वा नाही यावर अवलंबून असते. M व A यांचा एकमेकांशी संपर्क असल्यास MAn हा बहुपृष्ठक स्थिर असतो. मध्यवर्ती ऋणायनाची त्रिज्या rM व घनायनाची त्रिज्या rA असेल, तर त्यांच्या सीमांत गुणोत्तरावरून त्यांचा संपर्क असतो वा नसतो, हे कळू शकते. rM/rA हे गुणोत्तर ०.१५५ पेक्षा जास्त असते, तेव्हा बहुपृष्ठक स्थिर असतो. एवढेच नव्हे, तर त्या संरचनेचे स्थैर्य कायम ठेवून तिसरा गट जोडता येतो. सरळ रेषेत असलेल्या संरचनेच्या बाबतीत rM/rA हे गुणोत्तर कितीही असले, तरी स्थैर्याच्या या साध्या अटिची पूर्तता होते. कोष्टक क्र. ४ मध्ये सहसंबद्ध बहुपृष्ठकांची त्रिज्या गुणोत्तरे दिली आहेत.
कोष्टक क्र. ४. सहसंबद्ध बहुपृष्ठकांची त्रिज्या गुणोत्तरे
| सहसंबध्दांक | भूमितीय संरचना | त्रिज्या गुणोत्तरे
rM /rA |
| ३ | त्रिकोणीय समतल | ०.१५५ |
| ४ | चतुःपृष्ठक | ०.२५५ |
| ६ | अष्टपृष्ठक | ०.४१४ |
| ८ | घन (षट्पृष्ठक) | ०.७३२ |
कोष्टक क्र. ४ मध्ये विशिष्ट गुणोत्तराला दाखविलेल्या संरचनेशिवाय इतरही संरचना आढळू शकतात. ज्या रेणूंचे मध्यवर्ती आयन किंवा अणू अक्रिय वायू प्रकारातील किंवा आभासी अक्रिय वायू प्रकारातील असतात, त्यांच्या संरचना वरील तत्त्वानुसार आढळून येतात. जेव्हा रेणूंच्या मध्यवर्ती आयनांमध्ये असहभागी इलेक्ट्रॉन जोडी किंवा थोड्या असतात तेव्हा अशा इलेक्ट्रॉन जोड्या व मध्यवर्ती आयनास जोडलेले गट यांच्यावरून त्या रेणूची संरचना ठरविता येते. कारण एका गटामुळे अवकाशात जेवढी जागा व्यापली जाते तेवढीच जागा इलेक्ट्रॉनांच्या एका जोडीमुळे व्यापली जाते, असे गृहित धरले आहे. कोष्टक क्र. ५ मध्ये सहसंबद्धांक २ ते ६ यांच्या बाबतीत कोणत्या संरचना आढळून येतात, हे दाखविले आहे.
कोष्टक क्र. ५. मध्यवर्ती आयनामध्ये असहभागी इलेक्ट्रॉन जोड्या असलेल्या रेणूंच्या किंवा आयनांच्या संरचना.
| एकूण बंधक संख्या व इलेक्ट्रॉन जोड्या | सहसंबद्ध बहुपृष्ठक | असहभागी इलेक्ट्रॉन जोड्यांची संख्या | बंधकांची भूमितीय संरचना | उदाहरणे |
| २ | सरळ रेषीय | ० | सरळ रेषीय | CO2, HgCl2. |
| ३ | त्रिकोणीय प्रतल |
० १ |
त्रिकोणीय प्रतल
कोनाकार |
SO32–, BCl3, NO3– .
SO2, NO2–, SnCl2. |
| ४ | चतुःपृष्ठक | ०
१ २ |
चतुःपृष्ठक
प्रसूचीय कोनाकार |
CH4, PCl4–.
NF3, PCl3. H2S, OF2. |
| ५ | त्रिकोणीय द्विप्रसूची | ०
१ २ ३ |
त्रिकोणीय द्विप्रसूची
अनियमित चतुःपृष्ठक T-आकार सरळ रेषीय |
PCl5, AsF5.
TeCl4, SeF4. ClF3, BrF3. ICl2– |
| ६ | अष्टपृष्ठक | ०
१ २ |
अष्टपृष्ठक
चतुष्कोनीय चौरस एक-प्रतलीय |
SF6, PF6–.
BrF5, IF5. ICl4–. |
वरील विवेचनावरून असे दिसून येते की, मूलद्रव्यांचा इलेक्ट्रॉन विन्यास आयनांचे आकारमान व वर दाखविलेला त्यांचा परस्परसंबंध एवढ्या माहितीवरून द्वि-अंगी (ज्यांचे रेणू दोन मूलद्रव्यांच्या अणूंपासून बनवलेले आहेत अशी ) संयुगे किंवा जटिल आयन यांतील मध्यवर्ती अणू व त्याला जोडलेले गट माहित असल्यास यांच्या भूमितीय संरचनेचा अंदाज करणे शक्य होते. द्वि-अंगी संयुगांमध्ये मुख्यत्वे द्वि-अंगी हॅलाइडे, ऑक्साइडे, जटिल ऑक्सिजनयुक्त धनायन, हॅलोजनयुक्त धनायन, हॅलाइडयुक्त रेणू जलयुक्त व अमोनियमयुक्त धातवीय आयन या सर्वांची संरचना ठरविण्यास वरील माहिती उपयोगी पडते.
विद्युत् स्थितिकीय संबंधावरून संयुगांच्या भौतिक गुणधर्मांचे स्पष्टीकरण देता येत नाही. तसेच रासायनिक संयुगामध्ये फार मोठा विद्युत्भाकर असणारे आयन सहसा आढळत नाहीत. या प्रश्नांची उत्तरे शोधण्यासाठी मध्यवर्ती अणू व त्यांना जोडलेले बंधक यांतील रासायनिक बंध कोणत्या प्रकारचे अलतात, हे पाहणे आवश्यक आहे. संयोजकतेच्या ⇨पुंजयामिकी सिद्धांतावरून रासायनिक बंधाची अधिक स्पष्ट कल्पना येते. यासाठी संयुजा बंध सिद्धांताचा विचार येथे केला पाहिजे.
संयुजा बंध सिद्धांत : रेणूतील दोन अणू जेव्हा एकबंधाने एकत्र येतात तेव्हा त्या एकबंधातील इलेक्ट्रॉन जोडीवर दोन्ही अणूंचा ताबा असणे, हा या सिद्धांताचा आधार होय. दोन अणूंना बांधणारी इलेक्ट्रॉन जोडी ते अणू सामाईक भागीदारीने स्वीकारतात. मात्र या दोन्ही अणूंमध्ये बंधक (बांधणाऱ्या) इलेक्ट्रॉन जोडीला सामावून घेणारे योग्य आणवीय परिकक्ष [→ पुंज रसायनशास्त्र] उपलब्ध असणे आवश्यक आहे. बांधल्या जाणाऱ्या अणूंचे परिकक्ष त्या अणूंतील मध्यभागात कमीअधिक अंशाने अध्योरोपित म्हणजे परस्परव्याप्त होतात आणि या भागात बंधक इलेक्ट्रॉन जोडी स्थान ग्रहण करून त्या अणूंस सहसंयुजी बंधाने बांधते. हा बंध स्थानीय बंध समजला जातो.
एक संयुजी इलेक्ट्रॉन असणाऱ्या. असंक्रमणी मूलद्रव्यांच्या अणूमध्ये s परिकक्षातील इलेक्ट्रॉनाचा सहसंयुजी बंधात उपयोग केला जातो. जेव्हा असहभागी इलेक्ट्रॉनांची जोडी ns या परिकक्षात असते तेव्हा मध्यवर्ती अणूवरील तीन np परिकक्षांच्या साहाय्याने तीन समतुल्य सहसंयुजी बंध तयार होणे शक्य असते. हे तीन p परिकक्ष अवकाशात परिकक्ष अ वकाशात तीन परस्पर काटकोन करणार्याय दिशांत स्थापन झालेले असल्याने तयार होणारे तीन बंध एकमेकांस काटकोनात असावयास हवेत. PH3 या संयुगाच्या रेणूत काहीशी अशी संरचना आढळून येते. दोन बंधांत काटकोन नसून थोडा वेगळा कोन असतो. याचे कारण असहभागी इलक्ट्रॉन जोडीकडून या बंधावर उत्पन्न झालेली प्रतिकर्षण प्रेरणा हे असते.
s व p किंवा s व d किंवा s, p व d या परिकक्षांच्या जागी नवीन परिकक्ष येऊ शकतात. या नवीन परिकक्षांना संकरित परिकक्ष म्हणतात. प्रत्येक परिकक्षात दोन इलेक्ट्रॉनांपेक्षा जास्त इलेक्ट्रॉन नसतात. P व d या परिकक्षांत अनुक्रमे तीन व पाच उपरिकक्ष असतात. D मध्ये Px ,Py, Pz हे उपपरिकक्ष एकमेकांशी काटकोनात असतात, d मध्ये पाच उपपरिकक्ष अवकाशात वेगवेगळे कोन करतात. प्रत्येक s, Px , Py, Pz इ. परिकक्षांत जेव्हा एकच इलेक्ट्रॉन असतो तेव्हा वा तो रिकामा असल्यास बंध बनविण्यास उपलब्ध असतो पण जर दोन इलेक्ट्रॉन असतील, तर परिकक्ष व्यापणाऱ्या या जोडीतील इलेक्ट्रॉनांचे परिवलनांक (परिवलन गतीमुळे प्राप्त होणारे अंगभूत कोनीय संवेग) परस्परविरूद्ध असल्याने बंध बनविण्यासाठी यांचा उपयोग होत नाही. सर्व अक्रिय वायूंच्या अणूंमध्ये असलेले सर्व इलेक्ट्रॉन युग्मित असल्याने त्यांचे अणू सामान्य परिस्थितीस रासायनिक विक्रियेत भाग घेत नाहीत पण या अणूंना ऊर्जा दिल्यावर बाह्यतम परिकक्षातील इलेक्ट्रॉन युग्मातील एक इलेक्ट्रॉन वरच्या परिकक्षात जातो किंवा त्या अणूचा आयन बनतो. याप्रामाणे अशा अवस्थेतच अक्रिय वायू रासायनिक विक्रियेत भाग घेऊन संयुगे निर्माण करू शकतात.
बेरिलियम (Be) हा चवथ्या अणुक्रमांकाचा धातू आवर्त सारणीतील दुसऱ्या गटात आहे. Be च्या अणूची संरचना 1s2 2s2 अशी असल्याने पहिल्या व दुसऱ्या कवचातील दोन्ही s
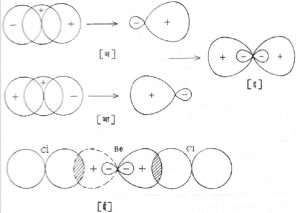
परिकक्ष युग्मित इलेक्ट्रॉनांनी भरलेले आहेत. 2 s मधील एक इलेक्ट्रॉन 2 p परिकक्षात गेल्याशिवाय बंध बनविण्यासाठी परिकक्ष उपलब्ध होणार नाही. 2 s चा एक इलेक्ट्रॉन 2 p परिकक्षात गेला, तर एक बंध s परिकक्षापासून व दुसरा p परिकक्षापासून तयार होईल. s परिकक्ष कोणत्याच निश्चित दिशेत नसल्याने म्हणजेच त्याच्यात गोलीय सममिती असल्याने या बंधाला कोणतीच निश्चित दिशा नसते परंतु p परिकक्ष अवकाशात एकमेकांशी काटकोनात असल्याने या परिकक्षातून निर्माण झालेला बंध अवकासात एका विशिष्ट दिशेने जाणारा असेल म्हणजेच Be चे दोन बंध दोन वेगवेगळ्या प्रकारचे असतील. BeCl2 या संयुगातील दोन्ही बंध एकाच स्वरूपाचे आणि समतुल्य असल्याचे तसेच त्यांच्यात १८०० चा कोन असल्याचे सिद्ध झाले आहे. या गुणधर्माचे स्पष्टीकरण संकरित परिकक्षाच्या कल्पनेमुळे देता येते. s व p या दोन परिकक्षांपासून sp हे दोन नवे संकरित परिकक्ष निर्माण होतात व ते बंधनिर्मितीसाठी उपलब्ध असल्याने दोन sp संकरित बंध बनतात.
आ. ४ वरून हे स्पष्ट होईल. Be चे दोन sp संकरित परिकक्ष क्लोरिनाच्या 3px उपपरिकक्षावर अध्यारोपित होऊन निर्माण झालेले दोन्ही Be- Cl बंध क्ष अक्षावरच असतात व अशा रीतीने Cl−Be−Cl रेणूतील Cl−Be−Cl हा कोन १८०० अंशाचाच असतो. संकरित परिकक्षांची व्याप्ती किंवा अध्यारोपण अधिक प्रमाणात होत असल्याने त्यांपासून निर्माण झालेले बंध अधिक स्थायी असतात. कार्बन अणूचा इलेक्ट्रॉन विन्यास 1s2 2s2 2p2 असा असा आहे. यांतील 2s परिकक्षातील एक इलेक्ट्रॉन 2p मध्ये गेल्यावर 1s2 2s1 2p3 असे त्याचे स्वरूप होते. या 2s1 आणि 2p3 परिकक्षांपासून Sp3 असे चार संकरित परिकक्ष निर्माण होतात. त्यांच्या दिशा चतुःपृष्ठकाच्या चार शिरोबिंदूंकडे असतात. जे. ए. ल. बेल व जे. एच् व्हांट-हॉफ यांनी कल्पना केल्या प्रमाणे कार्बनाची संयुजा चार असून त्याचे चतुःपृष्ठकीय स्वरूप अशा प्रकारे स्पष्ट होते.
संकरित परिकक्षाच्या निर्मितीत d उपपरिकक्षांचाही वाटा असू शकतो. सकरित परिकक्षामुळे उत्पन्न झालेले बंध सरळ रेषेत असतील किंवा एकप्रतलीय अथवा अवकाशात असतील हे संकरणाच्या वेळी भाग घेणाऱ्या p किंवा d परिकक्षांच्या संख्येवर अवलंबून असते. s व p यांच्या संकरित परिकक्षांच्या उदाहरणाने हे अधिक स्पष्ट होईल. एकच s व p एकच परिकक्षापासून फक्त दोन (sp संकरित) रेषीय बंधच उत्पन्न होऊ शकतात. एक s व दोन p या परिकक्षांपासून झालेले तीन sp2 संकरित परिकक्ष एकाच प्रतलात असतात. मात्र s व 3p यांपासून झालेले चार sp3 संकरित परिकक्ष अवकाशात चतुःपृष्ठकाच्या शिरोबिंदूकडे जाणारे बंध बनवितात. कोष्टक क्र. ६ मध्ये अणूंचे काही महत्त्वाचे संकरित परिकक्ष व त्यांच्या भूमितीय संरचना दिलेल्या आहेत.
कोष्टक क्र. ६. अणूंचे काही महत्त्वाचे परिकक्ष व त्यांच्या भूमितीय संरचना
| सहसंबद्धांक | परिकक्ष | भूमितीय संरचना | उदाहरणे |
| २ | sp | सरळ रेषा | HC º CH, BeCl2 |
| ३ | sp2 | त्रिकोणीय एकप्रतलीय | H2C = CH2, BCl3 |
| ४ | sp 3 | चतुःपृष्ठक | CH4 |
| ४ | d 3s | चतुःपृष्ठक | VO43– |
| ४ | dsp2 | चौरस एकप्रतलीय | PtCl42– |
| ५ | dsp3 | त्रिकोणीयद्विप्रसूचीय | Fe (CO)5 |
| ६ | d2sp3 | अष्टपृष्ठक | Cr(NH3)63+ |
अनुस्पंदन : अनुस्पंदन हा सिद्धांत रेणूची संरचना समजून घेण्यासाठी तसेच संयुगाच्या भौतिक व रासायनिक गुणधर्मांवरून त्याची संरचना ठरविण्यासाठी उपयोगी पडतो. बेंझीन
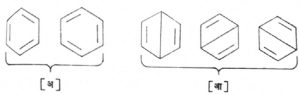
किंवा अन्य ॲरोमॅटिक संयुगांचे रेणू, संयुग्मित एकांतरित (एकाआड एक) द्विबंध असणारे रेणू, हायड्रोकार्बनाची मुक्त मूलके [⟶ मूलके] किंवा ज्यांची संरचना एकबंध, द्विबंध किंवा त्रिबंध यांच्या साहाय्याने ठरविता येत नाही अशा रेणूंची संरचना ठरविताना अनुस्पंदन सिद्धांताचा महत्त्वाचा उपयोग झाला आहे. बेंझिनाचा रेणू अनुस्पंदन सिद्धांताचा महत्त्वाचा उपयोग झाला आहे. बेंझिनाचा रेणू अनुस्पंदन सिद्धांत समजून घेण्यासाठी सर्वात उत्तम उदाहरण होय. अनुस्पंदनामुळे बेंझिनाचे स्थायीत्व, त्याची एकप्रतलीय संरचना व कार्बन-कार्बन (C–C) बंधाची लांबी यांचे स्पष्टीकरण प्राप्त होते.
बेंझिनाचा रेणू आ. ५ मध्ये दाखविल्याप्रमाणे एस्. एफ्. ए. फोन केकूले यांच्या दोन आणि जेम्स देवार (ड्यूअर) यांच्या तीन संरचनांद्वारे दाखविला जाऊ शकतो परंतु या कोणत्याही संरचनेच्या आधारे बेंझिनाचे गुणधर्म प्रकट होत नाहीत. बेंझिनाचा रेणू या सर्व संरचनांच्या समन्वयाने निर्माण झालेला एक
वेगळाच रेणू असतो पण त्याची संरचना कोणत्याही एका आकृतीने दाखविता येत नाही. आ. ५ मध्ये दाखविलेल्या कोणत्याही संरचनेचा रेणू अस्तित्वातच नसतो. बेंझिनाचे गुणधर्म पाहिल्यास असे दिसून येते की, त्याचा रेणू
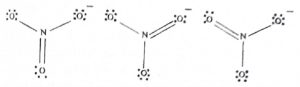
एकप्रतलीय असून C–C बंधाची लांबी १·३९ Å[१ Å (अँगस्ट्रॉम) = १०−१० मी.] असते म्हणजे हा बंध द्विबंध किंवा एकबंध नसून त्यांच्यापेक्षा एक वेगळाच बंध असतो. द्विबंधाची लांबी १·५४ Å असून एकबंधाची लांबी १·३२ Å आहे. अनुस्पंदनामुळे उत्पन्न झालेली संकरित संरचना सर्व संभाव्य रेणूंच्या एक दुसऱ्या अती जलद परिवर्तन झाल्याने निर्माण होते, असा समज आहे परंतु प्रत्यक्षात संभाव्य संरचनेचा एकही रेणू उत्पन्न झालेला नसतो म्हणजेच अशा रेणूची संरचना अनुस्पंदनरूप संकर असते. अनुस्पंदनामुळे रेणूत स्थैर्य येते, कारण अशा रेणूची ऊर्जा कोणत्याही एका संरचनेपासून अपेक्षिलेल्या ऊर्जेपेक्षा कमी असते. आ. ६ मध्ये दर्शविलेल्या उदाहरणावरून हे अधिक स्पष्ट होईल. नायट्रेट आयनात (NO3–) एकबंध व द्विबंध अशी संरचना असल्याचे दाखविले जाते परंतु N−O हे अंतर ठराविक असल्याचे दिसून येते म्हणजेच नायट्रेट आयनातील नायट्रोजन व ऑक्सिजन यांमधील बंध एकबंध व द्विबंध यांचा संकर असतो. [⟶ पुंज रसायनशास्त्र].
संकलित बहुपृष्ठकीय संरचना : आतापावेतो बहुआणवीय रेणू व आयन यांच्यासंबंधी केलेल्या विवरणात ज्यांच्या भूमितीय संरचनांचा खुलासा एकाच सहसंबद्ध बहुपृष्ठकाद्वारे करता येतो अशा जातींचाच विचार केलेला आहे. रासायनिक संयुगांच्या संरचनांच्या प्रश्नांत या जातींच्या संरचना समजून घेणे ही गोष्ट मध्यवर्ती असली, तरी सर्व किंवा बहुतांश ज्ञात रासायनिक संयुगांच्या संरचनांचे वर्णन करण्यासाठी हा आधार पुरेसा नाही. या संकल्पनांद्वारे ज्यांच्या संरचनांचा खुलासा होऊ शकत नाही अशा अधिकांश संरचनांत दोन वा अधिक सहसंबद्ध बहुपृष्ठके एकत्रित होऊन तयार होणाऱ्या अधिक जटिल समग्र संरचनांचा समावेश होतो. अशा संकलित बहुपृष्ठकांचा अंतर्भाव असलेल्या संयुगांची संख्या मोठी असून त्यांचा विचार स्वाभाविकपणेच ⇨घन अवस्था रसायनशास्त्रात करण्यात यतो. कार्बनी रसायनशास्त्रात आढळणाऱ्या संयुगांच्या सजातीय श्रेण्या ही प्रत्येक घटकात तेच मध्यवर्ती मूलद्रव्य असलेल्या संकलित बहुपृष्ठकांची चांगली उदाहरणे आहेत.
सजातीय श्रेणी : निरनिराळ्या ⇨पॅराफिनांची सूत्रे तपासली, तर असे दिसून येते की, प्रत्येक पॅराफीन व श्रेणीतील त्यांचा लगतचा शेजारी यांत एका CH2 गटाचा फरक आहे. ज्या श्रेणीतील घटक एका CH2 गटाने शेजारील घटकापेक्षा लहान किंवा मोठा असतो अशा श्रेणीस सजातीय श्रेणी म्हणतात. पॅराफीन श्रेणीतील काही घटक व त्यांचे गुणधर्म कोष्टक क्र. ७ मध्ये दिले आहेत. सजातीयत्वाच्या सिद्धांताचा उपयोग करून श्रेणीतील अपरिचित घटकाच्या गुणधर्मांचे अनुमान काढता येते. CnH2n+2 या सर्वसामान्य सूत्रावरून या श्रेणीतील कोणत्याही घटकांचे सूत्र काढता येते.
प्रत्येक कार्यकारी समूहात सजातीय श्रेणी आढळून येते. प्राथमिक अमाइने (CnH2n+1 NH2), अल्कोहॉले (Cn H2n+1 OH ), कार्बॉक्सिलिक अम्ले ( CnH2n+1 COOH), अमाइडे ( CnH2n+1 CONH2) वगैरे सजातीय श्रेण्यांची उदाहरणे आहेत.
समघटकता : बऱ्याच वेळा असे आढळून येते की, दोन किंवा अधिक रासायनिक संयुगांत मूलघटकांची संख्या सारखीच असून त्यांचा रेणूभार सारखाच असतो परंतु त्यांचे भौतिक किंवा रासायनिक गुणधर्म भिन्न असतात. हा प्रकार कार्बनी संयुगांत जास्त प्रामुख्याने आढळून येतो. सजातीय श्रेणीतील संयुगांत कार्बन अणूंची संख्या जसजशी वाढते तसतशी एकाच रेणूभाराच्या
कोष्टक क्र. ७. पॅराफिनांची सजातीय श्रेणी
| कार्बन संख्या | नाव | उकळबिंदू (० से.) | वितळबिंदू (० से.) | घनता (द्रवरूप स्थितीत ग्रॅ./सेंमी.३ २०० से.ला) | प्रणमनांक (सोडीयम रेषेला २०० से. ला) |
| १ | मिथेन | –१६१·५ | –१८३·० | ०·४२४ | – |
| २ | एथेन | –८८·६ | –१७२·० | ०·५४६ | – |
| ३ | प्रोपेन | –४२·१ | –१८८·० | ०·५०१ | – |
| ४ | ब्युटेन | –०·५ | –१३५·० | ०·५७९ | १·३३२६ |
| ५ | पेंटेन | ३६·१ | –१३०·० | ०·६२६ | १·३५७५ |
| ६ | हेक्झेन | ६८·७ | –९५·० | ०·६५९ | १·३७४९ |
| ७ | हेप्टेन | ९८·४ | –९१·० | ०·६८४ | १·३८७६ |
| ८ | ऑक्टेन | १२५·७ | –५७·० | ०·७०३ | १·३९७४ |
| ९ | नोनेन | १५०·८ | –५४·० | ०·७१८ | १·४०५४ |
| १० | डेकेन | १७४·१ | –३०·० | ०·७३० | १·४११९ |
रेणूसूत्राच्या समघटकांची संख्या वाढत जाते. समघटकता दोन प्रकारची असते : (१) संरचनात्मक व (२) त्रिमितीय. संरचनात्मक समघटकतेत दोन किंवा अधिक संयुगांत एकच संघटन
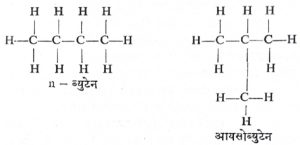
असते; परंतु घटकांची रचना वेगळी असते. उदा., n – ब्युटेन व आयसोब्युटेन या संयुगांची संरचनात्मक समघटकता (आ. ७).
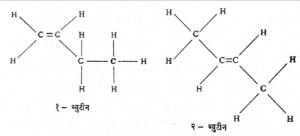
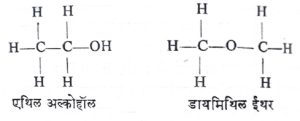
संरचनात्मक समघटकतेच्या स्थान समघटकता व कार्यकारी (वा क्रियाशील) गट समघटकता या उपप्रकारांची उदाहरणे आ. ८, ९ व १० यांत दिलेली आहेत.
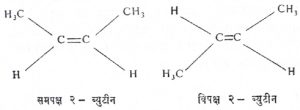
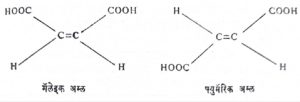
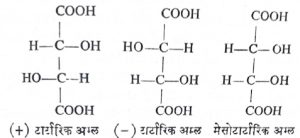
त्रिमितीय समघटकतेत दोन किंवा अधिक संयुगांत एकच कार्बन सांगाडा व तेच कार्यकारी गट असतातच; परंतु अवकाशातील त्यांची त्रिमितीय संरचना निरनिराळी असते. यात भूमितीय आणि प्रकाशीय समघटकता असे दोन उपप्रकार आढळतात. यांची उदाहरणे आ. ११, १२ व १३ यांत दिलेली आहेत.
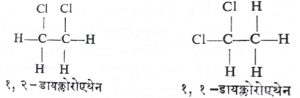
चलसमघटकता या प्रकारात संयुगांच्या दोन रूपांमध्ये समतोल असतो. ॲसिटोॲसिटिक एस्टराची दोन रूपे आ. १४ मध्ये दिलेल्या सूत्रांनी दाखविता येतात.
अकार्बनी सहसंबद्ध संयुगात जेव्हा दोन किंवा अधिक प्रकारचे गट जोडलेले असतात तेव्हा समघटकता दिसून येते.
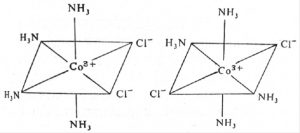
डायक्लोरोटेट्राअमाइन कोबाल्ट (।।।) ची दोन रूपे आढळतात. (आ. १५).
भाकित केलेल्या समघटकेतेचे अस्तित्व हा रासायनिक संरचनांसंबंधीच्या सिद्धांतांना एक महत्त्वाचा दृढ आधार ठरलेला आहे. भाकित केलेल्या कित्येक समघटकता प्रकारांच्या शोधामुळे रासायनिक संरचनांच्या बहुपृष्ठकीय दृष्टिकोनाचा पूर्णपणे पडताळा
मिळालेला आहे. संपृक्त (ज्यांतील सर्व बंध जोडले गेलेले आहेत म्हणजे ज्यात द्विबंध अथवा त्रिबंध नाहीत अशा) कार्बन अणूंच्या चतुःपृष्ठकीय संरचनेचा पहिला खरा खात्रीलायक पुरावा प्रकाशीय समघटकतेद्वारे मिळालेला आहे. समघटकतेच्या वरील विविध प्रकारांसंबंधीचे विस्तारपूर्वक विवरण ‘समघटकता’ या नोंदीत दिलेले आहे.
शृंखलीकरण : काही मूलद्रव्यांचे अणू एकमेकांस जोडले जाऊन त्यांच्या शृंखला किंवा वलये तयार होतात. या गुणधर्मास
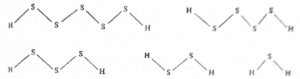
शृंखलीकरण म्हणतात. कार्बनामध्ये हा गुणधर्म प्रकर्षाने आढळून येतो, किंबहुना यामुळेच कार्बनी रसायनशास्त्र ही वेगळी शाखा निर्माण झाली. इतर मूलद्रव्यांतही ही गुणधर्म कमी प्रमाणात आढळून येतो. गंधकामध्ये HS(n)H ही सल्फेन संयुगे तयार होतात. सहा गंधक अणू असलेली संयुगे माहीत आहेत.
फॉस्फरस व सिलिकॉन या मूलद्रव्यांतही शृंखलीकरणाचा गुणधर्म आढळून येतो.
इलेक्ट्रॉन–न्यून संरचना : बहुतेक सर्व रेणूंमध्ये किंवा जटिल स्वरूपाच्या आयनांमध्ये असे दिसून येते की, त्यांतील जोडलेल्या
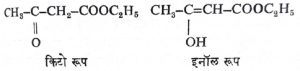
प्रत्येक दोन अणूंमध्ये सहसंयुजी बंधास आवश्यक असणारी इलेक्ट्रॉन जोडी उपलब्ध असते परंतु काही संरचना असाही आहेत की, त्यांतील प्रत्येक दोन अणूंना बांधणाऱ्या सहसंयुजी बंधांना आवश्यक असणाऱ्या इलेक्ट्रॉनांपेक्षा कमी इलेक्ट्रॉन उपलब्ध असतात. अशा संयुगांना इलेक्ट्रॉन-न्यून संयुगे म्हणतात. बोरॉन व हायड्रोजन यांच्यापासून मिळणारी बोरेन नामक संयुगे या वर्गात मोडतात. डाय बोरेन (B2H6)
हा रेणू बनताना प्रत्येकी तीन असे दोन बोरॉन अणूंचे सहा व प्रत्येक हायड्रोजनाचा एक असे सहा म्हणजे एकूण १२ इलेक्ट्रॉन सात सहसंयुजी बंधांसाठी उपलब्ध असतात. या सात बंधांसाठी १४ इलेक्ट्रॉनांची आवश्यकता आहे. यासाठी B2H6 हा C2H6 पेक्षा भिन्न असला पाहिजे. म्हणून चार B–H हे एका पातळीतील बंध सामान्य सहसंयुजी बंध मानले असून त्या प्रत्येकात बोरॉनापासून एक व हायड्रोजनापासून एक इलेक्ट्रॉन मिळवून अशी इलेक्ट्रॉन जोडी हे बंध बनविते, असे मानले आहे. त्याचप्रमाणे ![]() असे दोन गट उपलब्ध होतील आणि त्यांतील बोरॉन अणूवर अजून एक इलेक्ट्रॉन उपलब्ध असेल. आता उरलेले दोन हायड्रोजन अणू दोन बोरॉन अणूंबरोबर दोन सेतु-बंध तयार करतात. दोन B आणि दोन H यांचे एकंदर चार इलेक्ट्रॉन उपलब्ध असून त्यांच्या दोन जोड्या करून प्रत्येक इलेक्ट्रॉन जोडी B – – H – – B अशा तीन अणुकेंद्रांना बद्ध करते.
असे दोन गट उपलब्ध होतील आणि त्यांतील बोरॉन अणूवर अजून एक इलेक्ट्रॉन उपलब्ध असेल. आता उरलेले दोन हायड्रोजन अणू दोन बोरॉन अणूंबरोबर दोन सेतु-बंध तयार करतात. दोन B आणि दोन H यांचे एकंदर चार इलेक्ट्रॉन उपलब्ध असून त्यांच्या दोन जोड्या करून प्रत्येक इलेक्ट्रॉन जोडी B – – H – – B अशा तीन अणुकेंद्रांना बद्ध करते.
याला त्रिकेंद्री इलेक्ट्रॉन बंध म्हणतात. मध्यवर्ती असलेले हायड्रोजन अणू दोन बोरॉन अणूंना अशा त्रिकेंद्री बंधीने जोडलेले असतात. हे सेतु-बंध होत.
डायबोरेनाचे दोन हायड्रोजन अणू त्यातील चार हायड्रोजन अणूंपेक्षा भिन्न गुणधर्मांचे आहेत. बोरेन वा अल्फेन यांच्या क्ष-किरण
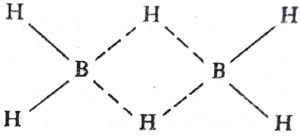
अभ्यासावरून त्यांच्या संरचना मूलतः भिन्न आहेत असे दिसून येते. या दोन्ही गोष्टींचे समर्थन अशी संरचना करू शकते. अशा बहुकेंद्री बंधांच्या सहाय्याने इलेक्ट्रॉन-असंपृक्त संयुगांच्या संरचना सुलभपणे स्पष्ट करता येतात. आ. १७ मध्ये डायबोरेनाची सेतु-बंध संरचना दाखविली आहे.
यापेक्षा जास्त समर्पक संरचना रणवीय परिकक्ष बंध सिद्धांताने मिळविता येतात.
पाहा : त्रिमीतीय रसायनशास्त्र; पुंज रसायनशास्त्र; संयुजा.
संदर्भ :
- Cartmell, E.; Fowles, G. W. A., Valency and Molecular Structures, Borough Green (U. K.), 1977.
- Cotton, F. A.; Wilkinson, G., Advanced Inorganic Chemistry, New York, 1972.
- Ferguson, L. N., The Modern Structural Theory of Organic Chemistry, New Delhi, 1963.
- Pauling, L., The Nature of Chemical Bond, New Delhi, 1967.
- Syrkin, Y. K.; Dyatkin, M. E.; Trans. Partridge, M. A.; Jordan, D. O., Structures of Molecules and the Chemical Bond, New York, 1964.
लेखक : पटवर्धन, सरिता अ.; करबेलकर, ना. वि.; वैद्य, वि. गो.