थोरियम : आवर्त सारणीतील [मूलद्रव्यांच्या कोष्टकरूपाने केलेल्या विशिष्ट मांडणीतील ⟶ आवर्त सारणी] ३ ब गटातील व ॲक्टिनाइड श्रेणीतील (क्र. ८९ ते १०३ या मूलद्रव्यांच्या श्रेणीतील) एक किरणोत्सर्गी (भेदक कण किंवा किरण बाहेर टाकण्याचा गुणधर्म असणारे) धातुरूप मूलद्रव्य. चिन्ह Th अणुक्रमांक (अणुकेंद्रातील प्रोटॉनांची संख्या) ९० अणुभार २३२·०३८ घनता ११·७२ ग्रॅ./घ. सेंमी. वितळबिंदू १,७५०° से. उकळबिंदू सु. ३,५००° से. किरणोत्सर्गी समस्थानिक (अणुक्रमांक तोच पण अणुभार भिन्न असलेले त्याच मूलद्रव्याचे प्रकार) २२७, २२८, २२९, २३०, २३१, २३२, २३४ यांपैकी २२९ अणुभाराचा समस्थानिक सोडून बाकीचे सर्व नैसर्गिक आहेत. संयुजा (अणूंची परस्परांशी संयोग पावण्याची क्षमता दर्शविणारा अंक) ४ विद्युत् विन्यास (इलेक्ट्रॉनांची अणूमधील मांडणी) २, ८, १८, ३२, १९, ९, २.
इतिहास : इ. स. १८१७ मध्ये गॅडोलिनाइटापासून आणि थोराइटापासून १८२८ मध्ये जे. जे. बर्झीलियस यांनी हे शोधून काढले. थोर या स्कँडिनेव्हियन युद्धदेवतेच्या नावावरून बर्झीलियस यांनी या मूलद्रव्याला थोरियम हे नाव दिले. त्यानंतर ५० वर्षांहून अधिक काळ हे मूलद्रव्य दुर्लक्षितच राहिले. १८८६ साली थोरियम ऑक्साइडाच्या प्रदीपन गुणधर्माचा शोध आउअर फोन वेल्सबाख यांनी लावला. मारी क्यूरी आणि जी. सी. श्मिट यांनी स्वतंत्र रीत्या थोरियमाच्या किरणोत्सर्गी गुणधर्माचा शोध लावला.
आढळ : युरेनियम व विरल मृत्तिका धातू यांच्याशी निगडित असलेल्या अनेक खनिजांत थोरियम आढळते. ⇨ थोरियानाइट (ThO2, थोरियम ऑक्साइड ८०%) व ⇨ थोराइट (ThO2, ६०%) या खनिजांत थोरियमाचे प्रमाण जास्त असले, तरी ही खनिजे विरळाच आढळतात. युरॅनोथोराइटातही थोरियम आढळते.
थोरियम व थोरियम ऑक्साइड ही मुख्यतः ⇨ मोनॅझाइट (विरल मृत्तिका धातूंचे फॉस्फेट) या खनिजापासून मिळविली जातात. मोनॅझाइट हे सिलिका व इतर खनिजांच्या जोडीने मोनॅझाइट वाळूमध्ये आढळते. या वाळूत थोरियम ऑक्साइडाचे प्रमाण २ ते १०·५% पर्यंत असते. कमी दर्जाच्या अशा वाळूचे शुद्धीकरण करून तीमधील थोरियम ऑक्साइडाचे प्रमाण ५ ते १०% पर्यंत करून घेण्यात येते. मोनॅझाइट वाळूचे मोठे साठे भारत आणि ब्राझीलमध्ये असून या दोन्ही देशांत तिच्यावर प्रक्रिया करण्याचे कामही चालते. यांशिवाय श्रीलंका, स्कँडिनेव्हिया, कॅनडा, मलेशिया, पूर्व व द. आफ्रिका, उरल पर्वत (रशिया), टास्मानिया (ऑस्ट्रेलिया), अमेरिका इ. प्रदेशांत मोनॅझाइट वाळूचे साठे आढळले आहेत. थोरियमाचा जागतिक साठा दहा लाख टनांपेक्षा जास्त असावा, असा अंदाज आहे.
भारतामध्ये केरळ व तमिळनाडूच्या किनारी भागांत मोनॅझाइट वाळूचे मोठे साठे आहेत. तसेच बिहारमध्येही मोनॅझाइटाचे प्लेसर निक्षेप (साठे) आढळले आहेत शिवाय ईशान्य भारतातही मोनॅझाइटाचे साठे असावेत, असे अलीकडच्या सर्वेक्षणावरून दिसून आले आहे. अशा प्रकारे भारतात थोरियमाचे ४ लाख टन साठे असावेत, असा अंदाज आहे. सामान्यतः या मोनॅझाइट वाळूमध्ये ८ ते १०·५% थोरियम ऑक्साइड असते काही प्रकारच्या मोनॅझाइटात हेच प्रमाण १९% पर्यंत असल्याचे, तर चेरालाइट या दुर्मिळ खनिजात हेच प्रमाण ३१–३३% पर्यंत असल्याचे आढळते. दुसऱ्या महायुद्धानंतर या वाळूच्या निर्यातीवर भारताने बंदी घातली आहे. १९५२ साली भारताने या वाळूवर प्रक्रिया करण्यासंबंधीचा करार दोन फ्रेंच कंपन्यांशी केला आहे व त्याद्वारे वर्षाला १,५०० टन संहत (थोरियम ऑक्साइडाचे प्रमाण वाढविलेले) मोनॅझाइट मिळविण्याची योजना आहे. यापासून थोरियम व विरल मृत्तिका धातूंची संयुगे बनविली जातात.
ब्राझीलमध्ये मोनॅझाइट वाळूचे १·५ लाख टनांचे साठे असून तिच्यात थोरियम ऑक्साइडाचे सरासरी प्रमाण ६% आहे. साऊँ पाउलू येथे १९४५ पासून मोनॅझाइट वाळूवर प्रक्रिया करण्याचे काम चालू आहे.
प्राप्ती : सिरियम व इतर विरल मृत्तिका यांची फॉस्फेटे, सिलिका, कॅल्शियम ऑक्साइड व आयर्न ऑक्साइड हे पदार्थ मोनॅझाइटातून वेगळे करून उरलेल्या भागातील थोरियम ऑक्साइड व इतर संयुगे मिळविण्यासाठी पुढील पद्धतींचा वापर करण्यात येतो.
(१) मोनॅझाइटाची बारीक केलेली पूड गरम व संहत (विद्रावातील प्रमाण जास्त असलेल्या) सल्फ्यूरिक अम्लात शिजवितात. यामुळे थोरियम व विरल मृत्तिका त्यात विरघळतात. हा विद्राव सौम्य केल्यास वा त्यात अमोनिया मिसळल्यास थोरियम फॉस्फेट वेगळे होते. यामुळे थोरियम ऑक्साइडाचे प्रमाण इतर विरल मृत्तिकांपेक्षा जास्त होते. फॉस्फरस व राहिलेली इतर विरल मृत्तिका मूलद्रव्ये पूर्णपणे काढून टाकण्यासाठी कार्बोनेट निष्कर्षण, सल्फेट विलगीकरण, ऑक्झॅलेट विलगीकरण इ. प्रक्रिया वापरल्या जातात व अवक्षेपणाने (न विरघळणारा साका बनवून) थोरियम ऑक्साइड मिळवितात. अवक्षेपणाची क्रिया जरी जटिल असली, तरी तिच्यामुळे ९९% पेक्षा शुद्धतेचे थोरियम ऑक्साइड मिळते. यात सिरियम, विरल मृत्तिकांची ऑक्साइडे, सिलिका, कॅल्शियम, मॅग्नेशियम इत्यादींची अशुद्धी ०·१ टक्क्याहून जास्त नसते.
(२) थोरियम धातुके (कच्च्या स्वरूपातील धातू), ऑक्साइड वा ऑक्झॅलेट यांची क्लोरिनाबरोबर विक्रिया करून थोरियम क्लोराइड (ThCI4) तयार करतात.
(३) विरल मृत्तिकांच्या नायट्रेटाच्या विद्रावात कॅल्शियम नायट्रेट व नायट्रिक अम्ल मिसळतात व त्यात ट्रायब्युटिल फॉस्फेटाचा विद्राव मिसळतात. हे दोन्ही विद्राव एका उभ्या स्तंभात एकमेकांच्या विरुद्ध दिशांनी सोडतात. त्यामुळे कार्बनी विद्रावात थोरियम नायट्रेट राहते. त्याचा पाण्याशी संपर्क येऊन तयार होणाऱ्या विद्रावाचे ऊर्ध्वपातन (विद्रावाची वाफ करून व ती थंड करून घटकद्रव्ये अलग करण्याची क्रिया) करून व जाळून थोरियम ऑक्साइड तयार होते. या पद्धतीने ९९·७% शुद्धतेचे ऑक्साइड तयार होते.
(४) थोरियम फ्ल्युओराइड (ThF4) वा ऑक्साइड व कॅल्शियम हे धातूच्या एका बंद भांड्यात (बाँबमध्ये) तापवितात. विक्रिया पूर्ण झाल्यावर सर्व पदार्थ बाहेर काढून त्यांची अम्लाशी विक्रिया करून थोरियमाचे चूर्ण मिळवितात. यात सुरुवातीलाच जस्त धातू मिसळल्यास थोरियमाचे चूर्ण होत नाही व जस्त–थोरियम मिश्रधातू मिळते. तिचे निर्वातात ऊर्ध्वपातन करून त्यातून जस्त वेगळे केल्यावर थोरियम धातू मिळते. निर्वातात तिचे ओतकाम करतात.
(५) थोरियम क्लोराइडासारख्या संयुगांचे विद्युत् विच्छेदन (विद्युत् प्रवाहाच्या साहाय्याने रेणूचे तुकडे करण्याची क्रिया) करून थोरियम धातू मिळवितात. कार्बनाच्या मुशीत वितळलेले थोरियम संयुग ठेवतात. तिच्यात मॉलिब्डेनम दंड ऋणाग्र म्हणून ठेवतात. मुशीतील पदार्थही ऋणाग्रासारखे काम करतो व मूस धनाग्राचे काम करते. मुशीतून ऋणाग्र बाहेर काढून त्यावर जमा झालेले थोरियमाचे चूर्ण व घन स्वरूपातील संयुग वेगळे करतात, दळतात आणि त्यातून अम्लाच्या साहाय्याने थोरियम वेगळे करतात.
उच्च शुद्धतेची थोरियम धातू पाहिजे असल्यास मुशीतून काढलेल्या ऋणाग्रावरील थोरियमाचे परत विद्युत् विच्छेदन करतात. या वेळी मुशीतील ऋणाग्रच ऋणाग्र म्हणून आणि शुद्ध थोरियम धातू धनाग्र म्हणून वापरतात. विद्युत् प्रवाह पाठविल्यास धनाग्रावर शुद्ध थोरियम धातू जमा होते.
थोरियम आयोडाइडाचे उष्णतेने अपघटन (घटक अलग करण्याची क्रिया) करून मिळणाऱ्या धातूचे शुद्धीकरण करून उच्च शुद्धतेची धातू मिळते.
चूर्णाचे ठोकळे बनविण्यासाठी ⇨ चूर्ण धातुविज्ञानातील पद्धतींचा उपयोग करतात.
गुणधर्म : थोरियमात कार्बनासारखी अशुद्धी अत्यल्प प्रमाणातही असल्यास त्याच्या गुणधर्मांत बदल होतो, असे आढळून आले आहे. संपुंजित (एकत्रित स्वरूपातील) स्थितीत या धातूचा रंग चांदीसारखा पांढरा असून हवेत उघडी राहिल्यास तो काळा अथवा करडा होतो. संपुंजित स्थितीत ही धातू हवेत स्थिर राहते, पण चूर्ण स्वरूपात ती ज्वालाग्राही होते. संपुंजित स्थितीत उच्च तापमानाचा तिच्यावर परिणाम होत नाही. उच्च तापमानाच्या वाफेचा तिच्यावर परिणाम होतो. पाणी, क्षार (अम्लांशी विक्रिया झाल्यास लवणे देणारे पदार्थ अल्कली) व ॲसिटिक अम्ल यांचा तिच्यावर परिणाम होत नाही. उकळत्या पाण्यामुळे तिचे ऑक्साइडात रूपांतर होते. ३००–४००° से. ला हायड्रोजन, ६५०° से. ला नायट्रोजन, ४५०° से. ला हॅलोजने आणि गंधक तसेच कार्बन आणि फॉस्फरस यांच्याशी ही धातू संयोग पावते. हायड्रोक्लोरिक अम्लाची तिच्यावर जलद विक्रिया होते. नायट्रिक अम्ल व धातू यांच्यातील विक्रिया सुरूवातीला जोरदार असते, पण नंतर ती होत नाही. विरल हायड्रोफ्ल्युओरिक, नायट्रिक व सल्फ्यूरिक आणि संहत परक्लोरिक व फॉस्फोरिक ह्या अम्लांमुळे या धातूवर मंद विक्रिया होऊन हायड्रोजन वायू तयार होतो. फ्ल्युओराइड व फ्ल्युओरोसिलिकेट यांच्या सान्निध्यात हायड्रोक्लोरिक व नायट्रिक अम्लांत ही धातू पूर्णपणे विरघळते. निकेल, चांदी, सोने, पारा, कॅल्शियम, तांबे, ॲल्युमिनियम इ. धातूंबरोबर थोरियमाच्या मिश्रधातू होतात.
-
|
समस्थानिक (अणुभार)
|
अर्धायुष्य
|
|
२२७
२२८
२२९
२३०
२३१
२३२
२३४
|
१८·२ दिवस
१·९० वर्षे
७,३४० वर्षे
८०,००० वर्षे
२६·६ तास
१·३९ X १०१० वर्षे
२४·१० दिवस
|
निसर्गात आढळणाऱ्या थोरियमाच्या किरणोत्सर्गी समस्थानिकांची अर्धायुष्ये (किरणोत्सर्गाची मूळ क्रियाशीलता निम्मी होण्यास लागणारे कालावधी) वरील कोष्टकात दाखविल्याप्रमाणे आहेत. यांपैकी थोरियम (२३२) हा समस्थानिक रासायनिक दृष्ट्या महत्त्वाचा आहे. युरेनियम (२३८) चा नैसर्गिक रीत्या क्षय होऊन थोरियम (२३०) हा समस्थानिक तयार होतो. युरेनियम–ऑक्टिनियम यांच्या नैसर्गिक समस्थानिकांचा नैसर्गिक रीत्या क्षय होऊन थोरियमाचे अल्पकाल टिकणारे समस्थानिक तयार होतात.
थोरियम (२३३) हा समस्थानिक थोरियम (२३२) मध्ये न्यूट्रॉन घुसवून तयार करतात. त्याचे अर्धायुष्य २३·३ मिनिटे आहे व त्याचे युरेनियम (२३३) मध्ये रूपांतर होते. नेपच्यूनियम धातूच्या क्षयातून थोरियम (२२९) हा समस्थानिक तयार होतो. त्याचे अर्धायुष्य जास्त असल्याने त्याच्या किरणोत्सर्गाचे उपकरणांद्वारे शोध घेऊन विविध प्रक्रियांच्या मार्गक्रमणाचा अभ्यास करण्यासाठी (मार्गणासाठी) त्याचा वापर करतात.
थोरियम धातूवर करण्यात येणारे यांत्रिक संस्कार ती थंड अवस्थेत असताना करतात. ही धातू मऊ व तन्य (तार काढता येण्यासारखी) आहे.
संयुगे : थोरिया (थोरियम ऑक्साइड, ThO2) हे सामान्यतः आढळणारे ऑक्साइड थोरियमाच्या नायट्रेट, हायड्रॉक्साइड, ऑक्झॅलेट इ. संयुगांच्या ऊष्मीय अपघटनाने तयार करतात. हे अति–उच्चतापसह (उच्च तापमानाला न वितळता टिकणारे) आहे. थोरियम पेरॉक्साइड (Th2O7·4H2O) आणि Th(OH)4 ही संयुगे थोरियमाच्या इतर संयुगांच्या विद्रावातून अवक्षेपणाने तयार करतात.
थोरियम नायट्रेट हे थोरियमाचे सर्वांत सामान्य संयुग असून त्याचे सूत्र Th(NO3)4·4H2O असे आहे. थोरियमाची सोडियम, पोटॅशियम इत्यादींबरोबर द्विनायट्रेटे तयार होतात.
हायड्रोजन वायूबरोबर थोरियमाची विक्रिया होऊन ThH2 व Th4H15 अशी हायड्राइडे तयार होतात. यांचा उपयोग थोरियम चूर्णाऐवजी काही ठिकाणी करतात, कारण त्यांच्यामुळे वातावरणीय ⇨ऑक्सिडीभवनास विरोध होतो.
थोरियमाची हॅलोजनांबरोबर विक्रिया होऊन ThX2, ThOX2 व Th(OH)2 X2 (X = क्लोरीन, ब्रोमीन, आयोडीन, फ्ल्युओरीन) अशी संयुगे होतात. थोरियम हॅलाइडांची क्षारीय धातूंच्या (सोडियम, पोटॅशियम इत्यादींच्या) हॅलाइडांबरोबर द्विलवणे (ठराविक प्रमाणात एकत्रितपणे स्फटिकीभूत होणाऱ्या, परंतु विद्रावात स्वतंत्रपणे अस्तित्वात असणाऱ्या दोन साध्या लवणांपासून बनणारी लवणे) तयार होतात.
निर्जल वा २, ४, ६, ८, ९ स्फटिकजलाचे रेणू असलेले थोरियम सल्फेट तयार करता येते. अमोनिया किंवा क्षारीय धातूंबरोबर त्याची द्विसल्फेटे तयार होतात. हायड्रोसल्फेट व थायोसल्फेट ही संयुगे पाण्यात विरघळत नाहीत.
यांशिवाय थोरियमाची आयोडेटे, कार्बोनेटे, फॉस्फेटे, क्रोमेटे इ. अकार्बनी संयुगे ज्ञात आहेत. बऱ्याच कार्बनी अम्लांबरोबर थोरियमाची विक्रिया होऊन त्यांची कार्बनी संयुगे तयार होतात. यांपैकी जलविद्राव्य थोरियम ऑक्झॅलेट [Th (C2O4)2·6H2O] हे संयुग थोरियमाची इतर संयुगे शुद्ध स्वरूपात तयार करण्याच्या दृष्टीने महत्त्वाचे आहे.
अभिज्ञान : (अस्तित्व ओळखणे). खडकांत व इतर नैसर्गिक स्वरूपात असणाऱ्या थोरियमाचे अभिज्ञान त्या त्या नमुन्याच्या किरणोत्सर्गावरून ओळखण्यात येते. सल्फ्यूरिक अम्लाच्या साहाय्याने नमुन्यातील थोरियम विद्रावात नेऊन ते इतर आयनांपासून (विद्युत् भारित अणू वा अणुगटांपासून) ⇨ आयन–विनिमय पद्धतीने, अवक्षेपणाने वा विद्रावक निष्कर्षणाने (योग्य विद्रावकात म्हणजे विरघळविणाऱ्या द्रवात विरघळवून पदार्थ अलग करण्याच्या क्रियेने) वेगळे करतात व ⇨ अनुमापन, ⇨ वर्णमापन इ. पद्धतींनी थोरियम ओळखतात [⟶ वैश्लेषिक रसायनशास्त्र].
उपयोग : थोरियम ऑक्साइड (९९%) व सेरिया (CeO2, १%) यांच्या मिश्रणात कापसाचे वा रॅमीचे कापड भिजवून, वाळवून व ते जाळून जास्त प्रकाश मिळतो, हे १८८५ मध्ये वेल्सबाख यांनी सिद्ध केले. त्यानंतर त्याचा उपयोग वायुजाळीसाठी (बत्तीमधील गॅस मँटलसाठी) करण्यात येऊ लागला. विजेच्या दिव्याच्या शोधानंतर वायुजाळीच्या वापराचे प्रमाण कमी झाले. टंगस्टन व ०·८–१% थोरियम ऑक्साइड यांचा उपयोग विजेच्या दिव्यातील तारांसाठी, थोरियम ऑक्साइड–धातू प्रयुक्तीचा उपयोग इलेक्ट्रॉनिकीमध्ये प्राथमिक इलेक्ट्रॉन उत्सर्जनासाठी, विद्युत् प्रज्योत वितळजोडकामाच्या (वेल्डिंगच्या) विद्युत् अग्राचा एक अटक म्हणून थोरियम ऑक्साइडाचा उपयोग करतात. तसेच ॲल्युमिनियम ऑक्साइडाबरोबर बऱ्याच वेळा थोरियम ऑक्साइडाचा उपयोग हायड्रोकार्बनांच्या ऑक्सिडीभवन, ⇨हायड्रोजनीकरण इ. विक्रियांत उत्प्रेरक (विक्रियेत भाग न घेता विक्रियेची गती वाढविणारा पदार्थ) म्हणूनही करण्यात येतो. थोरियम धातूचा उपयोग इलेक्ट्रॉनीय नलिका, दिवे आणि प्रकाशविद्युत् घटात (प्रकाश पडला असता ज्याची विद्युत् स्थिती बदलते अशा प्रयुक्तीत) करतात. थोरियमाच्या काही मिश्रधातूंचा उपयोग रासायनिक उद्योगांत, अवकाशयानात व क्षेपणास्त्रांत करतात.
थोरियम (२३२) चे मंद न्यूट्रॉनाने आणवीय भंजन (तुकडे होणे) होत नाही म्हणून अणुभट्टीत त्याचा इंधन म्हणून सरळ वापर करता येत नाही. तथापि त्याचे भंजनक्षम युरेनियम (२३३) मध्ये रूपांतर करून त्याचा इंधन म्हणून उपयोग करता येणे शक्य आहे. ही विक्रिया पुढीलप्रमाणे होते.
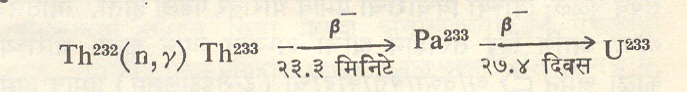
[येथे n हा न्यूट्रॉन, γ हा गॅमा किरणाचे उत्सर्जन व
β– हा निगॅट्रॉनाचे म्हणजे इलेक्ट्रॉनाचे उत्सर्जन दर्शवितात ⟶ अणुउर्जा]. प्रजनक विक्रियकात [⟶ अणुकेंद्रीय अभियांत्रिकी] थोरियमाचे भंजनक्षम युरेनियम (२३३) मध्ये रूपांतर करण्याच्या शक्यतेमुळे अणुकेंद्रीय ऊर्जा निर्माण करण्याकरिता लागणारे द्रव्य मोठ्या प्रमाणावर उपलब्ध होण्याच्या दृष्टीने थोरियमाला भविष्य काळात अतिशय महत्त्व प्राप्त होण्याची शक्यता आहे.
पहा : विरल मृत्तिका.
संदर्भ : 1. Grainger, L. Uranium and Thorium, London, 1958.
2. Hampel, C. A. Rare Metals Handbook, London, 1961.
3. Seaborg, G. T. Katz, J. J., Ed. The Chemistry of the Actinide Elements, New York, 1954.
मिठारी, भू. चिं.
“
आपल्या मित्रपरिवारात शेअर करा..
