ॲसिटाल्डिहाइड: ॲलिफॅटिक आल्डिहाइड श्रेणीतील क्रमांक दोनचे 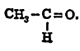 संयुग [→ आल्डिहाइडे]. संरचना सुत्र (रेणूतील अणूंची मांडणी दर्शविणारे सूत्र) शेजारी दाखविल्याप्रमाणे. ग्लुकोजापासून अल्कोहॉल तयार करण्याच्या कृतीत ॲसिटाल नावाचा पदार्थ अल्प प्रमाणात आढळतो. यावरून ॲसिटाल्डिहाइड मध्यंतरीच्या अवस्थेत तयार होत असेल पाहिजे असे अनुमान निघते. १९११ साली नॉयबर्ग यांनी हे अनुमान सत्य असल्याचे प्रायोगिक रीत्या सिद्ध केले. सूक्ष्म प्रमाणात निरोगी रक्तामध्ये व क्वचित प्रसंगी मूत्रामध्ये त्याचे अस्तित्व आढळून येते.
संयुग [→ आल्डिहाइडे]. संरचना सुत्र (रेणूतील अणूंची मांडणी दर्शविणारे सूत्र) शेजारी दाखविल्याप्रमाणे. ग्लुकोजापासून अल्कोहॉल तयार करण्याच्या कृतीत ॲसिटाल नावाचा पदार्थ अल्प प्रमाणात आढळतो. यावरून ॲसिटाल्डिहाइड मध्यंतरीच्या अवस्थेत तयार होत असेल पाहिजे असे अनुमान निघते. १९११ साली नॉयबर्ग यांनी हे अनुमान सत्य असल्याचे प्रायोगिक रीत्या सिद्ध केले. सूक्ष्म प्रमाणात निरोगी रक्तामध्ये व क्वचित प्रसंगी मूत्रामध्ये त्याचे अस्तित्व आढळून येते.
गुणधर्म: ॲसिटाल्डिहाइड हा वर्णहीन पदार्थ असून त्याचा वास उग्र व तिखट असतो. त्याचा उकळबिंदू २०·८० से. आहे. त्यामुळे घनरूप केल्याखेरीज तो हाताळणे कठीण होते. पाण्यात, अल्कोहॉलामध्ये व ईथरा- मध्ये तो मिसळू शकतो. ॲसिटाल्डिहाइडाची वाफ व हवा यांचे मिश्रण ज्वालाग्राही व स्फोटक असते. १९६८ मधील त्याचे जागतिक उत्पादन सु. १३·६ कोटी किग्रॅ. होते, पण त्यातील फारच थोडा भाग ॲसिटाल्डि- हाइड म्हणून विकला जातो. कारण तयार करण्याच्या जागीच त्याचे अनेक उपयुक्त कार्बनी रासायनिक द्रव्यांत (ॲसिटिक अम्ल, ॲसिटिक ॲनहायड्राइड, एथिल ॲसिटेट, ब्युटिल अल्कोहॉल, ब्युटाडाइन इत्यादींत) रूपांतर करण्यात येते.
उत्पादन पद्धती : औद्योगिक क्षेत्रातील उत्पादनाच्या काही महत्त्वाच्या पद्धती खालीलप्रमाणे आहेत.
(१) एथेनॉलची वाफ क्रोमियमाने सक्रियित (अधिक क्रियाशील बनविलेल्या) तांब्याच्या उत्प्रेरकावरून (विक्रियेत प्रत्यक्ष भाग न घेता ती जलद घडवून आणणाऱ्या पदार्थावरून) २६००—२९०० से. तापमान असताना नेली असता ॲसिटाल्डिहाइड व हायड्रोजन तयार होतात. मिळणारा हायड्रोजन पुरेसा शुद्ध असल्याने अन्य उत्पादनात त्याचा उपयोग जसाच्या तसा केला जातो.

(२) ॲसिटिलीन हा वायू मर्क्युरिक सल्फेट या उत्प्रेरकाच्या साहाय्याने सल्फ्यूरिक अम्लाच्या सान्निध्यात पाण्याचे घटक सामावून घेऊ शकतो व त्याचे ॲसिटाल्डिहाइडामध्ये रूपांतर होते.
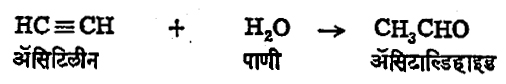
ॲसिटिलीन तयार करण्यास कॅल्शियम कार्बाइडाचा वापर केला जातो व कॅल्शियम कार्बाइडाच्या उत्पादनास विजेचा उपयोग करावा लागतो. म्हणून ही पद्धती ज्या ठिकाणी वीज विपुल प्रमाणात व अल्प खर्चात उपलब्ध असते अशाच ठिकाणी अवलंबिली जाते. वरील क्रियेमध्ये पाण्याचे घटक सल्फ्यूरिक अम्लापासून घेण्याऐवजी ॲसिटिक अम्लातून घेतल्यास त्याचे रूपांतर ॲसिटिक ॲनहायड्राइडामध्ये व ॲसिटिलिनाचे ॲसिटाल्डिहाइडामध्ये होते. अशा तऱ्हेने एकाच रासायनिक क्रियेत दोन महत्त्वाचे पदार्थ बनविण्याची कल्पक पद्धत अलीकडे वापरली जात आहे.
(३) ब्यूटेनासारखा (C4H10) हायड्रोकार्बन विशिष्ट परिस्थितीत पाण्याच्या वाफेच्या सान्निध्यात ऑक्सिजनाबरोबर क्रियाशील होऊन ॲसिटाल्डिहाइड, फॉर्माल्डिहाइड, मिथिल अल्कोहॉल व इतर अल्कोहॉले, कीटोने, ग्लायकॉले, कार्बनिक अम्ले इत्यादींचे मिश्रण देऊ शकतो. ही सर्व रसायने महत्त्वाची व नित्य उपयोगाची असल्याने मिळालेल्या मिश्रणातून घटक वेगळे करण्याकरिता पडणारे कष्ट व खर्च सोसूनही उत्पादन फायदेशीर ठरते.
रासायनिक विक्रिया: रासायनिक विक्रियेच्या साहाय्याने ॲसिटाल्डिहाइडापासून मिळणारे काही महत्त्वाचे पदार्थ पुढीलप्रमाणे आहेत.

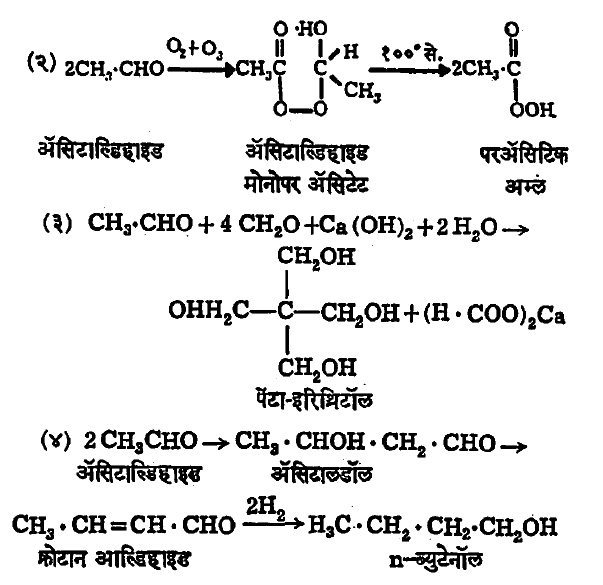
या रासायनिक विक्रियेतील पहिला टप्पा अल्डॉल संघनन या नावाने प्रसिद्ध आहे. या पद्धतीने लहान रेणू जोडून मोठा रेणू तयार करता येतो.
ॲसिटाल्डिहाइडामध्ये बहुवारिकीभवन (अनेक रेणू एकत्र येऊन मोठा रेणू बनण्याच्या) क्रियेची प्रवृत्ती फार आहे. वेगवेगळ्या उत्प्रेरकांबरोबर विशिष्ट परिस्थितीत निरनिराळे पदार्थ मिळू शकतात. त्यांची काही उदाहरणे खाली दिली आहेत.
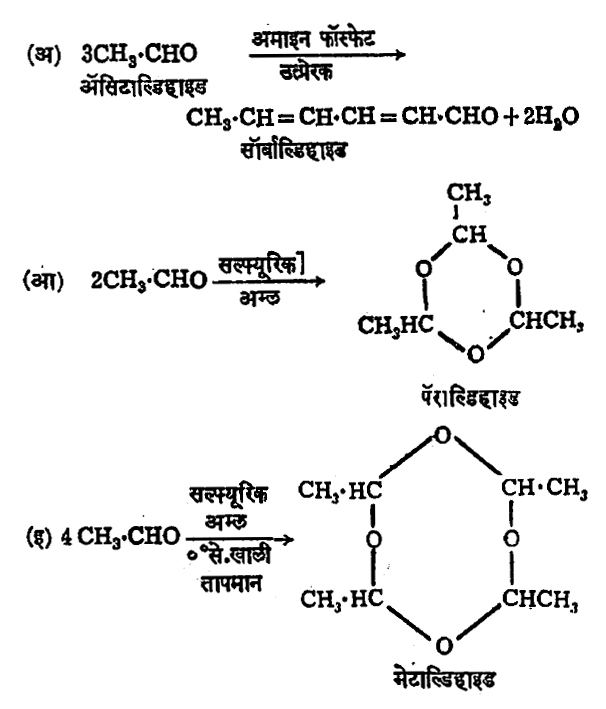
पॅराल्डिहाइडाचा उत्कलनबिंदू १२४० से. आहे. ते तापविले असता त्याच्यापासून ॲसिटाल्डिहाइड मिळते. सुरुवातीस निर्देश केलेली ॲसिटाल्डिहाइड हाताळण्याची, त्याचप्रमाणे तो दूरवर पाठविण्याची अडचण पॅराल्डिहाइडाचा वापर करून दूर केली जाते. झोपेच्या औषधातही त्याचा थोडा उपयोग होतो. मेटाल्डिहाइड हा एक ज्वलनक्षम घन पदार्थ असून गोगलगाईसारख्या प्राण्यांच्या संहाराकरिता विषारी पदार्थ म्हणून त्याचा उपयोग होतो.
उपयोग: ॲसिटाल्डिहाइडापासून ॲसिटिक अम्ल, ॲसिटिक ॲनहायड्राइड, n—ब्युटिल अल्कोहॉल ॲसिटोन, व्हिनील ॲसिटेट यांसारखे अनेक कार्बनी पदार्थ बनवितात. सरस, जिलेटीन, कातडी इ. पदार्थ कठीण करण्याकरिता तसेच कातड्यावर बुरशी येऊ नये म्हणूनही याचा वापर होतो. यांशिवाय फळे दीर्घकाल टिकविण्याकरिता, प्लॅस्टिकसारख्या गुणधर्माचे पदार्थ बनविण्याकरिता, रबराच्या धंद्यात प्रतिऑक्सिडीकारके (ऑक्सिडीकरणास विरोध करतील अशी संयुगे) तयार करण्याकरिता व औषधांत याचा उपयोग होतो.
शिंगटे, रा. धों.
“