नॅप्थॅलीन: ॲरोमॅटिक हायड्रोकार्बन वर्गातील एक संयुग [→ ॲरोमॅटिक संयुगे]. रेणुसूत्र C10H8 रेणुभार १२८·१६ वि. गु. १·१४५ वितळबिंदू ८०·२° से. उकळबिंदू २१८° से.
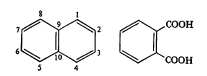
इतिहास, उपस्थिती व संरचना: दगडी कोळशाच्या डांबरात हे असते, असे प्रथम १८२० मध्ये ए. गार्डन यांना आढळून आले. १८२१ मध्ये किड यांनी उच्च तापमान वापरून डांबरापासून ते शुद्ध रूपात वेगळे केले आणि त्याला नॅप्थॅलीन हे नाव दिले. हे एक हायड्रोकार्बन आहे व याच्या संरचनेत (रेणूमधील अणूंच्या जोडणीत) दोन बेंझीन वलये एकमेकांशेजारच्या दोन कार्बन अणूंच्या योगाने जोडलेली आहेत (सूत्र १), असे ई. एर्लेनमायर यांनी १८६६ मध्ये सुचविले. १८६९ मध्ये सी. ग्रेबे यांनी नॅप्थॅलिनाचे ऑक्सिडीकरण [→ऑक्सिडीभवन] केले तेव्हा त्यापासून ऑर्थो थॅलिक अम्ल (सूत्र २) बनते, असे त्यांना दिसून आले व त्यावरून नॅप्थॅलिनाची संरचना सिद्ध झाली.
बिट्युमेनी दगडी कोळशापासून उच्च तापमान वापरून मिळणाऱ्या डांबरात ते ५–१०% असते. खनिज तेलाच्या परिष्करणातील ॲरोमॅटिकरण (ॲरोमॅटिक वर्गाची संयुगे बनविण्याची) प्रक्रिया केलेल्या तेल अंशात ते असते.
काही वनस्पतींच्या बाष्पनशील (बाष्परूपाने उडून जाणाऱ्या) घटकांतही ते असते उदा., लवंगांच्या देठातील घटकांत.
प्राप्ती: (१) बिट्युमेनी कोळशाच्या उच्च तापमानी कार्बनीकरणाने मिळणाऱ्या ⇨ डांबराचे ऊर्ध्वपातन (बंद पात्रात घालून तापविणे व बाष्प थंड करून घटक पदार्थ मिळविणे) केले असता सु. १७०°–२३०° से. या तापमान मर्यादेत ‘मध्यम तेल अंश’ या नावाचा एक अंश मिळतो. त्यामध्ये नॅप्थॅलीन, डांबर अम्ले व काही क्षारके (अम्लाबरोबर विक्रिया झाल्यास लवणे देणारे पदार्थ) यांचे मिश्रण असते. म्हणून या तेलाची प्रथम दाहक (कॉस्टिक) सोड्याबरोबर विक्रिया घडवितात. त्यामुळे अम्ले विरघळून जातात. नंतर राहिलेल्या तेलातून सल्फ्यूरिक अम्लाच्या विक्रियेने क्षारके काढून घेतात व उरलेले तेल थंड करतात. नॅप्थॅलीन घनरूपात बाहेर पडते. ते काढून घेऊन केंद्रोत्सारकाने (गरगर फिरविल्याने पदार्थ केंद्रापासून दूर सारले जातील अशी योजना असलेल्या उपकरणाने) त्याला चिकटून आलेले तेल काढून टाकतात किंवा सल्फ्यूरिक अम्लाची क्रिया झाल्यावर उरलेल्या तेलाचे पुन्हा ऊर्ध्वपातन करतात. प्रथम ऊर्ध्वपातन पावलेला अंश काढून टाकतात. त्यानंतरच्या ऊर्ध्वपातितात काही नॅप्थॅलीन असते म्हणून तो अंश वेगळा काढून व पुन्हा ऊर्ध्वपातन करून ते वेगळे काढतात. अगदी शेवटी मिळणाऱ्या भागांत बहुतेक सर्व नॅप्थॅलीनच असते पण ते अशुद्ध असते आणि ते एकदा सल्फ्यूरिक अम्लाने व त्यानंतर पाण्याने धुवून पुन्हा ऊर्ध्वपातन केले म्हणजे जास्त शुद्ध नॅप्थॅलीन मिळते.
थॅलिक ॲनहायड्राइड अथवा टेट्राहायड्रोनॅप्थॅलीन बनविण्यासाठी वापरावयाच्या नॅप्थॅलिनामध्ये थायानॅप्थीन हे संयुग मुळीच असता कामा नये. म्हणून ते काढून टाकण्यासाठी वरील नॅप्थॅलिनावर सोडियमाची विक्रिया घडवितात किंवा सौम्य व उत्प्रेरकी (विक्रिया त्वरेने घडवून आणणारा व विक्रियेनंतर तसाच राहणारा पदार्थ वापरून केलेले) हायड्रोजनीकरण (संयुगात हायड्रोजनाचा समावेश करण्याची विक्रिया) करतात. (२) १९६१ पासून अमेरिकेच्या संयुक्त संस्थानांत खनिज तेलाच्या परिष्करण प्रक्रियांतील काही अंशांपासूनही बरेच (सु. ४०%) नॅप्थॅलीन मिळू लागले आहे.
त्याकरिता परिष्करण-प्रक्रियांतील योग्य अंश घेऊन त्यापासून प्रथम वलयीकरणाने (कार्बन शृंखलेची टोके एकमेकांस जोडली जाऊन वलयी संयुगे बनण्याच्या प्रक्रियेने) नॅप्थॅलीन व डायमिथिल नॅप्थॅलिने यांच्या उकळबिंदूच्या पल्ल्यात येईल असा अंश बनवितात. नंतर अल्किल नॅप्थॅलिने ज्यात विपुल आहेत, असा अंश त्यातून निवडतात आणि त्यामधील अल्किल नॅप्थॅलिनातील अल्किल गट ऊष्मीय किंवा उत्प्रेरकी क्रियांनी काढून टाकून नॅप्थॅलीन मिळवितात.
भौतिक गुणधर्म: याचे स्फटिक चकचकीत, पांढरे व पत्रीसारखे असतात. याला विशिष्ट वास असतो आणि ते सुलभतेने संप्लवन पावते (घनावस्थेतून एकदम बाष्पावस्थेत जाते). पाण्यात अविद्राव्य (न विरघळणारे) पण अनेक कार्बनी विद्रावकांत ते विरघळते. गंधक, फॉस्फरस, आयोडीन व धातूंची सल्फाइडे नॅप्थॅलिनात विरघळतात.
रासायनिक विक्रिया: नॅप्थॅलिनातील १, ४, ५ व ८ (आल्फा स्थाने) ही स्थाने समान आहेत त्याचप्रमाणे २, ३, ६ व ७ (बीटा स्थाने) ही पण समान आहेत. त्यामुळे प्रतिष्ठापनाने (संयुगातील मूळचा एखादा अणू जाऊन त्या जागी दुसरा अणू अथवा गट येण्याच्या क्रियेने) जेव्हा एकच गट नॅप्थॅलिनात प्रविष्ट होतो तेव्हा २ समघटक [संयुगातील अणूंची संख्या व प्रकार तेच परंतु त्यांच्या रचना भिन्न असल्यामुळे बनलेली भिन्न संयुगे → समघटकता], तेच दोन गट प्रतिष्ठापक असतील तर १० व भिन्न असतील तर १४ समघटक संभवतात.
सल्फॉनीकरण: (संयुगात-SO३H गटाचे प्रतिष्ठापन करणे). संहत (जास्त प्रमाणात असलेले) सल्फ्यूरिक अम्ल व कमी तापमान अशी परिस्थिती असल्यास नॅप्थॅलिनापासून नॅप्थॅलीन आल्फा सल्फॉनिक अम्ल व तापमान उच्च असेल, तर नॅप्थॅलीन बीटा सल्फॉनिक अम्ल बनते. सल्फ्यूरिक अम्लात सल्फर ट्राय-ऑक्साइड विरघळविलेले असेल, तर दोन, तीन व चार सल्फॉनिक गट संरचनेत असलेली सल्फॉनिक अम्ले मिळतात. दाहक सोड्याच्या विक्रियेने सल्फॉनिक अम्लांपासून नॅप्थॉलनामक सल्फॉनिक गटाच्या जागी हायड्रॉक्सी (OH) गट असलेली, उपयुक्त संयुगे उपलब्ध होतात. सल्फॉनिक अम्ले संश्लिष्ट रंगधंद्यात [→ रंजक व रंजकद्रव्ये] आंतरिक द्रव्ये म्हणून उपयोगी पडतात [→ सल्फॉनीकरण].
नायट्रीकरण: (संयुगात NO2 गट प्रतिष्ठापित करणे). नायट्रिक व सल्फ्यूरिक अम्लांच्या मिश्रणाने मुख्यत्वे १ – नायट्रो नॅप्थॅलीन मिळते. यापासून १ – नॅप्थील अमाइन हे रंगद्रव्यांच्या उत्पादनात उपयोगी असलेले संयुग बनवितात [→ नायट्रीकरण].
क्लोरिनीकरण: (संयुगात Cl चे अणू घालणे). फेरिक क्लोराइडाच्या उपस्थितीत, क्लोरोबेंझिनामध्ये विक्रिया केल्यास १ – क्लोरोनॅप्थॅलीन कार्बन टेट्राक्लोराइडात केल्यास १, ४ – व १, ५ –डायक्लोरोनॅप्थॅलिने व वितळलेल्या स्थितीत केल्यास ऑक्टोक्लोरोनॅप्थॅलिनापर्यंत पॉलिक्लोरोनॅप्थॅलिने मिळतात. त्यांचा उपयोग विजेच्या केबलवरील आवरणातील एक घटक म्हणून होतो [→ हॅलोजनीकरण].
अल्किलीकरण: (अल्किल गट प्रतिष्ठापित करणे). ॲल्युमिनियम क्लोराइड, सल्फ्यूरिक अम्ल, फेरिक क्लोराइड इ. उत्प्रेरकांमुळे आणि अल्किल हॅलाइडे, अल्कोहॉले, ओलेफिने ही विक्रियाकारके वापरून अल्किल नॅप्थॅलिने बनविता येतात.
सल्फ्यूरिक अम्ल हे उत्प्रेरक वापरून अल्कोहॉलाने अल्किलीकरण केले, तर अल्किलीकरण आणि सल्फॉनीकरण या दोन्ही क्रिया एकाच वेळी घडून येतात. कित्येक अल्किल सल्फॉनिक अम्ले प्रक्षालकांच्या (वस्तू स्वच्छ करण्याचा साबणासारखा गुण असलेल्या पदार्थांच्या) निर्मितीसाठी उपयोगी पडतात [→ अल्किलीकरण].
समावेशक विक्रिया: (संयुगात इतर अणू अथवा गट मूळचे अणू तसेच ठेवून सामावून घेणाऱ्या विक्रिया). नॅप्थॅलिनामध्ये दोन, चार, सहा, आठ व दहा हायड्रोजन अणूंचा समावेश होतो आणि त्यामुळे अनुक्रमे डाय–, टेट्रा–, हेक्झॅ–, ऑक्टॅ– व डेका–हायड्रोनॅप्थॅलिने बनतात. टेट्रा–हायड्रोनॅप्थॅलीन (टेट्रालीन) हा एक वर्णहीन द्रव असून त्यामध्ये तेले, वसा (स्निग्ध पदार्थ), रेझिने तसेच नॅप्थॅलीन, अँथ्रॅसीन इ. हायड्रोकार्बने गंधक, आयोडीन इ. द्रव्ये विरघळतात. याचा उपयोग नैसर्गिक व संश्लिष्ट रेझिने विरघळविण्यासाठी करतात. निकेल हा प्रवर्तक वापरून हे बनविता येते. डेका–हायड्रोनॅप्थॅलीन (डेकालीन) हा एक उच्च उकळबिंदू असलेला विद्रावक आहे. तेले व मेणे विरघळविण्यासाठी आणि लेपित थरांचा विद्राव करून ते काढून टाकण्यासाठी हे वापरतात.
कमी तापमानास आणि उत्प्रेरक न वापरता क्लोरिनीकरण केले, तर नॅप्थॅलिनात क्लोरिनाचे समावेशन होते आणि नॅप्थॅलीन डाय– व टेट्रा–क्लोराइडे बनतात.
ही तापविल्यास त्यांमधून हायड्रोजन क्लोराइड निघून जाते आणि अनुक्रमे १ –क्लोरो व १, ४ – डायक्लोरोनॅप्थॅलिने बनतात.
वलयभेदन : (वलय मोडणे). सामान्य ऑक्सिडीकरणात नॅप्थॅलिनामधील वलये न मोडता नॅप्थाक्विनोन हे संयुग बनते परंतु ऑक्सिडीकरण याच्याही पुढे गेले म्हणजे एका वलयाचा भंग होतो व ऑर्थो थॅलिक अम्ल बनते आणि त्याच्या निर्जलीकरणाने थॅलिक ॲनहायड्राइड मिळते [→ थॅलिक अम्ले].
परीक्षण: नॅप्थॅलिनाची प्रतवारी त्याचा गोठणबिंदू ठरवून करतात आणि त्याकरिता पदार्थ कोरडा किंवा ओला असताना तो बिंदू ठरविला, ते नमूद करावे लागते. अलीकडे एखाद्या नमुन्याचे अवरक्त (वर्णपटातील तांबड्या रंगाच्या अलीकडील अदृश्य किरणांचे) शोषण आणि बाष्पावस्था वर्णलेखन [→ वर्णलेखन] यांच्या अवलोकनाने त्यातील अशुद्धीचे मापन करणे साध्य झाले आहे. नॅप्थॅलीन ज्या कामासाठी वापरावयाचे असेल त्यासाठी ते कितपत योग्य आहे, हे त्या कामाशी संबंधित अशा गुणधर्माचे परीक्षण करूनही ठरवितात उदा., कीटकनाशकांत वापरावयाचे असेल, तर बाष्पीभवनानंतर राहणाऱ्या अवशेषाचे मापन.
उपयोग: नॅप्थॅलिनाचा सर्वांत जास्त उपयोग थॅलिक ॲनहायड्राइड या संयुगाच्या उत्पादनासाठी होतो [→ थॅलिक अम्ले]. १ – नॅप्थील – N – मिथिलाकार्बामेट हे महत्त्वाचे कीटकनाशक नॅप्थॅलिनापासून बनवितात. बीटा नॅप्थॉल हे उपयुक्त संयुगही त्यापासूनच मिळते. रंजकनिर्मिती, पतंग (कीटक) प्रतिवारक, कवकनाशके (बुरशीसारख्या हरितद्रव्यरहित वनस्पतींचा नाश करणारी द्रव्ये), स्फोटक पदार्थ, वंगणे, संश्लेषित रेझिने व कातडी कमावण्यासाठी वापरण्यात येणारा संश्लिष्ट पदार्थ, परिरक्षक, विद्रावक इत्यादींच्या निर्मितीत नॅप्थॅलीन वापरले जाते. तुकडे, गोळे, वड्या, ठोकळे, द्रव, चूर्ण, कणीरूप इ. विविध स्वरूपांत ते उपलब्ध आहे.
संदर्भ : Finar, I. L. Organic Chemistry, London, 1962.
कारेकर, न. वि. केळकर, गो. रा.
“