युरेनियमोत्तर मूलद्रव्ये : आवर्त सारणीतील [इलेक्ट्रॉनांच्या रचनेनुसार केलेल्या मूलद्रव्यांच्या कोष्टकरूप मांडणीतील ⟶ आवर्त सारणी] शेवटचा आवर्त अपुरा असल्याची जाणीव बरेच दिवस शास्त्रज्ञांना होत होती. युरेनियम [अणुक्रमांक (अणुकेंद्रातील प्रोटॉनांची संख्या) ९२] हे निसर्गात सापडणारे शेवटचे मूलद्रव्य आहे, असे मानले जात होते. ९२ पेक्षा अधिक अणुक्रमांक असलेली मूलद्रव्ये एके काळी निसर्गात असावीत परंतु ती किरणोत्सर्गी (भेदक कण वा किरण बाहेर टाकणारी) असल्याने नाश पावली असावीत. युरेनियम (९२) नंतरची मूलद्रव्ये नेपच्यूनियम व प्लुटोनियम यांशिवाय एकही मूलद्रव्य निसर्गात आढळत नाही. हीही लेशमात्र आढळतात. ही सर्व मूलद्रव्ये मानवनिर्मित मूलद्रव्ये आहेत.[⟶ मूलद्रव्ये, मानवनिर्मित].
या मूलद्रव्यांचे आवर्त सारणीच्या दृष्टीने दोन भाग पडतात : (१) युरेनियमोत्तर मूलद्रव्ये व (२) ॲक्टिनियमोत्तर मूलद्रव्ये.
युरेनियमोत्तर मूलद्रव्ये पुढीलप्रमाणे : (नावानंतर कंसात रासायनिक चिन्ह व अणुक्रमांक दिला आहे). नेपच्यूनियम (Np, ९३), प्लुटोनियम (Pu, ९४), अमेरिसियम (Am, ९५), क्युरियम (Cm, ९६), बर्केलियम (Bk, ९७), कॅलिफोर्नियम (Cf, ९८), आइन्स्टाइनियम (Es, ९९), फेर्मियम (Fm, १००), मेंडेलेव्हियम (Md, १०१), नोबेलियम (No, १०२), व लॉरेन्सियम (Lr, १०३).
ॲक्टिनियमोत्तर मूलद्रव्ये पुढीलप्रमाणे : पहिले ॲक्टिनियमोत्तर मूलद्रव्य म्हणजे रदरफर्डियम अथवा कुरचॅटोव्हियम (Rf अथवा Ku, १०४) व त्यानंतर हानियम अथवा नील्सबोरियम (Ha अथवा Ns, १०५), अक्र. १०६, १०७, १०८, १०९, ते ११८ पर्यंत. यातील अक्र. ११० पासून अक्र. ११८ पर्यंतची मूलद्रव्ये अद्याप मिळालेली नाहीत.
नैसर्गिक मूलद्रव्यांच्या अणुभारांची संकल्पना [⟶ अणुभार] या मूलद्रव्यांच्या बाबतीत वापरता येत नाही कारण ती मूलद्रव्ये कशापासून आणि कशी तयार केलेली आहेत व त्यांचे अर्धायुष्य (किरणोत्सर्गी द्रव्याची मूळची क्रियाशीलता निम्मी होण्यास लागणारा काळ) किती आहे यांवर त्यांचा अणुभार विचारात घेतला जातो. त्या दृष्टीने सर्वांत जास्त काळ टिकणाऱ्या अथवा अधिक प्रमाणात उपलब्ध असलेल्या त्या त्या मूलद्रव्याच्या समस्थानिकांचे (अणुक्रमांक तोच पण भिन्न अणुभार असलेल्या त्याच मूलद्रव्याच्या प्रकारांचे) द्रव्यमानांक (अणुकेंद्रातील प्रोटॉन व न्यूट्रॉन यांची एकूण संख्या) त्यांचे अणुभार म्हणून पुढीलप्रमाणे समजता येतील : Np – २३७* Pu – २३९, २४४* Am – २४१, २४३* Cm – २४४, २४७* Bk – २४७, २४९* Cf – २५१*, २५२ Es – २५३, २५४* Fm – २५७* Md – २५८* No – २५९* Lr – २६०* Rf – २६१* Ha – २६२* मूलद्रव्य अक्र. १०६ – २६३*. येथे * अशी खूण केलेला द्रव्यमानांक सर्वांत जास्त काळ टिकणाऱ्या समस्थानिकाचा आहे व खूण न केलेला द्रव्यमानांक अधिक प्रमाणात उपलब्ध असलेल्या समस्थानिकांचा आहे.Np व Fm यांच्या बाबतीत दिलेले द्रव्यमानांक मात्र सर्वांत जास्त काळ टिकणाऱ्या तसेच अधिक प्रमाणात उपलब्ध असलेल्या समस्थानिकांचे आहेत.
आवर्त सारणीतील स्थान : युरेनियमोत्तर अक्र. ९३ ते अक्र. १०३ पर्यंतची मूलद्रव्ये ॲक्टिनाइड श्रेणीत मोडतात व ती गुणधर्माने ⇨ विरल मृत्तिका (लँथॅनाइड श्रेणी) मूलद्रव्यांशी मिळतीजुळती आहेत. ती ⇨ संक्रमणी मूलद्रव्यांतील असून f वर्गातील आहेत [⟶ मूलद्रव्ये]. लँथॅनाइड श्रेणीतील मूलद्रव्यांत 4f उपकवचात तर ॲक्टिनाइड श्रेणीतील मूलद्रव्यांत 5 f उपकवचात एक एक असे १४ पर्यंत इलेक्ट्रॉन ओळीने भरले जातात [⟶ अणु व आणवीय संरचना].
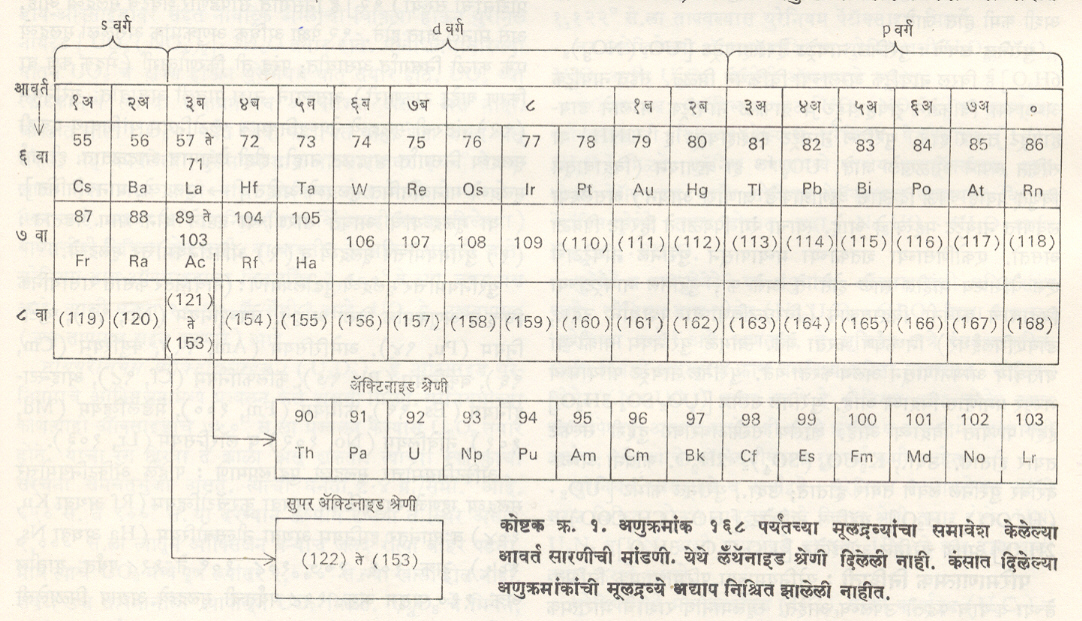
अक्र. १०४ ते अक्र. ११८ ही ॲक्टिनियमोत्तर मूलद्रव्ये आवर्त सारणीत अर्धवट असलेल्या सातव्या आवर्तात ॲक्टिनियमानंतर ओळीने येतात. त्यांत अक्र. १०४ चे मूलद्रव्ये सहाव्या आवर्तातील हाफ्नियम (अक्र. ७२) याच्या खाली तर अक्र. ११८ चे मूलद्रव्य सहाव्या आवर्तातील शेवटचे मूलद्रव्य रेडॉन (अक्र. ८६) याच्या खाली अशी मांडणी होईल.
अक्र. ११८ च्या पुढे अक्र. १२६ पर्यंतची मूलद्रव्ये मिळू शकतील, असे भाकीत करण्यात आलेले आहे. मग मात्र अक्र. ११९ पासून आवर्त सारणीत ८ वा आवर्त सुरू करावा लागेल. अक्र. ११९ चे मूलद्रव्य फ्रान्सियमाच्या (अक्र. ८७) खाली तर अक्र. १२० व १२१ अनुक्रमे रेडियम व ॲक्टिनियम (अक्र. ८८ व ८९) यांच्या खाली मांडावे लागेल. अक्र. १२१ च्या घरात लँथॅनाइड व ॲक्टिनाइड श्रेणींप्रमाणेच आंतर संक्रमणी मूलद्रव्यांची नवीन श्रेणीही तयार होण्याची शक्यता आहे. मात्र ही श्रेणी लँथॅनाइड व ॲक्टिनाइड श्रेणींप्रमाणे १४ मूलद्रव्यांची न राहता ३२ मूलद्रव्यांची राहील, असा गणितीय आकडेमोडीने अंदाज करण्यात आलेला आहे. या श्रेणीस सध्या सुपरॲक्टिनाइड श्रेणी असे संबोधिले आहे. यानंतर सारणीत अक्र. १५४ ते १६८ ओळीने मांडले असता अक्र. १६८ चे मूलद्रव्य रेडॉनाप्रमाणे अक्रिय (इतर मूलद्रव्यांशी रासायनिक विक्रिया सहजी न होणारा) वायू असेल. ही मांडणी आवर्त सारणीत कशी दिसेल, हे कोष्टक क्र. १ मध्ये दाखविले आहे.
या मूलद्रव्यांचे संश्लेषण (कृत्रिम रीत्या तयार करणे) व निरीक्षण ही मूलद्रव्ये पुरेशा अर्धायुष्याची असण्यावर व अणुकेंद्रीय विक्रियांतून बऱ्याच प्रमाणात प्राप्त होण्यावर आणि परीक्षणाकरिता लागणाऱ्या सूक्ष्मग्राही उपकरणांची उपलब्धता यांवर अवलंबून आहे.
आवर्त सारणीतील मांडणीमुळे या मूलद्रव्यांच्या गुणधर्मांवर प्रकाश पडतो. रदरफर्डियमाचे (अक्र. १०४) रासायनिक गुणधर्म त्याच्या डोक्यावरील हाफ्नियम (अक्र. ७२) प्रमाणे, हानियम (१०५) चे गुणधर्म टँटॅलमाप्रमाणे तर अक्र. १०६ च्या मूलद्रव्याचे गुणधर्म टंगस्टनाप्रमाणे आढळून येतात. अक्र. ११८ चे मूलद्रव्य त्याच्यावरील रेडॉनाप्रमाणे अक्रिय वायू असावा.
इलेक्ट्रॉन विन्यासाची (अणुकेंद्राभोवतील कवचांतील इलेक्ट्रॉनांच्या मांडणीची) कल्पना ‘अणु व आणवीय संरचना’ या नोंदीत विशद केली आहे. त्याप्रमाणे याही मूलद्रव्यांचा इलेक्ट्रॉन विन्यास मांडता येतो. त्यांच्या संयुजा इलेक्ट्रॉनांचा (अणूच्या सर्वांत बाहेरच्या कवचातील इलेक्ट्रॉनांचा) विन्यास दाखवता येतो व त्यावरून त्यांच्या गुणधर्मांचे भाकीत करता येते. काही मूलद्रव्यांच्या शेवटच्या कवचातील इलेक्ट्रॉनांचा विन्यास कोष्टक क्र. २ प्रमाणे मांडता येईल.
कोष्टक क्र. २. काही मूलद्रव्यांच्या शेवटच्या कवचातील इलेक्ट्रॉनांचा विन्यास
|
अणुक्रमांक आधीची रचना |
शेवटच्या कवचातील इलेक्ट्रॉन विन्यास |
विन्यासाप्रमाणे पडणारे वर्ग |
|
|
१०४ |
रेडॉनाप्रमाणे |
-5f14 6d2 7s2 |
|
|
१०५ |
” |
-5f14 6d३ 7s2 |
|
|
१०६ |
” |
-5f14 6d4 7s2 |
d वर्ग संक्रमणी मूलद्रव्ये |
|
१११ |
” |
-5f14 6d 97s2 |
|
|
११२ |
” |
-5f14 6d10 7s2 |
|
|
११३ |
” |
-5f14 6d10 7s2 7p1 |
|
|
११४ |
” |
-5f14 6d10 7s2 7p2 |
p वर्ग |
|
११८ |
” |
-5f14 6d10 7s2 7p6 |
|
|
११९ |
” |
-5f14 6d10 7s2 7p6 8 s1 |
S वर्ग |
|
१२० |
” |
-5f14 6d10 7s2 7p6 8 s2 |
|
|
इत्यादी |
|||
कोष्टक क्र. ३. मूलद्रव्ये – ११३ व – ११४ यांचे भाकीत केलेले काही गुणधर्म.
|
मूलद्रव्य – ११३ (एका – थॅलियम) |
मूलद्रव्य – ११४ (एका – लेड) |
|
|
रासायनिक गट |
३ अ |
४ अ |
|
अणुभार |
२९७ |
२९८ |
|
स्थिर ऑक्सिडीकरण अवस्था |
+१ |
+२ |
|
धातवीय त्रिज्या (Å) |
१.७५ |
१.८५ |
|
आयन त्रिज्या (Å) |
१.४८ |
१.३१ |
|
घनता (ग्रँ. / सेंमी. ३) |
१६ |
१४ |
|
वितळबिंदू (° से.) |
४३० |
७० |
|
उकळबिंदू (° से.) |
११०० |
१५० |
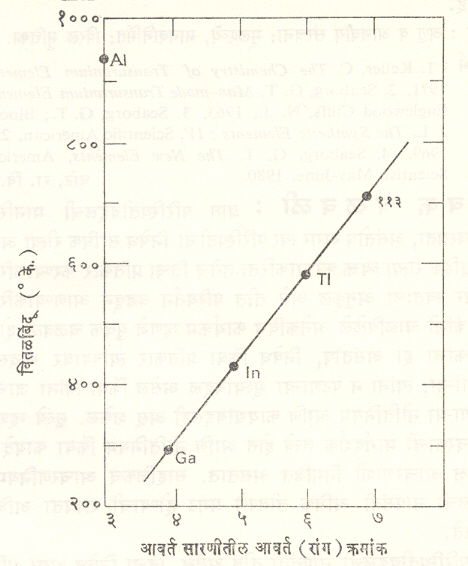 भौतिकीय गुणधर्मांचा अभ्यास करण्यासाठी आलेख पद्धतीचाही उपयोग करतात. उदा., आवर्त सारणीतील ३ अ गटातील मूलद्रव्यांच्या वितळबिंदूंचा आकृतीत दर्शविल्याप्रमाणे आलेख काढल्यास व त्याचे बहिर्वेशन केल्यास [⟶ अंतर्वेशन व बहिर्वेशन] मूलद्रव्य – ११३ चा वितळबिंदू मिळू शकतो. आलेखाप्रमाणे मूलद्रव्य – ११३ चा वितळबिंदू ४३०° से.(सु.७०३° के.)असा येतो. ४ अ गटातील मूलद्रव्यांची ऑक्सिडीकरण अवस्थेची वाढत्या अणुक्रमांकाबरोबर चारापासून दोनाकडे जाण्याची प्रवृत्ती आहे. कार्बन व सिलिकॉन यांची चतु:संयुजी संयुगे स्थिर आहेत, तर शिशाची द्विसंयुजी संयुगे जास्त स्थिर आहेत [⟶ मूलद्रव्ये] याचा आलेख काढून त्याचे बहिर्वेशन केल्यास सातव्या आवर्तातील मूलद्रव्य – ११४ चा कल चतु:संयुजी संयुगापेक्षा द्विसंयुजी संयुगे जास्त स्थिर असण्याकडे दिसून येते. आलेखावरून काढलेला हा निष्कर्ष संयुजा बंध उपपत्तीवरून [⟶ रासायनिक संरचना] सिद्ध होतो.
भौतिकीय गुणधर्मांचा अभ्यास करण्यासाठी आलेख पद्धतीचाही उपयोग करतात. उदा., आवर्त सारणीतील ३ अ गटातील मूलद्रव्यांच्या वितळबिंदूंचा आकृतीत दर्शविल्याप्रमाणे आलेख काढल्यास व त्याचे बहिर्वेशन केल्यास [⟶ अंतर्वेशन व बहिर्वेशन] मूलद्रव्य – ११३ चा वितळबिंदू मिळू शकतो. आलेखाप्रमाणे मूलद्रव्य – ११३ चा वितळबिंदू ४३०° से.(सु.७०३° के.)असा येतो. ४ अ गटातील मूलद्रव्यांची ऑक्सिडीकरण अवस्थेची वाढत्या अणुक्रमांकाबरोबर चारापासून दोनाकडे जाण्याची प्रवृत्ती आहे. कार्बन व सिलिकॉन यांची चतु:संयुजी संयुगे स्थिर आहेत, तर शिशाची द्विसंयुजी संयुगे जास्त स्थिर आहेत [⟶ मूलद्रव्ये] याचा आलेख काढून त्याचे बहिर्वेशन केल्यास सातव्या आवर्तातील मूलद्रव्य – ११४ चा कल चतु:संयुजी संयुगापेक्षा द्विसंयुजी संयुगे जास्त स्थिर असण्याकडे दिसून येते. आलेखावरून काढलेला हा निष्कर्ष संयुजा बंध उपपत्तीवरून [⟶ रासायनिक संरचना] सिद्ध होतो.
अशीच माहिती अतिजड मूलद्रव्ये – ११७ व – ११८ यांबद्दल काढलेली आहे. मूलद्रव्य – ११७ हॅलोजन गटात येते. ते ॲस्टटिनाप्रमाणे घनरूप व धातुसदृश असावे, असा निष्कर्ष निघतो. मात्र या गटाची (७ अ) ऑक्सिडीकरण अवस्था – १ असली, तरी मूलद्रव्य – ११७ ची ऑक्सिडीकरण अवस्था +३, +५, +७ अशी असावी, असे आढळते. मात्र हे मूलद्रव्य इतर हॅलोजनांशी स्थिर आंतर – हॅलोजन संयुगे तयार करील, असा अंदाज आहे.
मूलद्रव्य – ११९ बद्दल अद्याप फारशी माहिती नसली, तरी ते एक क्षार धातूप्रमाणे (१ अ गटातील लिथियम, सोडियम, पोटॅशियम इत्यादींप्रमाणे) +१ ऑक्सिडीकरण अवस्था असलेले मूलद्रव्य असावे, असा अंदाज करण्यात आला आहे. मूलद्रव्य – १२० हे रासायनिक दृष्ट्या कॅल्शियम व बेरियम यांसारखे असावे, असा अंदाज आहे. मूलद्रव्य – १२१ हे रासायनिक गुणधर्मांत लँथॅनम व ॲक्टिनियम या मूलद्रव्यांसारखे असावे परंतु त्याबाबतचे संशोधन अद्याप अपुरे आहे.
आवर्त सारणीचा शेवट केव्हा येईल याबद्दलही शास्त्रज्ञांनी विचार मांडले आहेत. त्यानुसार अणुकेंद्रामध्ये जसजसे जास्त जास्त प्रोटॉन घुसवले जातील तसतशी अशी वेळ येईल की, कक्षीय इलेक्ट्रॉनांची स्थिरता नाश पावेल. अणुकेंद्राची स्थिरता व कक्षीय इलेक्ट्रॉनांची स्थिरता एकच असत नाही. अशा प्रकारे रासायनिक दृष्ट्या क्रांतिक अणुक्रमांक येईल व तोच आवर्त सारणीतील शेवटचा अणुक्रमांक ठरेल. सध्याच्या उपपत्तीप्रमाणे सर्वाधिक अणुक्रमांक साधारणपणे १७० ते २१० च्या दरम्यान यावा, असे अनुमान काढण्यात आले आहे.
2. Seaborg, G. T. Man – made Transuranium Elements, Englewood Cliffs, N. J., 1963.
3. Seaborg, G. T. Bloom, J. L. The Synthetic Elements: IV, Scientific American, 220, 1969.
4. Seaborg, G. T. The New Elements, American Scientist, May – June, 1980.
“