नायट्रिक अम्ल : महत्त्वाचे खनिज अम्ल. रेणवीय सूत्र HNO3 . सर्वप्रथम तयार करण्यात व वापरण्यात आलेले नायट्रोजनाचे संयुग. ॲक्वा डिसोल्युटिव्हा, ॲक्वा प्राइमा, स्पिरिट ॲसिडस नायट्राय, स्पिरिट नायट्राय, फ्युमान्स ग्लाऊबेरी, ॲक्वा फॉर्टिस, ॲझोटिक ॲसिड, एनग्रेव्हर्स ॲसिड इ. नावांनीही हे अम्ल ओळखले जाते. हे एक द्रवरूप, पारभासी, रंगहीन वा पिवळट, वाफाळणारे, श्वासास अडथळा आणणारे, दाहक (कातडीशी स्पर्श झाल्यास तेथील पेशींचा दाह होतो) व संक्षारक (रासायनिक विक्रियेने हळूहळू नाश करणारे) अम्ल आहे. १००% शुद्ध नायट्रिक अम्ल रंगहीन द्रव असून त्याचे वि. गु. १·५०२६९ (२५° से. ला), वितळबिंदू – ४१·५९° से. व उकळबिंदू ८६° से. (एक वा. दा. ला) आहे.
इतिहास : मध्ययुगीन काळात यूरोपात नायट्रिक अम्ल माहीत होते. तसेच आठव्या शतकातील अरबांना व ईजिप्शियन लोकांनाही त्याची माहिती होती. पोटॅशियम नायट्रेट व मोरचूद एकत्र तापवून ॲक्वा फॉर्टिस या नावाने नायट्रिक अम्ल इ. स. ११०० च्या सुमारास तयार करीत असल्याचा उल्लेख आढळतो. पोटॅशियम नायट्रेटापासून नायट्रिक अम्ल तयार करण्याच्या पद्धतींचा उल्लेख आल्बर्ट्स मॅग्नस, लल्ली,जॉर्जिअस ॲग्रिकोला व जे. आर्. ग्लाऊबर यांच्या लिखाणात आढळतो. तप्त मँगॅनीज डाय-ऑक्साइडावरून अमोनियाची वाफ जाऊ देऊन आय्. मिल्नर यांनी नायट्रोजन ऑक्साइडे व नायट्रिक अम्ल तयार केले. १८२४ मध्ये डब्ल्यू. हेन्री यांनी ऑक्सिजनाबरोबर स्पंजी (सच्छिद्र) प्लॅटिनमाच्या सान्निध्यात अमोनिया उच्च तापमानाला संयोग पावतो हे सिद्ध केले. पुढे अनेक उत्प्रेरक (विक्रियेत भाग न घेता विक्रियेची गती वाढविणारे पदार्थ) वापरून एकोणिसाव्या शतकात व विसाव्या शतकाच्या सुरुवातीला हीच विक्रिया करण्याच्या पद्धती शोधल्या गेल्या. यातूनच पुढे आधुनिक नायट्रिक अम्लाच्या निर्मितीचा पाया घातला गेला. जे. मेयो यांनी १६६९ मध्ये सॉल्टपीटर हा पदार्थ हवेपासून मिळणाऱ्या अम्लाचे क्षारीय (अल्कली) लवण आहे असे नमूद केले होते. तथापि १७७६ मध्ये ए. एल्. लव्हॉयझर यांनी नायट्रिक अम्लात ऑक्सिजन असतो हे सप्रयोग दाखविले. १७८४ मध्ये एच्. कॅव्हेंडिश यांनी आर्द्र हवेतून विद्युत् ठिणग्या जाऊ देऊन नायट्रिक अम्ल संश्लेषित केले. १८१६ मध्ये जे. एल्. गे-ल्युसॅक व सी. एल्. बर्थेलॉट यांनी त्याचे संरचना सूत्र शोधून काढले. १९०० सालापर्यंत नायट्रिक अम्ल हे पोटॅशियम नायट्रेट वा सोडियम नायट्रेट यांची सल्फ्यूरिक अम्लाबरोबर विक्रिया करून व्यापारी प्रमाणात तयार करीत असत. ई.बर्कलँड व एस्. आइड यांनी नायट्रोजन व ऑक्सिजन यांच्यापासून विद्युत् प्रज्योत भट्टीच्या साहाय्याने नायट्रिक अम्ल तयार करण्याचा कारखाना नॉर्वेमध्ये १९०३ साली सुरू केला. यानंतर या पद्धतीवर आधारलेले कारखाने नॉर्वे व जर्मनीत निघाले. ह्या कारखान्यांत १९३० पर्यंत नायट्रिक अम्ल तयार होत होते. १९०१ मध्ये डब्ल्यू. ओस्टव्हाल्ट यांनी अमोनिया व हवा यांच्यापासून प्लॅटिनम उत्प्रेरकाच्या सान्निध्यात नायट्रिक अम्ल तयार करता येते हे सिद्ध केले. तथापि अमोनिया स्वस्त किंमतीत मिळेपर्यंत ह्या प्रक्रियेचा वापर करणे शक्य झाले नाही. १९१३ मध्ये जर्मनीमध्ये हाबर-बॉश पद्धतीने अमोनिया तयार करण्यात आला [⟶ अमोनिया] व त्यानंतर १९१७ मध्ये अमेरिकेतील मशल शोल्स येथे अमोनियाच्या ऑक्सिडीकरणाने [⟶ ऑक्सिडीभवन] नायट्रिक अम्ल तयार करण्याचा पहिला कारखाना निघाला. पहिल्या महायुद्धानंतर अशा कारखान्यांची संख्या वाढली व सध्या सर्वच नायट्रिक अम्ल ह्या पद्धतीने तयार केले जाते.
उत्पादन : शुद्ध व संहत (प्रमाण जास्त असलेले) सल्फ्यूरिक अम्ल व शुद्ध सोडियम नायट्रेट यांचे समग्रॅमरेणुभारातील (ग्रॅममध्ये मांडलेल्या रेणुभारातील) मिश्रण निर्वातात हळूहळू तापवून मिळणाऱ्या वाफा अम्लाच्या वितळबिंदूपेक्षा कमी तापमानाला थंड करून निर्जल व शुद्ध नायट्रिक अम्ल प्रयोगशाळेत तयार करण्यात येते.
|
H2SO4 |
+ |
NaNO3 |
⟶ |
NaHSO4 |
+ |
HNO3↑ |
(१) |
|
सल्फ्यूरिक अम्ल |
सोडियम नायट्रेट |
सोडियम बायसल्फेट |
नायट्रिक अम्ल (वायू) |
व्यापारी दृष्ट्या नायट्रिक अम्ल पुढील पद्धतींनी तयार करतात : (अ) सोडियम नायट्रेट वा पोटॅशियम नायट्रेट व सल्फ्यूरिक अम्ल यांच्या विक्रियेने, (आ) अमोनियाचे उत्प्रेरकी ऑक्सिडीकरण करून व (इ) विद्युत् प्रज्योत भट्टीत ऑक्सिजन व नायट्रोजन यांची विक्रिया करून.
(अ) आर्द्र हवेतून तडित् (वातावरणीय विद्युत्) गेल्यास अल्प प्रमाणात पावसाच्या पाण्यात नायट्रिक अम्ल आढळते. तसेच जमिनीतील नायट्रोजनयुक्त कार्बनी पदार्थांचे ऑक्सिडीभवन होऊन तेथे अल्प प्रमाणात नायट्रिक अम्ल तयार होते. जमिनीत असणाऱ्या क्षारकीय द्रव्यांमुळे या नायट्रिक अम्लाचे सॉल्टपीटर (KNO3) व चिली सॉल्टपीटर (NanO3) यांसारख्या नायट्रेटांत रूपांतर होते. यांपैकी चिली सॉल्टपीटर हे निसर्गात संहत (एकत्रित स्वरूपात) व विपुल प्रमाणात आढळते. या कच्च्या मालापासून वर वर्णन केलेल्या प्रयोगशालेय पद्धतीत थोडाफार बदल करून विसाव्या शतकापर्यंत नायट्रिक अम्ल व्यापारी पद्धतीवर तयार करीत असत. या पद्धतीत सोडियम नायट्रेट व सल्फ्यूरिक अम्ल सम ग्रॅमरेणुभारात घेऊन बिडाच्या भट्टीत कमी दाबाला तापवितात. यातून मिळणारे नायट्रिक अम्ल काचेच्या भांड्यात थंड करून अम्ल वेगळे काढतात. ही विक्रिया घडून येण्यास उच्च तापामानाची गरज असते व अशा तापमानाला तयार झालेल्या नायट्रिकअम्लाचे अपघटन (लहान रेणूंत तुकडे होणे) होते. यामुळे समी. (१) मध्ये दाखविल्याप्रमाणे एकदा नायट्रिक अम्ल तयार झाल्यावर उरलेल्या NaHSO4 वर किंवा NaHNO3 ची विक्रिया करून जास्त नायट्रिक अम्लाचे उत्पादन करता येत नाही. या अम्लाला त्यातील नायट्रोजन डाय-ऑक्साइडामुळे पिवळा रंग येतो म्हणून तो नाहीसा करण्यासाठी अम्लात थोडी हवा मिसळतात. (आ) अमोनियाचे उत्प्रेरकी ऑक्सिडीकरण करण्याची पद्धत ही सर्वांत जास्त प्रचारात असलेली पद्धत होय. या पद्धतीत द्रव अमोनिया बाष्पीभवनाने वायुरूप करतात. संपीडकातून (दाबयुक्त हवा पुरविणाऱ्या साधनातून) आवश्यक दाबात हवा घेऊन ती सु. २८०° से. पर्यंत गरम करतात. अमोनिया १०% व हवा ९०% या प्रमाणात मिश्रण करून ते परिवर्तकात (विक्रिया करावयाच्या पात्रात) नेतात. या परिवर्तकात उत्प्रेरक (९०% प्लॅटिनम व १०% ऱ्होडियम) तारेच्या जाळीच्या तक्त्यांच्या स्वरूपात नायक्रोमाच्या दांड्यावर बसविलेला असतो. या उत्प्रेरकाचे तापमान ९००° – १,०००° से.असून विक्रिया होत असताना निर्माण होणारी उष्णता उत्प्रेरकाचे तापमान योग्य ठेवण्यास पुरेशी असते.
|
NH3 |
+ |
5/4 O2 |
⟶ |
NO |
+ |
3/2H2O |
+ |
54100…………… (२) |
|
अमोनिया |
ऑक्सिजन |
नायट्रिक ऑक्साइड |
पाणी |
यात ९५% अमोनियाचे नायट्रिक ऑक्साइडात रूपांतर होते. परिवर्तकाचा वरील भाग अगंज (स्टेनलेस) पोलादाचा असून खालचा भाग क्रोमियमाचे उच्च प्रमाण असलेल्या लोखंडाचा असतो व त्याच्या भोवती पाणी खेळविलेले असते.
परिवर्तकातून बाहेर येणाऱ्या वायुमिश्रणातील अपशिष्ट (वाया जाणाऱ्या) उष्णतेचा उपयोग ‘अपशिष्ट उष्णता बाष्पित्र’ (बॉयलर) चालविण्यासाठी करतात. यानंतर परिवर्तित वायुमिश्रण शोषण मनोऱ्यातून बाहेर जाणाऱ्या वायूंनी प्राथमिक संघनित्रात (द्रवरूपात रूपांतर करणाऱ्या उपकरणात) थंड करतात व नंतर दुय्यम संघनित्रात ते पाण्याने थंड करून शोषक मनोऱ्यात नेतात. संघनित्रात वाफेचे पाणी होते व नायट्रिक ऑक्साइडाचा नायट्रोजन डाय-ऑक्साइड होतो आणि विरल नायट्रिक अम्ल तयार होते.
|
NO |
+ |
½ O2 |
⟶ |
NO2 |
+ |
13550कॅलरी……………… (३) |
||
|
नायट्रिक ऑक्साइड |
ऑक्सिजन |
नायट्रोजन डाय ऑक्साइड |
||||||
|
3NO2 |
+ |
H2O |
⟶ |
NO |
+ |
2HNO3 |
+ |
32200 कॅलरी .(४) |
|
नायट्रोजन डाय-ऑक्साइड |
पाणी |
नायट्रिक ऑक्साइड |
नायट्रिक अम्ल |
|||||
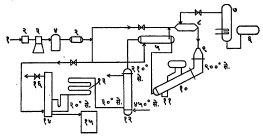
(३) व (४) या विक्रियांना अनुक्रमे १००° से. व ४०° से. कमाल तापमान लागते. शोषक मनोऱ्यात वायुमिश्रण खालून वर आणि पाणी (क्लोराइडयुक्त) वरून खाली वाहते. विरल अम्लही वरच्या बाजूने आत सोडतात. शोषक मनोरा एकावर एक बसविलेल्या फुग्यासारखा टोप्यांच्या पट्टांचा (प्लेट्सचा) बनविलेला असतो. प्रत्येक पट्टावर पाण्याचे शीतक वलय असते. शोषक मनोऱ्यात नायट्रिक ऑक्साइडाचा नायट्रोजन डाय-ऑक्साइड होऊन त्यापासून पाण्याबरोबर नायट्रिक अम्ल बनते. मनोऱ्याच्या तळाशी थोडी हवा आत सोडतात. त्यामुळे उत्पादित नायट्रिक अम्ल रंगहीन होते व ऑक्सिडीकरणासाठी ऑक्सिजनही मिळतो. नायट्रिक अम्ल साठविण्याची टाकी अंगज पोलादाची असते. परिवर्तकानंतरची सामग्री क्रोमियमाचे उच्च प्रमाण असलेल्या लोखंडाची असते. ही प्रक्रिया (१) ७ किग्रॅ./चौ.सेंमी. इतका उच्च (द्यू पाँ पद्धत), (२) मध्यम दाब (माँटे कॅटिनी पद्धत) व (३) वातावरणाइतका दाब अशा विविध दाबांच्या साहाय्याने करण्यात येते. यांतील (२) व (३) या कमी दाबांच्या पद्धतींत वर वर्णन केलेल्या प्रक्रिया व्यवस्थेत थोडा फरक असतो. उत्पादित नायट्रिक अम्ल वापरलेल्या दाबानुसार ५५–६५ % असते. यात संहत (६६′ बाऊमे) सल्फ्यूरिक अम्ल घालून बिडाच्या भट्टीत ऊर्ध्वपातनाने (बाष्प थंड करून घटक अलग मिळविण्याच्या क्रियेने) सु. ९८% नायट्रिक अम्ल तयार करतात. भट्टीऐवजी ‘पॉलिंग’ नावाच्या मनोऱ्यात वाफेच्या साहाय्याने नायट्रिक अम्ल संहत करतात. अलीकडे मॅग्नेशियम नायट्रेट विद्रावाच्या साहाय्याने ऊर्ध्वपातन करून नायट्रिक अम्लाचे संहतीकरण करण्याची पद्धत प्रचारात आली आहे.
फौझर उत्पादन पद्धतीत अमोनियाच्या ऑक्सिडीकरणाने एका टप्प्यात संहत नायट्रिक अम्ल मिळते. या पद्धतीत परिवर्तित वायुमिश्रण पुष्कळ थंड करतात व त्यामुळे शोषक मनोऱ्यात द्रव नायट्रोजन डाय-ऑक्साइड व विरल नायट्रिक अम्ल बनते. यापासून ⇨ऑटोक्लेव्हमध्ये ९८% नायट्रिक अम्ल तयार होते.
|
4NO2 |
+ |
2H2O |
+ |
O2 |
⟶ |
4HNO3 |
………(५) |
|
|
नायट्रोजन डाय-ऑक्साइड |
पाणी |
ऑक्सिजन |
नायट्रिक अम्ल |
|||||
(इ) हवेतील ऑक्सिजन व नायट्रोजन यांचा विद्युत् प्रज्योतीच्या साहाय्याने (तापमान १,२००° से.) संयोग करून नायट्रिक ऑक्साइड तयार होते. योग्य परिस्थितीत नायट्रिक ऑक्साइडाची फक्त २·५% निर्मिती होते. यापुढील विक्रिया समी. (३) व (४) मध्ये दाखविल्याप्रमाणे होतात. जेथे विद्युत् पुरवठा स्वस्त असतो तेथेही ह्या पद्धतीने व्यापारी उत्पादन करणे (आ) मध्ये वर्णन केलेल्या पद्धतीपेक्षा कमी खर्चात होत नाही.
गुणधर्म : शुद्ध नायट्रिक अम्ल प्रकाशाने व उष्णतेने पिवळे होते. ते पाण्याशी कोणत्याही प्रमाणात मिसळते. ६८% नायट्रिक अम्ल असलेला जलीय विद्राव हा व्यापारी दृष्ट्या संहत नायट्रिक अम्ल समजण्यात येतो. हा विद्राव वातावरणीय दाबाला स्थिर उकळबिंदू असणारा असतो. याचा उकळबिंदू १२०·५° से. असून वि. गु. १·४१ असते. ६८% पेक्षा कमी वा जास्त अम्ल असलेल्या सजल विद्रावाचे स्थिर उकळबिंदू असलेल्या विद्रावात रूपांतर करता येते. अतिसंहत वा शुद्ध अम्ल उकळल्यास अम्लाचे अपघटन होऊन पाणी तयार होते व वारंवार करण्यात येणाऱ्या ऊर्ध्वपातनामुळे स्थिर उकळबिंदूचे अम्ल तयार होते. ऊर्ध्वपातन करताना वापरण्यात येणाऱ्या दाबावर स्थिर उकळबिंदू अम्लाचे संघटन अवलंबून असते.
शुद्ध वा संहत नायट्रिक अम्लाच्या विद्रावाचे हळूहळू अपघटन होऊन पाणी, नायट्रोजन डाय-ऑक्साइड व ऑक्सिजन हे घटक वेगळे होतात. उच्च तापमान व प्रकाश यांमुळे अपघटनाचा वेग वाढतो. विद्रावात राहिलेल्या नायट्रोजन डाय-ऑक्साइडामुळे संहत नायट्रिक अम्लाला पिवळा रंग येतो. नायट्रिक अम्ल हे एक प्रबल अम्ल आहे. तसेच ते एक प्रभावी ऑक्सिडीकारक आहे. प्लॅटिनम, ऱ्होडियम, इरिडियम, टँटॅलम व सोने या धातू सोडल्यास सर्व धातूंचे या अम्लाने ऑक्सिडीभवन होते. बहुतेक सर्व धातूंपासून या अम्लामुळे नायट्रेटे मिळतात पण कथिल, आर्सेनिक, अँटिमनी, टंगस्टन व मॉलिब्डेनम यांपासून ऑक्साइडे मिळतात. लोह, तांबे वा क्रोमियम यांच्याशी नायट्रिक अम्लाचा संपर्क आल्यास धातूच्या पृष्ठभागावर धातूच्या ऑक्साइडाचे अतिपातळ असे पटल तयार होते. अशा धातूचे ⇨क्षपण होत नाही किंवा त्यावर अम्लाची विक्रिया होत नाही. हा गुणधर्म धातूचा पृष्ठभाग खरवडून, क्षपणकारकाची क्रिया करून किंवा प्रबल चुंबकीय क्षेत्राचा वापर करून नष्ट करता येतो.
वाफाळणारे नायट्रिक अम्ल पांढरे (९७%) अथवा तांबडे (८७%) असते. याचा उपयोग रॉकेटाच्या प्रचालक द्रव्यात (इंधनात) करण्यात येतो.
नायट्रिक अम्ल आणि विविध धातू यांच्यापासून धातूंच्या संयुजेनुसार [ इतर अणूंशी संयोग पावण्याच्या क्षमतेनुसार ⟶ संयुजा] विविध स्वरूपाची अकार्बनी नायट्रेटे तयार होतात. ती सर्वसाधारण तापमानाला स्फटिकीय असून पांढरी वा रंगीत असतात. बहुतेक सर्व नायट्रिक जलविद्राव्य (पाण्यात विरघळणारी) आहेत.
नायट्रिक अम्लाची क्षार (अल्कली), ऑक्साइडे इत्यादींबरोबर विक्रिया होऊन लवणे मिळतात. अमोनियाबरोबर त्याची विक्रिया होऊन अमोनियम नायट्रेट हे महत्त्वाचे खत तयार होते.
लोणारी कोळसा, लाकडाचा जळका भुस्सा, टर्पेंटाइन इत्यादींबरोबर त्याची जोरदार विक्रिया होते, तर अल्कोहॉलाबरोबर संहत अम्लाची स्फोटक विक्रिया होते. ज्यात –OH गट आहे अशा संयुगांबरोबर व अल्कोहॉलाबरोबर विक्रिया होऊन कार्बनी नायट्रेटे व पाणी तयार होते. सल्फ्यूरिक व नायट्रिक अम्ल यांच्या मिश्रणाबरोबर ग्लिसरॉलाची विक्रिया होऊन ⇨नायट्रोग्लिसरिन हे स्फोटक संयुग मिळते. नायट्रिक अम्ल व सेल्युलोज यांची विक्रिया होऊन वापरण्यात येणाऱ्या नायट्रिक अम्लाच्या प्रमाणानुसार गन कॉटन, पायरोक्सिलीन इ. पदार्थ मिळतात. सल्फ्यूरिक व नायट्रिक अम्लांचे मिश्रण आणि टोल्यूइन यांची विक्रिया होऊन ⇨ ट्रायनायट्रोटोल्यूइन (टीएनटी) हे स्फोटक संयुग मिळते.
मानवी शरीरावरील परिणाम व उपाय : नायट्रिक अम्लाची वाफ अत्यंत विषारी असते तसेच अम्लही संक्षारक असून शरीरावर जखमा करू शकते. निष्काळजीपणाने अम्ल हाताळल्यास गंभीर हानी व क्वचित मृत्यूही ओढवतो. अम्लाची संहती, विषबाधेची चिन्हे व लक्षणे, जखमेचे स्वरूप, अम्लाचा संपर्क काळ इ. गोष्टींवर शरीरहानीचे प्रमाण अवलंबून असते. अम्लाच्या वाफेचे हवेतील प्रमाण दहा लाख भागात २५ इतके असल्यास व आठ तास संपर्क राहिल्यास गंभीर स्वरूपाची फुप्फुस विकाराची लक्षणे ५–४८ तासांत दिसून येतात. अम्लाच्या वाफेचे प्रमाण १००–१५० भाग झाल्यास ३०–६० मिनिटांतच फुप्फुसशोफ (फुप्फुसातील वायुकोश व इतर भागांत द्रवाचा संचय होणे) होतो. २००–७०० भाग इतके प्रमाण झाल्यास अत्यल्प काळात फुप्फुसशोफ होऊन मृत्यू येतो. वाफ श्वसनमार्गात शिरताना वेदना वा अस्वस्थपणा जामवत नाही आणि बऱ्याच तासांनंतर मात्र लक्षणे दिसू शकतात.
द्रवरूप अम्लाचा त्वचेशी वा श्लेष्मकलेशी (शरीरातील विविध पोकळ्यांच्या पातळ अस्तराशी) संपर्क येताच संपर्क काल व अम्ल संहती यांनुसार संपर्काच्या जागेतील ऊतकांचा (पेशीसमूहांचा)नाश होतो. वेदना होणे, जळजळणे व संपर्काच्या ठिकाणचे ऊतक पिवळे होणे इ. लक्षणे दिसतात. संपर्क जास्त काळ राहिल्यास गंभीर भाजणे, चिरकारी (दीर्घकाल टिकणारा) व्रण उत्पन्न होणे आणि जखम बरी झाल्यास कायमचा वण राहणे इ. दुष्परिणाम दिसून येतात. हे अम्ल पोटात गेल्यास अन्नमार्ग आणि पोटात भाजल्यासारखे वाटते व रक्ती हगवण होते. काही वेळा मृत्यूही ओढवतो.
अम्लाशी संपर्क आलेली त्वचा वा श्लेष्मकला ताबडतोब पुष्कळशा स्वच्छ पाण्याने धुतात. अम्ल पोटात गेले असल्यास पुष्कळ कोमट पाणी, साबणाचे पाणी वा दूध प्यावयास देतात. उलटी आपोआप न झाल्यास उलटी करण्यास उद्युक्त करतात. पेज कच्च्या अंड्यातील पांढरा भाग गूह, ज्वारी इत्यादींच्या पिठाची खीर इ. प्यावयास देतात. यांपैकी कोणताही पदार्थ थोडा तरी पोटात राहीपर्यंत देतात कारण उलटी झाल्यास सर्वच बाहेर येण्याचा संभव असतो.
विषबाधेचा संशय आल्यास तात्काळ पुढील उपाय योजतात : (१) रोग्याला मोकळ्या व स्वच्छ हवेत हलवितात. (२) त्याला थोडेही श्रम करू देत नाहीत. (३) अंथरुणात पडून राहण्याची सक्त ताकीद देतात. (४) १००% ऑक्सिजन प्रत्येक तासात अर्धा तास या प्रमाणात सहा तास चालू ठेवतात. श्वसनक्रिया नैसर्गिक रीत्या चालू असल्यास खात्री करून मगच ऑक्सिजन बंद करतात. (५) ह्रदय रोग नसल्यास उच्छ्वास ४ सेंमी. पाण्याच्या धन दाबाविरुद्ध करावयास लावल्यास फुप्फुसशोफ होत नाही. (६) रोगी चोवीस तासांपर्यंत सतत वैद्यकीय देखरेखीखाली असणे जरूरीचे असते. वरील सर्व इलाज रुग्णालयातच करणे शक्य असल्यामुळे रोग्यास विषबाधेचा संशय आला तरीही रुग्णालयात ठेवणे हितावह असते.
उपयोग : नायट्रिक अम्ल हे एक औद्योगिक महत्त्वाचे रसायन आहे. खते, स्फोटक पदार्थ, रोगणे, कृत्रिम तंतू, रंजके इत्यादींच्या निर्मितीत नायट्रिक अम्ल मोठ्या प्रमाणावर वापरले जाते. धातुविज्ञान, फोटोएनग्रेव्हिंग (छायाचित्रणावर आधारलेली एक मुद्रण पद्धती), पोलादाचे कोरीवकाम, औषधे इत्यादींमध्ये अल्प प्रमाणात नायट्रिक अम्लाचा उपयोग करतात. तसेच वाफाळ नायट्रिक अम्लाचा उपयोग रॉकेट परिचालकात करण्यात येतो.
भारतीय उद्योग : भारतीय मानक संस्थेने नायट्रिक अम्लाच्या पुढील चार प्रती ठरविल्या आहेत : (१) तांत्रिक, (२) नायट्रीकरणास योग्य, (३) शुद्ध व (४) विश्लेषणात्मक. भारतात सार्वजनिक क्षेत्रातील काखान्यांत (उदा. सिंद्री, तुर्भे इ.) तसेच स्फोटक पदार्थांच्या कारखान्यांतून अमोनिया–ऑक्सिडीकरण पद्धतीने नायट्रिक अम्ल तयार करण्यात येते. त्यातील काही भाग व चिली नायट्रेटापासून तयार करण्यात येणारे नायट्रिक अम्ल यांचा उपयोग संरक्षणोपयोगी उद्योगधंद्यात करण्यात येतो. सार्वजनिक क्षेत्रातील फर्टिलायझर कॉर्पोरेशनतर्फे वर्षाला १,०३,२०० टन आणि हिंदुस्थान ऑर्गॅनिक केमिकल्स (रासायनी) या कारखान्यात १६,५०० टन (९८%) नायट्रिक अम्ल तयार करण्यात येते. या खेरीज ५ खाजगी कारखान्यांतही या अम्लाची निर्मिती करण्यात येते.
संदर्भ : 1. Faith, W. L. and Others, Industrial Chemicals, New York, 1965.
2. Riegel, E. R. Industrial Chemistry, Bombay, 1959.
3. Shreve, R. N. Chemical Process Industries, Tokyo, 1956.
कानिटकर, के. रा. भालेराव, य. त्र्यं.
“