रसायनशास्त्र : भौतिक शास्त्राची म्हणजे नैसर्गिक नियमांचा व प्रक्रियांचा (जिवंत द्रव्याशी निगडित असलेल्या वैशिष्ट्यपूर्ण नियमांच्या व प्रक्रियांच्या खेरीज करून) अभ्यास करणाऱ्या शास्त्राची ही एक शाखा आहे. पदार्थाचे संघटन, म्हणजे तो कोणत्या घटकद्रव्यांचा बनला आहे (उदा., पाण्याची घटकद्रव्ये ऑकिसजन व हायड्रोजन वायू), ती घटकद्रव्ये कशा प्रकारे एकत्रित झाल्यामुळे पदार्थ बनला आहे (उदा., पाण्याचा सूक्ष्मकण हा हायड्रोजनाचे दोन अतिसूक्ष्मकण एका ऑक्सिजनाच्या तशान अतिसूक्ष्मकणास जोडले गेल्यामुळे), घटकद्रव्यांत फरक झाल्यास पदार्थाच्या गुणधर्मांवर काय परिणाम घडतात, घटकद्रव्यांत बदल कसे घडविता येतात, ते होताना ऊर्जाबदल कसे होतात, त्याचप्रमाणे पदार्थाचे गुणधर्म व त्यांत पडणारे फरक इत्यादींसंबंधीचा अभ्यास या शास्त्रात करण्यात येतो. थोडक्यात म्हणजे या शास्त्रात पदार्थाचे गुणधर्म, संघटन व संरचना आणि यांत होणारे बदल व आनुषंगिक ऊर्जाबदल यांचा अभ्यास करण्यात येतो.
या शास्त्राचा ⇨भौतिकीशी फार जवळचा संबंध आहे. सुमारे सोळाव्या शतकापासून याला स्वतंत्र शास्त्रशाखेचे रूप येऊ लागले, त्यामुळे गणित व ज्योतिषशास्त्र यांसारखे हे शास्त्र फार जुने नाही.
अकार्बनी रसायनशास्त्र, कार्बनी रसायनशास्त्र, भौतिकीय रसायनशास्त्र, वैश्लेषिक रसायनशास्त्र व जीवरसायनशास्त्र हे यांचे प्रमुख विभाग समजले जातात. औषधी रसायनशास्त्र, अणुकेंद्रीय रसायनशास्त्र आणि विद्युत् रसायनशास्त्र यांचा उपविभाग म्हणून त्यात समावेश केला जातो. या प्रमुख विभागांवर आणि उपविभागांवर मराठी विश्वकोशात स्वतंत्र नोंदी आहेत. यांखेरीज आवर्त सारणी, उच्च तापमान रसायनशास्त्र, उत्प्रेरण ऊष्मारसायनशास्त्र, किमया, कृषी रसायनशास्त्र, केमर्जी, घन अवस्था रसायनशास्त्र, त्रिमितीय रसायनशास्त्र, न्याय रसायनशास्त्र, पुंज रसायनशास्त्र, पुरातत्त्वीय रसायनशास्त्र, भूरसायनशास्त्र, मूलद्रव्ये रसायनिक अभियांत्रिकी, रसायानिक उद्योग, रसायनिक गतिविज्ञान, लासायनिक विक्रिया, रसायनिक संयुगे, रसायनिक संरचना, रेडिओ रसायनशास्त्र, रेणवीय संरचना या रसायनशास्त्रातील महत्त्वाच्या विषयांवरही स्वतंत्र नोदी आहेत यांशिवाय विविध मूलद्रव्ये (उदा., क्लोरीन, लोखंड, सोने इ.), मूलद्रव्याचे गट (उदा., अक्रिय वायू, विरल मृत्तिका, संक्रमणी मूलद्रव्ये), कार्बनी संयुगांचे प्रमुख गट (उदा., अरोमॅटिक संयुगे, कार्बोहायड्रेट, हायड्रोकार्बने), विविध ऐकक क्रिया (उदा., अवसादन व निचरण, ऊर्ध्वपातन), महत्त्वाच्या रासायनिक विक्रिया (उदा., ऑक्सिडीभवन, ग्रीन्यार विक्रिया, क्षपण), विश्लेषणाच्या पद्धती (उदा., अनुमापन), प्रमुख रसायनशास्त्राज्ञ (उदा., डाल्टन, नागार्जुन, प्रीस्टली, प्रफुल्लचंद्र रे, हाबर), परिचित मुख्य संयुगे (उदा., क्लोरोफॉर्म, नवसागर, मोरचूद) वगैरेंवरही स्वतंत्र नोंदी आहेत. यांखेरीज औद्योगिक आणि नित्य व्यवहारातील महत्त्वाच्या विविध पदार्थांवर (उदा., खनिज तेल रसायने, दाहक सोडा, नायट्रिक अम्ल, प्लॅस्टिक व उच्च बहुवारिके, रंगलेप, रेझिने, शाई) स्वतंत्र नोंदी आहेत.
प्रस्तुत नोंदीच्या उर्वरित भागात रसायनशास्त्राच्या प्रगतीचा ऐतिहासिक आढावा घेतलेला असून रासायनिक संस्था, संघटना व आणि नियतकालिके यांविषयी थोडक्यात माहिती दिलेले आहे.
इतिहास : प्राचीन ते सोळाव्या शतकाअखेर : प्राचीन काळापासून (सु. १,०००) वर्षापूर्वीपासून मनुष्य अनेक रासायनिक कृतींचा उपयोग व्यवहारिक पदार्थ वनविष्यासाठी करून घेत आला आहे. उदा., विरजण लावून दूघाचे दही बनविणे, मद्ये तयार करणे, जनावरांची कातडी कमावून टिकाऊ व मृदू बनविणे वगैरे. अग्नीचा शोध लागल्यावर उष्णतेचा उपयोग करून धातुकांपासून (कच्च्या रूपातील धातूंपासून) शुद्ध धातू वेगळी काढणे, मिश्रधातू बनविणे यांसारख्या जास्त गूंतागुंतीच्या कृती मनुष्य घडवून आणू लागला. या उद्योगांसाठी ज्या प्रक्रिया वापरल्या जात त्या प्रत्यक्ष अनुभवाने मिळालेल्या माहितीवर व परंपरागत चालत आलेल्या पद्धतीवर आधारलेल्या असत. या कृतींची स्पष्टीकरणे गूढ व काल्पनिक असत.
निसर्गाचे काही नियम आहेत आणि त्यांना अनुसरून नैसर्गिक घडामोडी होतात, हे विज्ञानाला पायाभूत असलेले तत्त्व ग्रीकांनी इ. स. पू. ६००० वर्षे या सुमारास दृष्टोत्पत्तीस आणले. त्या काळच्या काही तत्त्वज्ञांची प्रथम अशी समजूत होती की सृष्टीतील पदार्थ जरी असंख्य असले, तरी सर्वांना मूलभूत असा एकच पदार्थ असावा. त्यानंतर काही काळाने दुसऱ्या तत्त्वज्ञांनी असे प्रतिपादन केले की, अशी चार मूलतत्त्वे असावीत ती म्हणजे पृथ्वी, आप, तेज व वायू ही होत. या प्रत्येक तत्त्वाचे काही गुणधर्म आहेत आणि वेगवेगळ्या प्रमाणात त्यांचे मिश्रण झाल्यामुळे पदार्थांमध्ये विविधता येते. ही मिश्रणाची प्रमाणे जर बदलली, तर एका पदार्थाचे दुसऱ्यात रूपांतर करणे शक्य होईल, असा तर्क त्यावरून करण्यात आला. त्याला अनुसरून तांव्यासारख्या किंमतीने कमी असलेल्या धातूचे सोन्यात रूपांतर करणे शक्य होईल, अशी कल्पना होती, या हेतूने काही धातुकारागिरांनी प्रयत्न आरंभिले व त्यांतूनच किमयेचा जन्म झाला [⟶ किमया]. किमयागारांचे दोन वर्ग, होते. एका वर्गातील किमयागार इष्ट साध्य करण्यासाठी मंत्रतंत्र, जादूटोणा व तत्सम गूढ मार्गाचा अवलंब करीत. दुसऱ्या वर्गाचे किमयागार निरनिराळ्या पदार्थांवर अनेक रासायनिक कृती करून तांब्याचे सोने करू पहात. किमयागारांचे प्रयत्न इ. स. पहिल्या शतकापासून सु. पंधराव्या शतकापर्यंत चालू होते. तथापि किमया साध्य झाली नाही परंतु वर उल्लेख केलेल्या दुसऱ्या वर्गातील किमयागारांच्या प्रयत्नांमुळे नवनवीन अम्लधर्मी व क्षारधर्मी (अम्लाशी विक्रिया झाल्यास लवणे देण्याचा गुणधर्म असलेले अल्कलाइन) पदार्थ, अनेक लवणे आणि इतर विक्रियाशील पदार्थ तयार करण्याच्या कृती मनुष्यास उपलब्ध झाल्या व नाना तऱ्हेची उपकरणेही माहीत झाली. त्यामुळे सोने बनविणे साध्य झाले नाही, तरी या नवीन पदार्थाचा उपयोग इतर व्यवहारात केला जाऊ लागला, तसाच तो रोग-निवारणासाठी करून पहावा अशी कल्पना निघाली. इ. स. १५०० ते १७०० या कालखंडात ⇨फिलिपस ऑरिओलस पॅरासेल्सस या स्विस वैद्यांनी त्या दृष्टीने प्रयत्न केले व यांच्या अनुयायांनी ते पुढे चालविले. या व्यावसायिकांना ‘इयॅट्रोकेमिस्ट’ म्हणतात. यांच्या प्रयत्नामुळे वनस्पती व त्यांपासून तयार केलेल्या औषधांच्या जागी किंवा यांच्या बरोबर नवीन रसायनिक पदार्थ वापरले जाऊ लागले. यांच्या अनुषंगाने विविध प्रक्रियांनी उपयुक्त पदार्थ बनविणे व ऊर्ध्वपातन (तापवून तयार झालेले बाष्प थंड करून मिश्रणातील घटक वेगळे करण्याची क्रिया) घडविणे इ. क्रिया प्रचारात आल्या व त्यांची वर्णन करणारी पुस्तकेही प्रसिद्ध होऊ लागली. अल्कोमिया हे अशा तऱ्हेचे पहिले पुस्तक म्हणता येईल. ते आन्ड्रेअस लिबॅव्हियस यांनी १५९७ मध्ये प्रसिद्ध केले. त्या काळी रसायनशास्त्राची व्याख्या ‘विक्रियाशील पदार्थ तयार करणे व मिश्रणातून घटकद्रव्ये वेगळी करणे यांसंबंधीचे ज्ञान’ अशी होती. पूर्वीच्या तत्त्ववेत्त्यांनी मांडलेली मते पडताळून पहावीत व कसोटीला उतरली तरच मान्य करावीत, अशी विचारसरणी सोळाव्या शतकाच्या अखेर मान्यता पावू लागली.
व्हॅनोसियो विरिनगुकिओ व जॉर्जिअस अग्रिकोला या सोळाव्या शतकातील धातुवैज्ञानिकांनी लिहिलेल्या ग्रंथात खनिज अम्ले, बंदुकीच्या तारूकरिता सॉल्ट पीटर, वस्त्रांच्या रंजनक्रियेसाठी तुरटी, काच व मिश्रधातू यांच्या निर्मितीसंबंधीची माहिती दिलेली आढळते.
भारतीय रसायनशास्त्र : प्राचीन काळी भारतात रसायनशास्त्र अल्प प्रमाणात होते. बुद्ध काळापासून (इ. स. पू. ६२३−५४३) या शास्त्रावर ग्रंथ आहेत. भारतीय रसायनशास्त्राची वाढ वैद्यकाची औषधी शाखा म्हणून झालेली आहे. धातूंची भस्मे बनविणे व त्यांचा रोग-निवारणासाठी, तसेच शारीरिक बल वाढविण्याकरिता कसा उपयोग करावा याचाच विचार त्यामध्ये मुख्यतः आहे.
रसायनाची योजना औषधे म्हणून करण्याची कल्पना बाहेरून भारतात आली, असे ग. कृ. गर्दे यांचे मत आहे. भारतीय रसायनशास्त्राची वाढ ग्रीकांशी संबंध आल्यानंतर झाली, असेही एक मत आहे पण रसायने अथर्ववेदाच्या काळापासून अव्याहत उपयोगात होती, असे प्रपुल्लचंद रे यांचे मत आहे.
भारतीयांना अप्रत्यक्षपणे सायट्रिक, टार्टारिक आणि ऑक्झालिक ही अम्ले व तत्सम कार्बनी अम्ले माहीत होती. त्याचप्रमाणे सल्फ्यूरिक, नायट्रिक इ. खनिज अम्ले भारतात तयार करीत. सर्व विद्रावक (सर्व द्रव्ये विरघळविणारे) जलराज (ऑक्वा फॉर्टिस) त्यांना माहीत होते. लोह, जस्त, ताम्रं यांच्या धातुकांपासून ती ती धातू वेगळी करण्याच्या क्रिया त्यांना अवगत होत्या. मोरचूद, तुरटी, हिराकस, रसकापूर (कॅलोमेल) इ. रासायनिक पदार्थ तयार करण्याचे कारखाने प्राचीन काळी भारतात होते. त्याचप्रमाणे शुद्ध धातूंपासून त्यांची ऑक्साइडे, सल्फाइडे, क्लोराइडे बनविण्याच्या कृतीही ते जाणत होते. आज रसायनशास्त्रज्ञ एखाद्या धातवीय संयुगात कोणती धातू आहे हे ओळखण्यासाठी जी ज्योत-कसोटी वापरतात [⟶ज्योत प्रखासमापन] तीही थोड्याफार प्रमाणात त्यांना माहीत होती. आधुनिक रसायनशास्त्रीय प्रयोगशाळेतील ऊर्ध्वपातन उपकरणाशी सादृश्य असलेले ऊर्ध्वपातन यंत्रही बनविण्यात आले होते. प्राचीन भारतीयांच्या अणू व परमाणूविषयक संकल्पना अनुक्रमे रेणू व अणू यांच्या व्याख्यांशी मिळत्याजुळत्या होत्या. मिश्रणे व संयुगे यांमधील भेद स्पष्ट करणारे अयुतसिद्धावयव (संयुग) व युतसिद्धावयव म्हणजे संयोग न पावलेले पदार्थ एकत्र असलेले मिश्रण हे पारिभाषिक शब्द वापरण्यात होते. पारा व गंधक यांच्या संयोगाने हिंगूळ बनविणे, पारा व मीठ यांपासून रसकापूर तयार करणे. रासयानिक संश्लेषण क्रियांशी त्यांचा परिचय होता. यावरून एवढे स्पष्ट दिसते की, मध्ययुगाच्या अखेरपर्यंत (इ. स. सु. १५००) भारतीयांना रसायनशास्त्राविषयक असलेली माहिती पाश्चात्त्यांपेक्षा जास्त होती.
सतरावे शतक : या शतकामध्ये ज्या महत्त्वाच्या घडामोडी झाल्या त्यांमध्ये मुख्यतः खालील गोष्टींचा समावेश होतो.
निरनिराळ्या मार्गांनी किंवा वेगवेगळ्या पदार्थांपासून बनविलेले कित्येक पदार्थ एकच आहेत हे दाखविण्यात आले. उदा., गॅस सिल्व्हेस्टर म्हणून त्याकाळी ओळखला जाणारा कार्बन डाय-ऑक्साइड हा वायू. तो लाकूड जाळल्याने निर्माण होतो, शंख-शिंपल्यावर विरल अम्लांची विक्रिया केल्यानेही बनतो. त्याचप्रमाणे धान्यांच्या किण्वन (आंबण्याच्या) विक्रियांमध्येही बाहेर पडतो. या तिन्ही प्रकारांनी बनणारा वायू एकच आहे, असे जे. वी. व्हान हेल्मॉट यांनी दाखविले.
अम्ल व क्षारक यांच्या विक्रयांमध्ये विक्रियासमाप्ती दाखविण्यासाठी वनस्पतिज रंगाचा उपयोग ⇨दर्शक म्हणून करता येतो, हे ⇨रोबर्ट बॉइल यांनी दाखविले. त्यांनीच पदार्थाच्या अभिज्ञानासाठी (ओळख पटवण्यासाठी) अवक्षेपण पद्धतीचा (न विरघळणारा साखा तयार करण्याच्या पद्धतीचा) वापर प्रथम केला. अशा प्रकारे गुणात्मक विश्लेषण आणि ज्यामध्ये रंगाचा उपयोग केला आहे अशा विश्लेषण पद्धतींचा पाया घातला गेला. तापमान कायम ठेवले, तर वायूच्या घनफळावर दाबाचा परिणाम कसा होतो याविषयीचा नियम त्यांनी शोधून काढला. १६६१ मध्ये त्यांनी स्केप्टिकल केमिस्ट हा ग्रंथ प्रसिद्ध केला. त्यात त्यांनी मूलद्रव्याची व्याख्या, ‘स्वयंभू, दुसऱ्या कोणत्याही द्रव्यांचे मिश्रण नसलेले व साधे द्रव्य’ अशी केली आहे. निर्वातात ज्वलन होत नाही त्यावरून ज्वलनाचा हवेशी संबंध असला पाहिजे, असे त्यांचे मत होते.
अठरावे शतक : वायूसंबंधीचे प्रयोग करणे त्या काळी कठीण असल्याने ज्वलनाविषयी जास्त माहिती मिळविता आली नाही. या वस्तुस्थितीमुळे ज्वलनाचे स्पष्टीकरण करू पाहणारी ‘फ्लॉजिस्टॉन’ उपपत्ती अठराव्या शतकात प्रचारात आली. ही उपपत्ती प्रथम जे. जे बेखर या जर्मन रसायनशास्त्रज्ञांनी सुचविली होती व तिचा विकास जी. ई. श्टाल यांनी केला. फ्लॉजिस्टॉन हे गूढ तत्त्व असून ते सर्व ज्वलनशील पदार्थामध्ये असते. पदार्थ जेव्हा जळतो तेव्हा ते बाहेर पडते. धातू तापविल्या असता त्यांची भस्मे बनतात तसेच कोळसा मिसळून धातूक तापविल्याने धातू निर्माण होतात. या विक्रियांचे स्पष्टीकरणही याच तत्त्वाचा उपयोग करून केले जाई.
या शतकात हवेचे घटक व इतर वायू यांसंबंधी वरेच मूलभूत संशोधन झाले. वायूसंबंधी प्रयोग करताना निर्माण केलेला वायू पुरेशा प्रमाणात जमा करून ठेवणे पूर्वी कठीण असे पण एस्. हेल्स यांनी वायु-द्रोणी हे उपकरण तयार केले व त्यामुळे हे कार्य सोपे झाले. ⇨जोसेफ ब्लॅक. यांनी असे दाखविले की, खडू किंवा मॅग्नेशिया अल्बा (मॅग्नेशियम कार्बोनेट) तापविला असता किंवा या पदार्थावर अम्लाची विक्रिया केली असता जो वायू (कार्बन डाय-ऑक्साइड) तयार होतो, त्याचाच संयोग कळीच्या चुन्याशी केल्यास खडू बनतो. या वायूला त्यांनी ‘स्थिर हवा’ (फिक्स्ड एअर) हे नाव दिले. ⇨हेन्री कॅव्हेंडिश यांनी या वायूची घनता, पाण्यातील विद्राव्यता (विरघळण्याची क्षमता) इ. गुणधर्मांचा अभ्यास केला. त्याचप्रमाणे १७६६ मध्ये हायड्रोजन वायू वेगळा करून त्याचा अभ्यास केला व त्याला त्यांनी ‘ज्वालाग्राही’ वायू हे नाव दिले.
इ. स. १७७४ मध्ये ⇨जोसेफ प्रीस्टली यांनी मर्क्यूरिक ऑक्साइड तापविले व निर्माण झालेला ऑक्सिजन वायू जमविला. याला त्यांनी ‘फ्लॉजिस्टॉनरहित हवा’ हे नाव दिले. ⇨कार्ल व्हिल्हेल्म शेले यांनी स्वतंत्रपणे हाच वायू बनवून त्याला ‘अग्नी वायू’ (फायर एअर) हे नाव दिले होते. अमोनिया, हायड्रोजन क्लोराइड, नायट्रोजनाची तीन ऑक्साइडे, तसेच सल्फर डाय-ऑक्साइड व दुसरेही कित्येक वायू प्रीस्टली यांनी बनविले व यांच्या गुणधर्मांचा अभ्यास केला.
या काळी फ्लॉजिस्टॉन उपत्तीचा पगडा असल्यामुळे शास्त्रज्ञ आपल्या शोधांची स्पष्टीकरणे या उपपत्तीच्या आधारानेच करीत परंतु क्रमाक्रमाने या उपपत्तीशी न जुळणारा भरपूर प्रायोगिक पुरावा उपलब्ध होऊ लागला. ⇨आंत्वान लॉरां लव्हॉयझर यांनी शिसे व कथिल तापविण्याचे (पूर्वी बॉइल यांनी वर्णिलेले) प्रयोग पुन्हा करून पाहिले. त्यांना असे दिसून आले की, तापविल्यानंतर मिळणारे पदार्थ मूळ पदार्थापेक्षा जड असून ते बनताना हवेच्या घनफळात घट येते. गंधक व फॉस्फरस यांवरील प्रयोगांचे निष्कर्षही असेच होते. लव्हॉयझर यांनी पारा तापवून प्रयोग केला तेव्हा त्यांना असे दिसून आले की, पाऱ्याचे तांबडे भस्म निर्माण झाले आणि त्याच वेळी मूळच्या हवेचे घनफळ सु. एक पंचमांशाने कमी झाले. जी हवा शिल्लक राहिली ती ज्वलनास साहाय्य करील अशी नव्हती. पाऱ्याचे तांबडे भस्म उच्च तापमानात तापविले तेव्हा पारा आणि प्रीस्टली यांनी वर्णन केलेली फ्लॉजिस्टॉनरहित हवा हे पदार्थ निर्माण झाले. या प्रयोगावरून लव्हॉयझर यांना असे वाटू लागले की, हा वायू हवेचा एक महत्त्वाचा घटक असावा आणि तोच धातूंबरोबर संयोग पावतो, तसाच ज्वलनशील पदार्थाशीही संयोग पावतो. गंधक, फॉस्फरस, कार्बन इ. अधातूंची प्रीस्टली यांनी वर्णिलेल्या वायूची संयुगे अम्लधर्मी असतात असे दिसून आल्यावर लव्हॉयझर यांनी या वायूला ‘अम्लजनक’ या अर्थाच्या ग्रीक शब्दांवरून ‘ऑक्सिजन’ हे नाव दिले. त्यांनी उष्ण लोखंडी नळीतून पाण्याची वाफ प्रवाहित केली. तेव्हा नळच्या आतील भागावर लोखंडाच्या गंजाचा थर चढला आहे आणि एक वायू नळीच्या टोकातून बाहेर पडत आहे असे त्यांना आढळले. या वायूला त्यांनी ‘जलजनक’ या अर्थाचे ‘हायड्रोजन’ हे नाव दिले. कॅव्हेंडिश यांनी यालाच ‘ज्वालाग्राही वायू’ असे नाव दिले होते.
आपल्या प्रयोगिक पुराव्याच्या आधारावर लव्हॉयझर यांन्ती १७८३ मध्ये फ्लॉडिस्टॉन उपपत्ती चुकीची असून ज्वलन व भर्जन (भाजणे) या क्रियांमध्ये हवेमध्ये असलेला ऑक्सिजन हा घटक ज्वलनशील पदार्थांशी किंवा धातूंशी संयोग पावतो व त्यांची ऑक्साइडे बनवितो असा सिद्धांत मांडला. या सिद्धांताला प्रथम अनेक प्रसिद्ध फ्रेंच रसायनशास्त्रज्ञांनी व यांच्या पाठोपाठ इंग्रज व जर्मन रसायनशास्त्रज्ञांनी मान्यता दिली तथापि प्रीस्टली हे मात्र फ्लॉडिस्टॉन उपपत्तीस चिकटून राहिले. नवोदित रसायनशास्त्रज्ञांना लव्हॉयझर यांचा सिद्धांत पसंत होता. लव्हॉयझर यांनी सी. एल्. बेर्ताले व इतर फ्रेंच रसायनशास्त्राज्ञांच्या सहकार्याने रसायनांच्या नामकरणात सुधारणा करण्याच्या दृष्टीने १७८७ मध्ये एक ग्रंथ लिहिला. त्यांनी परंपरागत नावांच्या जागी संयुगांची रसायनिक संघटन दर्शविणारी नावे अधिक पसंत केली. अकार्बनी रसायनशास्त्रात सध्या प्रचलित असलेल्या नामकरण पद्धतीला ही नामकरणपद्धती आधारभूत ठरली आहे.
याच शतकात निकेल, मँगॅनीज व मॉलिब्डेनम, युरोनियम, झिर्कोनियम, सिरियम, टेल्युरियम, टंगस्टन, इट्रियम, बेरिलियम, क्रोमियम, निओबियम टँटॅलम, पॅलॅडियम, र्होरडियम, ऑस्मियम व इरिडियम ह्या मूलद्रव्यांचा शोध लागला.
पदार्थाचे भारात्मक विश्लेषण करताना विक्रियाकारक शुद्ध असले पाहिजेत, विश्लेषणाकरिता घेतलेला नमुना प्रातिनिधिक असला पाहिजे आणि उपकरणे दूषित झालेली नाहीत याची काळजी घेतली पाहिजे इ. गोष्टींची रसायनशास्त्रज्ञांना जाणीव झाली व त्यामुले या विश्लेषण विभागाचा पाया घातला गेला.
एकोणिसावे शतक : या शतकात अणुसिद्धांताचा विकास झाला आणि मूलद्रव्यांचे अणुभार ठरविण्याचे प्रयत्न केले गेले. शुद्ध रासायनिक पदार्थाचे संघटन निश्चित असते का ते वेगवेगळे असू शकते याविषयी प्रथम एकवनाक्यता नव्हती. ⇨क्लोद ल्वी बेर्तॉले यांनी १८०३ मध्ये असे प्रतिपादन केले की रासयनिक पदार्थाचे संघटन, तो पदार्थ तयार करण्यासाठी वापरलेल्या विक्रियाकारकांच्या संहतिनुसार (प्रमाणानुसार) वेगवेगळे असते. तथापि ⇨झोझेफ ल्बी प्रूस्त यांनी शुद्ध रासायनिक पदार्थांचे काळजीपूर्वक विश्लेषण केले तेव्हा त्यांना दिसून आले की, त्यांची संघटने निश्चित असतात. बेर्ताले यांनी विश्लेषणासाठी वापरलेले पदार्थ अशुद्ध असावेत असा निष्कर्ष यामुळे निघाला आणि प्रूस्त यांचे मत ग्राह्य धरले गेले. यावरूनच ‘निश्चित प्रमाण नियम’ अस्तित्वात आला. रासायनिक संयोगाविषयीचा ‘गुणित प्रमाण नियम’ ⇨जॉन डाल्टन यांनी सुचविला, [⟶ रासायनिक विक्रिया].
अणुसिद्धांत : डाल्टन यांनी सुचवलेल्या अणुसिद्धांतानुसार सर्व मूलद्रव्ये सूक्ष्म व अविभाज्य कणांची बनलेली असतात. या कणांना अणू म्हणतात. प्रत्येक मूलद्रव्याचे स्वतःचे सर्व अणू द्रव्यमान व इतर गुणधर्मांत समान असतात पण दुसऱ्या मूलद्रव्यांच्या अणूपेक्षा वेगळे असतात. भिन्न अणूंचा संयोग होऊन संयुगे बनतात. डाल्टन यांचा अणुसिद्धांत व अणुभाराची संकल्पना रसायनशास्त्रात मूलभूत महत्त्वाची ठरली. [⟶ अणुभार अणु व आणवीय संरचना].
अणुभार : डाल्टन यांनी सापेक्ष अमुभारांचे महत्त्व ओळखले होते. त्यांनी हायड्रोजनाचा अणुभार एक आहे असे मानून त्या अणुभाराशी संयोग पावणारी दुसऱ्या मूलद्रव्याची वचने काढली व त्यांना त्या त्या मूलद्रव्याचे अणुभार समजून काही कोष्टकेही तयार केली होती. त्यात ऑक्सिजनाचा अणुभार समजून काही कोष्टकेही तयार केली होती. त्यात ऑस्किजनाचा अणुभार ५·५ दिला आहे. कारण त्या वेळी उपलब्ध असणाऱ्या विश्लेषणानुसार पाण्यामध्ये हायड्रोजनाच्या वजनी एक भागबरोबर ५·५ भाग ऑक्सिजन संयोगरूपाने होता आणि या संयुगात एका हायड्रोजन अणूबरोबर एक ऑक्सिजन अणू संयोजित आहे, अशी डाल्टन यांची समजूत होती. अणुभार निश्चित करण्यासाठी संयुगामध्ये असलेल्या मूलद्रव्यांच्या अणूंचे परस्परांशी संयोग पावण्याचे गुणोत्तर आणि त्यांची संयोग पावण्याची वजने या दोन्हींची गरज आहे परंतु संयुगांची सूत्रे (अणूंच्या संयोग पावण्याच्या गुणोत्तरावरून मिळणारी) त्या काळी उपलब्ध नव्हती व त्यामुळे अणूंचे संयोग-गुणोत्तर १:१ किंवा १:२ असे गृहीत धरून निश्चित केलेले अणुभार समाधानकारक नव्हते.
त्यानंतर ⇨झोझेफ ल्वीगे-ल्यूसँक या फ्रेंच रसायनशास्त्रज्ञांना असा शोध लागला की, तापमान व दाब समान असलेल्या स्थितीत मापन केल्यास विक्रिया पावणाऱ्या वायुरूप द्रव्याच्या घनफळांचे गुणोत्तर लहान पूर्णांकांनी दर्शविता येईल असे असते. यावरून सारख्या घनफळाच्या वायुरूप द्रव्यांत अणूंची संख्या सारखी असावी, असा त्यांनी तर्क केला. तथापि ही कल्पना मान्य केल्यास वरील प्रश्न सुटत नाहीत, असे दिसून आले. अखेरीस १८११ मध्ये ⇨आमेडेओ अव्होगाड्रो यांनी या अडचणीतून मार्ग काढील असा एक नियम सुचविला. यांच्या मते निरनिराळ्या वायूंच्या समान घनफळात अणूंची संख्या समान नसून, रेणूंची संख्या समान असते व वायूच्या रेणूमध्ये एकापेक्षा जास्त अणू असू शकतील. या नियमाच्या आधाराने प्रायोगिक निरीक्षणांचे स्पष्टीकरण होते, असेही त्यांनी दाखविले. तथापि अव्होगाड्रो यांचा नियम त्या काळी मान्यता पावला नाही. त्यानंतर ⇨यन्स याकॉप बर्झीलियस यांनी अतिशय काळजीपूर्वक प्रयोग करून अनेक मूलद्रव्यांचे अणुभार निश्चित करून प्रसिद्ध केले.
अणुभार निश्चितीसाठी उपयोगी पडेल असे एक निरीक्षण १८१९ मध्ये फ्रेंच रसायनशास्त्रज्ञ ⇨प्येअर ल्बी डुलाँग आणि आलेक्सी तेरेअझ पेटिट यांनी प्रसिद्ध केले. त्यांना असे दिसून आले की, मूलद्रव्याचा अणुभार व त्याची विशिष्ट उष्णता [⟶ उष्णता] यांचा गुणाकार एक स्थिरांक येतो. अणुभार निश्चित करताना जर अणुभाराची वेगवेगळी मूल्ये येत असतील, तर त्यांपैकी कोणते ग्राह्य मानावे हे ठरविण्यास हा नियम उपयुक्त ठरतो, असे आढळले.
असाच साह्यकारी होणारा एक नियम ⇨आइलहार्ट मिचर्लिख या जर्मन रसायनशास्त्रज्ञांनी प्रसिद्ध केला. अणुभार माहीत नसलेल्या एखाद्या मूलद्रव्याच्या संयुगांचे स्फटिक जर अणुभार निश्चित असलेल्या एखाद्या मूलद्रव्याच्या संयुगांच्या स्फटिकांशी समरूप (समाकृतिक) असतील, तर त्या मूलद्रव्यांच्या संयुगांची संघटन सूत्रे सारखी असतात, असा तो नियम आहे. संघटन सूत्र कळले म्हणजे मग अणुभार काढणे सोपे होते.
घन व द्रव पदार्थांची बाष्प घनता निश्चित करण्याची एक पद्धत ⇨झां बातिस्त आंद्रे द्यूमा यांनी बसविली.
बाष्प घनतेचा उपयोग करून एखाद्या मूलद्रव्याचा अणुभार निश्चित करण्यासाठी त्यांनी जी पद्धत सुचविली तिचे तत्त्व पुढीलप्रमाणे आहे. मूलद्रव्याच्या बाष्पाच्या घनतेस त्याच तापमान व दाबास असणाऱ्या हायड्रोजनाच्या घनतेने भागिले असता जो अंक येईल तोच अंक त्या मूलद्रव्याच्या रेणुभारास हायड्रोजनाच्या रेणुभाराने भागल्यास येईल. या नियमाने त्या मूलद्रव्याचा अणुभार मिळेल. रेणूमध्ये अणूंची संख्या किती हे मात्र निश्चित माहीत असले पाहिजे, अन्यया अणुभार चुकीचे येतील. अणुभारासंबंधीची अनिश्चित परिस्थिती अनेक वर्षे होती. १९६० नंतर संयुगांचे व मूलद्रव्यांचे रेणुभार निश्चित करणे साध्य होऊ लागले.
विद्युत् रसायनशास्त्र : इ. स. १८०० मध्ये ⇨आलेस्सांद्रे जुझेप्पेव्होल्टा यांनी असे दाखविले की, धातूंच्या दोन चकत्याच्या मध्ये मिठाच्या पाण्याने भिजविलेले कापड किंवा टीपकागद ठेवले व अशा अनेक चकत्या एकीवर एक रचून कडेच्या म्हणजे सर्वांत वरची व सर्वांत खालची या चकत्या तारेने जोडल्या, तर विद्युत् प्रवाह मिळतो. अशा प्रवाहाचा उपयोग करून विल्यम निकल्सन व अँथोनी कार्लाइल यांनी पाण्याचे अपघटन (घटकद्रव्यांचे अलगीकरण) घडविले. विजेच्या प्रावहाचा उपयोग पदार्थांचे रासायनिक अपघटन घडविण्यासाठी करता येतो आणि अशा अपघटनात हायड्रोजन व धातू हे ऋणाग्रापाशी आणि ऑक्सिजन व अम्लधर्मी पदार्थ धनाग्राशी जमतात, असे बर्जीलियस व ⇨सर हंफ्री डेव्ही यांनी निदर्शनास आणले. यावरून रासायनिक आकर्षण किंवा रासायनिक आसक्ती हिचे स्वरूप विद्युतीय असले पाहिजे, असा निष्कर्ष काढण्यात आला. बर्झीलियस यांनी या प्रयोगांच्या आधारे एक द्वैतवादी सिद्धांत मांडला. या सिद्धांतानुसार मूलद्रव्यांच्या अणूंना विशिष्ट ध्रुवता असते. विरुद्ध ध्रुवता असलेले अणू संयुगे पावतात व स्थिर संयुगे बनतात. काही संयुगांनाही ध्रुवता असते व त्यामुळे अशा संयुगांपासून जटिल संयुगे बनतात. हा सिद्धांत शेवटी व्यापक प्रमाणावर चुकीचा ठरला, तथापि त्याने रसायनशास्त्रीय विचारास अनेक दशके चालना दिली.
डेव्ही यांनी विद्युत् प्रवाहाचा उपयोग करून पोटॅशियम, सोडियम, बेरियम, स्ट्राँशियम, कॅल्शियम व मॅग्नेशियम या धातू यांच्या संयुगांतून वेगळ्या केल्या.
इ. स. १८३३ मध्ये ⇨मायकेल फॅराडे यांनी विद्युत् रासायनिक नियम शोधून काढले. त्यांना असे दिसून आले की, विद्युत् विच्छेदनात वापरलेली विशिष्ट विद्युत् राशी आणि तिने मुक्त केलेली मूलद्रव्याची राशी यांचा त्या मूलद्रव्याच्या सममूल्य भाराशी संबंध असतो. उदा., ज्या विद्युत् राशीने १ ग्रॅ. हायड्रोजन बाहेर पडेल, त्याच राशीने ८ ग्रॅ. ऑक्सिजन व ३५·५ ग्रॅ. क्लोरीन विद्युत् विच्छेदन होताना बाहेर पडेल.
रासायनिक चिन्हे : सध्या वापरण्यात असलेली मूलद्रव्ये, संयुगे इत्यादींची सांकेतिक चिन्हे ठरविण्याचे काम याच शतकात सुरू झाले. पूर्वी किमयागारांनी निरनिराळ्या पदार्थांसाठी सांकेतिक चिन्हे ठरविली होती पण ती पद्धतशीर नव्हती (उदा., सोने हे सूर्यासारखे तेजस्वी म्हणून त्याचे चिन्ह मध्यबिंदूसह वर्तुळ, चांदी चंद्रासारखी म्हणून तिचे चिन्ह चंद्रकोर). त्यानंतर डाल्टन यांनी मूलद्रव्यांसाठी निरनिराळ्या प्रकारची वर्तुळे (उदा., हायड्रोजनांकरिता मध्यबिंदूसह वर्तुळ, ऑक्सिजनांकरिता पोकळ वर्तुळ, कार्बनाकरिता भरीव वर्तुळ) सुचविली होती पण ती सोयीची नव्हती. मूलद्रव्याचा प्रचलित अगर लॅटिन वा इतर नावाचे पहिले अक्षर त्या त्या मूलद्रव्याचे सांकेतिक चिन्ह म्हणून वापरावे असे १९१४ मध्ये बर्झीलियस यांनी सुचविले. जेथे तेच आद्याक्षर निरनिराळ्या मूलद्रव्यांसाठी येण्याची शक्यता असेल, तेथे नावातील पहिली दोन (अथवा त्यापुढील) अक्षरे वापरून अडचणीचे निवारण केले जाई. अशा प्रकारे प्रचिलत नावांवरून आलेल्या चिन्हांची उदाहरणे म्हणजे क्लोरिनाकरिता CI (Ch/orine), फ्ल्युओरिनाकरिता F (Flourine), ॲल्युमिनियमाकरिता Al (Aluminium), बेरिलियमाकरिता Be (Beryllium), ऑक्सिजनाकरिता O (Oxygen) लॅटिन वा इतर नावांवरून आलेल्या चिन्हांची उदाहरणे म्हणजे सोन्याकरिता Au (Aurum), लोखंडाकरिता Fe (Ferrum), शिसाकरिता Pb (Plumbum) सोडियमाकरिता Na (Natrium), पोटॅशियमाकरिता K Kalium. ही चिन्हे एका किंवा दोन अक्षरांपासून बनलेली असून त्यांतील पहिले अक्षर नेहमी मोठे (कॅपिटल) व दुसरे (असल्यास) लहान (स्मॉल) लिहिले जाते. सर्व मूलद्रव्यांची चिन्हे ‘मूलद्रव्ये’ या नोंदीत दिलेली आहेत. रासायनिक संयोग दाखविण्यासाठी घटक मूलद्रव्यांची चिन्हे मधे अधिक चिन्ह (+) घालून त्या काळी लिहिली जात. सांकेतिक चिन्हांमुळे रासायनिक विक्रियांत भाग घेणारी मूलद्रव्ये व निर्माण होणारी संयुगे अथवा मूलद्रव्ये व्यक्त करणे फार सोयीचे झाले आहे.
अम्लांचे स्वरूप : अम्लांच्या रासायनिक स्वरूपांविषयी प्रथम कल्पना स्पष्ट नव्हत्या. लव्हॉयझर यांना असे दिसून आले की, अधातूंच्या ऑक्साइडांपासून अम्ले बनतात आणि त्यावरून ऑक्सिजनामुळे अम्लता येते, असे त्यांचे मत होते. हायड्रोक्लोरिक, हायड्रोसायनिक यांसारख्या अम्लांत ऑक्सिजन नाही म्हणून गे-ल्युसॅक यांनी अशा अम्लांसाठी हायड्रॅसीड ही संज्ञा सुचविली. डेव्ही यांचे मत असे होते की, अम्लता ही काही विशिष्ट मूलद्रव्य-समुच्चयावर अवलंबून असावी. डुलाँग यांना हे मान्य होते व त्यांनी सुचविले की, पाणी व अधातूचे ऑक्साइड (मूलद्रव्य समुच्चय) यांपासून अम्ले बनतात किंवा हायड्रोजन व अम्लगट यांपासूनही ती वनतात, असे मानता येईल.
इ. स. १८३० मध्ये ⇨टॉमस ग्रॅहॅम व ⇨युस्टुस फोन लीबिंग यांनी बहुक्षारकीय (विद्रावात ज्यापासून दोन अगर अधिक H⁺ आयन−विद्युत् भारित अणू−मिळतात अशा) अम्लांसंबंधी संशोधन केले. त्यातून फॉस्फोरिक अम्लाच्या लवणांच्या तीन श्रेणी पडतात व त्या H2O + P2O5 2H2O + P2O5 व 3H2O + P2O5 यांपासून बनणाऱ्या अम्लांच्या असतात, असे त्यांनी निदर्शनास आणले. आर्सेनिक अम्ले व आर्सेनेटे यांमध्येही असाच संबंध असल्याचे त्यांनी निदर्शनास आणले की, अम्लांमध्ये जो फरक दिसून येतो, तो त्यांमध्ये असणाऱ्या प्रतिष्ठापित होऊ शकतील (म्हणजे यांच्या जागा दुसरे अणू वा अणुगट घेऊ शकतील) अशा हायड्रोजन अणूंच्या संख्येवर अवलंबून असतो. हे लक्षात घेऊन तीन फॉस्फरोरिक अम्लांची सूत्रे HPO3, H4P2O7 व H3PO4 अशी मांडता येतात.
आवर्त सारणी : मूलद्रव्ये स्वयंभू असली, तरी त्यांचा व यांच्या संयुगांच्या गुणधर्माचा एकमेकांशी काही संबंध लावता येतो काय याविषयी शास्त्रज्ञ विचार करीत होते. १८२९ मध्ये जे. डब्ल्यू. डबेरायनर यांना असे दिसून आले की, मूलद्रव्यांचे अणुभार लक्षात घेऊन कित्येक मूलद्रव्यांची त्रिकुटे बनविता येतात. अशा त्रिकुटातील मधल्या मूलद्रव्याचा अणुभार पहिल्या व तिसऱ्या मूलद्रव्यांच्या अणुभारांच्या गणित माध्याइतका (सरासरीइतका) असतो याला ‘त्रिक नियम’ म्हणतात. कॅल्शियम, स्ट्राँशियम व बेरियम क्लोरीन, ब्रोमीन व आयोडीन ही अशा त्रिकुटांची उदाहरणे होत. या पद्धतीमुळे सारख्या गुणधर्माच्या मूलद्रव्यांची काही कुले करता आली परंतु याला अनेक अपवाद दिसून आल्यामुळे तिचा उपयोग फार मर्यादित झाला.
जॉन न्यूलँड्झ यांनी १८६५ मध्ये सप्तकाची एक कल्पना सुचविली. मूलद्रव्ये अणुभारांच्या चढत्या क्रमाने मांडली, तर त्यातील पहिले मूलद्रव्य व आठवे मूलद्रव्य त्याचप्रमाणे दुसरे, नववे आणि सोळावे मूलद्रव्य व त्यांची संयुगे यांमध्ये साम्य आढळते.
इ. स. १८६९ मध्ये ⇨दमित्री हव्हानव्ह्यिच मेडेलेव्ह यांनी असे निदर्शनास आणले की, मूलद्रव्ये अणुभारांच्या चढत्या क्रमाने लावली, तर काही अंतर गेल्यावर त्याच त्या गुणधर्माचे आवर्तन झालेले आढळते. या निरीक्षणाचा विकास करून एक ⇨आवर्त सारणी त्यांनी सिद्ध केली. आवर्त सारणीमुळे मूलद्रव्ये व त्यांचे गुणधर्म यांचे एकत्रीकरण करण्यात आले. विरल वायू हा मूलद्रव्यांचा एक समूह १८९० मध्ये आवर्त सारणीत समाविष्ट करण्यात आला. मूलद्रव्यांची रचना अशा तऱ्हेने का करता येते, हे विसाव्या शतकात अणूची संरचना स्पष्ट झाल्यावर कळून आले.
कार्बनी (सेंद्रिय) रसायनशास्त्र : खनिजांपासून मिळणारे पदार्थ आणि प्राणी व वनस्पती या सजीव सृष्टीतील (इंद्रिये असलेल्यांपासून मिळणारे) पदार्थ यांच्या संबंधीच्या रसायनशास्त्रात फरक आहे, हे व्यक्त करण्यासाठी सेंद्रिय रसायनशास्त्र ही संज्ञा प्रथम प्रचारात आली. कारण त्या काळी अशी कल्पना होती की, सजीव सृष्टीतील पदार्थांच्या निर्मितीसाठी एखाद्या जैवशक्तीची आवश्यकता असते. मानवाला प्रयोगशाळेत असे पदार्थ निर्माण करता येणार नाहीत. ही कल्पना १८२८ मध्ये यूरिया हा सेंद्रिय पदार्थ प्रयोगशाळेत तयार केला गेल्याने खोटी ठरली व सेंद्रिय रसायनशास्त्र म्हणजे कार्बन या मूलद्रव्याच्या रसायनशास्त्राचा विभाग आहे हे जाणून त्याचा उल्लेख कार्बनी रसायनशास्त्र असा केला जाऊ लागला [⟶ कार्बनी रसायनशास्त्र ].
इ. स. १८०० पूर्वी वनस्पती व प्राणी यांपासून फारच थोडे पदार्थ वेगळे करण्यात आले होते. त्यांमध्ये मुख्यतः शेले यांनी वेगळी केलेली ऑक्झॅलिक, मॅलिक, सायट्रिक, टार्टारिक, लॅक्टिक, यूरिक, गॅलिक, पायरोगॅलिक, म्युसिक व पायरोम्युसिक ही अम्ले आणि ग्लिसरीन यांचा समावेश होता. एच्.एम. रौले यांनी मानवी मूत्रातील यूरिया व गाईच्या मूत्रातील हिप्युरिक अम्ल हे पदार्थ वेगळे केले. त्यानंतर एकामागोमाग एक असे सजीव सृष्टीतील अनेक पदार्थ वेगळे करणे, ओळखणे व त्यांपासून सजीव सृष्टीत नसलेले पदार्थ बनविणे साध्य होऊ लागले. ग्लुकोज, सुक्रोज व फ्रुक्टोज या शर्करा ओळखल्या गेल्या. स्टार्च सल्फ्यूरिक अम्लाबरोबर उकळल्यास ग्लुकोज बनतो तसाच तो तागाच्या कापडाच्या चिंध्यांपासूनही बनविता येतो, असे दिसून आले. शर्करा, स्टार्च व सेल्युलोज यांच्या संघटनेतील हायड्रोजन व ऑक्सिजन यांचे प्रमाण दोनास एक म्हणजेच पाण्याच्या संघटनेत असते तसेच असते, असे गे-ल्युसॅक व एल्. जे. थेनार्ड यांनी विश्लेषणाने सिद्ध केले. यावरून १८४४ मध्ये कार्ल श्मिट यांनी या पदार्थांच्या वर्गाला कार्बोहायड्रेट ही संज्ञा दिली [⟶कार्बोहायड्रेटे ].
अशाच प्रकारे अनेक औषधशास्त्रज्ञांनी वनस्पतिज पदार्थांपासून कित्येक अल्कलॉइडे (उदा., मॉर्फीन, क्विनीन, सिंकोनीन, पायपरीन, कॅफीन, स्ट्रिक्नीन, ब्रूसीन इ.) वेगळी करून यांच्या रासायनिक व औषधी गुणधर्माचा अभ्यास केला.
इ. स. १९१०−२३ या कालखंडात एम्. ई. शव्ह्ररल या फ्रेंच रसायनशास्त्रज्ञांनी साबण बनताना कोणत्या रासयनिक क्रिया घडतात त्यांचे स्पष्टीकरण केले. त्यावरून वसा (स्निग्ध पदार्थ) ⇨वसाम्ले व ग्लिसरीन यांपासून बनलेली संयुगे आहेत, हे सिद्ध झाले. त्यांनी अनेक वसाम्लांचे वर्णन केले आणि कार्बनी पदार्थांचे परीक्षण करण्याची सर्वसाधारण तत्त्वे प्रस्थापित केली. शब्हरल यांनी या संशोधनात ज्या तांत्रिक क्रिया वापरल्या त्याही फार महत्त्वाच्या आहेत. नैसर्गिक पदार्थ वेगळे करताना यांच्या मूळच्या संरचनेत फरक पडू नये म्हणून निष्कर्षणासाठी अक्रिय (सहजपणे रसायनिक विक्रिया न होणारे) कार्बनी विद्रावक (विरघळविणारे द्रव पदार्थ) वापरणे आणि पदार्थाच्या शुद्धीकरणात घन पदार्थाचे स्फटिकीकरण, सर्वांत जास्त वितळबिंदू येईपर्यंत पुनःपुन्हा करणे अत्यंत महत्त्वाचे असेत, असे त्या संशोधनातून दिसून आले.
सजीव सृष्टीतील पदार्थ संश्लेषणाने (मूलद्रव्यांपासून किंवा साध्या संयुगांपासून कृत्रिम रीतीने) मानवास बनविता येतात हे ⇨फ्रीड्रिस व्हलर यांनी एक अमोनियम संयुग व एक सायनेट या अकार्बनी समजल्या जाणाऱ्या पदार्थावर केलेल्या प्रयोगाने अनपेक्षितपणे यूरिया मिळाल्याने सिद्ध झाले व त्यामुळे कार्बनी संयुगे संश्लेषणाने बनविण्याच्या प्रयत्नांना चालना मिळाली. १८६५ मध्ये ⇨प्येअर यूझेअन मार्सलां बर्थेलॉट यांनी कार्बन डायसल्फइड व हायड्रोजन सल्फिड ही मूलद्रव्यांपासून वनविता येणारी संयुगे वापरून मिथेन, एथिलीन व नॅप्थॅलीन यांसारखी संयुगे वनविता येतात, हे सिद्ध केले. तसेच कार्बन व हायड्रोजन यांपासून ॲसिटिलीन वायू बनविता येतो आणि ॲसिटिलीन वायू तापविलेल्या नळीतून प्रवाहित केला असता बेंझीन हे संयुग बनते हे १८६६ मध्ये दाखविले. बर्थेलॉट यांनी १८६० मध्ये प्रसिद्ध झालेल्या आपल्या ग्रंथात असे प्रतिपादन केले की, अकार्बनी रसायनशास्त्रातील पदार्थांपासून रसायनशास्त्रज्ञांना बनविता येईल. रसायनशास्त्रांतील जैवशक्तिवादी सिद्धांत यामुळे नष्ट झाला.
रसायनशास्त्रातील या प्रगतीमुळे अनेक प्रश्न निर्माण झाले. त्यांपैकी एक विशेष महत्त्वाचा म्हणजे संयुगांची रेणुसूत्रे ठरविण्याचा. त्यासाठी कार्बनी संयुगांतील कार्बन, हायड्रोजन, नायट्रोजन. मूलद्रव्यांचे रश्यात्मक विश्लेषण करण्याची आवश्यकता होती व त्याकरिता आतापर्यंत झालेले प्रयत्न अयशस्वी ठरले होते. १८३० मध्ये लीबिग यांनी विकसित केलेली पद्धत या दृष्टीने फार महत्त्वाची आहे. या पद्धतीमध्ये कार्बन व हायड्रोजन यांचे मापन करण्यासाठी वजन केलेला नमुना पदार्थ, कॉपर ऑक्साइड हे ऑक्सिडीकारक [⟶ ऑक्सिडीभवन ] भरलेल्या नळीमध्ये ठेवतात व नळीला उष्णता देऊन तो जाळतात. या ज्वलनात पदार्थातील हायड्रोजनापासून पाणी व कार्बनापासून कार्बन डाय-ऑक्साइड ही संयुगे बनतात. ती नळीच्या टोकातून बाहेर पडतात. नळीच्या या टोकाला पाणी शोषण करून घेईल अशा पदार्थ भरलेली शुष्खननलिका व कार्बन डाय-ऑक्साइड शोषून घ्यावा यासाठी पोटॅशियम हायड्रॉक्साइड भरलेला फुगा जोडलेला असतो. ही शुष्कन नलिका व फुगा प्रयोगापूर्वी वजन करून घेतलेले असतात. ज्वलनानंतर यांच्या वजनात जी वाढ होते, तीवरून त्या पदार्थापासून किती पाणी व किती कार्बन डाय-ऑक्साड निर्माण झाले हे कळते व आकडेमोड करून पदार्थातील कार्बन व हायड्रोजन यांची टक्केवारी काढता येते. नायट्रोजनाच्या मापनासाठी द्युमा यांनी एक पद्धत बसविली. या पद्धतीत कॉपर ऑक्साइड असलेल्या नळीत, कार्बन डाय-ऑक्साइडाच्या वातावरणात, पदार्थाचा वजन केलेला नमुना जाळला जातो. त्यामुळे निर्माण होणारा नायट्रोजन वायू आणि कार्बन डायऑक्साइड यांचे मिश्रण नळीच्या टोकातून बाहेर पडते. ते पोटॅशियम हायड्रॉक्साइडाच्या विद्रावातून जाते. तेथे कार्बन डाय-ऑक्साइड शोषला जातो व नायट्रोजन बाहेर पडतो. तो तेथे जोडलेल्या घनफळ मापन नळीमध्ये जमा केला जातो. या घनफळावरून नायट्रोजनाची टक्केवारी ठरविता येते, पदार्थातील ऑक्सिजनाचे प्रमाण प्रत्यक्ष ठरवीत नाहीत. इतर मूलद्रव्यांच्या शेकडा प्रमाणांची बेरीज करून ती १०० तून वजा केली म्हणजे ऑक्सिजनाचे शेकडा प्रमाण कळते. पदार्थामध्ये गंधक व हॅलोजने असतील, तर यांच्या मापनासाठी जी. एल्. कॅरियस या जर्मन रसायनशास्त्राज्ञांनी १८६४ मध्ये बसविलेली पद्धत उपयोगी पडते. या पद्धतीत वजन केलेला पदार्थ एका नळीत वाफाळ नायट्रिक अम्लाबरोबर व नळीची दोन्ही टोके बंद केलेल्या स्थितीत तापवितात. पदार्थातील गंधकाचे सल्फेटात रूपांतर होते. त्याचे मापन बेरियम सल्फेटाच्या रूपाने करतात व त्यावरून गंधकाचे प्रमाणात काढतात. हॅलोजनाचे रूपांतर याच पद्धतीने सिल्व्हर हॅलाइडात करून हॅलोजनाचे मापन केले जाते.
कार्बनी रसायनशास्त्रातील संयुगांच्या संघटनांसाठी एखादी एकीकृत पद्धत असावी या उद्देशाने द्यूमा व प्येअर बौले यांनी १८२८ मध्ये ‘मूलक सिद्धांत’ सुचविला. यांच्या मते C2H4 हे एक मुख्य मूलक आहे असे मानले, तर एथिल अल्कोहॉल, एथिल ईथर व एथिल एस्टरे ही या मूलकापासून पाणी, हायड्रोजन क्लोराइड इत्यादींबरोबर झालेली संयुगे आहेत, असे मानता येईल. १८३२ मध्ये लीबिंग व व्हलर यांनी कडू बदामाच्या तेलासंबंधीच्या संशोधनात बेंझाल्डिहाइड हे संयुग वेगळे केले व त्याच्या संघटनासाठी बेंझाइल (यांच्या कल्पने प्रमाणे C14H10O2) हे मूलक सुचविले. रासायनिक विक्रियांमध्ये मूलक कायम राहतात असा अर्थ ध्वनित होता [⟶ मूलके]. त्यानंतर मिथिल, एथिल, सॅलिसिल, ॲसिटील इ. अनेक मूलके सुचविण्यात आली. मूलके रासायनिक विक्रियांमध्ये अनेकदा जशीच्या तशी (बदल न होता) रहात असली, तरी त्यांच्या स्थैर्याला मर्यादा असतात, असे प्रयोगान्ती दिसून आले व त्यावरून द्यूमा यांनी १८३४ मध्ये प्रतिष्ठापनाचा नियम मांडला. या नियमानुसार एखाद्या हायड्रोजनयुक्त संयुगाचा क्लोरीन, ब्रोमीन, आयोडीन इत्यादींशी संपर्क येतो तेव्हा त्या संयुगातील हायड्रोजन अणू बाहेर पडतात बाहेर पडणाऱ्या प्रत्येक अणूच्या जागी एक एक क्लोरीन अणू त्याची जागा घेतो. १८३७ मध्ये ⇨ऑग्यूस्त लॉरां यांनी असे प्रतिपादन केले की, संयुगाचे गुणधर्म त्यामध्ये कोणते अणू आहेत यावरच केवळ अवलंबून नसतात, तर त्या संयुगातील केंद्रावर (म्हणजे भौतिक संरचनेवर) अवलंबून असतात. केंद्रातील अणूंचे प्रतिष्ठापन झाले, तरी संयुगाच्या गुणधर्मांत महत्त्वाचा बदल होत नाही.
इ. स. १८४० नंतरच्या दशकात अणुभारांच्या मूल्यांबाबत गोंधळ होता. त्यांनतर झां स्तास आणि द्यूमा यांनी काटेकोरपणे मापन करून जास्त परिशुद्ध अणुभार निश्चित केले.
इ. स. १८४९ मध्ये ⇨शार्ल आदोल्फ व्ह्यूर्त्स यांनी ⇨अमाइने ही कार्बनी संयुगे बनविण्याची पद्धत शोधून काढली. त्यांचे गुणधर्म अमोनियाप्रमाणे क्षारकीय असतात. यावरून ए. डब्ल्यू, फोन होफमान यांनी सुचविले की, त्यांचा अंतर्भाव अमोनियाच्या ‘प्रकारा’त करावा म्हणजे ज्यातील अमोनियामधील (NH3) एक, दोन व तीन हायड्रोजन अणूंचे प्रतिष्ठापन कार्बनी गटांनी केलेले असून त्यामुळे संयुगांचे क्षारकीय गुणधर्म नष्ट झालेले नाहीत अशा रेणू प्रकारात करावा.
अलेक्झांडर विल्यमसन यांनी ईथरे [⟶ ईथर−१] ही कार्बनी संयुगे बनविण्याची प्रक्रिया शोधून काढली तेव्हा या संयुगांचा व अल्कोहॉलांचा समावेश पाणी या ‘प्रकारा’त करावा असे त्यांनी सुचविले. कारण पाण्याच्या संरचनेतील एका हायड्रोजनाच्या जागी कार्बनी गट घातला म्हणजे अल्कोहॉलाची आणि दोन्ही हायड्रोजनांच्या जागी कार्बनी गट बसविले, तर ईथराच्या संरचना बनतात. सी. एफ्. झेरार यांनी असे आणखी काही प्रातिनिधिक ‘प्रकार’ही सुचविले.
संयुजा : रासायनिक संयुगांच्या वैशिष्ट्यांचा विचार करीत असता ⇨सर एडवर्ड फ्रँकलंड यांना आढळले की, मूलद्रव्यांचे अणू व अणुसमुच्चय यांची संयोगक्षमता (संयुजा) ठराविक असून ती लहान अंकांनी व्यक्त करता येते. उदा., हायड्रोजन, एथिल गट (C2H5), आयोडीन यांची ही क्षमता म्हणजेच संयुजा एक आहे. ऑक्सिजनाची संयुजा दोन असल्यामुळे ऑक्सिजनाच्या एका अणूची विक्रिया दोन हायड्रोजन अणूंबरोबर किंवा एक एथिल गट व एक हायड्रोजन अणू किंवा दोन एथिल गट यांबरोबर झाली पाहिजे. ही संयुजा-संकल्पना जरी सावकाश स्वीकारली गेली, तरी तिच्यामुळे संयुगाच्या रासायनिक सूत्रांचा अंदाज आगऊ करणे आणि त्यांचा अर्थ लावणे सोपे झाले. [⟶ संयुजा].
संयुजा-संकल्पनेच्या आधारावरच १८५८ मध्ये चार संयुजा असलेले कार्बन अणू एकमेकांशी संयोग पावून लांब साख्या बनवू शकतील, असे ⇨फोन श्ट्राडोनिट्स फ्रीड्रिख आउगुस्ट् केकूले यांनी सुचविले. अशीच कल्पना आर्चिबॉल्ड स्कॉट कूपर यांनाही सुचली होती तथापि केकूले यांचा यांसबंधीचा निबंध अगोदर प्रसिद्ध झाला, तसेच त्यांनी त्यात दुसऱ्याही काही संकल्पनांची भर घातली, त्यामुळे या संकल्पनेच श्रेय त्यांना दिले जाते.
रेणवीय संरचना : संयुजा-संकल्पनेचा आधार घेऊन संयुगांच्या रेणूंची संरचना म्हणजेच रेणूमध्ये अणूंची एकमेकांशी जोडणी कशी झालेली आहे हे स्पष्ट करणारी सूत्रे विकसित करण्याच्या कामात १८६० नंतर विशेषत्वाने कार्बनी रसायनशास्त्र विभागामध्ये प्रगती झाली. केकूले आणि रशियन रसायनशास्त्रज्ञ ए. एम्. बूटल्येरॉव्ह यांनी या कामी पुढाकार घेतला. या पूर्वीही काही थोड्या शास्त्रज्ञांनी संरचनांचा उपयोग केला होता.
संरचनामुळे अम्ले, अल्कोहॉले, अमाइने इ. विशिष्ट रासायनिक वर्गाच्या काही गुणधर्माचे स्पष्टीकरण झाले. इतकेच नव्हेतर ‘समघटकात’ या १८२० पासून असलेल्या आविष्काराचा बोध होऊ लागला कारण घटक व त्यांची संख्या जगी तीच असली, तरी संरचनाभिन्नत्वा मुळे एकापेक्षा अधिक संयुगे कशी होऊ शकतात, हे जास्त स्पष्ट झाले. [⟶ समघटकता].
एथिलीन (C2H4) व असिटिलीन (C2H2) या संयुगांमध्ये कार्बन अणूंच्या सर्व संयुजा तृप्त करण्यास पुरेशे हायड्रोजन अणू नाहीत. त्यामुळे यांच्या संरचना कशा मांडाव्या ही अडचण होती. ती दूर करण्यासाठी क्रम ब्राउन यांनी सुचविले की, एथिलिनामध्ये दोन कार्बन अणू दोन संयुजाबंध वापरून (द्विबंधाने) एकमेकांस जोडले गेले आहेत (सूत्र १). एमील एर्लेनमायर यांनी याच कल्पनेचा विस्तार केला आणि ॲसिटिलिनातील कार्बन अणूंसाठी त्रिबंध सुचविला (सूत्र २).
|
H |
H |
|||||||||||||
|
| |
| |
|||||||||||||
|
H |
− |
C |
= |
C |
− |
H |
H |
− |
C |
= |
C |
− |
H |
|
|
सूत्र १. एथिलीन द्विबंध |
सूत्र २. असिटिलीन त्रिबंध |
|||||||||||||
अशा संयुगांना असंतृप्त असे संबोधण्यात आले, कारण ही संयुगे ब्रोमीन, हायड्रोजन-ब्रोमाइड इ. विक्रियाकारकांना आपल्या संघटनातील अणू न गमावता आपल्या संरचनेत समाविष्ट करून घेतात. याच्या उलट इथेनासारख्या संयुगांच्या विक्रिया प्रतिष्ठापनाने होतात.
दगडी कोळशापासून प्रकाश देणारा वायू बनविताना जे डांबर मिळते त्यामध्ये बेंझीन हे द्रव्य असते, असे १८२५ च्या सुमारास दिसून आले. हेच फॅराडे यांनी देवमाशाच्या तेलाच्या वायूपासून वेगळे केले होते. १८६० नंतर याचे रेणुसूत्र C6H6 आहे असे सिद्ध झाले. यावरून त्यामध्ये मोठ्या प्रमाणात असंतृप्तता असली पाहिजे असे ध्वनित होते. तथापि त्याच्या विक्रिया असंतृप्त संयुगासारख्या नसून संतृप्त संयुगासारख्या आहेत, असे दिसून आले व त्याच्या संरचनेचे रेखाटन करण्यात पेचप्रसंग निर्माण झाला. १८६५ मध्ये हा प्रश्न केकूले यांनी सोडविला. त्यांनी सुचविले की, या संयुगाची संरचना प्रत्येक कोनाशी CH गट असलेल्या षट्कोनासारखी आहे व त्यामध्ये एका आड एक असे तीन द्विबंध आहेत (सूत्र ३). हे द्विबंध स्थिर नसून त्यांमध्ये अदलाबदल (स्पंदन) घडते व त्यामुळे बेंझीन असंतृप्त संयुगांसारख्या विक्रिया करू शकत
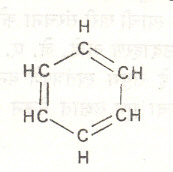 |
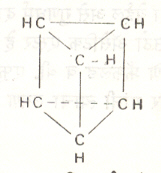 |
||
| सूत्र ३. केकूल यांची बेंझिनाची संरचना. | सूत्र ४. लाडेनबुर्ख यांची बेंझिनाची संरचना. |
नाही. द्विबंधाची गरज लागणार नाही अशी एक प्रचिन (लोलकासारखी) संरचना (सूत्र ४) आल्बेर्ट लाडेनबुर्ख यांनी सुचविली होती परंतु बेंझिनाच्या इतर विक्रियांशी ती सुसंगत ठरली नाही.
त्रिमितीय रसायनशास्त्र : काही संयुगे प्रकाशीय सक्रियता दाखवितात. टर्पेटाइन, लेमन ऑइल इ. तेले ध्रुवित (एकाच प्रतलांत कंपने होणाऱ्या) प्रकाशाचे वलन घडवितात [⟶ ध्रुवणमिति]. अमोनियम लवणाची दोन रूपे असून त्यांपैकी एक ध्रुवित प्रकाश उजव्या बाजूस, तर दुसरे तितकेच पण डाव्या बाजूस वळविते. याचे कारण यांच्या रेणवीय फरकात असावे अशी त्यांची कल्पना होती.
इ. स. १८७४ मध्ये ⇨याकोबस हेड्रिक्स व्हांट-हॉफ हे डच रसायनशास्त्रज्ञ व जे. ए. लबेल हे फ्रेंच रसायनशास्त्रज्ञ यांनी स्वतंत्रपणे संशोधन करून असे निदर्शनास आणले की, कार्बन अणूच्या चार संयुजा चतुष्फलकाच्या कोनाच्या दिशेने कार्यान्वित असतात व प्रकाशीय सक्रियतेत वरीलप्रमाणे फरक असणाऱ्या संयुगांच्या रेणूत निदान एक कार्बन अणू चार भिन्न अणूंना किंवा अणुसमुच्चयांना जोडलेल्या अवस्थेत (असममित) असतो. असममित कार्बन अणूला अणू अथवा अणुसमुच्चय दोन प्राकरे जोडता येतात आणि त्यमुळे ज्या संरचना होतात त्या बिंब व त्याचे आरशात पडलेले प्रतिबिंब अशा स्वरूपाच्या असतात. लॅक्टिक अम्लांची दोन रूपे अशाच तऱ्हेची आहेत.
काही असंतृप्त संयुगांची [उदा., C2H2 (COOH) 2 या सूत्राची] दोन रूपे आहेत व ती प्रकाशीय सक्रिय नाहीत. यांच्या संरचनांचे स्पष्टीकरण करण्यासाठी व्हांट-हॉफ यांनी सुचविले की, कार्बन अणू जेव्हा एकबंधाने जोडलेले असतात तेव्हा त्यांना बंधासभोवार फिरता येते परंतु द्विबंधाने जोडले असले म्हणजे त्यांना अडथळा येतो व फिरता येत नाही. त्यामुले त्या कार्बन अणूंना जोडलेल्या अणूंच्या अथवा अणुसमुच्चयांच्या दोन मांडण्या शक्य होतात. C2H2 (COOH) 2 या सूत्राची जी दोन अम्ले आहेत यांच्या संरचना खाली दिल्याप्रमाणे मांडता येतात.
|
H |
− |
C |
− |
CooH |
H |
− |
C |
− |
COOH |
|||||
|
|| |
|| |
|||||||||||||
|
H |
− |
C |
− |
COOH |
HOOC |
− |
C |
− |
H |
|||||
|
सूत्र ५. मॅलेइक अम्ल (समपक्ष) |
सूत्र ६. फ्यूमेरिक अम्ल (विपक्ष) |
|||||||||||||
व्हांट-हॉफ व ल बेल यांनी सुचविलेल्या संकल्पनांना संरचनात्मक दृष्टीने फार महत्त्व आहे. त्रिमितीय रसायनशास्त्रविषयक तत्त्वांचा उल्लेखनीय उपयोग ⇨एमील हेरमान फिशर यांनी शर्करांच्या संरचना ठरविताना केला. ग्लुकोजाच्या रेणूमध्ये चार असममित कार्बन अणू असल्यामुळे त्यांची संरचना ठरविताना सोळा समघटकांचा विचार करावा लागतो व त्यामुळे हे काम बरेच अवघड होते. [⟶ त्रिमितीय रसायनशास्त्र].
इ. स. १८६३ मध्ये संरचनेसंबंधीन आणखी एक प्रश्न शास्त्रीय जगापुढे आला. तो म्हणजे जेव्हा एकच संयुग दोन संरचनांनी दाखविता येईल असे गुणधर्म दाखविते, तेव्हा त्याची खरी संरचना कोणती? ॲसिटो ॲसेटिक एस्टर हे संयुग याचे उदाहरण आहे. जे. ए. म्यूथर आणि फ्रँकलंड व वी. एफ्. डुपा यांनी हे संयुग स्वतंत्रपणे बनविले. म्यूथर यांनी त्याचा लवण तयार करण्याचा गुण लक्षात घेऊन त्याला
|
OH |
||
|
| |
||
|
H3C−C=CH−COO C2H5 |
||
|
ईनॉल रूप |
||
ही संरचना सुचविली आणि फ्रँकलंड यांनी त्याचे गुणधर्म कीटोन वर्गाच्या संयुगासारखे आहेत असे आढळल्यावरून त्याला
|
O |
||
|
|| |
||
|
H3C−C=CH2−COOC2H5 |
||
|
कीटो रूप |
||
ही संरचना दिली, कोनराड लार यांनी १८८५ मध्ये या आविष्काराला टॉटोमेरिझम (चलसमघटकता) ही संज्ञा सुचविली. १९११ मध्ये लूटव्हिख क्नोर व कूर्ट मायर यांनी –७८° से. तापमान वापरून वरील दोन्ही संरचनांची संयुगे वेगळी केली. तापमान जसजसे वाढेल तसतसे एका हायड्रोजन अणूचे स्थानांतर होते आणि त्यामुळे एका संरचनेच्या संयुगापासून दुसरे निर्माण होते, असे याचे स्पष्टीकरण आहे. [⟶ समघटकता].
रंजकद्रव्ये : एकोणिसाव्या शतकाच्या उत्तरार्धात संश्लेषणाची अनेक तंत्रे विकसित करण्यात आली आणि त्यांचा उपयोग करून अनेक नैसर्गिक पदार्थ व त्याचप्रमाणे निसर्गात नसलेले पण उपयुक्त पदार्थ संश्लेषणाने बनविण्यात आले. त्यांमध्ये मॉव्ह हे ⇨सर विल्यम हेन्री पर्किन यांनी बनविलेले रंजकद्रव्य आणि ॲलिझरीन, नीळ इ. नैसर्गिक रंजकद्रव्यांचा अंतर्भाव होतो. [⟶ रंजक व रंजकद्रव्ये].
जीवरसायनशास्त्र : या काळी रसायनशास्त्रज्ञांचे लक्ष जैव सृष्टीतील केवळ पदार्थांकडेच होते असे नाही. त्यांना सृष्टीमध्ये पदार्थ निर्माण होण्याच्या ज्या प्रक्रिया आहेत यांच्याविषयीही जिज्ञासा होती. या हेतूने त्यांनी केलेल्या प्रयत्नांतून ⇨प्रकाशसंश्लेषण, वनस्पतींच्या वाढीसाठी लागणारी पोषक मूलद्रव्ये [⟶खते], अल्कोहॉली किण्वनामध्ये उपयोगी पडणारे एंझाइम (जीवरासायनिक विक्रिया घडून येण्यास मदत करणारे प्रथिन) आणि त्याचे स्वरूप [⟶ औद्योगिक सूक्ष्मजीवशास्त्र] यांविषयी बहुमोल माहिती मिळविण्यात आली.
भौतिकीय रसायनशास्त्र : पदार्थांचे भौतिक गुणधर्म व रासायनिक संरचना यांचा संबंध जोडण्याचे प्रयत्न हेरमान कोप यांनी १८४०−६० या दरम्यान केले. त्यानंतर त्यांनी असे दाखविले की, अल्कोहॉलाच्या समजात श्रेणीमधील संयुगांच्या [⟶ अल्कोहॉल] भौतिक गुणधर्मात पद्धतशीरपणे व नियमित प्रमाणात बदल होत जातात.
रासायनिक विक्रियांमध्ये होणाऱ्या उष्णता बदलाकडे रसायनशास्त्राज्ञांचे लक्ष पूर्वीपासून होते. रासायनिक आसक्ती व पदार्थ निर्माण होताना बाहेर पडणारी उष्णता यांचा संबंध जोडण्याचा प्रयत्नही काहींनी केला होता. ज्वलन-उष्णतेचा विस्तृत अभ्यास कोपनहेगनमधील एच्. पी. जे. टॉमसेन आणि पॅरिसमधील बर्थेलॉट यांनी केला. त्यांना असे दिसून आले की, पदार्थांच्या निर्मितीमध्ये बाहेर पडणारी उष्णता व त्या पदार्थाचे स्थैर्य यांचा एकमेकांशी संबंध असतो परंतु रासायनिक आसक्तीचा संबंध जोडता येत नाही.
रसायनशास्त्रात ⇨ऊष्मागतिकीचा उपयोग ए. एफ्. हॉर्स्टमान यांनी १८६८ मध्ये केला. त्यांनी द्रव पदार्थाच्या बाष्पदाबात तापमानाच्या बदलामुळे पडणाऱ्या फरकाच्या बाबतीत क्लॉसियसपिरॉन समीकरणाचा [सुप्त उष्णतेच्या पहिल्या समीकरणाचा ⟶ ऊष्मागतिकी] उपयोग केला. हे समीकरण त्यांनी कार्बोनेटे व हायड्रेटे यांच्या विगमनउष्णतेसही (रेणूंचे तुकडे होताना निर्माण होणाऱ्या उष्णतेसही) लावले. व्हांट-हॉफ यांनी या समीकरणाचे व्यापकीकरण केले. त्यामुळे वायू व विरल विद्राव यांच्या समतोल परिस्थितीला ते लावता येऊ लागले.
विषमांगी पदार्थांच्या समतोलावस्थेकरिता उष्मागतिकीचे उपयोजन ⇨जोसिआ विलर्ड गिब्ज यांनी केले. त्यांनी ⇨प्रावस्था नियमाचा प्रस्ताव केला. या नियमाने विषमांगी प्रणालीतील रासायनिक घटक आणि त्या प्रणालीचे वर्णन करण्यासाठी लागणाऱ्या उष्णता व दाब या परिस्थिती यांचा संबंध जोडला गेला. मिश्रधातूंचा अभ्यास करताना एच्. डब्ल्यू. वी. रोझेबोम यांनी या नियमाचा विस्तृत उपयोग केला.
व्हांट-हॉफ व फ्रेंच रसायनशास्त्रज्ञ एच्, एल्. ल शातल्ये यांनी ऊष्मागतिकीची तत्त्वे समांगी समतोलाला लावली. तापमान, दाब व संहती यांतील फरकामुळे एखाद्या प्रणालीत जे ताण निर्माण होतात व त्यामुळे जे फरक पडतात त्यांचे भाकीत करण्यासाठी त्यांचा उपयोग झाला. या तत्त्वांचा उपयोग करून ⇨फ्रिट्स हाबर यांनी वातावरणातील नायट्रोजन व हायड्रोजन यांपासून औद्योगिक प्रमाणावर अमोनिया निर्माण करण्यासाठी सर्वांत चांगली व व्यवहार्य परिस्थिती ठरविली.
ऊष्मागतिकी तत्त्वांच्या उपयोगाचा विस्तार करून १९०६ मध्ये ⇨व्हॉल्टर हेर्मान नेर्न्स्ट यांनी सुचविले की, पदार्थांची ⇨एंट्रॉपी निरपेक्ष शून्य तापमानास शून्य असते. हा सिद्धांत निर्विवादपणे सिद्ध झालेला नाही. तथापि तो मर्यादित भौतिकी स्थिरांकांच्या उपयोगाने रासायनिक प्रणालींचे समतोल ठरविण्यासाठी व्यापक प्रमाणावर वापरला गेला आहे. [⟶ ऊष्मागतिकी ऊष्मारसायनशास्त्र].
गत्यात्मक रेणवीय सिद्धांताचा विकासही या शतकात झाला. वायू हे गतिमान कणांचे बनलेले असावेत असा अंदाज निसर्ग तत्त्वज्ञांनी पूर्वी केला होता, तरी त्याचे खात्रीलायक विवेचन एकोणिसाव्या शतकाच्या मध्यापर्यंत झाले नव्हते. ते ⇨रूडॉल्फ युलिउस एमानुएल क्लॉसियस, ⇨बॅरन विल्यम टॉमसन केल्विन व ⇨जेम्स क्लार्क मॅकस्वेल यांच्या कार्याने झाले. वायू गतिमान रेणूंचे बनलेले आहेत, या रेणूंची गतिज ऊर्जा त्या वायूच्या तापमानाशी निगडित असते वे रेणूंचे एकमेकांवर होणारे आघात पूर्णपणे स्थितस्थापक (ज्यांत आघातापूर्वी व आघातानंतर गतिज ऊर्जांची बेरीज कायम राहाते असे) असतात या गत्यात्मक सिद्धांतातील गृहीतकांचा उपयोग करून बॉइल यांचा नियम. चार्ल्स यांचा नियम, ग्रॅहॅम यांचा वायु-विसरणाचा नियम व ॲव्होगाड्रो यांचे गृहीतक यांसारख्या सुपरिचित नियमांचे अनुमान करणे श्क्य झाले [⟶स्थिति समीकरण विसरण]. अती उच्च दावाखाली किंवा अती नीच तापमानास वायूंचे वर्तन वायूंच्या नियमांशी विसंगत असते. ⇨योहानेस डीडेरिक व्हॅन डर व्हाल्स यांनी असे प्रतिपादन केले की, त्या घन-संकुलित (परस्परांच्या अतिशय निकट असलेल्या) रेणूंनी व्यापलेले घनफळ आणि घन-संकुलनामुळे रेणूंमध्ये एकमेकांबद्दल निर्माण झालेले आकर्षण यांचा विचार केल्यास वरील विसंगतीचे स्पष्टीकरण मिळते. [⟶ द्रव्याचा गत्यात्मक सिद्धांत].
गत्यात्मक सिद्धांताचे महत्तव वायूंच्या द्रविकरणातही आहे. फ्रान्समध्ये ऑक्सिजन व नायट्रोजन यांचे प्रथम द्रवीकरण १८७७ मध्ये करण्यात आले. या प्रक्रियेचा मोठ्या प्रमाणावर वापर ⇨जेम्स देवार (डयूअर) यांनी लंडन येथे आणि एस्. एफ. फोन व्ह्रूब्लेफ्स्की व के. एस्. ओल्सझेवस्की यांनी क्रेको (पोलंड) येथे केला. हीलियमाचे द्रवीकरण मात्र १९०७ मध्ये लायडन येथील ⇨हाइके कामलिंग ऑनेस यांनी केले. [⟶ वायूंचे द्रवीकरण].
योहान हिटोर्फ यांनी १८५७ मध्ये असे निदर्शनास आणले की, विद्रावातून विद्युत् प्रवाह जात असताना काही आयन इतर आयनांपेक्षा जास्त त्वरेने प्रवास करतात. त्यांनतर १८७४ मध्ये ⇨फ्रीड्रिख व्हिल्लहेल्म गेओर्ख कोलरॉउश यांनी दाखविले की, प्रत्येक आयनास विशिष्ट गतिशीलता असते. ⇨स्वांट ऑगस्ट अऱ्हेनियम यांनी १८८४ मध्ये आयनीभवन हा महत्त्वाचा सिद्धांत मांडला. या सिद्धांतानुसार लवणे, अम्ले व क्षारक पाण्यात विरघळतात तेव्हा त्यांचे विगमन होऊन विद्युत् भारित कण (आयन) बनतात व त्यामुळे विद्रावातून विद्युत् प्रवाह पार जातो. आयनाचा जेव्हा त्याच्या विरुद्ध विद्युत् भार असलेल्या विद्युत् अग्राशी संपर्क येतो तेव्हा त्याचा विद्युत् भर नाहीसा होतो आणि तो आयन जर धातवीय असेल, तर त्याचा निक्षेप (थर) विद्युत् अग्रावर बसतो. आयन जर धातवीय असेल, तर त्याचा निक्षेप (थर) विद्युत् अग्रावर बसतो. आयन जर अधातूचा असेल, तर वायुरूपाने निघून जातो. विजेचा प्रवार पार जाऊ न देणाऱ्या साखर, अल्कोहॉल यांसारख्या विद्रुतांपेक्षा (विरघळणाऱ्या पदार्थांपेक्षा) लवणांचा परिणाम विद्रावकाचा तर्षणदाव [⟶ तर्षण], बाष्पदाब, वितळबिंदू व उकळबिंदू यांवर जास्त होतो याचे स्पष्टीकरण अऱ्हेनियस यांच्या सिद्धांतांने होते. आयनीभवन सिद्धांतामुळे विद्रावांच्या स्वरूपाविषयीच्या ज्ञानात मोठी प्रगती झाली. [⟶ विद्राव विद्रावक विद्युत् विच्छेदन].
किरणोत्सर्गाचा शोध : युरेनियम हे मूलद्रव्य उत्स्फूर्तपणे क्ष-किरण सदृश प्रारण (तरंगरूपी ऊर्जा) बाहेर फेकते असा शोध या शतकाच्या अखेरच्या काळात लागला. ⇨आंत्वान आंरी बेक्रेल हे प्रस्फुरक (विद्युत् चुंबकीय प्रारण वा अन्य क्षोभकारक कारणामुळे प्रकाशाचे उत्सर्जन करणाऱ्या) पदार्थांचा अभ्यास करित असताना आकस्मिकतपणे यांच्या हे निदर्शनास आले. त्यानंतर लवकरच हे स्पष्ट झाले की, युरेनियमाच्या सर्व प्रकारांत हा आविष्कार आढळतो. थोरियमाची संयुगेही किरणोत्सर्गी असतात असे ⇨मारी क्यूरी यांना आढळले आणि पुढे त्या व त्यांचे पती ⇨प्येअर क्यूरी यांनी पोलोनियम व रेडियम ही किरणोत्सर्गी मूलद्रव्ये वेगळी केली. [⟶ किरणोत्सर्ग].
विसावे शतक : रेडिओ रसायनशास्त्र : किरणोत्सर्गी मूलद्रव्यांचा अभ्यास केल्यावर १८९९ मध्ये ⇨अर्नेस्ट रदरफर्ड व त्याचे सहकारी यांना असे दिसून आले की,या मूलद्रव्यांपासून निघणारी प्रारणे एकविध (एकसारखी) नाहीत. त्यामध्ये एक सहज शोषला जाणारा भाग (आल्फा कण), एक चुंबकीय क्षेत्राने विचलित होणारा जास्त भेदनक्षम भाग (बीटा कण) आणि क्ष-किरणांसारखा अत्यंत भेदनक्षम असा एक भाग (गॅमा किरण) आहेत. सर जोसेफ जॉन टॉमसन यांना १८९७ मध्ये वायूतील विद्युत् विसर्जनाचा अभ्यास करीत असता जे ऋण विद्युत् भारित कण (इलेक्ट्रॉन) सापडले होते यांच्याशी बीटा कण समरूप होते. हीलियम वायूचे किरणोत्सर्गी पदार्थांशी साहचर्य असते, त्यावरून हीलियमाचा आल्फा कणांशी संबंध असावा, अशी शंका होती. १९०३ मध्ये ⇨सर विल्यम रॅम्झी हे इंग्रज संशोधनक व त्यांचे सहकारी ⇨फ्रेडरिक सॉडी यांना असे दिसून आले की, रेडियम क्लोराइडामधून हीलियम स्थिर वेगाने बाहेर पडत असतो. रदरफर्ड व टॉमस रॉइड्स यांनी आल्पा कण हे दुप्पट धन विद्युत् भार असलेले हीलियम आयन असतात, असे सिद्ध केले. युरेनियम व रेडियम यांचा क्षय होताना जे पदार्थ निर्माण होतात त्यांमधील किरणोत्सर्गी मूलद्रव्ये याच वेळी संशोधिली जात होती. रदरफर्ड व सॉडी यांनी थोरियमापासून थोरियम-एक्स हे एक किरणोत्सर्गी द्रव्य वेगळे केले, त्या वेळी निष्क्रिय थोरियम शिल्लक राहिले. थोरियम-एक्सची क्रियाशीलता क्रमाक्रमाने कमी होत होती त्याच वेळी थोरियम पुन्हा क्रियाशील होत होते. अनेक प्रयोगशाळांत किरणोत्सर्गी वायू वेगळे केले गेले. किरणोत्सर्गी द्रव्यापैकी निम्म्या द्रव्याचा क्षय होण्यास लागणाऱ्याय काळाने, व्यक्त करता येते. [⟶ किरणोत्सर्ग रेडिओ रसायनशास्त्र].
समस्थानिकांचा शोध : क्षय पावणाऱ्या किरणोत्सर्गी द्रव्यांपासून वेगळ्या केलेल्या मूलद्रव्यांचे अभिज्ञान केले तेव्हा माहीत असलेल्या मूलद्रव्यांशी त्यांचे साम्य दिसून आले. उदा., रेडियमाच्या क्षय श्रेणीतील रेडियम-डी हे किरणोत्सर्गी द्रव्य सामान्य शिशाशी मिश्र केल्यावर वेगळे करता येईना. रदरफर्ड व इतर संशोधक यांना असा संशय येऊ लागला की, किरणोत्सर्गी मूलद्रव्यांचे विघटन होऊन इतर मूलद्रव्ये बनत असावीत, काझिमीर फायान्स यांनी किरणोत्सर्गी धातुकापासून मिळविलेले शिसे व सामान्य धातुकापासून मिळविलेले शिसे यांच्या अणुभारांची काळजीपूर्वक निश्चिती केली, तेव्हा त्यांमध्ये फरक दिसून आला आणि त्यावरून मूलद्रव्याचे सर्व अणू सारखे नसतात, असे डाल्टन यांच्या सिद्धांताशी विसंगत मत सूचित झाले. १९१३ मध्ये द्रव्यमानात फरक असलेल्या परंतु इतर गुणधर्मांत साम्य असलेल्या मूलद्रव्यांच्या अणूंसाठी सॉडी यांनी आयसोटोप (समस्थानिक) ही संज्ञा सुचविली. याच वेळी फायान्स, सॉडी व ए. एस्. रसेल यांनी स्वतंत्रपणे किरणोत्सर्गी स्थानांतराचा नियम प्रस्थापित केला. या नियमाने किरणोत्सर्गी अणूचा क्षय होताना वनणाऱ्याण अणूच्या स्वरूपाचे भाकीत करता येते. जे.जे. टॉमसन व ⇨फ्रान्सिस विल्यम ॲस्टन यांनी द्रव्यमान वर्णपटलेखक [⟶ द्रव्यमान वर्णपटविज्ञान]. हे मूलद्रव्याच्या अणूंच्या द्रव्यमानांच्या फरकावरून अणू वेगळे करणे व त्यांची नोंद करणे हे कार्य करणारे उपकरण बनविल्यावर समखानिकाची संकल्पना स्थिर मूलद्रव्यासही लागू पडते, असे दिसून आले.
अणूपेक्षा लहान कण : किरणोत्सर्ग या आविष्कारावरून असे दिसून येते होते की, अणू म्हणजे अभिभाज्य सूक्ष्म कम ही संकल्पना सोडली पाहिजे. सर्व मूलद्रव्यांमद्ये इलेक्ट्रॉन असतात, असे दिसून येत होते. १९११ मध्ये रदरफर्ड यांचे साहाय्यक हान्स गायगर व एर्न्स्ट मार्सडेन यांनी सोन्याच्या बर्खावर आल्फा कणांचा भडिमार केला, तेव्हा कणांचे प्रकीर्णन (विखुरणे) विशिष्ट तऱ्हेने झाले आहे, असे त्यांना आढळून आले. त्यावरून रदरफर्ड यांनी असा निष्कर्ष काढला की, अणूमध्ये धन विद्युत् भार असलेले अणुकेंद्र असून त्याच्या सभोवार सूर्यमालेतील ग्रह सूर्याभोवती फिरंतात तसे इलेक्ट्रॉन फिरत असावेत, त्यांची अशी समजूत होती की, अणूचे सर्व द्रव्यमान अणुकेंद्रात केंद्रित झालेले असावे आणि हे अणुकेंद्र अणूपैकी फारच थोडी जागा व्यापीत असावे व बाकी सर्व रिक्तावकाश असावा.
रदरफर्ड यांनी सुचविलेले अणूचे प्रतिमान (मॉडेल) रूढ ⇨विद्युत् गतिकीशी विसंगत होते, कारण भ्रमण करीत असलेल्या इलेक्ट्रॉनाची ऊर्जा त्वरेने कमी होत जाऊन तो अणुकेंद्रात पडण्याची शक्यता आहे. ⇨नील्स बोर यांनी ⇨पुंज सिद्धांताच्या भूमिकेतून विचार करून हायड्रोजन बदल विशिष्ट ऊर्जा पातळव्यांमध्ये होणाऱ्या इलेक्ट्रॉन स्थलांतरापुरता मर्यादित होता. या प्रतिमानाच्या योगाने हायड्रोजन अणूतील इलेक्ट्रॉनांचे मार्ग आणि हायड्रोजनाच्या वर्णपटातील शोषण व उत्सर्जन रेषा यांचा संबंध त्यांना जोडता आला. बोर यांची अणु-संकल्पना अनेक आसन्नीकरणांचा (यथायोग्य उत्तराच्या समीप जाण्याच्या प्रक्रियांचा) समावेश केल्यावर इतर मूलद्रव्यांना लावता आली. ⇨ल्वी व्हीक्तॉर द ब्रॉग्ली व ⇨एर्व्हीन श्रोडिंजर यांच्या तरंग यामिकीय [⟶ पुंजयामिकी] विवरणामुळे आणि ⇨व्हेर्नर कार्ल हायझेनबेर्क यांच्या आव्यूह यामिकीय [⟶ पुंजयामिकी] विवरणामुळे १९२० नंतरच्या दशकात अणूंची प्रतिमाने अधिकाधिक गणिती बनली. [⟶ अणुकेंद्रीय भौतिकी अणु व आणवीय संरचना].
रदरफर्ड यांनी अणुकेंद्राचे द्रव्यमान त्यावरील विद्युत् भार यांचा विचार प्रथम अनुभवजन्य तऱ्हेने केला, १९१३ मध्ये ⇨हेन्रीड गिवनजेफ्रिझ मोझली यांनी असे दाखविले की, अणुक्रमांक(आंतापर्यंत आवर्त सारणीतील स्थानाशी संबंधित असलेले) याला भौतिक महत्त्व आहे. त्यांनी क्ष-किरण नलिकेत निरनिराळी मूलद्रव्ये लक्ष्य म्हणून वापरली, तेव्हा त्यांना असे आढळले की, त्यांपासून मिळणाऱ्या क्ष-किरणांच्या प्रमुख तरंगलव्यांची मूल्ये एखादे मूलद्रव्य आवर्त सारणीतील त्याच्या पूर्वीच्या मूलद्रव्याऐवजी वापरले असता, पद्धतशीरपणे कमी होतात.
नायट्रोजनावर आल्फा कणांचा भडिमार केला असता त्याचे ऑक्सिजनात रूपांतर होते व प्रोटॉनांचे उत्सर्जन होते, असे १९१९ मध्ये रदरफर्ड यांना आले. सामान्य हायड्रोजनाचे अणुकेंद्र म्हणजे प्रोटॉन याचा शोध लागल्यावर अणुकेंद्रावरील धन विद्युत् भाराचा हिशोब लावणे शक्य झाले. १९३१ मध्ये ⇨सर जेम्स चॅडविक यांनी न्यूट्रॉन मिळून अणुकेंद्राचे एकूण द्रव्यमान होते, हे स्पष्ट झाले.
बंध उपपत्ती : रासायनिक संयोग पावणाऱ्या मूलद्रव्यांच्या अणूंच्या सर्वांत बाहेरच्या कवचातील इलेक्ट्रॉनांशी संबंधित असलेल्या रासायनिक संयोगाच्या संकल्पना रसायनशास्त्रज्ञांनी अणुकेंद्रातील कणांच्या शोधापूर्वीही विकसित केल्या होत्या. ⇨गिलबर्ट न्यूटन ल्यूइस व ⇨अविंग लँगम्यूर या अमेरिकन शास्त्रज्ञांनी आणि व्हाल्टर कोसेल या जर्मन शास्त्रज्ञांनी स्वतंत्रपणे या विषयीच्या आपापल्या संकल्पना साधारणपणे १९१६ पासून विकसित केल्या. आवर्त सारणीतील हीलियमाच्या पलीकडे असणाऱ्या दुर्मिळ वायूंप्रमाणे मूलद्रव्यांच्या अणूच्या सर्वांत बाहेरच्या कवचात ८ इलेक्ट्रॉन असले म्हणजे ते स्थिर असते. असा निष्कर्ष त्यांनी काढला. एक, दोन अथवा जास्तीत जास्त तीन इलेक्ट्रॉन देऊन टाकले म्हणजे त्यांचे ८ इलेक्ट्रॉन असलेले कवच उघडे होते व धातूवर धन विद्युत् भार येतो. अधातूंचे सर्वांत बाहेरचे कवच एक, दोन अथवा तीन इलेक्ट्रॉन स्वीकारल्याने पूर्ण होईल असे असते व त्यामुळे त्यावर ऋण विद्युत् भार येतो. लवण तयार होताना धातूपासून अधातूकडे इलेक्ट्रॉनांचे स्थानांतर होते व एकमेकांना आकर्षित करणारे धन विद्युत् भारित व ऋण विद्युत् भारित आयन तयार होतात. यामुळे तयार झालेल्या आयनी संयुगातील घटक एकमेकांशी आयनी बंधाने संबद्ध असतात.
अधातवीय संयुगातील अणूंमध्ये इलेक्ट्रॉनांची जोडी भागीदारीत वापरली जावी अशी सोय वरील सिद्धांतात केली आहे. या जोड्या वापरताना प्रत्येक अणूच्या सर्वांत बाहेरच्या कवचात ८ इलेक्ट्रॉन असतात व त्यामुळे त्याला स्थैर्य असते. अशा प्रकारे झालेल्या संयोजनाला सहसंयुजी संयोग म्हणतात. यामध्ये सामाईक म्हणून वापरलेल्या इलेक्ट्रॉन जोडीला सहसंयुजी बंध म्हणतात. [⟶ रासायनिक संयुगे संयुजा].
जीवरसायनशास्त्र : विसाव्या शतकाच्या पहिल्या ३० वर्षांत ⇨हॉर्मोने व ⇨जीवनसत्त्वे यांकडे विशेष लक्ष दिले गेले. मार्गणक [जीवरासायनिक व इतर प्रक्रियांचे स्वरूप व यंत्रणा जाणण्यासाठी त्यांचा मागोवा घेण्याकरिता वापरण्यात येणारी मूलद्रव्ये ⟶ मार्गण मूलद्रव्ये] म्हणून समस्थानिक उपलब्ध झाल्यावर किण्वनासंबंधीचे ज्ञान, मध्यस्थ चयापचय (शरीरातील कोशिकांमध्ये-पेशींमध्ये-होणाऱ्या अन्नद्रव्यांच्या रासायनिक संश्लेषणातील व अपघश्रटनातील मध्यस्थ पायऱ्या), प्रकाशसंश्लेषण, एंझाइमांचे कार्य व जीववैज्ञानिक आनुवंशिकी यांमध्ये झपाट्याने प्रगती झाली.
पोषण : इ. स. १९१२ मध्ये इंग्लंडमधील केंब्रिज येथील ⇨सर फ्रेडरिक गाउलंड हॉपकिन्स् यांनी साहाय्यक अन्नघटकांची कल्पना सुचविली आणि लंडन येथील लिस्टर इन्स्टिट्यूटमधील कॅझिमिर फून्क यांनी व्हिटॅमिन (जीवनसत्त्व) हा शब्द त्यासाठी सुचविला. तथापि पोषणासंबंधीचे बरेचसे शोध कृषिविषयक प्रयोग करणाऱ्या संस्थामध्ये चाललेल्या प्राणिखाद्यासंबंधीच्या संशोधनातून लागले. उदा., पांढऱ्या उदारांसाठी आधारभूत असे समाधानकारक संश्लेषित खाद्य सिद्ध करताना एल्. वी. मेंडेल आणि टी. वी. ऑसबर्न यांना दुधामध्ये असलेल्या सूक्ष्ममात्रिक कार्बनी पोषकांची उपस्थिती दृष्टोत्पत्तीस आली. ई. व्ही. माकॉलम यांनी दुधातील वसा व एक वृद्धिघटक (अ जीवनसत्त्व) आणि जलविद्राव्य घटक (ब जीवनसत्त्व) व मलई काढलेल्या दुधाचा भाग यांचे साहचर्य दाखविले. आणखी एक जलविद्राव्य घटक (क जीवनसत्व) ताजी फळे व भाज्या यांमध्ये असून तो स्कर्व्ही रोगप्रतिबंधक असल्याचे लवकरच दिसून आले. प्रायोगिक प्राण्यांवर केलेल्या अतीव संशोधनाने असे दृष्टोत्पत्तीस आले की, पर्याप्त पोषणासाठी अनेक कार्बनी संयुगे सूक्ष्ममात्रिक प्रमाणात आवश्यक असतात. १९२० ते १९४० हा काळ अन्नात असलेले वसा-विद्राव्य आणि जंल-विद्राव्य घटक वेगळे काढणे, त्यांचे अभिज्ञान करणे वं संश्लेषण करणे यांत गेला. सूक्ष्ममांत्रिक खनिजे व आवश्यक ⇨अमिनो अम्ले यांची गरजे आणि चयांपचयातील त्यांचे कार्य यांविषयीही बरेच संशोधन झाले [⟶ पोषण].
हॉर्मोने : इंग्रज शरीरक्रियावैज्ञानिक अर्नेस्ट स्टारलिंग व विल्यम बेलिसं यांनी सिक्रिटिनाचा शोध लावला तेव्हा १९०२ मध्ये हॉर्मोने ही रासायनिक शरीरक्रियां नियंत्रक आहेत हे प्रथम मान्य झाले. जठरातून ग्रहणीत (लहान आतड्यांच्या प्रारंभीच्या भागात) अन्न पोहोचले म्हणजे या संयुगाचे रक्तप्रवाहात स्रवण होते. अग्निपिंडात सिक्रिटीन पोहोचले म्हणजे अग्निपिंडातील रसाचे स्रवण ते सुरू करते.
अग्निपिंडातील लांगरहान्स द्वीपकांपासून (विशिष्ट कोशिकासमूहांपासून) बनणारे ⇨इन्शुलीन हे कार्बोहायड्रेटांच्या चयापचयाशी संबंधित हॉर्मोन आहे. १९२२ मध्ये ⇨सर प्रेडरिक ब्रांट बँटिंग आणि ⇨चार्ल्स हर्बर्ट वेस्ट या कॅनेडियन शरीरक्रियावैज्ञानिकांनी इन्शुलिनाचे प्रमाण मोठे असलेला अर्क अग्निपिंडापासून बनविला. हा अर्क मधुमेही प्राण्यामध्ये टोचल्याने मधुमेहाच्या लक्षणांचे उपशमन होते असे दिसून आले. या हॉर्मोनाचे सुधारित शुद्धीकरण केल्यावर गाई-बैलांच्या अग्निपिंडापासून मिळविलेले इन्शुलीन मानवी मधुमेहावर उपचार म्हणून वापरणे शक्य झाले. इन्शुलीन या प्रथिनातील ॲमिनो अम्लांचा अनुक्रम ⇨फ्रेडरिक सँगर यांनी १९५३ मध्ये ठरविला. गो-इन्शुलिनाचे संश्लेषण १९६४ मध्ये एका चिनी संशोधक गटान केले आणि नंतर एक वर्षाने मानवी इन्शुलीन एका अमेरिकन संशोधक गटाने बनविले.विसाव्या शतकाच्या प्रारंभीच्या दशकांत शोधून काढलेल्या इतर हॉर्मोनांत ॲड्रेनॅलीन, थायरॉक्सिन, ⇨पोष ग्रंथीतील हॉर्मोने, ⇨अधिवृक्क ग्रंथीच्या बाह्यकातील हॉर्मोने व लिंग हॉर्मोने यांचा समावेश होतो. ॲड्रेनॅलीन व थायरॉक्सिन वगळता इतर हॉर्मोने ही जटिल पॉलिपेप्टाइडे किंवा स्टेरॉले आहेत.
प्रकाशसंश्लेषण : १९३० मध्ये ⇨हान्स फिशर यांनी हरितद्रव्याची (क्लोरोफिलाची) संरचना ठरविली. त्यांनी अगोदरच याच्यांशी रासायनिक दृष्ट्या संबंध असलेल्या रक्तारुणातील (हीमोग्लोबिनामधील) हीमीने या प्रथिनरहित भागाची संरचना निश्चित केली होती. हरितद्रव्याचे संश्लेषण १९६० मध्ये ⇨रॉबर्ट बर्न्स वुडवर्ड यांच्या मार्गदर्शनाखाली हार्व्हर्ड येथे काम करणाऱ्या संशोधन गटाने व एम्. स्ट्रेल यांनी म्यूनिक येथे स्वतंत्रपणे केले. प्रकाशसंश्लेषण प्रक्रियेचे स्वरूप फार सावकाश उघड झाले. १९०० नंतरच्या दशकातील प्रारंभीच्या काही वर्षांत असे सिद्ध करण्यात आले की, कार्बन डायऑक्साइडाचे ⇨क्षपणाने साखरेत होणारे रूपांतर अनेक टप्प्यांनी होते आणि त्यामध्ये प्रकाशातील व अंधारातील अशा दोन्ही प्रकारच्या विक्रियांचा समावेश होतो. १९२० नंतरच्या दशकात प्रकाशसंश्लेषणाशी साम्य असलेल्या सूक्ष्मजंतूंमधील विक्रियांचा जो अभ्यास करण्यात आला त्यावरून जैव ऊर्जेचे स्थानांतरण असणारे हायड्रोजन-स्वीकार करणाऱ्यांचे कार्य समजून आले आणि कार्बोहायड्रेटांच्या मध्यस्थ चयापचयासंबंधीच्या संशोधन कार्याने प्रकाशसंश्लेषणाचे स्वरूप समजून येण्यात आणंखी मदत झाली. [⟶ प्रकाशसंश्लेषण सूक्ष्मजंतु, प्रकाशसंश्लेषी].
समस्थानिक मार्गणक : १९३० नंतरच्या दशकाच्या अखेरीस समस्थानिक मार्गणकांचा उपयोग करण्यास प्रारंभ झाल्यावर जीवरसायनशास्त्रात लक्षणीय प्रगती करणे शक्य झाले. स्थिर मूलद्रव्यांपासून जड समस्थानिक तयार करणे शक्य असले, तरी किरणोत्सर्गी समस्थानिक बनविणे जास्त पसंत केले जाई कारण त्यांचे अभिज्ञान व मापन सोपे असते. ते १९३४ मध्ये फ्रदेरीक आणि ईरेन झाल्यो-क्यूरी या दांपत्याने फ्रान्समध्ये कृत्रिम किरणोत्सर्गाचा शोध लावल्यावर असे समस्थानिक उपलब्ध झाले. सांयक्लोट्रॉन हा ⇨कणवेगवर्धक उपयोगात आल्यावर गंधक (३५), फॉस्फरस (३२), आयोडीन (१३१) व लोह (५५) हे समस्थानिक जैव मार्गणक म्हणून वापरण्यासाठी पुरेशा प्रमाणात तयार करणे शक्य झाले. सॅम्यूएल रूबेन व मार्टिन कामेन यांनी कॅलिफोर्निया रेडिएशन लॅबोरेटरीमध्ये कार्बन (१४) चा १९४१ मध्ये शोध लावला. याचे अर्धायुष्य ५,७३० वर्षे आहे आणि त्यामुळे जीवरासायनिक मार्गणाच्या अभ्यासांस तो योग्य आहे. कॅलिफोर्निया विद्यापीठातील ⇨मेल्व्हन कॅल्व्हिन यांनी प्रकाशसंश्लेषण प्रक्रियेत कार्बन डाय-ऑक्साइडापासून बनणाऱ्या संयुगांचा अनुक्रम लावण्यासाठी कार्बन (१४) चा उपयोग केला. [⟶ मार्गण मूलद्रव्ये].
किण्वन : १९०४ मध्ये लिस्टर इन्स्टिट्यूटमधील आर्थर हार्डन व डब्ल्यू. जे. यंग यांनी यीस्ट रसापासून किण्वनास आवश्यक असलेले एक को-एंझाइम वेगळे केले. त्यानंतर सु. दहा वर्षांनी जर्मन जीवरसायनशास्त्रज्ञ ओटो फ्रिट्झ मायरहोफ यांनी असे दाखविले की, अल्कोहॉली किण्वनात उपस्थित असलेली को-एंझाइमे स्नायुकोशिकांमध्येही असतात व ती कार्बोहायड्रेटांच्या चयापचयात आवश्यक असतात.
श्वसन : ⇨ओटो हाइन्रिख व्हारबुर्ख या जर्मन जीवरसायन-शास्त्रज्ञांनी मध्यस्थ चयापचयातील ऑक्सिजनाच्या कार्याचा अभ्यास केला. १९२३ मध्ये व्हारबुर्ख यांनी श्वसन दावमापकात सुधारणा केली. त्यामुळे चयापचयामध्ये घेतल्या जाणाऱ्या ऑक्सिजनाचे मापन करणे शक्य झाले. त्यांचा असा विश्वास होता की, रक्तातील रक्तारुणाने कोशिकेपर्यंत ऑक्सिजन नेल्यानंतर तो सायटोक्रोम नावाच्या एंझिमांच्या प्रणालीने घेतला जातो. सायटोक्रोम म्हणजे रक्तारुणातील हीम या ऑक्सिजनवाहक भागाशी संयोग पावलेली प्रथिने आहेत असे सिद्ध झाले. ऑक्सिजन जास्त प्रमाणात घेऊ शकणाऱ्या, कबूतराच्या तुकडे केलेल्या स्नायूचा उपयोग करून हंगेरीचे ⇨ऑल्बेर्ट सेंट-डयर्ड्यी यांनी श्वसनाचा अभ्यास चालू ठेवला. त्यांनी असे निदर्शनास आणले की, कार्बोहायड्रेटांच्या चयापचयात मध्यस्थ पदार्थ म्हणून निर्माण होत असण्याची शक्यता असलेली काही विशिष्ट अम्लांची लवणे समाविष्ट केल्याने हा ऑक्सिजन घेण्याचा वेग कायम ठेवता येतो. चयापचयाची वाढ करणाऱ्या पदार्थाच्या यादीत तर अम्ले (सायट्रिक, आल्फा-कीटोग्लुटारिक, पायरुव्हिक, ग्लुटामिक आणि अस्पार्टिक) ⇨सर हान्स आडोल्फ क्रेब्ज यांनी समाविष्ट केली. १९३७ मध्ये क्रेब्ज यांनी एक चयापचय चक्र सुचविले. त्याअन्वये पायरूव्हिक अम्लाचे अवक्रमण एका २ –कार्बन असलेल्या खंडात होते व नंतर त्याचे ऑक्झॅलो-ॲसिटिक अम्लाशी संघनन होऊन सायट्रिक अम्ल निर्माण होते. नंतर सायट्रिक अम्लाचा समावेश एका विक्रिया मालिका चक्रात होतो. त्यामध्ये ऊर्जायुक्त हायड्रोजन अणू मोकळे होतात व कार्बन डाय-ऑक्साइड बाहेर पडतो. विक्रियांचे हे चक्र ऑक्झॅलो-ॲसिटिक अम्ल निर्माण होऊन पूर्ण होते व हे अम्ल पुन्हा त्या चक्रात समाविष्ट होते. १९११ मध्ये न्यूयार्क येथील ⇨सेव्हेरो ओचोआ यांनी असे दाखविले की, पायरूव्हिक अम्लापासून निघणारा २−कार्बन खंड हा ॲसिटिल गट जोडलेले को-एंझाइम ए आहे. या विक्रिया मालिकेला क्रेब्ज ‘सायट्रिक अम्ल चक्र’ असे म्हणतात. त्यामध्ये नंतर जरी काही किरकोळ बदल करण्यात आले असले, तरी पायरूव्हिक अम्लाचे कार्बन डाय-ऑक्साइड व पाणी यांत रूपांतर होऊन ऊर्जा मुक्त होणे याची खात्रीलायक यंत्रणा त्यामुळे मांडली गेली. [⟶ चयापचय].
एंझाइमे : सायट्रिक अम्ल चक्रातील सर्व टप्पे व जवळजवळ सर्व चयापचय विक्रिया एंजाइमांच्या उपस्थितीत पार पडतात. सामान्यतः अशी समजूत होती की, एंझाइमे ही अतिशय विशिष्ट संरचना असलेली प्रथिने आहेत परंतु याची सत्यता १९२६ मध्ये अमेरिकन जीवरसायनशास्त्रज्ञ ⇨जेम्स बॅचलर सम्नर यांनी यूपिएज हे यूरियाचे अमोनिया व कार्बन डाय-ऑक्साइड यांमध्ये जलीय विच्छेदन करणारे एंझाइम स्फटिकरूपात तयार करण्यात यश मिळविल्यावर सिद्ध झाली. त्यांनतर लवकरच ⇨जॉन हॉवर्ड नार्थ्रप या अमेरिकन पेप्सीन स्फटिकरूप बनविले. १९६० नंतरच्या दशकाच्या मध्यापर्यंत ७५ पेक्षा जास्त एंझाइमे स्फटिकरूप करण्यात आली. ती सर्व प्रधिने असून यांच्या संरचना एकाच प्रकारच्या विक्रिया घडविण्याच्या दृष्टीने अतिशय विशिष्ट आहेत, असे दिसून आले आहे. [⟶ एंझाइमे].
जीवरसायनशास्त्रीय आनुवंशिकी : एफ्. मिशर या स्विस जीवरसायनशास्त्रज्ञांनी १८६९ मध्ये ⇨न्यूक्लिडक अम्ले प्रथम वेगळी केली परंतु त्यांचे जीवविज्ञानातील महत्त्व १९४४ मध्ये रॉकफेलर विद्यापीठातील ओ. टी एव्हरी, सी. एम्. मॅकलाउड व एम्. माकार्टी या तीन वैज्ञानिकांनी सूक्ष्मजंतूंमध्ये आनुवंशिक ज्ञान डीऑक्सिरिबोन्यूक्लिइक अम्लाने (डीएनए ने) परिवाहीत होते, हे दाखवीपर्यंत निर्विवाद सिद्ध झाले नव्हते. ⇨फ्रॅन्सिस हॅरी कॉम्पटन क्रिक व ⇨जेम्स ड्यूई वॉटसन या जीवरसायनशास्त्रज्ञांनी १९५३ मध्ये केंब्रिज विद्यापीठात काम करीत असताना असे सुचविले की, डीएनए हे न्यूक्लिओटाइडांच्या दोन साखळ्या दुहेरी सर्पिलाकृतीने जोडल्याने बनलेले आहे. त्यांनी असेही सुचविले की, समोरासमोरच्या न्यूक्लिओटाइडांचे क्षारक क्षीण बंधांनी जोडले गेले आहेत आणि प्रत्येक साखळी ही नवीन डीएनए रेणू बनविण्यासाठी साचा म्हणून उपयोगी पडू शकते. वॉटसन-त्रिक यांची ही संकल्पना त्यानंतर अनेक प्रयोगांनी खात्रीलायकपणे सिद्ध झाली. रिबोन्यूक्लिइक अम्लांच्या संश्लेषणावर डीएनए नियंत्रण ठेवते. रिबोन्यूक्लिइक अम्ले प्रथिनांच्या संश्लेषणात सहभागी असतात, तथापि या विक्रियांच्या यंत्रणा अजून निश्चित झालेल्या नाहीत. [⟶ न्यूक्लिइक अम्ले आनुवंशिकी].
वैश्लेषिक रसायनशास्त्र : वर्णमापन : रंगीत विद्रावांनी होणाऱ्या प्रकाशाच्या शोषणाचा उपयोग एक विश्लेषण तंत्र म्हणून एक शतकाहून अधिक काळ केला जात आहे. यामध्ये अज्ञात संहतीच्या द्रवाच्या रंगाची तुलना ज्ञात संहतीच्या द्रवाच्या रंगाशी केवळ डोळ्याने निरीक्षण करून केली जात असे. या कामासाठी वर्णपट प्रकाशमापक [⟶ प्रकाशमापन] १९४० च्या सुमारास प्रत्यक्ष वापरात आले. या उपकरणामध्ये प्रकाशीय गाळण्यांच्या अथवा इतर प्रकाशीय साधनांचा उपयोग करून प्रकाशाची व्याप्ती थोड्या तरंगलांब्यांच्या प्रकाशापुरती मर्यादित केलेली असते. प्रकाशाच्या शोषणाचे मापन करण्यासाठी प्रकाशविद्युत् घटांचा उपयोग करण्यात येतो [⟶ प्रकाशविद्युत्]. याचबरोबर नवीन वर्णमापक विक्रियाकारके, उदा., डायथायाझोन, प्रचारात आल्याने वर्णमापन विश्लेषणाचे क्षेत्र बरेच व्यापक झाले आहे. [⟶ वर्ण व वर्णमापन].
वर्णपटविज्ञान : विसाव्या शतकाच्या मध्यास वर्णपटविज्ञानाचा उपयोग खूप विस्तार पावला. १८५९ मध्ये जर्मनीत ⇨रोबेर्ट व्हिल्हेल्म बन्सन व ⇨गुस्टाफ रोबेर्ट किरखोफ यांनी वर्णपटदर्शक बनविला. गुणात्मक विश्लेषणासाठी होणारा त्याचा उपयोग रासायनिक प्रयोगशाळांत आणि खगोलशास्त्रीय वेधशाळांत ताऱ्यांमध्ये असणाऱ्या मूलद्रव्यांच्या अभिज्ञानासाठी त्वरित मान्यता पावला.
वर्णपटविषयक तंत्रांचा अवरक्त (दृश्य वर्णपटातील तांबड्या रंगाच्या अलीकडील) क्षेत्रातील विस्तार गुणात्मक व राश्यात्मक विश्लेषणांसाठी विशेष महत्त्वाचा ठरला आहे. काही अणुगटांमुळे होणाऱ्या अंतर्रेणवीय कंपनांशी संबंधित असलेल्या ऊर्जा अवरक्त कक्षेत येतात. त्यामुळे अवरक्त शोषण वर्णपटविज्ञान हे संरचना विश्लेषण व जटिल संयुगांचे राश्यात्मक निर्धारण यांसाठी उपयुक्त ठरले आहे. [⟶ वर्णपटविज्ञान].
अति-केंद्रोत्सारक : कलिली संधारणातील [⟶ कलिल] अवसादन त्वरा (कण खाली बसण्याची त्वरा) मोजण्याचे हे उपकरण १९२० नंतरच्या दशकात विकसित करण्यात आले. या पद्धतीने स्टार्च, प्रथिनांची संधारणे व बहुवारिकी पदार्थ (लहान, साध्या रेणूंच्या संयोगाने बनणारी प्रचंड रेणूंची संयुगे) यांचे संभाव्य रेणुभार आणि विषमांगतेचे प्रमाण यांविषयी माहिती मिळविणे शक्य झाले. पूर्वीची अति-केंद्रोत्सारी यंत्रे स्वीडनमधील टेऑडॉर स्व्हेडबॅरी यांनी विकसित केली. ती जड, महाग व तेलावर चालणारी होती आणि त्यांचा उपयोग मर्यादित होता. आता यांच्याजागी हवेवर वि विजेवर चालणारी यंत्रे आली आहेत. [⟶ केंद्रोत्सारण].
विद्युत् संचारण : हे एक महत्त्वाचे विश्लेषण तंत्र आहे. यामध्ये विद्युत् भारित कणांचे विद्युत् क्षेत्रात स्थानांतरण घडते म्हणून ते अशा पदार्थाच्या विलगीकरणासाठी व अभिज्ञानासाठी वापरतात. या तंत्राचा उपयोग करण्यात स्वीडनचे ⇨आर्ने व्हिल्हेल्म काउरिन टिसेलियस यांचा महत्त्वाचा वाटा आहे. प्रथिने व उच्च बहुवारिके यांच्या अभ्यासात या तंत्राला विशेष महत्त्वे आहे. [⟶ विद्युत् संचारण].
द्रव्यमान वर्णपटमापन : या तंत्राचा विकास जे. जे टॉमसन व फ्रॅन्सिस ॲस्टन यांच्या कार्यातून झाला. त्यांनी धन आयनांच्या भारानुसार यांच्या विलगीकरणासाठी चुंबकीय व स्थिर विद्युत् क्षेत्रांचा उपयोग केला. १९४० पर्यंत द्रव्यमान वर्णपटदर्शकाचा उपयोग मुख्यतः विविध मूलद्रव्यांतील समस्थानिकांच्या वितरणाच्या अभ्यासासाठी करण्यात आला. मोठ्या प्रमाणावर बनविलेली उपकरणे उपलब्ध झाल्यावर द्रव्यमान वर्णपटमापनाचा विश्लेषणात विस्तृत प्रमाणात उपयोग होऊ लागला. [⟶ द्रव्यमान वर्णपटविज्ञान].
अणुकेंद्रीय चुंबकीय अनुस्पंदन : १९४० सालापासून या तंत्राचा विकास होऊ लागला. नियमितपणे बदलणाऱ्या कंप्रतेच्या (एका सेकंदात होणाऱ्यान कंपनसंख्येच्या) चुंबकीय क्षेत्राला अणुकेंद्रीय परिबलनाचा जो प्रतिसाद मिळतो, त्यावर हे आधारलेले आहे. उदा., चुंबकीय क्षेत्रात होणारे हायड्रोजनाच्या अणुकेंद्राचे वर्तन ते हायड्रोजन अणू ज्या अणूला जोडले असतील त्यानुसार बदलते. रेणवीय संरचनांच्या अभ्यासामध्ये अणुकेंद्रीय चुंबकीय अनुस्पंदन तंत्राला एक साधन म्हणून फार महत्त्व आहे. [⟶ अनुस्पंदन].
वर्णलेखन : १९०३ मध्ये भ्यिखाईल त्स्वेत या रशियन शास्त्रज्ञांनी नळीत भरलेल्या अभिशोषक स्तंभामधून वनस्पतीच्या रंगद्रव्यांचा विद्राव जाऊ देऊन त्यांचे विलगीकरण करण्यासाठी वर्णलेखनाचा विकास केला. १९३१ नंतर ⇨रिखार्ट कून या जर्मन जीवरसायनशास्त्रज्ञांनी एकमेकांशी दृढ संबंधित अशी जैव रंगद्रव्ये विलग करण्यासाठी हे तंत्र वापरल्यावर ते लोकप्रिय झाले. त्यानंतर कागद−वर्णलेखन विभाजन−वर्णलेखन, वायु−वर्णलेखन वगैरे वर्णलेखनाचे इतर प्रकार विकसित झाले. ही तंत्रे जटिल कार्बनी संयुगे विलग करण्यासाठी फार परिणामकारक ठरली आहेत. [⟶ वर्णलेखन].
क्ष-किरण स्फटिक विज्ञान : जर्मनीमध्ये ⇨माक्स टेओडोर फेलिक्स फोन लौए यांनी १९१२ मध्ये क्ष-किरण स्फटिकविज्ञान प्रथम वापरले. त्या काळी साध्या संयुगांच्या स्फटिकापुरताच त्याचा उपयोग मर्यादित होता. जलद गतीचे संगणक उपलब्ध झाल्यामुळे तंत्राचे ब१२ जीवनसत्त्व, डीएनए आणि रक्तारुण यांसारख्या जटिल स्फटिकांच्या संरचनांचे विश्लेषण करणे शक्य झाले आहे. [⟶ क्ष-किरण].
रासायनिक संस्था, संघटना व नियतकालिके : जगातील व भारतातील रसायनशास्त्राविषयीच्या काही महत्त्वाच्या संस्था, संघटना व नियतकालिके यांची माहिती थोडक्यांत पुढे दिली आहे.
इंटरनॅशनल युनियन ऑफ प्यूअर अँड अप्लाइड केमिस्ट्री : ऑक्सफर्ड येथील ही आंतरराष्ट्रीय संघटना पुढील गोष्टी करण्यासाठी १९१९ साली स्थापन करण्यात आली. सदस्य देशांमधील रसायनशास्त्रज्ञांमध्ये सहकार्य सतत वाढविणे ज्या आंतरराष्ट्रीय महत्त्वाच्या विषयांच्या बाबतीत नियम मानकीकरण किंवा संकेतावली ठरविणे आवश्यक असते अशा आंतरराष्ट्रीय महत्त्वाच्या विषयांचा अभ्यास करणे आणि शुद्ध व अनुप्रयुक्त रसायनशास्त्रामधील सर्वे बाबींच्या प्रगतीस हातभार लावणे. या संस्थेचे ४२ देश सदस्य आहेत (१९८७). या संस्थेतर्फे प्यूअर अँड ॲप्लाइड केमिस्ट्री हे मासिक व केमिस्ट्रि इंटरनॅशनल हे द्वैमासिक प्रसिद्ध होते.
रॉयल सोसायटी ऑफ केमिस्ट्री : केमिकल सोसायटी (स्थापना १८४१) व रॉयल इन्स्टिटयूट ऑफ केमिस्ट्री (स्थापना १८७७) यांच्या एकत्रीकरणातून ही संस्था १९८० साली लंडनला स्थापन झाली. या संस्थेचे ४० हजाराहून जास्त सदस्य असून हिच्यामार्फत पुढील प्रकाशने प्रसिद्ध होतात. केमिस्ट्री इन ब्रिटन (मासिक), प्रोफेशनक बुलेटीन (वर्षातून ९ वेळा), जर्नल ऑफ द केमिकल सोसायटी, एज्युकेशन इन केमिस्ट्री, तसेच रशियन जर्नल ऑफ फिजिकल केमिस्ट्री, रशियन जर्नल ऑफ इनऑर्गॅनिक केमिस्ट्री व रशियन केमिकल रिव्हूज हे अनुवाद आणि स्पेशॅलिस्ट पिरिऑडिकल रिपोर्टस, अनॅलिटिकल अब्स्ट्रॅक्टस आणि केमिकल बिझिनेस न्यूज बेस यांविषयीच्या मालिका.
Societe Francaise de Chimie : (फ्रेंच केमिकल सोसायटी). पॅरिस येथील ही संस्था १८५७ साली स्थापन झाली असून १९८७ साली तिचे ४,६०० सदस्य होते व तिची चार नियतकालिके प्रसिद्ध होतात.
अमेरिकन केमिकल सोसायटी : १८७६ साली स्थापन झालेल्या या वॉशिंग्टन (डी. सी.) येथील संस्थेचे १ लाख ३५ हजार सदस्य असून ती पुढील नियतकालिके प्रसिद्ध करते. जर्नल ऑफ द. ए. सी. एस., केमटेक, केमिकल अँड एंजिनिअरिंग न्यूज, इंडस्ट्रियल अँड एंजिनिअरिंग केमिस्ट्री, अनॅलिटिकल केमिस्ट्री, केमिकल अब्स्ट्रॅक्ट्स अँड इट्स व्हेरियस सर्व्हिसेस, जर्नल ऑफ फिजिकल केमिस्ट्री वगैरे.
अमेरिकन इन्स्टिट्यूट ऑफ केमिस्ट्स : ही बेथेस्डा येथील संस्था १९२३ साली स्थापन झाली. सहा हजार सदस्य असलेल्या या संस्थेचे द केमिस्ट हे मासिक व प्रोफेशनल डिरेक्टरी हे वार्षिक प्रसिद्ध होते.
निपॉन कागाकुवाई : (केमिकल सोसायटी ऑफ जपान). ही टोकियो येथिल संस्था १८७८ साली स्थापन झाली. तिचे ३२ हजार सदस्य असून तिची तीन जपानी व दोन इंग्रजी (केमिस्ट्री लेटर्स व बुलेटीन) नियतकालिके प्रसिद्ध होतात.
Gesellshaft Deutscher Chemiker : (सोसायटी ऑफ जर्मन केमिस्ट्स). १९४६ साली फ्रँकफूर्ट येथे स्थापलेल्या या संस्थेच १९,००० सदस्य असून तिची ५ सामिके, एक द्वैमासिक व एक साप्ताहिक प्रसिद्ध होतात. उदा., आनगेवांट केमी (जर्मन व इंग्रजी).
यांशिवाय चांगचुन इन्स्टिट्यूट ऑफ अप्लाइड केमिस्ट्री (चांगचुन, स्थापना १९४८) व इन्स्टिट्यूट ऑफ अप्लाइड केमिस्ट्री (पीकिंग, स्थापना १९५६, ५३० सदस्य) चीनमधील, तर नॅशनल कमिटी ऑफ सोव्हिएट केमिस्ट्स (मॉस्को) ही रशियातील संस्था आहे.
भारतातील इंडियन केमिकल सोसायटी ही संस्था १९२४ मध्ये कलकत्ता येथे स्थापन झाली. तिचे २,००० सदस्य असून ती इंडियन केमिकल सोसायटी जर्नल हे मासिक प्रसिद्ध करते. भारतात रसायनशास्त्रातील विविध शाखांत संशोधन करणाऱ्या राष्ट्रीय संस्था (उदा., नॅशनल केमिकल लॅबोरेटरी, सेंट्रल इलेक्ट्रोकेमिकल रिसर्च इन्स्टिट्यूट) असून त्यांची माहिती राष्ट्रीय प्रयोगशाळा या नोंदीत दिलेली आहे.
यांव्यतिरिक्त भारतातील व इतर देशांमधील काही महत्त्वाची रसायनशास्त्राविषयीची नियतकालिके पुढे दिली असून कंसामध्ये शक्य तेथे त्या नियतकालिकांचे स्थापना वर्ष व प्रकाशन स्थल अनुक्रमे दिलेले आहे.
केमिकल बुलेटीन (१९१४, शिकागो) जर्नल ऑफ केमिकल एज्युकेशन (१९२४, न्यूयॉर्क) केमिकल रिव्ह्यूज (१९२४, वॉशिंग्टन) जर्नल ऑफ जॅपनीज केमिस्ट्री (१९४७, टोकिओ) केमिस्ट्री इन कॅनडा (१९४९, ओटावा) जर्नल ऑफ जनरल केमिस्ट्री ऑफ द यू. एस. एस. आर. (१९४९, न्यूयॉर्क) केमिकल अँड फार्मॅस्युटिकल बुलेटोन (१९५३, टोकिओ) चायनीज केमिकल सोसायटी जर्नल (१९५४, तैपेह) मॉस्को युनिव्हर्सिटी केमिस्ट्री बुलेटीन (१९६०, न्यूयार्क) रशियन केमिकल रिव्ह्यूज (१९६०, लंडन) सोव्हिएत प्रोग्रेस इन केमिस्ट्री (१९६६, न्यूयॉर्क) केमिकल सोसायटी, लंडन रिव्हूज (१९७२, लंडन) केमिस्ट्री लेटर्स (१९७२, टोकिओ) इंडरनॅशनल न्यूज लेटर ऑन केमिकल एज्युकेशन (१९७४, ऑक्सफर्ड) व जर्नल ऑफ केमिकल रिसर्च (१९७७, लंडन).
इन्स्टिट्यूशन ऑफ केमिस्ट्स (इंडिया) जर्नल (१९२९, कलकत्ता, १९२९) केमिकल एज ऑफ इंडिया (१९४९, मुंबई, ५,५००) केमिकल वीकली (१९५६, मुंबई, ५,०००) इंडियन जर्नल ऑफ केमिस्ट्री सेक्शन ए : इन ऑर्गॅनिक, फिजिकल, थिओरिटिकल अँड ॲनॅलिटिकल केमिस्ट्री (१९६३, नवी दिल्ली, १,४००) : इंडियन जर्नल ऑफ केमिस्ट्री सेक्शन बी : ऑर्गॅनिक अँड मेडिकल केमिस्ट्री (१९७६, नवी दिल्ली) केमिकल इरा (१९६४, कलकत्ता) केमिकल इंटरनॅशनल (१९६५ नवी दिल्ली, ५,७६०) इंडियन केमिकल जर्नल (१९६६ मुंबई, ४,५००) केमिकल अँड पेट्रोकेमिकल्स जर्नल (१९६६, मुंबई, ४,०००) केमिकल टेक-ऑफ (१९७१, नवी दिल्ली, ६,०००) केमिकल टाइम्स (मुंबई) व इन्स्टिट्यूशन ऑफ केमिस्ट्स (इंडिया) प्रोसिडिंग्ज (कलकत्ता).
कार्यक्षेत्रे : रसायनशास्त्रज्ञ व रासायनिक अभियंते सामान्यतः रसायनशास्त्राच्या पुढीलपैकी एका क्षेत्रामद्ये अध्यापन, संशोधन, विकास किंवा नियंत्रण या प्रकारचे काम करतात : कार्बनी, अकार्बनी, भौतिकीय, वैश्लेषिक व जीवरासायनिक या शाखा आणि रासायनिक अभियांत्रिकी. यांशिवाय विक्री, व्यवस्थापन इ. क्षेत्रांतही अल्प प्रमाणात रसायनशास्त्रज्ञ कामे करतात. अशा प्रकारे रासायनिक द्रव्ये ओळखणे व त्यांतील घटकांचे प्रमाण निश्चित करणे रासायनिक द्रव्यांच्या भौतिकीय वैशिष्ट्यांमध्ये रस घेऊन अणुरेणूंची रासायनिक संरचना व रासायनिक विक्रियेची यंत्रणा स्पष्ट करणाऱ्या सुधारित संकल्पनांचा शोध घेणे जैव, खनिज व संश्लेषित द्रव्यांतील कार्बनी संयुगांचा अभ्यास करणे धातू, किरणोत्सर्गी मूलद्रव्ये, व्यापारी अम्ले, क्षार, लवणे व रासायनिक उद्योगातील महत्त्वाची उत्पादने यांच्या अकार्बनी संयुगांचे अध्ययन करणे जीवांतील संयुगे, साध्या द्रव्यांपासून त्यांची निर्मिती, कोशिकांद्वारे होणारे त्यांचे भंजन यांचा अभ्यास करणे (यात कृषिविषयक व वैद्यकीय रसायनशास्त्राचाही अभ्यास येतो) आणि रासायनिक द्रव्यांचे उत्पादन, रासायनिक संस्करणातील (प्रक्रियेतील) क्रियांचे नियंत्रण, संशोधन व विकास आणि रासायनिक संयंत्रांचे अभिकल्पन व उभारणी करणे ही यांची कार्यक्षेत्रे आहेत.
रोजगार संधी : बहुतेक रसायनशास्त्रज्ञ व रासायनिक अभियंते उद्योगधंद्यांत नोकरी करतात. कारखान्यांतील मोठ्या प्रयोगशाळांत ते नवीन रासायनिक द्रव्ये व सध्याच्या द्रव्यांचे सुधारित प्रकार तयार करतात तसेच उत्पादनाच्या प्रक्रियांचा विकास व त्यांत सुधारणा करतात. अनेक रसायनशास्त्रज्ञ शाळा, महाविद्यालये व विद्यापीठे यांच्यामधून अध्यापनाचे काम करतात. यांपैकी महाविद्यालये व विद्यापीठे येथील प्राध्यापक आपल्या कामाचा एक भाग म्हणून संशोधनांचे कामही करतात. सैद्धांतिक तसेच अनुप्रयुक्त संशोधन करणाऱ्या काही शासकीय, औद्योगिक व खाजगी प्रयोगशाळाही आहेत. त्यांमध्ये प्रत्यक्ष संशोधन, मार्गदर्शन व व्यवस्थापन यांकरिताही रसायनशास्त्रज्ञांचा उपयोग होतो.
शैक्षणिक पात्रता : रसायनशास्त्रज्ञ वा रासायनिक अभियंता होण्यासाठी किमान पदवीपर्यंतचे शिक्षण आवश्यक असते. याकरिता अकार्बनी, कार्बनी, वैश्लेषिक व भौतिकीय या रसायनशास्त्राच्या शाखा, गणित व भौतिकी या विषयांचे ज्ञान असणे आवश्यक असते. पदव्युत्तर वा डॉक्टरेट पदवी संपादणारे रसायनशास्त्राच्या एखाद्या शाखेचे खास अध्ययन करतात. त्यांना अधिक उच्च दर्जाच्या रोजगार संधी उपलब्ध होतात. यांच्या जबाबदाऱ्या जास्त असून त्यांना वेतन व प्रगती यांची अधिक संधी प्राप्त होते.
पहा : अकार्बनी रसायनशास्त्र कार्बनी रसायनशास्त्र जीवरसायनसास्त्र रसायनशास्त्र, भौतिकीय वैश्लेषिक रसायनशास्त्र.
संदर्भ : 1. Bose, D. M.: Sen, S. N. Subbarayappa, B. V., Ed., A Concise History of Science in India, New Delhi, 1971.
2. Brescia, F. and others, Fundamentals of Chemistry : A Modern Introduction, New York, 1966.
3. Farber, E. The Evolution of Chemistry, New York, 1952.
4. Farber, E. Ed., Great Chemists, New York, 1964.
5. Francis, C. A. Morse. E. C. Fundamentals of Chemistry and Applications, New York 1960.
6. Glinka. J. General Chemistry, Moscow, 1958.
7 Hicks. J. Comprehensive Chemistry, London, 1963.
8. Ihde, A. J. The development of Modern Chemistry, New York, 1964.
9. Kieffer, W. F. Chemistry : A Cultural Approach, New York, 1971.
10. Leicester, H. M. The Historical Background of Chemistry, New York, 1956.
11. Mahan, B. H. University Chemistry, London, 1965.
12. Nourse, A. E. So You Want to be a Chemist, New York, 1964.
13. Partington, J. R. A History of Chemistry, 3 Vols., Lonodn, 1961-64.
14. Partington J. R. General and Inorganic Chemistry, New York, 1966.
15 Pimentel, G. C., Sprately, R. D. Understanding Chemistry, San Francisco, 1971.
16. Sienko, M. J. Plane, R. A. Chemistry, New York, 1971.
17. Timm, J. R. General Chemistry, London, 1966.
केळकर, गो. रा. ठाकूर अ. ना.
“