पीएच मूल्य : (pH). विद्रावातील (ज्यामध्ये एखादा पदार्थ विरघळविला आहे अशा द्रवातील) हायड्रोजन आयनांची (विद्युत् भारित हायड्रोजन अणूंची) संहती (एक लिटर विद्रावात असलेल्या व ग्रॅममध्ये व्यक्त केलेल्या राशीस, रेणूभाराने भागल्याने मिळणारी संख्या) दर्शविणारा संकेतांक. हा संकेतांक विद्रावाची अम्लता वा क्षारकता (अम्लाशी विक्रिया झाल्यास लवण तयार करण्याची क्षमता) दर्शवितो. ७ हे pH मूल्य उदासीन (अम्लीय वा क्षारकीय नसलेल्या) पाण्यातील हायड्रोजन आयनसंहतीशी तुल्य आहे. ७ पेक्षा कमी pH मूल्य असलेला विद्राव क्षारकीय समजण्यात येतो. pH मूल्य बरोबर ७ असल्यास विद्राव (उदा., मिठाचा पाण्यातील विद्राव) उदासीन आहे असे समजण्यात येते. हा संकेतांक (pH) १९०९ मध्ये एस्. पी. एल्. सरेन्सन यांनी ‘हायड्रोजनाचा प्रभाव’ या अर्थाच्या Puissance d’hydrogen या फ्रेंच शब्दप्रयोगावरून बनविला.
pH व हायड्रोजन आयनांची संहती यांचा संबंध पुढीलप्रमाणे आहे.
| pH = लॉग१० | १ | ||
| (हायड्रोजन आयन संहती) | |||
| = – लॉग१० | (हायड्रोजन आयन संहती) |
हायड्रोजन आयनांच्या संहतीचा व्यस्तांक करून त्याचा १० आधारांकाचा लॉगरिथम काढला [→लॉगरिथम] म्हणजे pH मूल्य मिळते. उदा., एका विद्रावातील हायड्रोजन आयन संहती प्रतिलिटर १०-५ ग्रॅमरेणू असेल, तर त्या विद्रावाचे pH मूल्य
| pH = लॉग१० | १ | लॉग १० = ५ येईल | |
| १० –५ |
हायड्रोजन आयनांच्या संहती त्यांच्या संख्येने दाखविण्यापेक्षा त्या pH मूल्य रूपाने व्यक्त करणे जास्त सोयीचे असल्यामुळे हा संकेतांक मान्यता पावला आहे.
प्रत्यक्ष प्रायोगिक कार्यात आढळणाऱ्या हायड्रोजन आयन संहतीच्या मूल्यांच्या बऱ्याच मोठ्या कक्षेकरिता pH मूल्याच्या वरील व्याख्येमुळे उपयुक्त मापक्रम मिळतो परंतु हायड्रोजन आयन संहतीचा भौतिक अर्थ अनिश्चित असल्याने सध्या स्वीकृत झालेली pH मूल्याची व्याख्या प्रत्यक्ष विद्युत् मापन पध्दतीवर आधारलेली आहे. अमेरिकेच्या संयुक्त संस्थानांवरील नॅशनल ब्युरो ऑफ स्टँडर्ड्स या संस्थने pH ची व्याख्या ही निर्देशित विद्रावात ठेवलेल्या विशिष्ट मानक (प्रमाणभूत) विद्युत् अग्रांमध्ये निर्माण होणाऱ्या विद्युत् चालक प्रेरणेच्या (विद्युत् मंडलात विद्युत् प्रवाह वाहण्यास कारणीभूत होणाऱ्या प्रेरणेच्या वि. चा. प्रे.च्या) रूपात दिलेली आहे. एखाद्या परीक्षा करावयाच्या विद्रावाचे pH काढण्याकरिता त्यात दोन मानक विद्युत् अग्रे (सामान्यत: त्यांपैकी एक काचेचे व दुसरे कॅलोमेलाचे याचे वर्णन पुढे दिलेले आहे) ठेवतात व निर्माण होणारी विद्युत् चालक प्रेरणा योजतात. २५० से. ला pH मूल्य पुढील सूत्रावरून मिळते.
| pHx = [( Ex – Es ) / 0·05916] + pHs |
येथे pHs व Es ही मूल्ये एखाद्या मानक विद्रावाच्या बाबतीतील pH व तीच विद्युत् अग्रे वापरुन निर्माण झालेली विद्युत् चालक प्रेरणा यांची असून pHx व Ex ही परीक्षा विद्रावाच्या बाबतीतील आहेत. वि. चा. प्रे. व्होल्टमध्ये मोजलेली आहे. या व्याख्येनुसार pH मूल्य हे विक्रिया होत असलेल्या प्रणालीतील हायड्रोजन आयनांच्या प्रत्यक्ष संहतीऐवजी त्यांच्या क्रियाशीलतेशी (aH) संबंधित आहे, असे दिसते. ही क्रियाशीलता म्हणजे विक्रिया प्रणालीतील हायड्रोजनआयनांची आभासी परिणामकारक संहती होय. निरीक्षणावरुन काढलेले मूल्य व गणन करुन काढलेले मूल्य यांतील हा फरक आंतरआयनीय वा आंतररेणवीय आकर्षण यांसारख्या कारणांमुळे आदर्श विद्राव व प्रत्यक्ष विद्राव यांत फरक पडत असल्याने प्रत्ययास येतो, असे यासंबंधी विवरण देण्यात आलेले आहे. हल्लीच्या प्रघातानुसार pH मूल्य हा कोणते तरी अम्लीय वा क्षारकीय लक्षण असलेल्या विविध पदार्थांचा (यांत घन पदार्थ व जलेतर वा अंशत: जलेतर विद्रावकांतील विद्राव यांचाही समावेश करण्यात येतो) गुणधर्म समजला जातो. ही संज्ञा हायड्रोजन आयन क्रियाशीलता एक वा अधिक असलेल्या विद्रावांकरिता क्वचितच वापरली जाते. जलीय विरल विद्रावकांरिता मात्र हायड्रोजन आयनांची क्रियाशीलता त्यांच्या संहतीच्या [H+] बरोबर असल्याने pH = – लॉग१० [H+] ही व्याख्या त्यांच्या बाबतीत आसन्नत: (जवळजवळ) योग्य ठरते.
हायड्रोजन आयन व त्यांच्या संहती : हायड्रोजनाच्या अणूमध्ये असलेला इलेक्ट्राॅन काढून घेतला म्हणजे प्रोटॉन शिल्लक राहतो. तो धन विद्युत् भारित असून H+ या चिन्हाने दाखवितात. यालाच हायड्रोजन आयन असे म्हणतात. पाण्याचे आयनीभवन होऊन H+ व OH– हे आयन समान प्रमाणात निर्माण होतात.
| H2O | ⇌ | H+ | + | O H– |
| पाणी | हायड्रोजन आयन | हायड्रॉक्सिल आयन |
वास्तविक H+ आयन स्वतंत्रपणे अस्तित्वात राहत नाहीत. ते पाण्याच्या रेणूशी संयोगित होऊन, H3O+ या हायड्रोनियम किंवा ऑक्झोनियम आयनांच्या रुपात असतात.
| H+ | ⇌ | H2O | + | H3O+ |
| हायड्रोजन आयन | पाणी | हायड्रोनियम आयन |
तथापि H3O ऐवजी H+ वापरणे सोयीचे आणि व्यवहारास बाध न आणणारे असल्यामुळे त्याचाच वापर केला जातो.
पाण्याच्या आयनीभवनास वस्तूमान-समतोलाचा नियम [→ समतोल, रासायनिक] लावला, तर ती घटना पुढीलप्रमाणे दाखविता येईल.
| [H+] [OH–] | = K | ||
| [H2O] |
चौकटी कंसांनी त्या त्या द्रव्यांच्या संहती दाखविल्या जातात. K हा स्थिरांक आहे.
यात पाण्याचे प्रमाण इतके मोठे आहे की, त्याच्या संहतीत बदल पडत नाही असे समजता येईल म्हणून वरील समीकरण
| [H+] [OH–] = Kw असे मांडता येईल. |
या समीकरणाची डावी बाजू म्हणजे पाण्याचा आयनी गुणाकार होय. त्याचे मूल्य तापमान २५० से. असताना १०-१४ असते हे ज्ञात आहे म्हणून
| [H+] [OH–] = 10 –14 परंतु [H+] = [OH–]
∴ [H+] [OH–] = [H+]2 10 –14 |
|||
| ∴ [H+]2 = | √ | 10 –14 | = 10 –7 |
याचा अर्थ पाण्यामध्ये (२५० से. तापमानास) हायड्रोजन आयनांची संहती प्रतिलिटर १० – ७ ग्रॅमरेणू म्हणजेच १ / १००००००० असते.
| यावरून पाण्याचे pH = लॉग१० | १ | = ७ येते. |
| १० – ७ |
अम्ल विद्रावांच्या हायड्रोजन आयन संहती निश्चित केल्या तर असे आढळते की, अम्लांच्या विद्रावात त्या १० – ७ ग्रॅमरेणू / लिटर यापेक्षा जास्त असतात, म्हणजेच त्यांची pH मूल्ये ७ पेक्षा कमी असतात. प्रबल अम्लांच्या विद्रावात (उदा., हायड्रोक्लोरिक, सल्फ्युरिक) हायड्रोजन आयनांच्या संहती दुर्बल अम्लांच्या (उदा., अँसिटिक) विद्रावातील संहतीपेक्षा जास्त असतात.
pH मूल्याच्या भाषेत याचा अर्थ असा होतो की, अम्ल विद्रावांची pH मूल्ये नेहमी ७ पेक्षा कमी असून अम्ल जितके जास्त प्रबल तितके त्याचे pH मूल्य कमी असते.
क्षारक विद्रावांची pH मूल्ये ७ पेक्षा जास्त असून ती ७ ते १४ या मर्यादेत येतात. दुर्बल क्षारकाच्या pH मूल्यापेक्षा प्रबल क्षारकाचे pH मूल्य जास्त असते.
संपुर्ण pH मूल्यमापनाची व्याप्ती ० ते १४ या मर्यादेत येते. pH मूल्यावर विद्रावाच्या तापमानाचा परिणाम होतो. पाण्याचे pH मूल्य २५० से. तापमानास जरी ७ असते, तरी ०० तापमानास ते ७·४७ व १००० से. तापमानास ६·१० होते.
काही सामान्य पदार्थांची pH मूल्ये
Table missing (not typed)
ज्या विद्रावामध्ये अम्ले अथवा क्षारके मिसळली, तरी त्यांच्या मूळच्या pH मूल्यात फारसा बदल होत नाही त्यांना ⇨ उभयप्रतिरोधी विद्राव म्हणतात. निरनिरळ्या pH मूल्यांचे असे विद्राव बनविता येतात व अनेक ठिकाणी वापरले जातात.
अम्ले अथवा क्षारक यांचा प्रभाव त्यांच्या रेणूमध्ये किती हायड्रोजन अणू आहेत यावर अवलंबून नसतो, तर तो किती अणू हायड्रोजन आयनांच्या रूपात (H+) येतात यावरून ठरतो, हे pH मूल्यांवरून स्पष्ट होते. उदा., सल्फ्यूरिक अम्ल (H2 SO4) आणि बोरिक अम्ल (H3BO3) यांमध्ये अनुक्रमे २ व ३ हायड्रोजन अणू आहेत. या अम्लांत पाणी मिसळले, तर सल्फ्यूरिक अम्लातील सर्व हायड्रोजन अणूचे आयन बनतात पण बोरिक अम्लातील फारच थोडे आयन रूपात येतात. त्यामुळेच सल्फ्युरिक अम्ले हे प्रबल अम्ल आहे व बोरिक अम्ल हे दुर्बल अम्ल आहे. [→ अम्ले व क्षारक].
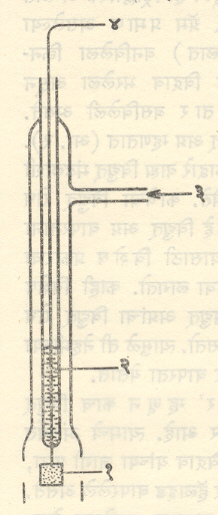
pH मूल्यमापन : विद्युत् वर्चस् मापन पध्दती : (विद्युत् स्थिती मोजण्याची पध्दती). विद्रावाचे pH मूल्य काटेकोरपणे ठरविता येते. याकरिता करावयाच्या योजनेत हायड्रोजन आयनाचा परिणाम होईल असे विद्युत् अग्र (याला दर्शक विद्युत् अग्र म्हणतात) pH मूल्य काढावयाच्या विद्रावात बुडविलेले असते. दुसरे विद्युत् अग्र (संदर्भ विद्युत् अग्र) बहुतेक ठिकाणी कॅलोमेलाचे असते. ही दोन विद्युत् अग्रे लवण सेतूने (एखाद्या लवणाच्या संतृप्त–ठराविक तापमानास जास्तीत जास्त लवण विरघळलेल्या विद्रावाने) किंवा संदर्भ विद्युत् अग्रही विद्रावात बुडवून जोडतात आणि निर्माण झालेली वि. चा. प्रे. ⇨ विद्युत् वर्चस् मापकाने मोजतात. जे मूल्य येईल त्यामधून संदर्भ विद्युत् अग्राची वि. चा. प्रे. मिळते. तीवरून विद्युत् अग्रानुसार योग्य ते समीकरण वापरून विद्रावाचे pH मूल्य निश्चित करतात.
दर्शक विद्युत् अग्र : दर्शक विद्युत् अग्रांचे तीन प्रकार आहेत : (१) हायड्रोजन विद्युत् अग्र, (२) क्विनहायड्रोन विद्युत् अग्र व (३) काच विद्युत् अग्र.
(१) हायड्रोजन विद्युत् अग्र : हे विद्युत् अग्र म्हणजे स्पंजासारख्या प्लॅटिनमाचा थर दिलेला प्लॅटिनमाच्या पातळ पत्र्याचा एक तुकडा असून तो pH मूल्य काढावयाच्या विद्रावात बुडविल्यावर त्याच्या सभोवार हायड्रोजन वायू बुडबुड्यांच्या रूपात निघत राहील अशी योजना केलेली असेते (आ. १). प्लॅटिनमाचा तुकडा एका पोकळ काचेच्या नळीच्या तळात बसविलेल्या प्लॅटिनमाच्या तारेला जोडलेला असून ही नळी अंशत: पाऱ्याने भरलेली असते. बाह्य विद्युत् मंडलाशी पाऱ्याव्दारे जोडणी होते.
प्लॅटिनम या उत्प्रेरकामुळे (विक्रिया सुलभतेने घडावी म्हणून उपयोगी पडणाऱ्या व विक्रियेच्या शेवटी जशाच्या तशा शिल्लक राहणाऱ्या पदार्थांमुळे) पुढील क्रिया घडून येते.
| H2 | – | 2e – | ⇌ | H+ |
| हायड्रोजन रेणू | इलेक्ट्राॅन | हायड्रोजन आयन |
विद्युत् अग्र घन विद्युत् भारित होऊ लागते व अंती त्यावर एक विशिष्ट विद्युत् वर्चस् प्रस्थापित होते. हे विद्युत् वर्चस् हायड्रोजन आयन व हायड्रोजन वायू यांच्या संहतीवर अवलंबून असते.
या विद्युत् अग्रासाठी हायड्रोजन वायू अतिशय शुध्द व कोरडा असावा लागतो. शिवाय प्लॅटिनम उत्प्रेरक सहज निकामी होऊ शकतो. त्यामुळे या विद्युत् अग्राऐवजी दुसरी विद्युत् अग्रे जास्त सोयीची म्हणून पसंत केली जातात.
(२) क्विनहायड्रोन विद्युत् अग्र : मूल्यमापन करावयाच्या विद्रावात क्विनहायड्रोन (यामध्ये हायड्रोक्विनोन व क्विनोन ही संयुगे समान रेणूप्रमाणात असतात) हे संयुग विद्राव संतृप्त होईपर्यंत विरघळविले व त्यात प्लॅटिनमाची तार उभी केली म्हणजे हे विद्युत् अग्र बनते. या ठिकाणी हायड्रोजन आयनांमुळे पुढील विक्रिया घडून येते व विद्युत् वर्चस् निर्माण होते.
| C6H4O2 | + | 2H+ | ⇌ | C6H6O2 | – | 2e– |
| क्विनोन | हायड्रोजन आयन | हायड्रोक्विनोन | इलेक्ट्राॅन |
हे विद्युत् अग्र ७ पेक्षा कमी pH मूल्य असलेल्या विद्रावांकरिताच वापरता येते. त्याचप्रमाणे काही लवणांच्या उपस्थितीत या विद्युत् अग्राचे निष्कर्ष विश्वसनीय नसतात.
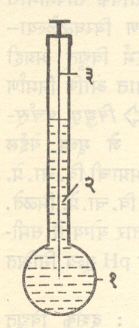
(3) काच विद्युत् अग्र : यात कमी वितळबिंदू असलेल्या काच नलिकेच्या एका टोकाला एक अतिशय पातळ फुगा फुगविलेला असतो. या फुग्यात १ सममूल्य हायड्रोक्लोरिक अम्लात (प्रतिलिटर ३६·५ ग्रॅम प्रमाण असलेल्या हायड्रोक्लोरिक अम्लात) बनविलेला क्विनहोयड्रोनाचा संतृप्त विद्राव भरलेला असून त्यात प्लॅटिनमाची तार बसविलेली असते. तिला अंतर्गत विद्युत् अग्र म्हणतात (आ. २). तारेच्या वरच्या टोकाद्वारे बाह्य विद्युत् मंडलाशी जोडणी करता येते. काचेचा विद्युत् रोध जास्त असल्यामुळे हे विद्युत् अग्र वापरताना वर्चस् मापन करण्यासाठी विशेष प्रकारचा वर्चस् मापक वापरावा लागतो. काही विशेष प्रकारच्या काच विद्युत् अग्रांचा विद्युत् रोध मात्र बराच कमी असतो. त्यामुळे ती नेहमीच्या वर्चस् मापकाबरोबर वापरता येतात.
‘कोरडा प्रकार’ म्हणून काच विद्युत् अग्रांचा एक प्रकार आहे. त्यामध्ये अंतर्गत विद्युत् अग्र आणि विद्राव यांच्या जागी पारा, चांदी किंवा सिल्व्हर हॅलाइड वापरलेले असते. हे विद्युत् अग्र सामान्यत : काचेच्या केशनलिकेचे केलेले असते. तिच्या बाह्यपृष्ठावर चांदी अथवा सिल्व्हर हॅलाइडाचा थर दिलेला असतो व त्याची विद्युत् मंडलाशी जोडणी तांब्याच्या किंवा चांदीच्या तारेने करता येते. ज्याचे pH मूल्य काढावयाचे आहे तो विद्राव केशनलिकेत ओढून घेता येतो किंवा त्या विद्रावात विद्युत् अग्र बुडविता येते.
फुग्यासारखे, सपाट पापुद्र्यासारखे, टाचणीच्या टोकासारखे किंवा वलयांसारखे काच पटल असलेली काच विद्युत् अग्रेही उपलब्ध आहेत. काच विद्युत् अग्रे टिकाऊ असतात व काळजीपूर्वक वापरल्यास दार्घकाल कार्यक्षम राहतात.
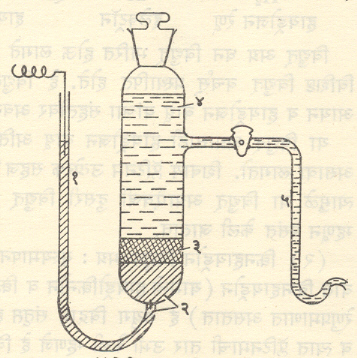
कॅलोमेल संदर्भ विद्युत् अग्र : तळाशी एक व बाजूस दुसरी अशा दोन नळ्या जोडलेल्या एका उभ्या काचपात्रात तळाशी शुध्द पारा, त्यावर कॅलोमेल (मर्क्युरस क्लोराइड) व पारा एकत्र खलून केलेली रबडी आणि त्यावर (आणि बाजूच्या दुसऱ्या नळीतही) पोटॅशियम क्लोराइडाचा कॅलोमेलाने संतृप्त असलेला जलीय विद्राव अशी याची रचना असते. तळातील नळीत प्लॅटिनमाची तार असून ती पाऱ्याशी संपर्क करील अशा तऱ्हेने बनविलेली असते (आ. ३.).
पोटॅशियम क्लोराइड विद्रावाच्या संहतीनुसार या विद्युत् अग्राचे तीन प्रकार आहेत. ते म्हणजे संतृप्त पोटॅशियम क्लोराइड विद्राव असलेले,१ सममूल्य पोटॅशियम क्लोराइडाचा विद्राव असलेले व १/१० सममूल्य विद्राव असलेले. यांपैकी पहिला प्रकार विशेष वापरला जातो. कारण त्यामध्ये पोटॅशियम क्लोराइडाच्या विद्रावावर पोटॅशियम क्लोराइडाचे काही स्फटिक ठेवून विद्राव नेहमी संतृप्त ठेवणे सहजसाध्य असते. या विद्युत् अग्राचे विद्युत् वर्चस् ज्ञात असल्यामुळे संदर्भ विद्युत् अग्र म्हणून अनेक ठिकाणी याचा वापर केला जातो.
मूल्यांचे आकडे प्रत्यक्ष दर्शविणारी pH मापके : आकडेमोड करावी न लागता विद्रावाचे pH मूल्य प्रत्यक्ष आकड्यांनी दर्शवितील अशी pH मापके आता उपलब्ध आहेत. यांत हायड्रोजन आयनांना प्रतिसाद देणारे एक विद्युत् अग्र (काच विद्युत् अग्र), एक संदर्भ विद्युत् अग्र (बहुधा संतृप्त कॅलोमेल विद्युत् अग्र) व एक लवणसेतू यांनी बनलेला pH घट आणि त्यात निर्माण झालेली वि. चा. प्रे. अचूकपणे मोजणारा उच्च रोधयुक्त ⇨ व्होल्टमापक असतात. ज्ञात pH मूल्यांच्या विद्रावांच्या साहाय्याने त्यातील मूल्यदर्शक पट्टीचे अंशन (pH मूल्ये दर्शविणारी अंशात्मक विभागणी) केलेली असते.
वर्णमापन पध्दतीने pH मूल्य ठरविणे : काही कार्बनी संयुगांचे वर्ण हायड्रोजन आयन संहतीनुसार बदलतात. त्यांना ⇨ दर्शके म्हणतात. त्याचा उपयोग करून विद्रावाचे pH मूल्य ठरविता येते. विद्रावाच्या संभाव्य pH मूल्याची कल्पना असल्यास योग्य दर्शकाची निवड करता येते. अन्यथा सर्वकामी [२ ते १० या pH मूल्यांच्या मर्यादेत वर्णबदल दाखविणारा → दर्शके] दर्शक वापरता येतो.
वेगवेगळ्या ज्ञात pH मूल्यांचे विद्राव घेऊन व त्यांत ठराविक प्रमाणात दर्शक मिसळून निरनिरळ्या pH मूल्यांस बनणाऱ्या वर्णांचे प्रमाणित नमुने तयार करतात. नंतर ज्याचे pH मूल्य काढावयाचे आहे तो विद्राव घेऊन त्यात त्याच प्रमाणात ते दर्शक मिसळतात. त्यामुळे जो वर्ण येईल त्याची तुलना प्रमाणित वर्णाच्या नमुन्याशी करतात. ज्या प्रमाणित वर्णाशी हा वर्ण जमेल त्याचे जे pH मूल्य असेल तेच या विद्रावाचे pH मूल्य होय.
वर्णांची तुलना करणे सोपे व्हावे म्हणून काही साधनेही उपलब्ध आहेत. अशा एका साधनात वर्ण ठरविण्यासाठी विविध वर्णांच्या काचा वापरतात. दिलेला दर्शक वापरून विद्रावाला आलेल्या वर्णाची या काचा शेजारी धरून त्यातून येणाऱ्या प्रकाशामुळे तुलना करता येते. यामध्ये ०· pH मूल्याने पडणारे वर्णबदल ओळखता येतात. अशी कित्येक साधने सुटसुटीत व वापरण्यास सोपी असतात.
वर्णमापन पध्दतीने मापन करताना विद्रावातील लवणांचे अस्तित्व, तापमानात पडणारे फरक वर्ण अचूकतेने ओळखण्याची अनिश्चितता या कारणांमुळे pH मूल्यात ०·२ ते ०·४ इतका फरक पडण्याची शक्यता असते.
pH मूल्यांचे महत्त्व : एंझाइमांची (जीवरासायनिक विक्रिया घडवून आणण्यात मदत करणाऱ्या प्रथिनयुक्त द्रव्यांची) क्रियाशीलता माध्यमाच्या pH मूल्यावर अवलंबून असते. उदा., मानवी जठररसातील पेप्सीन हे त्याचे pH मूल्य १.५ ते २ याच्या दरम्यान असताना सर्वाधिक क्रियाशील असते. जेवल्यानंतर २ तासांनी जठरातील द्रवाचे pH मूल्य ५ ते ६ इतके होते. त्या वेळी पेप्सीन निष्क्रिय बनते.
शेतजमिनीची (मृदेची) परीक्षा करून ती अम्लधर्मी, क्षारधर्मी (अल्कालाइन) किंवा उदासीन आहे हे ठरविण्यासाठी तिचे pH मूल्य काढणे आवश्यक असते. ते कळल्यावर तीमध्ये इष्ट सुधारणा करण्यासाठी (उदा., अम्लता घालविण्यासाठी चुना मिसळणे किंवा अम्लता वाढविण्यासाठी गंधक, सल्फ्युरिक अम्ल इ. मिसळणे) उपाय निश्चित करता येतात. खाद्यपदार्थांवर करावयाच्या प्रक्रियांत तसेच कागदाचा लगदा व कागद बनविण्याच्या उद्योगातील कृतीत pH नियंत्रण आवश्यक असते. रोगनिदान आणि उपचार यांकरिता शरीरातील रक्तरस, कोशिकांतर्गत (पेशींच्या आतील) द्रव, ऊतकद्रव (समान रचना व कार्य असलेल्या कोशिकांच्या समूहातील द्रव), मूत्र इत्यादींच्या pH मूल्यांची तपासणी करणे उपयुक्त असते.
पहा : अम्ले व क्षारक; उभयप्रतिरोधी विद्राव.
संदर्भ : 1. Bates, R. G. Determination of pH Theory and Practice, New York, 1964.
2. Donbrow, M. Instrumental Methods of Analytical Chemistry, Vol. I, Electrochemical Methods, London, 1966.
3. Maron, S. H. Prutton, C. F. Principles of Physical Chemistry, New York, 1961.
4. Mee, A. J. Physical Chemistry, London, 1962.
5. Willard, H. H. Merrit, L. L. Dean, A. J. Instrumental Methods of Analysis, New Delhi, 1955.
कट्टी, ना. गो. केळकर, गो. रा.
“