फिनॉले : ॲरोमॅटिक वलयातील [⟶ ॲरोमॅटिक संयुगे] एका अथवा अधिक हायड्रोजन अणूंच्या जागी एक अथवा अधिक हायड्रॉक्सी गट (OH) आल्याने (म्हणजे प्रतिष्ठापित झाल्याने) बनलेल्या संयुगांचा वर्ग. एक हायड्रॉक्सी गट असलेल्या फिनॉलांना मोनोहायड्रॉक्सी, दोन असलेल्यांना डायहायड्रॉक्सी आणि तीन असलेल्यांना ट्रायहायड्रॉक्सी फिनॉले म्हणतात.
नामकरण : फिनॉलांच्या संरचना सूत्रे १ ते ५ मध्ये दर्शविल्याप्रमाणे व्यक्त केल्या जातात. काहींना विशेषनामेही आहेत. त्यांचाही उपयोग सोयीसाठी केला जातो उदा., मोनोहायड्रॉक्सी फिनॉलाला नुसतेच फिनॉल किंवा कार्बॉलिक अम्ल ही विशेषनामे आहेत.
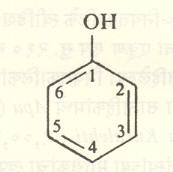
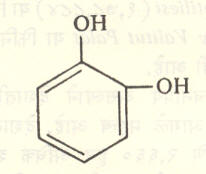
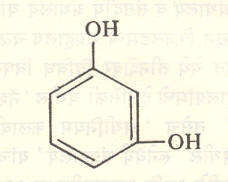
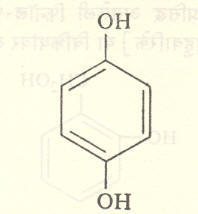
१ : २ : ३- ट्रायहायड्रॉक्सी बेंझीनाला पायरोगॅलॉल व १ : ३ : ५ — ट्रायहायड्रॉक्सी बेंझीनाला फ्लोरोग्लूसिनॉल म्हणतात. वलयात इतर गट असतील, तर त्यांचा स्थानासह उल्लेख करून नामकरण
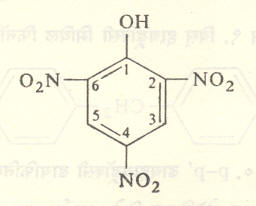
करतात. उदा., २ : ४ : ६ – ट्रायनायट्रोफिनॉल (पिक्रिक अम्ल) याचाच उल्लेख HO-C6H2(NO2)3 (१, २. ४, ६) असाही करतात. (सूत्र ५).
फिनॉल : (कार्बॉलिक अम्ल). हे प्रथम एफ्. एफ्. रूंगे यांनी १८३४ मध्ये दगडी कोळशाच्या डांबरापासून मिळविले व त्याला कार्बॉलिक अम्ल हे नाव दिले. ऑग्यूस्त लॉरां यांनी ते १८४१ मध्ये स्फटिकरूपात मिळविले व त्याला फिनॉलिक अम्ल म्हटले. याचेच संक्षिप्त रूप फिनॉल हे रूढ झाले.
व्यापारी उत्पादन : (१) दगडी कोळशाच्या डांबरातील मध्यम व डांबरअम्ल अंशापासून हे वेगळे काढले जाते [⟶ डांबर]. संश्लेषणाने (घटक द्रव्ये एकत्र आणून कृत्रिम रीतीने) हे पुढील प्रक्रियांनी बनविले जाते.
(२) बेंझीन व प्रोपिलीन यांपासून प्रथम क्युमीन (आयसोप्रोपिल बेंझीन) बनवितात व दाहक (कॉस्टिक) सोड्याच्या विरल विद्रावाने त्यास पायसरून (एकमेकांत न मिसळणाऱ्या द्रवांपासून बनलेल्या दृढ मिश्रणाचे रूप) देऊन हवेने त्याचे ऑक्सिडीकरण [⟶ ऑक्सीडीभवन] करतात. त्यामुळे क्युमीन हायड्रोपेरॉक्साइड बनते. सल्फ्यूरिक अम्लाच्या विक्रियेने त्यापासून फिनॉल व ॲसिटोन बनतात.
|
C6H5CH — (CH3)2 |
+ |
O2 |
⟶ |
C6H5C (CH3)2 OOH |
⟶ |
|
क्युमीन |
क्युमीन हायड्रोपेरॉक्साइड |
|
C6H5OH |
+ |
(CH3)2 CO |
|
फिनॉल |
ॲसिटोन |
सूत्र ६. क्युमिनापासून फिनॉल बनविण्याची विक्रिया
(३) टोल्यूइनाचे दोन टप्प्यांत ऑक्सीडीकरण करून पहिल्या टप्प्यात कोबाल्ट नॅप्थिनेट हा उत्प्रेरक (विक्रियेत भान न घेता तिचा वेग बदलणारा पदार्थ) वापरून ऑक्सीडीकरण केले म्हणजे बेंझॉइक अम्ल बनते. दुसऱ्या टप्प्यात क्युप्रिक बेंझोएट या उत्प्रेरकाच्या सान्निध्यात पाण्याची वाफ व हवा यांच्या योगाने विक्रिया होऊन फिनॉल मिळते. त्याच वेळी बेंझाल्डिहाइड, बेंझिल अल्कोहॉल व बेंझिल बेंझोएट हे उपपदार्थही तयार होतात.
(४) क्लोरोबेंझिनापासून बेंझिनाचे क्लोरिनीकरण करून (क्लोरिनाचा समावेश करून) क्लोरोबेंझीन बनविणे व त्याचे जलीय विच्छेदन (पाण्याच्या विक्रियेने रेणूंचे तुकडे पाडण्याची क्रिया) घडवून फिनॉल बनविण्याच्या दोन पद्धती प्रचलित आहेत. एका पद्धतीत दाहक सोड्याच्या विक्रियेने व दुसऱ्या पद्धतीत सिलिसिक अम्ल हे उत्प्रेरक वापरून पाण्याच्या योगाने जलीय विच्छेदन घडवून आणतात.
(५) बेंझीन सल्फोनेटापासून या प्रक्रियेत संहत (पाण्यातील विद्रावात जास्त प्रमाण असलेल्या) सल्फ्यूरिक अम्लाच्या विक्रियेने बेंझिनाचे बेंझीन सल्फोनिक अम्ल (C6H5SO3H) बनवितात व त्याचे ⇨ उदासिनीकरण करून सोडियम बेंझीन सल्फोनेट मिळवितात. वितळलेल्या दाहक सोड्याने, ३००°-३२०° से. तापमानास त्याचे अपघटन (घटक द्रव्ये अलग करण्याची क्रिया) केले म्हणजे सोडियम फिनेट (C6H5ONa) बनते. नंतर सल्फर डाय-ऑक्साइडाच्या विक्रियेने त्यापासून फिनॉल मिळवितात.
पहिल्या महायुद्धानंतर फिनॉलची मागणी फार वाढल्यामुळे संश्लेषणाने त्याचे उत्पादन मोठ्या प्रमाणावर केले जाते.
गुणधर्म : भौतिक: हे वर्णहीन व स्फटिकी असून त्याचा वितळबिंदू ४३° से. व उकळबिंदू १८२° से. आहे. त्याला विशिष्ट वास येतो. हवा व प्रकाश यांच्या संपर्काने ते गुलाबी होते. थंड पाण्यात ते अंशतः आणि उष्ण पाण्यात (६६° से.च्यावर) पूर्ण विद्राव (विरघळणारे) आहे. ईथर, अल्कोहॉल, ॲसिटिक अम्ल, बेंझीन, ग्लिसरॉल यांमध्ये ते विरघळते.
रासायनिक: पुढील विक्रिया फिनॉल वर्गाच्या लाक्षणिक विक्रिया आहेत फिनॉल व प्रतिष्ठापित फिनॉले यांवर त्या घडून येतात.
(१)फेरिक क्लोराइडाच्या विद्रावाने फिनॉलाना जांभळा, निळा, हिरवा इ. रंग येतात. फिनॉल स्वतः जांभळे होते.
(२)संहत सल्फ्यूरिक अम्लात फिनॉले विरघळविली व त्या विद्रावात सोडियम नायट्राइट विद्रावाचे थेंब टाकले व मिश्रम पाण्याने विरल केले, तर तांबडा रंग येतो. त्यात जलीय सोडियम हायड्रॉक्साइड मिसळून मिश्रण क्षारधर्मी (अम्लाशी विक्रिया झाल्यास लवण देणाऱ्या पदार्थाचे गुणधर्म असणारे) केले, तर मिश्रणास निळा अथवा हिरवा रंग येतो.
(३)ब्रोमिनाचा जलीय विद्राव मिसळल्यास फिनॉलांमुळे पांढरे अवक्षेप (न विरघळणाऱ्या साक्याच्या रूपातील पदार्थ) बनतात.
(४)डायाझोटीकृत [⟶ डायाझोटीकरण] अमाइनांच्या विद्रावात फिनॉलांचे क्षारमिश्र विद्राव मिसळले असता नारिंगी किंवा लाल रंगाच्या ॲझोरंजकाचे अवक्षेप मिळतात [⟶ ॲझो संयुगे].
(५)थॅलिक अनहायड्राइड व संहत सल्फ्यूरिक अम्ल यांच्या विक्रियेने फिनॉलांपासून थॅलिन वर्गाची संयुगे बनतात. दाहक सोड्याचा विद्राव मिसळल्यास त्यांचे विविध रंगाचे अनुस्फुरकी (विशिष्ट तरंगलांबीच्या प्रकाशाचे शोषण करून निराळ्या, बहुशः अधिक, तरंगलाबीचे प्रकाशतरंग बाहेर टाकणारे) विद्राव बनतात. फिनॉलापासून फिनॉलप्थॅलीन हे सुपरिचित दर्शक [⟶ दर्शके] बनते.
(६)बेंझॉइल क्लोराइडाची विक्रिया होऊन बेंझोएट वर्गाची संयुगे बनतात. फिनॉलाचे फिनिल बेंझोएट बनते.
(७)सोडियम कार्बोनेटाच्या विद्रावात फिनॉले मिसळल्यास कार्बन डाय-ऑक्साइड वायू निघत नाही. नायट्रो गट प्रतिष्ठापित असलेली फिनॉले मात्र याला अपवाद आहेत.
फिनॉल (C6H5OH) हे एक दुर्बल (ज्याचे जलीय विद्रावात अल्प प्रमाणात आयनीभवन होते असे आयनीभवन म्हणजे विद्युत् भारित अणू, रेणू वा अणुगटांत रूपांतर होणे) अम्ल आहे. प्रबल (ज्याचे जलीय विद्रावात उच्च प्रमाणात आयनीभवन होते अशा) क्षारकाबरोबर (अम्लाशी विक्रिया झाल्यास लवण देणाऱ्या पदार्थाबरोबर) विक्रिया होऊन फिनेटे किंवा फिनॉक्साइडे बनतात. उदा., दाहक सोड्याच्या क्रियेने सोडियम फिनेट किंवा सोडियम फिनॉक्साइड (C6H5ONa) हे संयुग बनते. बहुतेक फिनेट पाण्यात विद्राव्य असून कार्बन डाय-ऑक्साइडाने त्यांचे अपघटन (रेणूंचे तकडे होणे) होते व फिनॉले बनतात.
एस्टरीकरणाने [⟶ एस्टरीकरण] फिनॉलापासून फिनिल ॲसिटेट, फिनिल सॅलिसिलेट, ट्रायफिनिल फॉस्फेट इ. औद्योगिक दृष्ट्या महत्त्वाची एस्टरे बनतात.
सोडियम फिनेट व अल्किल हॅलाइडे यांमध्ये विक्रिया होऊन फिनिल ईथरे बनतात. फिनिल मिथिल ईथर (ॲनिसोल, C6H5O.CH3), फिनिल एथिल ईथर (फिनेटोल, C6H5O·C2H5) ही प्रमुख फिनिल ईथरे होत. डायअरिल ईथरे ही फिनॉल व ब्रोमोबेंझीन यांची विक्रिया ताम्रचूर्ण व दाहक पोटॅश यांच्यासह उलमान विक्रिया घडविली असता बनतात. डायफिनिल ईथर (C6H5-O-C6H5) हे उष्णता स्थानांतर करण्यासाठी उपयोगी पडणारे एक महत्त्वाचे डायअरिल ईथर आहे.
फिनॉलातील OH या कार्यकारी गटापासून मिळणाऱ्या वरील अनुजातांप्रमाणेच (एक संयुगापासून मिळणाऱ्या दुसऱ्या संयुगांप्रमाणेच) बेंझीन वलयातील हायड्रोजन अणूंचे प्रतिष्ठापन होऊन अनेक प्रतिष्ठापित फिनॉले मिळतात.
फिनॉलावर ब्रोमीन जलाची विक्रिया त्वरित होते व २, ४, ६- ट्रायब्रोमोफिनॉल अवक्षेपित होते. ही विक्रिया फिनॉलाचे परिमाणात्मक आगणक करण्यासाठी (एखाद्या नमुन्यातील परिमाणाचा अंदाज करण्यासाठी) वापरता येते.
नायट्रिक अम्लाच्या विक्रियेने योग्य प्रक्रिया वापरून २-नायट्रोफिनॉल, २, ४ – डायनायट्रोफिनॉल व २, ४, ६- ट्रायनायट्रोफिनॉल (पिक्रिक अम्ल) ही प्रतिष्ठापित नायट्रो संयुगे मिळविता येतात.
नायट्रोफिनॉलांच्या ⇨ क्षपणाने ॲमिनो फिनॉले बनतात. त्यांपैकी मेटा ॲमिनो फिनॉल रंजकद्रव्य धंद्यात मध्यस्थ संयुग (अंतिम पदार्थ मिळविण्याच्या प्रक्रियेतील मधल्या टप्प्यातील संयुग) म्हणून आणि पॅरा ॲमिनो फिनॉल छायाचित्रणात विकाशनकारक (प्रकाशन केलेल्या फिल्मवरील अदृश्य चित्राचे दृश्य चित्रात रूपांतर करण्याच्या रासायनिक प्रक्रियेत वापरण्यात येणारी द्रव्ये) म्हणून वापरली जातात.
संहत सल्फ्यूरिक अम्लाच्या विक्रियेने २-फिनॉल सल्फॉनिक अम्ल व ४-फिनॉल सल्फॉनिक अम्ल यांचे मिश्रण मिळते.
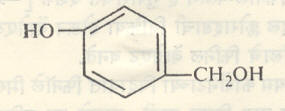
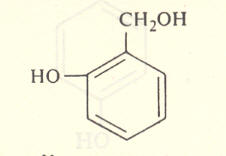
ॲलिफॅटिक व ॲरोमॅटिक आल्डिहाइडांची विक्रिया फिनॉलावर होते व OH गटाच्या ऑर्थो व पॅरा स्थानी प्रतिष्ठापन होते. उदा., फॉर्माल्डिहाइडाचा ४०% जलीय विद्राव आणि फिनॉल यांची विक्रिया, विरल अम्ल किंवा क्षार यांच्या उपस्थितीत व कमी तापमानास घडविली असता मुख्यतः पॅराहायड्रॉक्सी बेंझिल अल्कोहॉल (सूत्र ७) व अल्प प्रमाणात ऑर्थोहायड्रॉक्सी बेंझिल अल्कोहॉल (सूत्र ८) ही संयुगे बनतात.
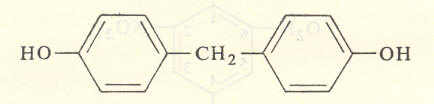
फॉर्माल्डिहाइडाचे प्रमाण वाढविले व इतर परिस्थितीत फरक केला असता दोन बिस् हायड्रॉक्सी मिथिल फिनॉले (सूत्र ९) व पॅरा-पॅराडॅश (P-P’) डायहायड्रॉक्सी डायफिनिलमिथेन (सूत्र १०) तयार होतात.
बेकेलाइट म्हणून प्रसिद्ध असलेली फिनॉल-फार्माल्डिहाइड रेझिने [⟶ प्लॅस्टिक व उच्च बहुवरिके] या विक्रियांवर आधारलेली आहेत.

सोडियम अथवा पोटॅशियम फिनेट कार्बन-डाय-ऑक्साइडाबरोबर तापविले असता सोडियम सॅलिसिलेट बनते त्यापासून ⇨ सॅलिसिलिक अम्ल तयार करता येते. निकेल उत्प्रेरक वापरून हायड्रोजनीकरण (हायड्रोजनाशी विक्रिया) केले असता फिनॉलाचे सायक्लोहेक्झॅनॉल (C6H11OH) बनते.
जस्ताच्या चूर्णाबरोबर तापविल्यास फिनॉलापासून बेंझिन तयार होते. ही विक्रिया नैसर्गिक कार्बनी पदार्थांच्या संरचना ठरविताना उपयोगी पडते.
फिनॉलाचे (इतर मोनोहायड्रिक फिनॉलांचेही) पोटॅशियम परसल्फेटाच्या विक्रियेने ऑक्सीडीकरण होऊन क्विनॉल हे डायहायड्रिक फिनॉल बनते. या विक्रियेत नवीन हायड्रॉक्सी गट मूळ हायड्रॉक्सी गटाच्या पॅरा स्थानी येतो. ती जागा रिकामी नसेल, तर ऑर्थो जागी येतो.
पोटॅशियम परमँगॅनेटाने फिनॉलाचे ऑक्सीडीकरण केल्यास बेंझीन वलयाचा एक भंग होतो. बहुतेक सर्व फिनॉलांच्या अंगी हा गुण आहे. तथापि फिनॉलांच्या समजातांच्या लागोपाठच्या (ज्यातील संयुगांच्या रेणूंत एका-CH2-गटाचा फरक आहे अशा श्रेणीतील संयुगांच्या) हायड्रॉक्सी गटांचे प्रथम ⇨ ॲसिलिकरण किंवा ⇨ अल्किलीकरण केले, तर त्यामधील मिथिल गटांचे ऑक्सीडीकरण करून ती ती ⇨ कार्बॉक्सिलिक अम्ले बनविता येतात. उदा., पॅराक्रेसॉलापासून पॅराहायड्रॉक्सी बेंझॉइक अम्ल मिळते.
क्रेसॉले (ऑर्थो, मेटा व पॅरा मिथिल फिनॉले) हे फिनॉलाचे समजात दगडी कोळशाच्या डांबरापासून वेगळे केले जातात [⟶ डांबर]. क्रेसॉलांच्या मिश्रणाला क्रिओसोट किंवा क्रिसेलिक अम्ल म्हणतात. इमारती लाकूड, रेल्वेच्या रूळांखाली आधाराकरिता वापरण्यात येणारे सिलिपाट (स्लिपर्स) करिता परिरक्षक (टिकण्यास मदत करणारा पदार्थ) म्हणून ते वापरले जाते. साबणाच्या पाण्यात केलेला याचा विद्राव (लायसॉल) जंतुनाशक म्हणून वापरला जातो.
थायमॉल (३ – मिथिल ६- आयसोप्रोपिल फिनॉल), कारव्हेक्रॉल (२ – मिथिल ५- आयसोप्रोपिल फिनॉल) इ. प्रतिष्ठापित फिनॉले निसर्गात आढळतात व संश्लेषणानेही बनविली जातात [⟶ बाष्पनशील तेले].
सॅलिसिलिक अम्लाचे मिथिल एस्टर, फिनिल एस्टर व ॲसिटिल सॅलिसिलिक अम्ल हे अनुजात, अनुक्रमे ऑइल विंटरग्रीन, सॅलॉल व ॲस्पिरीन या नावांनी प्रसिद्ध असून औषधात वापरले जातात. पॅरा ॲमिनो सॅलिसिलिक अम्ल (३ – ॲमिनो ६- कार्बॉक्सी फिनॉल) हे क्षयावर गुणकारी औषध असून ‘पास’ (PAS) म्हणून ओळखले जाते.
डायहायड्रिक फिनॉले : कॅटेचोल हे या वर्गाचे एक संयुग ऑर्थोक्लोरोफिनॉल किंवा ऑर्थोडायक्लोरोबेंझीन जलीय सोडियम हायड्रॉक्साइड व अल्प प्रमाणात कॉपर सल्फेट यांचे मिश्रण दाब वापरून १९०° से. तापमानास तापवून बनवितात. हे एक प्रबल क्षपणकारी आहे. छायाचित्रणात विकाशनकारक म्हणून वापरतात. बेंझीन मेटाडायसल्फॉनिक अम्ल क्षारकाबरोबर वितळवून रिसॉरसिनॉल बनवितात.
ॲनिलिनाचे ऑक्सिडीकरण केले असता एका पाठोपाठ अनेक विक्रिया होऊन अखेर क्विनोन हे एक पिवळे संयुग बनते. त्याचे क्षपण करून क्विनॉल बनवितात. हेही छायाचित्रणात विकाशनकारक म्हणून उपयोगी पडते.
ट्रायहायड्रिक फिनॉले : पायरोगॅलॉल हे संयुग गॅलिक अम्लाचा (१, २, ३ – ट्रायहायड्रॉक्सी ५-कार्बॉक्सी बेंझिनाचा) जलीय विद्राव दाब वापरून २१०° से. तापमानास तापविल्याने मिळते. याचा उपयोग वायुविश्लेषणात ऑक्सिजन व कार्बन डाय-ऑक्साइड यांचे शोषण करण्यासाठी केला जातो. छायाचित्रणात विकाशनकारक म्हणूनही याचा उपयोग होतो.
२, ४, ६ – ट्रायॲमिनो बेंझॉइक अम्लाचे जलीय विच्छेदन केले असता कार्बॉक्सी गट निघून जातो आणि ॲमिनो गटांचे हायड्रॉक्सी गटात रूपांतर होऊन फ्लोरोग्लूसिनॉल बनते. रिसॉरसिनॉल दाहक सोड्याबरोबर वितळवूनही हे बनविता येते. रासायनिक विश्लेषणात आणि औषधे व रंग यांच्या उत्पादनात हे वापरले जाते.
उपयोग: फिनॉलिक रेझिने, बिस्फिनॉल-ए, अल्किल फिनॉले, तणनाशके, कीटकनाशके, ⇨ हॉर्मोने, औषधे, रंजकद्रव्ये, सुवासिक पदार्थ, छायाचित्रणाकरिता लागणारी रसायने इत्यादींच्या उत्पादनात लागणारी मध्यस्थ संयुगे मिळविण्यासाठी फिनॉल वापरले जाते. वंगण तेलाच्या शुद्धीकरणात विद्रावक (विरघळविणारा पदार्थ) म्हणूनही त्याचा उपयोग होतो. भारतात फिनॉल- फॉर्माल्डिहाइड रेझिने, अल्डिड-फिनॉल रेझिने, कृत्रिम तंतू तयार करण्यासाठी वापरण्यात येणारे कॅप्रोलॅक्टम, विविध प्रकारची अंत्य-उत्पादन रसायने इत्यादींच्या उत्पादनात फिनॉल मुख्यत्वे वापरली जाते. पूतिरोधक [रोगकारक सूक्ष्मजंतूंचा वा सूक्ष्मजीवांचा नाश करण्यासाठी किंवा त्यांची वाढ रोखण्यासाठी वापरण्यात येणारा रासायनिक पदार्थ ⟶ पूतिरोधके] म्हणून शस्त्रक्रियेत वापण्यात आलेले फिनॉल हे पहिले संयुग होय.
वापरताना घ्यावयाची काळजी: याच्या संपर्काने त्वचा भाजते व तंत्रिकांवर (मज्जातंतूंवर) अनिष्ट परिणाम होतो. हे जास्त प्रमाणात त्वचेवर पडल्यास मृत्यूही संभवतो. अल्कोहॉलाचे किंवा गरम पाण्याने तत्काल त्वचा धुतल्यास गंभीर परिणाम टळतात. डोळ्यात गेल्यास अल्कोहॉलाऐवजी पाण्याने डोळे धुतात. कारखान्यात सुरक्षिततेसाठी अल्कोहॉलाचा साठा ठेवतात व अंगावर पाणी फवारता येईल, अशी योजना केलेली असते.
फिनॉलशी संपर्क येण्याचा संभव असलेल्या कर्मचाऱ्यांनी संरक्षक चष्मे, रबरी हातमोजे व संरक्षक आवरणे वापरणे आवश्यक असते.
विनिर्देश: अमेरिकेच्या संयुक्त संस्थानांच्या औषधिकोशातील विनिर्देशानुसार योग्य दर्जाच्या फिनॉलामध्ये फिनॉलाचे प्रमाण ९८ टक्क्यांपेक्षा कमी असू नये. त्याची विद्राव्यता १५ भाग पाण्यात १ भाग इतकी असून गोठणबिंदू ३९°से. पेक्षा कमी नसावा. त्यामध्ये बाष्पनशील (बाष्परूपाने उडून जाणाऱ्या) पदार्थाचे प्रमाण शेकडा ०·०५ पेक्षा जास्त नसावे. संश्लेषणाने बनविलेल्या बहुतेक सर्व फिनॉलांचा दर्जा या विनिर्देशापेक्षा जास्त उच्च असतो.
संदर्भ : 1. Faith, W. L. Keyes, D. B. Clark, R. L. Industrial Chemicals, London, 1957.
2. Finer, I. L. Organic Chemistry, Vol. I, London, 1973.
3. Gopal Rao, M. Sittig, M., Ed., Dryden’s Outlines of Chemical Technology, New Delhi, 1973.
जोशी, पां. ह. मिठारी, भू. चिं.
“