इंधन : घरगुती कामासाठी किंवा औद्योगिक उपयोगासाठी लागणारी उष्णता उत्पन्न करण्याकरिता अगर प्रकाश मिळविण्यासाठी जे पदार्थ जाळतात त्यांना इंधन म्हणतात. इंधन घन, द्रव किंवा वायू अशा कोणत्याही स्वरूपात असू शकते. लाकूड, दगडी कोळसा, खनिज तेल व नैसर्गिक (खनिज) वायू ही मुख्य, मूलभूत व नैसर्गिक इंधने आहेत. लोणारी कोळसा, कोक रॉकेल, पेट्रोल वगैरे तेले प्रोपेन, ब्युटेन, भट्टीमध्ये तयार केलेले वायू, मैलावायू ही साधित (मुद्दाम मिळविलेली) इंधने आहेत व मिथिल अल्कोहॉल, ॲसिटिलीन वायू वगैरे रासायनिक पदार्थ कृत्रिम इंधने आहेत. विद्युत्, सौर व आणवीय या ऊर्जांचाही काही वेळा इंधन या संदर्भात उल्लेख केला जातो परंतु वरील व्याख्येनुसार त्यांचा इंधन या संज्ञेत समावेश करणे योग्य होणार नाही.
झाडे तोडून इंधनाचे लाकूड मिळवितात. दगडी कोळसा, खनिज तेल व खनिज वायू ही इंधने पृथ्वीच्या खडकांत सापडतात. दगडी कोळसा हा वनस्पतींच्या अवशेषांपासून बनलेला असतो [→ कोळसा, दगडी]. खनिज तेल हे सूक्ष्म सागरी प्राण्यांच्या क्रियेमुळे उत्पन्न झालेले असते [→ खनिज तेल]. खनिज तेलाच्या शुद्धीकरणाच्या कारखान्यातील निरुपयोगी वायुरूप भागापासून प्रोपेन व ब्युटेन हे इंधन वायू तयार करतात. घरगुती मैला व शेण विहिरीसारख्या खोल टाकीत साठवून ठेवले म्हणजे त्यामधून मैलावायू मिळतो [→ गोबार वायु]. भट्टीमध्ये कोळसा किंवा तेल तापवून उत्पन्न केलेले वायू घरगुती उपयोगासाठी नळामधून पुरविण्यात येतात. त्यांचा स्वयंचलित वाहनात उपयोग करावयाचा असेल, तर वाहनामध्ये लहानशी भट्टी ठेवतात. प्रोपेन, इंडेन व ब्युटेन अशा काही वायूंना द्रव्यरूप देऊन ते लहानशा मजबूत पोलादी बरण्यांत (सिलिंडरांमध्ये) भरता येतात. त्यामुळे त्यांचे साठवण करून घरोघरी पुरवठा करणे शक्य व सोपे होते. शेण हे उत्तम प्रकारचे खत आहे तरीही त्याचा इंधन म्हणून खेडोपाडी वापर करतात. उसाची चिपाडे, शेंगांची टरफले व धान्यातील कचरा यांचाही इंधन म्हणून उपयोग होतो.
बहुतेक सर्व खंडात दगडी कोळसा सापडतो. अमेरिकेतील संयुक्त संस्थाने, इंग्लंड, फ्रान्स, जर्मनी व चीन या देशांत चांगल्या प्रतीचा दगडी कोळसा विपुल प्रमाणात सापडतो. भारतात तो मुख्यतः गोंडवनी आणि तृतीय कल्पी खडकांत आढळतो. बिहार व प. बंगालमध्ये मिळणारा दगडी कोळसा बऱ्यापैकी असतो. या जातीच्या कोळशाच्या ०·४५ मी. किंवा त्याहून जास्त जाडीच्या थरांचा साठा १०,९०० कोटी टनांवर असावा असा अंदाज आहे. लिग्नाइट म्हणजे हलक्या जातीचा तपकिरी रंगाचा कोळसा तमिळनाडू, राजस्थान, गुजरात, महाराष्ट्र व जम्मू-काश्मीर या राज्यांत असून त्याचा साठा २०६ कोटी टन असावा. यांपैकी २०३ कोटी टनांचा साठा तमिळनाडूतील नेव्हेली भागात आहे.
भारतातील तेलक्षेत्राचा १९७० सालचा अंदाज १०·३६ लक्ष चौ. किमी. एवढा असून ते आसाम, त्रिपुरा, मणिपूर, प. बंगाल, गंगेचे खोरे, पंजाब, हिमाचल प्रदेश, जम्मू-काश्मीर, राजस्थान व गुजरात या राज्यांत विखुरलेले आहे. तसेच पूर्व व पश्चिम किनाऱ्यालगत समुद्राखाली तेल असण्याचा संभव व्यक्त करण्यात आला आहे. खंबायतच्या आखातात तेल सापडलेही आहे. सांप्रत देशी तेलाचे उत्पादन अंदाजे ६८ लक्ष टन असून एकंदर २८० लक्ष टन खपाच्या मानाने अगदी कमी आहे. सर्व जगात दरवर्षी सु. २०० कोटी टन द्रव इंधन वापरण्यात येते. त्याचा पुरवठा मुख्यतः खनिज तेल खाणींतून होतो. जगातील आजचा ज्ञात साठा वार्षिक वापराच्या सु. २५ पट आहे. त्यातील ५०% अमेरिका खंडात व ३०% आशियात इराणच्या आखाताभोवती धरण्यात आला आहे. उत्पादनात सं. संस्थाने ५२%, मध्यपूर्व १८%, द. अमेरिका १५%, रशिया ९% व इतर देश ६% असा क्रम लागतो. यातील भारताचा वाटा ०·२५% पेक्षाही कमी आहे. भारतात द्रव इंधनाचा खप वाढत आहे. १९५१ साली तो ४० लक्ष टन होता तोच १९७१ साली २८० लक्ष टनांपर्यंत जाईल, असा अंदाज होता. खनिज तेलाचा आणखी एक उपलब्ध पण विशेष विनियोग न होणारा साठा कॅनडातील आल्बर्टा प्रांतात ॲथाबास्का नदीच्या खोऱ्यात आहे. हा साठा तेलमिश्रित डांबरी वाळूच्या रूपात असून त्याचा विस्तार मोठा आहे. त्यापासून लाखो टन कच्चे तेल मिळू शकेल. पण ते मिळविणे तांत्रिक दृष्ट्या कठीण व अफाट खर्चाचे असल्याने तेथे मोठ्या प्रमाणात उत्पादन करीत नाहीत.
भारतात खनिज तेलाबरोबर नैसर्गिक इंधन वायूही सापडतो. १९७० च्या मध्यापर्यंत वायू देणाऱ्या ६३ विहिरी होत्या. त्या मुख्यतः गुजरातमधील अंकलेश्वर भागात आहेत. तेथील वायू सुरतजवळील उतराणच्या औष्णिक शक्तिसंयंत्राला व निरनिराळ्या उद्योगधंद्यांना पुरविला जातो. अमेरिकेतील संयुक्त संस्थानांत नैसर्गिक वायूचा इंधन म्हणून मोठ्या प्रमाणात पुरवठा व वापर होतो. तेथे तो २७ संस्थानांत आढळत असून एकूण उत्पादनाच्या दोन तृतीयांश वायूच्या विहिरीतून व एक तृतीयांश तेलाच्या विहिरीतून मिळतो. तेथे आता कोळशाच्या वायूची जागा या नैसर्गिक वायूने घेतली आहे. रशियात नैसर्गिक वायूचे प्रमाण अगदी अल्प आहे. इंग्लंडमध्ये कोळशाच्या काही खाणींच्या परिसरात तो तुरळक मिळतो [→ नैसर्गिक वायु].
इतिहास : प्रथम घरगुती कामाकरिता लागणारा विस्तव तयार करण्यासाठी इंधन म्हणून लाकडाचा उपयोग होऊ लागला. विस्तवापासून उष्णता व रात्री उजेड मिळतो आणि प्रसंगी वन्य श्वापदांपासून आपले रक्षण करता येते याची जाणीव अश्मयुगीन मानवाला झाली. अगदी मध्ययुगीन कालापर्यंत सर्व देशांत अन्न शिजविणे, चुनखडी भाजणे, काही धातू गाळणे यांसारख्या कामांसाठी विस्तवाचा उपयोग करीत असत. उपनिषदांत व ग्रीक वाङ्मयात दिव्यांचा उल्लेख असून पिरॅमिडामध्येही (इ. स. पू. ३००० वर्षे) मृतांच्या शेजारी दिवे ठेवीत असत. दिव्यासाठी इंधन म्हणून मोहरी, तीळ, एरंडी, करंज, जवस व ऑलिव्ह यांची तेले व प्राण्यांची चरबी यांचा सुरुवातीपासून वापर होत होता. दिव्याकरिता खनिज तेलाचा वापर बॅबिलोनिया व इराण येथे बऱ्याच नंतरच्या काळात सुरू झाला.
इंधनाच्या वापरातील प्रगती लाकडी कोळशापासून सुरू झाली. वणव्यात करपून काळ्या झालेल्या लाकडापासून कोळशाच्या उपयोगाची कल्पना आली. जलद व धुराशिवाय प्रज्वलित होणारा विस्तव सहज मिळू लागला तेव्हा कोळशाचे महत्त्व माणसाच्या लक्षात आले. हा कोळसा मुख्यतः धातू गाळण्याच्या कामात विशेष उपयोगी ठरला.
ईजिप्त, चीन, भारत, बॅबिलोनिया इ. पुरातन संस्कृतींच्या देशांत प्राचीन काळी खनिज कोळशाचे उत्पादन होत होते किंवा नाही यासंबंधी निश्चित माहिती मिळत नाही. ग्रीक व रोमन साम्राज्यांनंतर उदय पावलेल्या संस्कृतींतही दगडी कोळशाचा उल्लेख सापडत नाही. रोमन साम्राज्याच्या अखेरच्या काळात रोमन लोकांनी गॉल (फ्रान्स) आणि ब्रिटन या देशांवर स्वाऱ्या करून इ. स. ४९ साली तेथे वसाहती केल्या व त्यानंतरच्या कालात तेथे दगडी कोळशाचा वापर सुरू झाला. जर्मनीतील हॅनोव्हर भागात आणि गॉल व ब्रिटन या देशांत काही ठिकाणी अगदी भूपृष्ठालगत दगडी कोळसा आढळला त्यामुळे तेथेच त्याचा वापर प्रथम सुरू झाला. मार्को पोलो (१२५४—१३२४) यांनी आपल्या वृत्तांतात चीन देशात काळा दगड जाळण्यात येत असल्याचा उल्लेख केला आहे.
भारतातील दगडी कोळशाची पहिली खाण १८१४ मध्ये राणीगंज (बंगाल) येथे सुरू झाली. तेथील साठा भूपृष्ठापासून जवळच होता. सुरुवातीला वाहतुकीच्या अडचणीमुळे कोळशाचे उत्पादन अगदी मर्यादित होते. पण १८५५ मध्ये तेथे रूळमार्ग झाल्यापासून उत्पादनाला गती मिळाली. १८६० साली २·८ लक्ष टन उत्पादन झाले आणि १९०० साली ते २५ लक्ष टनांपर्यंत वाढले.
खनिज तेल हे फार महत्त्वाचे इंधन आहे. तेलाच्या खाणीचा शोध १८५९ साली अमेरिकेतील संयुक्त संस्थानांत कर्नल ड्रेक यांनी लावला. तरीपण या व्यवसायाची खरी प्रगती विसाव्या शतकातच झाली. १९०१ पासून चक्रीय छिद्रकाचा (गिरमिटासाख्या पण आकाराने मोठ्या असलेल्या यंत्राचा) उपयोग रूढ झाला व त्यामुळे तेलासाठी खोल विहिरी खणणे सोपे झाले. रासायनिक अभियांत्रिकीत प्रगती होऊन अधिक उत्पादन देणाऱ्या अनेक रासायनिक प्रक्रिया वापरण्यात येऊ लागल्या व अधिक कार्यक्षम उत्प्रेरक (विक्रियेत स्वतः भाग न घेता तिची गती वाढविणारा पदार्थ) उपलब्ध झाल्याने उत्पादन वाढले व वेळेचीही बचत होऊ लागली. तेलावरील संस्करणात झालेली प्रगती त्याच्या वापरास व उत्पादन वाढीस कारणीभूत झाली.
गुणधर्मविचार : इंधनापासून उष्णता मिळविणे हा मुख्य हेतू असल्याने इंधनाच्या उष्णता प्रदान शक्तीप्रमाणे म्हणजे कॅलरीमूल्याप्रमाणे (एकक द्रव्यमानाचे इंधन पूर्णपणे जाळून मिळणाऱ्या उष्णता राशीप्रमाणे, हे मूल्य वापरलेल्या एककांवर अवलंबून असते) त्याची किंमत ठरविली जाते. इंधनामध्ये उष्णता प्रदानता नसणारे अक्रिय घटक शक्य तितके कमी असावेत व हे घटक उष्णता उत्सर्जनात (बाहेर टाकण्यात) व उष्णतेच्या वापरात अडथळा आणणारे नसावेत. घन इंधनातील अक्रिय घटक म्हणजे जलांश, खनिज अपद्रव्ये (माती, वाळू, धातुकण) व ऑक्सिजन हे होत. खनिज तेलापासून मिळणाऱ्या इंधनात ही अपद्रव्ये बहुधा नसतात व असलीच तर फारच अल्प प्रमाणात असतात. इंधनाचे ज्वलन होताना त्यातील जलांशाचे बाष्प होते व ते होताना उष्णता शोषिली जाते. पुढे या बाष्पाचे द्रव होते पण तसे होताना त्या क्रियेत उत्सर्जित होणारी सुप्त उष्णता (तपमान न बदलता पदार्थाची स्थिती बदलण्यास लागणारी उष्णता) बहुधा उपयोगी पडत नाही. अपद्रव्ये जळत नाहीत, उलट थोडीशी उष्णता शोषूनच घेतात. ऑक्सिजनाचे ज्वलन होत नाही, पण तो ज्वलनक्षम पदार्थ जाळू शकतो. इंधनात नेहमी आढळणाऱ्या हायड्रोजनाच्या ज्वलनाने बरीच उष्णता मिळते, पण इंधनातील सुट्या ऑक्सिजनाचा हायड्रोजनाच्या प्रमाणशीर भागाशी संयोग होऊन तेवढा हायड्रोजन अकार्यक्षम बनतो व त्याचे ज्वलन होत नाही. इंधनात कार्बन व हायड्रोजन हेच ज्वलनक्षम प्रधान घटक असतात. कार्बन व हायड्रोजन यांच्या कॅलरीमूल्यांचे प्रमाण १ : ४·२५ असल्याने उच्च हायड्रोजन-कार्बन गुणोत्तर व कमी ऑक्सिजन असणे ही उच्च प्रतीच्या इंधनांची लक्षणे आहेत.
इंधनाचे ज्वलन सावकाश किंवा जलद वेगाने झाले तरी त्याच्या वजनाच्या एककापासून मिळणाऱ्या उष्णतेच्या राशीत फरक पडत नाही म्हणजेच त्याचे कॅलरीमूल्य बदलत नाही. पण उपयुक्ततेच्या दृष्टीने मात्र त्यात तरतमभाव निश्चित येतो. ज्वलनजनित उष्णतेचा विनियोग करताना जर उच्च तपमान हवे असेल, तर ज्वलन जलद झाले पाहिजे व नीच तपमान हवे असेल, तर ज्वलन सावकाश झाले पाहिजे. जरूर असेल तेव्हा इंधनाच्या ज्वलनाचे नियमन करता आले पाहिजे. अशा नियमनाच्या सुकरतेच्या दृष्टीने घन इंधनापेक्षा द्रव व वायू इंधने सरस ठरतात.
इंधनाचे ज्वलन होण्यासाठी त्याचे तपमान त्याच्या प्रज्वलन बिंदूपर्यंत (पेट घेण्याच्या तपमानापर्यंत) वाढवावे लागते. थंड रॉकेलाला पेटलेली काडी लावली तरी ते एकदम पेट घेत नाही. पण रॉकेल पुरेसे तापवून जर त्याला पेटलेली काडी लावली तर ते पेट घेते. पेट्रोल थंड असतानाही त्याला पेटलेली काडी लावली तर ते पेट घेते, कारण रॉकेलापेक्षा पेट्रोलाचा प्रज्वलन बिंदू बराच खाली आहे. इंधनाचे ज्वलन होताना जर ज्योत उत्पन्न होत असेल तर उष्णता विनिमयाच्या (अदलाबदलीच्या) दृष्टीने ते ज्वलन सामान्यतः कमी कार्यक्षम होते. तापवावयाच्या भागांवर जर वायूचे पातळ पटल तयार झाले तर उष्णता संक्रमणात अडथळा उत्पन्न होतो.
कॅलरीमूल्य (कॅमू.) : कॅलरी हे उष्णता मापनाचे आंतरराष्ट्रीय एकक आहे. इंधनाचे कॅलरीमूल्य म्हणजे एक ग्रॅम इंधनाच्या ज्वलनाने मिळणाऱ्या कॅलरींची संख्या म्हणजेच प्रतिग्रॅम उष्णता प्रदान शक्ती. जेव्हा गणनात मोठ्या संख्या येतात, तेव्हा कॅलरीमूल्याचे परिमाण वाढवून किलो-कॅलरीत (किकॅ.) (१ किकॅ. = १,००० क्रॅ.) दर्शवितात.
इंधनांचे प्रकार : लाकूड : इमारती व इतर बांधकामासाठी निरुपयोगी असलेले कोरडे लाकूड इंधन म्हणून वापरतात. वाळलेल्या लाकडातील घटक व त्यांची टक्केवारी सामान्यपणे पुढीलप्रमाणे असते : जलांश २०, कार्बन ४०, हायड्रोजन ५, ऑक्सिजन ३४, गंधक व नायट्रोजन मिळून ०·५ आणि राख ०·५. कॅमू. सु. ३,५५० कॅ./ग्रॅ. असते.
पीट : हे खनिज कोळशाच्या विकासाच्या प्राथमिक अवस्थेचा एक प्रकार आहे, पण त्याचा कोळशांच्या प्रकारात समावेश करीत नाहीत. यात बरेच पाणी असते ते काढून टाकल्यानंतर तो इंधन म्हणून वापरता येतो. हा यूरोपात विशेषतः रशिया व आयर्लंडमध्ये विपुल प्रमाणात सापडतो. भारतात तो सापडत नाही. उघड्यावर वाळविल्यास त्यात १५ ते २०% जलांश राहतो. भट्टीत मुद्दाम तापवून पूर्ण कोरडा केलेला पीट पुन्हा मोकळ्या जागेत साठविला, तर तो पुन्हा जलांश शोषून घेतो. पीट वाळवून जलांश नाहीसा केल्यावर त्यातील घटकांची टक्केवारी पुढीलप्रमाणे असते : कार्बन ५७, ऑक्सिजन ३५, हायड्रोजन ६ व राख २. कॅमू. ५,५५० कॅ./ग्रॅ. असते, पण उघड्यावर साठविलेल्या पीटचे मात्र ४,२७५ क्रॅ./ग्रॅ. असते. पीट मुख्यतः घरगुती वापरासाठी उपयोगी पडतो [→ पीट].
दगडी कोळसा : याचे पुढील प्रकार आहेत :
(१) लिग्नाइट किंवा तपकिरी कोळसा : याचे गुणधर्म पीट आणि काळा दगडी कोळसा यांच्या मध्ये असतात. जळताना त्याच्या धुरकट लांब ज्वाला निघतात. तो फारसा नरम पडत नाही व पसरतही नाही. त्याचे सरासरी संघटन पुढीलप्रमाणे असते : जलांश १८, कार्बन २८, बाष्पनशील भाग ४७ व राख ७%. याचे कॅमू. अंदाजे ५,५५० कॅ./ग्रॅ. असते.
(२) कॅनल अथवा बत्ती कोळसा : यात कार्बनाच्या मानाने हायड्रोजनाचे प्रमाण अधिक असते. पूर्वी यूरोपीय देशांत दगडी कोळशाच्या वायूचे साध्या ज्योतीचे दिवे वापरीत असत, तेव्हा दगडी कोळशाच्या वायूत कॅनलचा वायू मिसळीत असत. अशा मिसळीमुळे दिव्याची ज्योत जास्त प्रकाश देत असे. हा कोळसा दिसण्यात मळकट असून कठीण असते. याचे साठे आता संपत आले आहेत.
(३) चिकी (केकिंग) कोळसा : हा कॅनल कोळशापेक्षा वरच्या प्रतीचा असून त्याचा वापर मुख्यतः कोक बनविण्यासाठी करतात. यात डांबराचे प्रमाण जास्त असल्याने तो तापल्यावर नरम (चिकीसारखा) होतो, फुगतो आणि त्याचे गोळे होतात. गोळे होण्याचा गुण जर प्रकर्षाने असला, तर त्यापासून ओतकामाच्या भट्टीचा कठीण कोक बनवितात. हा गुण कमी प्रमाणात असेल, तर त्यापासून लोखंडाच्या झोतभट्टीचा कोक बनवितात. हा कोळसा जळताना लांब ज्वाला निघतात. तो वाफराच्या (बॉयलरच्या) भट्टीत वापरताना विशेष काळजी घ्यावी लागते. मोकळ्यावर ठेवलेल्या चिकी कोळशाचे संघटन पुढीलप्रमाणे असते : जलांश १, बाष्पनशील भाग, ३२, कार्बन ६२ व राख ५%. कॅमू. ७,९५० क्रॅ./ग्रॅ. असते.
(४) चिकी न होणारा कोळसा : यात डांबराचा अंश कमी असतो. यापासूनही नरम कोक करता येतो, पण हा विशेषेकरून घरगुती चुल्यासाठी व वाफरामध्ये जाळण्यासाठी वापरतात. याच्या ज्वाला फारसा लांब नसतात व त्याचा फारसा धूरही निघत नाही. याचे संघटन व कॅलरीमूल्य सामान्यतः चिकी कोळशाप्रमाणेच असतात.
(५) अँथ्रॅसाइट कोळसा : वनस्पतीपासून कोळसा बनण्याची ही परिणत अवस्था आहे. तो जळताना ज्वाला निघत नाहीत व धूरही होत नाही. त्यामध्ये गोळे होण्याचा गुण अजिबात नसतो. त्यामुळे तो घरगुती चुल्यात व वाफराच्या भट्टीत जाळण्यासाठी फार सोईस्कर असतो. याचे साठे फार थोडे आहेत व तेही इंग्लंडातील द. वेल्सच्या भागात आहेत. यात कार्बनाचे प्रमाण ८८% किंवा त्याहूनही अधिक असते. जलांश १, बाष्पनशील भाग ८ व राख ३% असते. कॅमू. ८,४०० कॅ./ग्रॅ. असते.
कोळशाचे साठवण : कोळशाचा राखीव साठा करून ठेवणे बरेच खर्चाचे काम असते. पण तो संपल्यामुळे आयत्या वेळी अडू नये व कमी दराच्या हंगामाचा फायदा मिळावा म्हणून त्याचे मोठे साठे करून ठेवतात. कोळसा साठवून ठेवला म्हणजे त्याचा दर्जा खालावतो व त्याला अकस्मात आग लागण्याचाही संभव असतो. साठवणपद्धती चांगली नसली तर (अ) कोळशाचे आपसुख अपघटन (घटक सुटे होणे) होऊन तो फाटतो व त्याचे तुकडे होतात, (आ) हवेच्या संपर्काने ऑक्सिडीकरण (ऑक्सिजनाशी संयोग) होऊन कॅमू. कमी होते, (इ) चिकी होण्याच्या गुणात घट होते आणि (ई) वायू तयार करताना त्याचा उतारा कमी येतो.
खाणीतून नुकत्याच काढलेल्या किंवा नुकत्याच फोडलेल्या कोळशाच्या पृष्ठाभागातून त्यात अधिशोषित (पृष्ठभागावर शोषित झालेल्या) असलेली हायड्रोकार्बने (मुख्यतः मिथेन) बाहेर टाकली जातात. हे वायू जर साठ्यातच राहिले, तर हवेतील ऑक्सिजनाच्या संपर्काने कोळसा पेटण्याचा संभव असतो. म्हणून अशा साठ्यांना संवातनाची (हवा खेळती ठेवण्याची) सोय असावी लागते. हे वायू बाहेर निघून गेले, तर त्यांच्या जागी हवा भरते. यानंतर जर सर्व साठा हवाबंद केला, तर जास्त ऑक्सिडीकरण होत नाही व आगीचा संभवही राहत नाही. आगबोटीतील गुदामात कोळसा भरून झाल्यावर त्यात पाणी भरून गुदामाचे तोंड बंद करून ठेवतात. अँथ्रॅसाइट जातीच्या कोळशात ऑक्सिडीकरण कमी होते. कोळशाची प्रत जसजशी खाली जाईल तसतसे ऑक्सिडीकरणाचे व त्यामुळे होणाऱ्या हानीचे प्रमाण वाढत जाते.
साधित घन इंधने : लोणारी कोळसा : हा लाकडापासून अपूर्ण ज्वलनाने किंवा ऊर्ध्वपातनाने (हवेच्या किमान संपर्कात तापवून व बाष्पनशील पदार्थ गोळा करून) तयार करता येतो. दुसऱ्या पद्धतीत लाकडाच्या वजनाच्या २५% कोळसा मिळतो व शिवाय मिथिल अल्कोहॉल २%, ॲसिटिक अम्ल ३%, डांबर ५%, ज्वालाग्राही वायू १८% असे उपपदार्थही मिळतात. पहिल्या पद्धतीत हे सर्व वाया जाते व कोळशाचे प्रमाणही वाढत नाही. हा धूराशिवाय जळतो व त्याची आच लाकडापेक्षा चांगली असते. त्यामुळे तो शेगडीमध्ये वापरण्यास फार सोईचा असतो. या कोळशाचे सर्वसाधारण संघटन पुढीलप्रमाणे असते : जलांश १०, कार्बन ८५, हायड्रोजन २ व राख ३%. त्याचे कॅमू. ७,००० कॅ./ग्रॅ. असते [→ कोळसा, लोणारी].
कोळशाच्या विटा : खाणीतून कोळसा काढताना होणाऱ्या भुकटीपासून या विटा बनवितात. भुकटीत बंधक द्रव्य म्हणून डांबर मिसळतात व ते मिश्रण यंत्रात दाबून विटा पाडतात. या विटांचा आकार साधारणतः बांधकामाच्या विटांएवढाच असतो. यांच्या संघटनात जलांश ३, डांबर ८, राख ७% व बाकी कार्बन असून त्यांचे कॅमू. ८,००० कॅ./ग्रॅ. असते. नेव्हेली प्रकल्पात लिग्नाइटापासूनही अशा विटा बनवितात. त्यांचे कॅमू. ६,००० कॅ./ग्रॅ. पर्यंत असते. अशा विटांचा उपयोग घरगुती वापरात व औद्योगिक भट्ट्यांतही होतो.
कोक : हवेचा संपर्क होऊ न देता उत्तापसह (उच्च तपमान सहन करणाऱ्या) मातीच्या भांड्यात जर दगडी कोळसा तापविला तर त्यातील वायू व बाष्परूपाने द्रव घटक निघून जातात व त्याला कोकाचे स्वरूप प्राप्त होते. कोकात जवळजवळ ९५% कार्बन व बाकी गंधक व राख ही असतात. या तापनाच्या (तापविण्याच्या) क्रियेला समृद्धीकरण किंवा कार्बनीकरण म्हणतात, कारण या क्रियेमुळे इंधनातील कार्बनाचे प्रमाण सापेक्षतया वाढते. ही क्रिया म्हणजे कोळशाचे ऊर्ध्वपातनच असते. तयार होणाऱ्या कोकाचे एकंदर गुणधर्म मूळच्या कोळशावर, क्रियेतील तपमानावर व तापनाच्या वेगावर अवलंबून असतात. कोक तयार करण्यासाठी सामान्यतः डांबरी व त्यातल्या त्यात चिकी होणाऱ्या जातीचा कोळसा वापरतात. या जातीच्या कोळशापासून मिळणारा कोक म्हणजे कठीण कोक होय. साधारण ८३ ते ९०% कार्बन असलेल्या डांबरी कोळशात चिकीचा गुण जास्तीतजास्त असतो व ९२ टक्क्यांच्या वर तो गुण लुप्त होतो. कोळशाचे ऊर्ध्वपातन करून शहरी पुरवठ्यासाठी वायू तयार करणे हा मुख्य उद्देश असेल, तर बाष्पनशील द्रव्ये जास्त प्रमाणात असलेला कोळसा वापरतात. या कोळशापासून मिळतो तो नरम कोक होय. अशा ऊर्ध्वपातनात मिळणारा द्रव पदार्थ म्हणजे डांबर असते. बाष्पनशील द्रव्ये हायड्रोजन सल्फाइड, फेरस सल्फाइड, अमोनिया व सायनोजेन या रूपांत बाहेर पडतात. तरीही गंधक व नायट्रोजन यांचा थोडासा भाग कोकात राहतोच. कोकाचे उत्पादन कोळशाच्या ७५ ते ८०% वजनाने असते. त्याचे कॅमू. ८,३०० कॅ./ग्रॅ. असते. कोक कोळशापेक्षा वजनात हलका, दिसण्यात खडबडीत, काळपट पांढरा व सच्छिद्र असतो. तो जळताना धूर होत नाही व त्यातून फारशा ज्वालाही निघत नाहीत. परंतू त्याची आच तीव्र असते. कोकाचा मुख्य उपयोग लोखंड कारखान्यातील झोत भट्ट्यांत इंधन म्हणून व लोहधातुकाचा क्षपणकारक (धातुकातील ऑक्सिजन नाहीसा करणारा) म्हणूनही होतो. ओतशालेतील उभ्या भट्टीकरिता व घरगुती चुल्यासाठीही याचा उपयोग करतात [→ कोक].
द्रव इंधने : खनिज तेल : द्रव इंधनात खनिज तेल हेच महत्त्वाचे आहे. यातूनच पेट्रोल, रॉकेल, डीझेल तेल व भट्टी तेल ही इंधने मिळतात. द्रव इंधनाचा दुसरा प्रकार म्हणजे शेल तेल. शेल हे तेलाचे खडक असतात व ते तापवून त्यातील तेल निराळे काढता येते. त्याच्यावर करावयाच्या शुद्धीकरणादी क्रिया व त्यापासून मिळणारी इंधने खनिज तेलासारखीच असतात.
खाणीतून काढलेले तेल कच्च्या स्वरूपाचे असते. त्याचा इंधन म्हणून एकदम उपयोग करता येत नाही. ते शुद्धीकरण कारखान्यात नेऊन तापविल्यावर ऊर्ध्वपातनाने (तयार झालेले बाष्प थंड करून) त्यामधील निरनिराळी द्रव इंधने वेगळी करतात. घन इंधनापेक्षा द्रव इंधन सरस व सोईस्कर असते. त्याची वैशिष्ट्ये म्हणजे (१) त्याचे कॅलरीमूल्य कोळशापेक्षा ३९ : २५ या प्रमाणात जास्त असते, (२) त्याचे साठवण करण्यासाठी कोळशापेक्षा १·३ : १ या प्रमाणात कमी जागा लागते त्यामधील उष्णताशयाचा विचार केल्यास १·७ : १ या प्रमाणातच जागा लागते, (३) तेलाच्या ज्वलनाची तीव्रता जास्त असते व ज्वलनाचे नियमन करणेही सहजसाध्य असते आणि (४) तेलाची वाहतूक करणे सोपे जाते व टाकीत तेल भरण्याचे काम पंपाने सहज करता येते.
खनिज तेलाच्या तीन जाती आहेत : (१) पॅराफीन-प्रधान हीत ऊर्ध्वपातनानंतर पॅराफिनी मेणाचा गाळ उरतो, (२) अस्फाल्ट (डांबर) प्रधान हीत बिट्युमेन किंवा अस्फाल्टचा गाळ उरतो व (३) मिश्र हीत मेण एक ऊर्ध्वपातित म्हणून मिळते आणि गाळ अस्फाल्टी राहतो. तेलाचे संघटन सामान्यतः पुढीलप्रमाणे असते : कार्बन ७९·५–८७·१, हायड्रोजन ११·५–१४·८, गंधक ०·१–३·५, नायट्रोजन आणि ऑक्सिजन ०·१–०·५%.
कच्च्या तेलाचे कॅमू. सु. १०,५०० कॅ./ग्रॅ. असते. प्रत्यक्ष वापरातील इंधने यापासून साधित केलेली असतात. कच्च्या तेलाचे ऊर्ध्वपातन करून मिळणारे पदार्थ कोष्टक क्र. १ मध्ये दिलेले असून ते त्या त्या तपमानांत अनुक्रमाने मिळतात.
कोष्टक क्र. १. कच्च्या तेलाच्या ऊर्ध्वपातनात मिळणारे पदार्थ
| पदार्थ | तपमान सीमा ०से. | कॅमू. कॅ/ग्रॅ. | विशिष्ट गुरुत्व |
| पेट्रोल | ४०–१८० | ११,४०० | ०·७०–०·७६ |
| रॉकेल | १४०–२५० | ११,००० | ०·७८–०·८३ |
| डीझेल तेल
वायू तेल |
२५०–३४० | १०,५०० | ०·८५–०·८८ |
| भट्टी तेल, हलके | २००–३२० | १०,३०० | ०·८८–०·९२ |
| भट्टी तेल, जड | ३२० – व पुढे | ९.५५० | ०·९२–१·०० |
तेल शुद्धीकरणाच्या विधीत निरनिराळे वायू बाहेर पडतात. त्यांच्यापासून अनेक संश्लिष्ट इंधने बनविली जातात व ती प्रोपेन, ब्युटेन, इंडेन अशा विशेष नावांनी विकली जातात [→ खनिज तेल खनिज तेल रसायने].
वनस्पतिजन्य तेले : सोयाबीन, भुईमुग व सरकी यांपासून काढलेली तेले, पूर्वतापनाने त्यांची श्यानता (दाटपणा) कमी करून कोणत्याही डीझेल एंजिनात इंधन म्हणून वापरता येतात. त्यांचे कॅमू. ९,२०० क्रॅ./ग्रॅ. असते. अशा तेलावर डीझेल एंजिन सहज सुरू करता येते व ते धिम्या गतीने चालते. परंतु ही वनस्पती तेले इतर कामांकरिता उपयोगी पडत असल्याने त्यांची किंमत बरीच जास्त असते व त्यामुळे त्यांचा इंधन म्हणून उपयोग करीत नाहीत.
वायू इंधने : घन इंधनापेक्षा, द्रव इंधनाप्रमाणेच, वायू इंधन पुष्कळ सोईस्कर असते. वायू जळताना धूर होत नाही व त्याची राखही पडत नाही. औद्याेगिक व घरगुती वापरासाठी मध्यवर्ती पुरवठा केंद्रापासून नळातून तो पुरविता येतो. त्यामुळे वापरणाऱ्याला त्याचे साठवण करावे लागत नाही. आगबोटी व विमाने यांमध्ये वायू इंधन वापरणे शक्य होत नाही. वायू इंधनाचे कॅलरीमूल्य वजनाच्या ऐवजी घनफळाच्या एककात देतात.
वायूच्या वापरात त्याच्या ज्वालनाचे नियमन करताना काही वेळा अडचण येते. ज्वालक (ज्या साधनाद्वारे वायूचे प्रत्यक्ष ज्वलन होते ते साधन) जर योग्य नसेल तर वायू कमी सोडली असता ज्वाला नळाकडे पेटत जाते व वायू जास्त सोडला तर ज्वाला विझते. म्हणून प्रत्येक वायूकरिता योग्य असा ज्वालक निवडावा लागतो. बहुतेक ज्वालकांत हवा कमीजास्त करण्याची सोय केलेली असते.
नैसर्गिक वायू : यात मुख्यतः मिथेन (६० ते ९५%), दोन व तीन कार्बन अणू असलेली हायड्रोकार्बने व त्या मानाने थोड्या प्रमाणात समघटक (समान घटक असणारे परंतु निरनिराळ्या गुणधर्मांचे पदार्थ) नॅप्थायुक्त व ॲरोमॅटिक हायड्रोकार्बने, कार्बन डाय-ऑक्साइड व नायट्रोजन हे घटक सामान्यतः असतात. वि. गु. ०·६० च्या आसपास व कॅमू. ९,३०० किकॅ./मी.३ असते. नैसर्गिक वायूत कार्बन मोनॉक्साइड हा विषारी वायू नसतो व त्यामुळे नळातून नेताना नळांच्या सांध्यांतून तो बाहेर पडू लागला, तरी त्यापासून जीविताला धोका होत नाही. पण त्याला वास येत नसल्याने तो पसरू लागला तरी ते लक्षात येत नाही व स्फोटाचा धोका संभवतो. याकरिता त्यामध्ये ‘कॅलोडोरंट सी’ या व्यापारी नावाचा वास येणारा वायू थोड्या प्रमाणात मुद्दाम मिसळतात. त्यामुळे तो वायू नळाच्या बाहेर पडू लागला, तर वास येऊन ती गोष्ट लगेच लक्षात येते.
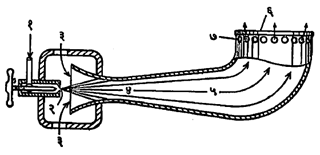
शहरी वायू : मोठ्या शहरात घरगुती इंधन म्हणून नळातून पुरविण्यात येणारा वायू मुख्यतः दगडी कोळशापासून बनविण्यात येतो. तो वायूच्या राशीप्रमाणे आपोआप वरखाली होणारे झाकण असलेल्या उभ्या टाकीत साठवतात. अशा रचनेमुळे वायूवरील दाब जवळजवळ एकसारखा राहतो. काही ठिकाणी कोळशाऐवजी खनिज तेलाचाही मूळ इंधन म्हणून उपयोग करतात. या वायूच्या संघटनात मुख्यतः हायड्रोजन, कार्बन मोनॉक्साइड, निरनिराळी हायड्रोकार्बने व थोड्या प्रमाणात कार्बन डाय-ऑक्साइड, ऑक्सिजन व नायट्रोजन हे वायू असतात. नळामधून येणारा वायू घरातील चुलीत जाळण्याकरिता विशेष प्रकारचा ज्वालक वापरावा लागतो. अशा ज्वालकाचा एक प्रकार आ. १ मध्ये दाखविला आहे [àकोल गॅस].
मलकुंड वायू : मोठ्या शहरात भुयारी गटारांतून जाणारे मलपाणी मोठ्या टाकीमध्ये साठवतात व त्या टाकीवर तरते लोखंडी झाकण बसवतात. या टाकीतल्या घाण पदार्थांपासून मिथेनासारखे इंधन वायू उत्पन्न होतात व वरच्या झाकणाखाली साठतात. हे वायू पंपाने दाबून नळातून दूर अंतरापर्यंत पाठविता येतात. मुंबई येथे अशा वायूचा इंधन म्हणून उपयोग करण्यात येत आहे.
गोबर (शेण) वायू : एऱ्हवी ज्या ठिकाणी शेण व संडासातील मैला फुकट जातो, तेथे त्यापासून खत व इंधन वायू तयार करतात. यासाठी जमिनीमध्ये विहिरीसारखे एक कुंड बांधतात. या कुंडात शेणाचे पाणी किंवा घरगुती मैला सोडतात. तो कुंडामध्ये कुजतो व त्यापासून मिथेनासारखे जळणारे वायू उत्पन्न होऊन वरच्या टाकीसारख्या तरत्या झाकणात साठतात. झाकणात साठलेले वायू रबरी नळीने बाहेर नेले जातात व नंतर ते साध्या नळातून घरोघरच्या चुलीपर्यंत नेऊन शहरी वायूप्रमाणे जाळतात. कुंडातून बाहेर पडणारे पाणी खत म्हणून वापरतात [àगोबर वायू].
इंधन विश्लेषण : प्रातिनिधिक नमुना : इंधनाच्या नमुन्याचे प्रयोगशाळेत विश्लेषण केले म्हणजे ते मूळ इंधनाच्या सर्व साठ्याला लागू होते असे समजतात. यामुळे घेतलेला नमुना सर्व साठ्याचा खरा प्रातिनिधिक असला पाहिजे. याकरिता नमुना घेण्याची आंतरराष्ट्रीय पद्धती ठरविण्यात आली आहे. या पद्धतीने कोळशाचा नमुना घेताना मुख्य साठ्यातील पुष्कळ ठिकाणचे नमुने घेऊन ते एकत्र करतात व चांगले मिसळतात. त्यातून चौथाई पद्धतीने जरूर त्या वजनाचा नमुना घेतला म्हणजे तो प्रातिनिधिक नमुना होतो. कोकाचा प्रातिनिधिक नमुना मिळविण्याची पद्धत साधारण कोळशाच्या पद्धतीसारखीच असते. परंतु ते नमुने जलांश प्रमाणाच्या आधाराने निश्चित करतात.
नळातून वाहणाऱ्या तेलाचे ठराविक वेळाने नमुने काढतात व नंतर ते एकत्र करून त्यामधून अंतिम नमुना घेतात. काही वेळा नळातून अखंड नमुनाही घेतात. यासाठी मोठ्या नळात एक बारीक नळी त्याच्या व्यासाच्या १/३ अंतरापर्यंत नेतात. तेथे तिचे तोंड येणाऱ्या प्रवाहाकडे वळविलेले असते. तेलसाठा मोठ्या उभ्या टाकीत असेल, तर टाकीच्या निरनिराळ्या पातळ्यांवरून वजन लावलेल्या बाटल्यांतून प्राथमिक नमुने घेतात. नमुने ठेवलेल्या भांड्यांची तोंडे लाकडी बुचांनी बंद करतात. याकरिता रबरी बुचे किंवा मेणात भिजविलेली साधी बुचे वापरीत नाहीत.
एकाच संघटनाच्या किंवा एकाच वेगाने वाहणाऱ्या वायूंच्या प्रवाहाचे नमुने घेणे सोपे असते. वायूच्या नमुन्यासाठी खास बनविलेल्या काचेच्या नळ्या असतात. यांच्या दोन्ही टोकांवर काचेच्याच गुडदी झडपा बसविलेल्या असतात. या झडपांना दोन निर्गमद्वारे असतात. नमुना घेण्यासाठी या नळीत प्रथम एक योग्य (घ्यावयाच्या वायूच्या दृष्टीने उदासीन म्हणजे त्याच्याशी विक्रिया न होणारा) असा द्रव भरतात. द्रव भरलेली नळी उभी धरून तिचे वरचे तोंड रबरी नळीने नमुना घेण्याच्या तोटीला जोडतात. वायूवर दाब असेल, तर वरच्या झडपेचा निर्गम बाहेरील हवेशी जोडून त्या झडपेपर्यंतच्या मार्गातील हवा बाहेर काढून ती जागा वायूने भरतात व नंतर गुडदी फिरवून वायूचा संबंध काचेच्या नळीशी जोडतात आणि खालची झडप उघडून नळीतील द्रव बाहेर सोडतात, त्यामुळे नळीतील द्रवाच्या जागेत वायू भरतो. वायूवर दाब नसेल, तर सुरुवातीला रबरी नळीतील हवा शोषून काढतात.
नळी भरण्याकरिता पारा हा त्यातल्या त्यात योग्य द्रव आहे, पण त्यावर हायड्रोजन सल्फाइडाचा परिणाम होतो. पाण्यात व कोणत्याही जलीय विद्रावात कार्बन डाय-ऑक्साइड मुरतो. मॅग्नेशियम क्लोराइडाचा तृप्त (कमाल राशी विरघळविलेला) विद्राव आणि ग्लिसरीन व पाणी यांचा समप्रमाणी विद्राव हेही काही ठिकाणी उपयुक्त ठरतात.
विश्लेषण तंत्र : इंधनांच्या विश्लेषणाचे तंत्र सर्वसाधारण कार्बनी पदार्थांच्या विश्वेषणासारखेच असते.
(१) घन इंधने : कोळशाच्या विश्लेषणाचे दोन प्रकार आहेत :एक व्यावहारिक व दुसरा रासायनिक. व्यावहारिक विश्लेषणात जलांश, राख व एकंदर बाष्पनशील द्रव्ये यांचे प्रमाण काढतात. पुष्कळदा यांच्याबरोबर गंधकाचे प्रमाण व कॅलरीमूल्य हीही काढतात. एवढी माहिती बहुतेक वेळा उद्योगधंद्यात पुरेशी असते. रासायनिक विश्लेषणात कोळशाच्या संघटनातील कार्बन, हायड्रोजन, गंधक, नायट्रोजन व ऑक्सिजन यांचे प्रमाण काढतात. तुलना व परिशुद्धी यांच्या द्दष्टीने माती व धातुकणरहित असा कोळसा पाया धरून विश्लेषणाचे फलित दाखविले पाहिजे, पण पुष्कळ वेळा कमी राख असलेल्या कोळशांच्या बाबतीत कोरडा व राखरहित कोळसा पाया धरून प्रमाण ठरविण्याची पद्धत वापरतात.
यावहारिक विश्लेषणात जलांश निश्चितीला फार महत्त्व असते. कारण कोळशाचे संघटन कोरड्या कोळशाच्या पायावर आधारित असते. मानकीय (विशिष्ट प्रमाणभूत) नियमाप्रमाणे जलांश काढण्यासाठी एक खास नमुनाच राखून ठेवावा लागतो. जलांश काढण्याची प्रमाण पद्धत म्हणजे नमुना भट्टीत १०५० ते ११०० से. तपमानात वजन कायम राहीपर्यंत तापवून अगोदरच्या वजनात झालेली घट ठरविणे. कोळसा हवेच्या संपर्कात तापविताना त्यामधील जलांश कमीकमी होत जाऊन वजन कमी होते. पण काही वेळाने ऑक्सिडीकरणामुळे त्याचे वजन वाढू लागते. म्हणून तापनाचा अवधी विनिर्देशित केलेला असतो. पर्यायी पद्धतीत नमुना जलांश शोषणपात्रात ठेवतात व त्यामधील जलांश शोषक द्रव्याच्या वजनात झालेल्या वाढीवरून नमुन्यातील जलांश ठरवितात.
बाष्पनशील द्रव्यांचे प्रमाण काढणे हे एक अनुभवसिद्ध पद्धतीचे परीक्षण आहे, म्हणून ते मानकीय नियमांचे काटेकोर पालन करून काढावे लागते. तापनाचा वेग व योजलेले तपमान हे या परीक्षणाचे महत्त्वाचे भाग असतात. कोळशाचा नमुना ९२५० ± १५० से. तपमानात हवेशी संपर्क न होऊ देता सिलिकेच्या प्रमाणभूत मुशीत तापवितात. ठराविक वेळानंतर तो बाहेर काढून वजन करतात. पूर्वीच्या व या वजनातील फरक बाष्पनशील द्रव्याचे वजन दाखवितो. राखेचे प्रमाण काढताना कोळशाचे ज्वलन करावे लागते. त्यासाठी मुशीतील जळणाऱ्या कोळशावरून हवेचा संथ प्रवाह वाहत राहील अशी व्यवस्था करावी लागते. सुरुवातीला ज्वलनाचा वेग कमी ठेवावा लागतो कारण कोळशाच्या काही जाती तडतड्या असतात. कोळशात मुळात असलेल्या अकार्बनी घटकांच्या वजनापेक्षा राखेचे वजन कमी भरते. वजन कमी होण्याची कारणे पुढीलप्रमाणे असतात : (१) कार्बोनेटातील CO2 निघून जातो, (२) मातीचे संधानजल (मातीचे कण एकत्र धरून ठेवणारे पाणी) निघून जाते, (३) पायराइट FeS2 चे Fe2O3 या फेरिक ऑक्साइडात रूपांतर (३ : २ या प्रमाणात) होते, (४) कार्बनी गंधकाचे सल्फेटीभवन होते आणि (५) क्लोरीन उडून जातो.
रासायनिक विश्लेषणात कार्बन व हायड्रोजन यांचे प्रमाण ठरविण्यासाठी अगदी लहान (२०० मिग्रॅ.) नमुना घेतात. त्यामुळे नमुना घेण्यापूर्वी कोळशाची पूड चांगली मिसळावी लागते. या पद्धतीने मिळणाऱ्या कार्बन व हायड्रोजनाच्या मूल्यांत मुळातल्या कोळशात असलेल्या कार्बोनेटामधील कार्बन व मातीच्या संधानजलातील हायड्रोजन यांचा अंतर्भाव असतो. हा कार्बनाचा अंश वगळून खऱ्या कार्बनाचे प्रमाण मिळते. नायट्रोजन व गंधक यांचे प्रमाण नेहमीच्या अनुक्रमे केल्डाल व एश्का यांच्या पद्धतींनी काढतात [→ रासायनिक विश्लेषण]. ऑक्सिजनाचे प्रमाण काढता येईल अशी विश्वसनीय पद्धती अजून सापडलेली नाही. अगोदर काढलेल्या इतर द्रव्यांच्या प्रमाणांची बेरीज शंभरातून वजा करून उरलेले ऑक्सिजनाचे प्रमाण मानण्यात येते.
कोकाची व्यावहारिक व रासायनिक विश्लेषणे साधारणतः कोळशासारखीच असतात. त्यातील बाष्पनशील द्रव्यांच्या प्रमाणासाठी तो तापवताना त्यावरून नायट्रोजनाचा संथ प्रवाह सोडतात किंवा मुशीत बेंझिनाचे २ ते ४ थेंब सोडून हवा बाहेर काढतात. धातुवैज्ञानिक उपयोग व ज्वलन यांच्या दृष्टींनी उपयुक्त अशा गुणधर्मांच्या बाबतीत कोकाची काही स्वतंत्र परीक्षणे करतात. ती बहुतेक सर्व भौतिकीयच आहेत. ही परीक्षणे म्हणजे खरे विशिष्ट गुरुत्व, व्याप घनता, शिल्लक उरलेल्या बाष्पनशील द्रव्याचे उष्णतामूल्य, काठिण्य इ. होत. घन इंधनांचे लाकूड, दगडी कोळसा वगैरे जे प्रकार आहेत त्यांच्या गुणधर्मांत स्थानपरत्वे बराच फरक पडतो. म्हणून या प्रकारच्या इंधनाचे विश्लेषण व कॅलरीमूल्य यांसंबंधी एकत्रित माहिती कोष्टकरूपाने येथे दिलेली नाही.
(२) द्रव इंधने : यांचे विश्लेषण घन इंधनापेक्षा वेगळ्या प्रकारचे असते परंतु तेही मानक पद्धतीनेच करावे लागते. त्यातून द्रव इंधनाचे विशिष्ट गुरुत्व, ज्वाला बिंदू, प्रज्वलन बिंदू, श्यानता (अंतर्गत घर्षण, चिकटपणा), पाण्याचा अंश, ऊर्ध्वपातनक्षमता, कार्बनाचा गाळ, अस्फाल्ट धारणा, गंधक धारणा, राख, ऑक्टेन किंवा सिटेन अंक [→ अंतर्ज्वलन एंजिन] यांची मूल्ये काढतात. ऑक्टेन अंक पेट्रोलसाठी, सिटेन अंक डीझेल तेलासाठी, श्यानता नळातून तेल दूर नेताना, कार्बनाचा गाळ अंतर्ज्वलन एंजिनांची इंधने व वंगण तेल यांच्यासाठी व जल धारणा भट्टीच्या इंधन तेलासाठी उपयोगी पडतात.
विशिष्ट गुरुत्व काढण्यासाठी तरकाटा, पिक्नॉमीटर (अचूक घनफळ दर्शविणारे काचेचे लहान भांडे), विशिष्ट गुरुत्व कुपी किंवा तराजू हे नेहमीचे साहित्य वापरतात. ज्वाला बिंदू म्हणजे इंधन तेलाच्या ज्या कमीतकमी तपमानावर ज्योतीने पेट घेण्यासारखे बाष्प बाहेर पडू लागते ते तपमान. प्रज्वलन बिंदू म्हणजे ज्या तपमानावर बाहेर पडणाऱ्या बाष्पाला ज्योत लावली असता बाष्प पेटून काही वेळ जळत राहू शकते ते तपमान. केवल (किंवा गतिकीय) श्यानता नेहमीच्या पद्धतीनुसार केशनलिकेतून (अगदी बारीक नळीतून) जाणाऱ्या प्रमाण तपमानाच्या इंधनाच्या प्रवाह वेगावरून काढतात. या प्रयोगासाठी रेडवूड श्यानतामापक १ व २ वापरतात [→ श्यानता].
घन इंधनाप्रमाणे द्रव इंधनांच्या संघटनात स्थानपरत्वे फरक पडतो. त्यामुळे त्यांचे घटक व कॅलरीमूल्य यांची सर्वसाधारण माहिती कोष्टकाच्या स्वरूपात येथे दिलेली नाही.
(३) वायू इंधने : यामध्ये नैसर्गिक, साधित व संश्लिष्ट (कृत्रिम) असे तीन वर्ग आहेत. नैसर्गिक वर्गात खनिज तेलाप्रमाणे जमिनीत सापडणारा खनिज वायू आहे. साधित वर्गात तेल शुद्धीकरण कारखान्यात उत्पन्न होणारे वायू, कोळसा अर्धवट जाळून उत्पन्न होणारे भट्टीतील वायू, पाणवायू (प्रदीप्त कोकवरून वाफ जाऊ दिल्यास तयार होणारा वायू), झोतभट्टीतून निघणारे वायू, सांडपाणी, शेण व मैला साठवून उत्पन्न होणारे वायू वगैरे आहेत. संश्लिष्ट वर्गात ॲसिटिलीन व द्रव मिथिल अल्कोहॉल हे आहेत.
पाणवायू व भट्टीतून निघणाऱ्या वायूत कार्बन मोनॉक्साईड व हायड्रोजन हे वायू असतात. इतर वायूंत निरनिराळी हायड्रोकार्बने ही त्यांचे मुख्य भाग असतात. त्यांचे विश्लेषण अनेक पद्धतींनी करता येते.
वायूंचे विश्लेषण सामान्यतः दोन पद्धतींनी करतात. पहिलीत वायूतील घटकांचे विशिष्ट विक्रियाकारकाद्वारा (मदतनीस पदार्थाद्वारा) चोषण (शोषण) होते व त्यांच्याशी त्या घटकांची रासायनिक विक्रिया घडून मापनही होते. दुसरीत घटकांच्या स्वाभाविक गुणधर्मांचा उपयोग करणारी उपकरणे वापरतात. ऑरसेट उपकरण हे अशा साधनांचे एक उदाहरण आहे. पण या पद्धतींचे मानकीकरण झालेले नसल्याने त्यासंबंधी येथे विशेष माहिती दिलेली नाही. काही प्रमुख इंधनांचे विश्लेषण व कॅलरीमूल्ये कोष्टक क्र. २ मध्ये दिली आहेत.
कॅलरीमूल्य : सर्व प्रकारच्या इंधनांचे कॅमू. गणिताने किंवा प्रत्यक्ष प्रयोगाने अशा दोन्ही रीतींनी काढता येते. ते गणिताने काढावयाचे असेल तर इंधनातील सर्व मूल घटक व त्यांचे प्रमाण माहीत असले पाहिजे. प्रत्येक ज्वलनक्षम मूलद्रव्याच्या एक ग्रॅमच्या ज्वलनाने मिळणाऱ्या उष्णतेचे मूल्य प्रयोगांनी ज्ञात झालेले आहे. त्यावरून हे गणित करता येते. सर्व इंधनांत सामान्यतः कार्बन, हायड्रोजन, गंधक, ऑक्सिजन व नायट्रोजन हे मुख्य घटक असतात. त्यांपैकी कार्बन व हायड्रोजन हेच मुख्य उष्णता देणारे घटक आहेत. गंधक अगदी थोड्या प्रमाणात असतो परंतु त्यापासूनही काही उष्णता मिळते. ऑक्सिजन व नायट्रोजन हे जळत नाहीत व त्यांपासून उष्णता मिळत नाही. कार्बन, हायड्रोजन व गंधक यांची कॅमू. पुढे दिली आहेत : कार्बन ८,०८० कॅ./ग्रॅ., हायड्रोजन ३४,५०० कॅ./ग्रॅ. व गंधक २,३०० कॅ./ग्रॅ. इंधनातील ऑक्सिजनाची उपस्थिती इंधनाच्या कॅमू. वर अनिष्ट परिणाम करते. ऑक्सिजन कोणत्या स्थितीत असतो हे निश्चितपणे ठरविणे कठीण असते, म्हणून त्याचा योग्य प्रमाणातील हायड्रोजनाशी संयोग झालेला आहे असे मानून तेवढा हायड्रोजन ज्वलनाला उपलब्ध नाही, असे धरतात व उरलेल्याचीच उष्णता कॅमू. मध्ये समाविष्ट करतात.
कॅमू.चे वरचे व खालचे असे दोन प्रकार असून त्यांतील फरक, ज्वलनात उत्पन्न झालेल्या पाण्याच्या वाफेच्या सुप्त उष्णतेएवढा असतो. ही राशी वगळली, तर खालचे मिळते. अलीकडे वरचे कॅमू.च वापरणे रूढ होत आहे.
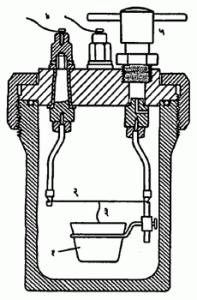
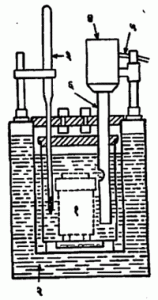
प्रायोगिक निश्चिती : प्रयोगाने कॅमूं. काढण्याच्या मानकात सुधारित प्रकार बर्थेलॉट बाँब– उष्णतामापक विनिर्देशित असतो. या प्रयोगात बाँबमध्ये ठेवलेल्या ठराविक वजनाच्या इधनाचे पूर्ण ज्वलन होते व ज्वलनाची उष्णता, मापकातील ठराविक वजनाच्या पाण्याला व इतर भागांना दिली जाते. पाण्याचे वाढलेले तपमान ०·०१० से. पर्यत मोजण्याची त्यात सोय असते. इंधनाच्या ज्वलनासाठी बाँबमध्ये २५ वातावरण दाबाचा (बाँबातील मूळ हवेसह) ऑक्सिजन भरलेला असतो व इंधन पेटविण्यासाठी बाहेरचा विद्युत् प्रवाह पाठवितात. बाँबचे छेदचित्र आ. २ मध्ये दाखविले आहे व आ. ३ मध्ये प्रयोगासाठी सिद्ध केलेले कॅलरीमापकासह सर्व साहित्य दाखविले आहे.
कोष्टक क्र. २. वायुरूप इंधनांचे व्यापात्मक विश्लेषण व त्यांची कॅलरीमूल्ये
| वायू | वि. गु | H2 % | CO % | CnH2n+2 मिथेनव पॅराफीन | CnHm अतृप्त हायड्रोकार्बन | CO2 | O2 | N2 | कॅलरीमूल्य किकॅ /मी.३ |
| क्षैतिज बकपात्र वायू | ०·४० | ५२ | ९ | २८ | ३ | २·५ | ०·५ | ५ | ४,२५० |
| उभे बकपात्र वायू | ०·४८ | ५० | १८ | २० | २ | ४ | ०·५ | ५·५ | ३,८०० |
| कोक भट्टी वायू | — | ५४ | ७·५ | २८ | २·५ | २·५ | ०·५ | ६ | ४,००० |
| निळा पाणवायू | ०·५४ | ४९ | ४१ | १ | —- | ५ | ०·५ | ५ | २,५०० |
| कार्बन-वृद्घीत पाणवायू | ०·६२ | ३७ | ३० | १४ | ७ | ६ | —- | ५ | ४,००० |
| तेल वायू वाफर | —- | ४८ | १९ | १४ | ६ | ८ | ०·५ | ४·५ | ४,४५० |
| बंबभट्टी वायू (दगडी कोळसा) | ०·८७ | १२ | २९ | २·५ | ०·४ | ४ | —- | ५२ | १,३५० |
| बंबभट्टी वायू (कोक) | ०·९० | ११ | २९ | ०·५ | —- | ५ | —- | ५४·५ | १,१०० |
| बंबभट्टी वायू (जलरहित) | ०·९८ | १ | ३३ | —- | —- | १ | —- | ६५ | ९०० |
| झोतभट्टी वायू | १·०२ | १ | २७ | —- | —- | ११ | —- | ६१ | ८०० |
| लुर्गी वायू (शोधित) | —- | ५० | १९ | २२ | १ | ७ | —- | १ | ४,००० |
| नैसर्गिक वायू | —- | —- | —- | ९० | ५ | १ | —- | ३ | ९,००० |
प्रयोगाच्या साहित्याचे मानकीकरण (प्रमाणीकरण) बारकाईने केलेले असल्यामुळे त्याच नमुन्याच्या इंधनावर एकाच ठिकाणी अनेक प्रयोग केले किंवा वेगळाल्या ठिकाणी प्रयोग केले, तरी कोळशाच्या बाबतीत ३० (एकाच प्रयोगशाळेत) ते ६५ (वेगळाल्या ठिकाणी) कॅलरींपेक्षा जास्त फरक पडत नाही. तसेच गणित करून काढलेले व प्रायोगिक मूल्य यांतही म्हणण्यासारखा फरक पडत नाही.
इंधनाची निवड : योजिलेल्या कामासाठी योग्य इंधनाची निवड करणे हे अनेक गोष्टींवर अवलंबून असते. जे इंधन जवळच्या ठिकाणी सापडते व जे सतत मिळू शकते तेच शेवटी स्वस्त ठरते. योग्य सामग्री वापरून कोणत्याही इंधनापासून उच्च औष्णिक कार्यक्षमता मिळविणे शक्य असते. परंतु एकंदरीने घन इंधनापेक्षा द्रव व वायू इंधने वापरणे जास्त सोयीचे होते. जगातील इतर देशांप्रमाणे भारतातही प्रथम लाकूड व मग दगडी कोळसा, कोक व खनिज तेल या क्रमाने इंधनात बदल होत गेला व आता वायूचाही वापर वाढत आहे.
घन इंधनात दगडी कोळसा व कोक ही मुख्य आहेत. कोळशाचा उपयोग शक्ती उत्पादन केंद्रातील वाफरांच्या भट्ट्या, कोक व वायू तयार करण्याच्या भट्ट्या अशा अनेक ठिकाणी होतो. कोळशाचे बरेच प्रकार आहेत व प्रत्येक ठिकाणी त्या त्या कामाला योग्य होईल अशाच प्रकारचा कोळसा वापरणे फायद्याचे होते. कोकाचा उपयोग लोखंड गाळण्याची झोतभट्टी, ओतशालेतील उभी भट्टी, घरगुती पण मोठ्या शेगड्या अशा विविध ठिकाणी होतो.
स्वयंचलांची इंधने : मोटारगाड्या, कर्षित्रे (ट्रॅक्टर) इत्यादी स्वयंचलांच्या एंजिनांसाठी पेट्रोल, रॉकेल व डीझेल तेल ही इंधने मुख्यतः वापरली जातात. यांपैकी पेट्रोल व रॉकेल ठिणगी एंजिनासाठी [→ अंतर्ज्वलन एंजिन] योग्य असतात. रॉकेल पेट्रोलापेक्षा दाट असते व डीझेल तेल रॉकेलापेक्षाही दाट असते. कर्षित्रे, मालमोटारी वगैरेंच्या डीझेल एंजिनासाठी डीझेल तेलच वापरावे लागते. शहरी प्रवासी मोटारींसाठी सामान्यतः पेट्रोल वापरतात [→ मोटारगाडी].
रेल्वे एंजिनांची व आगबोटींची इंधने : इतर प्रगत देशांप्रमाणे भारतातही रेल्वेचे वाफेचे एंजिन मागे पडत चालले आहे. त्यांची जागा डीझेल व विजेची एंजिने घेत आहेत. त्यामुळे कोळसा जाऊन रेल्वेसाठी डीझेल तेल हे प्रमुख इंधन होण्याची शक्यता आहे. दूरमार्गांचे विद्युतीकरणही चालू आहे पण त्यासाठी लागणारी वीज निर्माण करण्यासाठी विद्युत् निर्मिती केंद्रे उभारावी लागतील. यातील काही औष्णिक जातीची राहतील व तेथे मात्र कोळसा वापरावा लागेल. तो जवळच सापडत असल्यास हलक्या प्रतीचाही चालू शकेल. आगबोटींच्या बाबतीत आता वाफ एंजिने जवळजवळ नामशेष झाली असून त्यांची जागा डीझेल एंजिनांनी घेतली आहे. सामान्यतः एंजिनांना परिचालक (चालक पंखा) सरळ जोडतात. व त्यामुळे ती मंद गती जातीची करतात. या जातीच्या एंजिनांना स्वयंचलांच्या जलद गती एंजिनांना लागणाऱ्या डीझेल तेलापेक्षा जास्त दाट (जड) व म्हणून स्वस्त तेल वापरता येते. वाफ एंजिने गेल्यामुळे आता बोटींसाठी कोळशाचा वापर जवळजवळ बंदच झाला आहे. बोटीत अजून वाफ टरबाइने (चक्रीय एंजिने) वापरली जातात व त्यांसाठी वाफरही वापरावे लागतात. पण त्यांच्या भट्ट्यांमध्ये भट्टी तेलच इंधन म्हणून वापरतात. सांप्रतच्या अणुकेंद्रीय पाणबुड्यातही (उदा., अमेरिकेची पोलॅरिस) वाफर व वाफ टरबाइने असतात, पण वाफराला उष्णता अणुविक्रियकाद्वारा (अणुभट्टीद्वारा) पुरविली जाते [→ रेल्वे एंजिन टरबाइन प्रचालन].
विमान एंजिनांची इंधने : सु. १९५०–५५ पर्यंत विमानांची एंजिने ही मोटारगाड्यांच्या एंजिनांप्रमाणेच पश्चाग्र गतीची (पुढे मागे सरकणाऱ्या दट्ट्याद्वारे गती निर्माण करणारी) व पेट्रोलावर चालणारी होती. त्यांच्या शक्तीच्या मानाने त्यांचे वजन मात्र बरेच कमी असे. वजन कमी व्हावे म्हणून त्यात हवेचे अधिभरण (दाबयुक्त हवेचा वापर) करीत व त्यांचा वेगही उच्च ठेवीत. तसेच संपीडन गुणत्तरही (एंजिनाच्या सिलिंडरातील वायुरूप इंधनाचे संपीडन म्हणजे दट्ट्याने दाब देऊन संकोचन करण्यापूर्वी असलेले घनफळ व इंधन पेट घेण्यापूर्वी त्याचे असलेले घनफळ यांचे गुणोत्तर) जास्त असे. अशा एंजिनासाठी वापरावयाच्या पेट्रोलाचा ऑक्टेन अंक उच्च असावा लागे व ते अगदी निर्मळही असावे लागे. छोट्या विमानांशिवाय इतर विमानांसाठी पश्चाग्र गतीची एंजिने आता बहुशः प्रचारात नाहीत.
सध्या विमानासाठी मुख्यत्वे झोत (जेट) प्रचालन पद्धती वापरात आहे. याचा मुख्य फायदा म्हणजे इंधनाच्या ज्वलनाने उत्पन्न होणाऱ्या उष्णता ऊर्जेचे विमान चालण्याच्या यांत्रिक ऊर्जेत सरळ रूपांतर होते. त्यासाठी सिलिंडर-दट्ट्याच्या एंजिनाची किंवा वायू टरबाइनाचीही गरज लागत नाही. विमानाचे झोत एंजिन व रॉकेटाचे झोत एंजिन यांत सैद्धांतिक फरक नाही. पण विमानातील इंधनाच्या ज्वलनासाठी हवेतील ऑक्सिजन वापरता येतो तर रॉकेटात इंधनाचे ज्वलन घडवून आणणारा ऑक्सिडीकारक (ऑक्सिजनाशी संयोग घडवून आणणारा) पदार्थ इंधनाबरोबरच रॉकेटातून न्यावा लागतो. विमान व त्यातील एंजिन यांच्या अभिकल्पाचे (आराखड्याचे) एक मोठे वैशिष्ट्य म्हणजे विमानाला शक्य तितके कमी इंधन लागावे, म्हणजेच इंधनापासून जास्तीत जास्त उष्णता मिळविता यावी. त्यासाठी विमान एंजिनाचा विशिष्ट इंधन व्यय (सरासरी एक अश्वशक्ती उत्पन्न करण्यासाठी एका तासात खर्च होणारी इंधनराशी) शक्य तितका कमी असला पाहिजे. ज्वलनाच्या उष्णतेचे विमानाला मिळणाऱ्या रेट्यात रूपांतर होतानाची कार्यक्षमता जर स्थिर गृहीत धरली तर विमानाच्या उड्डाणाचा पल्ला, इंधनराशी कायम असल्यास, ज्वलन उष्णतेच्या समप्रमाण असतो. म्हणूनच इंधनाची ज्वलन उष्णता (कॅलरीमूल्य) जास्तीत जास्त असणे आवश्यक आहे [→ विमान एंजिन झोत प्रचालन].
झोत विमानाची इंधने : दट्ट्याच्या एंजिनाच्या निरनिराळ्या प्रकारच्या इंधनांची बाष्पनशीलता जवळजवळ एकाच प्रमाणात असते पण ज्वलनातील वैशिष्ट्ये वेगळी असतात. या उलट झोत एंजिनाच्या इंधनांच्या बाष्पनशीलतेच्या प्रमाणात फरक असतो, तर ज्वलन गुणधर्मातील फरक थोडाच असून त्याला गौण स्थान असते. ही इंधने रॉकेलपायाभूत (रॉकेलावर आधारलेली) असतात. त्यांचे प्रकार कोष्टक क्र. ३ मध्ये दिले आहेत.
| कोष्टक क्र. ३. झोत विमानांची इंधने | |
| प्रकार-संज्ञा | ऊर्ध्वपातनाच्या सीमा ० से. |
| जेपी – १ | १६० – २२० |
| जेपी – २ | केवळ प्रायोगिक |
| जेपी – ३ | ४० – २६० |
| जेपी – ४ | ६५ – २६० |
| जेपी – ५ | १७५ – २६० |
| जेपी – ६ | १५० – २६० |
| जेट – ए | १६० – २६० |
| जेट – बी | ६५ – २६० |
| विमानांचे पेट्रोल | ४५ – १६० |
या आठ प्रकारांपैकी जेपी–२ हा प्रकार प्रयोगावस्थेच्या पुढे गेला नाही व जेपी–१ व जेपी–३ ही इंधने आता प्रचारातून गेली आहेत. जेपी–४ व जेट– बी ही जवळजवळ सारखीच असून ती अनुक्रमे अमेरिकेच्या संरक्षण दलात व मुलकी वाहतुकीत वापरतात. जेपी–४ हे अमेरिकी हवाई दलाच्या अवस्वनी (आवाजाच्या वेगापेक्षा कमी वेगाच्या) विमानांसाठी वापरात आहे. मात्र जमिनीवरील साठवणाच्या व विमानांच्या टाक्यांत या दोन्ही इंधनांचे बाष्प जमा होते व त्यामुळे आगीचा धोका संभवतो. जेपी–५ व जेपी–६ ही अनुक्रमे अमेरिकी आरमाराच्या विमानासाठी व हवाई दलाच्या अधिस्वनी (आवाजाच्या वेगापेक्षा अधिक वेगाच्या) विमानासाठी वापरात आहेत. विमान एंजिनांच्या बाबतीत एक गोष्ट विशेष लक्षात घेण्यासारखी असते ती ही की, दट्ट्याची एंजिने इंधनाच्या बाबतीत जरा चोखंदळ असतात पण झोत एंजिनात पुष्कळ प्रकारची इंधने कार्यक्षमतेची फारशी हानी न होता वापरता येतात.
अलीकडे विमानाची दालने वगैरे वातानुकूलित करण्यासाठी आणि एंजिनाचे भाग, वंगण तेल, इ. थंड राखण्यासाठी जेट इंधनाचा वापर करण्यात येतो. यांमुळे इंधनाचे पूर्वतापन होते. असे पूर्वतापन विमानाच्या उड्डाणात इंधनाच्या टाक्या वायुगतिक कारणांनी तापतात तेव्हाही घटते. अशा क्रियांतून इंधनाचे तपमान १५००_ २५०० से.वाढू शकते व ही तपमानाची वाढ इंधनाला सहन करता आली पाहिजे. तसेच ती नीच तपमानातही (गोठण बिंदू –४०० से.जेट–ए ते –६०० से. जेपी-४) टाक्यांतून आपली द्रवावस्था टिकवून धरणारी असली पाहिजेत. या इंधनांच्या योग्यतेचा खरा महत्त्वाचा निकष त्यांचे कॅलरीमूल्य हा असून ते जेपी-५ चे १०,१६५ कॅ./ग्रॅ. व इतर सर्वांचे १०,२२० पेक्षा जास्त असले पाहिजे. मात्र हायड्रोकार्बनांच्या मिसळीने बनविलेल्या सर्व जेट इंधनांचे कॅमू. १०,२२० ते १०,४४० कॅ./ग्रॅ. या मर्यादेपलीकडे जाऊ शकत नाही. कशाही तर्हेची ज्वलन उष्णता वाढविणारी व्यवस्था जेट इंधनासाठी वापरली तरी तिला रॉकेलपायाभूत जेपी किंवा जेट जातींच्या (कोष्टक क्र. ३) इंधनांच्या बाबतीत मर्यादा पडते, कारण या व्यवस्थेत मुख्यतः इंधनाचे पूर्वतापन असते व ते काही मर्यादेपर्यंतच करता येते. म्हणून माख अंक (वस्तूचा एखाद्या माध्यमातील वेग आणि ध्वनीचा त्याच माध्यमातील वेग यांचे गुणोत्तर दर्शविणारा अंक) चारच्या (अंदाजे ४,४०० किमी./तास) वर विमानाचा वेग वाढवावयाचा असल्यास रॅमजेट किंवा स्क्रॅमजेट प्रचालन पद्धती [→ झोत प्रचालन] व अतिनीच द्रवीभवन बिंदू असलेल्या दोन वायूंचे (उदा., हायड्रोजन व मिथेन) मिश्रण इंधन म्हणून वापरावे असे सुचविण्यात आले आहे.
द्रव हायड्रोजनाचा उकळबिंदू जरी –२५३० से. इतका खाली असला तरी सुद्धा त्याचा स्क्रॅमजेट पद्धतीच्या विमानात माख अंक सहाच्या (सु. ६,५०० किमी./तास) वरील वेगासाठी इंधन म्हणून वापर होण्याची शक्यता आहे. या बाबतीतील त्याची उपयुक्त वैशिष्ट्ये म्हणजे त्याचे जेपी जातींच्या इंधनांपेक्षा तो ३–५ पट अधिक उष्णता सामावून घेऊ शकतो, त्याचे कॅमू. २८,९५० कॅ./ग्रॅ., म्हणजे जेपी इंधनांच्या २·८ पट आहे, तो हवेशी सहज मिसळू शकतो व स्क्रॅमजेटाच्या ज्वलनकक्षातील (इंधनाचे प्रत्यक्ष ज्वलन होणाऱ्या जागेतील) अती कठीण परिस्थितीतही तो जाळता येतो. याच जातीचे दुसरे अतिशीत इंधन म्हणजे द्रव मिथेन किंवा द्रव नैसर्गिक वायू (बहुतेक सर्व नैसर्गिक वायूंत ९० टक्क्यांपेक्षा जास्त मिथेन वायू असतो). याची वैशिष्ट्ये म्हणजे त्याचे द्रवीभवन तपमान –१६२० से., कॅमू. ११,९५० कॅ./ग्रॅ. (जेपी जातीच्यापेक्षा थोडे अधिक) आणि उष्णता सामावून घेण्याची शक्ती हायड्रोजन आणि जेपी इंधन यांच्यामधली आहे. सध्या द्रव नैसर्गिक वायू आफ्रिकेतून ब्रिटनमध्ये बोटींनी नेऊन वापरण्याइतका स्वस्त आहे व म्हणून तो व्यापारी हवाई वाहतुकीत वापरावा असे घाटत आहे.
अमेरिकेत १९५०–६० च्या दरम्यान हायड्रोकार्बनाव्यतिरिक्त इंधनांचा विकास करण्याचा प्रयत्न झाला होता. त्यांच्या दोन जाती होत्या, एक बोरॉन हायड्राइडापासून बनविलेली व दुसरी मॅग्नेशियमापासुनची. बोरॉन हायड्राइडांचे कॅमू. हायड्रोजनाच्या खालोखाल आहे हा त्यांचा विशेष गुण आहे. या प्रयत्नात अल्किल डेकॅबोरेन, डायबोरेन व पेंटॅबोरेन आणि बोरेन व मॅग्नेशियम यांची द्रव हायड्रोकार्बनातील मिश्रणे यांवर प्रयोग झाले, पण त्या सर्वांत काही ना काही दोष आढळल्यामुळे त्यांचा विचार सोडून दिला गेला.
रॉकेट एंजिनांची इंधने : ही द्रव आणि घन अशी दोन जातींची असतात. दोन्ही जातींसाठी इंधनाबरोबरच ऑक्सिडीकारकही ठेवावा लागतो. जेव्हा मोठ्या जबरदस्त रेट्याची आवश्यकता असते (उदा., अवकाशयान), तेव्हा द्रव इंधन वापरतात. जेव्हा रेटा मोठा नसला तरी चालू शकते (उदा., काही प्रकारची क्षेपणास्त्रे, उभ्या दिशेने सुटणारे विमान), तेव्हा घन इंधन वापरणे शक्य असते.
द्रवीकृत हायड्रोजन द्रवीकृत ऑक्सिजनासह रॉकेटांचे इंधन म्हणून वापरला गेला आहे. त्याचे कॅमू. खूपच आहे पण त्याची घनता बरीच कमी असते व त्यामुळे त्याच्या साठवणाला मोठी जागा लागते. या दोषामुळे द्रव हायड्रोजनाचा वापर मागे पडत आहे. पण द्रव हायड्रोजनाच्या जोडीने द्रव फ्ल्युओरीन वापरला तर मिश्रणाच्या ज्वलनाने खूपच मोठा विशिष्ट आवेग [→ प्रेरणा (रेटा) × वेळ ÷ वजन] मिळू शकतो असे आढळून आले आहे व सांप्रत या मिश्रणाच्या विकासाचे प्रयत्न चालू आहेत. हायड्रॅझीन N2H4 व दुसरी हायड्रॅझिनावर आधारभूत असलेली द्रव इंधने, नायट्रोजन टेट्रॉक्साइड N2O4 या द्रव ऑक्सिडीकारकाच्या जोडीने रॉकेटासाठी उपयुक्त आहेत. तसेच वर उल्लेख आलेली बोरॉन हायड्राइडे (डायबोरेन B2H6 व पेंटॅबोरेन B5H9) ही विमानांच्या झोत एंजिनांसाठी जरी उपयुक्त ठरली नाहीत, तरी रॉकेट एंजिनांसाठी ती उपयुक्त ठरली आहेत. यापासून खूप ज्वलनजनित उष्णता मिळते. ज्याच्यामुळे फार उच्च तपमानाची, अंदाजे ५,०००० से. ची, ज्वाला मिळते असे खास इंधन म्हणजे वायुरूप सायनोजेन C2N2 होय. हा वायू वायुरूप ऑक्सिजनाच्या जोडीने वापरतात.
निराळा ऑक्सिडीकारक न वापरता काही इंधनांचे उत्स्फूर्तपणे अपघटन होऊन त्यांचे स्वतःच किंवा एखाद्या उत्प्रेरकाच्या सान्निध्यामुळे ज्वलन होऊ शकते. या जातीच्या इंधनांची उदाहरणे म्हणजे हायड्रोजन पेरॉक्साइड H2O2 व नायट्रोमिथेन CH3NO2 ही होत. यांना एकेरी प्रचालनके म्हणतात. रॉकेटासाठी घन इंधने वापरणे द्रव इंधनापेक्षा सोपे व सोईस्कर असते, कारण त्यासाठी पंप, झडपा वगैरे हलणारे भाग लागत नाहीत. घन प्रचालनाकांचे दोन सामान्य वर्ग आहेत, एक द्विपायिक (दोन पदार्थ पायाभूत असलेले) व दुसरा संयुक्तांचा. द्विपायिक इंधने नायट्रोग्लिसरीन व नायट्रोसेल्युलोज यांची मिळून होतात व त्यांना निराळा ऑक्सिडीकारक लागत नाही. नायट्रोग्लिसरिनामुळे नायट्रोसेल्युलोज आकार्य (जरूर तो आकार देण्यायोग्य) होतो व या मिश्रणाचे टाकीच्या आकाराचे ओतीव बनविता येते. इंधनाच्या या टाक्या रॉकेटाच्या बुडाशी असतात. संयुक्त प्रचालनकात इंधन व ऑक्सिडीकारक ही स्वतंत्र असतात. इंधन म्हणून अस्फाल्टी तेल, ऊष्माद्दढ (तापविल्याने कठीण होणारी) प्लॅस्टिके (उदा., फिनॉल फॉरमाल्डिहाइड व फिनॉल फुरफुराल रेझिने वापरली गेली आहेत) किंवा कित्येक प्रकारचे संश्लिष्ट रबर आणि डिंकासारखे पदार्थ हेही सामान्यतः वापरतात. ऑक्सिडीकारक म्हणून पुढील रसायने वापरता येतात : अकार्बनी परक्लोरेटे, उदा., अमेनियम परक्लोरेट NH4ClO4 अथवा पोटॅशियम परक्लोरेट KClO4 एखादे नायट्रट, उदा., अमेनियम—, पोटॅशियम—किंवा सोडियम नायट्रेट NH4NO3, KNO3, NaNO3. अलीकडे बोरॉन, ॲल्युमिनियम व बेरिलियम या धातूंचे कण घन प्रचालनकात मिसळून त्यांची ज्वलन उष्णता वाढविता येते असे दिसून आले आहे. तसेच ज्वलन क्रिया चालू असता तेथे उद्भवणारी एक प्रकारची अस्थिरता या धातुकणांच्या मिसळीने टाळली जाते. वर दिलेली सर्व प्रकारची इंधने ही रासायनिक इंधने होत [→ रॉकेट].
पहा : कोक; कोल गॅस; कोळसा, दगडी; कोळसा, लोणारी; खनिज तेल.
संदर्भ : 1. Brame, J. S. S.; King, J. G. Fuel : Solid, Liquid and Gaseous, London, 1967.
2. Critchley, G. N. Ed. Future of Fuel Technology, New York, 1964.
3. Himus, G. W. Elements of Fuel Technology, 1958.
4. Williams, D. A.; Jones, G. Liquid Fuels, London, 1963.
बेहेरे, श्री. ना.; ओगले, कृ. इ.