पुंज रसायनशास्त्र : विविध रासायनिक संयुगांच्या रेणूंचा अभ्यास (उदा., वर्णपटावरून) करून रेणूंचे कित्येक गुणधर्म व त्यांच्या संबंधीच्या राशींचे ज्ञान होऊ शकते. त्यांपासून रसायनशास्त्रज्ञांनी वेगवेगळ्या अणूंचा संयोग का व कसा होतो. रेणूच्या घटकामधील अतरे बंधांमधील कोन, रेणूचे स्थैर्य इत्यादींबद्दल काही आडाखे बांधले. हे आडाखे कमीजास्त प्रमाणात बरोबर व उपयुक्तही ठरले ⇨ पुंजयामिकीच्या सहाय्याने या आडाख्यांना शास्त्रीय बैठक देण्याचे काम पुंज रसायनशास्त्रात केले जाते.
मर्यादा : अत्यंत सोप्या संरचनेचे रेणू वगळल्यास पुंज रसायनशास्त्रत येणारी पुंजनियामिकीय समीकरणे सोडविण्यास अत्यंत कठीण असतात. अद्ययावत संगणकाच्या (गणकयंत्राच्या) मदतीने सुद्धा अशा समीकरणांचे अचुक निर्वाह (उत्तरे) काढणे अद्याप शक्य होत नाही परंतु हायड्रोजन रेणू व त्यासारखा अत्यंत सोपी संरचना असलेल्या रेणूंच्या बाबतीत अचूक निर्वाह काढण्यात आलेले आहेत.त्यावरून काढलेले निष्कर्ष प्रायोगिक मूल्यांशी तंतोतंत जुळतात. त्यामुळे या अभ्यास पद्धतीवरचा विश्वास दृढ झालेला आहे.
जास्त जटील : (गुंतागुंतीची संरचना असलेल्या ) रेणूंच्या बाबतीत काही अनुभवसिद्ध आसन्नीकरणे (उद्दिष्टानुसार अचूक निर्वाहाच्या जास्तीत जास्त जवळचा निर्वाह मिळविण्याची पद्धती ) वापरून फक्त अंदाजी निर्वाह काढता येतात. परंतु जसजसे जास्त गुणवत्तेचे (वेग व संकलनक्षमता यांच्या दृष्टीने) संगणक अधिक वेळा उपलब्ध होत जातील व निर्वाह काढण्याच्या नवनव्या पद्धती निघत जातील तसतशी या शास्त्रात भरीव प्रगती होईल असे शास्त्रज्ञांना खात्रीपूर्वक वाटते. त्याशिवाय सध्या मिळणारे निर्वाह अगदी अचूक नसले, तरीही त्यांच्यापासून रेणू-संरचना, रासायनिक विक्रियागतिकी (रासायनिक विक्रियांच्या वेगासंबंधीचे शास्त्र) इत्यादींबद्दल अत्यंत उपयुक्त माहिती उपलब्ध झाली आहे.
दोन दृष्टीकोन : रेणूंचे संघटन व संरचना यांच्याबद्दल मूलग्राही स्पष्टीकरण करण्यासाठी पुंज रसायनशास्त्रात दोन वेगळेवेगळे दृष्टिकोन किंवा पद्धती वापरात आहेत. त्यांतील एक संयुजा-बंध पद्धती आणि दुसरी रेणवीय परिकक्ष (ऑर्बिटल) पद्धती होय. डब्ल्यू. हाइटलर व एफ्. लंडन यांनी संयुजा-बंध पद्धतीचा वापर करून हायड्रोजन रेणूच्या संघटनाचे विवरण य़शस्वीपणे करून दाखविले. स्थूलमानाने म्हणावयाचे तर या पद्धतीत असे गृहीत धरले जाते की, ज्या इलेक्ट्रॉन युग्मांमुळे दोन अणू एकमेकांस जोडले जातात, ते इलेक्ट्रॉन रेणू तयार झाल्यावरही आपआपल्या मूळच्या अणूकेंद्रांशी निगडित राहतात परंतु अनेक अणूंपासून बनणाऱ्या रेणूंच्या बाबतीत ही पद्धत फारशी उपयोगी पडत नाही [→ संयुजा रासायनिक संरचना].
रेणवीय परिकक्ष ही दुसरी पद्धत प्रथम ई. यू. कॉंड यांनी वापरली आणि एफ्. हंड, आर्. एस. म्यूलिकेन, ई. हकल यांनी विकसित केली. अणूपासून रेणू बनला म्हणजे संबंधीत आणवीय परिकक्ष परस्परांत विलिन होऊन नवीनच रेणवीय परिकक्ष बनतात असा दृष्टिकोन या पद्धतीत स्वीकारला जातो. ही पद्धत बहु-आणवीय रेणूंच्या बाबतीतही उपयोगी पडते. समजण्यास जास्त सोपी असल्याने प्रस्तुत नोंदीत या पद्धतीला जास्त प्राधान्य दिले आहे. प्रस्तुत नोंदीत वापरलेल्या अनेक संकल्पनांच्या तपशिलासाठी ‘अणू व आणवीय संरचना’ आणि ‘पुंजयामिकी’ या नोंदी पहाव्यात परंतु सोयीसाठी या संकल्पनांची त्रोटक चर्चा प्रथम केली आहे.
आणवीय इलेक्ट्रॉन कक्षा व त्यांचे निर्देशन : सूर्यमालेतील पृथ्वी व इतर ग्रह ज्याप्रमाणे ठराविक कक्षांमध्ये सूर्याभोवती फिरत असतात त्याचप्रमाणे काही ठराविक कक्षांमध्ये अणूमधील इलेक्ट्रॉन अणूकेंद्राभोवती फिरत आसतात अशी नील्स बोर व आर्नोल्ट झोमरफेल्ड यांची परिकल्पना होती. या परिकल्पनेनुसार n,l,mव s या चार पुंजांकांच्या साहाय्याने विशिष्ट इलेक्ट्रॉनाची अस्तित्व कक्षा निश्चित होते. यांतील n ला प्रमुख पुंजांक म्हणतात आणि त्याची मूल्ये १,२,३ इत्यादी पूर्णांक असतात. विशिष्ट इलेक्ट्रॉनाची एकूण ऊर्जा आणि त्याच्या कक्षेत विस्तार n वर अवलंबून असतो.l या पुंजांकाच्या मूल्यावर इलेक्ट्रॉनचा (कक्षीय)कोनीय संवेग (द्रव्यमान, परिभ्रमण अक्षापासूनच्या अंतराचा वर्ग व कोनीय वेग यांच्या गुणाकाराने मिळणारी ऱाशी) व त्याचा कक्षेचा आकार अवलंबून असतो. विशिष्ट nमूल्यासाठी l ची मूल्य 0, 1, 2,……,n-1अशी असू शकतात. वर्णपटीय परिभाषेनुसार l=0 या कक्षेला s कक्षा, l=1असणाऱ्या कक्षेला pकक्षा, l=2ला d कक्षा अशा संज्ञा देतात. विशिष्ट मूल्यासाठी कक्षांची एकून संख्या (21+1) इतकी असते. तेव्हाn=1या मूल्यासाठीचे फक्त (‘शून्य’ हे) एकच मूल्य संभवते पण n=2 साठी lची दोन मूल्ये (0,1) ही असू शकतात. म्हणून येते s कक्षा (l=0) व तीन p कक्षा (l=1) संभवतात. विशिष्ट कक्षेचे निर्देशन करण्यासाठी प्रथम त्या कक्षेशी संबंधीत मूल्याचा आकडा लिहून त्याच्या पुढे l-मूल्यामनुरुप (s, p, d इत्यादींपैकी )अक्षर लिहितात. (उदा., n=2,l=0 ही कक्षा 2s अशी किंवा n=3,l=2 ही कक्षा 3d अशी दिग्दर्शित केली जाईल). हीच पद्धत प्रस्तुत नोंदीत कक्षांच्या (व तत्संलग्न परिकक्षांच्या ) निर्देशनासाठी वापरली आहे. m या पुंजांकावरुन कक्षेची अवकाशातील दिशा निश्चित होते.
आणवीय परिकक्ष : अणूमध्ये भ्रमण करणाऱ्या ( विशिष्ट संवेगमूल्य असलेल्या ) इलेक्ट्रॉनाच्या बाबतीत, तो विशिष्ट क्षणी निश्चितपणे अमुक स्थानी असेल असे सांगताच येणार नाही [→ अनिश्चिततेचे तत्त्व]. त्यामुळे अशा इलेक्ट्रॉनाला रेखीव अशी निश्चित कक्षा असणेही अशक्य आहे. या तत्त्वामधून परिकक्ष ही कल्पना निर्माण झाली.
पुंजयामिकीत ज्या विशिष्ट फलनाच्या साहाय्याने एखाद्या इलेक्ट्रॉनाचे वर्णन केले जाते त्या फलनालाच त्या इलेक्ट्रॉनाचा परिकक्ष असे म्हणतात परंतु या संज्ञेचे स्पष्टीकरण दुसऱ्या दोन पर्यायी पद्धतीनी करतात.
इलेक्ट्र्र्रॉन हा कण आहे असे मानल्यास फलनावरून तो इलेक्ट्रॉन विशिष्ट प्रदेशात असण्याची संभाव्यता दिग्दर्शित केली जाते. बोरप्रणित विशिष्ट कक्षेभोवतीच्या जेवढ्या प्रदेशात विशिष्ट इलेक्ट्रॉनाचे अस्तित्व असण्याची शक्यता खूपच जास्त असते, तेवढ्या त्रिमितीय प्रदेशाला त्या इलेक्ट्रॉनाचा परिकक्ष असे म्हणतात. या परिकक्षाचे निर्देशन संबंधीत कक्षेप्रमाणे केले केले जाते. (उदा., २ s परिकक्ष 3pपरिकक्ष इत्यादी).
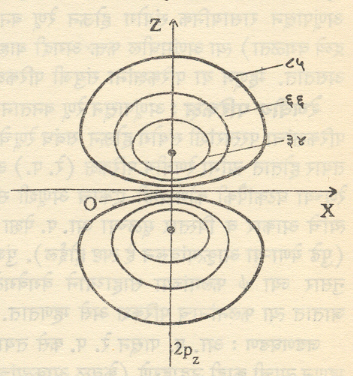
आ. १ मध्ये हायड्रोजन अणूतील एका विशिष्ट (2pz) या परिकक्षेकरिता x-zप्रतलातील समान संभाव्यता रेषा आलेखित केल्या आहेत. ३४ या आकड्याने निर्देशित केलेल्या वक्राच्या आत इलेक्ट्रॉन सापडण्याची संभाव्यता ३४% आहे. याचप्रमाणे इतर वक्रांचा अर्थ समजावा ही आकृती z-अक्षाभोवती फिरविल्यास आ. २ मध्ये दाखविलेल्या आकाराचा पृष्टभाग मिळेल आणि इलेक्ट्रॉन त्याच्या आतील भागात सापडण्याची संभाव्यता८५% असेल. नेहमीच्या संकेतानुसार असा ८५% संभाव्यतेच्या पृष्ठाने सीमित झालेला सर्व प्रदेश त्या इलेक्ट्रॉनाचा एक (येथे 2pz हा) परिकक्ष घेतला जातो (काही शास्त्रज्ञ ९५% संभाव्यतेच्या पृष्टाने सीमित केलेला प्रदेश म्हणजे परिकक्ष असे
मानतात).
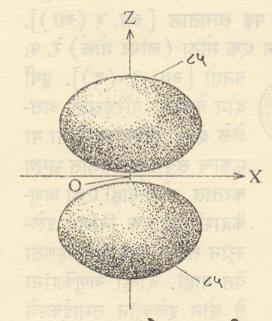
यावरुन हे लक्षात येईल की, विशिष्ट इलेक्ट्रॉन आपल्या परिकक्षाच्या बाहेर सापडण्याची संभाव्यता अल्प का होईना (वरील उदाहरणात १५% )असतेच. १००% संभाव्यतेचे पृष्ठ काढावयाचे म्हटल्यास ते अणुकेंद्रापासून अनंत अंतरावर काढावे लागले.
दूसऱ्या पर्यायी कल्पनेनुसार इलेक्ट्रॉन हा कणरूपी नसून विरळ मेघासासखा आहे असे मानले जाते. बोरप्रणीत कक्षेच्या आसपास या मेघाची घनता सर्वांत जास्त असते. ही कल्पना रसायनशास्त्रातील विवेचनात जास्त उपयुक्त ठरते.
काही वैशिष्ट्ये : एकाकी अणूशी संबद्ध इलेक्ट्रॉनांच्या परिकक्षांना आणवीय परिकक्ष (आ.प.) असे म्हणतात. एका परिकक्षात [पाउली यांच्या विवर्जन तत्त्वानुसार, → अणू व आणवीय संरचना] दोन इलेक्ट्रॉनांपेक्षा जास्त इलेक्ट्रॉन राहू शकत नाहीत. परंतु एखाद्या परिकक्षात एकही इलेक्ट्रॉन नसल्याने तो रिक्त किंवा एकच इलेक्ट्रॉन भासल्यास अंशतः रिक्त असू शकेल. sपरिकक्षांना अणुकेंद्राभोवती गोलीय सममिती असते. त्यामुळे त्यांना अवकाशात विशिष्ट अशी दिशा नसते. परंतू p परिक्षकांपैकी एकाला z-अक्षाभोवति, दूसऱ्याला y-अक्षाभोवती व तिसऱ्या x-अक्षाभोवती सममिती असते आणि त्यानुसार त्यांना pz,py,pxअशी नावे देतात. म्हणजेच या परिक्षकांना निश्चित दिशा असतात. म्हणून त्यांच्या योगे निर्माण होणाऱ्या रासायनिक बंधांनाही निश्चित दिशा असतात. त्याचप्रमाणे d, f इ. परिक्षकांमुळे उत्पन्न होणारे बंधही दिशायुक्त असतात. → त्रिमितीय रयानशास्त्राच्या दृष्टीने ही बाब महत्त्वाची आहे. अणूंपासून रसायनिक संयोग होऊन रेणू बनताना (संक्रमणी मूलद्रव्ये वगळता) त्या अणूंमधील फक्त अगदी बाह्य परिकक्षाचा कार्यकारी असतात. म्हणून या परिकक्षांना संयुजी परिकक्ष असे म्हणतात.
रेणवीय परिकक्ष : अणूंपासून रेणू बनताना घटक अणूंच्या संयुजी परिकक्षांची परस्परांशी संयोग होउन संबंध रेणूचे असे जे नवेच परिकक्ष तयार होतात त्यांना रेमवीय परिकक्ष (रे,प) असे म्हणतात. हे रे. प. रेणूच्या घटकांपैकी कोणत्याही एकाच अणूशी संलग्न झालेले नसतात. त्यांचे आकार व विस्तार मूळच्या आ. प. पेक्षा खूपच वेगळे असतात (पुढे येणाऱ्या आकृत्यांवरून हे स्पष्ट होईल). पुंजयामिकीतील रिवाजानुसार ज्या फलनाच्या साहाय्याने वेगवेगळे परिकक्ष व्यक्त केले जातात. त्या फलनांनाच परिकक्ष असे म्हणतात.
जडणघडण : आ. प. पासून रे. प. कसे तयार होतात हे स्पष्ट व्हावे म्हणून त्याची काही उदाहरणे (केवळ आकृत्यांच्या साहाय्याने) खाली दिली आहेत.
दोन हायड्रोजन अणूंच्या संयोगाने हायड्रोजन रेणू तयार होतो. एकाकी हायड्रोजन अणूतील 1sहा संयुुजा परिकक्ष पूर्णपणे गोलाकार असून त्याच्या मध्यावर अणूकेंद्र असते. असे दोन अलग अणू (आ. ३.अ) परस्परांच्या जवळ आणीत गेल्यास शेवटी त्या दोहोंचे परिकक्ष काही प्रमाणात परस्परांवर पडू लागतात. आ. ३ आ) मग आ. प. परस्परांत विलीन होऊन एक मोठा (लांबट गोल) रे. प. बनतो आ. ३ इ. पूर्वी दोन वेगळ्या परिकक्षांत असलेले दोन्ही इलेक्ट्रॉन आता या एकाच संयुक्त परिकक्षांत भ्रमण करतात. कोणत्याही एका अणूकेंद्राशी हा एक विशिष्ट इलेक्ट्रॉन संलग्न आहे असे म्हणता येत नाही. दोन्ही अणुकेंद्रांना ते दोन इलेक्ट्रॉन समाईकपणे संलग्न झालेले असतात असेच म्हणावे लागते. वरील आकृती दोन अणुकेद्राना जोडणाऱ्या रेषेभोवती फिरविली, तर संपूर्ण रे. प. ची त्रिमितीय आकृती मिळेल.
वरील आकृतीतील आ. प. म्हणजे इलेक्ट्रॉन मेघ आहेत असे मानल्यास [आ. ३ आ मध्ये] जेथे हे दोन मेघ परस्परांवर पडतात तेथे (म्हणजेच त्या दोन अणुकेंद्रांच्या दरम्यान) मेघांची इलेक्ट्रॉन घनता वाढते. या जास्त सधन इलेक्ट्रॉन मेघाकडून दोनही अणुकेंद्रे स्वतःकडे ओढली जातात, त्याचबरोबर दोन अणुकेंद्रे परस्परांचे अपसारणही करीत असतात. या दोन परस्पर विरुद्ध प्रेरणांचे संतुलन होईल इतके अंतर त्या दोन अणुकेंद्रात झाले म्हणजे रेणूला स्थैर्य येत, कारण या परिस्थितीत रेणूची एकूण ऊर्जा किमान होते.
प्रकार : आ. ३ (इ) वरून हे लक्षात येईल की,दोन अणुकेंद्रामधून जाणारी रेषा (ही रेषा सामन्यतः z-अक्ष घेतले जाते)ज्या प्रतलात
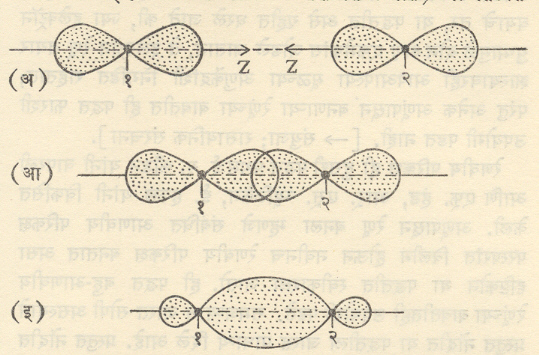
निर्मिती : (अ) दोन अणूंमधील अलग Pz परिकक्ष (आ) परिकक्षांचे टोकावर अंशतः परस्परव्यापन (इ) निष्पन्न रे. प. १व २ ही दोन अणूंची अणूकेंद्रे असून १–२ या रेषेभोवती आकृती फिरविल्यास या परिकक्षांचे त्रिमितीय आकार मिळतील.संपूर्ण पडेल अस निःस्पंद प्रतल (ज्या प्रतलावर चे मूल्य सर्वत्र शून्य आहे असे प्रतल) या रे. प. च्या बाबतीत संभावत नाही. अशा रे. प. ना. रे. प. (सिग्मा रे. प. ) असे म्हणतात. रे. प. मुळे निर्माण होणारे रासायनिक बंधसर्वाधिक सामर्थ्यवान असतात. आ. ४ मध्ये दोन अणूंमधील दोन Pzआ प. (यांचा आकार साधारणतः वाळूच्या घड्याळासारखा असून त्याला दोन पाळी आहेत हे आकृतीवरून स्पष्ट होईल )त्यांच्या टोकांकडून अंशतः परस्परव्यापी झाल्यास मिळणारे रे. प. ही प्रकारचेच असते, हे वरील विवेचनावरून समजून येईल.
परंतू दोन Pz आ. प. परस्परांवर आडव्या बाजूने ( अक्षाला लंब दिशेने) अंशतः परस्परव्यापी झाल्यास त्यांच्या संयोगामुळे निर्मान होणारा रे. प. आ. ५ (इ) मध्ये दाखविला आहे.
आ. ५ मध्ये z-अक्ष दोन अणूकेंद्राना जोडणाऱ्या रेषेला लंब घेतला आहे आ. ५ (इ) मध्ये मिळालेल्या रे. प. चे १–२ रेषेच्या वर एक आणि खाली एक असे दोन विभाग किंवा पाळी आहेत पण त्या दोन्ही मिळून एकच रे. प. बनतो. १–२ या रेषेमधून आकृतीच्या प्रतलाला लंब असे प्रतल (x-y) प्रतल घेतल्यास रे. प. च्या दोनपैकी कोणतेही पाळे त्या प्रतलाला छेदत नाही म्हणजेच हे निस्पंद
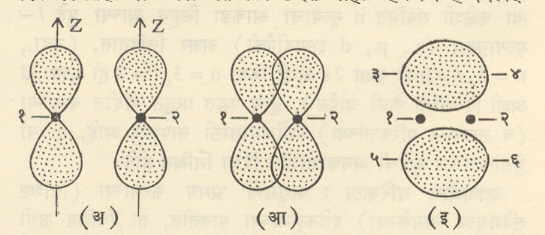
निर्मिती : (अ) आडव्या बाजूने जवळ येणारे दोनpz परिकक्ष (आ) दोन pz परिकक्षांचे z-अक्षाला लंब दिशेने अंसतः परस्परव्यापन (इ) निष्पन्न रे. प. १ व २ ही अणूकेंद्रे आहेत ३-४ व ५-६ या अक्षांभोवती रे. प. चे वरचे व खालचे पाळे फिरविल्यास संपूर्ण रे. प. चा त्रिमितीय आकार मिळेल ( हा आकार साधारणतः जांभळासारखा असतो). प्रतल होईल ( कारण त्यावर सर्वत्र आहे). अशा (एकच निःस्पंद प्रतल असलेल्या ) रे. प. ला रे. प. (पाय् रे. प. ) म्हणतात व त्यामुळे उत्पन्न होणाऱ्या रासायनिक बंधाला बंध असे म्हणतात. बंधाचे सामर्थ्य बंधापेक्षा सामान्यतः कमी असते.
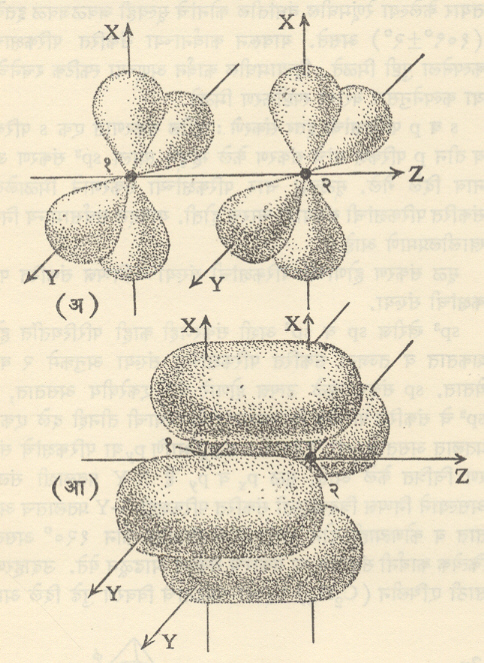
आ. ६ (अ) मध्ये दोन अणूंमधील 3 d परिकक्षांपैकी हे परिकक्ष अलग दाखविले आहेत z-अक्षाच्या दिशेने ते परस्परव्यापी होऊन बनलेला रे. प. आ. ६ (आ) मध्ये दाखविला आहे. या आकृतीत दोन अणुकेंद्राना जोडणारी रेषाच z- अक्ष घेतली आहे. निष्पन्न रे प. ला जांभळाच्या आकाराचे चार विभाग किंवा पाळी आहेत. ती सर्व मिळून एकच रे.प. होतो व त्या चारी पाळ्यांत मिळून फक्त दोन इलेक्ट्रॉन भ्रमण करू शकतात. या रे. प. चे मुख्य वैशिष्ट्य हे आहे की, यात दोन अणूकेंद्रांना जोडणाऱ्या रेषेमधून (z-अक्षामधून) जाणारी दोन (x-y,y-z)ही नि:स्पंद प्रतले आहेत. अशा प्रकारच्या रे.प. ला. रे. प. (डेल्टा –रे.प.) म्हणतात. हा बंध सर्वांत कमी सामर्थ्यवान असतो. रसायनशास्त्रात सामान्यतः हेच तीन प्रकारचे बंध महत्त्वाचे असतात.
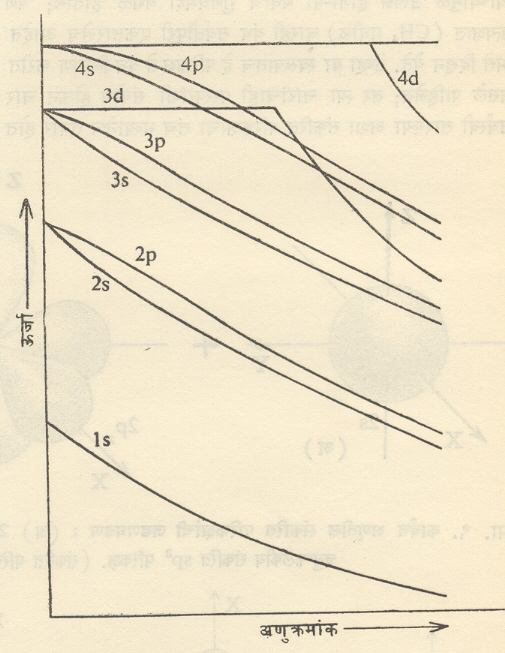
संकरण : अणूच्या रचनेत अनुक्रमे 1s,2p,3s,3p,3dइ. परिकक्षांच्या ऊर्जा वाढत्या श्रेणीमध्ये असतात परंतु बारकाईने पाहिले असता असे दिसते की, 2s 2p त्याचप्रमाणे 3s,3p इ. परिकक्षांमधील ऊर्जेतील फरक फारच कमी आहे (आ. ७).
लायनस पॉलिंग यांनी अशी कल्पना मांडली की, (काही विशिष्ट परिस्थितींत अणूंपासून रेणू बनण्याच्या आधी प्रथम) एकच अणूतील दोन जवळजवळ समान ऊर्जामूल्ये असणारे परिकक्ष एकमेकांत मिसळून त्यांच्यापासून वेगळाच आकार व दिशा असलेले नवीन (आणवीय) परिकक्ष बनतात. या क्रियेला संकरण व अशा तऱ्हेने बनलेल्या परिकक्षांना संकरित परिकक्ष असे म्हणतात. या संकरित परिकक्षांच्या साहाय्याने मग (रेणूमधील) बंध तयार होतात.
प्रत्यक्ष प्रयोगावरून कित्येक रेणूंची त्रिमितीय संरचना व काही गुमधर्म (ऊष्मारासायनिक) चांगल्या तऱ्हेने निश्चित झालेले आहेत. या रेणूंच्या संघटना असे संकरित परिकक्ष आहेत अशी कल्पना स्वीकारल्याशिवाय त्यांच्या संरचनेचे योग्य विवरण करता येत नाही.
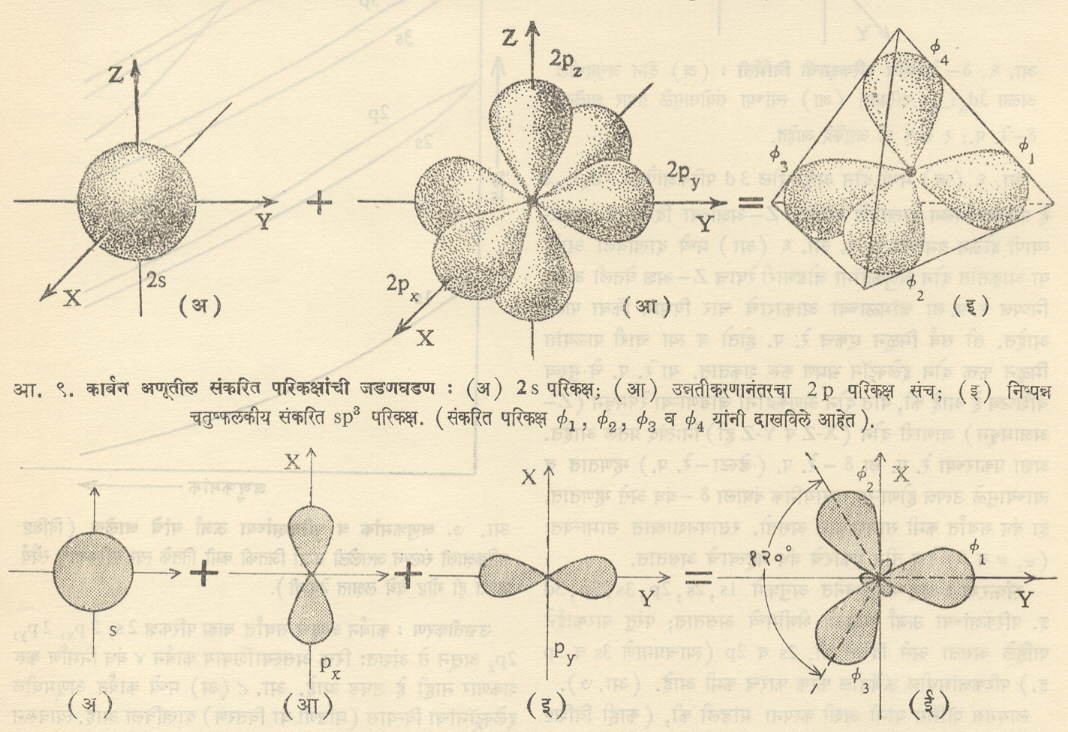
कार्बन अणूतील संकरण : हे स्पष्ट करण्यासाठी आपन मिथेनच्या रेणूचे उदाहरण घेऊ. अनेक प्रयोगांवरून याची संरचना निश्चितपणे माहीत झालेली आहे. या रेणूचा आकार नियमित चतुष्फलकासारखा आहे. या चतुष्फलकाच्या मध्यावर c अणू असून त्याच्या प्रत्येक शिरोबिंदूवर एक एक H अणू आहे. CH मधील हे चारही बंध तंतोतंत एकसारखे आहेत.
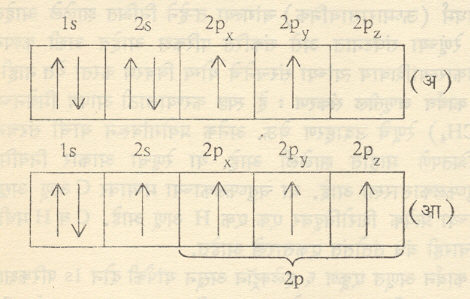
कार्बन अणूत एकूण ६ इलेक्ट्रॉन असून यांपैकी दोन 1sपरिकक्षात दोन 2sपरिकक्षात व दोन 2pपरिकक्षात असतात परंतु 2pपरिकक्षांतर्गत 2px,2py,2pz,असे तीन परिकक्ष आहेत. प्रत्येक परिकक्ष जास्तीत जास्त दोन इलेक्ट्रॉन धारण करू शकतो व अर्धवट भरलेला परिकक्षच रासायनिक बंध निर्माण करू शकतो हेही येथे लक्षात ठेवले पाहीजे.
उन्नतीकरण : कर्बन अणूचे सर्वांत बाह्य परिकक्ष 2s,2px,2py,2pz,असून ते अंशतःरिक्त असल्याशिवाय कार्बन ४ बंध निर्माण करू शकणार नाही हे उघड आहे. आ ८ (अ) मध्ये कार्बन अणूमधील इलेक्ट्रॉनांचा विन्यास (मांडणी वा वितरण)दाखविला आहे. त्यावरून असे लक्षात येईल की, ४ बंध निर्माण करणे शक्य होण्यासाठी 2sपरिकक्षातील एक इलेक्ट्रॉन 2pzया किंचित जास्त ऊर्जेच्या रिक्त परिकक्षात चढवला गेला पाहीजे कमी ऊर्जेच्या परिकक्षामधून इलेक्ट्रॉन जास्त ऊर्जेच्या परिकक्षात चढवला जाण्याच्या या क्रीयेला उन्नतीकरण असे म्हणतात.
अशा तऱ्हेने उन्नतीकरण झाल्यानंतर आपणाला बंध निर्मितीक्षम ४ बाह्य अर्धरिक्त परिकक्ष उपलब्ध झाले, तरी त्यांतील 2sहा परिकक्ष
उरलेल्या तीन परिकक्षांपेक्षा खूपच वेगळ्या स्वरूपाचा आहे. म्हणून त्याच्यामुळे उत्पन्न होणाऱ्या बंधाचे गुणधर्मही वेगळे होतील पण प्रत्यक्षात (मधील) चारही बंध सर्वतोपरी एकसारखेच आहेत असे दिसून येते. तेव्हा या स्वरूपातच हे परिकक्ष ते बंध निर्मान करीत नसले पाहीजे तर त्या चारांचाही परस्परांशी संयोग होऊन चार सर्वस्वी सारख्या अशा संकरित परिकक्षांचा संच नव्यानेच तयार होत
असावा, असे मानणे भाग पडते. आ ९ वरून या संकरित परिकक्षांची कल्पना येईल. कोणत्याही दोन परिकक्षांच्या अक्षांमधील कोन १०९o अंश २८’ आहे. हाच कोन CH4च्या दोन बंधांमध्ये असतो. CH4 मधील एखाद्या H च्या cl,F,Br यासारखे अणू घालून तयार केलेल्या रेणूंमधील बंधांतील कोनांचे मूल्यही जवळजवळ इतकेच (१०९0±२0) असते. यावरून कार्बनाच्या संकरित परिकक्षाच्या कल्पनेला पुष्टी मिळते. हिऱ्यामधील कार्बन अणूच्या स्फटिके रचनेचेही या कल्पनेनुसार बरोबर स्पष्टीकरण मिळते.
S व p परिकक्षांची इतर संकरणे : वरील संकरणात एक s परिकक्ष व तीन p परिकक्ष यांचे संकरण केले म्हणून त्याला sp3 संकरण असे नाव दिले गेले. मूळच्या चार परिकक्षांच्या संकरणाने मिळालेल्या संकरित परिकक्षांची संख्याही चारच होती. याबद्दल सर्वसामान्य नियम खालीलप्रमाणे आहे.
मूळ संकरण होणाऱ्या परिकक्षांची संख्या –निष्पन्न संकरित परिकक्षांची संख्या.
Sp3, खेरीज sp व sp2 अशी संकरणेही काही परिस्थितींत होऊ शकतात व तज्जन्य संकरित परिकक्षांच्या संख्या अनुक्रमे २ व ३ येतात. spसंकरणामुळे उत्पन्न होणारे बंध एकरेषीय असतात. तर sp2चे संकरित परिकक्ष त्रिदलाकार असून त्याची तीनही दले एकाच प्रतलात असतात. आ. १० मध्ये s,px,py या परिकक्षांचे संकरण चित्रित केले आहे. मूळ px,py हे X-Y प्रतलाशी संलग्न असल्याने निष्पन्न त्रिदलाकृती संकरित परीकक्षही X-Y प्रतलातच असतात. व कोणत्याही दोन दलांच्या अक्षांमधील कोन १२०० असतो. कित्येक कार्बनी संयुगांत या प्रकारचे संकरण आढळून येते. उदाहरणासाठी एथिलीन C2H4रेणूच्या संघटनाचे विवरण पुढे दिले आहे.
आ. १०. Sp2(ट्रायगोनल)संकरणाने होणारे त्रिदलाकृती संकरित परिकक्ष : (अ) परिकक्ष (आ) pxपरिकक्ष (इ) pyपरिकक्ष (ई) संकरित sp2परिकक्ष. (संकरित परिकक्ष
ने दर्शविले आहेत.
एथिलीन रेणू: कोणत्याही रेणूचे संघटन निश्चित करताना प्रथम त्याच्याबद्दल प्रयोगावरून उपलब्ध असलेली सर्व माहीती विचारा

घेणे जरूर असते. C2H4रेणूबद्दल पुढील गोष्टी ज्ञात आहे : (अ) या रेणूतील सर्व घटक अणू एकाच प्रतलात आहेत. (आ) C,H अणूंच्या मधील व बंधांच्या तुलनेने दोन C अणूंमधील बंध दुपटीपेक्षा थोडा कमी सामर्थ्यवान आहे. (इ) या रेणूतील एका CH2 गटाच्या संदर्भात दुसऱ्या CH2 गटाने भ्रमाण होऊ शकत नाही.
यांतील (अ) वरून कार्बन अणूमध्ये sp2संकरण होत असण्याची शक्यता दिसते. (आ) व (इ) वरुन असा तर्क करता येतो की, C-C बंधामध्ये बंधाखेरीज काही तरी जादा बंध (उदा., एक जादा बंध) असणे आवश्यक आहे. या दृष्टीने विचार करता असे मानू की, उन्नतीकरणानंतर दोनही C अणूंचे 2pzपरिकक्ष आहेत तसेच राहतात व s+px+py,(sp2) संकरण होऊन प्रत्येक अणूसाठी आ. १० (ई) मध्ये दाखविल्यासारखे दोन त्रिदलाकार संकरित परिकक्ष मिळतात (हे दोन्ही x-yप्रतलातच असतील). रेणूचे प्रतलही x-y
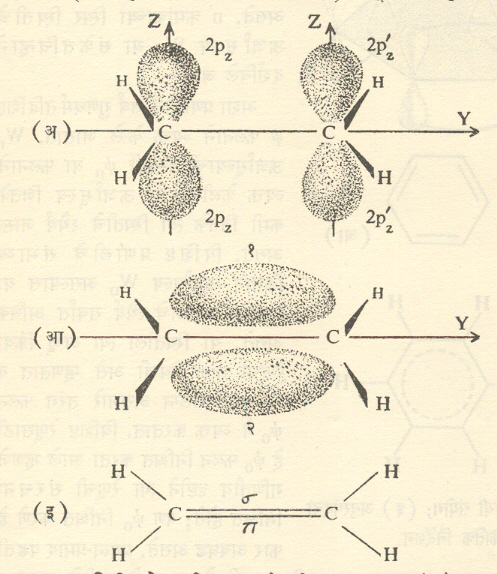
प्रतल घेतले, तर मिळणारा त्या प्रतलातील रेणूचा परिकक्षीय सांगाडा आ. ११ मध्ये दाखविला आहे. दोनही c अणूंचे परिकक्ष अंशतः परस्परव्यापी होऊन त्यांच्यामध्ये एक बंध तयार होतो. त्याचप्रमाणे प्रत्येक c अणूच्या बरोबर एक एक H अणूच्या s परिकक्षाचा संयोग होऊन तेथेही बंध तयार होतात. परंतु दोन्ही c अणूंवरील 2pz परिकक्ष ( हे आ. ११ च्या प्रतलात लंब असल्याने तेथे दाखविलेले नाहीत) अद्याप बंध निर्मान करण्यासाठी वापरलेले नाहीत दोन c अणू परस्परांना पुरेसे जवळ आल्यास त्यांचे 2pz परिकक्ष बाजूने परस्परव्यापी होऊन एक बंध तयार होईल (आ. ५ पहा). अशा तऱ्हने दोन कार्बन अणूंमध्ये (पूर्वीच निर्माण झालेला ) एक बंध व ( आता नव्याने तयार झालेला) एक बंध असे दोन बंध (द्विबंध) तयार होतील. आ १२ मध्ये बंध कसा तयार होतो ते दाखविण्यासाठी y-z प्रतलातील आकृत्या दिल्या आहेत.
वरील वर्णनावरून रेणूंची रचना ओढून ताणून कशी तरी जमविली आहे असा ग्रह होण्याचा संभव आहे, परंतु तो बरोबर नाही. आकृत्यांच्या साहाय्याने वरील दोन उदाहरणांत जे संकरण इ. प्रकार केले तेच त्या त्या परिकक्षांची फलने घेऊन त्यांची संयुक्त फलने बनवून करता येतात. यासाठी वेगवेगळ्या प्रकारे त्या फलनांचे संयोग करून त्यांपैकी कोण्त्या प्रकारचा संयोग प्रत्यक्ष प्रायोगिक मूल्यांशी जास्तीतजास्त सुसंगत होतो ते पहावे लागते. काही संयोग या कसोटीला उतरत नाहीत, मग ते त्याज्य ठरतात आणि मग दुसरे वेगळ्या तऱ्हेचे संयोग पारखले लागतात. अशा तऱ्हेनेच या शास्त्राची वाटचाल होत आली आहे.
इतर संकरणे : वर s,वpप्रकारच्या परिकक्षांची संकरणे उल्लेखिली आहेत. रसायनशास्त्रत d परिकक्षकांची s,p परिकक्षांबरोबर झालेली काही संकरणे अनेकदा उपयोगी पडतात. ती म्हणजे dsp2, dsp3, d2sp3 संकरणे होत. P परिकक्षांप्रमाणेच d परिकक्षांनाही अवकाशात विवक्षित दिशा असतात. त्यामुळे त्यांच्या संकरणामुळे निर्माण होणाऱ्या संकरित परिकक्षांनाही निश्चित दिशा प्राप्त होतात. त्रिमितीय रसायनशास्त्रात याचा उपयोग होतो. संकरणोत्पन्न परिकक्ष परस्परांना अपकर्षित करतात. या अपकर्षणाच्या तीव्रतेनुसार या परिकक्षांमुळे उत्पन्न होणाऱ्या बंधांमधील कोन बदलतात.
अनिर्णित स्थानीय किंवा अनुस्पंदन बंध : आतापर्यंत विवरण केलेल्या बंधांची स्थाने निश्चित होती, म्हणजेच कोणत्या तरी निश्चित दोन अणूंमध्ये ह बंध तयार झालेले होते. पण कित्येकदा अशी परिस्थिती असते की, विशिष्ट बंधाचे स्थान निश्चितपणे अमूक दोन अणूंमध्ये आहे असा निर्णय करताच येत नाही. अशा बंधाला अनिर्णित स्थानिय बंध किंवा अनुस्पंद बंध असे म्हणतात.
या बंधाची कल्पना स्पष्ट करण्यासाठी बेंझीन (C6H6)रेणूचे उदाहरण घेऊ. प्रयोगावरून या रेणूबद्दल पुढील माहिती निश्चितपणे मिळालेली आहे : (१) या रेणूतील सर्व अणू एकाच प्रतलाल बद्ध झालेले आहेत. (२) या रणूतील सहा अणूंमधील बंधांचा मिळून एक समभुज षट्कोन होतो. (३) यातील सर्व कार्बन अणूंचे (त्याचप्रमाणे हायड्रोजन अणूंचेही) गुणधर्म अगदी एकसारखे आहेत. यावरुन यापैकी कोणत्याही दोन c अणूंना जोडणारे बंध सर्वत्र एकसारखेच असले पाहिजेत हे उघड होते.
या रेणूच्या एक प्रतलीय मांडणीवरून (वर केलेल्या ch4च्या विश्लेषणाप्रमाणेच येथेही )प्रत्येक cअणूमध्ये sp२,संकरणे सूचित केली जातात. यामुळे उत्पन्न झालेल्या (या ) संकरित परिकक्षांचे प्रत्येकी एक h अणूबरोबर व आपल्या शेजारच्या C अणूबरोबर X-Y प्रतलात बंध होत असले पाहीजेत, असा तर्क करता येतो. अशा रीतीने C6H6 चा तयार झालेला सांगाडा आ. १३ (आ) मध्ये दाखविला आहे.
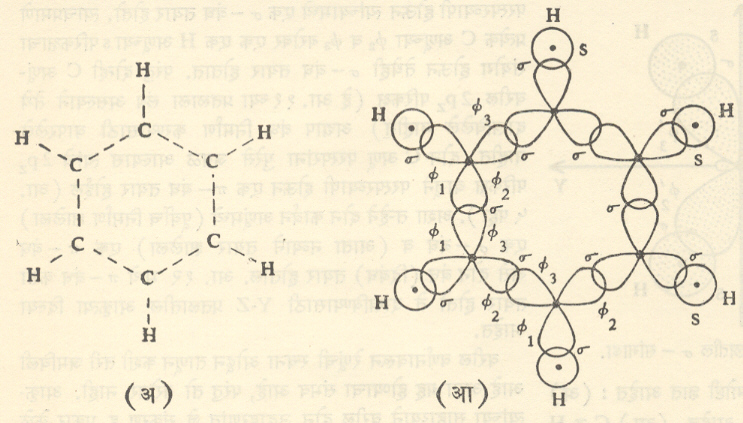
आता प्रत्येक c अणूचा pzपरिकक्ष (जो वरील आकृतीला लंब अाहे ) वापरावयाचा राहिला आहे. लगतच्या c अणूंच्या जोड्यांच्या परिकक्षांच्या परस्परव्यापनाने निर्माण होऊ शकणारे बंधांचेदोन पर्याय आ. १४ (अ) व (आ) मध्ये दाखविले आहेत. त्यानुसार कार्बन अणूमध्ये उत्पन्न होणारे एकेरी बंध आणि दुहेरी बंध (द्विबंध) त्या त्या आकृतीखाली दाखविले आहेत. प्रत्यक्षात या बंधांना
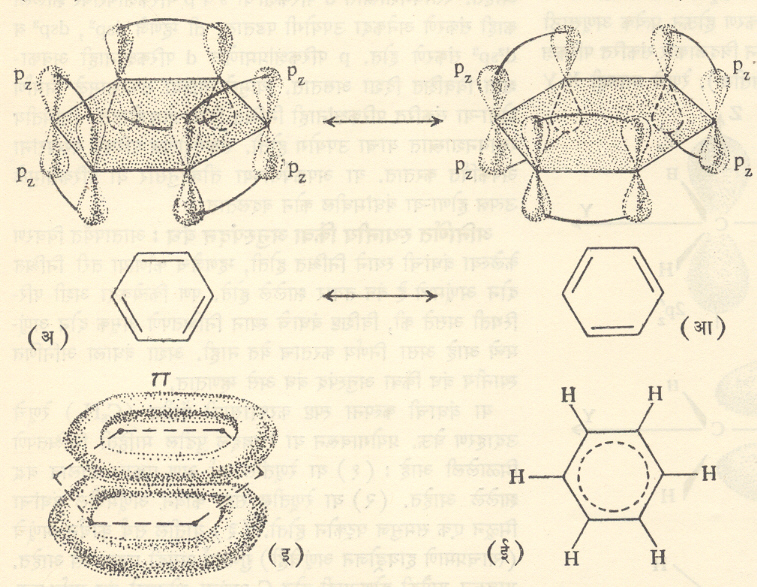
कारणीभूत होणारे सहा इलेक्ट्रॉन आ. १४ (इ) मध्ये दाखविलेल्या वलयाकृती इलेक्ट्रॉन मेघात भ्रमण करतात. ही रचना दाखविण्याची सांकेतीक पद्धत आ. १४ (ई) मध्ये चित्रित केली आहे. pzपरिकक्षांच्या परस्परव्यापनाने तयार होणारे बंध निश्चित कोणत्या दोन c अणूंना जोडतात ते सांगता येत नसल्याने या बंधाला अनिर्णित स्थान बंध हे नाव दिले गेले .
एकाच कंप्रतेचे (एका सेकंदात होणाऱ्या कंपनांची संख्या सारखीच असलेले) दोन कंपनशूल (नादकाटे समजा अ व आ) एकाच पेटीवर उभारून त्यातला अ आंदोलित केला, तर हळूहळू आ दोलायमान होत जाऊन त्याची आंदोलने जास्त जास्त जोरदार होत जातात. त्याचबरोबर अ च्या आंदोलनांची तीव्रता कमी होत जाऊन शेवटी त्याची आंदोलन थांबतात. अशा तऱ्हेने अ ची आंदोलन-ऊर्जा पूर्णपणे आ ला संक्रमित होते. याप्रमाणे या दोन कंपनशूलांत ऊर्जेची देवघेव चालू असते. या आविष्काराला ध्वनिशास्त्रात ⇨ अनुस्पंदन असे म्हणतात.
बेंझीन रेणूची संरचना आ. १४ (अ) व (आ) मध्ये दाखविलेल्या दोन पर्यायांत जणू काही उलटसुलट बदलत असते. अशा भूमिकेतून या बंधाला अनुस्पंद बंध ही संज्ञा देण्यात आली.
पुंजयामिकीय अनुस्पंदन : आतापर्यंत रेणूच्या संघटनाचे पुंजयामिकीय विवेचन केवळ आकृत्यांच्या साहाय्याने केले. त्याची गणितीय पाश्वभूमी फार खोलात न जाता थोडक्यात खाली दिली आहे. कोणताही अणू किंवा रेणू म्हणजे ⇨मुलकणांची विशिष्ट प्रणाली असते. अणु-रेणूंना काही निश्चित अशा स्थिर पुंज स्थिती असतात. यांपैकी प्रत्येक स्थितीचे काही विशिष्ट ऊर्जामूल्य असते. n क्रमांकाच्या स्थिर स्थितीचे ऊर्जामूल्य Wn या संकेतचिन्हांने दर्शविले जाते.
अशा प्रणालीचे सर्व गुणधर्म तद्विशिष्ट फलनाने व्यक्त केले जातात. Wn ऊर्जामूल्याची स्थिती या फलनाने व्यक्त केली जाते. ऊर्जामूल्य जितके कमी तितके त्या स्थितीचे स्थैर्य जास्त असते. विशिष्ट प्रणालीचे संभाव्य किमान ऊर्जामूल्य WO असल्यास या स्थितीत प्रणालीचे स्थैर्य सर्वांत अधिक असते. या स्थितीला त्या अणू कींवा रेणूची तळ स्थिती असे म्हणतात व तिच्याशी संलग्न असणारे तरंग फलन ने व्यक्त करतात. विशिष्ट रेणुसाठी हे फलन निश्चित करता आले म्हणजे गणितीय दृष्टीने त्या रेणूची संरचना निश्चित होते पण निश्चित करणे हे फार अवघड असते. प्रयत्न-प्रमाद पद्धती वापरून (एखाद्या फलनाची चाचणी घेऊन व ते चुकीचे ठरल्यास दुसरे वापरून व अशाच प्रकारे निरनिराळ्या फलने वापरून) आपण आसन्नपणे अजमावू शकतो.
समजा की, ही दोन फलने प्रणालीच्या दोन संभाव्य पर्यायी स्थिती दर्शवितात. यांना अनुक्रमे a व b या गुणकांनी गुणून त्यांची बेरीज केली असता मिळणारे फलने हे पुंजयामिकीतील सिद्धांतानुसार
त्या स्थितीचे दर्शक असे जास्त सार्वत्रिक फलन होते येथे a,b,हे स्वेच्छ गुणक असून त्यांची मूल्य आपण हवी तशी बदलू शकतो. त्यामुळे येथे a व b यांच्या स्वतंत्र मूल्यांना काहीच महत्त्व नाही पण त्यांचे गुणोत्तर b/a हे मात्र महत्त्वाचे आहे. कारण या गुणोत्तराचे मूल्य बदलले की, ( ) यांचे सापेक्ष वाटे बदलतात म्हणून चे स्वरूप बदलते.
गणिताने या शी सुसंगत असे ऊर्जामूल्य w हे (b/a) च्या फलनाच्या स्वरूपात व्यक्त करता येते. मग गणितावरूनच (b/a) च्या कोणत्या मूल्यांसाठी w चे मूल्य किमान होईल ते काढतात. हे विशिष्ट मूल्य (b/a)minवरील समी. (१) मध्ये घातले असता त्यावरून मिळणारे हे इष्ट चे जास्तीत जास्त अचूक असे आसन्न मूल्य होय.
समजा, जरूर त्या ((b/a)min चे मूल्य फार कमी आहे (म्हणजेच तर त्याचा अर्थ असा की, मध्ये चा वाटा फारच थोडा आहे व चे स्वरूप जवळजवळ सारखे आहे. याचा उलट परिस्थिती असताना होईल. परंतु( a/b)min चे मूल्य १ च्या जवळपास असेल, तर मात्र मध्ये यांचे वाटे जवळजवळ समान असतात. अशा परिस्थितीत त्या प्रणालीमध्ये व यांनी व्यक्त होणाऱ्या संरचनांमध्ये अनुस्पंदन होत आहे असे म्हणतात.
अनुस्पंदन ऊर्जा : तथापि वरील विधानाचा अर्थ असा नव्हे की, ने व्यक्त हाणारी संरचना ही व ने व्यक्त होणाऱ्या संरचनांचे मिश्रण आहे किंवा त्या दोहोंच्या दरम्यानची अशी एखादी स्थिती आहे. व यांच्याशी संलग्न ऊर्जामूल्ये अनुक्रमे W1,W2 असतील, तर असे सिद्ध करता येते की शी संलग्न ऊर्जामूल्य (Wm) हे W1 किंवा W2 या दोघांपेक्षाही कमी असते. म्हणजेच या संरचनेला जादा स्थैर्य प्राप्त होते. (W1,W2) यांपैकी जे मूल्य कमी असेल ते समजा W1, वजा W1 म्हणजे (W1- Wm) या वजाबाकीला ‘अणूस्पंदने ऊर्जा’ असे म्हणतात. अनुस्पंदन ऊर्जा जितकी जास्त तितके त्या संरचनेचे स्थैर्य जास्त हे उघ़ड आहे.
वरील वितरणात व या फलनांची निवड करण्याला कोणतेच नियम नसल्याने ही निवड स्वेच्छ किंवा अंदाज-अनुमान पद्धतीने केली आहे, पण याला दुसरा पर्याय नाही. त्याचप्रमाणे समी. (1) मधील हे फक्त व या दोनच फलनांच्या संयोगाने बनविले आहेत. परंतुु हा संयोग पुरेसा उपयुक्त वाटला नाही, तर हे तीन कींवा अधिक स्वेच्छ फलनांच्या संयोगाने बनवावे लागे. म्हणून सामान्यपणे,
असे म्हणता येईल.
पुंज रासायनिक अभ्यास पध्दती : आतापर्यंत आपन या पद्धतीचे केवळ आकृत्यांच्या साहाय्याने विवरण केले. तिची सैद्धांतिक बैठक काय आहे, हे थोडक्यात खाली दिले आहे. आकृतीय पद्धतीत आपण सुयोग्य असे आणवीय परिकक्ष निवडले व त्यांच्या परस्परांशी होणाऱ्या संयोगावरून तयार होणारे रेणवीय परिकक्ष काढले. याऐवजी आता प्रथम सुयोग्य अशा आणवीय तरंग फलनांची निवड केली जाईल. या फलनांचे वेगवेगळ्या तऱ्हेने संयोग करून मिळणारे फलन हे रेणवीय परिकक्ष दिग्दर्शित करील. त्यांच्यावरून त्या रासायनिक बंधाबद्दल काही उपयुक्त निष्कर्ष मिळू शकतील.
तरंग फलनाची निवड : या कार्यातला पहिला टप्पा म्हणजे इष्ट बंधाला अनुरूप अशा तरंग फलनाची निवड करणे. (अ) रेणूच्या गुणधर्मांबद्दल प्रयोगावरून पूर्वीच ज्ञात असलेली माहीती, (आ) पूर्वानुभव व (इ) बऱ्याच प्रमाणात अंतःप्रज्ञा यांच्यावर विसंबूनच ही निवड करणे अपरिहार्य आहे. कारण यासाठी कोणतेच शास्त्रशुद्ध असे नियम अद्याप सापडलेले नाहीत.
चाचणी फलन : निवडलेल्या (आणवीय) तरंग फलनांचे संयोग करून एक नवीनच फलन मिळते. हे फलन संपूर्ण रेणूला लागू पडेल असे गृहीत धरण्यात येते परंतु तसे ते लागू पडतेच असे नाही. म्हणून या फलनाला चाचणी असे म्हणतात.
कोणत्याही प्रणालीला स्थैर्य प्राप्त होण्यासाठी त्या प्रणालीचे ऊर्जामूल्य किमान असले पाहिजे हा निसर्गाचा सार्वत्रिक नीयम आहे. तेव्हा फलनात येणाऱ्या प्रचलांची (विशीष्ट परिस्थितीत निरनिराळी मूल्ये देता येणाऱ्या स्थिर राशींची मूल्ये व चे एकूण स्वरूप असे घेतात की, शी संलग्न ऊर्जामूल्य किमान होईल.
प्रयोगावरून त्या रेणूची विगमन (रेणूचे तात्पुरते वा पुन्हा जोडले जाऊ शकणारे लहान साध्या रेणूत वा अणूंत तुकडे पडण्याच्या क्रीयेची ) ऊर्जा, आयनीकरण (विद्युत् भारित अणू, रेणू वा अणुगटात रूपांतर होण्याची ) ऊर्जा, रेणूच्या घटक अणूंमधील अंतरे, बंधांची सामर्थे इ. माहीत असतात. आपण सिद्ध केलेल्या फलनावरून याच राशींची मूल्ये काढून ती त्या त्या राशींच्या मुल्यांशी कितपत जुळतात ते पहातात. जुळत नसतील, तर मग त्या दृष्टिने फलनात वेगवेगळ्या परिणामांचा किंवा आणवीय तरंग फलनांचा अतर्भाव करून क्रमाक्रमानेच्या जास्त जास्त सुधारित आवृत्ती काढतात. प्रत्येक वेळी वर उल्लेखलेल्या राशींची वरून मिळणारी व प्रायोगिक मूल्ये यांत कीतपत तफावत येते ते पाहतात. शेवटी ही तफावत अत्यंत थोडी राहीली म्हणजे त्यावेळचे फलन हे त्या रेणुप्रणालीचे (आसन्न) दिग्दर्शन करते असे मानतात.
हायड्रोजन रेणू : हायड्रोजन (H2) हा सर्वांत सोप्या संरचनेचा रेणू आहे. वरील पद्धतीनुसार त्याची संरचना कशी निश्चित केली गेली त्यांचे थोडक्यात विवरण खाली केले आहे. प्रयोगावरून असे निश्चित झाले आहे की, या रेणूतील दोन प्रोटॉनांमधील अंतर ०·७४ A (१ A=१०-१०मी)असून त्याची विगमन ऊर्जा ४·७२ eV=१०२·६ किकॅ. प्रती मोल आहे (येथे eV–इलेक्ट्रॉन व्होल्ट, १ eV= १· ६०२०३× अर्ग, कीकॅ किलोकॅलरी मोल- ग्रॅममध्ये मोजलेला रेणूभार). सर्वसामान्य परिस्थितीत हायड्रोजन अणूमधील इलेक्ट्रॉनाचे तरंग फलन 1s दर्शविले जाते. H2 रेणूतील दोन H अणूंची अणुकेंद्रे अनुक्रमे HA , HB आणि त्यांच्याशी सलग्न इलेक्ट्रॉन अनुक्रमे (१) व (२) ने दर्शवू, मग हायड्रोजन रेणूसाठी प्रथम हे चाचणी फलन घेता येईल. या फलनात प्रत्येक इलेक्ट्रॉन त्या त्या (मूळ) अणूकेंद्राशी संलग्न राहतो असे मानले आहे. या शी संलग्न ऊर्जामूल्य काढल्यास (HA व HB यांमधील अंतर rab हे कितीही असले तरी) ते ऊर्जामूल्य धन चिन्ह (+) युक्त राहते. म्हणजेच दोन हायड्रोजन अणूंमध्ये आकर्षण [यासाठी ऊर्जामूल्य ऋण चिन्ह (-) युक्त हवे] होऊन रेणू बनण्याची शक्यताच दीसत नाही. तेव्हा हे चाचणी फलन निरुपयोगी म्हणून सोडून दिले पाहिजे व दुसरे एखादे चाचणी फलन निवडले पाहिजे.
याकरिता प्रथम असे मानू की, दोन अणूंमधील इलेक्ट्रॉनांची एकमेकांत अदलाबदल होते, परंतु ते 1sपरिकक्षातच राहतात. या कल्पनेनुसार पुढील दोन पर्यायी चाचणी फलने सुचतात.
आणि
(येथे k1 व k2 हे बरेच जटिल गुणक असून त्यांचा तपशील येथे दिलेला नाही)
या दोन चाचणी फलनांनुसार मिळणाऱ्या H2 प्रणालीच्या ऊर्जाची मुल्ये Ha व Hb यांमधील अंतराच्या (rab च्या ) वेगवेगळ्या

मूल्यांसाठी कशी बदलतात ते आ.१५ मध्ये आलेखांनी व्यक्त केले असून तूलनेसाठी प्रायोगिक ऊर्जा मूल्यांचाही आलेख (इ) दाखविला आहे.
ऊर्जा जितकी जास्त ऋण मूल्याची असेल तितके त्या प्रणालीला जास्त स्थैर्य प्राप्त होते. यावरून व आ.१५ पाहता हे लक्षात येईल की, या फलनाचे दर्शविलेल्या संरचनेत स्थैर्य प्रायोगिक मूल्यापेक्षा काहीसे कमी (सु. २०% कमी ) असले, तरी त्यायोगे या दोन अणूमध्ये बंध तयार होऊ शकेल.
हे फलन त्या दोन इलेक्ट्रॉनांंचे परिवलन परस्परांना विरुद्ध दिशेने आहे असे दर्शविते. त्याचप्रमाणे त्याच्यावरून दोन इलेक्ट्रॉन एकमेकांना निकट असण्याची जास्त संभाव्यता व्यक्त होते. या फलनावरून दोन अणूकेंद्रामधील अंतर ०·८० व रेणूंची विगमन ऊर्जा ३·१४ म्हणजे प्रायोगिक मूल्याचा सु. ८०% येते. म्हणजे ही संरचना साधारणपणे समाधानकारक आहे असे म्हणता येते.
सुधारणा : वरील संरचनेमध्ये पुढीलप्रमाणे सुधारणा सुचवून वरील राशींची मुल्ये प्रायोगिक मूल्यांशी जुळणारी अशी आणविण्यात यश आले आहे.
(अ (अ) आयन कल्पना : या कल्पनेनुसार H2 रेणू काही प्रमाणात H वआयनांचा (म्हणजेच एका H अणूवरील इलेक्ट्रॉन पूर्णपणे निघून जाऊन तो दुसऱ्या H अणूला चिकटला आहे) बनला आहे, असे मानतात. या दोन आयनांमधील (विद्युत् स्थितिकीय) आकर्षणामुळे H२ रेणूंची बंधन ऊर्जा ५ टक्क्यांनी वाढते. म्हणून H२ बंध अंशतः होत असतात.
(आ) अणुकेंद्रावरील परिणामी विद्युत् भार ऐवजी सु. इतका असावा.
(इ) काही प्रमाणात H अणूमधील इलेक्ट्रॉन l s या तळ स्थितीच्या परिकक्षाएवजी २s ,2p यांसारख्या उच्च-ऊर्जेच्या परिकक्षांत संक्रमित होत असावेत.
या कल्पनांनुसार फलनांत फरक केल्यास H2 च्या प्रायोगिक मूल्याशी तंतोतंत जुळणारे असे H2 चे ‘चित्र’ तयार करता येते.
वरील सोप्या उदाहरणावरून रेणूंच्या संरचनेचा अभ्यास पुंजयामिकीय पद्धतीने कसा केला जातो त्याची सर्वसाधारण कल्पना येईल. पदार्थांचे प्रकाश शोषण, वर्ण व इतर प्रकाशीय गुणधर्म यांच्या स्पष्टीकरणासाठीही पुंज रसायनशास्त्रीय पद्धती विकसित करण्यात आलेल्या आहेत.
पहा : पुंजयामिकी रासायनिक संरचना संयुजा.
संदर्भ : 1. Brackenridge, J. B. Rosnenberg, R. M. The Principles of Physics and Chemistry, New York, 1970.
2. Companion, A. L. Chemical Bonding, New York, 1964.
3. Pauling, L. The Nature of Chemical Bond, New Delhi, 1967.
4. Pauling, L. Wilson, E. B. Introduction to Quantum Mechanics, with Application to Chemistry, New York, 1935.
पुरोहित, वा. ल.
“