पायरोक्सीन गट : खनिजांच्या गटाचे नाव. संरचना, भौतिक गुणधर्म व रासायनिक संघटन या सर्व बाबतींत या गटाच्या
खनिजांत बरेच साम्य आढळते. मात्र ती सामान्यतः एकनताक्ष व समचतुर्भुची या दोन स्फटिक समूहांची असतात. या गटातील सर्व जातींमध्ये प्रचिन (110) हा एक महत्त्वाचा आकार असतो. त्यांच्या
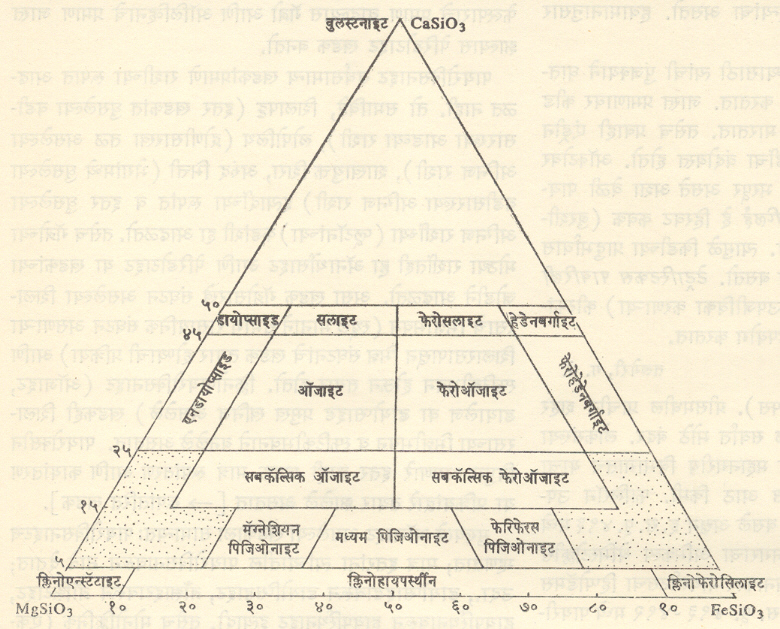
प्रचिनांच्या पृष्ठांमधील कोन ८७ ते ९३ अंशांचा म्हणजे जवळजवळ काटकोन असतो [→स्फटिकविज्ञान]. या (110) पृष्ठांना समांतर असे उत्कृष्ट => पाटन असते व (100) व (001) यांना समांतर विभाजनतले असतात. समचतुर्भुजी पायरोक्सिनांचे रासायनिक संघटन मुख्यत्वेकरून MgSiO3 – FeSiO3या मालेचे असते. एकनताक्ष गटाची बरीचशी खनिजे सामान्यपणे CaMgSi2O6, CaFeSi2O6, MgSiO3व FeSiO3 या चार घटकांच्या समूहांची असतात. त्यांची नावे व वर्गीकरण आ. २ मध्ये दर्शविली आहेत.
संघटन : पायरोक्सिनांचे रासायनिक संघटन (W,X,Y)2Z2O6 या सामान्य सूत्राने दर्शविता येते. W,X,Yव Z ही समान आणवीय त्रिज्या असणारी व एकमेकांऐवजी प्रतिष्ठापना होऊ शकणारी मूलद्रव्ये असतात. पायरोक्सिनात ही मूलद्रव्ये पुढीलप्रमाणे असतात : W= Ca, Na X=Mg, Fe2+, Mn2+, Li Y=Al, Fe3+, Ti आणि Z=Si, Al. शिवाय पायरोक्सिनाच्या (W,X,Y)2 Z2 O6 या सूत्रात W- अणूंचे प्रमाण १ किंवा ० असते. X- गटातील अणूंपैकी मँगॅनीज हे जोहान्सनाइट (CaMnSi2O6) या खनिजाव्यतिरिक्त इतर खनिजांत सामान्यतः अगदी कमी प्रमाणात असते. लिथियम फक्त स्पॉड्युमिनामध्ये (LiAlSi2O6) महत्त्वाचे घटक असते. सर्वसामान्यपणे आढळण्यार्या पायरोक्सीनात लोह व मॅग्नेशियम यांचेच अणू असतात. Y- गटामध्ये टिटॅनियम अगदी कमी प्रमाणात व ॲल्यूमिनियम किंवा फेरिक लोह यांच्या जागी आलेले असते.
Z म्हणजे सामान्यतः सिलिकॉन असते, पण त्याची अंशतः ॲल्युमिनियमाने Si: Al हे गुणोत्तर ३: १ होईल, या मर्यादेपर्यंत प्रतिष्ठापना झालेली असते.
खडक बनविणारी सर्वसामान्य पायरोक्सिने ही MgSiO3 – FeSiO3- CaSiO3 या त्रि-अंगी समूहाच्या प्रावस्था (ठराविक दाब व तापमानास तयार झालेली आणि हे तिन्ही घटक विशिष्ट प्रमाणात असलेली खनिजे) असतात. त्यांत CaSiO3 ५० टक्क्यांपेक्षा कमी असते.
समचतुर्भुजी पायरोक्सिने : => एन्स्टॅटाइट (MgSiO3), => हायपर्स्थीन (१३ टक्क्यांहून FeO अधिक असणारे) (Mg, Fe)- SiO3 ही सर्वसामान्य , तर ब्राँझाइट (५ तो १३ टक्के FeO असलेले) (Mg, Fe)- SiO3 व फेरोसलाइट FeSiO3 ही कमी प्रमाणात व क्वचित आढळणारी होत.
एकनताक्ष पायरोक्सिने : क्लिनोएन्स्टॅटाइट (MgSiO3), क्लिनोहायपर्स्थीन (Mg, Fe)SiO3, डायोप्साइड CaMg(Si2O6), हेडेनबर्गाइट CaFe(Si2O6) ही एकनताक्ष पायरोक्सिने असून => ऑजाइट (X, Y) Z2O6 हे डायोप्साइड आणि हेडेनबर्गाइट यांमधील असते व यात काही प्रमाणात ॲल्युमिनियम असते. पिजिओनाइट हे क्लिनोएन्स्टॅटाइट व ऑजाइट यांच्यामधील असते. शिवाय स्पॉड्युमीन LiAl (Si2O6), जेडाइट NaAl(Si2O6), एगिरीन NaFe (Si2O6), जोहान्सनाइट CaMn (Si2O6) ही एकनताक्ष पायरोक्सिने आहेत.
संरचना : पायरोक्सिने ही शृंखलामय सिलिकेटे (आयनो-सिलिकेटे) असतात. यांच्यात सिलिकेचा चतुष्फलक SiO4 हा प्रमुख एकक असतो. शेजारी शेजारी असणार्या सिलिकेच्या चतुष्फलकांतील ऑक्सिजनाचे अणू समाईक रीतीने जोडले जाऊन त्यांच्या शृंखला तयार होतात
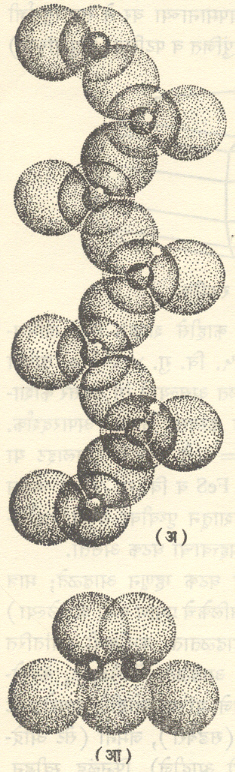
(आ. ३). शृंखलेमध्ये प्रत्येक चतुष्फलकातील चार ऑक्सिजन अणूंपैकी दोन अणू शेजारी शेजारी असणार्या दोन चतुष्फलकांत समाईक असतात. यामुळे त्यांच्या शृंखलांत सिलिकॉन व ऑक्सिजन यांचे गुणोत्तर १:३ असते व त्यांचे सामान्य सूत्र M1M2 (Si2O6) असे असते. प्रत्येक शृंखला एका म्हणजे c- अक्षाच्या [→स्फटिकविज्ञान] दिशेत अमर्याद वाढलेली असते.
शृंखलेच्या दिशेत दोन समान एककांतील अंतर सु. ५.३ Å (Å = अँगस्ट्राँम एकक = १०–८ सेंमी.) इतके असते. हीच एकक घटाची c- दिशेतील लांबी असते. या शृंखला एकमेकींना समांतर असतात व आडव्या दिशेत M1 आणिM2 या ऋणायनांच्या (विद्युत् भारित अणू, रेणू वा अणुगट म्हणजे आयन ऋणायनांच्या म्हणजे विद्युत् ऋणाग्राकडे जाणार्या धन भारित आयनांच्या) साहाय्याने आयनी (दोन आयनांतील इलेक्ट्रॉनांच्या देवघेवीमुळे बनलेल्या) बंधांनी बांधलेल्या असतात. M1 ऋणायनमोठे व दुर्बल विद्युत् भार असलेले सामान्यतः कॅल्शियम व सोडियम हे असतात व ते भोवतालच्या ऑक्सिजनांबरोबर आठाच्या सहसंयोजनाने बांधले गेलेले असतात. M2 ऋणायन सापेक्षतः लहान आकारमानाचे, मॅग्नेशियम, फेरस किंवा फेरिक लोह, ॲल्युमिनियम, द्वि-किंवा त्रि-संयुजी मँगॅनीज किंवा लिथियम किंवा चतुर्संयुजी टिटॅनियम यांचे ऋणायन असतात (संयुजा हा इतर मूलद्रव्यांच्या अणूशी संयोग पावण्याची क्षमता दर्शविणारा आकडा असतो) व ते ऑक्सिजनाशी सहासहाच्या सहसंयोजनाने जोडलेले असतात. कमी किंवा अधिक भार असणारे ऋणायन संरचनेत असल्यास विद्युत् भार समतोल करण्यासाठी त्याच वेळी चतुष्फलकीय जागांत सिलिकॉनाच्या जागी ॲल्युमिनियमाची स्थापना होते. M1 व M2 ही स्थाने मोठ्या व लहान आकारमानांच्या मिश्र आयनांनी व्यापलेली असल्यास एकनताक्ष समूहाची व फक्त लहान आयनांनी व्यापलेली असल्याससमचतुर्भुजी पायरोक्सिने तयार होतात. तसेच M1 आणिM2 या स्थानांवर मोठे आयन असल्यास रोडोनाइट (MnSiO3) आणि वुलस्टनाइट (CaSiO3) यांसारखी त्रिनताक्ष खनिजे (पायरोक्सिनॉइडे) तयार होतात.
CaMgSi2O6 – CaFeSi2O6 – MgSiO3 – FeSiO3 या रासायनिक संघटनांची पायरोक्सिने दोन संरचनात्मक गटांत विभागता येतात. एका गटाचे रासायनिक संघटन डायोप्साइड- हेडेनबर्गाइट (CaMgSi2O6 – CaFeSi2O6) यांमध्ये असते व यांमध्ये २५ टक्के मोल (Mg, Fe) SiO3 असते (मोल म्हणजे ग्रॅममध्ये मोजलेला रेणुभार). यांची सममिती एकनताक्ष असते. या गटातील सर्व खनिजे संरचनात्मक दृष्ट्या डायोप्साइडासारखी असतात. दुसऱ्या गटातील खनिजांचे रासायनिक संघटन MgSiO3 – FeSiO3 यांच्यामधील असते व त्यात जास्तीत जास्त १५ टक्के मोल CaSiO3 असते. या गटामध्ये ज्यांत सु. ३० टक्क्यांपेक्षा जास्त FeSiO3 असते, ती खनिजे उच्च तापमानास एकनताक्ष (पिजिओनाइट) व खालच्या तापमानास समचतुर्भुजी असतात. मॅग्नेशियमाचे प्रमाण अधिक असणारी म्हणजे ३० टक्क्यांहून कमी FeSiO3 असणारी या गटातील खनिजे तीन बहुरूपांत आढळतात, ती म्हणजे एन्स्टॅटाइट, प्रोटाएन्स्टॅटाइट (दोन्ही समचतुर्भुजी) आणि क्लिनोएन्स्टॅटाइट (एकनताक्ष) ही होत. यांपैकी समचतुर्भुजी बहुरूपेच खडकांत आढळतात. इतर सर्व पायरोक्सिनांत क्लिनोपायरोक्सिनातल्याप्रमाणे संरचना असते.
आ. ३. SiO3 ची शृंखला (अ) आणि तिचा आडवा छेद (आ). डायोप्साइडात SiO3 च्या शृंखला आडव्या दिशेत Ca व Mg आयनांनी जोडलेल्या असतात. Mg चे आयन ऑक्सिजनाशी सहांच्या सहसंयोजनाने जोडलेले असतात व ते फक्त एकाच सिलिकॉनाशी जोडलेले असतात. मोठ्या आकारमानाचे Ca आयन ऑक्सिजनांशी आठांच्या सहसंयोजनाने जोडलेले असतात. यांपैकी दोन ऑक्सिजन शेजारच्या शृंखलांमध्ये समाईक असतात. Mg अणू (आयन) SiO4 चतुष्फलकाच्या प्रामुख्याने वरच्या बाजूला, तर Ca अणू प्रामुख्याने त्यांच्या पायांच्या पातळीत असतात. क्लिनोएन्स्टॅटाइटातील संरचना डायोप्साइडातल्याप्रमाणेच असते पण क्लिनोएन्स्टॅटाइटात आडव्या दिशेतील सर्व जागा Mg ने व्यापलेल्या असतात. एन्स्टॅटाइट व इतर समचतुर्भुजी पायरोक्सिनांत शेजारच्या (SiO3) शृंखला आडव्या दिशेत Mg किंवा (Mg, Fe) या दोन्ही अणुंनी जोडलेल्या असतात. ही स्थाने डायोप्साइडातील Mg व Ca शी तुल्य अशी असतात परंतु Mg व Fe या दोहोंचे आयन Ca च्या आयनांपेक्षा लहान आकारमानाचे असल्यामुळे समचतुर्भुजी संरचना निर्माण होते. पिजिओनाइटाची संरचना डायोप्साइडातल्यासारखी असते, मात्र पिजिओनाइटात M2 स्थाने पूर्ण भरण्याइतके Ca आयन नसतात व त्यांपैकी उरलेली स्थाने Mg ऐवजी Fe ने व्यापलेली असतात. M1 स्थाने मध्यम ते मोठ्या आकारमानाच्या एकसंयुजी क्षार धातूंच्या (लिथियम, सोडियम, पोटॅशियम इ.) आयनांनी आणि M2 स्थाने लहान त्रिसंयुजी ऋणायनांनी व्यापलेली असल्यास स्पॉड्युमीन मालेची खनिजे- स्पॉड्युमीन, जेडाइट, एगिरीन इ. तयार होतात.
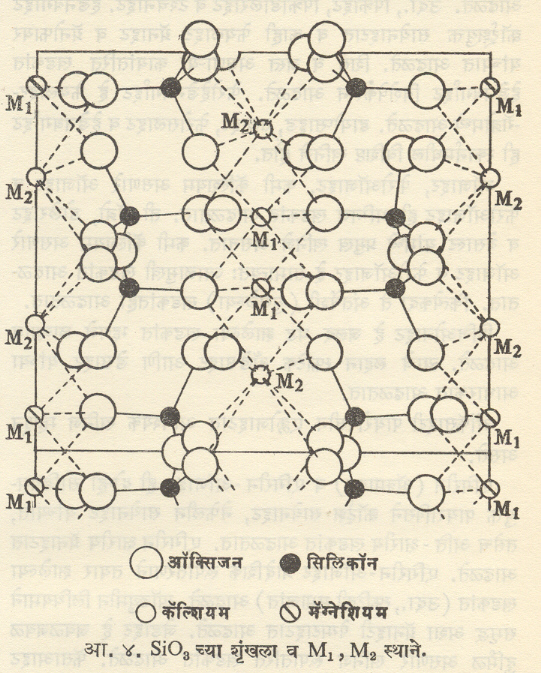
आ. ₹४. SiO3 च्या शृंखला व M1 , M2स्थाने बरीचशी समचतुर्भुजी पायरोक्सिने त्यांच्या विशिष्ट अशा गुलाबी ते हिरव्या रंगाच्या => नैकषर्णतेमुळे ओळखता येतात. एकनताक्ष पायरोक्सिनांच्या मानाने त्यांचे द्विप्रणमन कमी असते व ती सरळ दिशेत विलोपित होतात. [→ खनिजविज्ञान स्फटिकविज्ञान].
आढळ व उत्पत्ती : अग्निज खडकांच्या निर्मितीच्या प्रक्रियेत शिलारस निवून थंड होत असताना सुरुवातीला उच्च तापमानास अँफिबोलांच्या अगोदर पायरोक्सिने स्फटिकीभूत होतात. मॅग्नेशियमने समृद्ध असणारी समचतुर्भुजीपायरोक्सिने अत्यल्पसिकत (सिलिकेचे प्रमाण अतिशय कमी असणार्या) खडकांत (उदा., पायरोक्सिनाइट, हार्झबर्गाइट, लेर्झोलाइट व पिक्राइट) विशेषेकरून आढळतात. अधिक लोहयुक्त समचतुर्भुजी पायरोक्सिने काही अग्निज खडकांत उदा., काही डोलेराइट व ग्रॅनाइट यांत क्वचित आढळतात. समचतुर्भुजी पायरोक्सिन (हायपर्स्थीन) नोराइटात प्रमुख खनिज असते. चार्नोकाइट खडकात ते नेहमी व विशेष महत्त्वाचे म्हणून तर ग्रॅन्युलाइटात वैशिष्ट्यपूर्ण असते. मध्यम दर्जाचे औष्णिक रूपांतरण घडून आलेल्या मृत्तिकामय खडकांतही ते आढळते.
डायोप्साइड – हेडेनबर्गाइट या मालेची खनिजे विविध प्रकारच्या रूपांतरित खडकांत आढळतात. डायोप्साइड काही पिक्राइट व बेसाल्ट यांत आढळते. सलाइट क्षारीय बेसाल्टी शिलारसापासून तयार झालेल्या उपपातालीय (भूगर्भात मध्यम खोलीवर तयार झालेल्या) खडकांत आढळते. उदा., पिक्राइट, पिक्रोडोलेराइट व टेश्चेनाइट. हेडेनबर्गाइट क्वॉर्ट्झयुक्त सायेनाइटात व काही फेयलाइट ग्रॅनाइट व ग्रॅनोफायर यांच्यात आढळते. शिसे व जस्त असणार्या कायांतरित खडकांत हेडेनबर्गाइट विशेषेकरून आढळते. फेरोहेडेनबर्गाइट हे फेयलाइटग्रॅब्रोमध्ये आढळते. डायोप्साइड, सलाइट, फेरोसलाइट व हेडेनबर्गाइट ही स्कार्नमधील विशिष्ट खनिजे होत.
ऑजाइट, फेरोऑजाइट, कमी कॅल्शियम असणारे ऑजाइट व फेरोऑजाइट ही अग्निज खडकांत आढळतात. ती गॅब्रो, डोलेराइट व बेसाल्ट यांमध्ये प्रमुख खनिजे असतात. कमी कॅल्शियम असणारे ऑजाइट व फेरोऑजाइट हे सामान्यतः ज्वालामुखी खडकांत आढळतात. कित्येकदा ते अंतर्वेशी (घुसलेल्या) खडकांतही आढळतात.
पिजिओनाइट हे जलद थंड झालेल्या खडकांत म्हणजे लाव्ह्यात आढळते. त्याचे लहान स्फटिक अँडेसाइट आणि डेसाइट यांच्या आधारकात आढळतात.
ओंफॅसाइटी पायरोक्सीन एक्लोजाइटात आवश्यक खनिज म्हणून असते.
एगिरीन (ॲक्माइट) व एगिरीन – ऑजाइट ही दोन्ही सोडियमयुक्त पायरोक्सिने क्वॉर्ट्झ सायेनाइट, नेफेलीन सायेनाइट यांच्यात, तसेच अति – क्षारीय खडकांत आढळतात. एगिरीन – ऑजाइट प्रादेशिक रूपांतरणाने तयार झालेल्या खडकांत (उदा., स्फटिकी सुभाजांत) आढळते. स्पॉड्युमीन लिथियमाने समृद्ध अशा ग्रॅनाइटी पेग्मटाइटात आढळते. जेडाइट हे जवळजवळ दुर्मिळ असणारे खनिज रूपांतरित खडकांत आढळते. फॅसाआइट ॲल्युमिनियमयुक्त आणि थोडेसे सोडियम असलेले पायरोक्सीन चुनखडकांत आढळते.
वुलस्टनाइट अशुद्ध चुनखडकांचे रूपांतरण होताना तयार होते. संस्पर्शी रूपांतरण झालेल्या गाळातही ते आढळते. सिलिकायुक्त डोलोमाइटांचे रूपांतरण होत असतानाही ते तयार होते.
CaCO3 + SiO2 → CaSiO3 + CO2
वुलस्टनाइट क्षारीय अग्निज खडकांतही उदा., स्वीडनमधील आल्नन येथील जटिल खडक केन्यातील इयोलाइट व काही फोनोलाइट यांच्यात आढळते.
बहुतेक पायरोक्सिने खडकांतील इतर खनिजांसारखी घटक खनिजे आहेत. ती खडकांत विखुरलेली असतात. पायरोक्सिनाइटासारख्या काही थोड्या खडकांव्यतिरिक्त त्यांच्या एकत्र झालेल्या राशी क्वचितच आढळतात. बहुतेक पायरोक्सिनांचा कसलाही महत्त्वाचा औद्योगिक उपयोग होत नाही. मात्र काही पायरोक्सिनांचे पुढीलप्रमाणे विशिष्ट उपयोग आहेत. जेडाइट, स्पॉड्युमीनाचे कुन्साइट व हिडेनाइट हे प्रकार, तसेच डायोप्साइडाचे पारदर्शक प्रकार इ. रत्ने व उपरत्ने म्हणून वापरतात. स्पॉड्युमीनांचा लिथियमाची संयुगं तयार करण्यासाठी व मृत्तिका उद्योगांत उपयोग होतो. इमारती कामासाठी रोडोनाइट व वुलस्टनाइट यांच्या शोभिवंत फरशा वापरतात.
संदर्भ : 1. Berry, L. G. Mason, B. Mineralogy, Tokyo, 1960. 2. Deer, W. A. Howie, R. A. Zussaman, J. An Introduction to the Rock Forming Minerals, London, 1967. 3. Hurlbut, C. S., Ed. Dana’s Manual of Mineralogy, New York, 1969. 4. Wahlstrom, E. E. Petrographic Mineralogy, New York, 1960.
आगस्ते, र. पां.
“