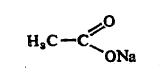
कार्बनी धातु संयुगे : (किंवा धातु -कार्बनी संयुगे). ज्या संयुगांमध्ये कार्बनी गट किंवा मूलके (विक्रियांमध्ये तसेच राहणारे पण सामान्यतः वेगळे अस्तित्व नसणारे अणूंचे गट) यांत कार्बनाचे अणू धातूंच्या अणूला प्रत्यक्ष जोडलेले असतात, त्या संयुगांना कार्बनी धातू संयुगे असे म्हणतात. उदा., C2H5-Zn-C2H5 डायएथिल झिंक, CH3MgBr मिथिल मॅग्नेशियम ब्रोमाइड इ. ज्या संयुगांना कार्बनी गट व धातूंचे अणू असूनही कार्बनी गटातील कार्बन अणू व धातूंचे अणू यांच्या प्रत्यक्ष बंधांपासून कार्बनी गट दुसऱ्या एखाद्या अणूमार्फत धातूच्या अणूला जोडलेला असतो, अशा संयुगांचा समावेश या वर्गात करीत नाहीत. उदा., धातूंची कार्बोनेटे, कार्बनी -धातू अमाइन जटिले, कार्बनी अम्लांची धातवीय लवणे. सोडियम ॲसिटेट [CH3COONa] किंवा सोडियम बेंझोएट[C6H5COONa] या धातवीय लवणात धातूचा अणू (सोडियम) कार्बनी गटाला ऑक्सिजन अणूमुळे जोडला गेलेला आहे. सोडियम ॲसिटेटची संरचना खालीलप्रमाणे दाखविता येईल.
प्राण्यांच्या रक्तातील हीमोग्लोबीन (रक्तातील तांबड्या पेशींतील लोयहुक्त रंगद्रव्य) व वनस्पतीतील हरित द्रव्य (हिरवे रंगद्रव्य, क्लोरोफिल) अशी काही कार्बनी-धातू संयुगेच फक्त निसर्गात आढळतात. बाकीची सर्व संयुगे संश्लेषित (कृत्रिम रीतीने बनविलेली) आहेत. कार्बनी-धातू संयुगे ह्या शब्दातील धातूची व्याख्या योग्य रीतीने करणे आवश्यक आहे. रासायनिक दृष्ट्या धातूची व्याख्या पुढीलप्रमाणे करता येईल : रासायनिक विक्रियेत जी मूलद्रव्ये स्वतःजवळील संयुजी (अणू परस्परांशी संयोग पावताना विनिमय होण्याची क्षमता असलेले) इलेक्ट्रॉन दुसऱ्यास देतात अशा मूलद्रव्यांना धातू असे म्हणतात. सर्व धातूंची विद्युत् ऋणता (संयुजी इलेक्ट्रॉनला आकर्षित करून धरून ठेवण्याची व ऋण विद्युत् भार वाढविण्याची प्रवृत्ती) साधारणपणे १·८ पेक्षा कमी असते. कार्बनी-धातू संयुगांच्या व्याख्येचे काटेकोरपणे पालन केले, तर ज्या मूलद्रव्यांची विद्युत् ऋणता १·८ पेक्षा कमी आहे अशांचीच कार्बनी संयुगे कार्बनी-धातू संयुगे ह्या वर्गामध्ये समाविष्ट करता येईल परंतु ज्या मूलद्रव्यांची विद्युत् ऋणता १·८ व २·० यांमध्ये आहे व जी कार्बनी गटांबरोबर आयनी बंधाने (दोन विद्युत् भारित रेणूंमध्ये वा अणूंमध्ये इलेक्ट्रॉनांच्या अदलाबदलीमुळे तयार झालेल्या बंधाने) बद्ध न होता सहसंयुजी बंधाने (दोन अणूंमध्ये इलेक्ट्रॉनांची एक जोडी समाईक असल्यामुळे तयार होणाऱ्या बंधाने) बद्ध होतात, अशा मूलद्रव्यांच्या कार्बनी संयुगांचे बरेचसे गुणधर्म कार्बनी-धातू संयुगासारखेच असल्यामुळे त्यांच्या कार्बनी संयुगांचा समावेश कार्बनी धातू संयुगे ह्या वर्गामध्येच करण्याची प्रथा आहे. उदा., सिलिकॉन, आर्सेनिक, अँटिमनी ह्या धातुसदृश मूलद्रव्यांची कार्बनी संयुगे.
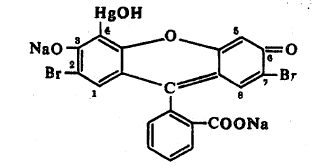
कार्बनी -धातू संयुगांचा उपयोग विविध क्षेत्रांत केला जातो. कित्येक कार्बनी-धातू संयुगे औषधे म्हणून वापरतात. उदा., पूतिरोधी (पू होण्यास विरोध करणारे) म्हणून प्रसिद्ध असलेले मर्क्युरोक्रोम किंवा मरब्रोमीन (C20H8O5Br2HgNa2O6) हे एक कार्बनी मर्क्युरी संयुग आहे. त्याचे रासायनिक नाव २, ७ –डायसोडियम ब्रामो –४ हायड्रॉक्सिमर्क्युरी ल्युओरोसीन असून या संयुगाची संरचना खालीलप्रमाणे आहे.
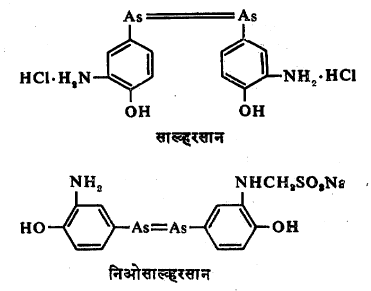
तसेच टिंक्चर ऑफ मरथायोलेट हे पूतिरोधी औषधदेखील एक कार्बनी-मर्क्युरी संयुग असून त्याचे रासायनिक नाव सोडियम एथिलमर्क्युरी थायोसॅलिसिलेट असे आहे. साल्व्हरसान (किंवा अरस्फिनामीन) व निओसारूल्व्हरसान (किंवा निओअरस्फिनामीन) ही संयुगेही औषधे म्हणून फार उपयोगी आहेत. ही दोन्ही संयुगे कार्बनी-आर्सेनिक संयुगे आहेत. ही दोन्ही औषधे गरमीच्या (उपदंशाच्या) रोगावर उपाय म्हणून वापरतात. त्यांची संरचना खालीलप्रमाणे आहे.
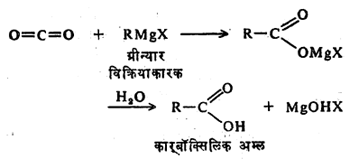
रसायनशास्त्रामध्ये कार्बनी-धातू संयुगांचा विविध कार्बनी संयुगांच्या संष्लेषणामध्ये (कृत्रिम पद्धतीने तयार करण्यामध्ये) फार उपयोग होतो. उदा., ग्रीन्यार विक्रियाकारक (ग्रीन्यार यांनी शोधून काढलेले विक्रिया घडवून आणणारे संयुग) या नावाचे मॅग्नेशियम असलेले कार्बनी-धातू संयुग. यांच्या उपयोगाने कार्बनी संयुगात ज्या जागी हायड्रॉक्सील (OH) गट आहे त्या जागी अल्किल किंवा अरिल गट जोडता येतात. जसे,

ह्या विक्रियेत प्राथमिक अल्कोहॉल वापरल्यास सरळ शृंखला असलेली हायड्रोकार्बने मिळतात. पण द्वितीयक किंवा तृतीयक अल्कोहॉल वापरले, तर सशाख हायड्रोकार्बन शृंखला मिळविता येतील.
ग्रीन्यार विक्रियाकारकाचा उपयोग करून सजातीय मालेतील कनिष्ठ अनुजातांपासून (मूळ संयुगांपासून तयार केलेल्या इतर संयुगांपासून) वरिष्ठ अनुजात मिळविता येतील. उदा., मिथिल मॅग्नेशिअम ब्रोमाइडाबरोबर मिथिल ब्रोमाइडची विक्रिया करून एथेन हा त्या सजातीय मालेतील वरिष्ठ अनुजात मिळविता येईल.
![]()
ग्रीन्यार विक्रियाकारकाचा उपयोग करून प्राथमिक व द्वितीयक अल्कोहॉले मिळविता येतील. त्यासाठी आल्डिहाइड, ग्रीन्यार विक्रियाकारक आणि हायड्रोक्लोरिक अम्ल किंवा यांची विक्रिया करतात. आल्डिहाइडाऐवजी त्याच विक्रियाकारकांची कीटोनांवर विक्रिया केल्यास तृतीयक अल्कोहॉले मिळतात.
उपयोग : कार्बनी-धातू संयुगांच्या विभागाचा विस्तार झपाट्याने होण्याचे कारण निरनिराळ्या औद्योगिक क्षेत्रांत त्यांचे होणारे उपयोग हे आहे. ॲल्युमिनिअम, लिथिअम, मॅग्नेशियम, पारा आणि कोबाल्ट यांची कार्बने संयुगे मोठ्या प्रमाणावर बनविली जात आहेत. कार्बनी-धातू संयुगांचा निरनिराळ्या विक्रियांत आणि बहुवारिकीकरण (अनेक रेणू एकत्र येऊन मोठ्या रेणूभाराचा रेणू बनविण्याच्या) प्रक्रियांत उत्प्रेरक (विक्रियेत भाग न घेता विक्रियेची गती वाढविणारा पदार्थ) किंवा प्रवर्तक (उत्प्रेरकाची क्रियाशीलता वाढविणारा पदार्थ) म्हणून उपयोग करतात. उदा., हायड्रोकार्बनपासून अल्कोहॉल बनविण्याच्या ऑक्सो प्रक्रियांत लोह, निकेल व कोबाल्ट यांची कार्बोनिले नामक संयुगे उत्प्रेरक म्हणून वापरतात. तसेच ओलेफिनाच्या बहुवारिकीकरणासाठी कार्बनी-ॲल्युमिलिअम संयुगे उत्प्रेरक म्हणून वापरतात. ॲसिटीलिनाच्या संघनन विक्रियेत (कार्बन अणू जोडले जाणाऱ्या विक्रियेत) कॉपर ॲसिटीलाइड आणि काही कार्बनी-धातू जटिले यांचा उत्प्रेरक म्हणून उपयोग होतो. माँड प्रक्रिया नामक निकेल शुद्धीकरण प्रक्रियेत निकेलाचे रूपांतर निकेल कार्बोनिल Ni(CO)4 ह्या कार्बनी-धातू संयुगात करतात. हे संयुग बाष्पनशील (उडून जाणारे) असल्यामुळे निकेलामधील अशुद्धी अवशेष म्हणून राहते व शुद्धी निकेलाचे निकेल कार्बोनिल बनून त्याचे शुद्धीकरण होते [àकार्बोनिले].
कित्येक कार्बनी-धातू संयुगांत सूक्ष्मजीवनाशक आणि कवकनाशक(हरितद्रव्यरहित बुरशीसारख्या वनस्पतींचा म्हणजे कवकांचा नाश करण्याचा) गुण आहेत. ह्यामुळे अशी कार्बनी-धातू संयुगे चोळलेल्या बियांची पेरणी केल्यास येणारी रोपे जास्त जोमदार व सतेज असतात. इस्पितळात येणाऱ्या वेगवेगळ्या प्रकारच्या रोग्यांमुळे इतर रोग्यांना संसर्गाने त्या रोगाची बाधा होऊ नये म्हणून इस्पितळात वापरण्यात येणाऱ्या सतरंज्या, चादरी व उशा ह्यांची निर्मिती अवस्थेतच काही संसर्गनाशक कार्बनी-कथिल संयुगांबरोबर क्रिया केलेली असते. त्यामुळे अशा वस्तू धुतल्या तरी त्यांचा हा गुण जात नाही.
अंतर्ज्वलन एंजिनामध्ये (ज्यातील इंधन त्यातील सिलिंडरातच चाळले जाते अशा एंजिनामध्ये) वापरावयाच्या पेट्रोलमध्ये मिसळलेले सर्व आघातरोधी (इंधन मिश्रणाचा विस्फोट होऊन धातूच्या ठोक्यासारखा आघात निर्माण होण्यास रोध करणारे) पदार्थ हे कार्बनी-धातू संयुगेच असतात. उदा., टेट्राएथिल लेड, अंतर्ज्वलन एंजिनामध्ये होणारे आघात हे पेट्रोलमधील हायड्रोकार्बन व ऑक्सिजन ह्यांच्या ठराविक दाबाला होणाऱ्या शृंखला विक्रियांमुळे होतात. आघातरोधी पदार्थ ह्या शृंखला योग्य ठिकाणी तोडतो व त्यामुळे विस्फोट न होता एंजिन सुरळीत चालते. अलीकडे आघातरोधी म्हणून कार्बनी मँगॅनीज संयुगे वापरण्याचा प्रयत्न होत आहे.
कार्बनी-धातू संयुगावर सिलिकोन संयुगांचा संपूर्ण धंदा उभारलेला आहे. उदा., सिलिकोन बहुवारिके किंवा सिलिकोन तेले ही कार्बनी धातू संयुगेच आहेत. कार्बनी सिलिकॉन संयुगांच्या उपयोगाची कक्षा फार वेगाने वाढत आहे व नेहमीच्या कार्बनी संयुगांना उपयोगाच्या बाबतीत ही संयुगे फार झपाट्याने मागे टाकीत आहे. उदा., सिलिकोन बहुवारिकांपेक्षा ऑक्सिडीकरणास [àऑक्सिडीभवन]जास्त विरोध करतात, तर सिलिकोन तेले ही हायड्रोकार्बनी तेलांपेक्षा आपले भौतिक गुणधर्म तापमानात बराच फरक पडला तरीही टिकवून धरतात. सिलिकोन रबर सूत्ररूपाने [(CH3)2 SiO]x असे लिहिता येईल. म्हणजेच सिलिकोन रबर हे डायमिथिल सिलऑक्सेन ह्या एकवारिकांचे बहुवारिक आहे. ह्या रबराचे वैशिष्ट्य असे की, ते -८०० से. तापमानापर्यंत आपले स्थितीस्थापकत्व राखते. त्यामुळे जास्त उंचीवरून उड्डाण करणाऱ्या विमानातील व अतिथंड प्रदेशातील विजेच्या निरोधनासाठी याचा उपयोग करतात. तसेच जास्त उंचीवरून उड्डाण करणाऱ्या विमानातील यंत्राचे काही भाग (उदा., गॅस्केट) ह्या रबरापासूनच बनविलेले असतात. तसेच सिलिकोन तेलांची श्यानता (दाटपणा) तापमानातील फरकांमुळे फारशी बदलत नसल्यामुळे ह्या तेलांचा वंगणे म्हणून उपयोग करतात.
वर दिलेली उदाहरणे कार्बनी-धातू संयुगांच्या नानाविध उपयोगांपैकी काहींची आहेत. यांशिवाय कार्बनी धातू संयुगांचा उपयोग प्लॅस्टिक, रंग, सिमेंट, इंधने, स्फोटक पदार्थ ह्या व अशा विविध क्षेत्रांत होतो. कार्बनी-धातू संयुगाच्या क्षेत्रात नवनवीन उपयोगांच्या दृष्टीने बरेच संशोधनही होत आहे.
नामकरण :या संयुगांच्या नामकरणामध्ये प्रथम कार्बनी मूलकाचे नाव व त्यानंतर धातूचा उल्लेख करावा असा संकेत आहे. मूलकांची संख्या एकापेक्षा जास्त असेल तर डाय-,ट्राय-इ. उपसर्ग नावाला लावले जातात. उदा., C2H5–Zn–C2H5याचे नाव डायएथिल झिंक तर(CH3)3–Al ह्याचे नाव ट्रायमिथिल ॲल्युमिनियम असे आहे.
ज्यासंयुगात धातूच्या अणूला कार्बनी गटांशिवाय क्लोरीन,ब्रोमीन इ. अन्य अणू जोडलेले असतात त्यावेळी त्यांचे अस्तित्व पुढीलप्रमाणे दर्शवितात.CH3MgBrयाचे नाव मिथिल मॅग्नेशियम ब्रोमाइड,तर C6H5HgClयाचे नाव फिनिल मर्क्युरिक क्लोराइड आहे.
कार्बनी गटांची संख्या व त्या गटात जर प्रतिष्ठापि (एक अणू वा अणुगट काढून तेथे बसविलेले) अणू असतील, तर त्यांचा उल्लेख स्थानांसह कार्बनी गटांच्या नावातच केला जातो. उदा.,
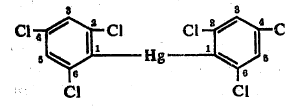
या संयुगाचे नाव डाय (२,४,६ ट्रायक्लोरो फिनिल) मर्क्युरी असे होते.
ज्यासंयुगांमध्ये ऑक्सिडीकरणाचा टप्पा दाखविणे आवश्यक असते तेथे तो रोमन आकड्यांनी दर्शवितात. उदा.,(CH3)3Sn (IV) Br, C6H5Hg (II) Clह्या संयुगांमध्ये कथिल आणि पारा या धातूंच्या ऑक्सिडीकरणाचे टप्पे अनुक्रमे ४ व २ आहेत.
इतिहास :रॉबर्ट बन्सन यांना १८४९ च्या सुमारास मुक्त मूलके (ज्यांच्यामध्ये काही संयुजे इलेक्ट्रॉन मुक्त आहेत, म्हणजे जे बंध निर्माण करण्यात भाग घेत नाहीत,अशी संयुगे) बनविण्याच्या प्रयत्नात(CH3)2–As–As–(CH3)2हे आर्सेनिकाचे कार्बनी संयुग मिळाले. त्याच सुमारास फ्रँकलंड यांनीही असेच प्रयत्न चालविले असताना त्यांनाC2H5–Zn–C2H5हे जस्ताचे कार्बनी संयुग मिळाले, अशी काही संयुगे बाष्पनशील आहेत असे दिसून आल्यावर नवीन सापडलेल्या धातूंच्या संयुजा व अणूभार ठरविण्याच्या कामी शास्त्रज्ञांना त्यांचा फार उपयोग झाला. उदा., (C2H5)4Geह्या संयुगांचा उपयोग करून जर्मेनियाची संयुजा आणि अणूभार ठरविला. अलीकडे बरीच नवीन कार्बनी-धातू संयुगे बनविली जात आहेत व त्यांचे गुणधर्म अभ्यासले जात आहेत.
(१)पहिल्या विभागात आवर्त सारणीतील (मूलद्रव्यांच्या विशिष्ट पद्धतीने केलेल्या कोष्टकरूप मांडणीतील) पहिल्या व दुसऱ्या गटांतील धातूंच्या उदा.,सोडियम,पोटॅशियम इ. च्या कार्बनी संयुगांचा समावेश केलेला आहे. हे धातू कार्बनी गटांना आयनी बंधाने जोडलेले असतात. ह्या आयनी बंधांमुळे येणारे गुणधर्म दाखवितात. उदा.,कार्बनी विद्रावकांत (विरघळविणाऱ्या पदार्थात) ही संयुगे विरघळत नाहीत व ती बाष्पनशील नसतात.
(२)आवर्त सारणीतील तिसऱ्या,चौथ्या,पाचव्या,आणि सहाव्या गटांतील धातू कार्बनी गटांशी मुख्यतः सहसंयुजी बंधांनी बद्ध असतात. ह्या संयुगांचे गुणधर्म सहसंयुजी बंधांनी तयार झालेल्या संयुगांसारखे असतात. उदा.,ही संयुगे कार्बनी विद्रावकात विरघळतात.
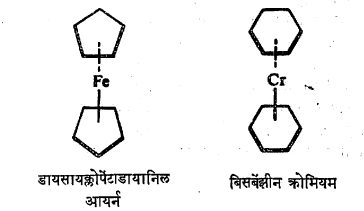
वरील संरचनेत दाखविलेले वलय आणि लोहाचे किंवा क्रोमियमाचे अणू यांतील बंध आयनी नसतात किंवा वलयातील प्रत्येक कार्बन अणू धातूच्या अणूला सहसंयुजी बंधाने जोडलेले नसतात. अशा संयुगात सबंध वलय अस्थानीकृत अशा रासायनिक बंधांनी धातूच्या अणूला जोडलेले असते.अशा प्रकारच्या बंधात वलयातील π-इलेक्ट्रॉन भाग घेतात.
ज्या कार्बनी-धातू संयुगांमध्ये धातूंचे अणू हे कार्बनी गटांना आणि त्याच वेळी इतर अणूंना (उदा.,क्लोरीन, ब्रोमीन,आयोडीन) किंवा कार्बनेतर मूलकांना (उदा.,हायड्रॉक्साइड,बायसल्फेट इ.) जोडलेले असतात, अशा संयुगांना मिश्र कार्बनी-धातू संयुगे अशी संज्ञा आहे. त्यांची वर्गवारी त्यांमधील धातूच्या आवर्त सारणीतील स्थानानुरूप म्हणजे कार्बनी गटाबरोबर तयार होणाऱ्या बंधानुसार त्या त्या विभागात करण्यात येते.
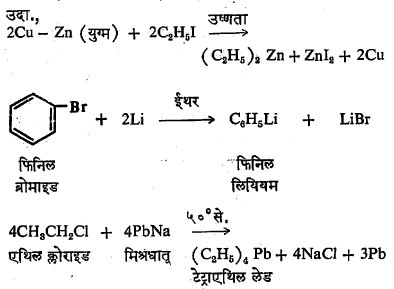
(१)सरल संश्लेषण :१९०१ साली ग्रीन्यार यांनी मॅग्नेशियम वापरून काही कार्बनी मॅग्नेशियम संयुगे तयार केली. त्या संयुगांना ग्रीन्यार विक्रियाकारक असे म्हणतात. ग्रीन्यार विक्रियाकारकाचे सर्वसाधारण सूत्र RMgX असे लिहितात. या सूत्रात R–हा कोणताही अल्किल किंवा अरिल गट दर्शवितो आणि X हा कोणताही हॅलोजन दर्शवितो. ग्रीन्यार विक्रियाकारक तयार करताना मॅग्नेशियम धातूचे तुकडे आणि अल्किल किंवा अरिल हॅलाइड यांची डायएथिल ईथरामधील विद्रावात विक्रिया करतात. सर्वसाधारण विक्रिया पुढीलप्रमाणे दाखविता येईल.

ह्या विक्रियेत डायएथिल ईथर हा उत्प्रेरकाचे कार्य करतो,असे आढळून आले आहे. तसेच विक्रियेचा वेग, इच्छित संयुगाचा उतारा आणि विक्रिया सुरू होण्याची सुलभता ह्या गोष्टी वापरण्यात येणाऱ्या अल्किल किंवा अरिल हॅलाइडच्या प्रकारावर म्हणजे क्लोराइड,ब्रोमाइड की आयोडाइड वापरले आहे यावर अवलंबून असतात. या तीनही प्रकारांपैकी जर ब्रोमाइड विक्रियेत वापरले तर विक्रिया सुरू होण्याची सुलभता,विक्रियेचा वेग आणि संयुगांचा उतारा यांमध्ये सुवर्णमध्य गाठला जातो.
संरचनेच्या वैशिष्ट्यांमुळे हायड्रोकार्बनमधील काही हायड्रोजन अणू हे जास्त क्रियाशील असतात व त्यांची क्रियाशीलता हॅलाइड संयुगातील हॅलोजनाएवढी असते. हायड्रोकार्बनमधील अशा ‘क्रियाशील’ हायड्रोजनामुळे ती संयुगे सरळ संश्लेषणात भाग घेतात व भाग घेणारी धातू जर जास्त विद्युत् घनतेची (संयुजी इलेक्ट्रॉन निघून जाण्याची व घन विद्युत् भार वाढविण्याची प्रवृत्ती असलेली) असेल,तर त्या धातूचे कार्बनी संयुग ह्या पद्धतीने बनविले जाते. उदा.,लोह,किंवा तांबे व सायक्लोपेंटाइन(C5H6)यांतील विक्रिया :
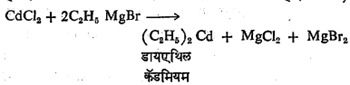
(२)प्रतिष्ठापन विक्रिया : या विक्रियांत ग्रीन्यार विक्रियाकारकाचा सरळ संश्लेषण पद्धतीने तयार करण्यात येणाऱ्या इतर धातूंच्या कार्बनी संयुगांचा मुख्य विक्रियाकारक म्हणून उपयोग करतात. मुख्य विक्रियाकारकातील धातूचे दुसऱ्या धातूने प्रतिष्ठापन करून प्रतिष्ठापन करणाऱ्या धातूचे कार्बनी संयुग मिळवितात. उदा.,

ह्या विक्रिया करताना पुढील गोष्ट लक्षात घ्यावयास हवी. जर मुख्य विक्रियाकारकातील धातूपेक्षा विक्रियेत वापरण्यात येणारी दुसरी धातू जास्त विद्युत् घनतेची असेल,तर मात्र त्या धातूचे हॅलाइड वापरून प्रतिष्ठापन विक्रिया करता येणार नाही. उदा.,फिनील मॅग्नेशियम ब्रोमाइड व सोडियम ब्रोमाइड यांची विक्रिया करून फिनिल सोडियम हे सोडियमाचे कार्बनी संयुग मिळविता येणार नाही. कारण ह्यात सोडियमाची विद्युत् घनता मॅग्नेशियम धातूपेक्षा जास्त आहे. ह्या कारणामुळेच डायफिनील झिंक किंवा डायफिनील मर्क्युरी आणि सोडियम हॅलाइड ह्यांत प्रतिष्ठापन विक्रिया करून फिनिल सोडियम हे संयुग बनविता येणार नाही. मात्र या प्रकारच्या विक्रियेत जर सोडियम हॅलाइडऐवजी सोडीयम धातू वापरली, तर प्रतिष्ठापन विक्रिया वर दाखविल्याप्रमाणे होऊन सोडियमाचे कार्बनी संयुग मिळेल. ह्या गोष्टी लक्षात घेऊन एक सर्वसाधारण निष्कर्ष निघतो तो असा की, मुख्य विक्रियाकारकातील धातू जर विक्रियेत भाग घेणाऱ्या दुसऱ्या धातूंपेक्षा जास्त विद्युत् घनतेची असेल तर भाग घेणाऱ्या दुसऱ्या धातूचे हॅलाइड वापरले तरी तो प्रतिष्ठापन विक्रिया शक्य होईल. जसे,
परंतु जर मुख्य विक्रियाकारकातील धातूची विद्युत् घनता विक्रियेत भाग घेणाऱ्या दुसऱ्या धातूच्या विद्युत् घनतेपेक्षा कमी असेल,तर भाग घेणारी दुसरी धातू ही तिच्या हॅलाइडच्या स्वरूपात न वापरता धातूच्या स्वरूपात वापरली तरच प्रतिष्ठापन विक्रिया शक्य होईल, उदा.,
![]()
(३)समावेशक विक्रिया :(दोन किंवा जास्त पदार्थ एकत्र येऊन नवीन पदार्थ तयार होण्याची विक्रिया). या पद्धतीत धातूंची विक्रियाशील संयुगे, (उदा.,धातूंची हायड्राइडे) आणि अतृप्त हायड्रोकार्बने ह्यांच्यात विक्रिया करतात. उदा., बोरॉन हायड्राइडB2H6व एथिलीन ह्यांच्यात १०००से. ला विक्रिया करून ट्रायएथिल बोरॉन हे बोरॉनाचे कार्बनी संयुग बनविता येते.
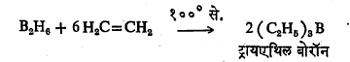
ह्यापद्धतीचा वापर करून सिलिकॉन,जर्मेनियम,कथिल इ. धातूंची कार्बनी संयुगे बनविता येतील. ह्या पद्धतीचा उपयोग करून ॲल्युमिनियमाची कार्बनी संयुगेदेखील बनविता येतात परंतु ह्या विक्रियेत ॲल्युमिनियमाचे हायड्राइड न वापरता ॲल्युमिनियम धातू आणि हायड्रोजनच वापरतात. ॲल्युमिनियम हायड्राइड हे साठविण्यास व हाताळण्यास अवघड असल्यामुळे ते वापरत नाहीत. ॲल्युमिनियम,हायड्रोजन एथिलीन यांतील विक्रिया पुढीलप्रमाणे दाखविता येईल.
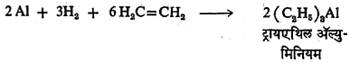
ह्या विक्रियेत प्रथम ॲल्युमिनियम हायड्राइडच तयार होते असे आढळून आले आहे. ॲल्युमिनियम हायड्राइड तयार झाल्यावर त्यात व एथिलीनामध्ये समावेशक विक्रिया होते.
भौतिक गुणधर्म : काही कार्बनी-धातू संयुगे वायुरूपात, (उदा.,ट्रायमिथिल बोरॉन),तर काही द्रवरूपात आढळतात पण बरीचशी संयुगे घनरूप आहेत. या संयुगांपैकी कित्येकांत आपोआप पेट घेण्याची प्रवृत्ती आढळते. पण रासायनिक विक्रियाशीलतेशी त्यांचा संबंध लावता येतोच असे नाही. उदा.,ट्रायमिथिल बोरॉन व ट्रायएथिल बिस्मथ ही संयुगे आपोआप पेट घेतात. परंतु इतर रासायनिक बाबतीत त्यांची विक्रियाशीलता कमी असते. तसेच कार्बनी-चांदी संयुगे व कार्बनी-सोने संयुगे ही अतिशय अस्थिर असतात,परंतु त्यांची रासायनिक विक्रियाशीलता अतिशय कमी असते. याउलट सर्वसाधारण तापमानासही एथिल पोटॅशियमाचे अपघटन (घटक द्रव्ये अलग होणे) होते. हे संयुग खूपच विक्रियाशील आहे.
रासायनिक गुणधर्म :(१)कार्बनी मूलक एका धातूपासून दुसऱ्या धातूकडे बदली होणे,अशा प्रकारच्या विक्रिया कार्बनी धातू संयुगांच्या वेगवेगळ्या संश्लेशण विक्रियांत वर उल्लेखिलेल्या आहेत.
उदा.,
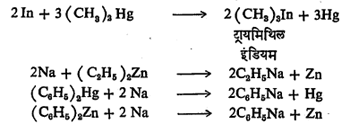
(२) काही कार्बनी-धातू संयुगे मुख्यतः ग्रीन्यार विक्रियाकारक अनेक कार्बनी संयुगांबरोबर संयोग पावतात. त्यांचा उपयोग वेगवेगळी कार्बनी संयुगे बनविण्यासाठी होतो. ह्या प्रकारात काही विक्रिया सुरूवातीस दिल्या आहेत. त्यांशिवाय पुढे दिलेल्या विक्रियाही महत्त्वाच्या आहेत. ग्रीन्यार विक्रियाकारक किंवा इतर काही कार्बनी-धातू संयुगे व पाणी यांत विक्रिया होऊन कार्बनी-धातू संयुगांचे जलीय विच्छेदन (पाण्याच्या विक्रियेने घटक द्रव्ये अलग होणे) होते आणि हायड्रोकार्बने बनतात. उदा.,
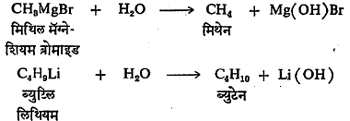
जलीय विच्छेदनात सर्वसाधारण नियम असा आहे की, ज्यांची रासायनिक विक्रियाशीलता कमी आहे अशा कार्बनी धातू संयुगांचे पाण्यामुळे जलीय विच्छेदन होत नाही. पण मध्यम आणि जास्त विक्रियाशीलता असलेल्या कार्बनी-धातू संयुगांचे मात्र जलीय विच्छेदन त्वरेने होते.
कार्बन–डायऑक्साइड आणि जस्त किंवा कॅडमियम यांचे अल्किल अनुजात यांत वरील विक्रिया होत नाही. उलट ह्या संयुगांसाठी कार्बन–डायऑक्साइडाचा संरक्षक म्हणून उपयोग करतात. एखादे कार्बनी-धातू संयुग कार्बन डायऑक्साडबरोबर विक्रिया करील की नाही, हे त्यातील धातूच्या विद्युत् ऋणता १·५ पेक्षा (पॉलिंग यांच्या मापन पद्धतीप्रमाणे) कमी असेल, तर त्या धातूचे कार्बनी संयुग व कार्बन–डायऑक्साइड ह्यांत विक्रिया होते. धातूची विद्युत् ऋणता १·५ पेक्षा अधिक असेल, तर ही विक्रिया होत नाही.
(४) अधातवीय मूलद्रव्ये व कार्बनी-धातू संयुगे यांतील विक्रिया : कोणत्याही हॅलोजनामुळे विक्रियाशील कार्बनी-धातू संयुगांचे अपघटन होऊन अल्किल हॅलाइड मिळते. जसे,
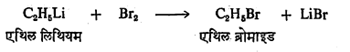
जास्त विक्रियाशील धातूंची कार्बनी संयुगे आणि गंधक ह्यांत ईथर माध्यमात पुढील विक्रिया होते.

नायट्रोजनाच्या ऑक्साइडांमुळे ग्रीन्यार विक्रियाकारकांचे ऑक्सिडीकरण होऊन प्रतिष्ठापित हायड्रॉक्सील अमाइन मिळते. जसे,
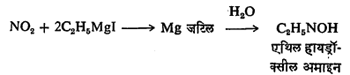
अमोनिया किंवा फॉस्फाइन आणि ग्रीन्यार विक्रियाकारक ह्यांत हायड्रोक्लोरिक अम्लाच्या उपस्थितीत खालील विक्रिया होते.
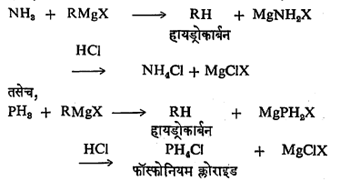
वरील काही उदाहरणांत फक्त ग्रीन्यार विक्रियाकारकाच्या विक्रिया दाखविल्या आहेत. परंतु ग्रीन्यार विक्रियाकारकाएवढी क्रियाशीलता असणारी कार्बनी-धातू संयुगे आणि ती विक्रियाकारके ह्यांत वर दाखविल्याप्रमाणेच विक्रिया होते.
(६)काही कार्बनी-धातू संयुगे व ईथर ह्यांत खाली दाखविल्याप्रमाणे विक्रिया होते :
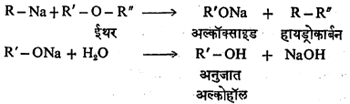
धातूंचे अल्किल आणि ईथर ह्यांत वरील विक्रिया होते. धातूंचे अल्किल अनुजात व ईथर ह्यांत विक्रिया होईल की नाही हे अल्किलामधील धातूच्या विद्युत् ऋणतेवर अवलंबून असते. ज्या धातूंची विद्युत् ऋणता ०·९ पेक्षा कमी आहे अशा धातूंचे अल्किल अनुजात व ईथर ह्यांत वरील विक्रया होईल.
संदर्भ – 1. Eisch, J. J. The Chemistry of Organometallic Compounds, New York, 1967.
2. Finar, I. L. Organic, Chemistry, London, 1962.
3. Harwood, J. H. Industrial Applications of the Organometallic compounds, London, 1963.
4. Kaufman, H. C. Handbook of Organometallic Compounds, Princeton, 1961.
5. Rochew, E. G., Hurd, D. T., Lewic, R. N. Organometallic Compounds, New York, 1957.
6. Zeiss, H. Organometallic Chemistry, New York, 1960.
भावे, अ.श्री.
“