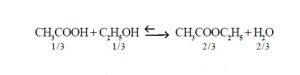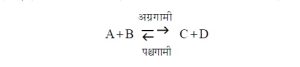समतोल, रासायनिक : बहुतेक अकार्बनी रासायनिक विक्रिया, विशेषत: आयनांमधील ( विद्युत् भारित अणू , रेणू वा अणुगट यांतील ) अन्योन्य विक्रिया, क्षणार्धातच पूर्ण होतात परंतु काही अकार्बनी व बहुतेक कार्बनी विक्रिया सावकाश होतात व कधीच पूर्ण होत नाहीत. म्हणून काही अपवादात्मक विक्रिया सोडल्यास बहुतेक विक्रिया अग्रगामी ( डावीकडून उजवीकडे ) व पश्र्चगामी ( उजवीकडून डावीकडे ) अशा दोन्ही बाजूंनी होत असतात. पश्र्चगामी विक्रियांचा वेग निरनिराळ्या विक्रियांत कमी-अधिक असतो इतकेच. काही वेळानंतर विक्रिया थांबते व समतोल स्थिती प्राप्त होते. अशा दोन्ही दिशांनी होणाऱ्या विक्रियांना व्युत्क्रमी विक्रिया असे म्हणतात. उदा., ॲसिटिक अम्ल व एथिल अल्कोहॉल प्रत्येकी एक रेणुभार घेऊन मिसळल्यास विक्रिया प्रथम जलद होते व हळूहळू तिचा वेग मंदावतो व नंतर थांबतो. अशा स्थितीत या मिश्रणात पुढे दिलेल्या समीकरणाने प्रत्येक पदार्थाचे रेणू दिले आहेत.
हे मिश्रण कितीही वेळ ठेवले, तरी त्या पदार्थाच्या संहतीत बदल होत नाही. सी. एम्. गुलबॅर व पी. व्हॉग या शास्त्रज्ञांनी अशा व्युत्क्रमी विक्रियांच्या बाबतीत पुढील सिद्धांत मांडला : “ रासायनिक विक्रियांचा वेग त्या विक्रियेत भाग घेणाऱ्या पदार्थांच्या ‘ क्रियाशील वस्तुमानावर ’ अवलंबून असतो ”. येथे क्रियाशील वस्तुमान म्हणजे पदार्थाची रेणू संहती होय.[⟶ रासायनिक गतिवाज्ञान].
समजा, दोन पदार्थ A व B हे रासायनिक विक्रियेने C व D हे पदार्थ देतात, ही अग्रगामी क्रिया आहे. तसेच C आणि D हे पदार्थ A व B देतात, ही पश्र्चगामी क्रिया आहे. याचाच अर्थ ह्या क्रिया व्युत्क्रमी आहेत.
दोन पदार्थांत विक्रिया होताना तिचा वेग त्यांच्या क्रियाशील वस्तुमानांच्या गुणाकारावर अवलंबून असणे स्वाभाविकच आहे. अग्रगामी विक्रियेचा वेग X आहे, हा वेग ( A ) व ( B ) या क्रियाशील वस्तुमानांच्या गुणाकारावर अवलंबून असल्याने
X µ ( A ) X ( B ) ∴ X = k1 ( A) X ( B)
पश्र्चगामी विक्रियेचा वेग Y आहे अशी कल्पना केल्यास
Y µ ( C ) X ( D ) ∴ Y = K2 ( C ) X ( D )
वरील समीकरणांत k1 व k2 हे वेग स्थिरांक आहेत. समतोल स्थितीत ‘अग्रगामी विक्रियेचा वेग = पश्र्चगामी विक्रियेचा वेग’ म्हणजे
K च्या मूल्याला समतोल स्थिरांक असे म्हणतात. अनेक प्रयोगांवरून असे दिसून आले आहे की, विशिष्ट तापमानाला K च्या मूल्यात दाब किंवा घटकांची संहती ( प्रमाणे ) यात बदल केल्याने कोणताही बदल होत नाही. प्रत्येक विक्रियेत K चे मूल्य वेगळे असते.
समांगी व्युत्क्रमी विक्रिया : या विक्रियेत भाग घेणारे सर्व घटक एकाच रूपात असतात उदा.,
यामध्ये छेदाचे मूल्य वाढल्यास अंशाचेही मूल्य वाढते, कारण K चे मूल्य विशिष्ट तापमानाला स्थिर असते. या व्युत्क्रमी विक्रियेत संहत सल्फ्यूरिक अम्ल वापरतात. ते मिश्रणात असताना त्याच्या जलशोषक गुणामुळे पाण्याची व एथिल असिटेटाची विक्रिया कमी प्रमाणात होते व त्याच्या परिणामी अंशाचे मूल्य कमी होते आणि त्यामुळे एथिल अल्कोहॉल व असिटिक अम्ल पश्चगामी विक्रियेने कमी प्रमाणात तयार होतात. याचा अर्थ असा की, सल्फ्यूरिक अम्ल वापरल्यास अग्रगामी विक्रिया जास्त प्रमाणात होऊन एथिल असिटेट जास्त प्रमाणात तयार होते. अशा रीतीने या शास्त्रीय ज्ञानाचा व्यवहारात उपयोग करून घेता येतो. सल्फ्यूरिक अम्ल वापरले नाही, तर एथिल अल्कोहॉल व असिटिक अम्ल यांचे रूपांतर समतोल स्थितीत ६६% होते. तेच सल्फ्यूरिक अम्ल वापरल्यास त्यांचे ९८% रूपांतर होते. अशा रीतीने विक्रियांत भाग घेणाऱ्या घटकांचे प्रमाण ( संहती ) कमी अथवा जास्त करून विक्रिया अग्रगामी अथवा पश्र्चगामी जास्त अथवा कमी प्रमाणात जरूरीप्रमाणे करून घेता येते.
दाबात फरक केल्यास होणारा परिणाम : दाबाचा परिणाम वायुरूप व्युत्क्रमी विक्रियांच्या बाबतीत जास्त महत्त्वाचा आहे. कारण वायुरूपात दाबाचा परिणाम विचारात घेण्यायोग्य एवढा होत असतो. द्रव व घन पदार्थांत तो जवळजवळ होत नाही. उदा.,
येथे विक्रियेत एका PCl5 च्या रेणूचे दोन रेणूंत ( PCl3 व Cl2 ) रूपांतर होते. म्हणजे अग्रगामी विक्रियेत घनफळ वाढते व पश्चगामी विक्रियेत ते कमी होते.
विक्रिया सुरू होताना PCl5ची संहती अ गॅमरेणुभार आहे आणि विक्रिया सुरू होऊन समतोल साधला गेला असता PCl3 व Cl2 यांची प्रत्येकी संहती ‘ क्ष ’ गॅमरेणुभार आहे असे मानल्यास त्याचा अर्थ असा की, अ संहती असलेल्या PCl5चे रूपांतर प्रत्येकी क्ष संहती असलेल्या PCl3 व Cl2 मध्ये होते. मिश्रणाचे घनफळ य लिटर आहे असे गृहीत धरल्यास प्रत्येकाचे क्रियाशील वस्तुमान असे येते :
K च्या मूल्यात ‘ य ’ येते व ते छेदात आहे. याचा अर्थ असा की, घनफळ कमी अगर जास्त केल्यास क्ष च्या मूल्यात बदल होईल. ‘ य ’ चे मूल्य दाबात बदल करून वाढविता अथवा कमी करता येते. कारण वायूंच्या बाबतीत
जर य चे मूल्य वाढविले म्हणजेच दाब कमी केला, तर क्ष चे मूल्य वाढते, कारण K स्थिर राहतो. म्हणजे दाब कमी केला असता PCl5 चे PCl3 व Cl2मध्ये जास्त प्रमाणात रूपांतर होते व दाब वाढविला असता त्याच्या उलट होते.
वरील उदाहरणावरून एक सामान्य नियम ठरविता येईल, ‘ ज्या विक्रियेत विक्रियेमुळे रेणूंची संख्या कमी होते, ती विक्रिया दाब वाढविल्यामुळे अधिक होईल. उलट, विक्रियेने रेणूंची संख्या वाढत असेल, तर दाब वाढविल्याने विक्रिया कमी होईल. जर रेणूंची संख्या बदलत नसेल, तर समतोलावर काहीच परिणाम होणार नाही ’.
तापमान बदलल्यास समतोलावर होणारा परिणाम : अनेक विक्रियां-वरून असे दिसून आले आहे की, तापमानात बदल केल्यास रासायनिक विक्रियेच्या समतोल स्थितीतील K च्या मूल्यात बदल होऊ शकतो. ज्या विक्रियांत उष्णता निर्माण होते, त्यांच्या बाबतीत तापमान शक्य तो कमी ठेवल्याने विक्रिया फल जास्त मिळत असते. उदा.,
2 SO2 + O2 ⟶ 2 SO3 + उष्णता
पण विक्रियेत उष्णता कमी होत असेल, तर तापमान वाढविल्यास विक्रिया-फल जास्त मिळते. उदा.,
N2 + O2 ⟶ 2NO – उष्णता
अशा रीतीने पदार्थांची संहती, दाब व तापमान यांचा अभ्यास अनेक समांगी व्युत्क्रमी विक्रियांच्या बाबतीत करून ⇨आंरी ल्वी ल शातल्ये या शास्त्रज्ञांनी पुढील तत्त्व शोधले आहे. ‘ समतोल स्थितीत असलेल्या विक्रियेच्या परिस्थितीत तापमान, दाब अथवा संहतीमध्ये कोणताही बदल केला, तर समतोल डावीकडे अथवा उजवीकडे अशा रीतीने ढळतो की, त्या बदलाने होणारा परिणाम नाहीसा होतो’.
या विक्रियेत अग्रगामी विक्रियेच्या बाबतीत घनफळ कमी होते व उष्णता निर्माण होते. म्हणून मिश्रणाचे घनफळ कमी केल्यास म्हणजेच दाब वाढ-विल्यास अग्रगामी विक्रियेचे विक्रिया फल जास्त मिळते. म्हणून ३०० ते ८०० वातावरणदाबाइतका दाब वापरतात. तसेच तापमान ४००० ते ४५०० से. ठेवतात. या तापमानाला भरपूर अमोनिया तयार होतो. तो वेगाने व्हावा म्हणून उत्प्रेरकाचा ( विक्रियेत प्रत्यक्ष भाग न घेता तिची गती बदल-णाऱ्या पदार्थाचा ) उपयोग करतात पण तापमान यापेक्षा जास्त वाढवीत नाहीत. ते वाढविल्यास नियमाप्रमाणे व प्रत्यक्ष विक्रिया फल कमी मिळते. तापमान वाढविणे फायदयाचे नसते. अशा रीतीने व्यवहारात मोठय प्रमाणावर अमोनिया तयार करताना रासायनिक समतोलाच्या अभ्यासाचा उपयोग होतो.
विषमांगी व्युत्क्रमी विक्रिया : ज्या विक्रियेत घन पदार्थ भाग घेत असतात, अशा पदार्थांच्या क्रियाशील वस्तुमानामध्ये दाबात अथवा ताप-मानात बदल केल्याने फारसा बदल होत नसतो व ते स्थिर असते असे गृहीत धरल्याने फारशी चूक होत नाही, हे गुल्बॅर व व्हॉग यांनी प्रयोगाने दाखवून दिले आहे. एखादया विक्रियेत घन व वायुरूप पदार्थ अथवा द्रव व वायुरूप पदार्थ भाग घेत असले म्हणजेच दोन किंवा तिन्ही रूपांतील पदार्थ भाग घेत असले, तर त्या विक्रियेस विषमांगी विक्रिया असे म्हणतात, उदा.,
येथे वाफेचे ( H2O) प्रमाण वाढले की, हायड्नोजनाचे प्रमाण वाढते. म्हणजे जास्त हायड्नोजन वायू तयार होतो. हायड्नोजन जास्त तयार होणे ही गोष्ट Fe अथवा Fe3O4यांच्या क्रियाशील वस्तुमानांत बदल करून साधता येत नाही, तर ती वाफेचे प्रमाण वाढवून साधता येते. उत्प्रेरकाचा उपयोग करून विक्रियेचा वेग वाढविता येतो, पण उत्प्रेरकामुळे समतोल स्थिरांकावर काहीही परिणाम होत नाही. वरील विक्रिया पाण्याच्या वाफेच्या प्रमाणावर व हायड्नोजन वायूच्या प्रमाणावर अवलंबून आहे. विक्रियेत वायुरूप पदार्थाच्या घनफळात बदल होत नाही. त्यामुळे दाब वाढविला अथवा कमी केल्याने दोन्ही दिशांना विक्रिया फल वाढत अथवा कमी होत नाही.
वरील विवेचनात क्रियाशील वस्तुमान गॅमरेणुभार संहतीने दर्शविले आहे. या पद्धतीत स्थिरांक व त्यावरून केलेली गणिते स्थूलमानाने बरोबर असतात परंतु अधिक सूक्ष्म गणिताकरिता क्रियाशील संहतीनेच क्रियाशील वस्तुमान निदर्शित केले पाहिजे.
पहा : प्रावस्था नियम; रसायनशास्त्र, भौतिकीय; रासायनिक गतिविज्ञान.
संदर्भ : 1. Barrow, G. M. Physical Chemistry, 1988.
2. Klotz, I. M. Rosenberg. R. M. Chemical Thermodynamics : Basic Theory Methods, 1994.
3. Levine, I. N. Physical Chemistry,1994.
पटवर्धन, सी. आर्.