विद्युत् विच्छेदन : विद्युत् विच्छेद्याच्या विद्रावातून किंवा वितळलेल्या लवणामधून विद्युत् प्रवाह पाठवून रासायनिक विक्रिया घडवून आणणारी एक पद्धत [विशिष्ट विद्रावकात (विशेषतः पाण्यात) विरघळविलेले असताना किंवा वितळविलेले असताना ज्या रासायनिक संयुगातून विजेचा प्रवाह वाहू शकतो. त्याला विद्युत् विच्छेद्यम्हणतात]. विद्युत् विच्छेदक घटात विद्युत् विच्छेदनाची प्रक्रिया होते. या घटात विद्युत् विच्छेद्याच्या विद्रावात अथवा वितळलेल्या लवणात धातू किंवा ग्रॅफाइट यासारख्या विद्युत् संवाहक पदार्थाची कांडीसारखी अग्रे बुडविलेली असतात. ही विद्युत् अग्रे एकदिश (एकाच दिशेत वहनाऱ्या) विद्युत् पुरवठ्याला जोडतात. जेव्हा या घटातून विद्युत् प्रवाह वाहतो. तेव्हा प्रत्येक विद्युत् अग्रापाशी एक किंवा अनेक विक्रिया घडतात. या वेळी धन आयन (आयन म्हणजे विद्युत् भारित अणू, रेणू अथवा अणुगट) ऋण अग्राकडे व ऋण आयन धन अग्राकडे स्थलांतरित होतात. ऋणाग्रापाशी धन आयनांचा विद्युत् घटमालेकडून आलेल्या विद्युत् प्रवाहाच्या रूपातील इलेक्ट्रॉनांशी संयोग होऊन निर्विद्युकरण होते. या प्रक्रियेला ⇨क्षपण म्हणतात. उलट धनाग्राजवळ इलेक्टॉन विद्रावातील आयनांकडून धनाग्राकडे जातात. या प्रक्रियेला ⇨ऑक्सिडीभवन म्हणतात उदा., जस्ताच्या क्लोराइडाचे विद्युत् विच्छेदन केल्यास क्षपणद्वारे जस्त ऋणाग्रावर साचते व ऑक्सिडीभवनाद्वारे बनलेला क्लोरीन वायू धनाग्राजवळ मुक्त होतो. (पहा: आकृती).
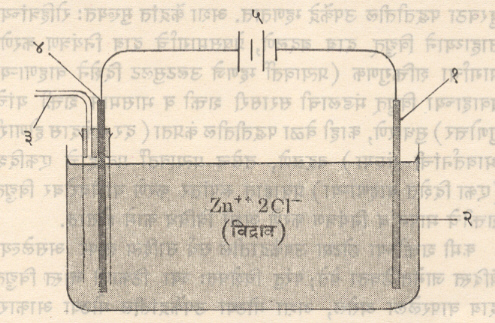
अशा घटात योग्य धातूची विद्युत् अग्रे वापरून काही मूलद्रव्ये किंवा संयुगे तयार करता येतात. उदा., सल्फेटाच्या विद्युत् विच्छेद्य विद्रावामध्ये तांब्याचे घन (Cu)++व सल्फेटाचे ऋण (SO4) −− आयन तयार होतात. या विद्रावात प्लॅटिनमाच्या विद्युत् अग्रामधूनविद्युत् प्रवाहपाठविल्यास तांब्याचे धन आयन ऋण आग्राकडे व सल्फेटाचे ऋण आयन धन अग्राकडे जातात. ऋण अग्रावरील इलेक्टॉनांमुळे तांब्याच्या आयनाचे निर्विद्युतिकरण होऊन ऋण अग्रावर शुद्ध तांबे निक्षेपित होते. (साचते). तसेच धन अग्राजवळ सल्फेट आयनांमधील इलेक्ट्रॉन निघून जाऊन त्यांचे निर्विद्युतीकरण होते व त्याचे सल्फेट मूल कामामध्ये रूपांतरण होते. सल्फेट मूलक स्वतंत्र्य स्थितीत राहू शकत नसल्याने विद्रावातील पाण्याशी त्याचा संयोग होतो आणि धन अग्राजवळ ऑक्सिजन वायू व सल्फ्यूरिक अम्ल तयार होतात
CuSO4 ⇆ Cu+++SO4—
ऋण अग्राजवळ Cu+++ 2e ⟶ Cu
धन अग्राजवळ SO4— — 2e ⟶ SO4
2SO4 + 2 H2O ⟶ 2H2 SO4 + O2 ↑
धातूंचे निक्षेपण, हायड्रोजन वायूची किंवा क्षारकिय पदार्थाची निर्मिती किंवा क्षपन विक्रिया ऋण अग्राजवळ घडतात. ऑक्सिजन किंवा अम्लीय पदार्थाची निर्मिती किंवा ऑक्सिडीकरण विक्रिया धन अग्राजवळ घडतात. काही वेळा विद्युत् अग्राजवळ निर्माण झालेले पदार्थ विद्रावाशी किंवा विद्युत् अग्राच्या पदार्थाशी संयुग पावून आनुषंगिक (द्वितीयक) रासायनिक प्रक्रिया घडतात. उदा., कॉपर सल्फेट विद्रावाच्या विद्युत् विच्छेदनाच्या वेळी तांब्याचेच धन अग्र वापरले, तर त्यातील शुद्ध तांबे ऋण अग्रावर निक्षेपित होते. म्हणून विद्युत् विच्छेदनामध्ये योग्य पदार्थ निर्माण होण्यासाठी विद्युत् विच्छेद, विद्युत् अग्र व विद्युत् प्रवाह यांचे स्वरूप काटेकोरपणे ठरवावे लागते.
सिद्धांत: विद्युत् विच्छेदनामध्ये उत्पन्न होणाऱ्या पदार्थाची राशी, त्यांच्या निर्मितीची त्वरा व स्वरूप या सर्व गोष्टी विद्युत् विच्छेदनाच्या परिस्थिवर अवलंबून असतात. मायकेल फॅराडे (१७९१-१८६७) यांनी विद्युत् प्रवाहाने निर्माण होणाऱ्या पदार्थाचे राश्यात्मक प्रमाण दोन नियमाच्या द्वारे सांगितले आहे. पहिल्या नियमानुसार विद्युत् विच्छेदनाने निर्मिलेच्या पदार्थाचे वजन वापरलेल्या एकूण विद्युत् भाराच्या सम प्रमाणात असते. समजा, व ग्रॅम वजनाचा पदार्थ प अँपिअर विद्युत् प्रवाहने स सेंकदांत निर्माण झाल्या असल्यास व = क्ष प स असे समीकरण मांडता येते. येथे क्ष हा स्थिराकं असून त्यांचे मूल्य एक अँपिअर विद्युत् प्रवाहाने एका सेंकदात निर्मिलेच्या पदार्थाच्या वजना इतके असते. यास पदार्थाच्या विद्युत् रासायनिक तुल्यांक म्हणतात (हा तुल्यांक धातूंचा ग्रॅममधील अणूभार भागिले त्याची संयूजा या सूत्राने मिळतो. उदा., तांब्याचा अणूभार ६३·५४ आहे. व तांब्याच्या संयुगाची संयूजा + २ आहे. म्हणून तांब्याच्या संयुगाच्या विद्रावाचा रासायनिक तुल्यांक ३१·७७ आहे).
फॅराडे यांच्या दुसऱ्या नियमानुसार वेगवेगळ्या विद्युत् विच्छेद्यातून समान मूल्यांचा विद्युत् प्रवाह पाठवल्यास निर्माण होणाऱ्या निरनिराळ्या पदार्थाची वजणे त्या पदार्थाच्या रासायनिक तुल्यांकाच्या समप्रमाणात असतात. यास सिद्धांतावरून पदार्ताच्या रासायनिक तुल्यांका इतका वजनाचा पदार्थ विद्युत् विच्छेदनाने निर्माण करण्यास लागणारा विद्युत् भार सर्व पदार्थाच्या बाबतीत सारख्याच असतो. उदा., १ ग्रॅम हायड्रोजन, ८ ग्रॅम ऑक्सिजन किंवा सु. ३२ ग्रॅम तांबे निर्माण करण्यास लागणारा विद्युत् भार जवळजवळ ९६,४८७ कुलंब असतो. विद्युत् भाराच्या या मूल्यास ‘फॅराडे’ (किंवा फॅराड स्थिरांक) असे म्हणतात विद्युत् भार मोजण्याचे मोठे परिमाण म्हणून त्याचा उपयोग होतो. विद्युत् भाराचे अंतरराष्ट्रीय परिमाण विद्युत् विच्छेदनाने निक्षेपित केलेल्या चांदीच्या वजनावर ठरविले जाते. ०·० १११८ ग्रॅम चांदीचे निक्षेपण करण्यास लागणारा विद्युत् म्हणजे एक अंतराष्ट्रीय कुंलब मानण्यात येते. हा विद्युत् भार मोजण्यासाठी कुंलब मापक हे पकरण वापरतात. इलेक्ट्रॉलीसिस (विद्युत् विच्छेदन) व इलेक्ट्रॉलाईट (विद्युत् विच्छेद्य) या संज्ञा फॅराडे यांनीच प्रथम वापरल्या
उपयोग: विद्युत् विच्छेदनाने तांबे, क्लोरीन, सोडियम हायड्रॉक्साइड, हायड्रोजन, ऑक्सिजन, हायडॉजनपॅरोक्साइड, मँगॅनीज ड्राय-ऑक्साइड, क्लोरेटे, परक्लोरेटे, परमॅँगॅनेटे वगैंरे पदार्थ मोठ्या प्रमाणात निर्माण करता येतात. (हायड्रोजन परॉक्साइड व परक्लोरेटे रॉकेटाच्या इधंनात वापरतात).
पाण्याचे विद्युत् विच्छेदन केले असता हायड्रोजन (व ऑक्सिजनही) निर्माण होतो. त्यामुळे विद्युत् विच्छेदक घटात जे पाणी शिल्लक असते, त्यात जड पाण्याचे (ड्यूटेरियम ऑक्साइड) प्रमाण वाढलेले असते. थोड्या प्रमाणात जड पाणी तयार करण्यासाठी ही पद्धती वापरतात [⟶ ड्यूटेरियम, ट्रिटीयम व जड पाणी].
वितळलेल्या लवणाचे विद्युत् विच्छेदन करून ॲल्युमिनियम, मॅग्नेशियम, सोडियम यासारख्या विशिष्ट धातूंचे उत्पादन करतात.कारण जलीय विद्रावापासून या धातूचे निक्षेपण करता येत नाही. वितळलेल्या सोडियम क्लोराइडाचे विद्युत् विच्छेदन करून धातूरूपातील सोडियम व क्लोरीन वायू यांचे उत्पादन करतात, तर सोडियम क्लोराइडाच्या जलिय विद्रावाचे विद्युत् विच्छेदन करून सोडियम हायड्रॉक्साइड व क्लोरीन वायू यांची निर्मिती करतात.
निर्जल हायड्रॉफ्ल्युओरिक अम्लामधील फ्ल्युओराइड आयनांच्या ऑक्सीडीभवनाने फ्ल्युओरीन निर्माण होते, तर फ्ल्युओराइडाच्या जलिय विद्रावाचे विद्युत् विच्छेदन केल्यास ऑक्सीजनाची निर्मिती होते. धातूचे विद्युत् विलेपन, धातूंचे निष्कर्षण व धातूंचे अंत्यरूपण हे विद्युत् विच्छेदनाचे इतर उपयोग आहेत. क्रोमियम, निकेल इत्यादींचा पातळ गंजरोधक मुलामा विद्युत् विलेपनाने देतात. कधीकधी विद्युत् विलेपणाने सोने (चांदी व तांबे यांचाही असा मुलामा देतात. तसेच धातूच्या पृष्ठभागावर गंजरोधक व शोभिवंत पातळ पटल निर्माण करण्यासाठीही विद्युत् विच्छेदनाचा उपयोग करतात.यासाठी हा भाग विद्युत् घटात ॲनोड (धनाग्र) म्हणून असतो व म्हणून या क्रियेला ॲनोडायझिंग म्हणतात. तांबे, चांदी, सोने व निकेल यांचे औद्योगिक परिष्करण (शुद्धीकरण) सुद्धा विद्युत् विलेपणाने करतात. कमी प्रतीच्या धातूकांच्या (कच्च्या रूपातील धातूंच्या ) विद्रावाचे विद्युत् करून काही धातूंचे (उदा., जस्त, कॅडमियम) करतात. धनाग्री ऑक्सिडीकरण ही विद्युत् विलेपणाची विरूद्ध विक्रिया असून विद्युतीय झिलईच्या प्रक्रियेत धातूंचे अंत्यरूपण करण्यासाठी ती वापरली जाते. रासायनिक विद्युत् घटांत वीजनिर्मितीसाठी विद्युत् विच्छेदनासाठी उपयोग करून घेतलेला असतो.
अनेक रासायनिक प्रक्रियांच्या मापनासाठी विद्युत् विच्छेदनाचा मोठ्या प्रमाणात वापर केला जातो. उदा., आर्सेनिक, अँटिमनी, जस्त, तांबे, चांदी, अभिजात धातू वगैंरे घटकांचे प्रमाण विद्युत् भारात्मक विच्छेदनाने मोजता येते. विद्रवात बुडविलेल्या एखाद्या काचेच्या दंडावरील वर्चस् मोजून त्या वरून त्या विद्रावातील हायड्रोजन आयनांचे प्रमाण म्हणजेच पर्यायाने त्या विद्रावाचे पीएच मूल्य मोजता येते [⟶पीएच मूल्य]. विद्युत् विच्छेदनाने काही कार्बनी संयुगाचे औद्योगिक उत्पादन करण्यात येते. नायट्रो संयुगे, आल्डिहाइडे, कीटोने, कार्बॉक्सिलिक अम्ले, असंतृप्त संयुगे, हॅलोजनीकृत पदार्थ इत्यादींच्या क्षपण विक्रिया आणि वसाम्ले, अल्कोहॉले, कीटोने, शर्करा इत्यादींच्या ऑक्सिडीकरण विक्रिया यांसाठी विद्युत् विच्छेदन पद्धती वापरली जाते.
पहा: गंजणे रसायनशास्त्र, भौतिकशास्त्र विद्युत् घट विद्युत् धातूविज्ञान विद्युत् रसायनशास्त्र विद्युत् विलेपन.
संदर्भ : 1. Conway, B. E. Theory and Principles of Electrodw processes, New York, 1965
2. Duffy. J. I., Ex., Electrodeposition Processes : Equipment and Composition, New York, 1982.
3. Kuhn, A., Ed., Industrial Electrochemical Processes, Chicago, 1971.
कुलकर्णी, श्री. रा. सूर्यवंशी, वि. ल.
“