फ्ल्युओरीन : हॅलोजन गटातील ( फ्ल्युओरीन , क्लोरीन , ब्रोमीन व आयोडीन या मूलद्रव्यांच्या गटातील ) प्रथम क्रमांकाचे वायुरूप मूलद्रव्य . रासायनिक चिन्ह F ⇨ आवर्त सारणी तील ( इलेक्ट्रॉ न रचनेनुसार केलेल्या मूलद्रव्यांच्या कोष्टकरूप मांडणीतील ) गट ७ अ अणुक्रमांक ( अणुकेंद्रातील प्रोटॉनां ची संख्या ) ९ अणुभार १८ · ९ ९ ८४ स्थिर समस्थानिक ( एकाच अणुक्रमांकाचे पण भिन्न अणुभार असलेले त्याच मूलद्रव्याचे प्रकार ) एकच असून त्याचा द्रव्यमानांक ( अणुकेंद्रातील प्रोटॉन व न्यू ट्रॉ न यांची एकूण संख्या ) १९ किरणोत्सर्गी ( भेदक कण अथवा किरण बाहेर फेकण्याचा गुणधर्म असलेल्या ) समस्थानिकांचे द्रव्यमानां क १७ , १८ , २० , २१ व २२ असून त्यांची अर्धायुष्ये ( मूळची किरणोत्सर्गाची क्रियाशीलता निम्मी होण्यास लागणारा कालावधी ) अनुक्रमे ७० सेकंद , ११२ मिनिटे , १० · ७ सेकंद , ५ सेकंद व ४ सेकंद आहेत विद्युत् विन्यास ( अणुकेंद्राभोवतील विविध कक्षांतील इलेक्ट्रानां ची संख्या ) २ , ७ संयुजा ( इतर अणूशी संयोग पावण्याची क्षमता दर्शविणारा अंक ) १ घनता १ · ६९६ ग्रॅ ./ लि .(०० से . तापमान आणि १ वातावरण दाब असताना ) उकळबिंदूला घनता १ · ५०५ ग्रॅ ./ मिलि . द्रवरूप फ्ल् युओरिनाचा उकळबिंदू— १८८० · १४ से . , गोठणबिंदू – २१९० · ६२ से. फिकट पिवळ्या वर्णाच्या घनरू प फ्ल् युओरिनाचा वितळबिंदू -२२३० से . – २५२० से . ला तो वर्णहीन होतो क्रां तिक तापमान ( जास्तीत जास्त दाब असताना वायूचे दवात रूपांतर होण्याचे तापमान ) – १२९० · २ से क्रांतिक दाब ( क्रांतिक तापमानाला असणारा दाब ) ५५ वा . दा . कोठी तापमानास ( सर्वसाधारण तापमानास ) हा फिकट हिरवट पिवळ्या रंगाच्या वायुरू पात असून त्याचा रेणू द्वि आणवीय ( दोन अणूंचा बनलेला ) F2 असा असतो .
इतिहास : फ्ल्यु ओरस्पार ( कॅल्शियम फ्ल् युओराइड , CaF2 ) या खनिजाचे वर्णन जॉर्जिअस ॲग्रिकोला या शास्त्रज्ञांनी १५३० साली fluo (= I flow) या लॅटिन शब्दावरून ‘फ्ल्यु ओर ’ असे केले आहे , कारण ते रक्तोष्म्याला वितळते . ते अभिवाह ( धातू अथवा कच्च्या रूपातील धातू वितळविण्यास मदत करणारा पदार्थ ) म्हणून वापरतात . कित्येक वर्षे याचे रासायनिक संघटन माहीत नव्हते . १६७० साली श्वां कहार्ड यांनी फ्ल्युओरस्पार व सल्फ्यू रिक अम्ल यांचे मिश्रण तापविले , तेव्हा त्यांना असे आढळून आले की , त्यातून निघणा ऱ्या धुराचा काचेवर परिणाम होतो . त्यानंतर जवळजवळ १०० वर्षांनी १७७१ मध्ये के . डब्ल्यू . शेले यांनी काचेच्या बकपात्राऐवजी कथिलाचे बकपात्र वापरून वरील प्रयोग केला व मिळणा ऱ्या पदार्थावरून फ्ल्युओरस्पार हे कॅल्शियम व एक नवीन खनिज अम्ल (फ्ल् युओरिक अम्ल ) यांचे लवण आहे , असे मत मांडले . १८०७ मध्ये जे . एल् . गे – ल्युसॅक व जे . थेनार्ड यांनी शुद्ध , तीव्र हायड्रोजन फ्ल् युओराइडाचा विद्राव तयार केला . ते ‘ फ्ल् युओरियम ’ या नवीन मूलद्रव्याचे ऑक्सिसंयुग असावे , असे त्याचें मत होते . १८१० मध्ये ए . एम् . अँपिअर यांनी हायड्रोक्लोरिक व हायड्रो फ्ल् युओरिक अम्लांचा तौलनिक अभ्यास करून असे सिद्ध केले की, हायड्रो फ्ल् युओरिक अम्लात ऑक्सिजनाचा अणू नाही . कॅल्शियम आयोडाइड , ब्रोमाइड , क्लोराइड व फ्ल् युओराइड या लवणांत दिसून आलेल्या साम्यामु ळे अँपिअर यांनी हायड्रोजन फ्ल् युओराइडामध्ये आतापर्यंत अज्ञात असलेले मूलद्रव्य हे हॅलोजन गटापैकी आहे , असे सिद्ध केले . १८१३ मध्ये या अज्ञात मूलद्रव्याला ‘ क्लोरीन ’ या नावाच्या धर्तीवर ‘ फ्ल् युओरीन ’ असे नाव देण्यात आले . अँपिअर यांनी तो अधातू असून विद्युत् विच्छेदनाने ( विद्रावातून विद्यु त् प्रवाह नेऊन घटक अलग करण्याच्या क्रियेने ) तयार करता येईल, असे सुचविले .
आढळ : फ्ल्युओरीन अत्यंत क्रियाशील असल्यामु ळे तो निसर्गात शुद्ध स्थितीत सापडत नाही . मात्र संयुगरूपात तो सर्वत्र आढळतो . भूकवचात त्याचे प्रमाण ०· ०६५ टक्के इतके आहे . औद्योगिक दृष्ट्या याचे सर्वात महत्त्वाचे खनिज म्हणजे फ्ल्युओरस्पार (४९ % F ) अगर ⇨ फ्ल्युओराइट . शिवाय तो क्रायोलाइट ( Na3AIF6 ५४ % F), फ्ल् युओरॲपेटाइट [Ca10(PO4)6F2 ३-४% F] व इतर फॉस्फेटी खडकांत आढळतो . पुष्काराज [ टोपॅझ A I2 SiO4 (F, OH) 2 ] तोरमल्ली ( टुर्मलीन ॲल्युमिनियम बोरोसिलिकेट ) यांमध्येही फ्ल् युओराइडे असतात . नैसर्गिक पाण्यात अत्यल्प प्रमाणात तो असतो . समुद्राच्या पाण्यात ०· ३ मिग्रॅ ./ लि . इतका असतो . पाण्यात १· ७ मिग्रॅ./ लि . यापेक्षा त्याचे जास्त प्रमाण असेल , तर दातांच्या लुकणावर काळे – पांढरे डाग पडतात व दात बिघडतात . पाण्यातील फ्ल् युओराइडाचे जास्त प्रमाण ॲल्युमिनियम सल्फेट घालून कमी करण्यात येते . हाडे , दातांचे लुकण (०· १ – ० ·२ % F कुत्र्या चे दात ० · ३ %), रक्त , दूध , वनस्पती यांमध्ये तो अल्प प्रमाणात आढळतो . माणसाच्या मेंदूत ० · ३ मि . ग्रॅ . इतका फ्ल्युओरीन असतो आणि फॉस्फरसाचे शरीरात समावेशन करण्यासाठी त्याचा उपयोग होतो , असे काही शरीरक्रियावैज्ञानिकांचे मत आहे .
निर्मिती : फ्ल्युओरीन अतिशय क्रियाशील असल्यामुळे त्याची निर्मिती ही शास्त्रज्ञांना एक समस्या होऊन बसली होती . इंफ्री डेव्ही , जे . निक्लेस , जॉर्ज पी . लॉयेट इ . शास्त्रज्ञांचे प्रयत्न अयशस्वी झाले . काच , प्लॅटिनम व कार्बन यांची उपकरणे याकरिता उपयोगी पडत नव्हती कारण तयार होणा ऱ्या वायूची त्यांवर रासायनिक विक्रिया होऊन SiF4, PtF4 व CF4 अशी संयूगे तयार होत . विद्यु त् विच्छेदनाचे प्रयोगही प्रथम प्रथम अयशस्वी झाले . कारण तयार होणा ऱ्या फ्ल् युओरिनामुळे फ्ल् युओराइडाच्या विद्रावातील पाण्याचे अपघटन ( रेणूचे तुकडे होण्याची क्रिया ) होऊन ओझोनयुक्त ऑक्सिजन मिळतो असे डेव्ही यांना आढळून आले व निर्जल हायड्रोफ्ल् युओरिक अम्ल विद्युत् अवाहक आहे , असे गोअर यांना आढळून आले . शेवटी १८८६ मध्ये आंरी म् वांसा यांनी प्लॅटिनम – इरिडियम या मिश्रधातूचे U या आकाराचे नलिकाकृती उपकरण तयार केले व त्यात पोटॅशियम फ्ल् युओराइडाच्या निर्जल हायड्रोजन फ्ल्यु ओराइडामधील विद्रावाचे विद्युत् विच्छेदन करून ॠणाग्रावर हायड्रोजन व धनाग्रावर फ्ल्युओरीन मिळविला . या मिश्रधातूवर फ्ल् युओरिनाची विक्रिया फारशी होत नाही . प्लॅटिनम-इरिडियम या महागड्या मिश्रधातूऐवजी तांब्याचे उपकरण वापरता येते असे नंतर दिसून आले , कारण निर्माण होणा ऱ्या फ्ल् युओरिनाची तांब्यावर विक्रिया होऊन एकदा कॉपर- फ्ल्यु ओराइडाचा थर तांब्यावर तयार झाला म्हणजे पुढे त्याच्यावर फ्ल् युओरानाची विक्रिया होत नाही . म्वासां पध्दतीत विद्युत् विच्छेदन चालू असताना संपूर्ण उपकरण मिथिल क्लोराइडाच्या उकळत्या विद्रावात ( उकळबिंदू -२३° से .) ठेवले होते . ही पद्धत तितकीशी यशस्वी न झाल्याने १९९० मध्ये ८०° – ८५° से . ला काम देणारे मध्यम तापमान वापरणारे विद्युत् विच्छेदन घट तयार करून व KF-2HF या संघटनेचे विद्युत् विच्छेद्य वापरून फ्ल्युओरीन तयार करण्यात येऊ लागला . सर्वात सोयीस्कर अशी पद्धत १९३१ मध्ये डेनिस , व्हीडेर व रोशो यांनी शोधून काढली .
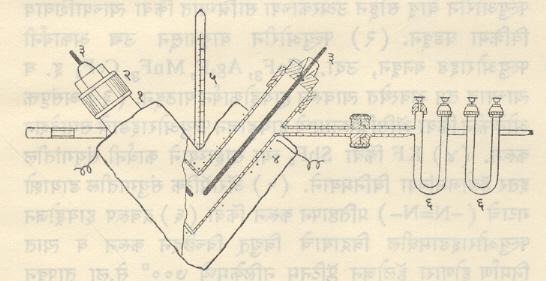
या पद्धतीत वितळविलेल्या व पूर्णपणे कोरड्या अशा पोटॅशियम हायड्रोजन फ्ल्युओराइडाचे ( KHF2), ग्रॅफाइटाचे विद्युत् अग्र वापरून विद्युत् विच्छेदन करतात आणि फ्ल्युओरीन मिळवितात . याकरिता तांब्याच्या जाड पत्र्याची इंग्रजी V या अक्षराच्या आकाराची , ५ सेमी . व्यासाची नळी (१ ) तयार करतात . नळीची तोंडे तांब्याच्या टोपणांनी (२ ) बंद करतात . या टोपणातून विद्युत् अग्र (३ ) बेकेलाइट-सिमेंटने पक्के बसवितात . हा तयार झालेला सबंध घट ॲस्बेस्टसाने लपेटून (४ ) विजेच्या साहाय्या ने आतील पोटॅशियम हायड्रोजन फ्ल्युओराइड वितळवितात . विद्युत् विच्छेदनाने तयार होणा ऱ्या फ्ल्युओरीन वायूतील हायड्रोजन फ्ल्युओराइड वेगळे करण्याकरिता धनाग्राच्या बाजूला सोडियम फ्ल्युओराइडाने भरलेल्या दोन यू ( U ) नलिका (६ ) जोडलेल्या असतात . हायड्रोजन फ्ल्युओराइड सोडियम फ्ल्युओराइडाचे सोडियम हायड्रोजन फ्ल्युओराइडामध्ये रूपांतर करते व अशा तऱ्हेने शुद्ध फ्ल्युओरीन मिळतो .
दुस ऱ्या महायुद्धात अणुबॉ ब निर्मितीसाठी नैसर्गिक युरेनियमापासून युरेनियम (२३५ ) हा समस्थानिक अलग करण्याकरिता फ्ल्युओरिनाचा उपयोग आवश्यक झाला [ ⟶ युरेनियम ]. UF6 हे संयुग तयार करण्याकरिता फ्ल्युओरिनाचा वाढत्या प्रमाणावर वापर सुरू झाला व त्याचे व्यापारी उत्पादन होऊ लागले . शुद्ध फ्ल्युओरिनाचे व्यापारी उत्पादन पोटॅशियम बाय – फ्ल्युओराइडाच्या निर्द्रव हायड्रोजन फ्ल्युओराइडामधील विद्रावाच्या विद्युत् विच्छेदनाने करतात . विच्छेदन घट पोलादाचे किंवा मोनेल मिश्रधातूचे वापरतात व धनाग्र विशेष प्रकारच्या कार्बनाचे व ॠणाग्र पोलादाचे वापरतात . विच्छेदन क्रियेसाठी १००° से . तापमान पुरते . फ्ल्युओरिनाच्या कमी क्रांतिक तापमानामुळे (-१२९° से .) तो द्रव स्थितीत सिलिंडंरमध्ये भरता येत नाही पण २८ किग्रॅ ./ चौ . सेमी . दाबाखाली वायुस्थितीत भरून प्रयोगशाळेतील कामाकरिता वापरता येतो . रॉकेटमध्ये वापरण्यासाठी निरोधित टाकी असलेल्या ट्रकमधून द्रवरूपात त्याची वाहतूक करण्यात येते .
रासायनिक गुणधर्म : फ्ल्युओरीन रासायनिक दृष्ट्या अतिशय क्रियाशील आहे व त्याची विद्युत् ॠणता ( संयुजी इलेक्ट्रॉनाला आकर्षित करून धरून ठेवण्याची व ॠण विद्युत् भार वाढविण्याची प्रवृत्ती ) सर्वात जास्त आहे . फ्ल्युओरीन आवर्त सारणीतली बहुतेक सर्व ( काही अक्रिय – रासायनिक विक्रिया करण्याची सहज प्रवृत्ती नसलेले – वायू सोडून ) मूलद्रव्यांशी संयोग पावतो . अक्रिय वायूंपैकी झेनॉन , रेडॉन व क्रिप्टॉन यांच्याशी प्रत्यक्षात संयोग पावून त्यांची फ्ल्युओराइडे तयार होतात . उदा . , XF2 , XF4 , XF6 इत्यादी . तो पाण्याचे त्वरित अपघटन करतो आणि हायड्रोजन फ्ल्युओराइड व ओझोनयुक्त ऑक्सिजन तयार होतो . या वायूत गंधक , सिलिनियम व टेल्यूरियम पेट घेतात आणि SF6, SeF6, TeF6 अशी फ्ल्युओराइडे मिळतात . क्लोरिनाबरोबर तापविला असता CIF व CIF3 तयार होतात . ब्रोमीन व आयोडीन पेट घेतात BrF3, IF5, IF7 तयार होतात . त्याचप्रमाणे फॉस्फरस ( P ) , आर्सेनिक ( As ) , बोरॉ न ( B) व सिलिकॉन ( Si) हेही पेट घेतात आणि PF3, PF5 AsF3, AsF5 BF4 व SiF4 अशी फ्ल्युओराइडे तयार होतात . कार्बनाची पूड या वायूत पेट घेते व CF4 आणि इतर कार्बन फ्ल्युओराइडे तयार हातात . ग्रॅफाइटावर रक्तोष्म्याला विक्रिया होते परंतु हि ऱ्या वर याचा काही परिणाम होत नाही .
सोडियम , पोटॅशियम , कॅल्शियम , मॅग्नेशियम ( पूड ) व अँटिमनी या वायूत पेट घेतात आणि आनुषांगिक फ्ल्युओराइडे तयार होतात . संपुं जित मॅग्नेशियम , चांदी , जस्त , ॲल्युमिनियम , क्रोमियम , कथिल, शिसे आणि निकेल या वायूत तापविले असता विक्रिया होताना प्रदीप्त होतात . रक्तोष्म्याला तांबे व सोने यांच्यावर विक्रिया होते . ऑस्मियम ( Os) २५०° से . ला पेट घेते , तर प्लॅटिनमावर ५०० ° – ६०० ° से . ला विक्रिया होते . रक्तो ष्म्या ला पॅलॅडियम , रुथेनियम व इरिडियम यांच्यावरही प्ल्युओरिनाची विक्रिया होते . हॅलोजन गटातील इतर मूलद्रव्यांना (CI, Br, I) त्यांच्या संयुगांमधून फ्ल्युओरीन प्रतिष्ठापित करतो ( म्हणजे संयुगांतील त्यां ची जागा घेतो ).
सिलिकॉन , फॉस्फरस , गंधक व काच यांवर द्रवरू प फ्ल्युओरिनाची विक्रिया होत नाही . विद्युत् प्रज्योत तापमानालाही नायट्रोजन व ऑक्सिजन यांच्याशी त्याचा संयोग होत नाही . ऑक्सिजनाची चार फ्ल्युओराइडे ( OF 2 , O 2 F5, O3F2 व O4F2 ) इतर पद्धतींनी तयार केली गेली आहेत . वायुरूप प्रक्रियांमध्ये नायट्रोजनाचा फ्ल्युओरिनाचे विरलीकरण करण्याकरिता उपयोग करतात .
हॅलोजन गटातील इतर मूलद्रव्यांपेक्षा फ्ल्युओरिनाच्या अणूचे आकारमान लहान असल्यामुळे आणि त्याच्या इलेक्ट्रानाच्या आसक्तीमुळे काही मूलद्रव्यांची सर्वात अधिक संयु जा उपयो गात येऊन फ्ल्युओराइडे तयार होतात . उदा . , AgF 2 , IF 7 , UF 6 इत्यादी . अणूंच्या लहान आकारमानामुळे त्या चे त्रिमितीय परिणाम फारसे होत नाहीत व त्यामुळे फ्ल् युओरीनीकृत हेप्टेन ( C7F16) हे संयुग सहजगत्या मिळते , अशा त ऱ्हे ची CI, Br व I यांची संयुगे मिळत नाहीत .
अल्कोहॉल , ईथर व टर्पेंटाइन या वायूत पेट घेतात . फ्ल्युओरीन हा एक सामर्थ्यवान ऑक्सिडीकारक [ ⟶ ऑक्सिडीभवन ] आहे . त्याची जटिल ( गुंतागुतीची संरचना असलेली ) व स्थिर अम्ले आणि संयुगे यांमुळे तो इतर हॅलोजनापासून वेगळा वाटतो .
संयुगे : फ्ल्युओरिनाची अकार्बनी व कार्बनी संयुगे पुष्कळ आहेत . फ्ल्युओरीनाची सगळ्या धातूंशी विक्रिया होते व अनेक एकेरी , दुहेरी व जटिल संयुगे मिळतात .
अकार्बनी संयुगे : बोरॉन फ्ल्युओराइड ( BF2) , अँटिमनी फ्ल्युओराइड ( SbF3 ) , तसेच हायड्रोजन फ्ल्युओराइड ( HF) ही संयुगे कार्बनी विक्रियांमध्ये महत्त्वाचे उत्प्रेरक ( प्रत्यक्ष विक्रियेत भाग न घेता विक्रियेची गती बदलणारे पदार्थ ) म्हणून वापरतात . कोबाल्टिक फ्ल्युओराइड ( CoF3) आणि क्लोरीन ट्रायफ्ल्युओराइड ( CIF3) हे फ्ल्युओरीनीकारक ( इतर संयुगांत फ्ल्युओरिनाचा समावेश करण्यासाठी उपयोगी पडणारी संयुगे ) म्हणून चांगले उपयोगी पडतात . सल्फर फ्ल्युओराइड ( SF6) हे वायुरू प विद्युत् निरोधक म्हणून वापरतात. युरेनियम प्ल्युओराइड ( UF6) हे युरिनियमाचे समस्थानिक वेगळे करण्याकरिता उपयोगी आहे . सोडियम फ्ल्युओराइड ( NaF ) हे दातांवरील डाग नाहीसे करण्यासाठी व लहान मुलाचा दंतक्षय नाहीसा करण्यासाठी पाण्याच्या शुद्धीकरणात वापरतात .
हायड्रोजन फ्ल्युओराइड वा हायड्रोफ्ल् युओरिक अम्ल ( H2F2) : फ्ल्युओरस्पार आणि ९७% सल्फ्यूरिक अम्ल यांच्या विक्रियेने हायड्रोजन फ्ल्युओराइड बनवितात . निर्जल स्थितीत ते द्रवरूप असून हवेत त्याच्या वाफा बनतात . ते अत्यंत विषारी आहे . त्वचेशी संबंध आल्यास त्वचेला भोके प ड तात . उकळबिंदू १९ °· ४ से . गोठणबिंदू -१०२° से . पाण्यात विद्राव्य अम्लाची सिलिका व सिलिकेट यांवरील विक्रिया महत्त्वाची आहे. तीव्र अम्ल व सिलिका यांच्यापासून सिलिकॉन टेट्राफ्ल्युओराइड ( SiF4) बनते आणि अम्लाचा त्याच्याशी संयोग होऊन हायड्रोफ्ल् युओरोसिलिसिक अम्ल बनते ( H2SiF6). काचेवरील नक्षीकामासाठी त्याचा उपयोग करतात .
AIF3, Na3AlF6 ही संयुगे काच उद्योगात वापरतात . अमोनियम बायफ्ल्युओराइड ( NH4HF2) दुधी काचेचे विजेचे दिवे करण्याकरिता व काचेवरील नक्षीकामात उपयोगी आहे .
फ्ल्युओबोरिक अम्ल (HBF4 ), फ्ल्युओरोफॉस्फोरिक अम्ले- H2PO3F ( मोनो ) , HPO2 F2 ( डाय ) , HPF6 ( हेक्झॅ ) , फॉस्फरस ऑक्सिफ्ल्युओराइड , फ्ल्युओरोसल्युरिक अम्ल इ . संयुगे महत्त्वाची आहेत . धातवीय फ्ल्युओरोबोरेटे विद्युत् विलेपन उद्योगात वापरतात . डायझोनियम फ्ल्युओबोरेटे ॲरोमॅटिक वलयामध्ये [ ⟶ ॲरोमॅटिक संयुगे ] फ्ल्युओरीन अणूचा प्रवेश करविण्याकरिता उपयोगी आहेत . परक्लोरिक फ्ल्युओराइड ( FCIO3) फ्ल्युओरीनीकरणात , कार्बनी संश्लेषणात ( घटक एकत्र आणून कृत्रि म रीत्या कार्बनी संयुगे तयार करण्यात ) व स्वयंप्रज्वलनकारक म्हणून वापरतात .
कार्बनी संयुगे : कार्बनी संयुगातील हायड्रोजनाचे फ्ल्युओरिनाने प्रतिष्ठापन करून असंख्य कार्बनी संयुगे मिळतात . फ्ल्युओरीन टेट्राफ्ल्युओराइड या कार्बनी संयुगाशिवाय बाकीच्या सर्व कार्बनी संयुगांवर फ्ल्युओरिनाची जोमाने विक्रिया होते . फ्ल्युओरीनीकरणाने फ्ल्युओरिहायड्रोकार्बने व फ्ल्युओराकार्बने ( संपृक्त – ज्यात इतर मूलद्रव्यांच्या अणूंचा वा संयुगांचा समावेश होऊ शकत नाही अशी -व असं पृक्त , साखळीयुक्त व वलयी ) , तसेच फ्ल्युओरो – अल्कोहॉले , ईथरे , आल्डिहाइडे , कीटोने , अमाइने , ॲरोमॅटिक संयुगे इ . सर्व प्रकारची फ्ल्युओरिनाची संयुगे तयार करण्यात आली आहेत . ‘ कार्बनी रसायनशास्त्र ’ या रसायनशास्त्राच्या शाखेप्रमाणे ‘ फ्ल्युओरीन रसायनशास्त्र ’ अशी वेगळी शाखा करण्याइतपत त्याची व्याप्ती वाढलेली आहे .
कार्बनी रसायनशास्त्रात विसाव्या शतकात फ्ल्युओरिनाला महत्त्वाचे स्थान प्राप्त झाले आहे . त्याच्या लहान आकारमानाच्या अणूमुळे व अतिक्रियाशीलतेमुळे हायड्रोकार्बनांशी त्यांचा संयोग होऊन आनुषंगिक फ्ल्युओरोकार्बने मिळतात .
फ्ल्युओरोकार्बने : कार्बन आणि फ्ल्युओरीन यांच्या संयुगांना ‘ फ्ल्युओरोकार्बने ’ म्हणतात . ही हायड्रोकार्बनांसारखी आहेत परंतु दोन्हींत खूप फरकही आहे [ ⟶ हायड्रोकार्बने ]. हायड्रोकार्बनांचे ऑक्सिडीकरण होते , ती चटकन पेट घेतात , सूक्ष्मजंतू व कीटक त्यांची मोडतोड करू शकतात . फ्ल्युओरोकार्बनांवर मात्र या कशाचाही परिणाम होत नाही . प्रबल ऑक्सिडीकारके , क्षपणकारके [ ⟶ क्षप ण ] किंवा क्षरणकारक ( झिजवि णारी ) अम्ले व क्षार ( अम्लाशी विक्रिया झाल्यास लवणे देणारी संयुगे ) यांच्या शी विक्रिया करू शकत नाहीत .
फ्ल्युओरोकार्बने ही घनरूप , द्रवरूप व वायुरूप असू शकतात . हायड्रोकार्बनांप्रमाणे त्यांची ही सजातीय श्रेणी असलेली संपृक्त व असंपृक्त , शृंखलायुक्त व वलयी संयुगे आहेत .
हायड्रोकार्बनांतील काही किंवा सर्व हायड्रोजन अणू फ्ल्युओरीन अणूने प्रतिष्ठापित केले असता मिळणा ऱ्या माध्यमिक संयुगांना ‘ फ्ल्युओरोहायड्रोकार्बने ’ असे म्हणतात . पूर्णपणे फ्ल्युओरोनीकरण केलेल्या संयुगसंचांना ‘ परफ्ल्युओरोकार्बने ’ असे म्हणतात व ज्या संयुगांच्या रेणूत फ्ल्युओरीन अणूंचे प्रमाण जास्त असते त्या संयुगांना ‘ पॉलिफ्ल्युओरोकार्बने ’ असे म्हणतात .
फ्ल्युओरीनीकरण पद्धती : (१ ) हायड्रोकार्बनाच्या विद्रावात फ्ल्युओरीन वायू सोडून उत्प्रेरकाच्या सान्निध्यात किंवा त्याच्याशिवाय विक्रिया घडवून . (२ ) फ्ल्युओरीन वायूपासून उच्च अकार्बनी फ्ल्युओराइड बनवून उदा . , CoF 3 , Ag2 F, MnF 3 , CeF 4 इ . व त्याच्यात तप्त अवस्थेत त्यावरून हायड्रोकार्बन पाठवून. (३ ) असंपृक्त ओलेफीन किंवा ॲसिटिलिनामध्ये हायड्रोजन फ्ल्युओराइडाचे समावेशन करून . (४ ) KF किंवा SbF5 च्या साहाय्याने कार्बनी संयुगांतील इतर हॅलोजनां च्या विनिमयाने . (५ ) ॲरोमॅटिक संयुगातील डायाझो गटाचे ( -N=N-) प्रतिष्ठापन करून किंवा (६ ) द्रवरूप हायड्रोजन फ्ल्युओराइडामधील विद्रावाचे विद्युत् विच्छेदन करून व त्यात निर्माण होणारा हॅलोजन प्लॅटिनम नलिकेमध्ये ७०० ° से . ला तापवून काढून टाकून [ ⟶ हॅलोजनीकरण ].
परफ्ल्युओरो ॲरोमॅटिक संयुगे तयार करण्याची एक सोपी पद्धत १९५९ साली शोधून काढण्यात आली . या पद्धतीत बेंझिनाचे ( C6H6) कोबाल्ट फ्ल्युओराइड पद्धतीने पूर्ण फ्ल्युओरीनीकरण करून परफ्ल्युओरो सायक्लोहेक्झेन ( C6F12) मिळते . हे संयुग तप्त लोखंडाच्या किंवा निकेलाच्या बारीक चूर्णावरून पाठविले म्हणजे सहा फ्ल्युओरीन अणू काढून टाकले जातात व हेक्झॅफ्ल्युओरॉबेंझीन ( C6F6) मिळते . बेंझिनाप्रमाणे हेक्झॅफ्ल्युओरोबेंझि ना पासून हजारो संयुगे तयार केली गेली आहेत . हेक्झॅफ्ल्युओरॉबेंझीन द्रवरूप असून ते अक्रिय , पेट न घेणारे , बिनविषारी परंतु प्रभावी शुद्धिहारक आहे . नॅप्थलिनाचीही फ्ल्युओरो संयुगे आहेत .
प्रशीतनक द्रव्ये [ ⟶ प्रशीतन ] म्हणून कार्बनी फ्ल्युओराइडे १९३० मध्ये उपयोगात येऊ लागली . १९३१ च्या सुरुवातीला डाय क्लो रोडायफ्ल्युओरोमिथेन CCI2F2 ( फ्रिऑन – १२ ) व ट्रायक्लोरोमोनोफ्ल्युओरोमिथेन CCI3F ( फ्रिऑन – १ १ ) यांचे प्रशीतनक द्रव्ये म्हणून व्यापारी उत्पादन सुरू झाले [ ⟶ फ्रिऑन ].
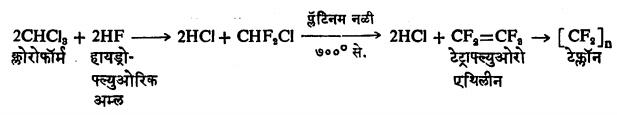
असंतृप्त फ्ल्युओरो संयुगांपासून रेझिने , प्लॅस्टिके तयार करण्यात ये ऊ लागली . प्रथम १९३८ मध्ये प्लंकेट यांनी टे फ्लॉ न शोधून काढले . आता ते क्लोरोफार्मापासून तयार करतात .
हे पॉलिटेट्राफ्ल्युओरो एथिलीन ( PTFE) आहे . हे एक पांढरे स्फटिकी व विलक्षण गुणधर्म असलेले बहुवारिक ( अनेक साध्या रेणूंच्या संयोगाने बनलेले जटिल रेणू असलेले संयुग ) आहे . याला पाणी किंवा तेल चिकटत नाही . सर्व रसायनांना ते विरोधक आहे . कोणत्याही विद्रावकाला ( विरघळविणा ऱ्या पदार्थाला ) शोषून घेत नाही आणि प्रारणरोधक ( तरंगरूपी ऊर्जेच्या परिणामाला रोध करणारे ) आहे .
त्याचे विद्युत् विषयक गुणधर्मही चांगले आहेत . त्या चा घर्षणांकही [ ⟶ घर्षण ] कमी आहे . यामुळे सुरक्षित वस्त ऱ्यां ची पाती , मोठाली ओझी ज्यांवरून सरकवायची आहेत अशा फरश्या , खाद्यपदार्थ भाजावयाचे तवे , स्वयंपाकाची भांडी इत्यादीवर झीजरोधक पातळ थर देण्याकरिता टेफ्लॉनाचा उपयोग होतो . यापेक्षाही महत्त्वाचा उपयोग म्हणजे जेथे जेथे कोरडे वंगण लागते तेथे ( उदा . , धारवे म्हणजे यंत्रातील फिरत्या भागांना देण्यात येणारे आधार बेअरिंगे ) याचा उपयोग होतो . PTFE रेझिने २०० ° ते २५० ° से . लादेखील चिवट व मजबूत राहतात . [ ⟶ प्लॅस्टिक व उच्च बहुवारिके ] .
CC I2 F 2 , CC I3 F, CHC I F2 , CC I F2 -CC I F2 आणि CCI2F-CCIF2 या संयुगांचेही व्यापारी प्रमाणावर उत्पादन करण्यात येते . याशिवाय (१ ) प्लॅस्टिके व प्रत्यास्थवारिके ( विकृती उत्पन्न कर णारी प्रेरणा काढून टाकल्यावर जवळजवळ मूळ आकार पुन्हा प्राप्त होणारी बहुवारिके ) बनविण्यासाठी CH2=CHF, CH2=CF2, CCIF=CF2 आणि CF3CF=CF2 यांचे मोठ्या प्रमाणावर उत्पादन होते . यांत्रिकी उद्योगात यंत्रांचे काही सुटे भाग फ्ल्युओरो प्लॅस्टिकांपासून तयार करण्यात येऊ लागले आहेत . (२ ) फ्ल्युओथेन ( CF3CHBrCI) हे शुद्धिहारक पुष्कळ वर्षे वापरात आहे . (३ ) ट्रायफ्ल्युओरोब्रोमोमिथेन ( CBrF3 ) व डायफ्ल्युओरो डायब्रोमोमिथेन ( CBr2F2) हे अग्निशामक म्हणून वापरतात . (४ ) क्लोरोट्रायफ्ल्युओरो एथिलीन , व्हिनिलिडीन फ्ल्युओराइड व हेक्झॅफ्ल्युओरोप्रोपिलीन यांच्यासारख्या एकवारिकाबरोबर फ्ल्युओरोकार्बनां चे सहवारिकीकरण केल्यास रबरासारखे गुणधर्म असलेली बहुवारिके मिळतात [ ⟶ बहुवारिकीकरण ] . ही बहुवारिके रसायने व उष्णता विरोधक आहेत . त्यांचे पेरॉक्साइडांनी संस्करण व अमाइनां नी व्हल्कनीकरण ( बहुवारिकातील साखळया रासायनिक विक्रियेने एकमेंकीना जोडून त्यांचे बल व स्थितीस्थापकता वाढविण्याची क्रिया ) करता येते . ती ऊष्माविरोधक झडपांना आवरण व झिरपरोधक म्हणून चांगली उपयोगात येतात . वाफाळणा ऱ्या नायट्रिक अम्लासारखी क्षरणकारी रसायने ठेवण्यासाठी यांचे अस्तर असलेली पात्रे वापरता येतात .
कार्बनी संयुगांप्रमाणे फ्ल्युओरिनाची असंख्य कार्बनी संयुगे तयार केली गेली आहेत . फ्ल्युओरोफॉर्म ( CHF 3 ) हा वर्णहीन व पेट न घेणारा वायू आहे . हा क्लोरोफॉर्मापासून फ्ल्युओरीनीकरणाने तयार करता येते . याला प्रचालक -२३ किंवा प्रशीतनक -२३ अशीही नावे आहेत . बीटाफ्ल्युओरो एथिल अल्कोहॉल ( CFH2 CH2 OH), डायफ्ल्युओरो एथिल व ट्रायफ्ल्युओरो एथिल अल्कोहॉले तयार केली आहेत . हेक्झॅफ्ल्युओरो ॲसिटोनही ( CF3·CO ·CF3 ) मिळतो .
मोनोफ्ल्युओरो ॲसिटिक अम्ल हे निसर्गात मिळते व संश्लेषणानेही तयार करता येते . दक्षिण आफ्रिकेतील गिफब्लाड या वनस्पतीच्या पानांपासून ते अलग करतात . ते उंदीर व इतर सस्तन प्राणी यांना विषारी आहे . याचे सोडियम लवण व मिथिल एस्टर व एथिल एस्टर ही विषारी द्रव्ये म्हणून वापरतात . मोनोफ्ल्युओरो ॲसिटिक अमाइड ( CH2F ·CO ·NH2 ) कीटकनाशक आहे . ट्रायफ्ल्युओरो ॲसिटिक अम्ल ( CF3 ·COOH) हे द्रवरूप असून कार्बनी संयुगाकरिता एक चांगला विद्रावक म्हणून उपयोगी पडते .
फ्ल्युओरोबेंझीन ( C6H5F) हे माध्यमिक ( उत्पादन करावयाच्या इष्ट संयुगाच्या अगोदरचे ) संयुगे आहे . त्यापासून कीटकनाशके तयार करतात . पेंटाफ्ल्युओरो फिनॉल ( C6F5OH) याचें अनुजात ( एका संयुगापासून तयार केलेली अन्य संयुगे ) कवकविरोधी ( बुरशीसारख्या हरितद्रव्यरहित वनस्पतींच्या वाढीस विरोध करणारे ) आहेत .
पेंटाफ्ल्युओरोटोल्यूइन ( C6F5CH3) , पेंटाफ्ल्युओरोॲनिलिन ( C6F5NH2) , पेंटाफ्ल्युओरोबेंझाल्डिहाइड ( C6F5CHO) , पेंटाफ्ल्युओरो बेंझोनायट्राइल ( C6F5CN ) , पेंटाफ्ल्युओरोबेंझॉइक अम्ल १ – फ्ल्युओरो नॅप्थॅलीन २ – फ्ल्युओरोपिरिडीन ( C5H4FN) यांसारखी विषमवलयी इ . अनेक प्रकारची संयुगे व त्यांचे अनुजात तयार केले गेले आहेत . पॅराफ्ल्युओरोॲनिलीन हे द्रवरूपमाध्यमिक संयुग म्हणून व कीटकनाशक म्हणून वापरतात . १ – फ्ल्युओरो – २ , ४ – डायनायट्रोबेंझीन हे विक्रियाकारक आहे .
उपयोग : फ्ल्युओरीन व त्याची संयुगे विविध प्रकारे उपयुक्त आहेत . फ्ल्युओरिनाची UF6 व SF6 ही संयुगे अतिशय उपयोगी ठरली आहेत . त्याचप्रमाणे पुष्कळशी संयुगे निरनिराळ्या व्यापारी उत्पादनां त उपयोगी पडतात .
फ्ल्युओरिनाचा किरणोत्सर्गी समस्थानिक F(18) अस्थिरोगचिकित्सेमध्ये उपयोगी पडतो . क्रायोलाइट व फ्ल्युओरस्पार धातुविज्ञानामध्ये तापमान खाली आणण्यासाठी अभिवाह म्हणून फार पूर्वीपासून वापरात आहेत . ॲल्यु मिनियम उत्पादनाकरिता संश्लेषित क्रायोलाइट तयार करण्यासाठी निर्जल हायड्रोजन फ्ल्युओराइड वापरतात . शिवाय त्याचा अगं ज ( स्टेनलेस ) पोलादाच्या उत्पादनात , तसेच वायुकलिली प्रचालक [ ⟶ वायुकलिल ] , फेस निर्माण करणारी द्रव्ये , स्वच्छतेकरिता वापरण्यात येणारी द्रव्ये , प्लॅस्टिके इ . कार्बनी संयुगे फ्ल्युओरीनीकरणने तयार करण्याकरिता उपयोग करण्यात येतो . औषधे व विशिष्ट रंजके यांच्या निर्मितीतही त्याचा वापर होतो . विविध रासायनिक विक्रियां त त्याचा उत्प्रेरक म्हणून उपयोग होतो .
फ्ल्युओरोकार्बनां चा उपयोग निरनिराळया उद्योगधंद्यांत वाढत्या प्रमाणावर होऊ लागला आहे . प्लॅस्टिके , चकाकी आणणारी पृष्ठक्रियाकारके , तेल व पाणी यांना विरोधक असल्याने वस्त्र उद्योगात अंतिम संस्करण प्रक्रियां त , निर्जल धुलाईत , मुलामा देण्याच्या उद्योगात , खळयुक्त कागद तयार करण्यासाठी , आवेष्टनासाठी लागणारे आर्द्र ता व बाष्परोधक आणि मजबूत कागद बनविण्यासाठी , पक्के रंग व निरनिराळी औषधे , तणनाशके , कीटकनाशके तयार करण्यासाठी , साधी व निर्जल वंगणे इ . विविध क्षेत्रांत फ्ल्युओरोकार्बनां चा उपयोग होतो .
फ्ल्युओरोकार्बनांचा एक महत्त्वाचा अनपेक्षित गुणधर्म म्हणजे ती रक्तापेक्षा अडीचपट ऑक्सिजन शोषून घेऊ शकतात . ५० मिलि . ऑक्सिजन १०० मिलि . फ्ल्युओरोकार्बनात विलय पावतो . या गुणधर्माचा उपयोग निरनिराळ्या फ्ल्युओरोकार्बनांची पायसे ( एकमेकांत न मिसळणा ऱ्या दोन द्रवांची मिश्रणे ) रक्ताऐवजी विशेषतः रक्त उपलब्ध नसेल किंवा रुग्णाला सोसवत नसेल अशा वेळी वापरण्याकरिता होऊ शकेल . काही फ्ल्युओरोकार्बने अशा तऱ्हेने वापरली असता प्राण्यांच्या शरीरातून कालांतराने नाहीशी होतात , तर काही यकृतामध्ये काही वर्षे घट्ट चिकटून राहतात पण त्यांचा अनिष्ट परिणाम होत नाही , असे काही प्राण्यां वर प्रयोग करून पाहिल्यावर दिसून आले आहे . फ्ल्युओरोडेकालिने आणि काही परफ्ल्युओरोईथरे औषधे म्हणून बरीच पुढे आलेली आहेत . फ्रिऑनांचा मोठा उपयोग प्रशीतनक द्रव्याशिवाय जंतुनाशक द्रव्यांचे , औषधांचे , सौंदर्यप्रसाधनां चे , सुवासिक द्रव्यांचे घरगुती किंवा औद्योगिक प्रमाणावर फवारे उडविण्याकरिता ( वायुकलिली प्रचालक म्हणून ) होतो .
वापरातील धोके व सुरक्षा उपाय : फ्ल्युओरीन व हायड्रोफ्ल्युओरिक अम्ल हे प्रक्षोभक व क्षरणकारक आहेत . त्यांच्यामुळे कातडीला भोके पडतात . त्यां चा वापर करताना निओप्रिनाचे संरक्षक कपडे , हातमोजे व मुखाच्छादन वापरावे लागते . यांच्यामुळे ज्या शरीर भागांना इजा झाली असेल ते पाण्याने चांगले धुवावेत व थंड ७० % अल्कोहॉलामध्ये अर्धा तास बुडवून ठेवावे किंवा थंड संपृक्त ( विद्रावातील प्रमाण कमाल असलेल्या ) मॅग्नेशियम सल्फेटामध्ये बुडवून ठेवावेत व दर दोन मिनिटांनी विद्राव बदलावा . मॅग्नेशियम ऑक्साइड व ग्लिसरीन यांची पेस्ट लावावी . श्वासाद्वारे हायड्रोफ्ल्युओरिक अम्ल गेले असेल , तर रुग्णाला १०० % ऑक्सिजनामध्ये ठेवावे व त्याला काही हालचाल करू देऊ नये . डोळ्यात गेल्यास डोळे पाण्याने स्वच्छ चांगले धुवावेत आणि तज्ञ डॉक्टरांच्याकडून त्वरित उपाय योजावेत .
फ्ल्युओरोकार्बनामुळे होणारे प्रदूषण : पृथ्वीभोवतील वातावरणातील स्थितांबरामध्ये (२१ ते २६ किमी . या उंचीच्या दरम्यानच्या भागामध्ये ) ओझोना चा थर असतो . त्यामुळे सू र्यापासून पृथ्वीवर येणा ऱ्या भेदक जंबुपार ( दृश्य वर्णपटातील जांभळ्या रं गाच्या पलीकडील अदृश्य ) प्रारणापासून जीवसृष्टीला संरक्षण मिळते . स्थितांबरामध्ये होणा ऱ्या रासायनिक प्रक्रिया ओझोना चा समतोल परस्पर सांभाळत असतात . फ्ल्युओरोकार्बने ही विमानात वायुकलिली प्रचालक म्हणून वापरली जातात व ती स्थितांबरामध्ये पोचू शकतात . तेथे ती ओझोनाचे अपघटन करून तेथील त्याचे प्रमाण कमी होईल आणि त्यामुळे जंबुपार प्रारण पृथ्वीवर पोचून वनस्पती व प्राणी यांना फार अपायकारक होईल , असे अनेक शास्त्रज्ञां चे मत आहे . २ , ८०० ते ३ , २०० Å ( Å म्हणजे अँगस्ट्रॉम एकक , १ अँगस्ट्रॉम =१० – १० मी .) तंरगलांबीचे जंबुपार प्रारण कातडीचा कर्करोग , अंधत्व , वनस्पती व प्राणी यांच्या पेशीं वर हानिकारक परिणाम इ. अनिष्ट गोष्टी घडवून आणू शकेल [ ⟶ जंबुपार प्रारण ] . या प्रदू षणाची चाहूल प्रथम जून १९७४ मध्ये लागली व तेव्हापासून शास्त्रज्ञां चे लक्ष ही आपत्ती कशी टाळावी याकडे लागले आहे .
अभिज्ञान : ( अस्तित्व ओळखणे ). फ्ल्युओराइडाच्या अभिज्ञानासाठी दिलेला नमुना पदा र्थ संहत ( विद्रावातील प्रमाण जास्त असलेल्या ) सल्फ्यूरिक अम्लाबरोबर शिशाच्या मुशीत तापवितात . जर पाण्याने ओली केलेली काचेची कांडी मुशीतून बाहेर पडणा ऱ्या वाफेत धरली , तर हायड्रोफ्ल्युओरिक अम्लाच्या उपस्थितीमुळे कांडी खडबडीत व तुषारित झाल्यासारखी होते . फ्ल्युओराइडां चे विद्राव कॅल्शियम क्लोराइडाच्या विद्रावाबरोबर कॅल्शियम फ्ल्युओराइडाचा पांढरा अवक्षेप ( न विरघळणारा साका ) देतात पण सिल्व्हर नायट्रेटाबरोबर अवक्षेप मिळत नाही आणि त्यामुळे इतर हॅलाइडांपासून फ्ल्युओरा इड वेगळे ओळखता येते .
मूलद्रव्य रू पातील फ्ल्युओरिनाचे विश्लेषण करण्यासाठी नमुना सोडियम फ्ल्युओरा इ डाच्या थरातून नेतात . या थरात हायड्रोजन फ्ल्युओराइड तसेच राहते . नंतर नमुना दाणेदार सोडियम क्लोराइडावरून नेतात . त्याची फ्ल्युओरिनाशी विक्रिया होऊन ति तक्या च राशीचा क्लोरीन मुक्त होतो . या क्लोरिनाचे क्लोराइडात रूपांतर करून क्लोरिनाचे प्रमाण ( व त्यावरून फ्ल्युओरिनाचे ) काढतात .
हवेतील किरणोत्सर्गी फ्ल्युओरिनाचे अल्प प्रमाण ओळखण्याच्या दोन पद्धती उपलब्ध आहेत . एका पध्दतीत क्रिप्टॉन (८५ ) या किरणोत्सर्गी समस्थानिकाचा उपयोग करतात आणि दुस ऱ्या पद्धतीत डायमिथिल अमाइनाबरोबर फ्ल्युओरिनाची विक्रिया होऊन तयार झालेल्या कार्बनी लवणामुळे निर्माण झालेल्या वायुकलिलाचे आयनीकरण कोठीने [ ⟶ कण अभिज्ञातक ] अभिज्ञान करण्यात येते .
पहा : फ्ल्युओराइट हॅलोजने .
संदर्भ : 1. Banks. R. E. Fluorocarbons and Their Derivatives, London, 1970.
2. Chambers, R. D. Fluorine in Organic Chemistry, New York, 1973.
3. Emeleus, H. J. The Chemistry , New York, 1971.
4. Hudlicky, M. Chemistry of Organic Fluorine Compounds, Oxford, 1962.
मिठारी , भू . चिं . घाटे , रा . वि .
“