जलसंयोग : पाण्याच्या रेणूचा, H2O या रूपात, दुसऱ्या रेणूशी किंवा आयनाशी (विद्युत् भारित अणू, अणुगट किंवा रेणू यांच्याशी) संयोग होण्याची क्रिया. या क्रियेने बनलेल्या संयुगांना हायड्रेटे किंवा सजल संयुगे म्हणतात.
कित्येक स्फटिकरूप संयुगे हायड्रेटे असतात. उदा., सामान्य तुरटी K2SO4·Al2(SO4)3·24H2O. कॉपर सल्फेट हे संयुग निर्जलरूपात पांढरे असते, पाण्यातून त्याचे स्फटिकीकरण केले म्हणजे गडद निळ्या रंगाचे स्फटिक मिळतात. त्यांची संघटना (रेणूमध्ये असणारे अणू व त्यांची संख्या दाखविणरे सूत्र) CuSO4·5H2O अशी आहे. याच्या व्यापारी रूपाला मोरचूद म्हणतात. अशाच प्रकारे सोडियम सल्फेटाचे Na2SO4·10H2O, फेरस सल्फेटाचे FeSO4·7H2O, सोडियम थायोसल्फेटाचे (हायपो) Na2S2O3·5H2O, ऑक्झॅलिक अम्लाचे (COOH)2·2H2O अशी सजल स्फटिकरूपे ज्ञात आहेत.
सजल स्फटिकातील पाण्यास स्वतःचा बाष्पदाब (बाष्प आणि पाणी समतोलावस्थेत असताना आढळणारा बाष्पाचा दाब) असतो. तो व सभोवतालच्या वातावरणातील पाण्याचा दाब सारखा असला, तर स्फटिकावर काही परिणाम होत नाही पण वातावरणाचा बाष्पदाब जास्त असेल, तर समतोल प्रस्थापित करण्यासाठी स्फटिक वातावरणातील पाणी ओढून घेतात आणि त्यात विरघळतात. MgCl2·6H2O हे अशा प्रकारे विरघळणाऱ्या स्फटिकाचे उदाहरण आहे. याच्या उलट स्फटिकाचा बाष्पदाब वातावरणाच्या बाष्पदाबापेक्षा जास्त असे, तर त्यातील स्फटिकजल बाहेर पडू पाहते व त्यामुळे स्फटिकाचा भुगा होतो. अशा स्फटिकांना फुलारणारे स्फटिक म्हणतात. सोडियम कार्बोनेटाचे, Na2CO3·10H2O या संघटनेचे, स्फटिक अशा तऱ्हेने – विशेषतः उन्हाळ्यात – फुलारतात. सजल स्फटिक तापविले किंवा त्यांवरील बाष्पदाब कमी केला म्हणजे त्यांमधील स्फटिकजल अंशतः किंवा संपूर्णपणे निघून जाते आणि अंशतः निर्जल किंवा संपूर्ण निर्जल संयुगे शिल्लक राहतात. जिप्सम या खनिजाचे संघटन CaSO4.2H2O असे आहे. ते १००–११०० से. तापमानास तापविले, तर त्यामधील ३/४ जलांश निघून जातो व (CaSO4)2·H2O हे संयुग बनते, यालाच प्लॅस्टर ऑफ पॅरिस असे म्हणतात. यामध्ये पाणी मिसळले म्हणजे उलट क्रिया होते व पुन्हा जिप्सम बनते. ही क्रिया होताना त्याचे तापमान आणि आकारमान किंचित वाढते व ते कठीणही होते. या गुणधर्मांमुळेच त्याचा उपयोग वस्तू बनविण्याचे साचे करण्यासाठी आणि मोडलेले हाड सांधले जात असता न हालता जागच्या जागी स्थिर रहावे म्हणून लेपन करण्यासाठी केला जाते.
जी संयुगे सुलभतेने जलसंयोग करू शकतात त्यांचा उपयोग निर्जलकारक (पदार्थ कोरडा करणारा) म्हणून करता येतो.
पाणी जलसंयोग करू शकते याचे कारण त्याचा रेणू द्विध्रुवी (एका बाजूस धन व दुसऱ्या बाजूस ऋण विद्युत् भार असलेला) आहे आणि त्यामधील ऑक्सिजनाचा अणू आपली इलेक्ट्रॉन जोडी दुसऱ्या अणूबरोबर समाइकपणे वापरून (सहसंबद्ध बंधाने) संयोग पावू शकतो, हे होय.
कॉपर सल्फेट पेंटा हायड्रेट (CuSO4·5H2O) या संयुगाच्या रेणूत, तसेच त्याच्या जलीय विद्रावात पाण्याचे चार रेणू क्यूप्रिक आयनाशी (Cu++) सहसंबद्ध बंधाने जोडले गेले असून जटिल (गुंतागुंतीचा) आयन तयार झालेला असतो. पाचवा जलरेणू हायड्रोजन बंधाने सल्फेट आयनाशी संबद्ध असावा.
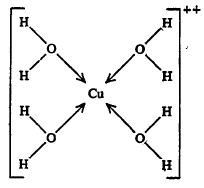 स्फटिक जलाचे रेणू आयनांशीच संबद्ध असले पाहिजेत असे नाही. काही ठिकाणी ते स्फटिक-जालकात विवक्षित ठिकाणी स्थित असतात. उदा., तुरटी.
स्फटिक जलाचे रेणू आयनांशीच संबद्ध असले पाहिजेत असे नाही. काही ठिकाणी ते स्फटिक-जालकात विवक्षित ठिकाणी स्थित असतात. उदा., तुरटी.
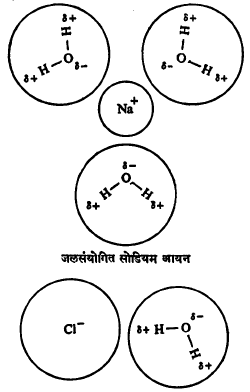
आयनी पदार्थ (ज्यांच्यापासून धन व ऋण विद्युत् भार असलेले अणू अथवा अणुगट मिळू शकतात अशी संयुगे) पाण्यात विरघळतात याचे स्पष्टीकरण जलसंयोगाने करता येते. आयनी पदार्थांचा जेव्हा पाण्याशी संपर्क येतो तेव्हा त्याच्या घनरूपातील आयनांभोवती पाण्याचे रेणू जमतात आणि धन आयनांसमोर आपली ऋण विद्युत् भारित बाजू आणि ऋण आयनांसमोर धन विद्युत् भारित बाजू उभी करतात. त्यामुळे आयनी पदार्थांतील आयनांचे परस्परांमधील आकर्षण घटते आणि आयन पाण्यात उतरून त्यांचा विद्राव बनतो. विद्रावामध्ये असलेल्या आयनांच्या सभोवार अनेक जलरेणू स्थिर विद्युती आकर्षणाने उपस्थित होऊन जलसंयोग सिद्ध होतो. उदा., मीठ पाण्यात विरघळले म्हणजे त्यातील Na+ व Cl– हे आयन खाली दाखविल्याप्रमाणे जलसंयोगरूपाने राहतात.
 हायड्रोक्लोरिक (HCl) इ. अम्लांचा अम्लधर्म ते कोरड्या बेंझिनामध्ये विरघळविले तर दिसून येत नाही परंतु ते पाण्यात विरघळविले म्हणजे प्रकट होतो याचे कारण जलसंयोग हे आहे. पाण्याच्या रेणूला प्रोटॉनाबद्दल (H+) असलेल्या आकर्षणामुळे हायड्रोक्लोरिक अम्ल पाण्यात विरघळविले म्हणजे त्यातील प्रोटॉनांबरोबर पाणी संयोग पावते त्यामुळे (H3O)+ आयन तयार होतात. हे आयन म्हणजेच जलसंयोगित प्रोटॉन होत. यांच्याच अस्तित्वामुळे अम्लत्व प्रकट होते. कोरड्या बेंझिनासारखा अध्रुवी विद्रावक (विरघळविणारा पदार्थ) असेल, तर हे शक्य होत नाही व त्यामुळे त्यात केलेले विद्राव अम्लधर्म दाखवीत नाहीत.
हायड्रोक्लोरिक (HCl) इ. अम्लांचा अम्लधर्म ते कोरड्या बेंझिनामध्ये विरघळविले तर दिसून येत नाही परंतु ते पाण्यात विरघळविले म्हणजे प्रकट होतो याचे कारण जलसंयोग हे आहे. पाण्याच्या रेणूला प्रोटॉनाबद्दल (H+) असलेल्या आकर्षणामुळे हायड्रोक्लोरिक अम्ल पाण्यात विरघळविले म्हणजे त्यातील प्रोटॉनांबरोबर पाणी संयोग पावते त्यामुळे (H3O)+ आयन तयार होतात. हे आयन म्हणजेच जलसंयोगित प्रोटॉन होत. यांच्याच अस्तित्वामुळे अम्लत्व प्रकट होते. कोरड्या बेंझिनासारखा अध्रुवी विद्रावक (विरघळविणारा पदार्थ) असेल, तर हे शक्य होत नाही व त्यामुळे त्यात केलेले विद्राव अम्लधर्म दाखवीत नाहीत.
औद्योगिक रसायनशास्त्रातील काही प्रक्रिया जलसंयोगामुळेच घडून येतात. उदा., एथिलिनापासून अम्लाच्या उपस्थितीत विक्रिया घडवून एथिल अल्कोहॉल बनविण्याची पद्धत.
क्लोरल (CCl3CHO) या द्रवरूप संयुगापासून पाण्याच्या क्रियेने पाण्याचा एक रेणू सामावून घेतलेले एक स्फटिकी संयुग–क्लोरल हायड्रेट –मिळते. तथापि ते बरेच स्थिर आहे. तापविल्यास ते विघटन न पावता प्रथम वितळते. यामुळे ते जलसंयुग आहे किंवा नाही याबद्दल एकमत नाही.
पहा : जलीय विच्छेदन.
दीक्षित, व. चिं.
“