ऑक्साइडे : ऑक्सिजन व इतर एखादे मूलद्रव्य यांच्या द्वि–अंगी (दोन घटक असलेल्या) संयुगाला ऑक्साइड म्हणतात.
बंधाच्या प्रकारास अनुसरून त्यांचे पुढील गट पडतात :
(१)आयनी ऑक्साइडे : यांच्यात धातुजालकावर आधारलेले O2–धातूंचे ऋणायन (धन विद्युत् भारित अणू) असतात. उदा., क्षार (अल्कली) धातूंची M2Oव क्षारीय मृत्तिकांची MOऑक्साइडे (येथे M= धातू. उदा,. सोडियम Na).
(२) सहसंयुजी ऑक्साइडे:यांच्या रेणूतील अणू सहसंयुजी (दोन अणूंत इलेक्ट्रॉनांची भागीदारी असणाऱ्या) बंधाने जोडलेले असतात. उदा. , SO2, P4O10, CO2, SiO2.
(३) मध्यस्थित ऑक्साइडे : यांचे बंध पूर्णपणे आयनी नाहीत व पूर्णपणे सहसंयुजीही नाहीत, अशा स्वरूपाचे असतात. उदा., AS4O6, Sb4O6, SeO2, TeO2, SnO, PbO.
रासायनिक लक्षणास अनुसरून ऑक्साइडांचे पुढील गट पडतात :
(१) अम्लीय ऑक्साइडे : यांची व क्षारकांची विक्रिया होऊन लवणे तयार होतात. ही सामान्यतः कमी विद्युत् घनता असलेल्या (संयुजी इलेक्ट्रॉन निघून जाण्याची व धन विद्युत् भार वाढविण्याची प्रवृत्ती असलेल्या) मूलद्रव्यांपासून झालेली व सहसंयुजी असतात. यांपैकी पाण्यात विरघळू शकणाऱ्या ऑक्साइडांपासून अम्ले तयार होतात. उदा., CO2, SO2, SO3, P4O10, P4O6, N2O4, CrO3, Mn2O7, SiO2.
(२) क्षारकीय ऑक्साइडे : यांची व अम्लांची विक्रिया होऊन फक्त लवणे व पाणी मिळते. यांतील बंध सामान्यतः आयनी पण कित्येकांतील बरेचसे बंध सहसंयुजीही असू शकतात. पाण्यात विरघळू शकणाऱ्यांपासून क्षार तयार होतात. उदा., Na2O, MgO, CaO, CuO, NiO.
(३) उभयधर्मी ऑक्साइडे : अम्ले व क्षार या दोहोंशीही यांची विक्रिया होते व लवणे तयार होतात. त्यांच्यात काही आयनी व काही सहसंयुजी अशा दोन्ही प्रकारचे बंध असतात. उदा. PbO (आयनी), As4O6(सहसंयुजी).
(४) उदासीन ऑक्साइडे : ही अम्लीय नसतात व क्षारकीयही नसतात. इतर कोणत्याही गटात त्यांचा समावेश करता येत नाही. उदा., H2O, N2O, NO, CO.
(५) संयुक्त ऑक्साइडे : दोन साध्या ऑक्साइडांच्या मिश्रणासारखे यांचे वर्तन असते. उदा., Pb3O4, (PbO2, 2PbO) Fe3O4 (Fe2O3, FeO).
(६) पेरॉक्साइडे : थंड पाण्याशी किंवा थंड खनिज अम्लाशी यांची विक्रिया होऊन हायड्रोजन पेरॉक्साइड (H2O2) मिळते. ही हायड्रोजन पेरॉक्साइडाची लवणे असून त्यांच्यात O22-आयन असतात. उदा. Na2O2, Ba2O2, काही ऑक्साइडांना (उदा., NO2, PbO2). पेरॉक्साइड हे नाव चुकीने दिले गेले आहे.
(७) सुपर ऑक्साइडे : यांच्यात O2-आयन असतात व त्यांच्यावर थंड पाणी किंवा थंड विरल अम्लांची विक्रिया केल्याने हायड्रोजन पेरॉक्साइड व ऑक्सिजन ही मिळतात. उदा., Na2O, K2O.
(८) उच्चतर ऑक्साइडे : एखाद्या मूलद्रव्याच्या ऑक्सिडीभवनाच्या सामान्य अवस्थेपेक्षा उच्चतर अवस्थेतील ऑक्साइडांना उच्चतर ऑक्साइडे म्हणतात.पण ती पेरॉक्साइडे नाहीत कारण विरल अम्लाने त्यांपासून हायड्रोजन पेरॉक्साइड मिळत नाही. उदा.,Pbo2, Mno2 यांच्यातील बरेचसे बंध सहसंयुजी असतात.
(९) नीचतर ऑक्साइडे :एखाद्या मूलद्रव्याच्या सामान्य ऑक्साइडापेक्षा कमी प्रमाणात ऑक्सिजन असणारी ऑक्साइडे . उदा., Pb2O, C3O2.
एखाद्या मूलद्रव्याचा व ऑक्सिजनाचा २:३ या प्रमाणात संयोग होऊन तयार झालेल्या ऑक्साइडांना सेस्क्वी ऑक्साइडे म्हणतात. उदा.,Cr2O3, Mn2O3, Pb2O3, Al2O3.पण त्यांचा विशिष्ट लक्षणे असणारा गट होत नाही.
ऑक्साइडे तयार करण्याच्या रीती : (१) मूलद्रव्य व ऑक्सिजन यांचा सरळ संयोग घडवून, उदा., 2Ca+O2=2 CaO,किंवा मूलद्रव्यावर एखाद्या ऑक्सिडीकारकाची विक्रिया करून उदा.,
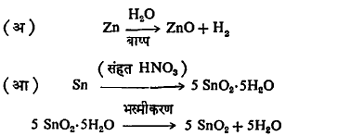
(२) रासायनिक संयुगांच्या तप्त अपघटनाने (घटक पदार्थ सुटे होण्याने), उदा.,
CaCO3 → CaO2+CO2.
संदर्भ : Abbot, D., Inorganic Chemistry, London 1965.
ठाकूर, अ. ना.
“