सायट्रिक अम्ल : (C6H8O7). एक साधे हायड्रॉक्सिट्रायकार्बॉक्सिलिक अम्ल. याची रासायनिक संरचना (रेणूतील अणूंची मांडणी दाखविणारी रचना) पुढीलप्रमाणे आहे.
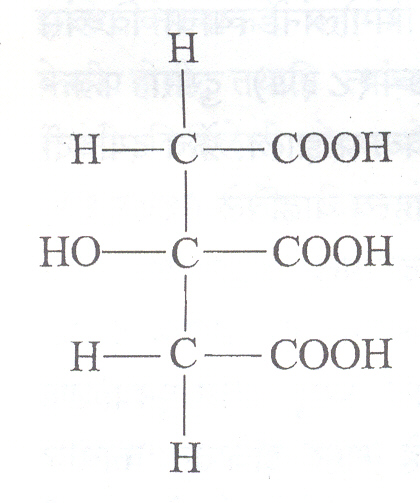 या अम्लास β– हायड्रॉक्सिट्रायकार्बॉलिलिक अम्ल किंवा २– हायड्रॉक्सिप्रोपेन–१, २, ३– ट्रायकार्बॉक्सिलिक अम्ल असेही म्हणतात. हे अम्ल निर्जल व सजल या दोन्ही अवस्थांमध्ये आढळते. सजल अम्लात पाण्याचा एक रेणू असतो (C6H8O7.H2O). सोडियम, कॅल्शियम, पोटॅशियम, डाय-अमोनियम, फेरिक अमोनियम इत्यादींबरोबरची याची लवणे व्यापारी दृष्ट्या महत्त्वाची आहेत. सायट्रिक अम्ल व त्याची लवणे अल्पविषाक्त, हाताळण्यास सोपी आणि सहजसुलभ जैव अपघटनशील असल्यामुळे मोठ्या प्रमाणात वापरली जातात.
या अम्लास β– हायड्रॉक्सिट्रायकार्बॉलिलिक अम्ल किंवा २– हायड्रॉक्सिप्रोपेन–१, २, ३– ट्रायकार्बॉक्सिलिक अम्ल असेही म्हणतात. हे अम्ल निर्जल व सजल या दोन्ही अवस्थांमध्ये आढळते. सजल अम्लात पाण्याचा एक रेणू असतो (C6H8O7.H2O). सोडियम, कॅल्शियम, पोटॅशियम, डाय-अमोनियम, फेरिक अमोनियम इत्यादींबरोबरची याची लवणे व्यापारी दृष्ट्या महत्त्वाची आहेत. सायट्रिक अम्ल व त्याची लवणे अल्पविषाक्त, हाताळण्यास सोपी आणि सहजसुलभ जैव अपघटनशील असल्यामुळे मोठ्या प्रमाणात वापरली जातात.
आढळ : सायट्रिक अम्ल लिंबू, ईडलिंबू, महाळुंग, संत्रे, मोसंबी, अननस इ. लिंबू वर्गीय फळांमध्ये मोठ्या प्रमाणात आढळते. हे अम्ल प्राण्यांची ऊतके(समान रचना व कार्य असलेले कोशिका समूह) व द्रायूंमध्ये (द्रव किंवा वायू यांमध्ये) मुक्त अम्ल किंवा सायट्रेट आयनांच्या स्वरूपात आढळते. सायट्रिक अम्ल विविध फळे, भाजीपाला इत्यादींमध्ये प्रतिशत प्रमाणात पुढीलप्रमाणे असते: लिंबाच्या रसामध्ये ४–८ संत्र्याच्या रसामध्ये ०·६–१·० द्राक्ष रसात १·२–२·१ स्ट्रॉबेरी ०·६६–०·८२ काळा आंचू १·१–१·३ बेदाणे १·५–३·० मनुका ०·७–१·४ गूजबेरी ०·९८–०·९९ टोमॅटो ०·२५ कोबी ०·०५–०·०७ मका ०·०२ वांगे ०·०१ डाळिंब ०·०५ गाईचे दूध ०·०८–०·२३ मानवी दूध ०·३५–१·२५ कोंबडीचे मांस ०·००१–०·०७. सजीवांमध्ये चयापचयक्रियेत (शरीरात सतत घडत असणाऱ्या भौतिक व रासायनिक घडामोडींत) क्रेब्ज चक्राद्वारे कार्बोहायड्रेटे, वसा आणि प्रथिने यांचे कार्बन डाय-ऑक्साइड व पाणी यांमध्ये रूपांतर होत असताना सायट्रिक अम्ल हा एक घटक पदार्थ तयार होतो.
गुणधर्म : सायट्रिक अम्लाचे स्फटिक रंगहीन, अर्धपारदर्शक व समचतुर्भुजी आकाराचे असतात. कोरड्या हवेत यातील स्फटिकजल सावकाश उडून जाते. हे अम्ल प्रकाशीय दृष्ट्या निष्क्रिय आहे. ते दाब विद्युत् परिणाम दाखवीत नाही. सायट्रिक अम्लाचा रेणुभार १९२·१३ आणि वितळबिंदू 153°से. आहे. त्याची विद्राव्यता (ग्रॅ. प्रती १०० मिलि., 25° से.ला)पुढीलप्रमाणे आहे: पाणी १८१, एथॅनॉल ५९ व ईथर ०·७५.
उत्पादन : पहिल्या महायुद्घाच्या काळापर्यंत सायट्रिक अम्ल हे लिंबू वर्गीय फळांच्या निष्कर्षणापासून तयार केले जात होते. आता ते व्यापारी दृष्ट्या किण्वन (आंबविण्याची) क्रिया वापरून तयार करतात. या प्रक्रियेमध्ये बुरशी (ॲस्परजिलस नायगर)किंवा यीस्ट (किण्व कँडिडा ग्विलिअरमोडी) यांच्याद्वारे सॅकॅरीन, सुक्रोज, साखरकारखान्यातील मळी, एंझाइमयुक्त स्टार्च आणि साधी पॅराफिने यांसारख्या पदार्थांचे किण्वन घडवून आणले जाते. या विक्रियेतून सायट्रिक अम्ल विद्रावक निष्कर्षण किंवा कॅल्शियम सायट्रेट अवक्षेपणाने तयार करतात. कॅल्शियम सायट्रेटाची सल्फ्यूरिक अम्लाबरोबर विक्रिया केल्यानंतर सायट्रिक अम्ल व कॅल्शियम सल्फेट तयार होते. गालन पद्घतीने कॅल्शियम सल्फेट काढून घेतात आणि सायट्रिक अम्लाचे शुद्घीकरण करतात. उष्ण (संक्रमण तापमान ३६·६° से. पेक्षा जास्त) जलीय विद्रावापासून स्फटिकीभवनाने निर्जल, तर थंड विद्रावापासून सजल सायट्रिक अम्ल मिळते.
उपयोग : खाद्यपदार्थ तसेच औषधांमध्ये सायट्रिक अम्ल अन्नपरिरक्षक व स्वादकारक म्हणून वापरले जाते. जेली, मुरंबे व मद्य यांना स्वाद आणण्यासाठी आणि सरबतासारखी पेये तयार करण्यासाठी ह्या अम्लाचा उपयोग करतात. खाद्यपदार्थ व औषधांमधील ⇨ पीएच मूल्याचे नियंत्रण करण्याकरिता आणि त्यांमधील लेश धातूंचे ग्राभ तयार करण्याकरिता सायट्रिक अम्ल वापरतात. त्याचा रुधिर क्लथनरोधक (रक्त गोठण्याविरुद्घचे द्रव्य) म्हणूनही वापर केला जातो.
सायट्रिक अम्लामध्ये अत्यल्प विषाक्तता, अक्षारकता आणि जैवअपघटनशीलता हे गुणधर्म असल्याने प्रबल खनिज अम्लांवर विविध रासायनिक विक्रिया करण्यासाठी त्याचा उपयोग करतात. त्यांमध्ये बाष्पित्र, अणुकेंद्रीय विक्रियक, उष्णता विनिमयक यांमधील आयर्न व कॉपर ऑक्साइडांचे थर काढणे, काँक्रीट जमिनीवर अम्लकोरण करणे इत्यादींचा समावेश होतो. तसेच कापड उद्योगांमध्ये सायट्रिक अम्ल टिटॅनियम डाय-ऑक्साइड राळ्याच्या स्थिरीकरणास प्रतिरोध करणारे विसरक आणि विलगीकारक व पीएच मूल्य नियंत्रक म्हणून वापरले जाते.
लवणे: सायट्रिक अम्ल त्रिक्षारकीय असल्यामुळे ते विविध अम्ले व उदासीन लवणे तयार करू शकते. ⇨ उभयप्रतिरोधी विद्राव म्हणून पीएच मूल्याची त्याची व्याप्ती मोठी असते. ट्रायसोडियम सायट्रेट (डायहायड्रेट आणि निर्जल), ट्रायपोटॅशियम सायट्रेट (मोनोहायड्रेट), कॅल्शियम सायट्रेट (टेट्राहायड्रेट), डाय – अमोनियमसायट्रेट (निर्जल) आणि फेरिक अमोनियम सायट्रेट ही सायट्रिक अम्लाची सहज उपलब्ध होणारी व्यापारी दृष्ट्या महत्त्वाची लवणे आहेत.
मोठ्या प्रमाणावर वापरल्या जाणाऱ्या ट्रायसोडियम सायट्रेट या डायहायड्रेटाचे स्फटिक पांढरे किंवा कणीदार असतात. प्रकियित चीज उत्पादांमध्ये वसेचे विलगीकरण रोखण्यासाठी, प्रवाहितता आणण्यासाठी आणि योग्य लवचिकपणा असलेले काप (वड्या) बनविण्यासाठी हे ‘पायसीकारक’ [⟶ पायस] म्हणून वापरले जाते. दुग्धशालेतील उत्पादनांमध्ये (उदा., आईसक्रीम, उकळविलेले दूध इत्यादींमध्ये)हे ‘स्थिरकारी’ आणि ‘श्यानतानियंत्रक’ पदार्थ म्हणून वापरतात. उच्च अम्लता असलेल्या मादक पेयांचा कडकपणा (तीव्रता) वाढविण्यासाठी त्यामध्ये सोडियम सायट्रेट मिसळतात. जॅम व जेली, जिलेटिनयुक्त भोजनोत्तर उपाहार आणि विविध प्रकारच्या औषधनिर्मितीकरिता उभयप्रतिरोधी विद्राव म्हणून सोडियम सायट्रेट वापरतात. सोडियम सायट्रेटाचा रुधिर क्लथनरोधक म्हणूनही वापर केला जातो. हे जलद रीतीने जैवअपघटनशील, पर्यावरणीय दृष्ट्या स्वीकारार्ह आणि कॅल्शियम, मॅग्नेशियम व इतर धातू आयनांबरोबर ग्राभ तयार करीत असल्यामुळे ⇨ प्रक्षालके तयार करण्यासाठी औद्योगिक दृष्ट्या मोठ्या प्रमाणावर वापरले जाते. सोडियम सायट्रेटाचा वापर जलानुकूलक द्रव्य (वॉटर कंडिशनर) व सिमेंट आळण्याची गती मंद करणारे द्रव्य तर उभयप्रतिरोधी आणि खराराक्रियाकारक (खरवडण्याची क्रिया करणारा) म्हणून अनेक वायूंच्या मिश्रणातून सल्फरडाय-ऑक्साइड काढून घेण्यासाठी वापरतात. डायहायड्रेट स्वरूपातील लवणे कमी किंमतीत उपलब्ध असल्यामुळे विशेषेकरून तीच जास्त प्रमाणात उपयोगात आणतात. अपवादात्मक परिस्थितीत निर्जल लवणांचा वापर केला जातो.
पोटॅशियम सायट्रेट पांढरे, कणीदार स्फटिकमय व चूर्णरूपी लवण असून ते हवेतील आर्द्रता शोषून घेते. ज्या ठिकाणी सोडियम आयन वापरणे धोकादायक व अनिष्ट असेल, त्या ठिकाणी सोडियम सायट्रेटाऐवजी पोटॅशियम सायट्रेट हा पर्यायी पदार्थ वापरतात. कॅल्शियम सायट्रेट (स्थिर व पांढरे चूर्ण) कॅल्शियमाचा मुख्य स्रोत व पोषणयुक्त आहारात मूलभूत घटक म्हणून वापरतात. फेरिक अमोनियम सायट्रेट हे लोह, अमोनिया आणि सायट्रिक अम्लापासून तयार झालेले एक जटिल लवण आहे. १४·५–१६% लोह असलेले लवण हिरवे आणि १४·५– १८·५% लोह असलेले लवण तपकिरी रंगात असते. ही दोन्ही लवणे सतत हवेतील आर्द्रता शोषून घेत असतात. त्यांवर प्रकाशाचा परिणाम होतो. ही लवणे अन्नामध्ये आणि औषधांचा पाक व अर्क यांमध्ये लोहाचा पोषक स्रोत म्हणून वापरतात. डाय-अमोनियम सायट्रेट हे पांढरे व स्थिर चूर्ण असून ते धातू स्वच्छ करण्यासाठी वापरतात.
पहा: उभयप्रतिरोधी विद्राव पायस पीएच मूल्य.
संदर्भ : 1. National Research Council, Comp., Food Chemicals Codex, IVth Ed., 1996.
2. Pfizer Chemical Division, Comp., Technical Literature : Citric Acid and Citrates, 1978.
दीक्षित, रा. ज्ञा.
“