ईथर – १ : (रसायनशास्त्र). जेव्हा कार्बन, हायड्रोजन व ऑक्सिजन असणाऱ्या संयुगाची संरचना R – O – R अशी असते, तेव्हा त्याला ईथर म्हणतात. यातील R यागटात सामान्यत: अल्कोहॉल किंवा फिनॉल यांचे अनुजात (साध्या विक्रियेने बनणारी संयुगे) असतात. दोन्ही R गट एकसारखे असतात, तेव्हा त्यांना साधी किंवा सममित (घटक रेणूंनी एकसारखी व नियमितपणे मांडणी असणारी संरचना) व वेगवेगळे असतात तेव्हा त्यांना मिश्र किंवा असममित ईथरे म्हणतात. १८५१ मध्ये विल्यमसन यांनी सर्व ईथरांची संरचना R – O – R अशी असते, असे सिद्ध केले. ईथर ही संज्ञा aither म्हणजे हवा या ग्रीक शब्दावरून घेतलेली आहे. यातील काही संयुगे बाष्पनशील असतात.
ईथरामधील हायड्रोकार्बनी गटांच्या नावावरून साध्या ईथरांचे नामकरण करतात. उदा., CH3.O.CH3 साधे मिथिल ईथर किंवा डायमिथिल ईथर. मिश्र ईथरांना हायड्रोकार्बनी अनुजात किंवा संमिश्र ईथरे म्हणून ओळखतात. उदा., CH3.O.CH2.CH2.CH3 मिथिल प्रोपिल ईथर किंवा १—मिथॉक्सि—प्रोपेन.
गुणधर्म : सामान्यत: ईथरे ही गोड वासाची, तिखट चवीची व वर्णहीन द्रव्ये असतात. त्यांचे विशिष्ट गुरुत्व (वि. गु.) एकापेक्षा कमी असते. ती पाण्यात फारच कमी विद्राव्य व कार्बनी विद्रावकांत (विरघळविणाऱ्या पदार्थांत) सहज विद्राव्य असतात.ईथरे उत्कृष्ट विद्रावके आहेत. काही ईथरे गुंगी आणणारी असतात. त्यांचे क्वथनबिंदू (उकळबिंदू) व वि. गु. वाढत्या रेणुभाराबरोबर वाढत जाते. निरनिराळ्या कार्बनी संयुगांबरोबर विक्रिया होऊन स्थिर क्वथनबिंदू असणारी मिश्रणे तयार होतात. जेव्हा मिश्र द्रवांचा क्वथनबिंदू त्यांच्यातील शुद्ध द्रवांपेक्षा कमी व स्थिर असून दोन्ही द्रव एकत्रितपणे ऊर्ध्वपातित (तापविल्याने प्रथम बाष्परूप व नंतर थंड केल्याने परत द्रवरूप) होतात, तेव्हा त्या क्वथनबिंदूला स्थिर क्वथनबिंदू म्हणतात.
ईथरे रासायनिक दृष्टीने अक्रिय (विक्रिया होण्याची प्रवृत्ती नसलेली) असतात. क्षार (अल्कली) धातूंची (उदा., सोडियम, पोटॅशिअम इ.) व क्षारांची त्यांच्यावर विक्रिया होत नाही. हवेत पुष्कळ वेळा उघडी राहिली तर ईथरांचे स्वयंस्फूर्त ऑक्सिडीभवन [→ ऑक्सिडीभवन] होऊन स्फोटक पेरॉक्साइडमध्ये रूपांतर होते. प्रबल ऑक्सिडीकरण करताना ईथरांच्या रेणूचे अपघटन (मोठ्या रेणूचे लहान तुकडे होणे) होते, तथापि द्विबंधाच्या अगर मुक्त, प्राथमिक किंवा द्वितीयक अल्कोहॉल गटांच्या [→ अल्कोहॉल]ऑक्सिडीकरणात ईथर गट अक्रिय राहतो. हायड्रोक्लोरिक किंवा नायट्रिक अम्लांसारखी अकार्बनी अम्ले, ॲसिल हॅलाइडे, फॉस्फरस पेंटाक्लोराइड यांनी एक किंवा दोन्हीही ऑक्सिजन बंध तोडले जातात.
ॲल्युमिनाच्या (Al2O3)सान्निध्यात ईथरे उष्णतेने अपघटित होऊन त्यापासून ओलेफिने, पाणी व इतर पदार्थ मिळतात. हायड्रोक्लोरिक किंवा इतर प्रबल अकार्बनी अम्लांबरोबर [R 2OH]+X – या सूत्राची ऑक्झोनियमासारखी समावेशन (इतर अणू अथवा अणुगट सामावणारी) संयुगे बनतात. थंड प्रबल सल्फ्यूरिक अम्लात ऑक्झोनियम संयुगे विद्राव्य असल्यामुळे ऑक्झोनियम सल्फेट बनते. या विक्रियेमुळे ईथरे ही पॅराफिने, हायड्रोकार्बने व अल्किल हॅलाइडे ह्यांहून वेगळी असतात, हे सिद्ध होते व त्यामुळे ती त्यांच्यापासून निराळी करता येतात. सल्फ्यूरिक अम्लात विरघळलेली ईथरे त्या मिश्रणात पाणी घालून परत मिळविता येतात. ईथरांचे जलीय विच्छेदन (पाण्यामुळे विघटन होणे) टाळण्यासाठी तो विद्राव बर्फावर ओतावा लागतो.
अकार्बनी हॅलाइडांबरोबर, ईथरांची जटिल विद्राव्य संयुगे बनतात. पॅराफीन हायड्रोकार्बनांपेक्षा ईथरांच्या हायड्रोकार्बन गटांचे क्लोरिनीकरण किंवा ब्रोमिनीकरण [→ हॅलोजनीकरण] लवकर होते.
ईथर तयार करण्याच्या महत्त्वाच्या पद्धती : (१) अल्कोहॉलाचे निर्जलीकरण : सामान्यत: अल्कोहॉलांचे निर्जलीकरण सल्फ्यूरिक अम्लाच्या साहाय्याने करून ईथर मिळवितात. ही विक्रिया २-३ टप्प्यांनी होते असे मानले जाते. या पद्धतीने एथिल ईथरासारख्या हलक्या ईथरांचे औद्योगिक उत्पादन केले जाते. प्रोपिल ईथरापेक्षा जास्त कार्बन अणू असलेल्या ईथरांचे उत्पादन या पद्धतीने समाधानकारक होत नाही, कारण उच्च अल्कोहॉले, द्वितीयक व तृतीयक अल्कोहॉले यांचे खनिज अम्लांमुळे जलद निर्जलीकरण होऊन ओलेफिने तयार होतात. अल्कोहॉलांच्या निर्जलीकरणासाठी सल्फ्यूरिक अम्लाव्यतिरिक्त फॉस्फोरिक अम्ल, बोरिक अम्ल, हायड्रोक्लोरिक अम्ल आणि फॉस्फरस पेंटाक्लोराईड हे उत्प्रेरक (विक्रियेत भाग न घेता विक्रियेची गती वाढविणारे पदार्थ) म्हणून वापरतात.
(२) विल्यमसन यांची ईथर संश्लेषण पद्धती : हायड्रोकार्बनांचे हॅलोजन अनुजात व सोडियम अल्कोहॉलेट यांच्या विक्रियेमुळे ईथर बनते. या पद्धतीने साधी किंवा मिश्र ईथरे बनविता येतात. क्षारीय सेल्युलोज आणि एथिल क्लोराइड अथवा अल्किल हॅलाइड यांच्यापासून या पद्धतीने एथिल सेल्युलोज व इतर सेल्युलोज ईथरांचे औद्योगिक उत्पादन करतात. निर्जल सोडियम अल्कोहॉलेट तयार करण्यासाठी सोडियम नॅप्थॅलीन वापरल्यास उच्च प्रतीचे ईथर मिळते. फिनॉलिक ईथरासाठी डाय-अल्किलसल्फेट वापरतात. क्षाराच्या सान्निध्यात किंवा क्षाराव्यतिरिक्त अल्कोहॉल व अल्किल हॅलाइड यांच्यापासून साधी अगर मिश्र ईथरे तयार होतात.
(३) तृतीयक ओलेफिनांची अल्कोहॉलबरोबर विक्रिया करून ईथरे बनवितात. एक अल्किल गट असलेली तृतीयक मिश्र ईथरे, आयसो-ब्युटिलिनासारख्या ओलेफिनाची अल्कोहॉलाबरोबर सल्फ्यूरिक अम्लाच्या सान्निध्यात विक्रिया करून बनवितात.
उपयोग : ईथरांचा उपयोग निष्कर्षण (द्रव मिश्रणातून आवश्यक द्रव वेगळा करण्याच्या) पद्धतीत व पाण्याने विरल झालेल्या कार्बन अम्लांची सांद्रता वाढविण्यासाठी करतात. ईथरांचा मुख्य उपयोग उद्योगधंद्यात व प्रयोगशाळेत विशेषत: तेल, मेद, मेण व हायड्रोकार्बन यांच्याकरिता विद्रावक म्हणून करतात.
विशेष महत्त्वाच्या ईथरांची माहिती खाली दिली आहे:
आयसो-प्रोपिल ईथर : सूत्र (CH3)2 .CHOH.(CH3)2यालाच डाय-आयसो-प्रोपिल ईथर किंवा २-आयसो-प्रोपॉक्सिप्रोपेन असेही म्हणतात. हे वर्णहीन, साधारण बाष्पनशील (बाष्पाच्या स्वरूपात उडून जाणारे) व ज्वालाग्राही द्रव असून त्याला ईथराचा विशिष्ट वास असतो. त्याचा रेणुभार १०२·११ आहे. द्रवांक (वितळबिंदू) -६८·०२०से. क्वथनबिंदू ६८·४७० से. हे २०० से. तापमानाला पाण्यात वजनी ०·९४% विद्राव्य असते, पण पाणी आयसो-प्रोपिल ईथरामध्ये वजनी ०·५५% विद्राव्य असते. याचे सर्व गुणधर्म ईथरांच्या सर्वसामान्य गुणधर्मांसारखेच आहेत.
याचे औद्योगिक उत्पादन पुढील प्रमाणे करतात : (१) सल्फ्यूरिक अम्लाच्या साहाय्याने आयसो-प्रोपिल अल्कोहॉलचे निर्जलीकरण करून व (२) प्रोपिलीन व सल्फ्यूरिक अम्ल यांच्यापासून आयसो-प्रोपिल अल्कोहॉल तयार करताना हे उपपदार्थ म्हणून मिळते.
आयसो-प्रोपिल ईथर ज्वालाग्राही असल्याने त्याची हाताळणी फारच दक्षतेने करावी लागते. प्रत्येक पिंप व पेटी, त्याचप्रमाणे ज्यातून वाहतूक करतात त्यावर इंटरनॅशनल कॉमर्स कमिशनच्या नियमाप्रमाणे ‘ज्वालाग्राही’ म्हणून खूण असलीच पाहिजे असा दंडक आहे. ह्याने होणारे शुद्धीहरण एथिल ईथरापेक्षा कमी तीव्रतेचे असते व बऱ्याच उशीराने होते. हे वापरताना आरोग्यरक्षणासाठी व आग टाळण्यासाठी वायुवीजनाची (हवा खेळती रहाण्याची) सोय असली पाहिजे.
याचा उपयोग औद्योगिक विद्रावक म्हणून आणि प्रोपिलिनाच्या व लॅकराच्या उत्पादनासाठी तसेच रेझीन व रबर धंद्यांतही करतात.
गाळकर, ना. तु.
मिथिल ईथर : सूत्र CH3.O.CH3. दुसरी नावे डायमिथिल ईथर, मिथिल ऑक्साइड व वुड ईथर. रेणुभार ४६·०७ रंगहीन वायू द्रवांक १३८·५० से. क्वथनबिंदू – २३·६५० से. द्रवाचे वि. गु. ०·६६१ (२०० से. ला). याचा उपयोग प्रशीतक (पदार्थ थंड ठेवणारे माध्यम), विद्रावक व विक्रिया माध्यम म्हणून व निष्कर्षणासाठी करतात. हे २२·५ किग्रॅ. दाबाच्या सिलिंडरामध्ये बाजारात उपलब्ध असून वाहतुकीसाठी त्यावर ‘ज्वालाग्राही’म्हणून खूण लावणे आवश्यक असते.
एथिल ईथर : सूत्र C2H5.O.C2H5. यालाच एथॉक्सि-एथेन ईथर, डाय-एथिल ईथर, एथिल ऑक्साइड किंवा नुसते ईथर असेही म्हणतात.ईथर गटापैकी अत्यंत महत्वाचे संयुग. सल्फ्यूरिक अम्ल व अल्कोहॉल यांपासून एथिल ईथर बनविता येते, हे तेराव्या शतकात माहीत होते. बेसिल व्हॅलेन्टाईन व व्हॅलेरियस कार्डस यांनी त्याच्या उत्पादनाचे व गुणधर्मांचे वर्णन केलेले आहे. १७३० पर्यंत यालाच सल्फ्यूरिक ईथर असे संबोधित असत. १८०० च्या सुमारास त्यात गंधकाचा अंश नाही, हे सिद्ध केले गेले.
गुणधर्म : रंगहीन, बाष्पनशील, शीघ्र ज्वालाग्राही, गोड व झोंबणाऱ्या वासाचा द्रव रेणुभार ७४·०८ गोठणबिंदू -११७·४° से. क्वथनबिंदू ३४·६° से.एथिल ईथर २०° से. तापमानाला पाण्यात वजनी ६·८% विद्राव्य असते, तर पाणी एथिल ईथरामध्ये वजनी १·२% विद्राव्य असते. एथिल अल्कोहॉल तेल व इतर कार्बनी विद्रावकांत सर्व प्रमाणात विरघळते.
एथिल ईथर सामान्यत: अक्रिय असते, तथापि त्याच्या काही विक्रिया महत्त्वाच्या आहेत. हवा व प्रकाश यांच्या सान्निध्यात उघडे राहिले, तर त्याचे अबाष्पनशील पेरॉक्साइडात आपोआप रूपांतर होते. ही विक्रिया थांबविली नाही, तर पेरॉक्साइड स्फोटक असल्यामुळे धोका उद्भवतो. ईथरामधील पाणी काढून टाकण्यासाठी त्याचे ऊर्ध्वपातन करताना ते निघून जाते, पण पेरॉक्साइडाचा अवशेष राहतो व त्याचा जोरदार स्फोट होतो. पेरॉक्साइडामुळे छातीला अपाय होतो. त्यामुळे शुद्धीहारक म्हणून ज्याचा उपयोग करावयाचा आहे अशा एथिल ईथरामध्ये ते नसणे अत्यंत आवश्यक असते.
जोरदार ऑक्सिडीकरणाने एथिल ईथराचे अपघटन होते. तांबे व प्लॅटिनमाची काळी पूड या उत्प्रेरकांच्या सान्निध्यात ईथराची वाफ व हवा यांच्या विक्रियेने १००° से. ला ॲसिटाल्डिहाइड व फॉर्माल्डिहाइड बनते. क्रोमिक ॲनहायड्राइड (Cr2O3) किंवा नायट्रिक अम्ल याने त्याचे ऑक्सिडीकरण होऊन ॲसिटिक अम्ल बनते. शुद्ध नायट्रिक अम्लाबरोबर त्याची विक्रिया इतकी जोरदार असते की, त्यामुळे स्फोट होतो. अकार्बनी अम्लाने एथिल ईथराचे अपघटन होते. हॅलाइडांबरोबर त्याची समावेशक संयुगे बनतात. त्या ईथरामधील एथिल गट क्लोरीन किंवा ब्रोमीन यांकडून प्रतिष्ठापित केले जातात (एका अणुगटाच्या जागी दुसरा अणू किंवा अणुगट विक्रियेद्वारे येणे).
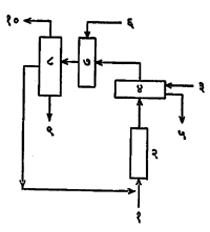
उत्पादन : (१) सल्फ्यूरिक अम्लाने एथिल अल्कोहॉलाचे सतत निर्जलीकरण करून एथिल ईथर बनते. ही पद्धती बौले (१८०९) यांनी प्रथम वर्णन केलेली आढळते. नंतर ती प्रमाणभूत होऊन बारबेट प्रक्रिया म्हणून ओळखली गेली. या प्रक्रियेत ६६° बाऊमे एकक (विशिष्ट गुरुत्वाचे एक एकक) असलेल्या, आकार मानाने ९५% सल्फ्यूरिक अम्लाच्या दहा रेणुभारास, एथिल अल्कोहॉलाचे बारा रेणुभार या प्रमाणात गंज प्रतिरोधक भांड्यात मिसळतात. नंतर त्याचे तापमान १४०° से. पर्यंत वाढवतात. विक्रियकात (विक्रिया घडवून आणण्याच्या उपकरणात) अम्ल व अल्कोहॉल बाष्प यांचे मिश्रण एकत्र करतात. विक्रियकातून बाहेर पडलेले ईथर, अल्कोहॉल व पाणी यांची वाफ क्षारीय खरारा स्तंभातून (बाष्प वा वायू यांच्या मिश्रणातून एक किंवा अनेक घटक वेगळे करणाऱ्या स्तंभातून) नेतात. यामुळे सल्फरडाय-ऑक्साइड व सल्फ्यूरिक अम्ल निराळी केली जातात. नंतर उदासीन वाफ विभाजक (वेगळी करणाऱ्या) स्तंभातून नेल्यावर सर्व घटक निरनिराळे केले जातात व पाणी तळातून बाहेर काढतात. ईथर व पाणीमिश्रित अल्कोहॉल स्तंभाच्या वरच्या भागातून काढून, त्यांचे संघनन (द्रवात रूपांतर) करून बाष्पित्रामधून (बॉयलरामधून) परत विक्रियकात नेतात. थोडे पाणी असलेले व किंचित अल्कोहॉल असलेले ईथर वरून बाहेर काढतात. प्रथम क्षारीय परमँगॅनेट द्रवाशी ईथराची विक्रिया करून नंतर कॅल्शियम क्लोराइडाच्या साहाय्याने निर्जलीकरण करून ऊर्ध्वपातनाने शुद्ध करतात किंवा विभाजक स्तंभाच्या साहाय्याने भौतिकीय पद्धतीने ते शुद्ध करतात. सल्फ्यूरिक अम्लाऐवजी बेंझॉइक अम्लही वापरले जाते.
(२) एथिलिनापासून एथिल अल्कोहॉल तयार करण्याच्या सल्फ्यूरिक अम्ल प्रक्रियेत एथिल ईथर उपपदार्थ म्हणून मिळते. या पद्धतीत सुधारणा केल्यास ईथर व अल्कोहॉल या दोहोंचे उत्पादन करता येते.
खनिज तेलातील हायड्रोकार्बनांचे भंजन [खनिज तेलाच्या जड ऊर्ध्वपतितांचे भौतिक पद्धतीने रूपांतर करून हलक्या पदार्थांचे अधिक उत्पादन करण्याची क्रिया, → खनिज तेल] करून मिळालेल्या एथिलिनाचे सल्फ्यूरिक अम्लात साधारण उच्च दाब व नियंत्रित तापमानाला शोषण करून एथिल हायड्रोजन सल्फेट व डाय-एथिल सल्फेट यांचे मिश्रण मिळते. हे मिश्रण विक्रिया पात्रात नेतात. त्या मिश्रणातून हायड्रोकार्बनापासून फक्त ६६% सल्फ्यूरिक अम्ल मुक्त होईल इतकेच पाणी मिसळतात. विक्रियापात्रातील मिश्रणाचे तापमान १२५° से. राखले जाते. मिश्रण तेथे सामान्यत: तीन तासांपर्यंत असते. तापमान जास्त असेल, तर वेळ कमी लागतो. दाब विशिष्ट मर्यादेपर्यंत राखतात. ईथर, अल्कोहॉल, पाणी, सल्फ्यूरिक अम्ल व एथिल सल्फेट यांचे प्रमाण व विक्रियेचा समतोल राखणे हे महत्त्वाचे काम असते. हे मिश्रण विक्रियापात्रातून कषायपात्रात (अर्क काढण्याच्या भांड्यात) नेताना, मुक्त होणाऱ्या हायड्रोकार्बनाच्या ५०% सल्फ्यूरिक अम्लाची सांद्रता सतत राहील इतक्या प्रमाणात पाणी पुरवतात. नंतर ते मिश्रण सामान्य दाबापेक्षा किंचित जास्त दाबात अतितप्त वाफेने त्यातील सल्फ्यूरिक अम्ल निराळे करतात. नंतरते १०% दाहक सोड्याच्या विद्रावातून नेल्याने सल्फर डाय-ऑक्साइड व सल्फ्यूरिक अम्ल यांचा अवशेष काढून टाकून राहिलेल्या ईथराचे संघनन करतात. साठवण्यापूर्वी द्रवरूप व वायुरूप ईथर निराळे करतात.
शेवटी ईथर, अल्कोहॉल व पाणी यांच्या निरनिराळ्या क्वथनबिंदूंचा उपयोग करून त्यांच्या मिश्रणातील अंश विशिष्ट प्रकारचे मनोरे व व पाणी यांच्या साहाय्याने अलग करतात. ईथर मनोऱ्यात ईथर निराळे होते. ईथरामधील अल्कोहॉल निराळे करण्यासाठी प्रथम ते पाण्यातून नेतात व त्यानंतर क्षारीय परमँगॅनेटाच्या विद्रावातून नेतात. या प्रक्रियेनंतर ईथरामधील राहिलेला पाण्याचा अवशेष निर्जलीकरण मनोऱ्यातून नेऊन काढून टाकतात. नंतर हे शुष्क ईथर आणखी एका मनोऱ्यातून नेऊन अतिशुद्ध ईथर मिळविले जाते.
श्रेणी व विनिर्देश : एथिल ईथराच्या विक्रियाकारक, शुद्धीहारक, शुद्ध सांद्र इ. निरनिराळ्या श्रेणी ठरविण्यात आल्या आहेत. ईथराच्या उपयोगावर व ग्राहकाच्या गरजेवर त्याचा विनिर्देश (विशिष्ट अपेक्षित गुणधर्म) अवलंबून असतो.
हाताळण्याची पद्धती : इंटरनॅशनल कॉमर्स कमिशनच्या नियमानुसार एथिल ईथराला ज्वालाग्राही द्रव मानण्यात येते. म्हणून या ईथराची हाताळणी विशिष्ट पद्धतीनेच करावी लागते. अतिबाष्पनशील, नीच स्वयंस्फोट तापमान व स्थिर विद्युत् भार निर्माण होण्याची शक्यता या गुणधर्मांमुळे त्याचा स्फोट होण्याचा धोका असतो. ईथराची हाताळणी करणारी हत्यारे, टाक्या वगैरे ठिणगी उत्पन्न करणार नाहीत अशी असावी लागतात. ईथर कमी विषारी असले तरी त्यापासून आग लागणे व स्फोट होणे हे मोठे धोके असतात. आतड्यात व फुफ्फुसात ते झटकन जसेच्या तसेच विक्रिया न होता भिनले जाते, म्हणून उद्योगधंद्यात वापरण्यापूर्वी त्यात पेरॉक्साइड नाही याची खात्री करून घेणे अत्यंत आवश्यक असते.
उपयोग : रंजकद्रव्ये, सुवासिक द्रव्ये, डिंक, मेणे, तेले, रेझिने, अल्कलॉइडे इ. कार्बनी पदार्थांसाठी विद्रावक म्हणून तसेच वैद्यकशास्त्रात शुद्धीहारक म्हणून याचा उपयोग करतात. एथिल ईथर व एथिल अल्कोहॉल यांचे मिश्रण नायट्रोसेल्युलोजासाठी उत्तम विद्रावक आहे. एथिल अल्कोहॉल पिण्यास अयोग्य करण्यासाठी त्यात एथिल ईथर मिसळतात. यांशिवाय औषधनिर्मिती, रंग, चर्मोद्योग इ. उद्योगांत त्याचा उपयोग करण्यात येतो.
 यालाच ऑक्सिरान किंवा एथिलिन डाय-ऑक्साइड असेही म्हणतात. वलयी ईथराचे उत्पादन प्रबल पोटॅशियम किंवा कॅल्शियम हायड्रॉक्साइडाचा विद्राव व एथिलीन क्लोरोहायड्रिनाच्या ऊर्ध्वपातनाने करतात. याचे औद्योगिक उत्पादन एथिलीन व हवा यांचे मिश्रण, दाबाखाली व २००°–४००° से. तापमानात चांदीच्या उत्प्रेरकावरून जाऊ देऊन करतात.
यालाच ऑक्सिरान किंवा एथिलिन डाय-ऑक्साइड असेही म्हणतात. वलयी ईथराचे उत्पादन प्रबल पोटॅशियम किंवा कॅल्शियम हायड्रॉक्साइडाचा विद्राव व एथिलीन क्लोरोहायड्रिनाच्या ऊर्ध्वपातनाने करतात. याचे औद्योगिक उत्पादन एथिलीन व हवा यांचे मिश्रण, दाबाखाली व २००°–४००° से. तापमानात चांदीच्या उत्प्रेरकावरून जाऊ देऊन करतात.

वर्णहीन वायू किंवा गतिशील द्रव क्वथनबिंदू १०·७° से. पाणी, अल्कोहॉल व एथिल ईथर यांमध्ये विद्राव्य त्याच्या जलीय विद्रावाचे मंद गतीने ग्लायकॉलामध्ये रूपांतर होते, सौम्य हायड्रोक्लोरिक अम्लाने जलद रूपांतर होते. कीटकनाशक म्हणून व प्रयोगशाळेतील संश्लेषणात त्याचा उपयोग होतो.
बेंझिल ईथर : सूत्र C6H5CH2OCH2C6H5. रंगहीन तेलकट द्रव क्वथनबिंदू २९५–२९८° से. द्रवांक ४·५०से. प्रज्वलनबिंदू (ज्या तापमानाला पदार्थ पेट घेतो ते तापमान) १३५° से. आर्द्र हवेत हळूहळू अपघटन पावते व बेंझाल्डिहाइड तयार होते. पाण्यात अविद्राव्य, पण अल्कोहॉल व एथिल ईथरानमध्ये सहज विद्राव्य.
बेंझिल अल्कोहॉलाचे निर्जलीकरण करून ७०% बेंझिल ईथर मिळते. तसेच बेंझिल क्लोराइड व पोटॅशियम हायड्रॉक्साइड यांची २००° से. वर विक्रिया करून व बेंझाल्डिहाइडाचे क्षपणात्मक हायड्रोजनीकरण [ऑक्सिजन काढून हायड्रोजन घालण्याची क्रिया, → हायड्रोजनीकरण] करूनही बेंझिल ईथर बनवितात.
सेल्युलोज ॲसिटेट व नायट्रोसेल्युलोज यांसाठी प्लॅस्टिसायझर (प्लॅस्टिक पदार्थाची लवचिकता इ. गुणधर्म सुधारण्यासाठी त्यात मिसळण्यात येणारा पदार्थ) म्हणून डिंक, रेझिने, रबरे, मेणे यांसाठी विद्रावक म्हणून सुवासिक द्रव्यांच्या धंद्यात विद्रावक म्हणून बेंझिल ईथर व झिंक ऑक्साइड यांचे क्रीम, मलम, पायस (एकमेकांत न मिसळणाऱ्या दोन द्रवांचे मिश्रण) किंवा चूर्ण स्वरूपातील मिश्रण माशा, डास इ. कीटकांच्या नाशासाठी वापरतात.
मिठारी, भू. चिं.
संदर्भ : 1. Fieser, L. F.; Fieser, M. Organic Chemistry, Bombay, 1962.
2. Finar, I. L. Organic Chemistry, London, 1962.