घन अवस्था रसायनशास्त्र : साधारणपणे १९४५ सालानंतर भौतिक शास्त्रज्ञ पदार्थाच्या घन अवस्थेचा अभ्यास एका निराळ्या व विशिष्ट दृष्टिकोनातून करीत आले आहेत. या अभ्यासात काही नवीन कल्पनांचा उदय झाला व त्यामुळे घन अवस्था भौतिकी आणि घन अवस्था रसायनशास्त्र अशा दोन नव्या शाखा निर्माण झाल्या. या दोन्ही शाखांचा विकास एकमेकींस पूरक ठरत आहे.
पदार्थ घन अवस्थेत असताना त्यातील घटक आयन (विद्युत् भारित अणू, रेणू वा अणुगट), अणू किंवा रेणू भूमितीय आकारांत तीन स्वतंत्र दिशांना रचले गेलेले असतात म्हणजे घन अवस्थेतील पदार्थ त्रिमितीय असतात. पदार्थ घन अवस्थेत असताना, त्याच्या ठिकाणी दृढता असते. पदार्थावर दाब दिला अथवा ताण दिला, तर ही गोष्ट लक्षात येते. घन पदार्थाचे अणू, रेणू अथवा आयन ज्या रीतीने एकमेकांशी जोडले गेले असतील त्यावर त्यांचे गुणधर्म अवलंबून असतात. या घटकांच्या आदर्श रचनेत काही कारणामुळे बदल झाला, तर त्या धन पदार्थाच्या गुणधर्मांतही बदल होतो.
पदार्थाच्या घन अवस्थेचा अभ्यास करताना काही नव्या वस्तुस्थिती आढळून आल्या आहेत. त्या पुढीलप्रमाणे आहेत : (१) रिक्तस्थाने, (२) स्थानभ्रंश आणि (३) धन भारित पोकळ्या.
वरील वस्तुस्थितींच्या आधारे घन अवस्था रसायनशास्त्रात संरचनात्मक, रासायनिक आणि विक्रियाशीलतेसंबंधी अनेक गुणधर्मांचा प्रामुख्याने विचार केला जातो. स्फटिक-स्थानभ्रंश-रसायनशास्त्र, आयनी स्फटिकातील (आयनांच्या जालकाने तयार झालेल्या स्फटिकातील) जालक परिणाम, घन पदार्थावर होणारी प्रकाशाची विक्रिया, घन पदार्थाचा पृष्ठभाग, त्याची अर्धसंवाहकता (धातू व निरोधक यांच्या दरम्यान असणारी विद्युत् संवाहकता) व चुंबकीय रसायनशास्त्र, बाष्प, द्रव आणि घन अवस्थांमधून होणारे स्फटिकांचे न्यष्टीयन (एखाद्या कणाभोवती स्फटिक तयार होणे), घन विक्रियांची वर्गीकरण पद्धती, घन अवस्थेतील मॉसबावर परिणाम इ. विषयांचा समावेश या अभ्यासात सामान्यतः होतो. अकार्बनी घन अवस्था रसायनशास्त्र, कार्बनी घन अवस्था रसायनशास्त्र आणि घन अवस्थेचे विद्युत् रसायनशास्त्र या घन अवस्था रसायनशास्त्राच्या तीन उपशाखा आहेत व त्यांचीही प्रगती होत आहे. त्यामुळे रसायनशास्त्राच्या अभ्यासात अधिकाधिक अचूकपणा येत आहे. घन अवस्था भौतिकीमध्ये उपयोगात आणल्या जाणाऱ्या अनेक आधुनिक तंत्रांचा उपयोग रसायनशास्त्राच्या अभ्यासात करण्यात येऊ लागला आहे.
ज्या रासायनिक विक्रिया बहुविध अवस्थेत चालू असतात त्यांचा विचार त्रिमितीय विक्रिया म्हणून होणे जरूर आहे. यापूर्वी रासायनिक विक्रियांबद्दल असा सर्वंकष विशाल दृष्टिकोन नव्हता. उदा., रसायनशास्त्रातील उत्प्रेरण (विक्रिया होताना ज्याच्यात कायम स्वरूपाचा रासायनिक बदल होत नाही अशा पदार्थाच्या साहाय्याने विक्रियेची गती वाढविण्याच्या किंवा कमी करण्याच्या) विक्रिया कशा घडतात याचे रसायनशास्त्राच्या दृष्टिकोणातून जे एक विशिष्ट चित्र असते, त्यात प्रामुख्याने विक्रिया घडण्याचे स्थान म्हणून पात्राच्या पृष्ठभागावरील एका रेणूच्या जाडीइतका पातळ थरच फक्त उत्प्रेरणा विक्रिया घडवून आणण्यात भाग घेतो, या कल्पनेच्या आधारेच विचार केला जात असे. पृष्ठभागावरील थराच्या बाबतीत असलेली द्विमितीय चित्राची मूळ कल्पना लँगम्यूर या शास्त्राज्ञांची आहे. घन अवस्था रसायनशास्त्राने या चित्राची व्याप्ती वाढवून उत्प्रेरण विक्रियेचे स्वरूप त्रिमितीय आहे, असे प्रतिपादन केले.
घन पदार्थांची संरचना : घन अवस्था रसायनशास्त्रात कोणत्या दृष्टीने घन पदार्थांचा अभ्यास केला जातो, हे वर सांगितले आहेच. घन पदार्थांची संरचना समजून घ्यावयाची झाल्यास प्रथम एखाद्या विद्युत् संयुजी (आयनांनी बनलेल्या) लवणाचे उदाहरण घेणे सोईचे होईल. अशा घन पदार्थांत एकाणुक (एकाच अणूचे बनलेले) ऋणायन (विद्रावातून विद्युत् प्रवाह वाहू दिला असता ऋण अग्राकडे जाणारे धन भारित आयन) व धनायन (धन अग्राकडे जाणारे ऋण भारित आयन) आलटून पालटून ओळीने रचलेले असतात. ऋणायनाच्या
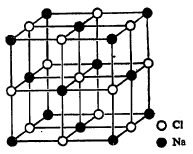 भोवती धनायन व धनायनाच्या भोवती ऋणायन असतात. क्षारीय धातूंच्या (पोटॅशियम, सोडियम इत्यादींच्या हॅलाइडांची (क्लोराइड, ब्रोमाइड इत्यादींची) संरचना अशी असते. हे सर्व ऋणायन अथवा धनायन सरळ रेषेत उभे आडवे, आलटून पालटून असतात. म्हणून हॅलाइडांची स्फटिकी संरचना एखाद्या जाळीप्रमाणे असते. उदा., सोडियम क्लोराइडाच्या स्फटिकी संरचनेत प्रत्येक सोडियम आयनाभोवती (Na+) सहा क्लोराइड आयन (Cl–) असतात आणि एकूण संरचना घनाकृती असते त्याचप्रमाणे क्षारीय मृत्तिका धातूंची (बेरियम, कॅल्शियम, स्ट्राँशियम यांची) ऑक्साइडे व सल्फाइडे, काही मिश्रधातू, तसेच इतर काही नाइट्राइडे व कार्बाइडे यांची संरचनाही घनाकृती असते व त्यांतील अणू आलटून पालटून स्थिरावलेले असतात. सिझियम क्लोराइड, सिझियम ब्रोमाइड व सिझियम आयोडाइड यांची संरचना मात्र थोडी निराळी असते. त्यांचे स्फटिक घनाकृती असले, तरी त्यांमध्ये शरीरकेंद्रित (घनाकृतीच्या कोपऱ्यांवर व मध्यभागी अणू असलेली) आयनी संरचना असते. सिझियम या क्षारीय धातूच्या हॅलाइडांखेरीज इतर सर्व क्षारीय हॅलाइडांची आयनी संरचना घनाकृती असते.
भोवती धनायन व धनायनाच्या भोवती ऋणायन असतात. क्षारीय धातूंच्या (पोटॅशियम, सोडियम इत्यादींच्या हॅलाइडांची (क्लोराइड, ब्रोमाइड इत्यादींची) संरचना अशी असते. हे सर्व ऋणायन अथवा धनायन सरळ रेषेत उभे आडवे, आलटून पालटून असतात. म्हणून हॅलाइडांची स्फटिकी संरचना एखाद्या जाळीप्रमाणे असते. उदा., सोडियम क्लोराइडाच्या स्फटिकी संरचनेत प्रत्येक सोडियम आयनाभोवती (Na+) सहा क्लोराइड आयन (Cl–) असतात आणि एकूण संरचना घनाकृती असते त्याचप्रमाणे क्षारीय मृत्तिका धातूंची (बेरियम, कॅल्शियम, स्ट्राँशियम यांची) ऑक्साइडे व सल्फाइडे, काही मिश्रधातू, तसेच इतर काही नाइट्राइडे व कार्बाइडे यांची संरचनाही घनाकृती असते व त्यांतील अणू आलटून पालटून स्थिरावलेले असतात. सिझियम क्लोराइड, सिझियम ब्रोमाइड व सिझियम आयोडाइड यांची संरचना मात्र थोडी निराळी असते. त्यांचे स्फटिक घनाकृती असले, तरी त्यांमध्ये शरीरकेंद्रित (घनाकृतीच्या कोपऱ्यांवर व मध्यभागी अणू असलेली) आयनी संरचना असते. सिझियम या क्षारीय धातूच्या हॅलाइडांखेरीज इतर सर्व क्षारीय हॅलाइडांची आयनी संरचना घनाकृती असते.
साधे आयनी घन पदार्थ : धनायन आणि ऋणायन यांच्या आलटून पालटून होणाऱ्या त्रिमितीय मांडणीमुळे साध्या विद्युत् संयुजी लवणांचे गुणधर्म निर्माण होतात. ऋणायन व धनायन यांच्या निकट अस्तित्वामुळे त्यांच्यात स्थिर विद्युती आकर्षण निर्माण होते व त्यामुळे स्थिर घटकी स्फटिक निर्माण होतात. या आयनांना एकमेकांपासून दूर करावयाचे झाल्यास बरीच ऊर्जा खर्च करावी लागेल. साहजिकच अशा लवणांचे वितळबिंदू उच्च असतात. त्यांच्या ठिकाणी कठीणपणा जास्त असतो कारण दोनही आयन व त्यांचे इलेक्ट्रॉन यांचे वास्तव्य ठराविक क्षेत्रात असते. आदर्श स्थितीत हे स्फटिक विद्युत् निरोधक असतात. त्यांच्या ठिकाणी आढळणारा आणखी एक गुण म्हणजे ठिसूळपणा होय व त्याचा खुलासा पुढीलप्रमाणे करता येतो. स्फटिक जालकात शेजारशेजारच्या अणूंमध्ये असमतोल असल्यास कर्तन प्रेरणेमुळे (जी प्रेरणा एखाद्या प्रतलास लावल्यास ते प्रतल शेजारच्या प्रतलावरून घसरते अशा प्रेरणेमुळे) समजात आयन एकमेकांजवळ येतील. त्यामुळे त्यांच्यात प्रतिसारण (दूर सारण्याची क्रिया) होऊन दौर्बल्य निर्माण होईल. अशा प्रकारच्या स्थितिजन्य दुर्बलतेमुळे पदार्थ ठिसूळ बनतात.
विद्युत् संयुजी पदार्थांच्या स्फटिक संरचनेची संपूर्ण निश्चिती झाल्यामुळे एकमेकांशेजारच्या धन-ऋण आयनांमधील अंतरही निश्चित करता येते. धन आणि ऋण आयनांत ठराविक अंतर असेपर्यंतच आकर्षण प्रेरणा कार्य करील. या कार्याची प्रेरणा आयनांवरील विरुद्ध विद्युत् भार हीच राहील. परंतु अणुमध्याबाहेरील इलेक्ट्रॉनांवरील सम विद्युत् भारामुळे ही गती थांबेल. या स्थितीत दोन आयनांमधील अंतर हे त्यांच्या त्रिज्येच्या बेरजेइतके असेल. अशा प्रकारे आयनांवरून लाइनस पॉलिंग यांनी निश्चित केलेल्या स्फटिक त्रिज्या कोष्टक क्र. १ मध्ये दिल्या आहेत. काही पदार्थांचे स्फटिक केवळ आयनी नसतात. अशा स्फटिकांच्या त्रिज्यांची लांबीही अशा प्रकारे काढणे शक्य असते. कारण अशा प्रकारच्या मापनवरून दोन अणुमध्यांमधील अंतर माहीत होते परंतु त्याचे आयनधर्म निश्चित होत नाहीत.
|
कोष्टक क्रं.१. काही आयनांच्या स्फटिक त्रिज्या (अँगस्ट्रॉममध्ये, १ अँगस्ट्रॉम = १०–८ सेंमी.). |
|||||
|
+१ |
+२ |
+३ |
+४ |
-३ |
-२ |
|
Li |
Be |
B |
C |
N |
O |
|
०·६० |
०·३१ |
०·२० |
०·१५ |
१·७१ |
१·४० |
|
Na |
Mg |
Al |
Si |
P |
S |
|
०·९५ |
०·६५ |
०·५० |
०·४१ |
२·१२ |
१·८४ |
|
K |
Ca |
Ga |
Ge |
As |
Se |
|
१·३३ |
०·९९ |
०·६२ |
०·५३ |
२·२२ |
१·९८ |
|
Rb |
Sr |
In |
Sn |
Sb |
Te |
|
१·४८ |
१·१३ |
०·८१ |
०·७१ |
२·४५ |
२·२१ |
|
Cs |
Ba |
Ti |
Pb |
||
|
१·६९ |
१·३५ |
०·९५ |
०·८४ |
||
साध्या आयनांनी तयार झालेल्या आयनी घनांखेरीज अनेक आयनी स्फटिकात जटिल आयनसुद्धा पृथकपणे असू शकतात. ऑक्सिअम्लांच्या (ज्यांत ऑक्सिजन आहे अशा अम्लांच्या) लवणांत (उदा., NaNo3, K2SO4, Na3PO4) जटिल आयन आहेत. त्याचप्रमाणे NH4+, N(CH3)4+ व S(CH2)3+ हेही जटिल ऋणायन होत. काही धातवीय जटिल ऋणायन आणि धनायन खाली दिले आहेत. धातवीय जटिल धनायन : [Fe(CN)6]4–, [Co(NH3)6]3-, [Hgl4]2–, [PdCl4]2– व [SiF6]2–. धातवीय जटिल ऋणायन : [Co(NH2)6]3+, [Pt(NH3)4]2+, [Ni(H2O)6]2+.
या धातवीय जटिल आयनांपासूनही आयनी स्फटिक बनतात. बहुधा विरूद्ध विद्युत् भार असणाऱ्या साध्या किंवा जटिल आयनांबरोबर एकत्र येऊन स्फटिकनिर्मिती होते.
या वर्गातील स्फटिकांचे आणखी एक वैशिष्ट्य म्हणजे त्यांची सलग संरचना. उदा., सोडियम क्लोराइड व सिझियम क्लोराइड यांचे साधे एककच एकमेकांस जोडले जाऊन मोठा स्फटिक तयार होतो आणि एककाचेच काही भूमितीय गुणधर्म या मोठ्या स्फटिकाला प्राप्त होतात.
आयनी स्फटिकांच्या सलग संरचनेसारखीच सलग संरचना धातू, मिश्रधातू, घनीकृत अक्रिय (रासायनिक विक्रियेत सहजासहजी भाग न घेणारे) वायू, त्याचप्रमाणे ज्या स्फटिकांची संरचना सहसंयुजी बंधांनी (ज्यात दोन अणूंमध्ये काही इलेक्ट्रॉन, सामान्यतः दोन, समाईक असतात अशा बंधांनी) घडलेली असते असे विविध पदार्थ यांमध्ये आढळते. हायड्रोजन बंध असलेले काही पदार्थही (उदा., बर्फ) साधारण अशाच प्रकारचा गुणधर्म दाखवितात.
व्हॅन डर व्हाल्स संरचना : अक्रिय वायू हे गोलाकार एकआणवीय रेणूंचे बनलेले असतात. कमी तापमानास त्यांचे स्फटिकीभवन होते. स्फटिकीभवन झालेली त्यांची रचना ठासून भरलेल्या घनाकृतीसारखी होते. अक्रिय वायूंच्या अणूच्या गुणधर्माचा परिणाम म्हणून या घनस्थितीत फक्त दुर्बल व्हॅन डर व्हाल्स प्रेरणा (संयुजी प्रेरणांखेरीज असणाऱ्या इतर आंतररेणवीय व आंतरआणवीय आकर्षण प्रेरणा व्हॅन डर व्हाल्स या शास्त्रज्ञांच्या नावावरून) घनांना एकत्र ठेवण्यास कारणीभूत असतात. काही घनाकृती संरचना अशाही आढळतात की, त्यांतील जटिल रेणूरचनेमुळे व दुर्बल प्रेरणांमुळे रेणू स्वतःभोवती भ्रमण करीत असतात. या प्रकाराची उदाहरणे द्यावयाची झाल्यास घन अवस्थेतील हायड्रोक्लोरिक अम्ल, नायट्रोजन व हायड्रोजन यांची देता येतील. अशा प्रकारच्या पदार्थांत, ते थंड केले तर एका विशिष्ट तापमानास रेणूंची स्वयंभ्रमणे जवळजवळ थांबतील आणि अशा परिस्थितीत जी स्फटिक संरचना होईल ती निश्चितपणे काहीशी शिथिल होईल.
वरील पदार्थांखेरीज आणखीही अनेक पदार्थ असे आहेत की, ज्यांचे रेणू सहसंयुजी बंधांनी बनलेले असल्याने त्यांचे मोठमोठे समूह निर्माण होतात. घन अवस्थेत त्यांची संरचना वेगवेगळ्या प्रकारांनी होऊन निरनिराळे पदार्थ तयार होतात. घन अवस्थेत रेणूंची संरचना अनेक प्रकारांनी होत असली, तरी त्यांचे महत्त्वाचे गुणधर्म स्फटिकी संरचनेपेक्षा रेणवीय संरचनेवरच अवलंबून असतात. दुर्बल बांधणी असणाऱ्या घन पदार्थांच्या बाबतीत नीच वितळबिंदू, अधिक बाष्पनशीलता, मृदुता आणि अतिशय नीच विद्युत् संवाहकता हे गुणधर्म विशेषत्वाने आढळून येतात.
सहसंयुजी संरचना : ज्या घनपदार्थांची संरचना सर्वथा सहसंयुजी बंधांनी झालेली असते त्यांचे गुणधर्म वरील पदार्थांपेक्षा निराळे असतात. सहसंयुजी बंध जास्त दृढ असतो. त्यामुळे अशा पदार्थांचे उकळबिंदू उच्च असतात. ते अधिक कठीण व अत्यंत स्थिर असतात. हिरा हे अशा पदार्थांचे सुपरिचित उदाहरण आहे. यामध्ये कार्बनाच्या चारी संयुजा (इतर अणूंशी ज्याद्वारे संयोग होतो असे बंध) दुसऱ्या चार कार्बन अणूंना सहसंयुजी बंधांनी जोडण्यासाठी वापरलेल्या असतात. अशा प्रकारे तयार झालेला हिऱ्याचा स्फटिक हा एकच मोठा रेणू म्हणता येईल. कारण या रेणूची संरचना म्हणजे त्रिमितीय सहसंयुजांचे जालक बनून तयार झालेला एक घटक होय. हिऱ्याच्या रचनेप्रमाणेच सिलिकॉन, जर्मेनियम, कार्बोरंडम (सिलिकॉन कार्बाइड) व घनाकृती रूपाचे बोरॉन नायट्राइड यांची संरचना आढळते. अशा तऱ्हेच्या संयुगांची आणखी काही उदाहरणे म्हणजे जस्ताचे सिलिनाइड, टेब्यूराइड व सल्फाइड ही संयुगे होत. बेरिलियम, कॅडमियम आणि पारा यांची सिलिनाइडे, टेल्यूराइडे व सल्फाइडे आणि ॲल्युमिनियम व गॅलियम यांची फॉस्फाइडे व अर्सेनाइडे ही संयुगेही याच वर्गात पडतात. व्ह्यूर्ट्झाइटाची संरचनाही जवळजवळ अशाच प्रकारची असते. त्यामध्ये विद्युत् घनता असणारे संयुजी इलेक्ट्रॉन देऊन धन विद्युत् भार वाढविण्याची प्रवृत्ती असणारे अणू व विद्युत् ऋणता असणारे (संयुजी इलेक्ट्रॉन आकर्षून घेऊन ऋण विद्युत् भार वाढविण्याची प्रवृत्ती असणारे) अणू एकाआड एक चतुष्फलकीय बंधांनी जोडलेले असतात. या सर्व संयुगांमध्ये केवळ आयनिक संयुजा नसून काही सहसंयुजांनीही त्यांच्या संरचना झालेल्या असाव्या असे म्हणण्यास आधार आहे.
इतरही अनेक त्रिमितीय स्फटिकी संरचना माहीत झाल्या आहेत पण त्यांचा कोणत्याही मुक्त मूलद्रव्याशी संबंध नाही. शुद्ध गारगोटी कुरूविंद व रूटाइट ही त्यांची उदाहरणे होत.
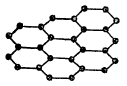 घनांच्या संरचनेत द्विमितीय आणि एकमितीय मांडणी असणारे स्फटिकही बरेच आहेत. द्विमितीय मांडणी असलेल्या पदार्थाचे उत्तम उदाहरण म्हणजे ग्रॅफाइट होय. ग्रॅफाइटामधले कार्बन अणू एकमेकांस जोडले जाताना दोन दिशांतच त्यांची मांडणी होते (आ. २ मध्ये कार्बनाच्या अणूंचा फक्त एकच थर दाखविला आहे) व अशा कार्बन अणुरचनेचे एकावर एक थर होत होत, ग्रॅफाइटाचा स्फटिक तयार होतो. प्रत्येक थरातील कार्बनाचा अणू शेजारच्या तीन कार्बन अणूंशी सहसंयुजी बंधांनी जोडलेला असतो. अशा प्रकारे रचना झाल्यावर राहिलेली चौथी संयुजा म्हणजे π संयुजा होय. वरच्या थरातील प्रत्येक कार्बन अणूची चौथी π संयुजा खालच्या थरातील कार्बन अणूंशी निगडीत झालेली असते. अशा रचनेमुळे इलेक्ट्रॉनांना हालचाल करण्याचे स्वातंत्र्य मिळते व त्यामुळे अशा पदार्थांच्या ठिकाणी उच्च विद्युत् संवाहकता येते. दोन कार्बन थरांतील π बंधने त्या मानाने दुर्बल असतात म्हणून एक थर दुसऱ्या थरावरून सहज घसरू शकतो. या कारणाने ग्रॅफाइटाच्या ठिकाणी वंगणाचे गुण आले आहेत.
घनांच्या संरचनेत द्विमितीय आणि एकमितीय मांडणी असणारे स्फटिकही बरेच आहेत. द्विमितीय मांडणी असलेल्या पदार्थाचे उत्तम उदाहरण म्हणजे ग्रॅफाइट होय. ग्रॅफाइटामधले कार्बन अणू एकमेकांस जोडले जाताना दोन दिशांतच त्यांची मांडणी होते (आ. २ मध्ये कार्बनाच्या अणूंचा फक्त एकच थर दाखविला आहे) व अशा कार्बन अणुरचनेचे एकावर एक थर होत होत, ग्रॅफाइटाचा स्फटिक तयार होतो. प्रत्येक थरातील कार्बनाचा अणू शेजारच्या तीन कार्बन अणूंशी सहसंयुजी बंधांनी जोडलेला असतो. अशा प्रकारे रचना झाल्यावर राहिलेली चौथी संयुजा म्हणजे π संयुजा होय. वरच्या थरातील प्रत्येक कार्बन अणूची चौथी π संयुजा खालच्या थरातील कार्बन अणूंशी निगडीत झालेली असते. अशा रचनेमुळे इलेक्ट्रॉनांना हालचाल करण्याचे स्वातंत्र्य मिळते व त्यामुळे अशा पदार्थांच्या ठिकाणी उच्च विद्युत् संवाहकता येते. दोन कार्बन थरांतील π बंधने त्या मानाने दुर्बल असतात म्हणून एक थर दुसऱ्या थरावरून सहज घसरू शकतो. या कारणाने ग्रॅफाइटाच्या ठिकाणी वंगणाचे गुण आले आहेत.
ज्या कारणामुळे त्रिमितीय स्फटिकांमध्ये उकळबिंदू उच्च असतो त्याच कारणामुळे ग्रॅफाइटाचा उकळबिंदूही उच्च आहे. बोरॉन नायट्राइड ग्रॅफाइटाप्रमाणे षट्कोनी संरचनेचे असते व त्यामध्ये बोरॉन आणि नायट्रोजन यांचे अणू संपूर्ण थरांमध्ये एकाआड एक असे जोडलेले असतात. त्यामुळे त्यांच्यातील π इलेक्ट्रॉन ग्रॅफाइटामधील π इलेक्ट्रॉनांइतके चलनक्षम नसतात. बोरॉन आणि नायट्रोजन हे दोन निरनिराळ्या थरांत असून एकमेकांस जोडलेले असतात असे यावरून म्हणता येईल. मॉलिब्डेनम सल्फाइड (MoS2) हे आणखी एक अशाच प्रकाराचे, म्हणजे थरांची रचना असलेले, उदाहरण आहे आणि म्हणून ग्रॅफाइटाप्रमाणे हेही घन वंगण म्हणून वापरले जाते.
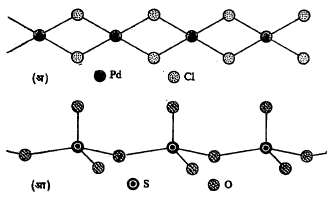 एकमितीय रचना असणारे पदार्थ म्हणून पॅलॅडियम क्लोराइड (PdCl2) सिलिकॉन डाय सल्फाइड (SiS2), बीटा-सल्फर ट्राय-ऑक्साइड (β-SO3), सिलिनियम (Se) व टेल्यूरियम (Te) यांचा उल्लेख करता येईल (आ. ३).
एकमितीय रचना असणारे पदार्थ म्हणून पॅलॅडियम क्लोराइड (PdCl2) सिलिकॉन डाय सल्फाइड (SiS2), बीटा-सल्फर ट्राय-ऑक्साइड (β-SO3), सिलिनियम (Se) व टेल्यूरियम (Te) यांचा उल्लेख करता येईल (आ. ३).
अपरिमित लांबीचे जटिल आयन : अशा प्रकारचे आयन व सहसंयुजी आयन यांमध्ये साम्य असते. ते अधिक जटिल असतात कारण त्यांच्या संरचनेत अखंड सहसंयुजी सांगाडा असतो आणि विरुद्ध विद्युत् भार असणारे आयन या सांगड्याने एकमेकांस जोडलेले असतात. अशा प्रकारच्या आयनांचे उदाहरण म्हणून सिलिकेटे व ॲल्युमिनो सिलिकेटे यांचे देता येईल. त्रिमितीय धनायनी संरचना असलेल्या झिओलाइटांचे उदाहरण या बाबतीत नमुनेदार आहे. धनायनी सांगाड्याच्या आवृत (खुल्या) स्वरूपामुळे झिओलाइटांना त्यांच्या अखंड संरचनेमुळे प्राप्त झालेल्या गुणधर्मांशिवाय आणखी एक विशेष गुणधर्म प्राप्त होतो. या स्फटिकांचे ऋणायन तुलनेने जास्त चलनक्षम असतात. त्यामुळे योग्य ऋणायन असणाऱ्या विद्रावाशी संपर्क झाल्यास या ऋणायनांची जागा विद्रावातील ऋणायन घेऊ शकतात. स्फटिकी संरचना होऊनही स्फटिकामध्ये बरीच जागा रिकामी राहते. या अंतर्गत रिकाम्या जागा ध्रुवीय रेणूंचे (ज्यांना विद्युत् द्विध्रुवी परिबल असते अशा अणूंचे द्विध्रुवी परिबल म्हणजे सन्निध असणाऱ्या, सारख्या मूल्याच्या व विरुद्ध विद्युत् भाराच्या दोन ध्रुवांपैकी एका ध्रुवावरील विद्युत् भार आणि त्या ध्रुवांमधील अंतर यांचा गुणाकार) दृढतेने अधिशोषण (पृष्ठभागावर होणारे शोषण) होण्यास 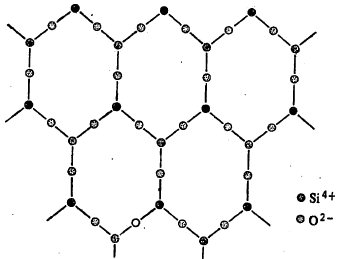 अतिशय अनुकूल असतात. अंतर्गत रिकामी जागा व्यापण्यासाठी ऋणायन आत जाण्याचे जे मार्ग असतात ते सूक्ष्म असतात. या सूक्ष्म मार्गांचा आकार बदलणे, ते लहान वा मोठे करणे, हे स्फटिक संरचना बदलून करणे शक्य असते. अशा प्रकारे स्फटिक संरचनेत फरक करून अंतर्गत भागात जाण्याच्या मार्गाचा आकार नियंत्रित करणे शक्य झाल्यामुळे अशा पदार्थांचा उपयोग वेगवेगळ्या आकारमानांचे रेणू एकमेकांपासून विभक्त करण्यासाठी करता येतो. म्हणून त्यांना रेणवीय चाळण्या म्हणतात.
अतिशय अनुकूल असतात. अंतर्गत रिकामी जागा व्यापण्यासाठी ऋणायन आत जाण्याचे जे मार्ग असतात ते सूक्ष्म असतात. या सूक्ष्म मार्गांचा आकार बदलणे, ते लहान वा मोठे करणे, हे स्फटिक संरचना बदलून करणे शक्य असते. अशा प्रकारे स्फटिक संरचनेत फरक करून अंतर्गत भागात जाण्याच्या मार्गाचा आकार नियंत्रित करणे शक्य झाल्यामुळे अशा पदार्थांचा उपयोग वेगवेगळ्या आकारमानांचे रेणू एकमेकांपासून विभक्त करण्यासाठी करता येतो. म्हणून त्यांना रेणवीय चाळण्या म्हणतात.
अल्ट्रामरिनांची संरचनाही झिओलाइटांशी सदृश असते (उदा., सोडालाइट Na8Al6Si6O24.Cl2). ॲल्युमिनो सिलिकेटांपैकी सांगाड्याच्या स्वरूपाची संरचना असणाऱ्या फेल्स्पार या तिसऱ्या वर्गातील अणू एकमेकांच्या अधिक निकटवर्ती असतात (उदा., ऑर्थोक्लेज KAlSi3O8). झिओलाइटांची नमुनेदार उदाहरणे म्हणजे ॲनॅलसाइट [Na(AlSi2O6).H2O] टॉम्सनाइट [Na(Ca2Al5O20).6H2O] ही होत.
द्विमितीय आयनांची उत्तम उदाहरणे सिलिकेट संयुग-वर्गात आढळतात. संगजिरे (टाल्क) व अभ्रक ही अशी सिलिकेटे होत (आ. ४ मध्ये सिलिकॉन अणूंच्या वरचे ऑक्सिजन अणू दाखविलेले नाहीत).
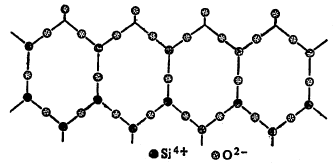 पायरोक्सिने आणि अँफिबोले यांच्या संरचना अपरिमित लांबीच्या शृंखलांसारख्या असतात. त्यांच्या स्फटिकांच्या दृश्य गुणधर्मावरून त्यांची संरचना सहज लक्षात येते. ॲस्बेस्टस दृश्य रूपात तंतुमय तर अभ्रक पातळ पापुद्र्यांच्या समुच्चयाच्या रूपात आढळतो (आ. ५ मध्ये सिलिकॉन अणूंच्या वरेच ऑक्सिजन अणू दाखविलेले नाहीत).
पायरोक्सिने आणि अँफिबोले यांच्या संरचना अपरिमित लांबीच्या शृंखलांसारख्या असतात. त्यांच्या स्फटिकांच्या दृश्य गुणधर्मावरून त्यांची संरचना सहज लक्षात येते. ॲस्बेस्टस दृश्य रूपात तंतुमय तर अभ्रक पातळ पापुद्र्यांच्या समुच्चयाच्या रूपात आढळतो (आ. ५ मध्ये सिलिकॉन अणूंच्या वरेच ऑक्सिजन अणू दाखविलेले नाहीत).
धातवीय अवस्था : धातूंच्या अणूंची संरचना मात्र वर वर्णन केलेल्या संरचनेपेक्षा वैशिष्ट्यपूर्ण व निराळ्या प्रकारची असते. अशा संरचनेमुळे त्यांना विशिष्ट गुणधर्म प्राप्त झालेले आहेत. त्यांपैकी काही पुढीलप्रमाणे होत : (१) उच्च उष्णता संवाहकता व विद्युत् संवाहकता, (२) धातवीय चमक, (३) तन्यता (तार काढता येणे), (४) वर्धनीयता व (५) निकटबंधित मांडणी असलेले अणू. धातूतील अणू एकमेकांच्या अत्यंत निकट असतात व त्यांची संख्या संयुजी इलेक्ट्रॉनांच्या मानाने मोठी असते. अशा धातूंची नमुनेदार उदाहरणे म्हणजे धातूंच्या बाबतीत वैशिष्ट्यपूर्ण संरचना असलेले व ज्यात अणू निकटबंधित आहेत असे घनाकृती, षट्कोणाकृती व शरीरकेंद्रित संरचना असलेल्या धातू होत. ॲक्टिनाइड श्रेणीच्या धातू या संरचनेला महत्त्वाचा एकमेव अपवाद आहेत.
अणूंमध्ये असणारे इलेक्ट्रॉन स्वतंत्रपणे फिरण्यास मोकळे असू शकतात असे अणूचे चित्र मान्य केल्यावर धातूंच्या गुणधर्मांचा संयुक्तिक खुलासा करणे शक्य होते. ज्या इलेक्ट्रॉनांमुळे संयुगे बनतात ते इतस्ततः फिरू शकतात. धातूच्या अणूंचे आयनीभवन झाल्याने हे आयन फिरण्यास मोकळे असतात. जालकांतील सर्व बिंदू सममूल्य असतात, तसेच संयुजी इलेक्ट्रॉनांच्या ऊर्जास्थितीमुळे त्यांच्या ठिकाणी थोडे दिशादर्शकत्व असते. धातूंच्या अंगी असणाऱ्या वर्धनीयता आणि तन्यता या गुणांचा संबंध वरील दोन गोष्टींशी लावला जातो. रेणवीय कक्षक संकल्पनेचा उपयोग करून याच गोष्टींचा संबंध चांगल्या प्रकारे स्पष्ट करता येतो. धातूंची स्फटिक जालके म्हणजे एक रेणू असे समजले जाते. रेणूंचे कक्षक त्यांतील अणूंच्या वैयक्तिक कक्षकांपासून बनलेले असतात व रेणूंचे कक्षक संपूर्ण स्फटिक व्यापून टाकतात. त्यात या कक्षकांचे एकमेकांतील अंतर आणि संख्या यांचा धातूंच्या व अणूंच्या संरचना व भूमितीय मांडणी यांच्याशी संबंध असतो. यावरून असा निष्कर्ष निघतो की, संयुजी इलेक्ट्रॉन एकमेकांच्या अतिशय जवळ असलेल्या पण पृथक् असणाऱ्या ऊर्जा पातळ्यांनी बनलेल्या ऊर्जा पट्ट्यांत असू शकतात. त्याचप्रमाणे काही ऊर्जा पट्ट्यांत संयुजी इलेक्ट्रॉनांना जागा मिळणे अशक्य असते अथवा त्या पट्ट्यांत त्यांना प्रवेश नसतो, असेही दाखविता येते. या संकल्पनांच्या आधारे प्रत्येक अणूस एक विशिष्ट संख्या प्राप्त होते. ही संख्या त्या अणूच्या ब्रीय्वँ विभागात नीचतम ऊर्जा पट्ट्यांत सामावण्याइतके इलेक्ट्रॉन झाले की, त्यानंतर इलेक्ट्रॉनांची भरती वरच्या ऊर्जा पट्ट्यात होते. ही भरती पाउली यांच्या विवर्जन तत्त्वाप्रमाणे होते (या तत्त्वानुसार एकाच कक्षकात भरती झालेले इलेक्ट्रॉन एकमेकांच्या उलट दिशेने परिवलन म्हणजे स्वतःच्या अक्षाभोवती भ्रमण करीत असतात).
हा दृष्टिकोन स्वीकारला की, धातूंचे संवाहक, अर्धसंवाहक व निरोधक असे जे वर्गीकरण केले जाते त्याची नीट व सुस्पष्ट कल्पना येते. युग्मित इलेक्ट्रॉन विद्युत् संवाहकतेस हातभार लावीत नाहीत अर्धपूर्ण विभागातील एकाकी इलेक्ट्रॉन विद्युत् संवाहकतेस कारणीभूत होतो. निरोधकात ब्रीय्वँ विभाग संपूर्ण भरलेला असतो. ज्यामध्ये ब्रीय्वँ विभाग अपूर्ण भरलेला असतो ती धातू संवाहक होते. तांबे, चांदी व सोने यांच्या उच्च संवाहकतेचा खुलासा वरील विचारसरणीमुळे होतो. या तीनही धातू घनाकृती व निकटबंधित संरचना असलेल्या व सर्वसाधारणपणे विचार केला, तर नीचतम ऊर्जा पट्ट्यात एक इलेक्ट्रॉन धारण करणाऱ्या आहेत. घनाकृती सुस्थिर निकटबंधीत संरचनेमध्ये इलेक्ट्रॉन व अणू यांचे प्रथम विभागात २ : १ असे प्रमाण असते. परिणामतः तो विभाग फक्त अर्धपूर्ण असतो. निरोधकांच्या बाबतीत असे म्हणता येईल की, जेव्हा काही इलेक्ट्रॉन पूर्ण पट्ट्यातून अपूर्ण पट्ट्यात चढविले जातात त्यावेळी ही बढती साध्य करण्यासाठी आवश्यक असणारी ऊर्जा ही संपूर्ण पट्टा नीचतम व अपूर्ण पट्टा यांच्या ऊर्जांमध्ये असणाऱ्या फरकावर अवलंबून असते. निरोधक काही प्रमाणात संवाहक करण्यासाठी ही ऊर्जा उष्णता, स्थिर विद्युत् वर्चस्, प्रकाश इ. अनेक मार्गांनी पुरविता येते. अर्थात ती कोणत्या मार्गाने पुरवावयाची हे त्यावेळच्या विशिष्ट परिस्थितीवर अवलंबून राहील.
मिश्रधातू व आंतर धातवीय संयुगे : साधारण दोन धातू एकत्र वितळवून अथवा इतर प्रकारे त्यांना एकत्रित करून एक नवी घन अवस्था त्यांना प्रदान करता येते. दोन धातूंपासून बनणाऱ्या घन अवस्थांचे वर्गीकरण पुढीलप्रमाणे करता येते : घन विद्राव, संयुजा संयुगे व इलेक्ट्रॉनी संयुगे. हे वर्गीकरण सर्व समावेशक नाही. तथापि त्यामुळे आपणास महत्त्वाच्या संरचना प्रकारांची रूपरेषा समजते.
घन विद्राव : विद्रावक (ज्यात दुसरी धातू मिसळावयाची त्या) धातूची स्फटिक संरचना कायम ठेवून विद्रावक अणूंचे विद्रुत (जी मिसळावयाची त्या) धातूच्या अणूंनी इतस्ततः प्रतिष्ठापन केले म्हणजे घन विद्राव बनतो. घन विद्रावातील धातूंचे प्रमाण त्या दोन धातूंच्या गुणधर्मांत किती साम्य आहे यावर अवलंबून राहील. काही धातू एकमेकींत मुळीच मिसळणार नाहीत. या उलट काही संपूर्णपणे मिसळून जातील. दोन धातू एकमेकींत संपूर्णपणे मिसळून जाण्यासाठी त्यांच्यात अनेक गुण सारखे असावे लागतात. उदा., पोटॅशियम व रुबिडियम, चांदी व सोने, आर्सेनिक व अँटिमनी, मॉलिब्डेनम व टंगस्टन, निकेल व पॅलॅडियम आणि निकेल व कोबाल्ट या धातुजोड्या समान गुणधर्मांमुळे संपूर्ण मिश्रणीय आहेत. अणूचे आकारमान, स्फटिकी संरचना आणि इलेक्ट्रॉन आकर्षण करण्याचा गुण या बाबतींत त्यांत साम्य आहे. त्यामुळे त्यांचे मिश्रणाचे प्रमाण त्यांच्या अणूंच्या सापेक्ष आकारमानाशी निगडीत आहे. व्हेगार्ड यांच्या नियमाप्रमाणे अशा घन विद्रावात स्फटिकाच्या एकक मूळघटकाचे आकारमान विद्रुताच्या संहतीशी (विद्रावातील प्रमाणाशी) रैखिक (एकघाती) प्रमाणात बदलत असते.
या वर्गातील काही विद्रावांत विद्रुतांच्या अणूंचे वितरण इतस्ततः झालेले नसते. त्यांची सुसूत्र संरचना असते. तांबे व सोने यांच्या घन विद्रावात असा प्रकार आढळतो. ह्या दोन धातूंची फलककेंद्रित घनाकृती संरचना (ज्यात घनाकृतीच्या कोपऱ्यावर व फलकांच्या मध्यावर अणू असतात अशा संरचना) असलेले अनेक घन विद्राव बनतात. नीच तापमानास दोन्ही धातूंचे अणू एकाच पातळीवर जमतात व त्यामुळे स्तर संरचना निर्माण होते [→ घन विद्राव].
संयुजा संयुगे : ही संयगे म्हणजे मिश्रधातूंच्या संरचनेचे दुसरे टोक होय. दोन धातूंचा संयोग कशा प्रकारे होईल हे त्यांच्या संयोगापूर्वी अणूंच्या संयुजांवरून वर्तविता येते. या संयुगांची संरचना त्यांच्यापासून बनणाऱ्या लवणांच्या रेणवीय संरचनेसारखीच असते. काही संयुजा व संयुगांची सूत्रे पुढीलप्रमाणे आहेत.
अँटिफ्ल्युओराइट संरचना : Mg2Ge, Mg2Sn, Mg2Pb
अँटि Mn2O3संरचना : Mg3As2, Mg3Sb2
सोडियम क्लोराइड संरचना : MgSe
ज्या धातूंमध्ये पुरेसा विद्युत् ऋणतेचा फरक आहे अशा धातूंपासून अशा तऱ्हेची संयुगे बनतात. या प्रकारच्या संरचनेमुळे घन विद्रावांची संख्या फार मर्यादित होते. या प्रकारची मध्यस्थ संयुगे निरोधके किंवा अर्धसंवाहके असतात. अशा गुणधर्मांची संयुगे आयनी असलीच पाहिजेत असे नाही. धातूंच्या पट्टा उपपत्तीच्या दृष्टीने विचार केल्यास फ्ल्युओराइटी (CaF2) संरचना असे दर्शविते की, इलेक्ट्रॉन-अणू प्रमाण नीचतम ऊर्जा पट्ट्यात ८ : ३ असे असते. Mg2Ge, Mg2Sn, व Mg2Pb या सूत्रांवरून असे स्पष्ट होते की, हे पट्टे भरलेले असतात व त्यामुळे ही संयुगे निरोधक असतात.
इलेक्ट्रॉनी संयुगे : आतापर्यंत दोन प्रकारच्या संयुगांचा विचार करण्यात आला. त्यात भाग घेणाऱ्या धातूंच्या विद्युत् ऋणतेमधील फरकाच्या मानाने मध्यवर्ती असणाऱ्या विद्युत् ऋणता फरकाच्या जोड्यांपासून जी संयुगे बनतात त्यांना इलेक्ट्रॉनी संयुगे किंवा ‘ह्यूम-रोदरी संयुगे’ असे म्हणतात. अशा प्रकारच्या द्विअंगी पद्धतीमध्ये जसजसा संघटनेमध्ये बदल होत जातो तसतसा स्फटिक संरचनेतही बदल घडून येतो व पदार्थांच्या वेगवेगळ्या प्रावस्था तयार होतात.
|
α — प्रावस्था फलकेंद्रित घनाकृती संरचना |
→ |
β — प्रावस्था शरीरकेंद्रित घनाकृती संरचना |
→ |
γ — प्रावस्था जटिल घनाकृती संरचना |
→ |
ε — प्रावस्था षट्कोणी निकटबंधित संरचना |
α —प्रावस्था हे धातूचे शुद्ध स्वरूप होय. β, γ व ε ही आंतरधातवीय संयुगे होत. कोष्टक क्र. २ वरून असे दिसून येईल की, रसप्रमाणमापनशास्त्राच्या (रासायनिक रूपांतरणांत भाग घेणाऱ्या पदार्थांची व तयार होणाऱ्या पदार्थांची गणितीय प्रमाणे यांसंबंधी अभ्यास करणाऱ्या शास्त्राच्या) दृष्टीने विविध प्रकारच्या प्रावस्था या विशिष्ट संरचनांच्या बाबतीत आढळणे शक्य आहे. त्याचप्रमाणे संयुजी इलेक्ट्रॉनसंख्या आणि अणू यांची गुणोत्तरेही या संयुगांकरिता या कोष्टकात दिलेली आहेत.
|
कोष्टक क्र. २. इलेक्ट्रॉन किंवा ह्यूम-रोदरी संयुगे |
|||||
|
β – प्रावस्था |
γ – प्रावस्था |
ε – प्रावस्था |
|||
|
संघटना |
इलेक्ट्रॉनसंख्या / अणूसंख्या |
संघटना |
इलेक्ट्रॉनसंख्या / अणूसंख्या |
संघटना |
इलेक्ट्रॉनसंख्या / अणूसंख्या |
|
CuZn |
(१+२)/२ |
Cu5Zn8 |
(५+१६)/१३ |
CuZn3 |
(१+६)/४ |
|
AgZn |
(१+२)/२ |
Ag5Zn8 |
(५+१६)/१३ |
AgZn3 |
(१+६)/४ |
|
AuZn |
(१+२)/२ |
Au5Zn8 |
(५+१६)/१३ |
AuZn3 |
(१+६)/४ |
|
Cu5Sn |
(५+४)/६ |
Cu31Sn6 |
(३१+३२)/३९ |
Cu3Sn |
(३+४)/४ |
|
Cu5Si |
(५+४)/६ |
Cu31Si8 |
(३१+३२)/३९ |
Cu3Si |
(३+४)/४ |
|
Ag3Al |
(३+३)/४ |
Cu3Al4 |
(९+१२)/१३ |
Ag5Al3 |
(५+९)/८ |
|
Cu3Al |
(३+३)/४ |
Na31Pb8 |
(३१+३२)/३९ |
– |
– |
|
CoAl |
(०+३)/२ |
Co5Zn21 |
(०+४२)/२६ |
– |
– |
|
CoZn3 |
(०+६)/४ |
Ni5Zn21 |
(०+४२)/२६ |
– |
– |
|
FeAl |
(०+३)/२ |
Pt5Zn21 |
(०+४२)/२६ |
– |
– |
|
NiAl |
(०+३)/२ |
||||
त्यावरून असे दिसते की, या तीन प्रकारच्या आंतरधातवीय संरचनांसाठी या गुणोत्तराची काही विवक्षित मूल्ये आहेत. लोह, कोबाल्ट, निकेल व प्लॅटिनम यांच्या बाबतीत असे गृहीत धरावे लागते की, या धातूवरील प्रमाणे साधण्यासाठी आपले संयुजी इलेक्ट्रॉन देऊ शकत नाहीत. या संयुगांची संघटना धातूंच्या पट्टा उपपत्तीनुसार स्पष्ट करता येते. या उपपत्तीनुसार असे अनुमान करता येते की, संयुगांच्या β— प्रावस्थेत नीचतम ऊर्जा असणाऱ्या इलेक्ट्रॉन कक्षेत १·४८० इलेक्ट्रॉन प्रती अणू या प्रमाणात सामावले जातात. तर हेच प्रमाण γ— प्रावस्थेत १·५३८ इलेक्ट्रॉन प्रती अणू इतके असते. पट्टा सिद्धांतानुसार अतिस्थिर, β, γ व ε प्रावस्थांतील अणु-गुणोत्तरे पुर्णांकी असतीलच असे नाही. उदा., जस्ताचे अणू तांब्याच्या अणूत घालताना प्रती अणू इलेक्ट्रॉनांची संख्याच केवळ वाढवावयाची असते व ती एकसंयुजी अणूच्या बदली द्विसंयुजी अणू घालून वाढवता येते. धातूची प्रारंभीची संरचना, α— प्रावस्था, ही पहिली ब्रीय्वँ कक्षा जवळजवळ पूर्ण होईपर्यंत स्थिर राहते. त्यानंतर भरती होणारे इलेक्ट्रॉन दुसऱ्या बऱ्याच उच्च ऊर्जेच्या कक्षेत जातात. तेव्हा ज्या पदार्थात नीचतम ब्रीय्वँ कक्षेत अणु-इलेक्ट्रॉन गुणोत्तर जास्त असेल तो पदार्थ अधिक स्थिर असणार अशी अपेक्षा करावयास हरकत नाही.
अभ्यंतर संयुगे : संक्रमणी धातू आणि बोरॉन, कार्बन, नायट्रोजन व काही प्रमाणात ऑक्सिजन ह्या हलक्या अधातू यांपासून झालेली द्वैती संयुगे म्हणजे संयुगांचा एक अभिनव वर्ग आहे. या संयुगांना धातूंची चमक व विद्युत् संवाहकता असते. त्यातील काही अत्यंत कठीण व अगलनीय (न वितळणाऱ्या) आहेत. कोष्टक क्र. ३ मध्ये अशा काही पदार्थांचे वितळबिंदू, कठिनता आणि सूत्रे दिली आहेत. [हिऱ्याची कठिनता १० धरलेल्या मोस मापक्रमानुसार कठिनता दिलेली आहे → कठिनता.]
कोष्टक क्र. ३ मधील उदाहरणांशिवाय आणखीही काही संक्रमणी धातूंची कार्बाइडे, नायट्राइटे ऑक्साइडे यांचे गुणधर्मही तसेच असतात. या सर्वांची संरचना बहुतांशी सोडियम क्लोराइडाच्या स्फटिकासारखी असते.
|
कोष्टक क्र. ३. अंतराली संयुगे |
||
|
सूत्र |
वितळबिंदू०के. |
कठिनता |
|
TiC |
३,४१० |
८–९ |
|
ZrC |
३,८०५ |
८–९ |
|
HfC |
४,१६० |
— |
|
TaC |
४,१५० |
— |
|
W2C |
३,१३० |
९—१० |
|
WC |
३,१३० |
९ |
|
Mo2C |
२,६०० |
— |
|
MoC |
२,८४० |
— |
|
TiN |
३,२२० |
८.९ |
|
ZrN |
३,२५५ |
८ |
|
TaN |
३,३६० |
— |
वरील संयुगांची वर्गवारी वर नमूद केलेल्या दोन प्रकारांत करता येते. आत्यंतिक औष्णिक स्थिरता, ठिसूळपणा, कठिनता यांवरून त्यांची संरचना हिऱ्यापेक्षा भूमितीच्या दृष्टीने निराळी असली, तरी ती सलग व सहसंयुजी संरचना असल्यामुळे हिरा व वरील पदार्थ यांचा एकच सामान्य वर्ग मानता येईल. त्याचबरोबर त्यांना असणारी धातवीय चमक व संवाहकता मिश्रधातू प्रणाली सूचित करते.
घन अवस्था दोष : आतापर्यंत केलेले घन अवस्थेचे विवेचन घन पदार्थांची संरचना निर्दोष असते, अशा गृहीत तत्त्वावर केले गेले आहे. परंतु वस्तुस्थिती सामान्यपणे तशी नसते. तथापि आदर्श स्थिती आणि प्रत्यक्ष स्थिती यांमधील तफावत फारशी महत्त्वाची नसते. रासायनिक पदार्थातील अशुद्धीचे प्रमाण बहुधा हजारात काही भाग इतके आणि क्वचितच दशलक्ष भागात काही भाग इतके कमी असते. त्याचप्रमाणे कित्येक घन पदार्थांतील निरनिराळ्या अणूंची गुणोत्तरे रसप्रमाणमापनशास्राप्रमाणे येणाऱ्या पूर्णांकांत नसतात. अशा संयुगांना बर्थोलॉइड संयुगे म्हणतात. याशिवाय काही आदर्श शुद्ध पदार्थ व त्यांचे रसप्रमाणमापन यांतही काही अपूर्णता आढळून येते. ही अपूर्णता दोन प्रकारची असते. स्फटिकांच्या स्थानभ्रंशासंबंधीचे दोष हा एक प्रकार व जालकी दोष हा दुसरा होय.
वरील विवेचनात स्फटिक संरचनेतील जालके आदर्श आहेत असे गृहीत धरले आहे, तरीही कित्येक घन पदार्थांच्या बाबतीत स्फटिकामधून होणारे आयनांचे विसरण, विद्युत् अर्धसंवाहकता आणि प्रकाशीय गुणधर्म यांचे स्पष्टीकरण होऊ शकत नाही. या गुणधर्मांच्या स्पष्टीकरणासाठी असे मानावे लागते की, बरेचसे अणू किंवा आयन आदर्श शुद्ध व रसप्रमाणमापनशास्राप्रमाणे ठरणाऱ्या जालकातील स्थानापासून च्युत झाले असावेत. दोन प्रकारचे स्फटिक दोष ओळखले जातात. पहिला म्हणजे फ्रेंकेल दोष. यामध्ये सामान्यतः एक ऋणायन आपली जालकातील नित्याची जागा सोडून स्फटिकातील रिक्त जागा व्यापतो, म्हणजे तो एक अभ्यंतर आयन बनतो. दुसरा दोष म्हणजे शोट्की दोष होय, यात आयन त्याच्या जालकातील नेहमीच्या स्थानापासून भ्रष्ट होऊन स्फटिक पृष्ठांत पुनःस्थापित झालेले असतात. या दोषात ऋणायन व धनायन यांची संख्या सारखीच असू शकते.
दोन्ही प्रकारांत आयनांची घन पदार्थांतील गती जालकातील मोकळ्या जागांमुळे शक्य असते. यावरून आयनांचे घन पदार्थांत, घन अवस्था विक्रियांमध्ये विसरण (एकमेकांत मिसळणे) कसे होते याचे व इतर अनेक आविष्कारांचे स्पष्टीकरण होते [→ घन अवस्था भौतिकी].
एखाद्या शुद्ध रसायनात अगदी अल्प प्रमाणात इतर पदार्थ अशुद्धी म्हणून मिसळला, तर त्याचा काय परिणाम होतो हे जर्मेनियम धातूचे उदाहरण घेऊन सांगता येईल. जर्मेनियम व सिलिकॉन ही मूलद्रव्ये स्फटिकावस्थेत असताना त्यांची संरचना हिऱ्याच्या स्फटिक संरचनेसारखी असते. त्यांचे चारी संयुजी इलेक्ट्रॉन त्रिमितीय, सलग आणि सहसंयुजी बंधांचे जालक घडविण्यासाठी उपयोगी पडतात. परिणामी हे पदार्थ अत्यंत विशुद्धावस्थेत असले की, त्यांची विद्युत् संवाहकता फार कमी असते. पण त्यांत आर्सेनिक अथवा गॅलियम थोड्या प्रमाणात जरी मिसळले, तरी ही मूलद्रव्ये अर्धसंवाहक बनतात, आर्सेनिक अथवा ग्रॅलियम यांचे अणू स्फटिक संरचनेत जर्मेनियम अणूप्रमाणेच सहभागी होतात. आर्सेनिकाच्या पाच संयुजी इलेक्ट्रॉनांपैकी चारच इलेक्ट्रॉन स्फटिक संरचनेत भाग घेतात. पाचवा इलेक्ट्रॉन त्या मानाने हालचालीस मोकळा असतो व त्यामुळे विद्युत् प्रवाह वहनास अनुकूल अशी स्फटिक संरचना होते. इलेक्ट्रॉन हे ऋण विद्युत् भारित विद्युत् प्रवाह वाहक असल्यामुळे अशा अपद्रव्य भारित जर्मेनियमास n – जर्मेनियम (n = निगेटिव्ह ऋण विद्युत् भारित) असे म्हणतात. गॅलियमाजवळ तीन संयुजी इलेक्ट्रॉन आहेत परंतु जर्मेनियमामध्ये ते मिसळले म्हणजे अशा प्रकारे जागा व्यापतात की, चार संयुजाबंध तयार होणे आवश्यक असते. त्यामुळे एका इलेक्ट्रॉनाची कमतरता असते आणि त्यामुळे जर्मेनियम अर्धसंवाहक बनते. येथे विद्युत् प्रवाह वाहक धन विद्युत् भारित असल्याप्रमाणे वागतो म्हणून गॅलियम अपद्रव्य भारित जर्मेनियमाला p- प्रकारचा (p= पॉझिटिव्ह, धन विद्युत् भारित) अर्धसंवाहक म्हणतात [→ अर्धसंवाहक].
संदर्भ : 1. Galway, A. K. Chemistry of Solids, London, 1967.
2. Garner, W. E. Chemistry of Solid State, London, 1955.
शेजवलकर, बा. ग.
“