नेपच्यूनियम : धातुरूप मूलद्रव्य. रासायनिक चिन्ह Np अणुक्रमांक (अणूमधील प्रोटॉनांची संख्या) ९३ अणुभार २३७ आवर्त सारणीतील (इलेक्ट्रॉन रचनेनुसार केलेल्या मूलद्रव्यांच्या कोष्टकरूप मांडणीतील) ३ ब गटातील ॲक्टिनाइड श्रेणीतील चौथे किरणोत्सर्गी (भेदक कण वा किरण बाहेर टाकणारे) व युरेनियमानंतरचे पहिले मूलद्रव्य संयुजा (इतर अणूंशी संयोग पावण्याची क्षमता दर्शविणारा अंक) ३,४,५,६ विद्युत् विन्यास (अणूमधील इलेक्ट्रॉनांची मांडणी) २,८,१८,३२,२२,९,२ समस्थानिकांची (अणुक्रमांक तोच परंतु अणुभार भिन्न असलेल्या त्याच मूलद्रव्याच्या प्रकारांची) एकूण संख्या १३ असून त्यांचे अणुभार २३१ पासून २४१ पर्यंत आहेत, त्यांपैकी २३७ अणुभाराचा समस्थानिक रासायनिक दृष्ट्या महत्त्वाचा असून त्याचा अर्धायुकाल (किरणोत्सर्गी पदार्थाची मूळ क्रियाशीलता निम्मी होण्यास लागणारा काळ) २·२०X१०६ वर्षे आहे.
सूर्यकुलात युरेनस (प्रजापती) या ग्रहानंतर नेपच्यून (वरुण) हा ग्रह आहे. युरेनसाच्या नावावरून युरेनियम हे नाव आवर्त सारणीतील ९२ क्रमांकाच्या मूलद्रव्यास दिले, म्हणून युरेनियमानंतर येणाऱ्या या मूलद्रव्यास ‘नेपच्यूनियम’ असे नाव देण्यात आले.
इतिहास : १९४० मध्ये युरेनियमाच्या अणूवर न्यूट्रॉनांचा भडिमार केल्यावर तयार होणाऱ्या भंजन खंडाच्या शक्तीचे मोजमाप करण्याविषयी ई. एम्. मॅकमिलन हे प्रयोग करीत असताना त्यामधून एक नवीन घटक तयार होतो, असे त्यांना आढळून आले. पी. एच्. आबेल्सन यांच्यासह त्यांनी हा प्रयोग करून त्यात तयार होणाऱ्या एका नव्या मूलद्रव्याचा शोध लावला. हा नेपच्यूनियमाचा २३९ अणुभाराचा समस्थानिक होता. त्याचा अर्धायुकाल २·३३ दिवस असल्याचे आढळून आले. ही धातू वजन करता येईल इतक्या प्रमाणात प्रथम १९४४ मध्ये एल्. बी. नुसोन व टी. जे. लाचापेले यांनी तयार केली.
निर्मिती : युरेनियमाबरोबर अत्यल्प प्रमाणात नेपच्यूनिमय (२३९) आढळते. युरेनियम (२३८ व २३५) वर न्यूट्रॉनांचा भडिमार केल्यास अणुकेंद्रीय विक्रियकामध्ये (अणुभट्टीमध्ये) भंजन विक्रियेने नेपच्यूनियम (२३७) तयार होते.
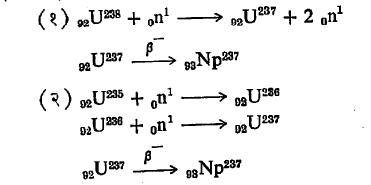
येथे 0n1 आणि β– हे अनुक्रमे न्यूट्रॉन व निगॅट्रॉन (इलेक्ट्रॉन) दर्शवितात. नेपच्यूनियमाची विद्युत् घनता (संयुजी इलेक्ट्रॉन सहजी देऊन टाकून धन विद्युत् भार वाढविण्याची प्रवृत्ती) अतिशय असल्याने तिच्या वितळलेल्या हॅलाइडांच्या विद्युत् विच्छेदनाने (विद्युत् प्रवाहाच्या साहाय्याने घटक अलग करण्याच्या क्रियेने) ती तयार करता येते.
गुणधर्म : ही चांदीसारखी दिसणारी, सारख्याच परिस्थितीत तयार केलेल्या युरेनियमाइतकीच जवळजवळ वर्धनीय (लाटण, घडाई इ. क्रियांनी न तुटता आकार बदलता येणारी) व कोठी तापमानाला हवेत उघडी ठेवल्यास तेज जलद कमी न होणारी धातू आहे. वितळबिंदू ६४०° से. कोठी तापमानास ही धातू (α – नेपच्यूनियम) समचतुर्भुजी स्वरूपाची (घनता २०·४५ ग्रॅ./सेंमी३). असून हे स्वरूप २७८° से. पर्यंत स्थिर राहते. या तापमानाला तिचे रूपांतर चतुष्कोणीय रूपात (β – नेपच्यूनियम) होते आणि त्याची ३१३° से. ला घनता १९·३६ ग्रॅ./सेंमी.३ असते. ५७०° से. पेक्षा अधिक तापमानाला तिचे रूपांतर शरीरकेंद्रीत घनीय [→ स्फटिकविज्ञान] स्वरूपात (γ –नेपच्यूनियम) होते (घनता ६००° से. ला १८ ग्रॅ./सेंमी.३) व हे स्वरूप वितळबिंदूपर्यंत कदाचित स्थिर राहत असावे. हिच्यातून आल्फा किरण [→ किरणोत्सर्ग] उत्सर्जित होतात.
नेपच्यूनियम धातू ॲल्युमिनियमापेक्षा थोडी कमी क्रियाशील आहे. Np4+ स्थिर आयन असून जलीय विद्रावात हवेमुळे ⇨ ऑक्सिडीभवन होऊन NpO2+ आयन तयार होतो. NpO2 इतर लवणांपेक्षा स्थिर आहे. ते आणखी तापविल्यास त्यापेक्षा अस्थिर असलेले Np3O8 हे उच्च ऑक्साइड तयार होते. यांशिवाय परिस्थितीनुसार NpO2ते Np3O8 यांच्या दरम्यान संघटन असलेली ऑक्साइडेही अस्तित्वात आहेत. NpO2 हे ऑक्साइड HF, CCl4, AlBr3 किंवा AII3 बरोबर तापविल्यास नेपच्यूनियम हॅलाइडे मिळतात. नेपच्यूनियमाच्या आयनांचा जलीय विद्रावातील रंग साधारणपणे Np3+ फिकट जांभळा, Np4+ पिवळट हिरवा, NpO2+ हिरवट निळा आणि NpO22+ च्या बाबतीत विद्रावातील अम्लानुसार रंगहीन ते गुलाबी किंवा पिवळट हिरवा असे आढळतात.
अभिज्ञान : (अस्तित्व ओळखणे). युरेनियमोत्तर मूलद्रव्यांच्या लवणांच्या मिश्रणात NaBrO3 चा विद्राव्य मिळविल्यास नेपच्यूनियम लवणांचे ऑक्सिडीभवन होऊन NpO22+ आयन तयार होतो, इतरांवर क्रिया होत नाही. त्यामध्ये फ्लुओराइडाचा विद्राव मिसळल्यास नेपच्यूनियम लवणांव्यतिरिक्त युरेनियमोत्तर मूलद्रव्यांच्या लवणांचा अवक्षेप (न विरघळणारा साका) वेगळा होतो.
पहा : युरेनियमोत्तर मूलद्रव्ये.
संदर्भ : 1. Nechamkin, H. The Chemistry of the Elements, New York, 1968.
2. Seaborg, G.T. Man-Made Transuranium Elements, Englewood Cliffs, N. J. 1963.
भोईटे, प्र. बा.
“