पेरॉक्सी संयुगे : ज्यांच्या संरचनांमध्ये (रेणूमधील अणू एकमेकांना जोडण्याच्या पद्धतीत) दोन ऑक्सिजन अणू एकमेकांना जोडलेले असून शिवाय त्यांना इतर अणू किंवा अणूंचे गट जोडलेले असतात अशी संयुगे. हायड्रोजन पेरॉक्साइड H-O-O-H हे या वर्गाचे आद्य संयुग होय [→हायड्रोजन-पेरॉक्साइड ]. यातील एका अथवा दोन्ही हायड्रोजन अणूंच्या जागी इतर अणू किवां अणुगट योजिले म्हणजे पेरॉक्सी संयुगांच्या संरचना सिद्ध होतात. अकार्बनी व कार्बनी या दोन्ही वर्गाची पेरॉक्सी संयुगे ज्ञात आहेत.
पेरॉक्सी संयुगांचे चार मुख्य प्रकार आहेत. ते म्हणजे (१) पेरॉक्साइडे, (२) पेरॉक्सी अम्ले, (३) पेरॉक्सी लवणे व (४) पेरॉक्सी हायड्रेटे हे होत.
अकार्बनी संयुगे :पेरॉक्साइडे : क्षार धातूंची (लिथियम, सोडियम, पोटॅशियम, रूबिडियम इ.) पेरॉक्साइडे त्या त्या धातू किंवात्यांची नीच ऑक्साइडे, कोरड्या व कार्बन डाय-ऑक्साइडरहित हवेत उच्च तापमानास तापविल्याने बनतात. याच पद्धतीने बेरियम ऑक्साइडापासून बेरियम पेरॉक्साइड बनते. ðआवर्त सराणीतील दुसऱ्या गटाच्या (बेरियमाशिवाय) धातूंची पेरॉक्साइडे त्या त्या धातूंची ऑक्साइडे, हायड्रॉक्साइडे किंवा लवणे आणि हायड्रोजन पेरॉक्साइड यांमध्ये रासायनिक विक्रिया होऊन बनतात.
सोडियम पेरॉक्साइड: (Na2O2) हे औद्योगिक दृष्टीने महत्त्वाचे संयुग घन अथवा वितळलेल्या सोडियमापासून बनवितात. हे दाणेदार किंवा चूर्णरूप व पिवळसर रंगाचे असते. यात सु. ९६% पेरॉक्साइड असते. शुद्ध केलेले संयुग ६६०º से. तापमानास वितळते. सु. ७५०º से. तापमानास त्याचे अपघटन (रेणूचे तुकडे पडणे) होते व ऑक्सिजन निराळा होतो. हे एक प्रबल ऑक्सिडीकारक [→ऑक्सिडीभवन ] आहे.
कागदाचा लगदा, सुती कापड, गवत इत्यादींच्या विरंजनासाठी (रंग नाहीसा करण्यासाठी) याचा विरल व क्षारीय (अम्लाबरोबर विक्रिया झाल्यास लवण देणारा अल्कलाइन) विद्राव वापरतात. अनेक कार्बनी पेरॉक्साइडे बनविण्यासाठी आणि कोळसा, कोक इत्यादींत असलेल्या गंधकाचे प्रमाण ठरविण्याकरिता ‘पार सल्फर बाँब’ या उपकरणात हे उपयोगी पडते.
दमट व ज्वलनशील पदार्थ याच्या संपर्काने पेटतो. (दाहक (कॉस्टिक) सोड्याप्रमाणेच याच्या विद्रावाने कातडीस इजा होते. हे गुणधर्म लक्षात घेऊन याचा वापर करावा लागतो.
मॅग्नेशियम पेरॉक्साइड : (MgO2) हा पांढुरका घन पदार्थ असून एखादे विद्राव्य मॅग्नेशियम लवण (उदा., सल्फेट), क्षार व हायड्रोजन पेरॉक्साइड यांपासून हे बनविता येते. ते अम्लीय जलात सहज विरघळते व हायड्रोजन पेरॉक्साइड निर्माण होते. पोटातील अम्लतानाशक औषधात किण्वनविरोधी [→किण्वन ] म्हणून हे वापरतात.
कॅल्शियम पेरॉक्साइड : (CaO2). हे विद्राव्य कॅल्शियम लवणापासून बनविता येते. हे दंतधावनात आणि पोटातील अम्लतानाशक औषधात वापरतात. बी-बियाणे व धान्ये यांसाठी हे एक सुरक्षित निर्जंतुकीकारक व तापमानाचा परिणाम न होणारे असे पेरॉक्सी वर्गाचे संयुग आहे.
स्ट्राँशियम पेरॉक्साइड (SrO2) व बेरियम पेरॉक्साइड (BaO2) यांचा उपयोग शोभेच्या दारूमध्ये अनुक्रमे तांबडा व हिरवा प्रकाश निर्माण करण्यासाठी होतो.
झिंक पेरॉक्साइड : (ZnO2). हे रबर उद्योगात आणि दुर्गंधिहारक व त्वचारोगनाशक म्हणून औषधांत वापरले जाते.
पेरॉक्सी अम्ले : सल्फ्यूरिक अम्लातील एक OH गट काढून घेतला म्हणजे -SO2–OH हा अणुगट राहतो. तो हायड्रोजन पेरॉक्साइडातील एका हायड्रोजन अणूच्या जागी बसविला म्हणजे पेरॉक्सिमोनो-सल्फ्यूरिक अम्ल असते. दोन्ही हायड्रोजनांच्या जागी असे दोन गट बसविले म्हणजे पेरॉक्सिडायसल्फ्यूरिक अम्ल तयार होते.
पेरॉक्सिमोनोसल्फ्यूरिक अम्ल : (H2SO5). हे क्लोरोसल्फॉनिक अम्ल व हायड्रोजन पेरॉक्साइड यांपासून तयार होते. संहत (पाण्याचे प्रमाण कमी असलेले) सल्फ्यूरिक अम्ल व हायड्रोजन पेरॉक्साइड यांपासूनही हे बनविता येते. यालाच ‘कारो यांचे अम्ल’ असेही म्हणतात. याचे स्फटिक पांढरे असून ते ४५ º से. तापमानास वितळतात. हे व्यापारी प्रमाणावर बनविले जात नाही. प्रयोगशाळेत याचा उपयोग एक प्रबल व विशिष्ट प्रकारचा ऑक्सिडीकारक म्हणून केला जातो उदा., कीटोनांपासून एस्टरे व लॅक्टोने, सल्फाइडांची सल्फॉक्साइडे व सल्फोने, अमाइनांची अमाइन ऑक्साइडे बनविण्यासाठी. विक्रिया मिश्रणात तयार केलेल्या स्थितीत हे न आकसणारी लोकर बनविण्यासाठी वापरण्यात आले आहे.
पेरॉक्सिडायसल्फ्यूरिक अम्ल : (H2S2O8). हे सल्फ्यूरिक अम्ल असलेल्या जलीय विद्रावाचे विशिष्ट तर्हेने विद्युत् विच्छेदन (विद्रावातून विद्युत् प्रवाह पाठवून घटक अलग करण्याची क्रिया) केले असता याचा विद्राव मिळतो. शुद्ध अम्ल पांढरे व स्फटिकरूप असते. ते अत्यंत विक्रियाशील (ऑक्सिडीकारक) आणि अस्थिर आहे. पाण्याच्या विक्रियेने यापासून हायड्रोजन पेरॉक्साइड बनते. हायड्रोजन पेरॉक्साइड बनविण्यासाठी हे पूर्वी वापरीत.
पेरॉक्सी लवणे : पोटॅशियम पेरॉक्सिमोनोसल्फेट : (KHSO5) हे व्यापारी प्रतीचे लवण पांढरे असून पुरेसे टिकाऊ असते. कापड धुलाईत विरंजक म्हणून हे वापरले जाते.
अमोनियम पेरॉक्सिडायसल्फेट :[ किंवा अमोनियम परसल्फेट (NH4)2S2O8]. हे अमोनियम बाय सल्फेटाचा विद्राव वापरून, पेरॉक्सिडायसल्फ्यूरिक अम्ल बनविण्याच्या कृतीसारख्या प्रक्रियेने बनवितात. हे पांढरे, स्फटिकमय व किंचित आर्द्रताशोषक आहे. बहुवारिकीकरणात [→ बहुवारिकीकरण] उत्प्रेरक (विक्रिया सुलभतेने घडावी म्हणून उपयोगी पडणारा पण विक्रियेच्या शेवटी जसाच्या तसा राहणारा पदार्थ), प्रयोगशाळेत विक्रियाकारक, साबणात मिसळण्यासाठी मेदांच्या विरंजनाकरिता आणि काही रंजकद्रव्यांचे ऑक्सिडीकरण घडविण्यासाठी हे लवण उपयोगी पडते.
पोटॅशियम पेरॉक्सिडायसल्फेट :[ अथवा पोटॅशियम परसल्फेटK2S2O8]. हे लवण अमोनियम पेरॉक्सिडायसल्फेट बनविताना विद्युत् विच्छेदनानंतर जो विद्राव बनतो, त्यात पोटॅशियम बायसल्फेट मिसळून मोठ्या प्रमाणावर बनवितात. याचे पांढरे स्फटिक टिकाऊ असतात. पायसी बहुवारिकीकरणात [→ बहुवारिकीकरण ] आरंभकारक म्हणून हे महत्त्वाचे आहे. याचे इतर उपयोग अमोनियम पेरॉक्सिडाय-सल्फेटाप्रमाणेच आहेत.
सोडियम पेरॉक्सिबोरेटे : NaBO3.4H2O (टेट्राहायड्रेट) व NaBO3.H2O (मोनोहायड्रेट). बोरॅक्सच्या (Na2B4O7) विद्रावावर हायड्रोजन पेरॉक्साइड व सोडियम हायड्रॉक्साइड यांची विक्रिया केल्याने सोडियम पेरॉक्साइड टेट्राहायड्रेट बनते. त्यांचे निर्जलीकरण करून मोनोहायड्रेट बनवितात. दोन्ही लवणे पांढरी, स्फटिकमय व पुरेशी टिकाऊ आहेत. वस्त्रोद्योगात, धुलाईत, दंतधावनात, दातांच्या कवळ्या स्वच्छ करण्याच्या मिश्रणात व रंगद्रव्याच्या ऑक्सिडीकरणात ही उपयोगी पडतात.
पेरॉक्सी हायड्रेटे : लवणांच्या रेणूमध्ये, पाण्याच्या रेणूंचे समावेशन (मूळ रेणूतील अणू तसेच ठेवून नवीन रेणू त्यात सामावले जाणे) होऊन ज्याप्रमाणे सजल लवणे (हायड्रेटे) बनतात (उदा., CuSO4.5H2O), त्याचप्रमाणे हायड्रोजन पेरॉक्साइडाच्या रेणूंचे लवण रेणूंमध्ये समावेशन होऊन पेरॉक्सी हायड्रेटे बनतात. हायड्रोजन पेरॉक्साइड असलेल्या विद्रावातून लवणांचे स्फटिकीकरण करून किंवा त्यांचा हायड्रोजन पेरॉक्साइड मिश्रित दाट विद्राव कोरडा करून ती बनवितात.
सोडियम कार्बोनेट पेरॉक्सी हायड्रेट : (2Na2CO3.3H2O2) हे पांढरे व स्फटिकमय असते. हे मोठ्या प्रमाणावर बनविले जाते. दाताच्या कवळ्या स्वच्छ करण्याच्या मिश्रणात व घरगुती धुलाईच्या प्रक्षालकांत (डिटर्जंट्समध्ये) हे वापरतात.
सोडियम पायरोफॉस्फेट पेरॉक्सी हायड्रेट : (Na4P2O7.2H2O2) हे मोठ्या प्रमाणावर बनविले जाते. याचे पांढुरके स्फटिक असून त्यामध्ये ९ % सक्रिय ऑक्सिजन असतो. पाण्यात २० º से. तापमानासयाची विद्राव्यता ८.३ % आहे व pH मूल्य [→ पीएच मूल्य] ८ ते ९ असते.
सुपर ऑक्साइडे : यांच्या संरचनेत O2 ˉहा आयन (विद्युत् भारित रेणू) असतो. सर्व क्षार धातूंची सुपर ऑक्साइडे माहीत आहेत. पोटॅशियम सुपर ऑक्साइड हे या वर्गाचे सर्वांत महत्त्वाचे संयुग आहे.[→ पोटॅशियम].
कार्बनी संयुगे : हायड्रोजन पेरॉक्साइडाच्या संरचनेतील हायड्रोजन अणूंच्या जागी कार्बनी गट योजिले म्हणजे कार्बनी पेरॉक्सी संयुगांच्या संरचना बनतात.
उपस्थिती : चिनोपोडियम तेलामध्ये अँस्कॅरिडॉल नावाचा जो कृमिनाशक घटक आहे, तो एक स्थिर कार्बनी पेरॉक्साइड आहे.
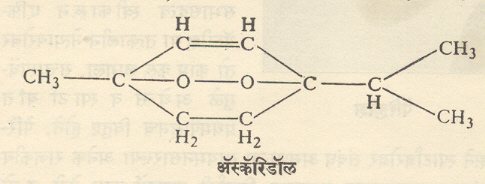
कित्येक नैसर्गिक पदार्थांवर अनिष्ट परिणाम होतात तेव्हा अंतिम द्रव्ये बनण्यापूर्वी पेरॉक्साइडे ही माध्यमिक संयुगे बनलेली असतात. उदा., मेदे (स्निग्ध पदार्थ) खवट होणे, यंत्रात घातलेले वंगण तेल चिकट होणे, जीवनसत्त्वांचे गुण नाहीसे होणे इत्यादी. डाय-एथिल ईथराचे ऊर्ध्वपातन (बंद भांड्यात तापवून बनणारी वाफ थंड करून घटक पदार्थ अलग मिळविणे) करताना अस्थिर कार्बनी पेरॉक्साइडे बनून स्फोट होण्याचा धोका संभवतो. यासाठीच नैसर्गिक व संश्लिष्ट (घटकद्रव्ये एकत्रित आणून तयार केलेल्या) पदार्थांमध्ये ऑक्सिडीकरण प्रतिबंधके मिसळतात.
पेरॉक्साइडे : कार्बनी पेरॉक्साइडांपैकी काही स्थिर असून उपयोगीही आहेत. उदा., डाय- t -ब्युटिल पेरॉक्साइड
[(CH3)3CCl(CH3)3]. t –ब्युटिल क्लोराइडावर
[(CH3)3CCl] हायड्रोजन पेरॉक्साइडाची विक्रिया करून हे बनविता येते. कार्बनी संयुगांच्या संश्लेषणात ते उपयोगी पडते.
डायबेंझॉइल पेरॉक्साइड : [C6H5COOOCOC6H5]. बेंझॉइल क्लोराइडावर क्षारमिश्र हायड्रोजन पेरॉक्साइडाची विक्रिया करून हे बनविता येते. हे चूर्णरूप व पांढऱ्या रंगाचे असून नेहमीच्या तापमानास स्थिर असते, पण तापविल्याने त्याचा स्फोट होतो. खाद्य तेले व धान्यांचे पीठ विरंजित करण्यासाठी आणि संश्लेषित रबर [→ रबर] व प्लॅस्टिके यांमध्ये बहुवारिकीकरणास आरंभ करून देणारे द्रव्य म्हणून याचा उपयोग होतो.
बहुसंख्य कार्बनी पेरॉक्साइडांच्या बाष्पाने डोकेदुखी उद्-भवते आणि संवेदी ऊतकांचा (समान रचना व कार्य असणाऱ्या पेशींच्या समूहांचा) उदा., घसा, फुप्फुसे यांच्या श्लेष्मल (बुळबुळीत) आवरणांचा, क्षोभ होतो. आघात, घर्षण किंवा उष्णता यांनी कित्येकांचा स्फोट होतो.
पेरॉक्सी अम्ले : परॲसिटिक अम्ल : ![]()
अँसिटिक अम्ल व हायड्रोजन पेरॉक्साइड यांच्या विक्रियेने हे औद्योगिक प्रमाणावर बनविले जाते व अँसिटिक अम्लात विरघळलेल्या स्थितीत विकले जाते. एपॉक्सी व हायड्रॉक्सी संयुगांच्या संश्लेषणाकरिता, तसेच जंतुनाशक व कवकनाशक (बुरशीसारख्या हरितद्रव्यरहित वनस्पतींचा नाश करणारे) म्हणून आणि प्रक्रिया-उपकरणे निर्जंतुक करण्यासाठी हे उपयोगी पडते.
पेरॉक्सी हायड्रेटे : यूरिया पेरॉक्सी हायड्रेट : [CO(NH2)2.H2O2]. हे कार्बनी पेरॉक्सी हायड्रेटाचे अक उदाहरण आहे.
इंग्रजीतील Per (उच्चार पर व पेर) या उपसर्गाने नेहमी पेरॉक्सी संयुगेच दर्शविली जातात असे नाही. त्याने एखाद्या मूलद्रव्याच्या ऑक्सिडीकरणाची अत्युच्च अवस्था (उदा., पोटॅशियम परमँगॅनेटातील मँगॅनिजाची) किंवा प्रतिष्ठापनाची (एक मूलद्रव्य काढून त्या जागी दुसरे घालण्याची) पूर्णावस्थाही सूचित केली जाते उदा., परक्लोरोएथेन म्हणजे एथेनमधील सर्व हायड्रोजन अणूंच्या जागी क्लोरीन अणू येऊन झालेले संयुग.
संदर्भ : Mark, H. F. and others, Ed., Kirk-Othmer Encyclopaedia of Chemical Technology, Vol. 14, New York, 1967.
कारेकर, न. वि. केळकर, गो. रा.
“