थॅलिक अम्ले : ही कार्बनी अम्ले असून यांच्या संरचनांत (रेणूमध्ये असलेल्या अणूंच्या रचनांत) बेंझीन वलयाला [⟶ बेंझीन] दोन कार्बॉक्सी गट (COOH) जोडलेले असतात. रेणुसूत्र (संयुगाच्या रेणूत असलेल्या मूलद्रव्यांचे प्रकार व त्यांच्या अणूंची संख्या दर्शविणारे सूत्र) C8H6O4 रेणुभार १६६·१३.
 बेंझीन वलयाला जोडलेल्या कार्बॉक्सी गटांच्या स्थानांनुसार यांचे तीन समघटक (रेणूतील अणूंचे प्रकार व संख्या तीच असलेली पण त्यातील अणूंची मांडणी भिन्न असलेली संयुगे) आहेत.
बेंझीन वलयाला जोडलेल्या कार्बॉक्सी गटांच्या स्थानांनुसार यांचे तीन समघटक (रेणूतील अणूंचे प्रकार व संख्या तीच असलेली पण त्यातील अणूंची मांडणी भिन्न असलेली संयुगे) आहेत.
(अ) या संयुगास १:२ बेंझीन डायकार्बॉक्सिलिक अम्ल, ऑर्थो बेंझीन डायकार्बॉक्सिलिक अम्ल, ऑर्थो थॅलिक अम्ल वा थॅलिक अम्ल म्हणतात (आ) हे संयुग १:३ बेंझीन डायकार्बॉक्सिलिक अम्ल, मेटा बेंझीन डायकार्बॉक्सिलिक अम्ल किंवा आयसोप्थॅलिक अम्ल व (इ) हे १:४ बेंझीन डायकार्बॉक्सिलिक अम्ल, पॅरा बेंझीन डायकार्बॉक्सिलिक अम्ल किंवा टेरेप्थॅलिक अम्ल म्हणून ओळखले जाते.
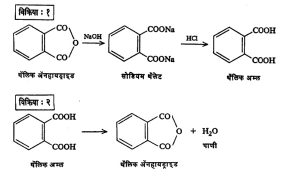 थॅलिक अम्ल : हे अम्ल प्रथम १८३६ मध्ये ऑग्यूस्त लॉरां यांनी १ : २ : ३ : ४ टेट्राक्लोरोनॅप्थॅलिनाचे नायट्रिक अम्लाने ऑक्सिडीकरण [⟶ ऑक्सिडीभवन] करून मिळविले. त्या काळी त्याला नॅप्थॅलिनिक अम्ल म्हणत. आधुनिक काळात मोठ्या प्रमाणात बनविण्यात येणाऱ्या थॅलिक ॲनहायड्राइड या संयुगापासून ते खाली दाखविल्याप्रमाणे तयार करतात (विक्रिया : १).
थॅलिक अम्ल : हे अम्ल प्रथम १८३६ मध्ये ऑग्यूस्त लॉरां यांनी १ : २ : ३ : ४ टेट्राक्लोरोनॅप्थॅलिनाचे नायट्रिक अम्लाने ऑक्सिडीकरण [⟶ ऑक्सिडीभवन] करून मिळविले. त्या काळी त्याला नॅप्थॅलिनिक अम्ल म्हणत. आधुनिक काळात मोठ्या प्रमाणात बनविण्यात येणाऱ्या थॅलिक ॲनहायड्राइड या संयुगापासून ते खाली दाखविल्याप्रमाणे तयार करतात (विक्रिया : १).
भौतिक गुणधर्म : वर्णहीन स्फटिक वितळबिंदू १९१° से. (बंद केलेल्या नळीत) थंड पाणी, ईथर व क्लोरोफॉर्म यांमध्ये अत्यल्प विद्राव्य (विरघळणारे) गरम पाणी तसेच अल्कोहॉल, बेंझीन इ. कार्बनी विद्रावकांत (विरघळविणाऱ्या पदार्थांत) सहज विद्राव्य.
रासायनिक गुणधर्म : तापविल्याने किंवा निर्जलीकारकांच्या (पाणी काढून घेण्याची क्रिया करणाऱ्या पदार्थांच्या) क्रियेने थॅलिक ॲनहायड्राइड बनते (विक्रिया : २).
फॉस्फरस पेंटाक्लोराइड (PCI5) किंवा झिंक क्लोराइडासह थायोनील क्लोराइड (SOCI2) यांच्याबरोबर तापविल्यास थॅलॉइल क्लोराइड मिळते.
मोनोहायड्रिक (एक OH गट असलेल्या) अल्कोहॉलाशी या अम्लाचा संयोग होऊन डायएस्टरे बनतात. उदा., मिथिल अल्कोहॉलाच्या विक्रियेने डायमिथिल थॅलेट बनते.
डायहायड्रिक (दोन OH गट असलेल्या) अल्कोहॉलामुळे जे एस्टर प्रथम बनते त्याचे बहुवारिकीकरण (अनेक रेणूंचा संयोग होऊन अधिक जटिल रेणू तयार होण्याची क्रिया) होऊन दीर्घ शृंखलाकार बहुवारिक संयुगे बनतात. उदा., एथिलीन ग्लायकॉल वापरल्यास, (विक्रिया : ३).
ट्रायहायड्रिक (तीन OH गट असलेल्या) अल्कोहॉलाची (उदा., ग्लिसरिनाची) विक्रिया केल्यास प्रथम ग्लिसरिनातील कडेच्या हायड्रॉक्सी गटाशी संयोग होतो व शृंखलाकार बहुवारिक बनते. त्यानंतर त्यातील द्वितीयक हायड्रॉक्सी गटाची (–CH गटाला जोडलेल्या OH गटाची) विक्रिया होऊन दीर्घ शृंखलांमध्ये पार्श्वबंध (दोन साखळ्या परस्परांस जोडणारे बंध) तयार होऊन त्रिमितीय बहुवारिकी संरचना निर्माण होतात. त्यांना अल्किड रेझिने म्हणतात. यांच्या औद्योगिक उत्पादनासाठी थॅलिक अम्लाऐवजी थॅलिक ॲनहायड्राइड वापरतात. पॉलिहायड्रिक (अनेक OH गट असलेल्या) अल्कोहॉलांच्या विक्रियांनीही या वर्गाची रेझिने बनतात [⟶ रेझिने].
पोटॅशियम हायड्रॉक्साइडाबरोबर तापविल्यास याचे अपघटन (रेणूचे तुकडे होणे) होऊन बेंझीन तयार होते.
सोडियम पारदमेलाने (पाऱ्याबरोबर बनलेल्या मिश्रधातूने) ⇨ क्षपण केल्यास डाय–,टेट्रा– व हेक्झॅ–हायड्रोप्थॅलिक अम्ले बनतात. सोडियम थॅलेट व जलीय (पाण्यात विरघळवून बनविलेले) मर्क्युरिक ॲसिटेट यांचे सोडियम ॲसिटेटाच्या उपस्थितीत पश्ववाहन (वाफ होऊन उडून जाणारा पदार्थ द्रवरूप होऊन पुन्हा विक्रिया मिश्रणात परत येईल अशी योजना) केल्यास थॅलिक अम्लाचे पारदीकरण (संयुगात पाऱ्याच्या अणूचा अंतर्भाव होणे) होते.
 थॅलिक ॲनहायड्राइड : हा थॅलिक अम्लाचा अत्यंत महत्त्वाचा अनुजात (एका संयुगापासून रासायनिक विक्रियेने बनविलेले दुसरे संयुग) आहे.
थॅलिक ॲनहायड्राइड : हा थॅलिक अम्लाचा अत्यंत महत्त्वाचा अनुजात (एका संयुगापासून रासायनिक विक्रियेने बनविलेले दुसरे संयुग) आहे.
ऑर्थो झायलिनाचे किंवा नॅप्थॅलिनाचे ऑक्सिडीकरण केले म्हणजे हे बनते. याच्या औद्योगिक उत्पादनासाठी पूर्वी मर्क्युरिक सल्फेट हे उत्प्रेरक (रासायनिक विक्रिया त्वरेने अथवा कमी तापमानास व्हावी म्हणून वापरलेला व शेवटी तसाच उरणारा पदार्थ) वापरून दगडी कोळशाच्या डांबरापासून मिळणाऱ्या नॅप्थॅलिनाचे सल्फ्यूरिक अम्लाने ऑक्सिडीकरण करीत. ही पद्धत पहिल्या महायुद्धाच्या काळापर्यंत प्रचलित होती.
आधुनिक औद्योगिक प्रक्रियेत नॅप्थॅलिनाची वाफ आणि हवा यांचे मिश्रण व्हॅनेडियम पेंटॉक्साइड ह्या उत्प्रेरकावरून ३०° ते ५००° से. तापमानास प्रवाहित केले जाते. या प्रक्रियेच्या तपशिलाचे अनेक प्रकार आहेत. एका प्रकारात वितळलेल्या नॅप्थॅलिनात उष्ण हवा प्रवाहित करतात. त्यामुळे होणारे हवा व नॅप्थॅलिनाची वाफ यांचे मिश्रण जास्त हवा मिसळून बारीक गोळ्यांच्या रूपात असलेला उत्प्रेरक भरलेल्या नळ्यांमधून नेले जाते. दुसऱ्या एका प्रकारात चूर्णरूप उत्प्रेरक संधारित (लोंबकळत्या) अवस्थेत ठेवून त्याचा संपर्क नॅप्थॅलिनाची वाफ आणि हवा यांच्याशी साधला जातो. विक्रिया झाल्यावर बनलेल्या मिश्रणाच्या प्रवाहातून उत्प्रेरक वेगळा करण्याची योजना असते. त्यानंतर एकामागोमाग एक असलेल्या शीतक पात्रांच्या योगाने विक्रियेत तयार झालेले बाष्प मिश्रण थंड करतात. त्यायोगाने पहिल्या पात्रात शुद्ध थॅलिक ॲनहायड्राइड निक्षेपाच्या रूपाने जमते. त्यानंतरच्या शीतक पात्रातील थॅलिक ॲनहायड्राइड तितके शुद्ध नसते. त्यामध्ये मॅलेइक ॲनहायड्राइड, बेंझॉइक अम्ल, नॅप्थॅक्किनोन इत्यादींची भेसळ असते. शेवटच्या पात्रातून बाहेर पडणारे बाष्पमिश्रण पाण्याने धुतले जाते. त्यामुळे त्यात राहिलेले मॅलेइक ॲनहायड्राइड निघून येते.
ऑर्थो झायलीन व खनिज तेलाच्या शुद्धीकरणातून मिळणारे नॅप्थॅलीन यांचाही उपयोग वरील प्रक्रियेत करून औद्योगिक प्रमाणावर थॅलिक ॲनहायड्राइड आता बनविले जाते.
भौतिक गुणधर्म : यांचे स्फटिक वर्णहीन व सुईच्या आकाराचे असतात. तापविल्यास याचे संप्लवन होते (घनरूपातून द्रवरूपात न जाता एकदम वायुरूपात जाते). थंड पाणी, एथिल अल्कोहॉल व ईथर यांत अल्प प्रमाणात विरघळते गरम पाणी व बेंझीन यांत सहज विरघळते. ते ज्वालाग्राही (सहज पेट घेणारे) आहे.
रासायनिक गुणधर्म : फॉस्फरस पेंटाक्लोराइडाच्या विक्रियेने याचे थॅलॉइल क्लोराइड बनते. थॅलिक अम्लापासूनही ते या क्रियेने तयार होते. क्लोरिनाच्या विक्रियेने, बेंझीन वलयातील ४ हायड्रोजन अणूंच्या जागी ४ क्लोरिनाचे अणू येतात व टेट्राक्लोरोप्थॅलिक ॲनहायड्राइड तयार होते. सल्फ्यूरिक अम्लाच्या विक्रियेने ३–सल्फो–व ४– सल्फोप्थॅलिक ॲनहायड्राइड हे अनुजात बनतात (विक्रिया : ४). सल्फ्यूरिक अम्लाच्या उपस्थितीत वाफाळ नायट्रिक अम्लाची विक्रिया केल्यास ३–नायट्रो व ४–नायट्रोप्थॅलिक अम्ले बनतात.
आमोनियाच्या विक्रियेने परिस्थितीनुसार थॅलॅमिक अम्ल, थॅलोनायट्राइल, थॅलामाइड व थॅलिमाइड ही संयुगे तयार होतात (विक्रिया : ५).
धातुलवणाच्या उपस्थितीत वितळलेल्या थॅलिक ॲनहायड्राइडातून अमोनिया प्रवाहित केल्यास किंवा थॅलिक ॲनहायड्राइड, यूरिया व धातुलवण यांचे मिश्रण बोरिक अम्ल हे उत्प्रेरक वापरून तापविले, तर थॅलोसायनीन या वर्गाची रंजकद्रव्ये मिळतात [⟶ रंजक व रंजकद्रव्ये]. प्रकाश, उष्णता, अम्ले व क्षार (अम्लाशी विक्रिया झाल्यास लवणे देणारे पदार्थ, अल्कली) यांचा या द्रव्यावर परिणाम होत नाही म्हणून ती महत्त्वाची आहेत.
थॅलिमाइडावर अल्कोहॉली पोटॅशियम हायड्रॉक्साइडाची विक्रिया झाल्यास पोटॅशियम थॅलिमाइड बनते (विक्रिया : ६).
गाब्रीएल विक्रियेने प्राथमिक अमाइने (NH2 गट असलेली) व आल्फा ॲमिनो अम्ले या संयुगांपासून पुढीलप्रमाणे हे बनविता येते म्हणून हे महत्त्वाचे आहे (विक्रिया : ७).
 थॅलिमाइडापासून सोडियम हायपोक्लोराइटाच्या विक्रियेने अँथ्रॅनिलिक अम्ल औद्योगिक प्रमाणात बनवितात (विक्रिया : ८).
थॅलिमाइडापासून सोडियम हायपोक्लोराइटाच्या विक्रियेने अँथ्रॅनिलिक अम्ल औद्योगिक प्रमाणात बनवितात (विक्रिया : ८).
वितळलेल्या थॅलिक ॲनहायड्राइडातून तांबे अथवा क्रोमियम यांच्या उपस्थितीत वाफेचा प्रवाह सोडला, तर कार्बन डाय–ऑक्साइड बाहेर पडतो व बेंझॉइक अम्ल बनते. अल्कोहॉलांशी विक्रिया केल्यास मोनोएस्टर व डायएस्टर किंवा मिश्रएस्टर ही संयुगे बनतात.
पॉलिहायड्रिक अल्कोहॉले वापरल्यास (उदा., ग्लिसरीन) जी एस्टरे बनतात, त्यांच्या बहुवारिकीकरणाने अल्किड रेझिने [⟶ रेझिने] मिळतात.
फिनॉलाच्या दोन रेणूंबरोबर थॅलिक ॲनहायड्राइडाचा संयोग होतो व फिनॉलप्थॅलीन हे उपयुक्त संयुग बनते (विक्रिया : ९). फिनॉलातील OH गटाच्या पॅरा स्थानी अशा विक्रिया घडून येतात. पॅरा स्थान मोकळे नसेल, तर ऑर्थो स्थानी विक्रिया होते. उदा., पॅरा क्लोरोफिनॉलाची विक्रिया.
१–हायड्रॉक्सि–४ क्लोरोअँथ्रॅक्किनोनापासून बोरिक अम्लमिश्रित सल्फ्यूरिक अम्लाने क्किनिझरीन हे एक उपयुक्त संयुग बनते (विक्रिया : १०).
रिसॉरसिनॉलाबरोबर विक्रिया होऊन फ्ल्युओरेसीन हे संयुग मिळते (विक्रिया : ११).
याच तऱ्हेने विक्रिया होऊन मेटा डायएथिल ॲमिनोफिनॉल या संयुगापासून ऱ्होडामाइन–बी हे रंजकद्रव्य मिळते [⟶ रंजक व रंजकद्रव्ये].
कॅटेचोलाशी संयोग केल्याने ॲलिझरीन (मंजिष्ठातील रंजकद्रव्य) मिळते.
क्षारयुक्त हायड्रोजन पेरॉक्साइडाच्या विक्रियेने बनणारे माध्यमिक संयुग अम्लधर्मी केले म्हणजे मोनोपरप्थॅलिक अम्ल मिळते (विक्रिया : १२). हे एक विक्रियाकारक आहे.
उपयोग : थॅलिक ॲनहायड्राइडाची अनेक एस्टरे प्लॅस्टिकीकारके म्हणून उपयोगी पडतात [⟶प्लॅस्टिक व उच्च बहुवारिके]. उदा., डायऑक्टिल, ऑक्टिल डेसिल, डायमिथिल, डायएथिल आणि डायब्युटिल इ. थॅलेटे. मिथिल व एथिल थॅलेटे कीटक प्रतिवारक म्हणून वापरतात. पॉलिहायड्रिक अल्कोहॉलांच्या विक्रियेने (उदा., ग्लिसरीन, पेंटाएरिथ्रिटॉल, ग्लायकॉले इ.) बनणारी संयुगे ‘अल्किड रेझिने’ या वर्गात पडतात. त्यांचा उपयोग टिकाऊ व त्वरित वाळणाऱ्या रंगलेपात होतो. अभ्रक चिकटविण्यासाठीही ती वापरतात. अँथ्रॅक्किनोन व त्यापासून बनणारे रंग, तसेच फ्लुओरेसीन व त्याचे अनुजात, ऱ्होडामाइन व थॅलोसायनीन रंग आणि फिनॉलप्थॅलीन, सल्फाप्थॅलिडीन ही औषधी संयुगे इत्यादींच्या संश्लेषणात (घटकद्रव्ये एकत्र आणून कृत्रिम रीतीने तयार करण्याच्या प्रक्रियेत) थॅलिक ॲनहायड्राइड लागते.
पन्हळी पत्रे व गलबतांचे सांगाडे तयार करण्यासाठी उपयुक्त पदार्थ बनविण्याच्या कृतीत थॅलिक ॲनहायड्राइड हे एक घटक द्रव्य असते. थॅलिक ॲनहायड्राइडापासून बनणारे पोटॅशियम हायड्रोजन थॅलेट पाणी शोषून न घेणारे, शुद्ध करण्यास सोपे व पाण्यात विद्राव्य असल्यामुळे ⇨ अनुमापन करून विद्रावात किती क्षार आहे, हे ठरविण्यासाठी मूलमापक (मान्य करण्यात आलेले मूलभूत माप) म्हणून वापरले जाते.
धोके : थॅलिक ॲनहायड्राइडाची बारीक पूड आणि वाफ यांचे हवेबरोबर झालेले मिश्रण स्फोटक असते. बारीक पूड आणि वाफ यांनी डोळे, नाक, घसा व श्वसनमार्गाचा वरचा भाग यांचा क्षोभ होतो. ते विषारी नाही, पण पोटात गेल्यास आतड्यावर स्थानिक परिणाम होतो. याचा पुनःपुन्हा संपर्क झाल्यास त्वचेचा प्रक्षोभ होतो. त्यामुळे डोळ्यांची जळजळ किंवा नाकातील श्लेष्मल (बुळबुळीत) आवरणात रक्ताधिक्य किंवा जखमा होतात. ज्यांचा या रसायनाशी संबंध येतो त्यांनी भुकटी व वाफेचा भपकारा यांच्या फार संपर्कात येणे टाळावे.
भारतीय उत्पादन: मागणीच्या मानाने भारतीय उत्पादन फार कमी आहे. बहुतेक पुरवठा आयात करून केला जातो. हावडा येथील शालिमार टार प्रॉडक्ट्स हा कारखाना दर साल ७०० टन नॅप्थॅलिनापासून थॅलिक ॲनहायड्राइड बनवितो. हे नॅप्थॅलीन टाटा आयर्न अँड स्टील कंपनी व इंडियन आयर्न अँड स्टील कंपनी या कारखान्यांकडून मिळते. सरकारी क्षेत्रात असणाऱ्या तिन्ही कारखान्यांतील दगडी कोळशाचे डांबर वापरले, तर दर साल ६,००० टन नॅप्थॅलीन मिळू शकेल. जिएलगोरा येथील सेंट्रल फ्यूएल रिसर्च इन्स्टिट्यूटने विशेष तऱ्हेचे व्हॅनेडियम पेंटॉक्साइड वापरून प्रत्यक्ष दगडी कोळशाच्या उदासीन डांबरतेलापासून थॅलिक ॲनहायड्राइड बनविण्याची एक प्रक्रिया सिद्ध केली आहे. दुर्गापूर केमिकल्स लि., हेर्डिलिया केमिकल्स लि., (अहमदाबाद–बडोदा) या चार कारखान्यांतही थॅलिक ॲनहायड्राइडाचे उत्पादन करण्यात येत असून त्यांची वार्षिक क्षमता १९७३ साली अनुक्रमे (आकडे टनांत) ३,३०० ६,१०० ६,००० व ६,००० होती. थॅलिक ॲनहायड्राइडाचे १९७० मध्ये ७,३५५ टन, १९७१ मध्ये ६,०९३ टन, १९७२ साली ५,२४९ टन व १९७३ मध्ये ४,१९७ टन उत्पादन झाले. १९७०-७१ मध्ये ५,२९१ टन, १९७१-७२ मध्ये १४,६४७ टन, १९७२-७३ मध्ये ३,७९४ टन, १९७३-७४ मध्ये ५,६३५ टन व १९७४-७५ मध्ये ६,४६६ टन थॅलिक ॲनहायड्राइडाची आयात करण्यात आली. जर्मन तंत्रविद्येच्या आधारे हैदराबाद येथील एंजिनिअर्स इंडिया लि. या कारखान्यानेही थॅलिक ॲनहायड्राइडाचे उत्पादन करण्यास १९७६ मध्ये सुरूवात केली आहे. थॅलिक एस्टरे व थॅलिक अम्ल यांचे भारतीय उत्पादनही अल्प आहे.
आयसोप्थॅलिक अम्ल: भौतिक गुणधर्म : वर्णहीन स्फटिक वितळबिंदू ३४५° से. (बंद नळीत) थंड पाण्यात अविद्राव्य गरम पाण्यात थोडे विरघळते मिथिल अल्कोहॉलात आणि उष्ण ग्लेशियल ॲसिटिक अम्लात पाण्यापेक्षा जास्त विरघळते बेंझीन व टेल्यूइन यांत विरघळत नाही.
रासायनिक गुणधर्म : उच्च तापमानास उत्प्रेरकाशिवाय व कमी तापमानास उत्प्रेरक (खनिज अम्ले) वापरल्यास अल्कोहॉलांशी संयोग होऊन डायएस्टरे बनतात. उदा., मिथिल अल्कोहॉलापासून डायमिथिल आयसोप्थॅलेट बनते.
पॉलिहायड्रिक अल्कोहॉलाबरोबर २००° से. तापमानास विक्रिया होते व पॉलिएस्टरे बनतात.
फॉस्फरस पेंटाक्लोराइड किंवा थायोनील क्लोराइड यांच्या विक्रियांनी आयसोप्थॅलॉइल क्लोराइड हे संयुग मिळते.
हॅलोजनांच्या (क्लोरीन, ब्रोमीन व आयोडीन) यांच्याशी विक्रिया होऊन टेट्राहॅलोआयसोप्थॅलिक अम्ले बनतात. उदा., क्लोरिनाच्या विक्रियेने टेट्राक्लोरोआयसोप्थॅलिक अम्ल मिळते.
पॅलॅडियम या उत्प्रेरकाच्या उपस्थितीत हायड्रोजनीकरण (रेणूत हायड्रोजनाचा समावेश करण्याची क्रिया) केल्यास सायक्लोहेक्झेन १ : ३ डायकार्बॉक्सी अम्ल बनते.
ॲडिपिक अम्लाची हेक्झॅमिथिलीन डाय-अमाइनाबरोबर जशी विक्रिया [⟶ तंतु, कृत्रिम] होते तशीच आयसोप्थॅलिक अम्लाचीही होऊन लवण बनते.
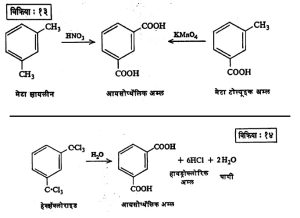 प्राप्ती : नायट्रिक वा क्रोमिक अम्लाने मेटा झायलिनाचे ऑक्सिडीकरण केल्यास, तसेच पोटॅशियम परमँगॅनेटाने मेटा टोल्यूइक अम्लाचे ऑक्सिडीकरण केल्यास हे अम्ल बनते (विक्रिया : १३).
प्राप्ती : नायट्रिक वा क्रोमिक अम्लाने मेटा झायलिनाचे ऑक्सिडीकरण केल्यास, तसेच पोटॅशियम परमँगॅनेटाने मेटा टोल्यूइक अम्लाचे ऑक्सिडीकरण केल्यास हे अम्ल बनते (विक्रिया : १३).
मेटा झायलिनाच्या मिथिल गटांचे क्लोरिनीकरण करून मिळणाऱ्याहेवझॅक्लोराइडाचे जलीय विच्छेदन (पाण्यात विक्रियेने रेणूचे तुकडे पाडण्याची क्रिया) केले म्हणजेही आयसोप्थॅलिक अम्ल तयार होते (विक्रिया : १४).
यासाठी लागणारे मेटा झायलीन दगडी कोळशाच्या डांबरापासून जे झायलीन मिश्रण मिळते त्यातून वेगळे करावे लागते [⟶ झायलीन].
औद्योगिक उत्पादन : १९५६ साली हे प्रथम औद्योगिक प्रमाणात बनविण्यात आले. त्यासाठी प्रथम मेटा झायलिनाचे गंधक व जलीय अमोनिया वापरून २६०°–३१५° से. या तापमानास व ७२ ते १५० किग्रॅ./सेंमी.२ इतका दाब ठेवून या अम्लाच्या अमाइडात रूपांतर करतात. त्याचे जलीय विच्छेदन केले म्हणजे हे अम्ल मिळते.
त्यानंतर प्रचारात आलेल्या एका पद्धतीत झायलीन मिश्रण वापरून हवेने त्याचे द्रवावस्था–ऑक्सिडीकरण करतात. त्याकरिता उत्प्रेरक म्हणून ब्रोमीन वापरतात. विक्रिया झाल्यावर जे अम्ल मिश्रण मिळते, त्यातून आयसोप्थॅलिक अम्ल वेगळे करतात. याचे उत्पादन मुख्यतः अमेरिकेच्या संयुक्त संस्थानांत होते.
उपयोग: आयसोप्थॅलिक अम्ल प्रोपिलीन ग्लायकॉल, फ्यूमारिक किंवा मॅलेइक अम्ल अथवा तत्सम एखादे अतृप्त अम्ल (ज्यामधील कार्बन अणू एकमेकांस द्विबंधाने जोडले गेले आहेत असे अम्ल) यांपासून अतृप्त पॉलिएस्टर रेझिने [⟶ रेझिने] मिळतात. ती स्टायरीन, व्हिनिलटोल्यूइन इत्यादींशी संयोग पावून ऊष्मादृढ (दाब व उष्णता दिली असता कठीण बनणारे व पुन्हा मृदू होऊ शकत नाहीत असे) पदार्थ बनतात. असेच पदार्थ थॅलिक ॲनहायड्राइड वापरूनही मिळतात पण त्यापेक्षा आयसोप्थॅलिक अम्लापासून बनणारे पदार्थ मजबुती, रसायनरोध व उष्णतारोध या गुणांत सरस असल्यामुळे मोटारींचे भाग, जलक्रीडेच्या नौकांचे सांगाडे यांसाठी जास्त उपयुक्त ठरतात.
आयसोप्थॅलिक अम्लापासून बनलेली अल्किड रेझिने घरे रंगविण्याच्या रंगात आणि हे अम्ल व हेक्झॅमिथिलीन डाय–अमाइन यांपासून बनलेल्या पॉलिअमाइडाचे तंतू उष्णतारोधी असल्यामुळे मोटारींच्या धावांच्या (टायरांच्या) बनावटीत नायलॉनाच्या तंतूबरोबर वापरले जातात.
धोके : या अम्लाची बारीक भुकटी व हवा यांचे मिश्रण स्फोटक असते ७००° से. तापमानास ते पेट घेते. हे अम्ल पोटात गेल्यास विषबाधा संभवत नाही. ते थॅलिक ॲनहायड्राइडापेक्षा त्वचेस कमी क्षोभकारक आहे. तथापि थॅलिक ॲनहायड्राइड वापरताना जशी काळजी घेतात तशीच या अम्लाच्या बाबतीतही श्रेयस्कर ठरते.
टेरेप्थॅलिक अम्ल : भौतिक गुणधर्म : वर्णहीन, सुईसारखे स्फटिक वितळबिंदू ४२५° से. (बंद नळीत) सु. ३००° से. ला संप्लवन पावते पाण्यात आयसोप्थॅलिक अम्लापेक्षाही कमी विद्राव्य उष्ण सल्फ्यूरिक अम्ल, पिरीडीन, डायमिथिल सल्फॉक्साइड व डायमिथिल फॉर्मामाइड यांत विरघळते.
रासायनिक गुणधर्म : यातील बेंझीन वलयात नेहमीप्रमाणे प्रतिष्ठापन होते. उदा., संहत (विद्रावातील प्रमाण जास्त असलेल्या) नायट्रिक अम्लाने मोनो नायट्रो अनुजात व वाफाळ सल्फ्यूरिक अम्लाने सल्फोटेरेप्थॅलिक अम्ल बनते.
फॉस्फरस पेंटाहॅलाइड किंवा थायोनील हॅलाइडे यांनी टेरेप्थॅलॉइल हॅलाइडे मिळतात. उदा., फॉस्फरस पेंटाक्लोराइड किंवा थायोनील क्लोराइड यांच्या विक्रियांनी टेरेप्थॅलॉइल क्लोराइड बनते. ही हॅलाइडे विद्राव्य व जास्त विक्रियाशील असल्यामुळे या अम्लाचे अनुजात बनविण्यास उपयोगी पडतात.
उच्च तापमान असल्यास उत्प्रेरकाशिवाय व कमी तापमान असेल, तर प्रबल अम्ले उत्प्रेरक म्हणून वापरून अल्कोहॉलांबरोबर संयोग होऊन एस्टरे बनतात. उदा., ४–डायमिथिल टेरेप्थॅलेट हे एस्टर व एथिलीन ग्लायकॉल यांची विक्रिया केल्यास एस्टर–अंतरण (एस्टरातील अल्किल गट आणि ग्लायकॉलातील अल्किल गट यांची अदलाबदल होण्याची क्रिया) होऊन ग्लायकॉलाचे टेरेप्थॅलेट व मिथिल अल्कोहॉल तयार होते. ग्लायकॉलाच्या एस्टराचे बहुवारिकीकरण होऊन पॉलिएस्टरे बनतात. ती तंतुद्रव्ये म्हणून महत्त्वाची आहेत.
या अम्लाची सोडियम, पोटॅशियम व अमोनियम लवणे जलविद्राव्य आहेत. अम्लाचे शुद्धीकरण करण्यासाठी त्यांचा उपयोग करता येतो.
हे अम्ल सामान्य विद्रावकांत अविद्राव्य असल्यामुळे आणि त्याचा वितळबिंदू उच्च असल्यामुळे त्यावर विक्रिया घडवून आणणे इतर थॅलिक अम्लांपेक्षा कठीण असते.
औद्योगिक उत्पादन : दुसऱ्या महायुद्धानंतर या अम्लाचे औद्योगिक उत्पादन सुरू झाले. पॅरा झायलिनाचे विरल नायट्रिक अम्लाने ऑक्सिडीकरण करून हे अम्ल प्रथम बनवीत असत. त्यानंतर प्रचारात आलेल्या काही प्रक्रियांत ॲसिटिक अम्ल विक्रिया माध्यम म्हणून वापरून हवेच्या योगाने पॅरा झायलिनाचे ऑक्सिडीकरण करीत असत. त्याकरिता कोबाल्ट व मँगॅनीज या धातू उत्प्रेरक म्हणून वापरीत. त्यांचे प्रवर्तन (उत्प्रेरकाची क्रिया त्वरेने घडवून आणणे) ब्रोमिनाने केले जात असे आणि १७५°–२३०° से. तापमान व १४ ते २८ किग्रॅ./ सेंमी.२ दाब वापरावा लागे. दुसऱ्या एका प्रक्रियेत ॲसिटाल्डिहाइड विक्रिया प्रवर्तक म्हणून वापरतात. मिथिल एथिल कीटोन विक्रिया प्रवर्तक वापरून शुद्ध ऑक्सिजन किंवा ऑक्सिजनमिश्र हवेने ऑक्सिडीकरण घडविण्याचीही एक प्रक्रिया ज्ञात आहे. या क्रियांची एकस्वे (पेटंटे) वेगवेगळ्या कंपन्यांनी घेतलेली आहेत. या पद्धतींनी बनविलेले टेरेप्थॅलिक अम्ल नायट्रिक अम्लाने बनविलेल्या अम्लापेक्षा जास्त शुद्ध असते.
नॅप्थॅलिनापासून प्रथम थॅलिक ॲनहायड्राइड बनवावयाचे व नंतर त्याचा पुनर्विन्यास (रेणूच्या संरचनेत फरक घडविण्याची क्रिया) करून हे अम्ल बनविण्याची एक प्रक्रिया जपानमध्ये वापरली जाते.
टोल्यूइन हे प्रारंभिक द्रव्य वापरून व प्रथम बेंझॉइक अम्ल बनवून नंतर त्याचे टेरेप्थॅलिक अम्लात रूपांतर करण्याचीही एक पद्धत प्रचलित आहे. या पद्धतीत टेरेप्थॅलिक अम्लाबरोबरच बेंझीनही तयार होते.
फॉर्माल्डिहाइड व हायड्रोक्लोरिक अम्ल यांची विक्रिया टोल्यूइनावर करून त्यातील मिथिल गटाच्या ऑर्थो आणि पॅरा स्थानी क्लोरोमिथिल गट (–CH2CI) असलेली संयुगे बनवावयाची व नायट्रिक अम्लाने त्यांचे ऑक्सिडीकरण करावयाचे अशी एक प्रक्रिया आहे. या प्रक्रियेने ऑर्थो प्थॅलिक व टेरेप्थॅलिक अम्लांचे मिश्रण मिळते. त्यातून टेरेप्थॅलिक वेगळे करतात. ही प्रक्रिया जपानमध्ये वापरात आहे. बहुवारिक बनविण्यालायक डायमिथिल टेरेप्थॅलेट बनविण्याची एक प्रक्रिया १९४९ मध्ये सिद्ध केली गेली. या प्रक्रियेत सल्फ्यूरिक अम्लाच्या उपस्थितीत १०५° से. तापमान व ३·५ किग्रॅ./ सेंमी.२ दाब वापरून टेरेप्थॅलिक अम्लाचे मिथिल अल्कोहॉलाने एस्टरीकरण घडवितात. या प्रक्रियेने उताराही चांगला येतो परंतु या विक्रियेत मिथिल अल्कोहॉलाचे डायमिथिल ईथरही बनते, ही एक उणीव आहे.
मिथिल अल्कोहॉल या विक्रिया माध्यमात उच्च तापमान व दाब यांच्या साहाय्याने उत्प्रेरकाशिवाय किंवा उत्प्रेरकाने एस्टरीकरण घडवून आणण्याच्या प्रक्रिया प्रचलित आहेत. बनलेल्या एस्टराचे शुद्धीकरण करण्यासाठी स्फटिकीकरण व ऊर्ध्वपातन (वाफ करून व मग ती थंड करून घटकद्रव्ये अलग करण्याची क्रिया) करून केले जाते.
पॅरा झायलिनापासून एकदम डायमिथिल टेरेप्थॅलेट बनविण्याची एक प्रक्रियाही उपलब्ध आहे. तिला विट्टेन–हर्त्कुलीझ प्रक्रिया म्हणतात. या प्रक्रियेत झायलीन हे विक्रिया माध्यम असते आणि कोबाल्ट हे उत्प्रेरक १४९° से. तापमान आणि ३·५–७·० किग्रॅ./सेंमी.२ दाब यांचा वापर करून हवेने पॅरा टोल्यूइटाचे पॅरा टोल्यूइक अम्लात रूपांतर करतात व लगेच त्यापासून मिथिल पॅरा टोल्यूएट बनवितात. कोबाल्ट उत्प्रेरक २०५° से. तापमान आणि १४ ते २१ किग्रॅ./सेंमी.२ दाब वापरून हवेने मिथिल पॅरा टोल्यूइटाचे ऑक्सिडीकरण केले म्हणजे मोनो मिथिल टेरेप्थॅलेट बनते. मिथिल अल्कोहॉलाने त्यापासून डायमिथिल टेरेप्थॅलेट बनविले जाते.
सर्व पॉलिएथिलीन टेरेप्थॅलेट १९६३ पर्यंत डायमिथिल टेरेप्थॅलेटापासून बनवीत असत. तथापि ही पद्धत वापरण्यात काही तोटेही आहेत. त्यांपैकी एक म्हणजे प्रक्रियेत तयार होणारे आणि एथिलीन ग्लायकॉलात मिश्र असलेले मिथिल अल्कोहॉल परत मिळवावे लागते. त्यामुळे तंतू बनविण्यासाठी उपयोगी पडेल अशा प्रतीचे टेरेप्थॅलिक अम्ल बनवून तेच वापरावे या दृष्टीने प्रयत्नांना चालना मिळाली. त्या वेळेपर्यंतच्या प्रक्रियांनी अशा गुणवत्तेचे अम्ल मिळत नसे. द्रवावस्थेत ऑक्सिडीकरणाच्या प्रक्रिया जास्त जबरदस्त परिस्थितीत घडविल्या व मिळणाऱ्या अम्लाचे स्फटिकीकरण केले, तर हे उद्दिष्ट साध्य होते. औद्योगिक प्रतीच्या अम्लाचे उच्च तापमानास संप्लवन करणे, विद्राव बनविणे, त्याची डायसोडियम, डायपोटॅशियम किंवा डाय–अमोनियम लवणे बनविणे, तसेच त्याचे पृष्ठशोषण करणे इ. क्रियांचा शुद्धीकरणासाठी उपयोग करून तंतुद्रव्य बनविण्यालायक टेरेप्थॅलिक अम्ल बनविण्याच्या प्रक्रियांची एकस्वे घेण्यात आली आहेत.
बहुवारिकीकरणासाठी योग्य टेरेप्थॅलिक अम्ल कोणत्या कसोट्यांस उतरले पाहिजे, याविषयीचा तपशील उपलब्ध आहे.
वापरण्यातील सुरक्षितता : डायमिथिल थॅलेटाचा ज्वलनांक (पेट घेण्याचे तापमान) ५७०° से. व टेरेप्थॅलिक अम्लाचा ६८०° से. आहे. यांची वाफ किंवा बारीक भुकटी आणि हवा यांची मिश्रणे स्फोटक असतात. टेरेप्थॅलिक अम्ल फारसे विषारी नाही. त्याच्या संपर्काने त्वचेचा सौम्य क्षोभ होतो, पण ते त्वचेतून शोषले जात नाही. याची बारीक भुकटी श्वासाबरोबर घेणे आणि त्वचेशी संपर्क येणे या गोष्टी टाळणे आवश्यक आहे. औद्योगिक रासायनिक पदार्थ वापरताना जशी खबरदारी घेतात तशीच हे अम्ल वापरतानाही घ्यावी लागते.
डायमिथिल टेरेप्थॅलेटाने त्वचेचा क्षोभ होत नाही तसेच ते त्वचेतून शोषले जात नाही. हेही फारसे विषारी नाही. याचा सतत व मोठ्या प्रमाणात संपर्क टाळणे हितावह असते.
उपयोग : टेरेप्थॅलिक अम्ल व डायमिथिल टेरेप्थॅलेट यांचा उपयोग मुख्यतः तंतू (उदा., टेरिलीन) आणि फिल्मा बनविण्यासाठी लागणारे पॉलिएथिलीन टेरेप्थॅलेट तयार करण्यासाठी होतो [⟶ तंतु, कृत्रिम]. फिल्मांचा उपयोग ध्वनिमुद्रणासाठी वापरण्यात येणाऱ्या चुंबकीय फिती (टेप्स), विद्युत् निरोधक आवरणे आणि छायाचित्रण यांमध्ये होतो. याला लवकर चरे पडत नाहीत, शिवाय याला तकाकी असते म्हणून साच्यांच्या योगाने यापासून वस्तू बनविण्याचे प्रयत्न केले जात आहेत.
वनस्पतिनाशक पदार्थ बनविण्यासाठी एक माध्यमिक द्रव्य म्हणून आसंजके (चिकटविणारे पदार्थ) बनविण्याच्या कृतीत आणि छापण्याची शाई व रंग यांमध्येही हे अम्ल आणि डायमिथिल टेरेप्थॅलेट यांचा किरकोळ प्रमाणात उपयोग होतो. जनावरांना पूरक अन्न म्हणून करावयाच्या खाद्यातही या अम्लाचा उपयोग होतो. आल्फा मिथिल बेंझील अल्कोहॉल व टेरेप्थॅलिक अम्ल यांपासून बनलेले एस्टर प्लॅस्टिकीकारक म्हणून वापरतात. या अम्लाचे उत्पादन भारतात होत नाही.
संदर्भ: 1. C. S. I. R. The Wealth of India, Industrial Products. Vol. VI, New Delhi, 1965.
2. Faith, W. L. Keyes, D. B. Clark, R. L. Industrial Chemicals, London, 1957.
3. Finar, I. L. Organic Chemistry, Bombay, 1962.
4. Richter, G. H. Textbook of Organic Chemistry, London, 1959.
5. Venkataraman, K. Chemistry of Synthetic Dyes, New York, 1952.
केळकर, गो. रा.; लेले, आ. मा.