कार्बनी रसायनशास्त्र : कार्बन या मूलद्रव्याच्या संयुगांचे रसायनशास्त्र म्हणजे कार्बनी रसायनशास्त्र होय. तथापि धातूंची कार्बोनेटे, सायनाइडेव कार्बनाची ऑक्साइडे यांच्या संघटनेत कार्बनाचे अणू असूनही त्यांचा समावेश कार्बनी रसायनांत केला जात नाही. कार्बनाच्या अणूंमुळे निर्माण होणारी शृंखला व वलयी संरचना हे कार्बनी संयुगांचे एक वैशिष्ट्य आहे.
इतिहास व विकास : खनिज पदार्थांपासून मिळविलेले पदार्थ व वनस्पतिज आणि प्राणिज पदार्थ यांतील फरक दाखविण्यासाठी निरिंद्रिय व सेंद्रिय रसायने अशा संज्ञा एकोणिसाव्या शतकाच्या सुरुवातीस रूढ झाल्या. वनस्पतिज व प्राणिज रसायनांचा, खनिज पदार्थांपेक्षा, परस्परांमध्ये जास्त जवळचा संबंध आहे. ज्यावेळी सेंद्रिय रसायन हा शब्द प्रचारात आला त्यावेळी अशी कल्पना होती की, प्राणिज किंवा वनस्पतिज पदार्थ निर्माण होण्यासाठी काहीतरी विशिष्ट जैव शक्तीची जरूरी आहे व ही शक्ती फक्त प्राणी आणि वनस्पती या सजीवांच्या ठायी आहे. त्यामुळे वनस्पतींमध्ये किंवा प्राण्यांमध्ये आढळणारे पदार्थ प्रयोगशाळेत खनिज पदार्थांपासून तयार करता येणार नाहीत अशी समजूत होती.
व्होलर या शास्त्रज्ञांनी १८२८ मध्ये लेड सायनेट व अमोनियम क्लोराइड यांच्या विक्रियेने एक पदार्थ मिळविला. तो तापविला असता त्याचे यूरिया या प्राणिज पदार्थामध्ये रूपांतर झाले. या प्रयोगामुळे जैव शक्तीची कल्पना निराधार आहे, असे दिसून आले. त्यानंतर १८४५ साली कोल्बे यांनी ॲसिटिक अम्लही प्रयोगशाळेत तयार करून दाखविले.
उत्तरोत्तर अनेक वनस्पतिज व प्राणिज पदार्थांच्या बाबतीत असेच अनुभव येत गेले आणि त्यामुळे अखेरीस जैव शक्तीची कल्पना नामशेष झाली व रसायनशास्त्राचे मूलभूत नियम सजीव व निर्जिव कोटींतील पदार्थांना सारखेच लागू पडतात, हे सिद्ध झाले. असे असले तरी कार्बनी रसायनशास्त्र हा एक स्वतंत्र विभाग कल्पिला जातो, कारण कार्बन या मूलद्रव्याच्या काही वैशिष्ट्यांमुळे त्याची संयुगेही काही बाबतींत वैशिष्ट्यपूर्ण आहेत. शिवाय कार्बनाच्या संयुगांची संख्या इतर मूलद्रव्यांच्या संयुगांपेक्षा कितीतरी अवाढव्य आहे आणि म्हणून या संयुगांचा विचार एका स्वतंत्र विभागात करणे सोयीचे आहे.
रसायनशास्त्राच्या विकासाच्या संदर्भात पुढे दिलेल्या गोष्टींचा मुख्यत: विचार करावा लागेल. (१) निरनिराळ्या रासायनिक विक्रियांत भाग घेऊनही भाराचे अविनाशित्व (२) मूलद्रव्यांची संकल्पना (३) पदार्थ निरनिराळ्या सूक्ष्म कणांचा (अणू) आहे ही संकल्पना व एखाद्या मूलद्रव्याचा अणू हायड्रोजन अणूच्या किती पट आहे, यावरून त्याचा अणुभार ठरवावा ही संकल्पना (४) रेणू आणि रेणूभार ही संकल्पना (५) एकमेकांना जोडले जाण्याची अणूंची शक्ती किंवा संयोजन शक्ती. ह्या संकल्पनांमुळे रसायनशास्त्राचा विकास झाला आहे असे दिसून येते. ह्या संकल्पनांखेरीज आणखी दोन संकल्पना कार्बनी रसायनशास्त्राच्या विकासास कारणीभूत झालेल्या दिसून येतात. (६) कार्बनी रसायनांच्या विक्रियांविषयीचे नियम व उत्पत्ती बऱ्याच रसायनांना एकाच वेळी लावण्याची शक्यता व (७) कार्बनी पदार्थांचे घटक अणू एकमेकांस कोणत्या प्रकारे जोडले गेले आहेत, त्या संरचनेचा विचार व संरचना भिन्नत्वाप्रमाणे निरनिराळ्या पदार्थांचे नामाभिधान करण्याची शक्यता, ह्या त्या संकल्पना होत.
कार्बनी पदार्थांचे ज्वलन केल्यास त्यांपासून पाणी व कार्बन–डायऑक्साइड वायू मिळतो, असे फार पूर्वीच शास्त्रज्ञांच्या लक्षात आले होते. कार्बन, हायड्रोजन आणि ऑक्सिजन ह्या मूलद्रव्यांचे अणू एकत्र येऊन एथिल अल्कोहॉल तयार होते असे लव्हॉयझर यांनी १७९३–९४ मध्ये सिद्ध केले होते. पण त्यावेळी विश्लेषणशास्त्र जितके पाहिजे तितके प्रगतावस्थेत नसल्याने एथिल अल्कोहॉलातील कार्बन, हायड्रोजन, आणि ऑक्सिजन अणूंचे एकमेकांशी काय प्रमाण असावे ह्या विषयीचा त्यांचा अंदाज चुकला. विश्लेषणशास्त्रात इष्ट असलेला बराचसा बिनचुकपणा थेनार्ड आणि गे-ल्युसॅक यांनी आणला व त्यांनी १८११ च्या सुमारास बऱ्याचशा साध्या कार्बनी पदार्थांचे बहुतांशी अचूक विश्लेषण केले. वनस्पतिज पदार्थांतील हायड्रोजन व ऑक्सिजन यांचे प्रमाण व त्याच मूलद्रव्यांचे पाण्यातील परस्पर प्रमाण (अणुप्रमाणे किंवा अणुभाराप्रमाणे) यांच्या तुलनेवरून त्यांनी काही निष्कर्ष काढून पक्के केले होते. हे निष्कर्ष पुढीलप्रमाणे आहेत. (१) पाण्यात हायड्रोजनाचे व ऑक्सिजनाचे परस्पर प्रमाण जितके असते त्यापेक्षा जास्त ऑक्सिजन कार्बनी संयुगात असल्यास तो पदार्थ अम्लधर्मी असतो. (२) पाण्यात हायड्रोजनाचे जे प्रमाण असते त्यापेक्षा जास्त हायड्रोजन कार्बनी संयुगात असल्यास त्या पदार्थाचा समावेश तेल, रेझीन किंवा अल्कोहॉल या वर्गांपैकी एककात करण्यात येतो. (३) कार्बनी पदार्थातील हायड्रोजन व ऑक्सिजन यांचे प्रमाण त्या मूलद्रव्यांच्या पाण्यातील प्रमाणाइतकेच असल्यास तो पदार्थ शर्करा किंवा स्टार्च यांपैकी एका वर्गात मोडतो.
प्राणिज कार्बनी पदार्थांचे विश्लेषण केल्यानंतर त्यांना असे आढळून आले की, पाण्यात ऑक्सिजनाचे जितके प्रमाण असते त्यापेक्षा जास्त प्रमाणात त्यामध्ये हायड्रोजन असतो आणि या जास्त प्रमाणात असलेल्या हायड्रोजनाचे पदार्थातील नायट्रोजनाशी प्रमाण अमोनियातील हायड्रोजन व नायट्रोजन यांच्या परस्पर प्रमाणाइतके असते.
थेनार्ड व गे-ल्युसॅक यांची विश्लेषणाची येथपर्यंत प्रगती होईपर्यंत स्वीडनमध्ये बर्झीलियस यांनी अकार्बनी संयुगांचे विश्लेषण करण्याच्या पद्धतीत एकसूत्रता आणली होती. या पद्धतींचा उपयोग त्यांनी कार्बनी अम्लांच्या सोडियम लवणांचे विश्लेषण करण्यासाठी केला. त्यामुळे ती लवणे व धातूंची ऑक्साइडे यांमधील साम्य कळून आले. धातूंच्या ऑक्साइडांमध्ये धातू व ऑक्सिजन यांचा संयोग झालेला असतो, तर या सोडियम लवणामध्ये एक विशिष्ट मूलक (विक्रीयांमध्ये स्थिर राहणारा परंतु सामान्यत: स्वतंत्र अस्तित्व नसणारा अणुगट) आणि सोडियम धातू यांचा संयोग झालेला असतो. या विश्लेषणातून ऑक्सिजन अणूप्रमाणे रासायनिक विक्रियात भाग घेणारे एक विशिष्ट मूलक असते ही संकल्पना उदयास आली. अशा विशिष्ट मूलकाबद्दलची ही संकल्पना लव्हॉयझर व गे-ल्युसॅक यांच्याही लेखनांत मांडली गेलेली आढळते.
मूलकांच्या संकल्पनांना १८३२ मध्ये उपपत्तीचे स्वरूप आले. त्या वर्षी व्हलर आणि लीबिक या संशोधकद्वयाने बेंझॉइक अम्लामधील विशिष्ट मूलकाबद्दल एक निश्चित संकल्पना पुढे मांडली. अणुभार आणि रेणुभार या विषयींच्या तत्कालीन संकल्पना भिन्न असल्यामुळे १४ कार्बन अणू १० हायड्रोजन अणू व २ ऑक्सिजन अणू मिळून बेंझॉइक अम्लामधील बेंझॉइल मूलक तयार होते, असे मत त्यांनी व्यक्त केले. सध्या C7H5O किंवा C6H5CO हे रासायनिक सूत्र ह्या बेंझॉइल मूलकाबद्दल वापरतात. या मूलकाचे अस्तित्व ग्राह्य धरून व्होलर व लीबिक यांनी बेंझाल्डिहाइड व बेंझॉइक अम्ल यांची रासायनिक सूत्रे मांडली. बेंझॉइक अम्ल म्हणजे बेंझॉइल हायड्रॉक्साइड C6H5COOH व बेंझाल्डिहाइड म्हणजे बेंझॉइल हायड्राइड C6H5COH आहे असे या संशोधकद्वयाचे म्हणणे होते. व्हलर व लीबिक यांची ही कल्पना शास्त्रज्ञांना ग्राह्य वाटली. यानंतर १८३७—४३ या कालात, कॅकोडिल मूलकाविषयीचे संशोधन बन्सन यांनी प्रसिद्ध केले. हे मूलक (CH3)2As या सूत्राने दाखविले जाते.
कार्बनी पदार्थातील कार्बन व हायड्रोजनाचे प्रमाण ठरविण्याच्या पद्धतीत सुधारणा करून लीबिक यांनी १८३१ मध्ये त्या पद्धतीत जास्त अचूकपणा आणला, तर द्यूमा यांनी कार्बनी पदार्थातील नायट्रोजनाचे प्रमाण ठरविण्याची अचूक पद्धत शोधून काढली. सध्या वापरात असलेल्या आधुनिक पद्धतीसुद्धा, लीबिक आणि द्यूमा ह्यांच्या पद्धतींवर आधारित आहेत, हेत्या पद्धतींचे वैशिष्ट्य म्हणता येईल.
क्लोरीन, ब्रोमीन यांसारखे हॅलोजन गटातील पदार्थ, ऑक्सिजन किंवा संयुगांतील विशिष्ट मूलके ह्यांबरोबर कार्बनी पदार्थांची विक्रिया झाल्यास कार्बनी पदार्थातील एक किंवा अधिक हायड्रोजन अणूंऐवजी सममूल्य हॅलोजन, ऑक्सिजन किंवा विशिष्ट मूलके येतात. परंतु अशा प्रकारची विक्रिया काही विशिष्ट परिस्थितीतच दिसून येते. विक्रियेमध्ये भाग घेणारा मूळ पदार्थ आणि विक्रियेनंतर तयार होणारा पदार्थ यांचे रासायनिक स्वरूप एकच असल्यास ही विक्रिया घडून येते. परंतु कार्बनी पदार्थांच्या रेणूमधील कार्य त्या पदार्थातील पूर्वीच्या अणूसारखेच असू शकते, यावर द्यूमा यांचा विश्वास नव्हता.
कार्बनी संयुगे कशी तयार होतात याविषयी बर्झीलियस यांनी एक उपपत्ती मांडली होती. विवेचनाच्या सोयीसाठी तिला आपण द्वैतवाद असे म्हणू या. बर्झीलियस यांच्या या द्वैतवादाप्रमाणे संयुगातील घटक, त्यांवर आलेल्या परस्परविरुद्ध विद्युत् भारांमुळे एकत्र येऊन संयुग तयार होते. अशाच तऱ्हेचे मत इंग्लंडमधील सर हंफ्री डेव्ही ह्या शास्त्रज्ञांचेही होते. घटकांमध्ये परस्परांबद्दल असलेल्या विद्युत् आकर्षणामुळे संयुगातील घटक एकत्र आलेले असतात असे मत त्यांनी १८०७ मध्ये मांडले. संयुगातील हायड्रोजनाऐवजी क्लोरीन आला, तरी त्या संयुगाचे स्वरूप पालटत नाही असे या द्वैतवादाच्या पुरस्कर्त्यांचे मत होते तथापि ही संकल्पना चूक होती.
मूलक आणि ठराविक रासायनिक विक्रिया दर्शविणारे विशिष्ट अणुसमूह यांविषयीच्या उपपत्तींचा मेळ घालण्याचे काम झेरार यांनी केले. कार्बनी संयुजेविषयी (अणूंच्या परस्परांशी संयोग पावणाच्या क्षमतेविषयी) बरीच सैद्धांतिक चर्चा आणि उपपत्तीमधील परस्परविरोध ही कार्बनी रसायनशास्त्राच्या विकासाच्या दृष्टीने १८३८—५८ या कालखंडाची वैशिष्ट्ये होत. या कालखंडामध्ये विशेष प्रगती झाल्याचे दिसून येत नाही.
आर्चिबॉल्ड कूपर यांनी १८५८ साली मूलद्रव्यांच्या संयुजेवर आधारलेली संयुगांची संरचना सूत्रे (रेणूतील अणूंची जोडणी दर्शविणारी सूत्रे) मांडावयाला सुरुवात केली. त्याच सुमारास जर्मनीतील केकूले या शास्त्रज्ञांनी कूपर यांच्यासारख्याच संकल्पना जास्त विस्तृतपणे मांडल्या. एखादे संयुग वर्गीकरणाच्या दृष्टीने दोन वर्गांत पडण्याची शक्यता आहे आणि संयुगाचे रासायनिक गुणधर्म लक्षात आणून देण्याच्या दृष्टीने संयुगांचे वर्गीकरण करता येते, हे त्यांनी दाखवून दिले.
जरी सरतेशेवटी संयुगातील मूलके बऱ्याचशा विक्रियांमध्ये बदल न होता राहू शकतात, तरी ती अभेद्य मानण्याचे कारण नाही, कारण दुसऱ्या काही विक्रियांमध्ये तीच मूलके भंग पावतात असे केकूले यांनी दाखवून दिले. संयुगांच्या रासायनिक गुणधर्मांवरून त्यांचे वर्गीकरण करून त्यांची रासायनिक सूत्रे तयार केली असल्याने संयुगांची आपण मांडलेली रासायनिक सूत्रे म्हणजेच ती त्यांची संरचना सूत्रे होत, असे मानण्याचे कारण नाही. संयुगांची संरचना त्यांच्या फक्त रासायनिक विक्रियांवरून समजून येत नाही. ही संरचना समजून घेण्यासाठी संयुगाच्या इतरही भौतिक गुणधर्मांचा अभ्यास केला पाहिजे असे केकूले यांचे म्हणणे होते. १८६५ -६६ साली केकूले यांनी बेंझिनाची संरचना काय असावी याबद्दल एक उपपत्ती मांडली व तिच्यावरून मांडलेले बेंझिनाचे संरचना सूत्र अजूनही वापरले जाते. संयुजा आणि अणूंना एकमेकांस जोडणारे बंध यांविषयी झालेल्या आधुनिक संशोधनामुळे केकूले यांच्या संकल्पनांत थोडेफार फेरफार करवे लागले, तरी संरचना सूत्रात कोणताच महत्त्वाचा फेरफार झाला नाही.
एखाद्या कार्बनी संयुगातील निरनिराळ्या मूलद्रव्यांच्या अणूंची संख्या आणि त्यांचे परस्परांशी प्रमाण समजले, तरी ती माहिती त्या पदार्थाचे संरचना सूत्र ठरविण्यास अपुरी पडते. कारण एकच रासायनिक रेणुसूत्र (रेणूतील अणूंचे प्रकार व त्यांची संख्या दर्शविणारे सूत्र) ज्यांना लागू करता येते अशी दोन किंवा अधिक संयुगे आढळून येतात. त्यामुळे एखाद्या पदार्थाचे संरचना सूत्र मांडावयाचे असल्यास, त्या पदार्थातील अणू किंवा मूलके कार्बन अणूस कशी जोडली गेली आहेत आणि ते कार्बन अणू एकमेकांस कसे जोडले आहेत हे समजणे जरूर आहे. अणुकेंद्राभोवती ऋण विद्युत् भारित कण (इलेक्ट्रॉन) निरनिराळ्या कक्षांत फिरत असतात व त्यांतील शेवटच्या कक्षेत फिरणाऱ्या इलेक्ट्रॉनांच्या देवघेवीमुळे किंवा दोन अणूंमध्ये काही इलेक्ट्रॉन समाईक राहिल्यामुळे दोन अणू एकमेकांस जोडले जातात. ही कल्पना आल्यांनतर कार्बनी संयुगातील निरनिराळे अणू एकमेकांस कसे जोडले जातात, याचा विचार झाला. दोन, चार किंवा सहा इलेक्ट्रॉन दोन कार्बन अणूंमध्ये समाईक राहिल्यास ते कार्बन अणू जोडले जातात असे आढळून आले आहे व समाईक रीत्या दोन कार्बन अणूंकडून वापरल्या गेलेल्या दोन, चार किंवा सहा या अणूंच्या संख्येवरून त्या कार्बन अणूमध्ये एक बंध, द्विबंध किंवा त्रिबंध तयार होतात असे मानले जाते. कार्बनी संयुगे तयार होतांना इलेक्ट्रॉनांवर समाईक हक्क राहण्याचा प्रकार बहुतेक वेळी दिसून येतो. कार्बन अणूंच्या अशा प्रकारच्या संयुजेला ‘सहसंयुजा’ असे म्हणतात. [→ संयुजा].
कार्बनी संयुगांच्या संरचना आकृती व संरचना सूत्रे : १८२५ साली मायकेल फॅराडे यांना कार्बन व हायड्रोजन यांचे एक नवीन संयुग मिळाले. त्या संयुगातील कार्बन व हायड्रोजनाचे प्रमाण व जॉन डाल्टन यांना पूर्वीच १८२० साली मिळालेल्या एथिलीन या वायूतील कार्बन व हायड्रोजन यांचे प्रमाण एकच होते. त्यामुळे संयुगातील घटक मूलद्रव्यांच्या परस्पर प्रमाणावरून पदार्थांतील भिन्नत्व ओळखता येईल, या कल्पनेस धक्का बसला. फॅराडे यांना मिळालेल्या हायड्रोकार्बनाची घनता एथिलिनाच्या घनतेच्या दुप्पट होती. त्यावरून फॅराडे यांनी असा निष्कर्ष काढला की, ह्या दोन संयुगांतील कार्बन व हायड्रोजनाचे परस्परांशी प्रमाण एकच असले, तरी त्यांतील कार्बन आणि हायड्रोजनाच्या अणूंची संख्या भिन्न असली पाहिजे.
व्होलर यांनी १८२३ च्या सुमारास असे आढळून आले की, आपण तयार केलेल्या सायनेट संयुगाची रासायनिक सूत्रे व रेणुभार आणि लीबिक व गे-ल्युसॅक यांनी तयार केलेल्या फल्मिनेटाची सूत्रे व रेणुभार एकच आहेत. या संयुगाचे सूत्र MCNO असेच होते. M या अक्षराने एक संयुजा असलेली धातू दाखवावयाची म्हटल्यास सायनेट व फल्मिनेट यांमधील फरकांचे स्पष्टीकरण देणे आवश्यक असल्याचे कळून आले. अशाच प्रकारच्या अडचणी १८३० साली बर्झीलियस यांना बहिःपूरित रॅसेमिक (एका विशिष्ट प्रतलात कंपन पावणाऱ्या प्रकाशाचे म्हणजे ध्रुवित प्रकाशाचे कंपन प्रतल डावीकडे व उजवीकडे वळविणाऱ्या घटकांचे ज्या संयुगातील प्रमाण समान असते व त्यामुळे ज्यात कंपन प्रतल वळविण्याची क्षमता नसते अशा) टार्टारिक अम्लाच्या (C4H6 O6) संशोधनात आल्या. १८३२ मध्ये एकच रासायनिक सूत्र पण भिन्न गुणधर्म असलेल्या संयुगांस समघटकी संयुगे म्हणावे असे त्यांनी सुचविले.
समघटकता : संरचना भिन्नत्वाप्रमाणे समघटकतेचे विविध प्रकार कल्पिले आहेत. त्यांपैकी काही मुख्य प्रकार पुढे दिले आहेत. (१) शृंखला समघटकता : रेणुसूत्र एकच असणे पण अणूंच्या जोडण्याची पद्धती भिन्न असणे. उदा., प्रोपिल क्लोराइड CH3.CH2.CH2Cl व आयसो – प्रोपिल क्लोराइड CH3.CHCl.CH3. (२) कार्यकारी मूलक समघटकता : रेणुसूत्र एकच असणे पण कार्यकारी मूलक भिन्न असणे. उदा., ॲसिटिक अम्ल CH3COOH व मिथिल फॉर्मेट H.COOCH3.यांतील पहिले अम्ल व दुसरे एस्टर वर्गातील आहे. (३) त्रिमितीय विन्यास समघटकता : रेणुसूत्र एकच असणे पण अणूंची अवकाशातील मांडणी भिन्न असणे. उदा., मॅलेइक अम्ल
| CH.COOH | व फ्यूमेरिक अम्ल | HC-COOH |
| ll | ll | |
| CH.COOH | HOOC-CH |
(४) प्रकाशीय समघटकता : रेणुसूत्र, रेणूभार, रासायनिक आणि बरेच भौतिक गुणधर्म एकच असणे पण ध्रुवित प्रकाशाचे प्रतल वळविण्याच्या दिशेत फरक असणे. उदा., दक्षिणवलनी (प्रतल उजवीकडे वळविणारे) टार्टारिक अम्ल व वामवलनी (प्रतल डावीकडे वळविणारे) टार्टारिक अम्ल [→ समघटकता].
ह्यांशिवाय द्विबंध असलेल्या संयुगांत द्विबंधाच्या भिन्न स्थानांमुळेही समघटकता असू शकते किंवा संरचना मूलत: भिन्न असल्यामुळेही समघटकता असू शकते. उदा., C4H8 या संयुगाच्या पाच तऱ्हा असू शकतील.
(१) १-ब्युटीन CH2 = CH – CH2 – CH3
(२) २-ब्युटीन CH3 – CH = CH – CH
| (३) २- मिथिल प्रोपिलीन | CH2 = | CH3 |
| l | ||
| C | ||
| l | ||
| CH3 |
| (४) सायक्लोब्युटेन | CH2 – | CH2 |
| l | l | |
| CH2– | CH2 |
| (५) मिथिल सायक्लोप्रोपेन | CH2 | |
| ∕ | \ | |
| H2C – CH – CH3 | ||
यांतील २ – ब्युटिनामध्ये खाली दर्शविल्याप्रमाणे समपक्ष (रेणूतील अणू वा अणुगट द्विबंधाच्या एका बाजूस असलेले) व विपक्ष (रेणूतील अणू वा अणुगट द्विबंधाच्या विरुद्ध बाजूंना असलेले) अशी त्रिमितीय समघटकता आढळते.
| H–C – CH3 | H–C – CH3 |
| ll | ll |
| H–C – CH3 | CH3 – C – H |
| समपक्ष २ – ब्युटीन | विपक्ष २ – ब्युटीन |
कार्बन, हायड्रोजन, ऑक्सिजन, किंवा इतर कोणतेही मूलद्रव्य यापासून होणाऱ्या संयुगांमध्येही समघटकता आढळते. ऑक्सिजन अणू असलेल्या संयुगातील समघटकतेचे उदाहरण द्यावयाचे असल्यास C2H6O हे सूत्र असलेल्या संयुगाचे देता येईल. एथिल अल्कोहॉल CH3.CH2OH आणि डाय-मिथिल-ईथर CH3.O.CH3 या दोन्ही संयुगांचे रेणुसूत्र एकच आहे. पण संरचना भिन्नत्वामुळे त्यांचे गुणधर्म भिन्न आहेत.
कार्बनाची संयुजा चार असून सुसम चतुष्फलकाच्या मध्यभागी कार्बन अणू आहे अशी कल्पना केल्यास त्या चतुष्फलकाच्या चारी टोकांच्या दिशेकडे कार्बनाच्या बंधाची दिशा असते म्हणजे कार्बनाच्या दोन बंधांमध्ये १०९०२८′ चा कोन असतो.परंतू बंधाचे चित्र समपातळीत दाखवावयाचे असल्यास ते ![]() असे दाखविता येते.
असे दाखविता येते.
या संरचना आकृतीमध्ये कार्बनाच्या बंधामध्ये ९० अंशांचा कोन आहे. कार्बन व त्याच्या संयुजा एकाच पातळीत आहेत असे दिसत असले, तरी सुसम चतुष्फलकाच्या मध्यभागी कार्बन अणू आणि त्याच्या चार टोकांच्या दिशेने कार्बन अणूंचे बंध कार्य करतात हे लक्षात ठेवले पाहिजे. कार्बन अणूच्या संयुजेविषयीच्या ह्या मूलभूत कल्पनांवर संयुगांची त्रिमितीय समघटकता स्पष्ट करता येते. रासायनिक समीकरणे मांडताना वर दाखविलेल्या पद्धतीने संयुगांची सूत्रे मांडण्यात येतात. संयुगांच्या संरचना आकृती अवश्य तेथेच काढतात. [→ त्रिमितीय रसायनशास्त्र ].
कार्बनी संयुगांचे नामकरण : ज्यावेळी कार्बनी संयुगांची संख्या थोडी होती त्यावेळी ज्या मूळ पदार्थापासून तो पदार्थ मिळविला असेल, त्याच्या नावावरून कार्बनी संयुगाचे नामकरण करीत असत. उदा., लोण्यामध्ये असलेल्या ब्युटिरिक अम्लापासून ब्युटेन असे नाव निघाले. पण संयुगांची संख्या वाढल्यावर त्याचे पद्धतशीर वर्गीकरण करण्याची जरूरी वाटू लागली.
सर्वसाधारणपणे रसायनशास्त्रज्ञांच्या आंतरराष्ट्रीय समितीने सुचविलेली नामकरणाची पद्धत वापरण्यात येते. याशिवाय अमेरिकन केमिकल सोसायटीने दुसरी एक पद्धत सुचविली आहे. ही पद्धत ती सोसायटी प्रसिद्ध करीत असलेल्या सारांश पत्रिकांमध्ये (केमिकल ॲबस्ट्रॅक्टमध्ये) वापरली जाते. (१९४५ साली प्रसिद्ध झालेली विषयसूचीची प्रस्तावना केमिकल ॲबस्ट्रॅक्ट ३९, ५८६५-५९७५). सध्या मान्य असलेल्या नामकरण पद्धतीत जुनी चालत आलेली नावे तशीच ठेवली आहेत अणि संयुगाला नाव देताना एकाच संयुगाला कित्येकदा दोन नावेही दिली जातात. हे प्रकार पुढीलप्रमाणे जास्त स्पष्ट केले आहेत.
C6H14 किंवा CH3.(CH2)4.CH3 ह्या रेणुसूत्राच्या संयुगातील सर्व कार्बन अणू सरळ शृंखलेत CH3.CH2.CH2.CH2.CH2.CH3 असले तर त्याला नॉर्मल हेक्झेन म्हणतात. हेच C6H14 सूत्र असलेल्या संयुगाच्या शृंखलेचे स्वरूप असे
| CH3.CH.CH2.CH2.CH3किंवा CH3.CH2.CH.CH2.CH3 |
| l l |
| CH3 CH3 |
| (१) (२) |
| किंवा CH3.CH2.CH2.CH.CH3 |
| l |
| (३) CH3 |
असल्यास, म्हणजे पाच कार्बन अणू सरळ शृंखलेत असून मधल्या तीन अणूंपैकी कोणत्याही एकास मिथिल -CH3 मूलक जोडलेला असल्यास त्यास आयसो-हेक्झेन असे म्हणतात. त्यात आणखी स्पष्टता येण्यासाठी सरळ शृंखलेतील कार्बन अणूंना डावीकडून किंवा उजवीकडून क्रमांक देऊन गटाचे स्थान दर्शविले जाते. तशी नावे दिल्यास (१) व (३) या संयुगांना २-मिथिल पेंटेन म्हणावे लागेल कारण ती दोन्ही संयुगे एकच आहेत आणि (२) या संयुगाला ३-मिथिल पेंटेन असे म्हणावे लागेल. परंतु त्याच C6H14 ची किंवा हेक्झेनची संरचना
 अशी असल्यास त्याला निओ-हेक्झेन म्हणतात.
अशी असल्यास त्याला निओ-हेक्झेन म्हणतात.
किंवा त्यासच २,२-डायमिथिल ब्युटेन असेही म्हणतात. त्याचप्रमाणे CH3.CO.CH3 हे सूत्र असलेल्या संयुगास व्यवहारात ॲसिटोन म्हणतात, पण त्याचे पद्धतशीर नाव डायमिथिल कीटोन असे आहे.
कार्बनी संयुगांचे वर्गीकरण : कार्बनी संयुगांचे वर्गीकरण सर्वसाधारणपणे दोन वर्ग समजण्यात येतात. (१) ॲलिफॅटिक व (२) ॲरोमॅटिक. ॲलिफॅटिक संयुगांचे (अ) विवृत शृंखला (जिची टोके मोकळी आहेत अशी शृंखला) असलेले व (आ) संवृत शृंखला (जिची टोके जोडलेली असतात अशी शृंखला किंवा वलये असलेले, असे दोन भाग केले आहेत. कार्बन अणूंचे वलय असलेल्या ॲलिफॅटिक संयुगांना ‘ॲलिसायक्लिक’ असे नाव आहे (ॲलिफॅटिकमधील ‘ॲलि’ व वलयी रचना दाखविणारा ‘सायक्लिक’ हे दोन शब्द एकत्र आणून ‘ॲलिसायक्लिक’ हा शब्द बनविला आहे). बेंझीनाच्या षट्कोनाकृती वलयाचा 
समावेश संयुगांच्या संरचनेत असल्यास ती संयुगे ॲरोमॅटिक संयुगांच्या वर्गात पडतात. बेंझिनाची दोन-तीन वलये एकमेकांस जोडून तयार झालेल्या दोन किंवा तीन षट्कोनाकृती वलयी शृंखला एकमेकीस जोडून तयार झालेल्या नॅप्थॅलिनाच्या  किंवा अँथ्रॅसिनाच्या
किंवा अँथ्रॅसिनाच्या  रेणूंचा समावेश ॲरोमॅटिक संयुगांतच होतो. कधीकधी एकाच संयुगात ॲरोमॅटिक आणि ॲलिफटिक भाग एकत्र आलेले असतात. उदा., टोल्यूइनाची संरचना आकृती घेतल्यास ती
रेणूंचा समावेश ॲरोमॅटिक संयुगांतच होतो. कधीकधी एकाच संयुगात ॲरोमॅटिक आणि ॲलिफटिक भाग एकत्र आलेले असतात. उदा., टोल्यूइनाची संरचना आकृती घेतल्यास ती  अशी आहे, यातील
अशी आहे, यातील  हा भाग ॲरोमॅटिक वर्गाचा आहे तर -CH3 हा भाग ॲलिफॅटिक वर्गाचा आहे. ज्यावेळी एखाद्या पदार्थाचा रेणू ॲरोमॅटिक आणि ॲलिफॅटिक भाग एकत्र आल्याने तयार झालेला असतो, त्यावेळी त्या पदार्थात ॲलिफॅटिक आणि ॲरोमॅटिक या दोन्ही वर्गांचे गुणधर्म प्रयोग-परिस्थितीनुरूप दिसून येतात. उदा., टोल्यूइनाची आणि क्लोरिनाची विक्रिया होऊ दिल्यास प्रयोग भिन्नत्वाप्रमाणे ऑर्थो-क्लोरोटोल्यूिन
हा भाग ॲरोमॅटिक वर्गाचा आहे तर -CH3 हा भाग ॲलिफॅटिक वर्गाचा आहे. ज्यावेळी एखाद्या पदार्थाचा रेणू ॲरोमॅटिक आणि ॲलिफॅटिक भाग एकत्र आल्याने तयार झालेला असतो, त्यावेळी त्या पदार्थात ॲलिफॅटिक आणि ॲरोमॅटिक या दोन्ही वर्गांचे गुणधर्म प्रयोग-परिस्थितीनुरूप दिसून येतात. उदा., टोल्यूइनाची आणि क्लोरिनाची विक्रिया होऊ दिल्यास प्रयोग भिन्नत्वाप्रमाणे ऑर्थो-क्लोरोटोल्यूिन  पॅरा-क्लोरोटोल्यूिन
पॅरा-क्लोरोटोल्यूिन  आणि बेझील क्लोराइड
आणि बेझील क्लोराइड  ही संयुगे मिळतात. ह्यासारखाच प्रकार स्टायरीन
ही संयुगे मिळतात. ह्यासारखाच प्रकार स्टायरीन 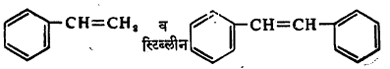 ह्या पदार्थांच्या बाबतीत दिसून येतो [→ ॲलिफॅटिक संयुगे ॲरोमॅटिक संयुगे ॲलिसायक्लिक संयुगे].
ह्या पदार्थांच्या बाबतीत दिसून येतो [→ ॲलिफॅटिक संयुगे ॲरोमॅटिक संयुगे ॲलिसायक्लिक संयुगे].
कार्बनी अणूंची विवृत शृंखला असलेल्या कार्बनी संयुगातील सर्व कार्बन अणू एकमेकांस एकबंधाने जोडले गेलेले असतात, त्यावेळी त्या संयुगास संतृप्त संयुग असे म्हणतात. पण ज्यावेळी संयुगातील काही अणू एकमेकांस द्विबंधाने किंवा त्रिबंधाने जोडलेले असतात, त्यावेळी त्या संयुगास असंतृप्त संयुग म्हणतात.
कार्बनांच्या संवृत शृंखला (किंवा वलये) असलेल्या संयुगांमध्ये वलये किती आहेत त्यावरून त्यांना एकवलयी, द्विवलयी किंवा त्रिवलयी असे संबोधण्यात येते. एकाहून अधिक वलय असलेल्या अनेक ॲलिफॅटिक वलयी संयुगांत (ॲलिसायक्लिक) एक अथवा दोन कार्बन अणू


दोन्ही वलयांत समाविष्ट असतात. ज्या संयुगांमध्ये असा एक कार्बन अणू असतो त्यांना स्पायरो संयुगे म्हणतात. तर ज्यांमध्ये असे दोन कार्बन अणू असतात त्या संयुगांस जोडवलयी संयुगांच्या वर्गात घालतात. ज्या संयुगांतील वलयात, सर्व अणू कार्बनाचे असतात त्यांना समवलयी म्हणतात. पण ज्यावेळी वलयात कार्बन अणुव्यतिरिक्त दुसऱ्या मूलद्रव्यांचे अणूही असतात, त्या संयुगांना ⇨विषमवलयी संयुगे म्हणतात. उदा.,
 या शिवाय गुणधर्म आणि संरचना यांच्या सादृश्यावरून ⇨अल्कलॉइडे, टर्पिनॉइडे इ. वर्गही करण्यात आले आहेत.
या शिवाय गुणधर्म आणि संरचना यांच्या सादृश्यावरून ⇨अल्कलॉइडे, टर्पिनॉइडे इ. वर्गही करण्यात आले आहेत.
ज्यावेळी संयुगांमध्ये कार्बन व हायड्रोजन यांच्या व्यतिरिक्त दुसरे मूलद्रव्य असते, त्यावेळी त्या संयुगाच्या रासायनिक स्वरूपावरून म्हणजेच त्या संयुगाच्या कार्यकारी मूलकावरून त्याचे वर्गीकरण करण्यात येते. ॲलिफॅटिक किंवा ॲरोमॅटिक वर्गातील हायड्रोकार्बन संयुगाच्या रेणूतील हायड्रोजन अणूबद्दल क्लोरीन किंवा हॅलोजन वर्गातील इतर अणू जोडल्यास मिळणाऱ्या संयुगास हॅलोजनी हायड्रोकार्बने म्हणतात. मूळ हायड्रोकार्बन ॲलिफॅटिक वर्गातील असल्यास तो हॅलोजनी हायड्रोकार्बन अल्किल हॅलाइड वर्गात पडतो व मूळ हायड्रोकार्बन ॲरोमॅटिक असल्यास तो अरिल हॅलाइड वर्गात पडतो. उदा., मिथेन CH4 ह्या ॲलिफॅटिक हायड्रोकार्बनपासून मिथिल क्लोराइड CH3Cl किंवा हॅलोजनी हायड्रोकार्बन मिथिल हॅलाइड CH3 X( X=हॅलोजन) ही अल्किल हॅलाइड वर्गाची संयुगे तयार होतात. तसेच बेंझीन C6H6 या ॲरोमॅटिक हायड्रोकार्बनापासून क्लोरोबेंझीन C6H5Cl किंवा हॅलोजनो बेंझीन C6H5 X(X=हॅलोजन) किंवा फिनील क्लोराइड किंवा फिनील हॅलाइड ही अरिल हॅलाइड वर्गातील संयुगे बनतात.
ॲलिफॅटिक हायड्रोकार्बनांमधील हायड्रोजनाऐवजी हायड्रॉक्सिल मूलक-OH जोडल्यास अल्कोहॉल वर्गातील पदार्थ तयार होतात. उदा., मिथेन CH4 पासून मिथिल अल्कोहॉल CH3OH तयार होतो. ॲरोमॅटिक हायड्रोकार्बनातील हायड्रोजन अणूऐवजी हायड्रॉक्सिल मूलक-OH जोडल्यास फिनॉल वर्गातील पदार्थ तयार होतात. उदा., बेंझीन C6H6 पासून फिनॉल C6H5OH तयार होते.
ॲलिफॅटिक किंवा ॲरोमॅटिक हायड्रोकार्बनच्या अणूऐवजी ॲमिनो मूलक-NH2 जोडल्यास ॲमिनो वर्गातील पदार्थ तयार होतात. उदा., मिथेन CH4 पासून मिथेल अमाइन CH3NH2 व बेंझीन C6H6 पासून फिनील अमाइन C6H5NH2 किंवा ॲनिलीन तयार होते.
ॲलिफॅटिक किंवा ॲरोमॅटिक हायड्रोकार्बनातील हायड्रोजन अणूऐवजी कार्बॉक्सिल – COOH मूलक जोडल्यास अम्ल वर्गातील पदार्थ तयार होतात. उदा., मिथेन CH4 पासून ॲसिटिक अम्ल CH3COOH व बेंझीन C6H6 पासून बेंझॉइक अम्ल C6H5COOH तयार होते. ह्याप्रमाणे हायड्रोकार्बनातील हायड्रोजनाऐवजी निरनिराळे अणू किंवा मूलके जोडल्यास निरनिराळ्या वर्गांतील पदार्थ तयार होतात.
अल्कोहॉल वर्गातील संयुगांचे तीन विभाग केले आहेत. त्या संयुगांत असलेल्या![]() ह्या मूलकांवरून अल्कोहॉलांना प्राथमिक, द्वितीयक व तृतीयक अल्कोहॉले असे अनुक्रमे म्हणतात. [ →अल्कोहॉल].
ह्या मूलकांवरून अल्कोहॉलांना प्राथमिक, द्वितीयक व तृतीयक अल्कोहॉले असे अनुक्रमे म्हणतात. [ →अल्कोहॉल].
अल्कोहॉलामधील कार्यकारी मूलक दाखविण्यासाठी कधीकधी हायड्रॉक्सी हा शब्द संयुगाच्या नावाच्या अगोदर वापरतात किंवा संयुगाच्या नावास ‘ऑल’ असा प्रत्यय लावतात. उदा., C2H5OH या अल्काहॉलाला हायड्रोक्सि-एथेन किंवा एथेनॉल म्हणतात.
त्याचप्रमाणे अमाइन विभागातील संयुगांचे तीन विभाग केले आहेत. अमाइन संयुगांत असलेल्या –CH2.NH2, –CH2.NH.R आणि  (R = अल्किल मूलक) मूलकांवरून अमाइन संयुगांना अनुक्रमे प्राथमिक, द्वितीयक, तृतीयक अमाइने म्हणतात [ →अमाइने].
(R = अल्किल मूलक) मूलकांवरून अमाइन संयुगांना अनुक्रमे प्राथमिक, द्वितीयक, तृतीयक अमाइने म्हणतात [ →अमाइने].
कधीकधी संयुगातील ऑक्सिजन अणू कार्बोनिल 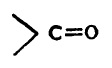 मूलकाच्या रूपात असतो. संयुगातील या कार्बोनिल मूलकाला एक हायड्रोजन अणू जोडला गेला म्हणजे ते संयुग आल्डिहाइड वर्गात पडते. आल्डिहाइडाचे साधारण सूत्र
मूलकाच्या रूपात असतो. संयुगातील या कार्बोनिल मूलकाला एक हायड्रोजन अणू जोडला गेला म्हणजे ते संयुग आल्डिहाइड वर्गात पडते. आल्डिहाइडाचे साधारण सूत्र 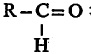 असे असते. ह्या सूत्रातील R म्हणजे –CH3,– C2H5,–C6H5
असे असते. ह्या सूत्रातील R म्हणजे –CH3,– C2H5,–C6H5
यांसारखे कोणतेही मूलक असते. संयुगातील कार्बोनिल मूलक दोन मूलकांस जोडले गेले असल्यास त्या संयुगाचा समावेश कीटोन वर्गात करतात. कीटोन वर्गाचे साधारण रासायनिक सूत्र  असे समजले जाते. ह्या सूत्रातील R1 व R2 म्हणजे कोणतेही –CH3,– C2H5,– C6H5 यांसारखे मूलक होत. ही मूलके समान किंवा भिन्न असू शकतील. उदा., CH3–CO–CH3 व CH3–CO–C2H5. कार्बोनिल मूलक
असे समजले जाते. ह्या सूत्रातील R1 व R2 म्हणजे कोणतेही –CH3,– C2H5,– C6H5 यांसारखे मूलक होत. ही मूलके समान किंवा भिन्न असू शकतील. उदा., CH3–CO–CH3 व CH3–CO–C2H5. कार्बोनिल मूलक  हा कार्बॉक्सिलिक अम्ले आणि त्यांपासून तयार होणाऱ्या संयुगांतही दिसून येतो. पण कार्बॉक्सिलिक अम्लांच्या रासायनिक विक्रिया भिन्न असल्यामुळे त्यांचा वेगळाच वर्ग करण्यात आला आहे. एखाद्या आल्डिहाइड वर्गातील संयुगाचे नामकरण करताना त्या आल्डिहाइडामध्ये आहेत तितकेच कार्बन अणू असलेल्या हायड्रोकार्बनी संयुगाच्या नावास ‘अल’ असा प्रत्यय लावण्यात येतो किंवा त्या आल्डिहाइडापासून जे अम्ल मिळते त्या अम्लाच्या नावापुढे आल्डिहाइड हे पद लावून नामकरण करण्यात येते. उदा., CH3CHO हे संयुग एथॅनॉल किंवा ॲसिट-आल्डिहाइड या नावांनी ओळखण्यात येते [→ आल्डिहाइडे कीटोने ].
हा कार्बॉक्सिलिक अम्ले आणि त्यांपासून तयार होणाऱ्या संयुगांतही दिसून येतो. पण कार्बॉक्सिलिक अम्लांच्या रासायनिक विक्रिया भिन्न असल्यामुळे त्यांचा वेगळाच वर्ग करण्यात आला आहे. एखाद्या आल्डिहाइड वर्गातील संयुगाचे नामकरण करताना त्या आल्डिहाइडामध्ये आहेत तितकेच कार्बन अणू असलेल्या हायड्रोकार्बनी संयुगाच्या नावास ‘अल’ असा प्रत्यय लावण्यात येतो किंवा त्या आल्डिहाइडापासून जे अम्ल मिळते त्या अम्लाच्या नावापुढे आल्डिहाइड हे पद लावून नामकरण करण्यात येते. उदा., CH3CHO हे संयुग एथॅनॉल किंवा ॲसिट-आल्डिहाइड या नावांनी ओळखण्यात येते [→ आल्डिहाइडे कीटोने ].
कीटोन वर्गातील संयुगांचे नामकरण करताना कीटोनाप्रमाणे आहेत तितकेच कार्बन अणू असलेल्या हायड्रोकार्बनी संयुगाच्या नावास ‘ओन’ असा प्रत्यय लावण्यात येतो किंवा कीटोनामधील कार्बोनिल अणुसमुहास जोडलेल्या मूलकांच्या नावावरून त्याचे नामकरण करण्यात येते. उदा., CH3.CO.CH3 हे प्रोपेनोन किंवा डायमिथिल कीटोन ह्या नावानी ओळखले जाते,तर

अशी संरचना असलेल्या संयुगात वलय आहे हे लक्षात घेऊन त्यास सायक्लोहेक्झॅनोन म्हणण्यात येते. कधीकधी कीटोन वर्गातील संयुगास अगोदरपासून रूढ असलेल्या नावानेही संबोधण्यात येते. उदा., CH3.CO.CH3 हे ॲसिटोन या नावाने ओळखले जाते. आल्डिहाइड व कीटोन या वर्गांतील पदार्थांपासून ॲसिटाल व कीटाल वर्गांतील पदार्थ मिळतात. या वर्गांतील संयुगांची साधारण रासायनिक सूत्रे

अशी आहेत. या सूत्रातील R , R1, R2 म्हणजे अल्किल मूलके असे समजावे.
कार्बनी अम्लांचे वर्गीकरण त्यांमध्ये असलेल्या अम्लधर्मी मूलकावरून करण्यात येते. कार्बॉक्सिल मूलक –COOH व सल्फॉनिक मूलक –SO3H ही मुख्यत्वेकरून अम्लधर्मी मूलके समजण्यात येतात. CH3COOH या अम्लास ॲसिटिक अम्ल ह्या नावाने ओळखतात. त्यास मिथेन कार्बॉक्सिलिक अम्ल अशीही संज्ञा आहे. C6H5SO3H ह्यास बेंझीन सल्फॉनिक अम्ल किंवा सल्फोबेंझीन असेही म्हणतात.
अम्ल क्लोराइडे, एस्टरे व अमाइडे या वर्गांतील पदार्थांचा अम्ल वर्गातील पदार्थांशी फार जवळचा संबंध आहे. अम्लांमधील कार्बॉक्सिल मूलकातील हायड्रॉक्सिल –OH या मूलकाबद्दल क्लोरीन –Cl आल्यास अम्ल क्लोराइडे तयार होतात. उदा., CH3COOH ॲसिटिक अम्लातील – OH बद्दल –Cl आल्यास CH3COCl तयार होते. ते ॲसिटील क्लोराइड म्हणून ओळखले जाते. तर अम्लातील कार्बॉक्सिल मूलकातील –OH बद्दल –NH2 हे मूलक आल्यास ॲसिटामाइड CH3CONH2 तयार होते. कार्बॉक्सिलिक अम्ल वर्गातील पदार्थांची अल्कोहॉलाबरोबर विक्रिया होऊन एस्टर वर्गातील पदार्थ होतात. उदा., ॲसिटिक अम्लाची एथिल अल्कोहॉलाबरोबर विक्रिया केल्यास CH3COOC2H5 एथिल ॲसिटेट हे एस्टर तयार होते. अम्लाची क्षाराबरोबर (अल्कलीबरोबर) विक्रिया होऊन ज्याप्रमाणे लवणे मिळतात, त्याचप्रमाणे कार्बनी अम्लांची अल्कोहॉलांबरोबर विक्रिया होऊन एस्टरे मिळत असल्याने, एका दृष्टीने एस्टरे लवणांसारखी असतात असे म्हणण्यास हरकत नाही. कार्बॉक्सिलिक अम्लांपासून क्लोराइडे, अमाइडे व एस्टरे मिळतात. त्याचप्रमाणे सल्फॉनिक अम्लांपासूनही तत्ससदृश संयुगे तयार होतात. R.SO3H ह्या मूळ अम्लापासून R–SO2Cl, R.SO2NH2, R.SO3.C2H5 अशी क्लोराइडे, अमाइडे व एस्टरे मिळतात. यांशिवाय अम्ल ॲनहायड्राइडे व ॲमिडीन ह्या वर्गातील पदार्थांचाही अम्ल वर्गातील पदार्थांशी जवळचा संबंध आहे. कार्बॉक्सिलिक अम्लांच्या दोन रेणूंतून पाण्याचा एक रेणू काढून टाकल्यास अम्ल ॲनहाइड्राइडे तयार होतात. उदा.,

पण डाय कार्बॉक्सिलिक अम्ल असल्यास एकाच अम्ल रेणूमधून पाण्याचा रेणू काढता येतो. उदा.,

तसेच एकाच अम्ल रेणूमध्ये दोन भिन्न अम्ल मूलके (उदा., COOH व HSO2) जवळजवळ आली तरीही ॲनहायड्राइड बनू शकते.

ॲमिडीन संयुगे, अमाइड या संयुगवर्गातील ॲमिडो –CONH2 या मूलकाचे जे –C(OH)=NH हे पर्यायी रूप आहे. त्यातील OH च्या जागी ॲमिनो मूलक (NH2) आणल्याने बनतात. उदा.,

ऑक्सिजन अणू असलेल्या कार्बनी संयुगांत ईथरे हा एक वर्ग आहे. ऑक्सिजन अणूच्या दोन्ही बाजूंस एक एक अल्किल किंवा अरिल मूलक जोडल्यास ईथर वर्गातील संयुगे तयार होतात. उदा., C2H5–O–C2H5 डायएथिल ईथर, C2H5–O–C6H5 एथिलफिनिल ईथर, C6H5–O–C6H5 डायफिनिल ईथर.
नायट्रोजन अणू असलेल्या संयुगांत अमाइन वर्गाची संयुगे महत्त्वाची समजली जातात. NH3 म्हणजे अमोनिया याच्या रेणूतील हायड्रोजन अणूऐवजी अल्किल किंवा अरिल मूलके आल्यास अमाइन वर्गातील पदार्थ तयार होतात. उदा., C2H5NH2 एथिल अमाइन, C6H5NH2 फिनिल अमाइन (ॲनिलीन) वगैरे. अमोनियाच्या रेणूतील एका हायड्रोजन अणूऐवजी अल्किल किंवा अरिल मूलके आले असल्यास त्यास प्राथमिक अमाइन, दोन हायड्रोजन अणूंच्या ऐवजी दोन अल्किल किंवा अरिल मूलके आली असता द्वितीयक अमाइन व तीन हायड्रोजन अणूंऐवजी तीन अल्किल किंवा अरिल मूलके आली असल्यास तृतीयक अमाइन असे म्हणतात. त्यांची रासायनिक सूत्रे खाली दिल्याप्रमाणे मांडता येतील. प्राथमिक अमाइन R–NH2, द्वितीयक अमाइन  तृतीयक अमाइन
तृतीयक अमाइन  यातील R, R1 किंवा R2 म्हणजे अल्किल किंवा अरिल मूलके होत. अमाइन वर्गातील पदार्थांचे नामकरण करताना दुसरीही एक पद्धत वापरण्यात येते. अमाइनमध्ये जितके अणू आहेत तितकेच कार्बन अणू असलेल्या हायड्रोकार्बनाच्या नावाआधी ॲमिनो हा शब्द जोडावयाचा. उदा., CH3NH2 ॲमिनोमिथेन, C6H5NH2 ॲमिनोबेंझीन,
यातील R, R1 किंवा R2 म्हणजे अल्किल किंवा अरिल मूलके होत. अमाइन वर्गातील पदार्थांचे नामकरण करताना दुसरीही एक पद्धत वापरण्यात येते. अमाइनमध्ये जितके अणू आहेत तितकेच कार्बन अणू असलेल्या हायड्रोकार्बनाच्या नावाआधी ॲमिनो हा शब्द जोडावयाचा. उदा., CH3NH2 ॲमिनोमिथेन, C6H5NH2 ॲमिनोबेंझीन,  यास फिनिलॲमिनोमिथेन किंवा मिथिलॲमिनोबेंझीन किंवा या नावाने ओळखतात.
यास फिनिलॲमिनोमिथेन किंवा मिथिलॲमिनोबेंझीन किंवा या नावाने ओळखतात.
कधीकधी नायट्रोजन अणू असलेल्या कार्बनी संयुगांत – CN हे कार्यकारी मूलक असते अशा संयुगांचे साधारण सूत्र R–CN असे होते. त्यांना सायनाइडे म्हणतात. यात R म्हणजे अल्किल किंवा अरिल मूलक होय. ह्या सायनाइडापासून जलीय विच्छेदनाने (पाण्याच्या विक्रियेने घटक अलग करून) जे अम्ल मिळते त्या अम्लावरून आणि नायट्राइल हे पद लावून त्या सायनाइडाचे नामकरण करण्यात येते. उदा., CH3CN याला मिथिल सायनाइड किंवा ॲसिटोनायट्राइल असे म्हणतात कारण याच्या जलीय विच्छेदनाने ॲसिटिक अम्ल मिळते. कधीकधी सायनोजन – CN मूलकाला जोडलेल्या मूलकामध्ये जितके कार्बन अणू असतात तितकेच कार्बन अणू असलेल्या हायड्रोकार्बनला ‘सायनो’ हे पद सुरूवातीस लावून सायनाइडाचे नामकरण करण्यात येते. उदा., CH3CN याला सायनोमिथेन ह्या नावानेही ओळखतात. C6H5CN हे फिनील सायनाइड, बेंझोनायट्राइल व सायनोबेंझीन या तीन नावांनी ओळखले जाते.
सायनाइडाचेच रासायनिक सूत्र असलेले आयसोसायनाइड नावाचे पदार्थ आहेत. ह्या संयुगांमध्ये –NC हे कार्यकारी मूलक असते. त्याचे साधारण रासायनिक सूत्र R–NC असे आहे. यात R म्हणजे अल्किल किंवा अरिल मूलक होय. ह्या वर्गातील पदार्थांचे गुणधर्म सायनाइड वर्गातील पदार्थांच्या गुणधर्मांहून भिन्न असतात. आयसोसायनाइडाचे जलीय विच्छेदन केल्यास त्यापासून अम्ल न मिळता प्राथमिक अमाइन मिळते. उदा., R – NC → R – NH2. आयसोसायनाइड वर्गातील संयुगांची नावे त्यातील अल्किल अथवा अरिल गटांच्या नावांपुढे आयसोसायनाइड हे उपपद लावून बनवितात. उदा., C6H5NC फिनिल आयसोसायनाइड.
हायड्रोकार्बनातील हायड्रोजन अणूच्या जागी हॅलोजन अणू घातल्याने जी संयुगे बनतात त्यांची नावे त्यात असलेल्या कार्बनी मूलकावरून किंवा संयुगातील हॅलोजन अणूऐवजी हायड्रोजन अणू आणल्यास जे संयुग मिळते त्याच्या नावापूर्वी हॅलोजनाचे नाव लावून ठरविण्यात येतात. उदा., C2H5Cl हे सूत्र असलेल्या संयुगास एथिल क्लोराइड किंवा क्लोरोएथेन म्हणतात व C6H5Cl हे सूत्र असलेल्या संयुगास फिनिल क्लोराइड किंवा क्लोरोबेंझीन म्हणतात. ज्यावेळी संयुगामध्ये एकाहून अधिक हॅलोजन अणू असतात त्यावेळी त्या संयुगास नाव देताना त्यातील हॅलोजन अणूंची संख्या व ते कोणत्या कार्बन अणूंस जोडले गेले आहेत ते दर्शविण्यात येते. उदा., CH2Cl.CH2Cl हे सूत्र असलेल्या संयुगास १, २ – डायक्लोरो एथेन म्हणण्यात येते व CH3.CHCl2 हे सूत्र असलेल्या संयुगास १, १ – डायक्लोरो एथेन म्हणतात. यातील १, २ किंवा १,१ यावरून कोणकोणत्या कार्बन अणूस हॅलोजन अणू जोडले आहेत हे समजते, तर ‘डाय’ ह्या शब्दाने रेणूतील हॅलोजन अणूंची संख्या दोन आहे हे व्यक्त होते. ॲरोमॅटिक वर्गातील पदार्थांमध्ये, हॅलोजन अणू कोठे जोडले गेले आहेत हे दाखविण्यासाठी ऑर्थो, मेटा व पॅरा हे शब्द वापरण्यात येतात. उदा., खालील सूत्रांनी दाखविण्यात आलेल्या पदार्थांची नावे अनुक्रमे ऑर्थो-डायक्लोरो बेंझीन, मेटा-डायक्लोरो बेंझीन आणि पॅरा-डायक्लोरो बेंझीन अशी आहेत.

कधीकधी हॅलोजन अणू ज्या कार्बन अणूस जोडला गेलेला आहे त्या कार्बन अणूस पहिला क्रमांक देऊन तेथून वलयात असलेल्या इतर कार्बन अणूंचे क्रमांक ठरविण्यात येतात व कोणत्या कार्बन अणूस हॅलोजन अणू जोडला गेलेला आहे ते दर्शविण्यात येते. उदा., ऑर्थो-डायक्लोरो बेंझिनाला १, २-डायक्लोरो बेंझीन, मेटा-डायक्लोरो बेंझीनाला १, ३ डायक्लोरो बेंझीन व पॅरा डायक्लोरो बेंझीनाला १, ४ डायक्लोरो बेंझीन असेही म्हणतात. ऑर्थो, मेटा व पॅरा या संज्ञांनी समीप, एकांतरित (एकाआड एक) व संमुख (समोरासमोरील) स्थाने दर्शविली जातात.
कार्बनी संयुगांचे वर्गीकरण कसे करतात हे दाखविण्यासाठी काही थोड्या संयुगांचे वर्ग उदाहरणादाखल घेतले आहेत. आतापर्यंत वर्णन केलेल्या कार्बनी संयुगांच्या वर्गांशिवाय आणखी कित्येक वर्ग माहीत आहेत. त्यांतील काही वर्गांची नावे व त्या त्या वर्गातील कार्यकारी मूलके पुढे दिली आहेत. ॲझो –N = N–, हायड्राझो – NH–NH–, नायट्रोसो – N = O , आयसोनायट्रोसो = N–OH, हायड्राझीन –NH = NH2, हायड्रॉक्सिल ॲमिनो – NH – OH, फॉस्फिनो – PH2, मर्कॅप्टो –SH, सल्फोनिल = SO2, सल्फॅनिल = S = O, सल्फिनो – SO2H, थायोकार्बॉनिल = C = S इत्यादी.
संयुगामध्ये एकच कार्यकारी मूलक असल्यास अशा संयुगास एक-कार्यकारी संयुग म्हणतात. एकाहून अधिक कार्यकारी मूलके असल्यास त्यास बहु-कार्यकारी संयुगे म्हणतात किंवा संयुगातील कार्यकारी मूलकांची संख्या द्वि, त्रि यांसारखे संख्यावाचक शब्द वापरून दाखविली जाते.
रासायनिक गुणधर्मांव्यतिरिक्त इतर गुणधर्मांवर आधारलेले वर्गीकरण : कधीकधी संरचना भिन्नत्व आणि रासायनिक गुणधर्म भिन्नत्व असूनही काही संयुगांचा, त्यांचे इतर गुणधर्म लक्षात घेऊन, एकाच वर्गात समावेश करतात. उदा., जीवनसत्वे, ग्रंथिस्त्राव किंवा अंत:स्त्राव द्रव्ये (हॉर्मोने), टर्पिने, प्लॅस्टिके, रंजकद्रव्ये इत्यादी.
निरनिराळ्या जीवनसत्त्वांची संरचना व रासायनिक गुणधर्म एकमेकांसारखे मुळीच नाहीत. पण त्यांमध्ये असलेला एक समान गुण म्हणजे जीवनसत्त्वे शरीराच्या स्वाभविक वाढीसाठी आहारात असणे जरूर आहे व ती नसल्यास वा अपुरी पडल्यास काही विशिष्ट रोग उद्भवतात व ते रोग त्या त्या जीवनसत्त्वाच्या आहाराने बरे होतात, हे लक्षात घेऊन त्यांचा समावेश एकाच वर्गात करण्यात आला आहे.
शरीरातील अंत:स्त्रावी ग्रंथींतून शरीराला मिळणाऱ्या अंत:स्त्राव द्रव्यांमुळे शरीराच्या निरनिराळ्या घटकांचे कार्य सुसूत्रपणे चालते. पण या अंत:स्त्रावात काही बिघाड झाल्यास किंवा पुरेशी अंत:स्त्राव द्रव्ये शरीरास न मिळाल्यास रोगोद्भव होतो. हा समान गुण लक्षात घेऊन अंत:स्त्राव द्रव्यांचा एकाच वर्गात समावेश करण्यात आला आहे. त्याचप्रमाणे संरचना भिन्नत्व व रासायनिक गुणधर्मांत भेद असूनही बाष्पनशील (उडून जाणाऱ्या) तेलांत सापडणाऱ्या पदार्थांचा समावेश टर्पिने या वर्गात करण्यात आला आहे.
एकाच प्रकारचे किंवा अनेक प्रकारचे रेणू एकत्र येऊन त्यांपासून जास्त रेणुभार असलेले रेणुपुंज तयार झाल्यामुळे प्लॅस्टिक वर्गातील पदार्थ तयार होतात. प्लॅस्टिक तापवून त्यास दाबाखाली पाहिजे तो आकार देता येतो. ह्या वर्गातील पदार्थांचा हा समान गुणधर्म होय. पण काही पदार्थांना उष्णता व दाब यांच्या साहाय्याने एकदा आकार दिल्यानंतर त्या आकारात पुन्हा फरक करता येत नाही, अशा प्लॅस्टिकांना ऊष्मादृढ प्लॅस्टिके म्हणतात. बेकेलाइट हे अशा तऱ्हेचे प्लॅस्टिक आहे, तर लुसाइटासारखे प्लॅस्टिक पाहिजे तितक्या वेळा तापवून त्यास प्रत्येक वेळी नवीन आकार देता येतो. लुसाइटासारख्या प्लॅस्टिकाला ऊष्मामृदू प्लॅस्टिक म्हणतात.
कापडाला किंवा तत्सम पदार्थांना रंगविण्याचा गुणधर्म असणाऱ्या पदार्थांना रंजकद्रव्ये म्हणतात. त्यांमध्ये कार्यकारी किंवा वैशिष्ट्यपूर्ण मूलके असतात. त्यावरून ॲझो, ट्रायफिनिल मिथेन, नायट्रोसो, अँथ्रॅसीन, सल्फर इ. रंजकद्रव्ये कल्पिली आहेत. त्यांचे वर्गीकरण कधीकधी त्यांच्या साहाय्याने ज्या पद्धतीने कापड रंगवितात त्या पद्धतींना अनुलक्षून करण्यात येते. उदा., सबस्टॅंटिव्ह, व्हॅट इत्यादी.
कार्बनी रसायनशास्त्राची काही उद्दिष्टे : (१) निसर्गात मिळणाऱ्या किंवा प्रयोगशाळेत तयार केलेल्या कार्बनी संयुगांचे रासायनिक स्वरूप व संरचना ओळखणे, (२) निसर्गात सापडणाऱ्या कार्बनी संयुगांच्या संरचनेत फेरफार करून नवीन संयुगे तयार करणे व (३) विशिष्ट व अभिप्रेत गुणधर्म असलेली संयुगे प्रयोगशाळेत तयार करणे.
निसर्गात मिळणाऱ्या किंवा प्रयोगशाळेत तयार झालेल्या संयुगांची रेणुसंरचना ठरविण्याचे काम अत्यंत अवघड असते. पदार्थ अत्यंत शुद्धावस्थेत मिळाल्यावर प्रथमत: त्याचे रेणुसूत्र व नंतर संयुगातील कार्यकारी मूलके ठरविण्यात येतात. त्यानंतर त्या संयुगावर विविध रासायनिक विक्रिया करून त्यापासून लहान लहान रेणू मिळविण्यात येतात व त्यांच्या संरचना काय आहेत हे ठरविले जाते. मूळच्या संयुगापासून मिळालेल्या या लहान लहान रेणूंच्या संरचना लक्षात घेऊन मूळ रेणूची संरचना काय असावी याचा अंदाज करण्यात येतो. हा अंदाज बिनचूक आहे की नाही हे पाहण्यासाठी अंदाज केलेल्या संरचनेबरहुकूम संरचना असलेले संयुग प्रयोगशाळेत संश्लेषणाने (कृत्रिम रीत्या) तयार करण्यात येते. त्यानंतर मूळचे संयुग व प्रयोगशाळेत तयार केलेले संयुग यांच्या गुणधर्मांचा तौलनिक अभ्यास करून अंदाजलेली रेणुसंरचना बरोबर असल्याबद्दलची खात्री करून घेण्यात येते.
निसर्गात सापडणारे एखादे संयुग औषधासाठी उपयोगाचे असल्यास किंवा व्यापारी दृष्ट्या महत्त्वाचे असल्यास त्यासाठी निसर्गावरच अवलंबून रहावयास नको या उद्देशाने ते संयुग प्रयोगशाळेत तयार करण्यात येते. कधीकधी निसर्गात असणाऱ्या संयुगाचीच संरचना असलेले संयुग प्रयोगशाळेत तयार करण्याच्या कामी यश मिळते. पण ते संयुग प्रयोगशाळेत तयार करण्यास इतका खर्च येतो की, निसर्गात मिळणारे संयुग व प्रयोगशाळेत तयार केलेले संयुग यांमध्ये किंमतीच्या दृष्टीने चढाओढ असूच शकत नाही. अशावेळी एखाद्या नवीन पद्धतीचा उपयोग करून निर्मितीची किंमत खाली आणावी लागते आणि मगच प्रयोगशाळेत तयार झालेले संयुग व्यापारी दृष्ट्या यशस्वी ठरते. नीळ या रंजकद्रव्याविषयी जर्मनीत झालेले संशोधन अशा प्रकारच्या संशोधनाचे उत्तम उदाहरण म्हणून सांगता येईल.
कार्बनी संयुगांची रेणुसंरचना कळून आल्यावर, त्या संरचनेत काही फेरबदल करून, त्या संयुगांच्या उपयुक्ततेत काही भर पडते का हे पाहिले जाते. यासाठी मूळ रेणूतील काही कार्यकारी मूलके काढली जातात किंवा मूळ रेणूतील काही कार्यकारी मूलकांस नवीन कार्यकारी मूलके जोडली जातात किंवा मूळ रेणूतील काही कार्यकारी मूलके काढून त्यांऐवजी नवीन मूलके जोडली जातात. नीळ या रंजकद्रव्यावरील एक प्रयोग उदाहरणादाखल सांगता येईल. नीळ पाण्यात अविद्राव्य (न विरघळणारी) आहे. निळीचे ⇨क्षपण करून मिळविलेल्या वर्णहीन संयुगाच्या विद्रावात रंगवावयाचे कापड बुडविले जाते. कापडाने शोषून घेतलेल्या वर्णहीन द्रव्याचे हवेत ऑक्सिडीकरण [ → ऑक्सिडीभवन]होऊन कापडास निळा रंग येतो. निळीच्या रेणूवर सल्फ्यूरिक अम्लाची विक्रिया करून त्यास सल्फॉनिक मूलक जोडल्यानंतर तयार झालेल्या नवीन रेणूत पाण्यात विरघळण्याचा गुण येतो. अशा रीतीने पाण्यात विद्राव्य असलेले इंडिगो सल्फॉनिक अम्ल लोकर रंगविण्यासाठी उपयोगी पडते, तर याउलट निसर्गात मिळणारी नीळ जशीच्या तशी लोकरीवर चढविता येत नाही.
ज्याची रेणुसंरचना संपूर्ण माहीत आहे असे एखादे संयुग विशिष्ट कार्यासाठी उपयुक्त ठरल्यास कोणत्या मूलकाने ह्या संयुगास त्या विशिष्ट गुणधर्माची प्राप्ती झाली आहे, हे शोधून काढण्यात येते. त्यासाठी त्या संयुगाच्या गुणधर्मांचा अभ्यास करण्यात येतो. उदा., सिंकोनीन व क्विनीन ही दोन्ही औषधे हिवतापावर अत्यंत उपयुक्त ठरली आहेत. या दोन्ही औषधांची रेणुसंरचना ही बऱ्याच अंशी एकमेकांसारखी आहे. सिंकोनीन व क्विनीन यांच्या रेणूंचा अभ्यास करून त्यांच्या रेणूंतील समान भाग ठरविला गेला. क्विनीन व सिंकोनीन यांमध्ये असणाऱ्या समान भागामुळे त्यांमध्ये विशिष्ट औषधी गुणधर्म आला आहे असे ठरवून तो विशिष्ट भाग ज्यांच्या रेणूंमध्ये अंतर्भूत आहे अशी अटेब्रीन व प्लास्मोक्विन ही औषधे तयार करण्यात आली व ती हिवतापाच्या बाबतीत उपयुक्त ठरली आहेत.

१९३२ च्या सुमारास प्रॉन्टोसील हे रंजकद्रव्य काही विशिष्ट रोगजंतूंना अत्यंत यशस्वी रीत्या प्रतिकार करीत असल्याचे आढळून आले. या रंजकद्रव्यामध्ये हा औषधी गुणधर्म कसा आला त्याचा शोध करता त्यामध्ये संयोगरूपाने असलेल्या सल्फॉनिल-अमाइड  या भागामुळे तो गुणधर्म आल्याचे समजून आले. या रेणूतील–SO2.NH2 व –NH2 ही मूलके मुळातील बेंझीन रेणूला एकमेकांना संमुख जोडलेली आहेत. या पदार्थाच्या दुसऱ्या समघटकी संयुगांमध्ये म्हणजे ऑर्थो-आणि मेटा-ॲमिनो-बेंझीन सल्फोनामाइडामध्ये हा औषधी गुण अजिबात नाही हेही समजून आले. हे समजून आल्यावर पॅरा-सल्फॅनिल-अमाइडाच्या रेणुसंरचनेची मूलभूत रचना असलेली इतर संयुगे तयार करण्यात आली. अशा रीतीने सल्फापिरीडीन, सल्फाग्वानिडीन, सल्फाडायाझीन, सल्फाथायॉझॉल इ. औषधे तयार करण्यात आली.
या भागामुळे तो गुणधर्म आल्याचे समजून आले. या रेणूतील–SO2.NH2 व –NH2 ही मूलके मुळातील बेंझीन रेणूला एकमेकांना संमुख जोडलेली आहेत. या पदार्थाच्या दुसऱ्या समघटकी संयुगांमध्ये म्हणजे ऑर्थो-आणि मेटा-ॲमिनो-बेंझीन सल्फोनामाइडामध्ये हा औषधी गुण अजिबात नाही हेही समजून आले. हे समजून आल्यावर पॅरा-सल्फॅनिल-अमाइडाच्या रेणुसंरचनेची मूलभूत रचना असलेली इतर संयुगे तयार करण्यात आली. अशा रीतीने सल्फापिरीडीन, सल्फाग्वानिडीन, सल्फाडायाझीन, सल्फाथायॉझॉल इ. औषधे तयार करण्यात आली.
निरनिराळ्या कृत्रिम रबरांचा विचार त्यांच्याही बाबतीत असाच प्रकार झाल्याचे दिसून येते. नैसर्गिक रबराचे ऊर्ध्वपातन (वाफ करून व ती थंड करून) केल्यास आयसोप्रीन  हे द्रव्य मिळते. आयसोप्रीन बराच वेळ राहिल्यास त्याचे रबरासारख्या पदार्थात रूपांतर होते. त्यामुळे आयसोप्रिनाचे अनेक रेणू एकत्र येऊन त्यांचा रबराच्या गुणधर्माचा बृहद्रेणू (मोठा रेणू) तयार होतो असा निष्कर्ष निघाला. त्यामुळे आयसोप्रिनाच्या संरचनेसारखी संरचना असलेले ब्युटाडाइन H2C=CH–CH–CH2 आणि क्लोरोप्रीन
हे द्रव्य मिळते. आयसोप्रीन बराच वेळ राहिल्यास त्याचे रबरासारख्या पदार्थात रूपांतर होते. त्यामुळे आयसोप्रिनाचे अनेक रेणू एकत्र येऊन त्यांचा रबराच्या गुणधर्माचा बृहद्रेणू (मोठा रेणू) तयार होतो असा निष्कर्ष निघाला. त्यामुळे आयसोप्रिनाच्या संरचनेसारखी संरचना असलेले ब्युटाडाइन H2C=CH–CH–CH2 आणि क्लोरोप्रीन ![]() ही संयुगे तयार करून त्यांचे रेणू बहुवारिकीकरणाने (अनेक रेणू एकत्र करून एक जटिल रेणू तयार करण्याच्या क्रियेने) एकत्र करण्यात आले. अशा रीतीने तयार केलेल्या बृहद्रेणूंचे गुणधर्म नैसर्गिक रबरापेक्षाही काही बाबतींत सरस असल्याचे दिसून आले. या सारखाच प्रकार कृत्रिम तंतूंच्या बाबतीत झाल्याचे दिसून येते. ॲमिनो अम्लांचे रेणू एकमेकांस जोडले जाऊन प्रथिनांचे रेणू तयार होतात हे समजल्यानंतर डायकार्बॉक्सिलिक अम्ले व डायअमाइने यांचे रेणू एकत्र आणून त्यांचा बृहद्रेणू प्रथम बनविला गेला व त्यातून पुढे नायलॉनासारख्या अत्यंत उपयुक्त तंतूंचा शोध लागला. नायलॉनाच्या तंतूंची संरचना बरीचशी रेशीम व लोकर यांसारखी असली, तरीपण नायलॉनाचे गुणधर्म रेशीम व लोकर यांहून अगदी भिन्न आहेत व त्यामुळे तो तंतू म्हणजे कृत्रिम रेशीम किंवा कृत्रिम लोकर नाही.
ही संयुगे तयार करून त्यांचे रेणू बहुवारिकीकरणाने (अनेक रेणू एकत्र करून एक जटिल रेणू तयार करण्याच्या क्रियेने) एकत्र करण्यात आले. अशा रीतीने तयार केलेल्या बृहद्रेणूंचे गुणधर्म नैसर्गिक रबरापेक्षाही काही बाबतींत सरस असल्याचे दिसून आले. या सारखाच प्रकार कृत्रिम तंतूंच्या बाबतीत झाल्याचे दिसून येते. ॲमिनो अम्लांचे रेणू एकमेकांस जोडले जाऊन प्रथिनांचे रेणू तयार होतात हे समजल्यानंतर डायकार्बॉक्सिलिक अम्ले व डायअमाइने यांचे रेणू एकत्र आणून त्यांचा बृहद्रेणू प्रथम बनविला गेला व त्यातून पुढे नायलॉनासारख्या अत्यंत उपयुक्त तंतूंचा शोध लागला. नायलॉनाच्या तंतूंची संरचना बरीचशी रेशीम व लोकर यांसारखी असली, तरीपण नायलॉनाचे गुणधर्म रेशीम व लोकर यांहून अगदी भिन्न आहेत व त्यामुळे तो तंतू म्हणजे कृत्रिम रेशीम किंवा कृत्रिम लोकर नाही.
वरील उदाहरणांवरून कार्बनी रसायनशास्त्राचा व्यवहारात कसा उपयोग होतो याची कल्पना येईल.
पहा : ॲमिनो अम्ले; ईथर-१; एस्टरे; कार्बॉक्सिलिक अम्ले; कार्बोहायड्रेटे; टर्पिने; प्लॅस्टिक व उच्च बहुवारिके; रसायनशास्त्र; रासायनिक विक्रिया; रासायनिक संरचना; वैश्लेषिक रसायनशास्त्र; हायड्रोकार्बने.
संदर्भ : 1. Clark, N. G. Modern Organic Chemistry, New York, 1965.
2. Cram, D. R.; Hammond, G. S. Organic Chemistry, New York, 1963.
3. Fieser, L. F.; Fieser, M. Advanced Organic Chemistry, New York, 1961.
4. Finar, I. L. Organic Chemistry, New York. 1963.
5. Gilman, H. Organic Chemistry : An Advanced Treatise, 4 Vols., New York and London, 1953.
6. Ingold, C. K. Structure and Mechanism in Organic Chemistry, New York, 1953.
7. Roberts, J. D.; Caserio, M. C. Basic Principles of Organic Chemistry, New York, 1964.
8. Schorlemmer, C. The Rise and Development of Organic Chemistry, London, 1894.
9.Todd, A. R., Ed. Perspectives in Organic Chemistry, New York, 1953.
जाधव, ग. वि.