त्रिमितीय रसायनशास्त्र : रसायनशास्त्राच्या या विभागात संयुगांच्या रेणूंमध्ये जे घटक अणू असतात त्यांची मांडणी त्रिमितीय (लांबी, रुंदी व उंची किंवा खोली यांचा समावेश असलेल्या) अवकाशात कशी झालेली आहे आणि तिचा त्या संयुगाच्या गुणधर्मांवर काय परिणाम होतो, यासंबंधी विचार करण्यात येतो.
इतिहास : या विभागाचा उगम कार्बनी रसायनशास्त्रातील संरचना सिद्धांतातून झाला. या सिद्धांतानुसार संयुगाचे घटक अणू एकमेकांस ज्या तऱ्हेने जोडलेले असतात (संरचना) त्याला अनुसरून त्यांचे गुणधर्म ठरतात. एकच रेणुसूत्र (संयुगाच्या रेणूत असलेल्या अणूंचे प्रकार व संख्या व्यक्त करणारे सूत्र) असलेली एकापेक्षा अधिक संयुगे असतील, तर त्यांच्या संरचना भिन्न असतात. म्हणून एकाच रेणूसूत्राची जितकी संयुगे असतील तितक्या भिन्न संरचनाही असल्या पाहिजेत, हे उघड आहे [⟶ समघटकता].
रसायनशास्त्राच्या प्रारंभाच्या काळी ज्ञात संयुगांची संख्या, त्याचे गुणधर्म आणि संरचनांचे वेगवेगळे प्रकार यांचा मेळ बरोबर बसत असे परंतु एकोणिसाव्या शतकात असे आढळू लागले की, एकाच संरचनेची एकापेक्षा अधिक संयुगे अस्तित्वात असू शकतात. या वस्तुस्थितीचे आद्य उदाहरण म्हणजे टार्टारिक अम्ल. लूई पाश्चर यांना असे दिसून आले की, याचे दोन प्रकार आहेत. दोहोंची संरचना एकच परंतु गुणधर्मांचा विचार केल्यास ती दोन वेगळी संयुगे ठरतात. भेद दर्शविणारा त्यांचा गुण म्हणजे प्रतल–ध्रुवित (ज्याचे तरंग एकाच प्रतलात कंप पावतात अशा) प्रकाशावर होणारा त्यांचा परिणाम. या अम्लाच्या प्रकारांचे सारखे प्रमाण घेऊन मापन केले, तर एका प्रकाराने अशा प्रकाशाचे कंपन–प्रतल उजवीकडे वळविले जाते, तर दुसऱ्या प्रकाराने ते तितक्याच अंशाने पण डावीकडे वळविले जाते (प्रकाशीय वलन). या घटनेचे स्पष्टीकरण कसे करावे हा त्या काळी एक मोठा प्रश्न होता.
असाच परिणाम क्वॉर्ट्झ या खनिजाच्या स्फटिकामुळेही होतो, असा अनुभव होता. शिवाय या स्फटिकांची दोन रूपे आहेत आणि त्यांची तुलना केली तर असे आढळते की, एकाचे रूप हे दुसऱ्याच्या आरशात पडलेल्या प्रतिबिंबासारखे असून त्यांचे अध्यारोपण होत नाही, हे माहीत होते (रूपांचे सारखे भाग एकाच दिशेकडे तोंडे करतील अशा तऱ्हेने घेऊन रूपे एकमेकांवर ठेवली असता त्यांचे सर्व सारखे भाग एकमेकांशी जुळले म्हणजे अध्यारोपण झाले असे म्हणतात उदा., आपल्या हाताचे पंजे. एक पंजा हा दुसऱ्याच्या आरशात पडलेल्या प्रतिबिंबासारखा आहे. दोहोंचे तळहात वर किंवा खाली होतील अशा तऱ्हेने धरून ते एकमेकांवर ठेवले तर आंगठे, तर्जनी, मधले बोट व करंगळी हे सारखे भाग एकमेकांशी जुळत नाहीत म्हणजेच त्यांचे अध्यारोपण होत नाही).
इ. स. १८४८ च्या सुमारास पाश्चर यांनी टार्टारिक अम्लाच्या प्रकारांचे आणि त्यांच्या लवणांचे निरीक्षण केले तेंव्हा त्यांच्या स्फटिकरूपांची स्थितीही तशीच आहे, असे त्यांना दिसून आले परंतु क्वॉर्ट्झ आणि टार्टारिक अम्ले यांमध्ये एक महत्त्वाचा फरकही आढळला. तो म्हणजे क्वॉर्ट्झाने होणारे प्रकाशीय वलन त्याचे स्फटिकरूप कायम असेल तरच टिकते स्फटिकरूप नाहीसे झाले की, प्रकाशीय वलनही नाहीसे होते परंतु टार्टारिक अम्लाने घडणारे प्रकाशीय वलन त्याच्या स्फटिकरूपाशी निगडित नाही. अम्ल विद्रावकात (विरघळविणाऱ्या पदार्थात) ते विरघळविले म्हणजे त्याचे स्फटिकरूप जाते परंतु विद्रावात प्रकाशीय वलनाचा गुण कायम राहतो.
क्वॉर्ट्झाचे स्फटिक आणि टार्टारिक अम्ले यांमधील साम्य आणि भेद यांचा विचार करून पाश्चर यांनी असा निष्कर्ष काढला की, अम्लाचा हा गुण क्वॉर्ट्झाप्रमाणे स्फटिकांतील रेणूंच्या मांडणीत नसून अम्लांच्या रेणूंमध्ये असणाऱ्या अणू आणि मूलके (विक्रियांमध्ये तसेच राहणारे पण सामान्यतः वेगळे अस्तित्व नसणारे अणूंचे गट) यांच्या त्रिमितीय अवकाशात झालेल्या मांडणीत असला पाहिजे. त्यांनी असेही सुचविले की, अम्लाच्या एका प्रकारात ही मांडणी उजवीकडून सुरू होणाऱ्या सर्पिलासारखी (स्क्रूच्या आट्यांप्रमाणे) आणि दुसऱ्यात डाव्या बाजूने सुरू होणाऱ्या सर्पिलासारखी असावी किंवा अम्लाचे घटक–अणू आणि मूलके एखाद्या अनियमीत चतुःपृष्ठकाच्या (चार पृष्ठे असलेल्या घनाकृतीच्या) कोनांच्या ठिकाणी असावेत. अशा तऱ्हेने संयुगाच्या गुणधर्माचे स्पष्टीकरण करण्यासाठी त्रिमितीय मांडणीची कल्पना प्रथमच अस्तित्वात आली व त्रिमितीय रसायनशास्त्राचा पाया घातला गेला.
लॅक्टिक अम्लाचेही दोन प्रकार असून त्यांपैकी एक प्रकाशीय वलन दाखवतो, असे जे. व्हिस्लीत्सेनुस यांनी १८७२ मध्ये निदर्शनास आणले. H

व मूलके एकाच प्रतलात आहेत असे मानले, तर दोन भिन्न संयुगांचे अस्तित्व स्पष्ट करणे अशक्य आहे. तेव्हा येथे त्रिमितीय मांडणीचा स्वीकार करण्याखेरीज गत्यंतर नाही, असे त्यांनी प्रतिपादन केले.
कार्बनी संयुगांच्या त्रिमितीय मांडणीसंबंधी निश्चित सिद्धांत १८७४ मध्ये जे. एच् व्हांट हॉफ आणि जे. ए. ल बेल या शास्रज्ञांनी मांडला. त्यानुसार कार्बन अणूच्या चार संयुजा [अणूंची परस्परांशी संयोग पावण्याची क्षमता ⟶ संयुजा] नियमीत चतुःपृष्ठकाच्या कोनांच्या दिशेने कार्यान्वित असतात. हे लक्षात घेऊन अणूंची व मूलकांची मांडणी केली तर प्रकाशीय वलन असणाऱ्या रेणूंचे स्पष्टीकरण कसे करता येते, हे त्यांनी दाखविले इतकेच नव्हे, तर द्विबंध (ज्यामध्ये कार्बन अणू एकमेकांस दोन संयुजाबंधांनी जोडले गेले आहेत अशा) असलेल्या कार्बनी संयुगांचे कोणते प्रकार असणे शक्य आहे, याचेही भाकीत केले ते नंतर झालेल्या संशोधनाने खरे ठरले.
आधुनिक काळात असे दिसून आले आहे की, केवळ कार्बन अणूच्याच नव्हे तर नायट्रोजन, गंधक, फॉस्फरस इ. अनेक अणूंच्या संयुजाही अवकाशात चतुःपृष्ठकांच्या कोनांच्या दिशांनी कार्य करतात. त्यामुळे त्रिमितीय रसायनशास्त्र हे आता कार्बनापुरतेच मर्यादित नाही. तथापि कार्बनांच्या त्रिमितीय रसायनशास्त्राइतका सांगोपांग अभ्यास इतर सर्व मूलद्रव्यांच्या बाबतीत झालेला नाही.
प्रकाशीय वलनक्षमतेची कारणमीमांसा : ज्या संयुगाच्या रेणूची त्रिमितीय मांडणी तिच्या प्रतिबिंबरूप मांडणीवर अध्यारोपित करता येत नाही, असे संयुग प्रकाशीय परिवलन दाखविते. रेणूला अशी स्थिती म्हणजे असममितता येण्यासाठी त्यामध्ये पुढील गोष्टी नसल्या पाहिजेत असे सिद्ध झाले आहे. त्या म्हणजे (१) सममिती प्रतल, (२) सममिती बिंदू व (३) पर्यायी सममिती अक्ष या होत.
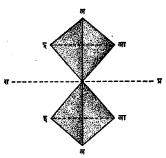
 (१) रेणूतून जाईल अशा ज्या कल्पित प्रतलामुळे रेणूचे असे दोन भाग पडतात की, त्यांतील एक भाग हा दुसऱ्याचे आरशात पडलेले प्रतिबिंब आहे त्या प्रतलाला सममिती प्रतल म्हणतात (आ. ३).
(१) रेणूतून जाईल अशा ज्या कल्पित प्रतलामुळे रेणूचे असे दोन भाग पडतात की, त्यांतील एक भाग हा दुसऱ्याचे आरशात पडलेले प्रतिबिंब आहे त्या प्रतलाला सममिती प्रतल म्हणतात (आ. ३).
(२) रेणूमध्ये असलेला असा एखादा कल्पित बिंदू की, ज्यातून जाणारी सरळ रेषा दोन्ही बाजूंस वाढविली, तर तिची टोके समान अणूंना किंवा समान मूलकांना मिळतील अशा बिंदूला सममिती बिंदू असे म्हणतात (आ. ४).
 (३) पर्यायी सममिती अक्ष सामान्यतः वलयी (अणूंच्या शृंखलेची टोके जोडली म्हणजे होणारी संरचना) संयुगात आढळतो. संयुगाच्या वलयात असणारे अणू एका प्रतलात आणि त्यांना जोडलेले अणू वा मूलके वलयी प्रतलाच्या खाली व वर अशा दोन वेगळ्या प्रतलांत असतात. वलयाच्या मध्यभागी असणाऱ्या कल्पित बिंदूला रेणुकेंद्र म्हणतात. रेणुकेंद्रातून जाईल अशा ज्या कल्पित अक्षाभोवती वरील दोन प्रतलांपैकी कोणतेही एक ९०° ने फिरविले असता वलयी प्रतल सममिती प्रतल होते व आणखी ९०° ने फिरविले, तर ते सममिती प्रतल राहत नाही, अशा अक्षाला पर्यायी सममिती अक्ष म्हणतात. आकृती ५ मध्ये याची दोन उदाहरणे दिली आहेत.
(३) पर्यायी सममिती अक्ष सामान्यतः वलयी (अणूंच्या शृंखलेची टोके जोडली म्हणजे होणारी संरचना) संयुगात आढळतो. संयुगाच्या वलयात असणारे अणू एका प्रतलात आणि त्यांना जोडलेले अणू वा मूलके वलयी प्रतलाच्या खाली व वर अशा दोन वेगळ्या प्रतलांत असतात. वलयाच्या मध्यभागी असणाऱ्या कल्पित बिंदूला रेणुकेंद्र म्हणतात. रेणुकेंद्रातून जाईल अशा ज्या कल्पित अक्षाभोवती वरील दोन प्रतलांपैकी कोणतेही एक ९०° ने फिरविले असता वलयी प्रतल सममिती प्रतल होते व आणखी ९०° ने फिरविले, तर ते सममिती प्रतल राहत नाही, अशा अक्षाला पर्यायी सममिती अक्ष म्हणतात. आकृती ५ मध्ये याची दोन उदाहरणे दिली आहेत.
एखाद्या संयुगातील कार्बन अणूला चार निरनिराळे अणू किंवा मूलके जोडलेली असतील, तर तो रेणू असममित होतो. अशा कार्बन अणूलाही असममित कार्बन अणू म्हणतात. उदा., लॅक्टिक अम्लातील तारांकित कार्बन अणू असममित आहे (सूत्र १).

नामकरण : प्रकाशीय वलनक्षम पदार्थातून पार गेल्यावर प्रतल ध्रुवित प्रकाश घटिवत (घड्याळाचे काटे ज्या दिशेने फिरतात त्या) दिशेने वलन पावला, तर त्या वलनाला दक्षिण वलन म्हणतात व ते (+) या चिन्हाने किंवा d या अक्षराने दाखवितात. याच्या विरुद्ध दिशेने होणारे वलन (–) या चिन्हाने किंवा I या अक्षराने दाखविले जाते व त्याला वामवलन म्हणतात. प्रकाशीय वलन असलेल्या संयुगाची एक मांडणी दक्षिण वलनी (+) असली, तर तिचे प्रतिबिंब होईल अशी मांडणी वामवलनी (–) असते.
बहिःपूरण : एखाद्या संयुगाचा दक्षिण वलनी प्रकार व वामवलनी प्रकार जेव्हा सम प्रमाणात एकत्र असतात तेव्हा एकाचे दक्षिण वलन दुसऱ्याच्या वामवलनाने नष्ट होते व त्यामुळे असे मिश्रण प्रकाशीय वलन दाखवीत नाही. या अवलनी प्रकारास बहिःपूरित (रॅसेमिक) प्रकार म्हणतात व तो (±) या चिन्हाने किंवा d। या संज्ञेने दर्शवितात. या प्रकाराचा उल्लेख बहिःपूरित असाही केला जातो.
उष्णता, विक्रियाकारक वा उत्प्रेरक (विक्रिया त्वरेने व्हावी म्हणून वापरलेला व शेवटी तसाच राहणारा पदार्थ) यांचा परिणाम होऊन कित्येकदा मूळच्या दक्षिण वलनी (किंवा वामवलनी) संयुगापैकी निम्मा अंश वामवलनी (किंवा दक्षिण वलनी) होतो व त्यामुळे प्रकाशीय वलन नष्ट होते. या घटनेस बहिःपूरण (रॅसेमायझेशन) म्हणतात.
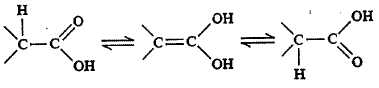
बहिःपूरण संयुगाच्या संरचनेवरही अवलंबून असते, असे दिसून आले आहे. सामान्यतः ज्या संयुगात असममित कार्बन अणूला एक हायड्रोजन अणू जोडलेला असून शेजारी कार्बोनिल गट (CO) असेल, तर बहिःपूरण सुलभतेने घडून येते. उदा., ग्लिसराल्डिहाइड, मँडेलिक अम्ल. याची उपपत्ती अशी लावतात की, या हायड्रोजन अणूमुळे चलसमघटकतेने [⟶ समघटकता] कीटोरूपाचे प्रथम ईनॉलात रूपांतर होते. त्यामुळे द्विबंध निर्माण होऊन कार्बनी अणूची असममितता नष्ट होते. ईनॉलाचे पुन्हा जेव्हा कीटोरूप बनते त्या वेळी द्विबंधांपैकी कोणताही भंग पावू शकतो कारण दोन्ही बंध समान आहेत. एकामुळे मूळचे संयुग (+) किंवा (–) निर्माण झाले, तर दुसऱ्याच्या भंगामुळे त्याचे प्रतिबिंबरूप संयुग निर्माण होईल. दोन्ही संयुगे बनण्याची शक्यता सारखीच असल्यामुळे (+) व (–) यांचे सम प्रमाण असलेले मिश्रण बनते व बहिःपूरण होते.
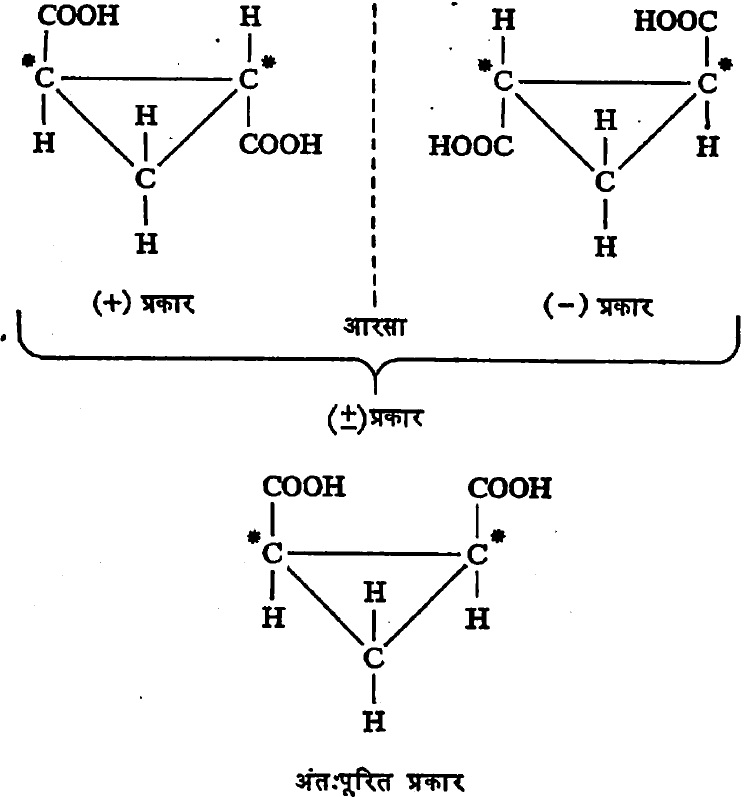
अंतःपूरण : काही संयुगांमध्ये दोन (अथवा अधिक) असममित अणू असतात व त्यांना जोडलेले अणू अथवा मूलके समान असून रेणूमध्ये त्या अणूंची मांडणी एकमेकांच्या बिंब–प्रतिबिंबासासारखी असते. त्यामुळे ते अणू एकमेकांचे प्रकाशीय वलन नष्ट करतात.
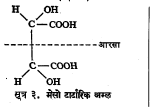
अशा संयुगांचा निर्देश ‘मेसो’ किंवा अंतःपूरित असा केला जातो, कारण येथे झालेला वलन–नाश रेणूच्या अंतर्गत असतो. उदा., मेसो टार्टारिक अम्ल (सूत्र ३).
 विभेदन : प्रकाशतः सक्रिय (प्रकाशीय वलन दाखविणाऱ्या) संयुगाचे संश्लेषण (घटक अणू अथवा मूलके असलेल्या साध्या संयुगांपासून रासायनिक विक्रियेने ते संयुग बनविण्याची क्रिया) केले, तर सामान्यतः त्याची दक्षिण वलनी आणि वामवलनी रूपे सम प्रमाणात निर्माण होऊन बहिःपूरित (±) प्रकार मिळतो. त्यापासून हवा असलेला इष्ट वलनाचा प्रकार मिळविण्याच्या क्रियेला विभेदन अशी संज्ञा आहे. यासाठी पुढील पद्धती मुख्यतः वापरल्या जातात.
विभेदन : प्रकाशतः सक्रिय (प्रकाशीय वलन दाखविणाऱ्या) संयुगाचे संश्लेषण (घटक अणू अथवा मूलके असलेल्या साध्या संयुगांपासून रासायनिक विक्रियेने ते संयुग बनविण्याची क्रिया) केले, तर सामान्यतः त्याची दक्षिण वलनी आणि वामवलनी रूपे सम प्रमाणात निर्माण होऊन बहिःपूरित (±) प्रकार मिळतो. त्यापासून हवा असलेला इष्ट वलनाचा प्रकार मिळविण्याच्या क्रियेला विभेदन अशी संज्ञा आहे. यासाठी पुढील पद्धती मुख्यतः वापरल्या जातात.
बहिःपूरित संयुगे अम्लधर्मी असतील, तर त्यांचा संयोग एखाद्या प्रकाशीय वलन असलेल्या क्षारकाबरोबर (अम्लाअबरोबर विक्रिया झाल्यास लवण देणाऱ्या पदार्थाबरोबर) घडवितात. उदा., (–) सिंकोनीन, (–) क्विनीन, (–) ब्रूसीन. विक्रियेसाठी (–) क्विनीन वापरले आहे असे समजले, तर बहिःपूरित प्रकारातील (+) अम्ल व (–) क्विनीन आणि (–) अम्ल व (–) क्विनीन यांच्या संयोगाने दोन त्रिमितीय पारसमघटकांचे (बिंब–प्रतिबिंब अशा मांडण्या नसलेल्या समघटकांचे) मिश्रण मिळेल. मिश्रणातील घटक स्फटिकीकरण अथवा तत्सम क्रियांनी वेगळे केले व नंतर त्यांचे अपघटन (मोठ्या रेणूचे तुकडे करून लहान रेणू बनविण्याची क्रिया) केले म्हणजे इष्ट ते प्रकाशतः सक्रिय अम्ल मिळविता येईल.
बहिःपूरित संयुगे क्षारकधर्मी (उदा., अमाइने) असतील, तर (–) क्विनिक अम्ल किंवा यासारख्या प्रकाशतः सक्रिय असणाऱ्या अम्लाशी [उदा., (+) कॅम्फोर सल्फॉनिक अम्ल] त्यांचा संयोग घडवून आणतात आणि मिळणारी संयुगे वरीलप्रमाणेच वेगळी काढून व त्यांचे अपघटन करून प्रकाशतः सक्रिय क्षारके वेगळी काढतात.
घटक उदासीन (क्षारकधर्मी किंवा अम्लधर्मी नसलेले) असतील (उदा., अल्कोहॉले), तर थॅलिक अम्लासारख्या एखाद्या द्विक्षारकीय (रेणूमध्ये दोन COOH मूलके असलेल्या) अम्लाशी त्यांचा संयोग घडवून प्रथम त्यापासून अम्लाधर्मी मोनोएस्टरे बनवितात व नंतर त्यांचा प्रकाशीय वलन असलेल्या क्षारकांबरोबर संयोग घडवून वरीलप्रमाणेच कार्यभाग साधतात.
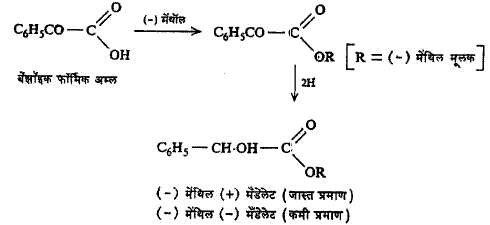
असममित संश्लेषण : प्रकाशतः सक्रिय संयुगाचे संश्लेषण करताना संश्लेषण क्रियेत प्रकाशीय वलन असलेल्या संयुगाचा समावेश केला, तर (+) व (–) या रूपांपैकी एक दुसऱ्यापेक्षा जास्त प्रमाणात निर्माण करता येते, या प्रक्रियेला असममित संश्लेषण म्हणतात. उदा., मेंथिल मँडेलेट (सूत्र ४).
बेंझाल्डिहाइडावर हायड्रोजन सायनाइडाची विक्रिया (+) क्विनीडिनाच्या उपस्थितीत घडविली, तर मिळणाऱ्या मिश्रणात (–) मँडेलोनायट्राइलाचे प्रमाण जास्त असते. (सूत्र ५).
प्रकाशीय वलनाचे मापन : यासाठी ध्रुवणमापक (पोलॅरिमीटर) हे उपकरण वापरतात. यामध्ये आ. ६ मधील (१) येथून एकवर्णी (एकच तरंगलांबी असलेला) प्रकाश आत जातो. तो (२) या निकोल लोलकामधून गेला म्हणजे प्रतल ध्रुवित बनतो व (४) या नळीतील प्रकाशीय वलनक्षम पदार्थात शिरतो. या पदार्थामुळे त्याचे मूळचे कंपन–प्रतल बदलते. ते किती अंशाने बदलेले आहे, हे ठरविण्यासाठी मापकात पदार्थ असलेली नळी ठेवण्यापूर्वी (३) हा निकोल


लोलक (१) या लोलकामधून येणारा प्रकाश पार जाऊ देणार नाही, अशा तऱ्हेने फिरवून घेतात व तो कोन मोजतात (को१). त्यानंतर पदार्थ भरलेली नळी लोलकांमध्ये ठेवली म्हणजे पदार्थ प्रकाशतः सक्रिय असल्यामुळे (३) या लोलकामधून अंशतः प्रकाश पार जात आहे असे आढळते. म्हणून तो पुन्हा फिरवून प्रकाश पार जाणार नाही अशी स्थिती आणतात व तो कोनही मोजतात (को२). मूळचा कोन (को१) आणि हा कोन (को२) यांमधील अंशात्मक फरक म्हणजे त्या पदार्थाने घडविलेले वलन होय. ते µ या अक्षराने दर्शवितात आणि त्यावरून विशिष्ट प्रकाशीय [µ] हा त्या पदार्थाचा स्थिरांक पुढे दिलेल्या समीकरणांनी ठरवितात.
पदार्थ द्रवरूप असेल, तर तसाच वापरता येतो पण घनरूप असेल तर त्याचा विद्राव वापरावा लागतो. मापन करताना वापरलेल्या एकवर्णी प्रकाशाची तरंगलांबी (), मापनाच्या वेळचे तापमान (t से.), संयुग विद्रावरूपात असेल, तर १०० घ. सेंमी. विद्रावात असलेले त्याचे ग्रॅममध्ये वजन (c) व वापरलेला विद्रावक यांची नोंद करावी लागते कारण स्थिरांकाचे मूल्य या सर्वांवर अवलंबून असते. सोडियमाच्या वाफेपासून मिळणारा एकवर्णी प्रकाश वापरला असेल तर तरंगलांबीऐवजी D हे अक्षर वापरण्याचा प्रघात आहे. द्रव पदार्थासाठी वापरावयाचे सूत्र :

येथे I = पदार्थ भरलेल्या नळीची डेसीमीटर व्यक्त केलेली लांबी व d = पदार्थाची सापेक्ष घनता.
विद्रावासाठी वापरावयाचे सूत्र :
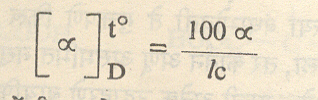
कार्बनाचे त्रिमितीय रसायनशास्त्र : प्रकाशवलनी संयुगांचे विवेचन करताना त्यांच्या रेणूंचे रेखाटन त्रिमितीय आकृतींनी करणे सोयीचे नसते. म्हणून प्रक्षेपणाच्या रूपाने त्यांचे रेखाटन केले जाते ते समजण्यासाठी त्यासंबंधीचे संकेत माहीत असणे आवश्यक आहे.
प्रक्षेपण करताना कार्बन अणूच्या चतुःपृष्ठकाची एक बाजू आडवी (क्षितिजसमांतर) व आपणाकडे आहे आणि चतुःपृष्ठकाची दोन पृष्ठे आपणास दिसत आहेत, अशा तऱ्हेने चतुःपृष्ठक धरावा. कार्बन अणू या कागदाच्या पृष्ठभागी आहे असे मानले, तर या स्थितीत त्याच्या दोन संयुजा कागदाच्या पृष्ठभागापासून वर आपणाकडे येत आहेत आणि उरलेल्या दोन कागदाच्या पृष्ठभागाच्या खाली आपणापासून दूर जात आहेत (आ. ७ अ). अशा स्थितीतील संयुजांचे प्रक्षेपण आ. ७ (आ) मध्ये दाखविल्याप्रमाणे केले जाते. फुलीच्या मध्यभागी
कार्बन अणू आहे असा संकेत असल्यामुळे त्याचे अस्तित्व दाखवावे लागत नाही. या प्रक्षेपणासंबंधी असाही संकेत आहे की, कागदाच्या पातळीत तो फिरविला, तरी त्रिमितीय स्थिती बदलत नाही परंतु कागदाच्या पृष्ठाबाहेर काढून १८०° नी तो फिरविला, तर मूळच्या रेणूच्या प्रतिबिंबाचा प्रक्षेप होतो.
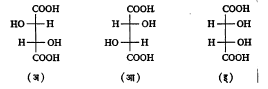
प्रक्षेपणरूपाने टार्टारिक अम्लाचे प्रकार सूत्र ६ मध्ये दाखविल्याप्रमाणे दर्शविता येतात.
कार्बनाचे प्रकाशीय समघटक : (समघटक म्हणजे रेणूतील अणूंचे प्रकार व संख्या तीच परंतु गुणधर्म वेगळे असलेले पदार्थ). हे समघटक दोन प्रकारचे असतात. पहिल्या प्रकारात संयुगांच्या संरचना सारख्या परंतु त्रिमितीय मांडणी किंवा विन्यास वेगळा म्हणजे एक विन्यास दुसऱ्याच्या आरशात पडलेल्या प्रतिबिंबासारखा असतो. या प्रकाशीय समघटकांचे प्रकाशीय वलन मूल्याने सारखे परंतु एकमेकांच्या विरुद्ध दिशेने असते. त्यांचे इतर भौतिक आणि रासायनिक गुणधर्म सारखे असतात. या प्रकाराला बिंब–प्रतिबिंबरूप समघटकता म्हणतात.
दुसऱ्या प्रकारच्या समघटकांच्याही विन्यासात फरक असतो परंतु तो बिंब–प्रतिबिंबरूप नसतो. अर्थातच त्यांची प्रकाशीय वलने समान अथवा भिन्न आणि त्यांच्या दिशाही समान किंवा एकमेकींच्या विरुद्ध असू शकतात. त्यांच्या भौतिक व रासायनिक गुणधर्मात भेद असतो. या प्रकाराला त्रिमितीय पारसमघटकता अशी संज्ञा आहे.
बिंब–प्रतिबिंबरूप समघटक : एक कार्बन अणू असममित असलेल्या अशा समघटकांचे एक ठळक उदाहरण म्हणजे लॅक्टिक अम्ल होय. याचा दक्षिण वलनी (+) प्रकार स्नायूपासून काढलेल्या रसात आढळतो व वामवलनी (–) प्रकार नासलेल्या दुधापासून वेगळा करता येतो.
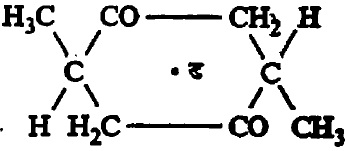
टार्टारिक अम्लामध्ये दोन असममित कार्बन अणू असून त्यांना जोडलेले अणू व मूलके समान आहेत. त्यामुळे या अम्लाचे एकंदर चार प्रकार आहेत. त्यांपैकी एक दक्षिण वलनी व एक वामवलनी हे दोन प्रकाशतः सक्रिय असून उरलेले दोन प्रकाशीय वलनरहित आहेत. या वलनरहित प्रकारांतील एक बहिःपूरित आहे. विभेदनाने त्यापासून (+) व (–) हे प्रकार वेगळे करता येतात. दुसरा प्रकार अंतःपूरित आहे. त्यामध्ये सूत्र ३ मध्ये दाखविल्याप्रमाणे रेणूचा खालचा अर्धा भाग व वरचा अर्धा भाग हे बिंब–प्रतिबिंबरूप आहेत.
दोन असममित व असमान अणू असलेल्या संयुगांत अंतःपूरित प्रकार संभवत नाही. त्यांचे चार प्रकाशीय वलनी मिळतात.
प्रकाशीय वलनी संयुगांची संख्या : संयुगामध्ये असणाऱ्या असममित व असमान कार्बन अणूंची संख्या n या चिन्हाने दर्शविली, तर संभाव्य प्रकाशीय वलनी संयुगांची संख्या २n इतकी होते. उदा., चार कार्बन अणू असममित व असमान असतील, तर २४ = १६ प्रकाशीय वलनी समघटक मिळतील. शर्करा वर्गात अशी संयुगे आढळतात.
प्रकाशतः सक्रिय वलयी संयुगे : असममित कार्बन अणू असलेली वलयी संयुगेही माहीत आहेत. त्यांच्या प्रकाशीय समघटकतेचे स्पष्टीकरण वरील तत्वांनुसार करता येते. उदा., एक अणू असममित असलेली (सूत्र ७). यांचे एकंदर तीन प्रकार (+), (–) व (±) होतात. त्यांपैकी दोन प्रकाशतः सक्रिय असतात.
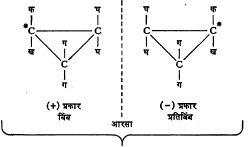
दोन असममित अणू असून ते समान असतील, तर (+), (–) , (±) व अंतःपूरित असे चार प्रकार संभवतात.
याप्रमाणे चार, पाच, सहा इ. कार्बन अणूंच्या स्वतंत्र किंवा एकमेकांस जोडलेल्या म्हणजेच संयुक्त वलयातही प्रकाशीय समघटकता अपेक्षेप्रमाणे दिसून येते.
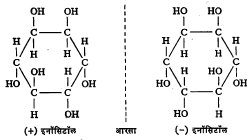
रेणवीय असममितता : (१) एखादे संयुग प्रकाशतः सक्रिय होण्यासाठी यामध्ये असममित अणूच असला पाहिजे असे नाही. जर तो रेणू असा असेल, की त्याचे प्रतिबिंब बिंबावर अध्यारोपित करता येत
नाही, तर त्यात असममित अणू नसला तरीही तो प्रकाशीय वलन दाखवितो. उदा., इनॉसिटॉल (सूत्र ९).
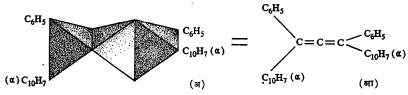
(२) तीन कार्बन अणू एकमेकांना द्विबंधाने जोडले गेले असून कडेच्या कार्बन अणूंना जर भिन्न मूलके जोडलेली असतील, तरीही रेणवीय असममितता निर्माण होऊन असे संयुग प्रकाशतः सक्रिय बनेल, असे भाकीत व्हांट हॉफ यांनी १८७४ मध्ये केले होते. त्या काळी अशी संयुगे ज्ञात नव्हती व त्यामुळे याचा प्रत्यय घेता आला नाही. १९३५ मध्ये डब्ल्यू. एच्. मिल्स व पी. मेटलंड यांनी असे एक संयुग डायफिनिलडाय –α–नॅप्थिल ॲलीन (आ.८) बनविले. ते अपेक्षेप्रमाणे प्रकाशीय वलनी आहे असे दिसून आले. अशा संयुगात पहिल्या व तिसऱ्या कार्बन अणूंच्या बंधाची प्रतले काटकोनात येतात.
(३) दोन कार्बन अणू जेव्हा एकमेकांना एका बंधाने जोडले गेलेले असतात तेव्हा त्या बंधाभोवती ते मुक्तपणे फिरू शकतात परंतु या भ्रमणास बाध आला, तर कार्बन अणू असममित नसूनही संयुग प्रकाशतः सक्रिय होऊ शकते. याची अनेक उदाहरणे बायफिनिल वर्गात आढळतात. उदा., २ : २′ कार्बॉक्सी ६′ नायट्रो बायफिनिल हे संयुग. येथे वलयांना जोडणाऱ्या, कार्बन अणूंच्या अगदी नजीक (ऑर्थो स्थानी) मोठ्या आकारमानाचे मूलक अथवा अणू उपस्थित असल्यामुळे मुक्त भ्रमणास अडथळा येतो आणि वलये भिन्न प्रतलांत राहतात (सूत्र १०).
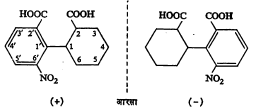
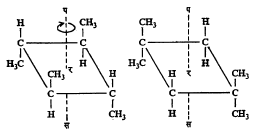
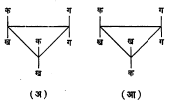
भूमितीय समघटकता : कार्बन अणू द्विबंधाने एकमेकांस जोडले गेले म्हणजे त्यांचे मुक्त भ्रमण अशक्य होते. या कार्बन अणूंना जोडलेले अणू अथवा मूलके एका प्रतलात येतात व त्यामुळे प्रकाशीय समघटकता संभवत नाही पण ह्यांपैकी दोन अणू अथवा मूलके जर भिन्न असतील, तर एक निराळ्या प्रकारची समघटकता निर्माण होते. तिला भूमितीय समघटकता म्हणतात. अशा संयुगांच्या ज्या दोन मांडण्या होतात त्यांपैकी एकीमध्ये दुसऱ्या मांडणीच्या मानाने समान मूलके एकमेकांच्या जास्त जवळ असतात. अशा मांडणीला समपक्ष रूप व दुसरीला विपक्ष म्हणतात (आ. ९).
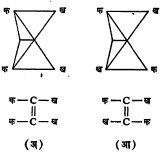
मॅलेइक अम्ल (समपक्ष रूप) व फ्यूमेरिक अम्ल (विपक्ष रूप) ही अशा समघटकतेची प्रसिद्ध उदाहरणे आहेत (सूत्र ११).
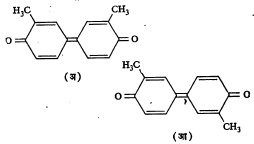
डायमिथिल डायफिनोक्विनोन या वलयी संयुगांत अशीच समघटकता आहे. (सूत्र १२).
नायट्रोजन अणूच्या संयुजा कार्बन अणूप्रमाणेच चतु:पृष्ठकाच्या तीन कोनांच्या दिशेने कार्यान्वित असतात व इलेक्ट्रॉनांची जोडी चौथ्या कोनाशी अधिष्ठित असते. त्यामुळे नायट्रोजनाच्या अणूची त्रिमितीय मांडणी होऊ शकते व नायट्रोजन अणू एखाद्या संयुगात द्विबंधांनी जोडलेला असेल, तर त्याच्या संयुगाचेही भूमितीय समघटक संभवतात.
याची उदाहरणे म्हणजे आल्डिहाइडे आणि कीटोने यांपासून

हायड्रॉक्सिल अमाइनाच्या विक्रियेने बनणारी ऑक्झाइमे होत (सूत्र १३).
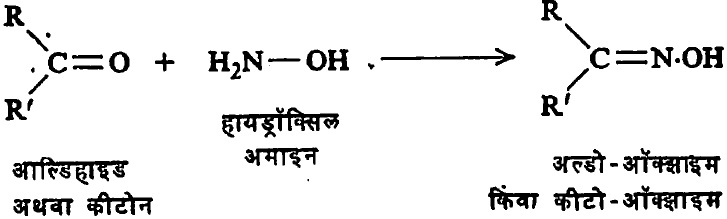
येथे R, R′ = अल्किल मूलक असले म्हणजे कीटो-ऑक्झाइम बनते R′= H असला म्हणजे अल्डो–ऑक्झाइन होते.
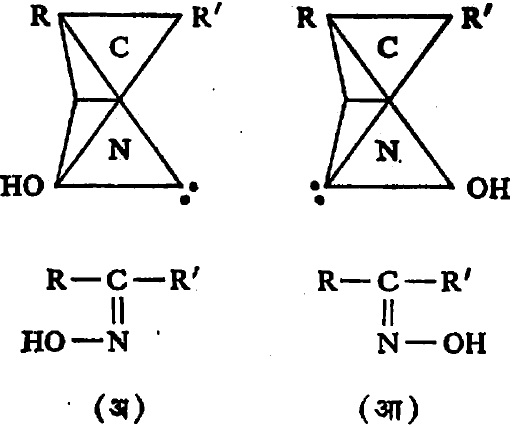
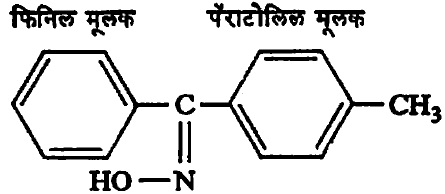
या संज्ञा वापरतात. आ. १० मधील (अ) हे पैलस्थ–अल्डो–ऑक्झाइम आणि (आ) हे ऐलस्थ–अल्डो–ऑक्झाइम आहे. कीटो–ऑक्झाइम असेल, तर त्यातील हायड्रॉक्सी मूलक ज्या मूलकाच्या समीप येत असेल त्याचा उल्लेख ऐलस्थ या पदानंतर करावा लागतो उदा., ऐलस्थफिनिलपॅराटोलिल कीटो–ऑक्झाइम (सूत्र १४).
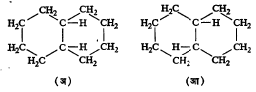
कार्बनाच्या वलयी संयुगातही (द्विबंध नसला तरी वलयी रचनेमुळे मुक्त भ्रमण अशक्य झाल्यामुळे) अशा तऱ्हेची समघटकता आढळते.
उदा., सूत्र १५ मधील (अ) हे समपक्ष व (आ) हे विपक्ष रूप आहे. १, ३–डायक्लोरोहेक्झेनाचे समघटक हे अशा तऱ्हेचे एक उदाहरण आहे.

दोन वलये एकमेकांस जोडली गेल्यामुळे जेथे मांडणीस दृढता आली आहे अशा संयुगांत (सूत्र १७ मधील अ आणि आ) आणि वलयात असलेली मूलके मुक्त वलनास बाध आणतात अशा संयुगांत (सूत्र १८ मधील अ आणि आ) समपक्ष व विपक्ष रूपे संभवतात.
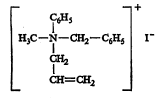
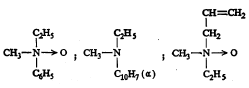
नायट्रोजनाचे त्रिमितीय रसायनशास्त्र : नायट्रोजनाच्या संयुजा व इलेक्ट्रॉनांची एक जोडी यांची मांडणी कार्बन अणूच्या संयुजांसारखी असल्यामुळे ॲलिल–मिथिल–फिनिल–बेंझिल–आयोडाइड (सूत्र १९) हे संयुग प्रकाशीय वलनक्षम आहे. याची (+) व (–) रूपे डब्ल्यू. जे. पोप व एस्. जे. पीची यांनी १८९९ मध्ये विभेदनाने वेगळी केली. त्याचप्रमाणे सूत्र २० मध्ये दाखविलेल्या अमाइन ऑक्साइडांची रूपेही प्रकाशतः सक्रिय असल्याचे दिसून आले आहे.
ॲझोबेंझीन, ॲझॉक्सिबेंझीन इ. द्विबंध असलेल्या नायट्रोजन संयुगांत
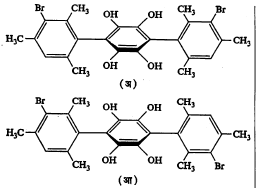
समपक्ष–विपक्ष प्रकारची समघटकता आढळते (सूत्रे २१ आणि २२). यांचे नामकरण समपक्ष याऐवजी ऐलस्थ व विपक्ष याऐवजी पैलस्थ असेही करतात.

गंधकाचे त्रिमितीय रसायनशास्त्र : गंधक अणूच्या संयुजाही चतुःपृष्ठीय असल्यामुळे गंधकाची संयुगे प्रकाशतः सक्रिय असणे शक्य आहे. प्रत्यक्षात मिथिल–एथिल–कार्बॉक्सिमिथिल–सल्फोनियम ब्रोमाइड व कित्येक सल्फॉक्साइडे, डायसल्फाइडे इ. संयुगे प्रकाशीय वलनी रूपात वेगळी केली गेली आहेत (सूत्र २३).
फॉस्फरसाची त्रिमितीय संयुगे : तीन वेगवेगळे अणू अथवा गट असलेली फॉस्फोनियम ऑक्साइड वर्गाची संयुगे प्रकाशतः सक्रिय

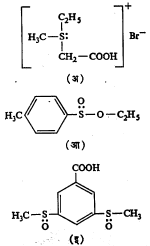
रूपात असणे शक्य आहे व प्रत्यक्ष अनुभवानेही हे सिद्ध झाले आहे. उदाहरणादाखल अशी काही संयुगे सूत्र २४ मध्ये दाखविली आहेत.
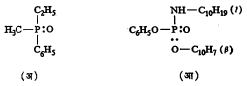
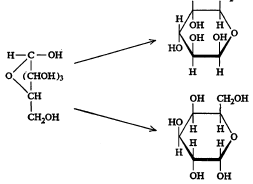
कार्बोहायड्रेटे : या वर्गात असममित व असमान असे अनेक कार्बन अणू असलेली संयुगे आहेत. त्याचप्रमाणे एक ऑक्सिजन अणू असलेली कार्बन वलयी संयुगेही आहेत आणि अशी वलये विशिष्ट पद्धतींनी जोडून झालेले रेणूही आहेत. या संयुगांतील H व OH यांचे मांडणीप्रकार, ऑक्सिजन अणूची सापेक्ष मांडणी इत्यादींची संगती त्रिमितीय रसायनशास्त्राच्या तत्त्वांनुसार लावण्यात आलेली आहे. उदा., ग्लुकोज (सूत्र २५).
इतर मूलद्रव्ये : सिलिनियम, टेल्यूरियम, जर्मेनियम, आर्सेनिक, सिलिकॉन, बोरॉन, प्लॅटिनम, निकेल, पॅलॅडियम यांच्या संयुगांच्याही त्रिमितीय मांडण्या होतात आणि ती प्रकाशतः सक्रिय समघटकता व भूमितीय समघटकता दाखवितात.
संदर्भ : 1. Eliel, E. L. Stereochemistry of carbon Compounds, New York, 1962.
2. Fieser, L. F. Fieser, M. Advanced Organic Chemistry, New Delhi, 1960.
3. Gilman, H. Organic Chemistry–An Advanced Treatise, Vol. I, New York, 1937.
4. Wheland, G. W. Advanced Organic Chemistry, New York, 1960.
केळकर, गो. रा.
“