समघटकता : रासायनिक संघटन आणि रेणुभार सारखेच असलेल्या परंतु भौतिक व रासायनिक गुणधर्म वेगवेगळे असलेल्या दोन किंवा अधिक पदार्थांचा संच असू शकतो. अशा संचातील वेगवेगळ्या पदार्थांना एकमेकांचे समघटक म्हणतात. रेणूमधील अणूंच्या मांडणीमधील फरकांमुळे समघटकांच्या गुणधर्मांमध्ये फरक घडू शकतात, असे आता सर्वमान्य झाले आहे. १८३० मध्ये स्वीडिश रसायनशास्त्रज्ञ ⇨यन्स याकॉप बर्झीलियस यांनी समघटकता ( आयसोमेरिझम ) ही सैद्धांतिक संकल्पना प्रथम मांडली. कार्बनाच्या वैशिष्टयामुळे कार्बनी रसायनशास्त्रातच समघटकतेचा आविष्कार प्रकर्षाने आढळतो. अकार्बनी रसायनशास्त्रात समघटकता मर्यादित प्रमाणात आढळते.
समघटकतेचे पुढील दोन मुख्य प्रकार आहेत : (१) संरचना समघटकता आणि (२) त्रिमितीय समघटकता. अणू एकमेकांस वेगवेगळ्या तऱ्हेने जोडले गेल्यामुळे जी समघटकता निर्माण होते, तिला संरचना समघटकता असे म्हणतात. संरचना सारखीच पण अवकाशात अणूंची मांडणी भिन्न तऱ्हेने झाल्यामुळे निर्माण होणारी समघटकता म्हणजे त्रिमितीय सम-घटकता होय. चलसमघटकता हाही संरचना समघटकतेचा एक प्रकार आहे. मराठी विश्वकोशा त त्रिमितीय समघटकतेविषयीची माहिती ‘ त्रिमितीय रसायनशास्त्र ’ या नोंदीत दिलेली आहे.
संरचना समघटकतेचे कार्बनी रसायनशास्त्रात पुढीलप्रमाणे तीन विभाग करता येतात : (१) सांगाडा समघटकता, (२) स्थान समघटकता आणि (३) कियाशील गट समघटकता. चलसमघटकतेचा समावेश यामध्येच होतो. अकार्बनी रसायनशास्त्रात आयनीभवन, सहसंबद्धता, बंधक, अनुबंधन, भूमितीय आणि प्रकाशीय अशा प्रकारच्या समघटकता आढळतात.
सांगाडा समघटकता : कार्बनाचे अनेक अणू एकमेकांस जोडले जाऊन कमीजास्त लांबीच्या साखळ्या बनतात किंवा साखळीची टोके जोडल्यामुळे लहान मोठी वलये तयार होतात. यात साखळ्या अथवा वलये वेगवेगळ्या तऱ्हेची असू शकतात आणि त्यामुळे ही समघटकता निर्माण होते. उदा., C4H10 या रेणुसूत्राचे दोन समघटक माहीत आहेत. ते त्यांच्या सांगाडयतील फरकामुळे होत.
H3C CH2CH2CH3 आणि H3C – CH – CH3
सूत्र क. १ CH3
सूत्र क्र. २.
संरचना सूत्र क. १ मध्ये चारी कार्बन अणू एकमेकांस सरळ जोडले आहेत, तर क. २ मध्ये दुसऱ्या कार्बन अणूपासून एक शाखा निघालेली आहे. या संरचनाभेदामुळे ही दोन संयुगे झाली आहेत.
C4H8या रेणु सूत्राचे दोन सांगाडा समघटक पुढील प्रमाणे होतात.

संरचना सूत्र क. ३ मध्ये त्रिकार्बनी वलय आहे आणि क. ४ मध्ये चारकार्बनी वलय आहे.
संयुगातील कार्बन अणूंची संख्या वाढली म्हणजे समघटकांची संख्या झपाटयने वाढते. हायड्रोकार्बनाच्या पॅराफिन श्रेणीमधील पहिल्या तीन घटकांना ( CH4 , C2H6 आणि C3 H8 ) समघटक नाहीत. C4 H10 याचे दोन व C5 H12 याचे तीन समघटक आहेत. त्यानंतर घटकांच्या अनेक समघटकांची संख्या जलदपणे वाढत राहते. उदा., उ C10 H22 या रेणुसूत्राचे ७५,C15H32 याचे ४,३४७ व C20H42 याचे ३,६६,३१९ इतके सांगाडा समघटक संभवतात. C20H42 या घटकामधील एका हायड्रोजनाचे क्लोरिनाने प्रतिष्ठापन झाल्यास C20H41Cl याचे ५० लाखाहून अधिक समघटक असू शकतात.
स्थान समघटकता : कित्येक कार्बनी संयुगांत क्लोरीन, ब्रोमीन इत्यादींचे एक अथवा अधिक अणू किंवा – OH, – COOH, – NO2 इ. क्रियाशील अणुसमूह अथवा गट कार्बन साखळ्यांना किंवा वलयांना जोडलेले असतात. त्याचप्रमाणे काही संयुगांत एक अथवा अधिक द्विबंध किंवा त्रिबंध यांचे अस्तित्व असते. एकाच रेणुसूत्राच्या संयुगांत या अणूंची, गटांची अथवा द्विबंध किंवा त्रिबंध याची स्थाने भिन्न असली म्हणजे समघटकता निर्माण होते. उदा., C3H३8 O या रेणुसूत्राचे-OH गटाच्या स्थानपरत्वे दोन समघटक माहीत आहेत.
H3C – CH2 – CH2 –OH आणिH3C – CH– CH3
सूत्र क्र. ५. |
OH
सूत्र क्र. ६.
संरचना सूत्र क्र. ५ मध्ये – OH गट कार्बन क्रमांक ३ ला (किंवा उजव्या बाजूने मोजल्यास क्रमांक १ ला) जोडलेला आहे आणि सूत्र क्र. ६ मध्ये तो कार्बन क्रमांक २ ला जोडलेला आहे. या तत्त्वाप्रमाणे C5H12ज या रेणुसूत्रामध्ये कार्बन अणू एकमेकांस जोडलेले असल्यास – OH गटाच्या स्थानपरत्वे तीन समघटक दाखविता येतात परंतु पाच कार्बन अणूंच्या दोन सशाख साखळ्या होऊ शकत असल्यामुळे -जक गटाच्या स्थानपरत्वे आणखी पाच समघटक दाखविता येतात.[à अलिफॅटिक संयुगें ].
कीटोन नामक विशिष्ट गुणधर्माच्या संयुगांत – CO – हा गट असतो. C5H10O या रेणुसूत्रात – CO – चे स्थान बदलल्याने होणारी समघटकता पुढील संरचनांनी दाखविली आहे. [à कीटोने].
H3C – CO – CH2 – CH2 – CH3 H3C – CH2 – CO – CH2- CH3
सूत्र क्र. ७मिथिल n-प्रोपिल कीटोन सूत्र क्र. ८ डायएथिल कीटोन
|
H3 C- |
CO- |
CH |
/ |
CH3 CH3 |
सूत्र क्र. ९. मिथिल आयसोप्रोपिल कीटोन
-COOH या गटामुळे कार्बनी अम्ले सिद्ध होतात. C4H8O2या रेणुसूत्राचे -COOH याच्या स्थानभिन्नत्वामुळे होणारे समघटक पुढीलप्रमाणे आहेत.
H3C – CH2– CH2– COOH H3C – CH – CH3
।
COOH
सूत्र क्र. १०. n-ब्युटिरिक अम्ल सूत्र क्र.११. आयसोब्युटिरिक अम्ल
वलयी संयुगांमध्ये आढळणारी समघटकता खालील उदाहरणावरून स्पष्ट होईल. C10H8O या रेणुसूत्राची नॅप्थॉल नामक दोन संयुगे आहेत.
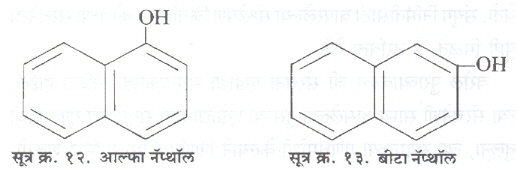
याच वलयांमध्ये दोन-OH गट समाविष्ट केले, तर दहा समघटक निर्माण होतात.
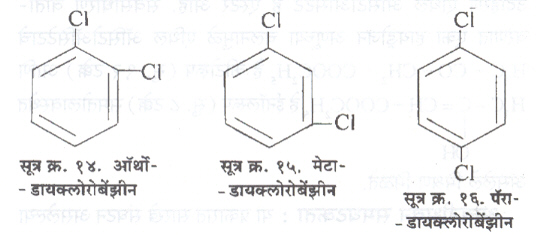
बेंझीन वलयात दोन हायड्रोजनांऐवजी दोन क्लोरीन अणू बसविले, तर तीन स्थान समघटक निर्माण होतात.
द्विबंधांच्या स्थानभिन्नत्वाने होणाऱ्या समघटकतेची कल्पना पुढील संरचनांवरून येईल. C4H8 या रेणुसूत्राचे एक द्विबंध असलेले तीन समघटक होतात.
H2C = CH-CH2-CH3 CH3-CH=CH-CH3
सूत्र क्र. १७. सूत्र क्र. १८.
|
H3C H3C |
/ |
C |
= |
CH2 |
सूत्र क्र. १९.
C5H8 या रेणुसूत्राच्या दोन द्विबंध असलेल्या स्थान समघटकांच्या संरचना पुढीलप्रमाणे आहेत.
H2C=CH-CH2-CH=CH2 H2C=CH-CH=CH-CH3
सूत्र क्र. २०. सूत्र क्र. २१.
H3 C – C – CH = CH2
। ।
CH2
सूत्र क्र. २२.
क्रियाशील गट समघटकता : C2H6O या रेणुसूत्राचे पुढील दोन समघटक अस्तित्वात आहेत : एथिल अल्कोहॉल (CH-CH2-OH) आणि मिथिल ईथर (CH3-O-CH3). वातावरणीय दाबाला एथिल अल्कोहॉल द्रवरूप असून त्याचा उकळबिंदू ७८° से. असतो. हायड्राआयोडिक अम्लाबरोबर विक्रिया झाल्यास त्याचे एथिल आयोडाइडामध्ये रूपांतर होते. मिथिल ईथर वायुरूप असून ते -२४° से. तापमानाला द्रवरूप बनते. हायड्राआयोडिक अम्लाबरोबर विक्रिया झाल्यास त्याचे मिथिल आयोडाइडामध्ये रूपांतर होते. म्हणून एकामध्ये क्रियाशील गट – OH म्हणजे अल्कोहॉलाचा आहे, तर दुसऱ्यात तो – O – म्हणजे ईथरचा आहे. संतृप्त अल्कोहॉल वर्गातील एखादे संयुग आणि त्याच्याइतकेच कार्बन अणू असलेले ईथर वर्गातील संयुग यांमध्ये अशी समघटकता असते.
एस्टर वर्गातील संयुगांची समघटकता जास्त विविध असते. उदा., C4H8O2या रेणुसूत्राचे एस्टर दुसऱ्या एखादया अम्लाच्या किंवा दुसऱ्या अल्कोहॉलाच्या एस्टराचा समघटक होतो तसेच चार कार्बनी अम्ले व द्विबंधी चार कार्बनी डायॉल यांचाही समघटक होतो.
कीटोन वर्गातील संयुगे, तितकेच कार्बन अणू असलेल्या आल्डिहाइडाचे समघटक होऊ शकतात. उदा., H3C–CO-CH3हा कीटोन CH3-CH2-CHO या आल्डिहाइडाचा समघटक आहे.
चलसमघटकता : जे सांरचनिक समघटक एकमेकांत लगेच बदलू शकतात त्यांना चलसमघटक असे म्हणतात. यांमध्ये एखादा अणू किंवा अणुगट चल असतो व तो स्थाने बदलतो, त्यामुळे दोन किंवा अधिक क्रियाशील समघटकी रूपे समतोलावस्थेत राहतात. याचे वैशिष्टयपूर्ण उदाहरण एथिल असिटोअसिटेट हे एस्टर आहे. सर्वसाधारण वातावरणात एका हायड्रोजन अणूच्या चलनामुळे एथिल असिटोअसिटेटाचे
H3C – CO-CH2– COOC2H5 हे कीटोरूप (सु. ९२ टक्के) आणि H3C – C = CH – COOC2H5 हे ईनॉलरूप
(सु. ८ टक्के) समतोलावस्थेत
।
OH
असलेले मिश्रण मिळते.
आयनीभवन समघटकता : या प्रकारात सारखे संघटन असलेल्या संयुगापासून आयनीभवनाने भिन्न आयन (विद्युत् भारित अणू , रेणू किंवा अणुगट) तयार होतात. उदा., [Co(NH3)5Br]SO4या संयुगात
ब्रोमीन आयन (Br– ) कोबाल्टाशी (Co) सहसंबद्ध आहे तर [Co(NH3)5(SO4) ]Br या त्याच संघटनेच्या जटिलात सल्फेट (SO4 2–) आयन कोबाल्टाशी सहसंबद्ध आहे. त्यामुळे आयनीभवनाने पहिल्यापासून (SO4 2–) आयन आणि दुसऱ्यापासून Br– आयन निर्माण होतात.
सहसंबद्धता समघटकता : [Co(NH3)6] [Cr(CN)6] आणि [Cr(NH3)6] [Co(CN)6] या जटिलांमध्ये सहसंबद्ध झालेल्या बंधकात धातूच्या अणूंची अदलाबदल झालेली आहे आणि त्यामुळे समघटकता घडून आली आहे.
बंधक समघटकता : बंधकाच्या संरचनेत फरक असल्यामुळे ही समघटकता निर्माण होते. उदा.,
[Pt(NH2-CH2-CH2-CH2-NH2)2]2+ आणि[Pt(NH2-CH-CH2-NH2)2]2+
।
CH3
या बंधकांनी निर्माण होणारी जटिल संयुगे.
अनुबंधन समघटकता : जेथे एखादया बंधकातील वेगवेगळ्या अणूंमुळे सहसंबद्घबंध निर्माण झाला असेल,तेथे ही समघटकता घडून येते. उदा., [Co(NH3)5(NO2)]2+आणि[Co(NH3)5 (ONO)]2+ यांमधील पहिल्या बंधकातील NO2– मुळे व दुसऱ्यातील जछजम मुळे सहसंबद्ध बंध निर्माण झाला आहे आणि समघटकता झाली आहे.
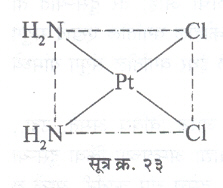
भूमितीय समघटकता : या प्रकारात बंधकांचे वितरण अवकशात वेगवेगळ्या प्रकारे झालेले असते. उदा.,
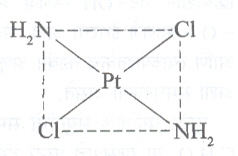
सूत्र क्र. २३ या जटिलामध्ये दोन NH2 व Cl एकमेकांशेजारी व सूत्र क्र. २४ मध्ये ते एकमेकांसमोर आहेत आणि त्यामुळे समघटकता आली आहे. अशा समघटकांना अनुकरमे समपक्ष (सिस) व विपक्ष (ट्रान्स) रूप समघटक म्हणतात.
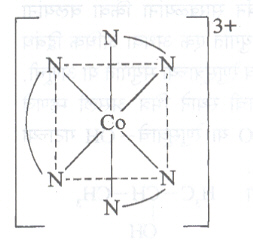
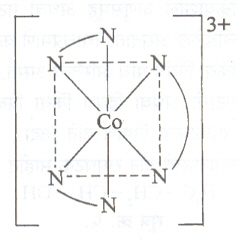
प्रकाशीय समघटकता : ज्या वेळी संयुगाचे बिंब आणि प्रतिबिंब एकमेकांवर अध्यारोपित करता येत नाहीत, तेव्हा अशी समघटकता संभवते. जटिल संयुगामध्ये जर असममित बंधक असेल, अथवा बंधकांची जटिल संयुगातील संरचना असममित असेल, तर प्रकाशीय समघटकता संभवते. उदा., एथिलीन डायअमाइनासारखी तीन बंधक संरचनेत असलेली अष्टफलकीय कोबाल्ट जटिले. येथे एथिलीन डायअमाइन बंधके दोन नायट्रोजन अणू व त्यांना जोडलेली वक्र रेषा यांनी दाखविली आहेत.
संभाव्य समघटक संख्या : प्रत्येक संयुगाला निश्चित संरचना असते. ती बदलली तर संयुगाचे गुणधर्म बदलतात व नवे संयुग बनते. संरचना सिद्धांतानुसार जेवढया वेगवेगळ्या संरचना मांडता येतील तेवढी समघटकी संयुगे असली पाहिजेत आणि जेवढे समघटक माहीत असतील तेवढया वेगवेगळ्या संरचना असल्या पाहिजेत, हे नियम अबाधित आहेत. त्यामध्ये कधीकधी विसंगती वाटते परंतु तिचे निराकरण खालीलप्रमाणे करता येते.
जेवढया संरचना तत्त्वत: शक्य आहेत, तितकी सर्व संयुगे माहीत नसतील, तर त्यांचे कारण एक तर ती सर्व बनविण्याची आवश्यकता नसेल किंवा दुसरे म्हणजे ती संयुगे बनविण्यास लागणाऱ्या संश्लेषण पद्धती अजून उपलब्ध नसतील.
काही विशिष्ट संरचनेचे संयुग अस्थिर असल्यामुळे त्याचे रूपांतर आपोआप स्थिर संरचनेच्या संयुगात होते व त्यामुळे मूळ संरचनेचे संयुग वेगळे काढता येत नाही ते बनत नाही असे नव्हे. उदा., CH2=CHOH या अल्कोहॉलाचे रूपांतर CH3CHO मध्ये त्वरेने होते त्यामुळे संश्लेषणाने ते अल्कोहॉल मिळविता येत नाही.
काही संरचनांमध्ये संयुजा बंधावर वाजवीपेक्षा फार जास्त ताण पडतो, त्यामुळे अशा संरचना अतिशय अस्थिर असतात. एकच संरचना असून गुणधर्म वेगळे असल्याची जी उदाहरणे आढळतात त्यांत अणूंची अवक्राशातील त्रिमितीय मांडणी वेगवेगळी असते. एकच संयुग वेगवेगळ्या संरचना असल्याप्रमाणे गुणधर्म दाखविते, त्याचे कारण चलसमघटकता हे असते.
संरचना निश्चिती : संरचना सिद्धांताप्रमाणे कोणकोणत्या संरचना, एखादया रेणुसूत्राच्या बाबतीत, संभाव्य आहेत हे ठरविल्यावर कोणती संरचना कोणत्या ज्ञात संयुगाला दयावी हे निश्चित करणे आवश्यक असते. त्याकरिता संयुगाच्या रासायनिक क्रियांचा अभ्यास करून त्या कोणत्या संरचनेशी सुसंगत आहेत ते पाहून त्याच्या संरचनेविषयी अंदाज करता येतो. संयुग निर्मितीसाठी वापरलेल्या संश्लेषण क्रियांवरून कोणत्या संरचनेला पुष्टी मिळते, हे ठरविता येते.
वरील पुराव्यावरून जी संरचना एखादया संयुगाकरिता निश्चित होईल, त्या संरचनेशी साम्य असलेल्या दुसऱ्या एखादया ज्ञात संयुगाच्या गुणधर्मांची तुलना, त्या संयुगाच्या गुणधर्मांशी केल्याने निर्णायक पुरावा मिळू शकतो.
संयुगाच्या अवरक्त वर्णपटावरून त्यामध्ये असलेले कार्बानिल (-CO-), हायड्रॉक्सी(OH) गट व वेगवेगळ्या तऱ्हेचे द्विबंध इत्यादींची माहिती सुलभतेने मिळते. जंबुपार वर्णपटावरून संयुगात एकाआड एक द्विबंध आहेत किंवा काय ते कळू शकते. याशिवाय रेणवीय प्रणमन, प्रकाशीय परिवलन व प्रकाशीय परिवलनात्मक अपस्करण या भोतिकी गुणधर्मांचा उपयोग संरचनानिश्चितीकरिता होतो. अणुकेंद्रीय चुंबकीय अनुस्पंदन वर्णपटाच्या साहाय्याने संयुगात असलेले मिथिल गट, द्विबंध इत्यादींचे अस्तित्व, संख्या व स्थाने निश्चित करणे शक्य होते आणि त्यामुळे पर्यायी संरचनांमधून योग्य त्या संरचनेची निवड करणे सोपे जाते.
कार्बन अणूच्या संयुजा एकाच पातळीत नाहीत. एकबंधाने जोडले गेलेले कार्बन अणू सामान्यत: त्या बंधासभोवती फिरू शकतात. काही विशेष परिस्थितीत जेव्हा या मुक्त परिवलनास व्यत्यय येतो अशा वेळी आणि वलयीभवनामुळे किंवा द्विबंधांमुळे जेव्हा परिवलन अशक्य होते त्यावेळी भिन्न त्रिमितीय संरचना संभवतात व समघटकता निर्माण होते.या समघटकता प्रकाराचा विचार ⇨ त्रिमितीय रसायनशास्त्रा त केला जातो.
एका समघटकाचे दुसऱ्यात रूपांतर करण्याच्या क्रियेस समघटकीकरण असे म्हणतात. खनिज तेल उत्पादनांत आणि प्लॅस्टिक किंवा कृत्रिम रबर निर्मितीत विशिष्ट क्रियांच्या योगाने अशाख हायड्रोकार्बनांचे सशाख हायड्रोकार्बनांत रूपांतर केले जाते. औदयोगिक दृष्टया या क्रियेला फार महत्त्व आहे.
पहा : त्रिमितीय रसायनशास्त्र प्रकाशरसायनशास्त्र रासायनिक संरचना समघटकीकरण.
केळकर, गो. रा.