लॅक्टिक अम्ल : एक कार्बनी अम्ल. याला आल्फा हायड्रॉक्सी प्रोपिऑनिक अम्ल असेही म्हणतात. याची संरचना (H3C-CH(OH)-COOH) अशी दर्शविली जाते. दही व ताक या दुधापासून मिळणाऱ्या पदार्थात त्याचप्रमाणे प्राण्यांच्या रक्तात, मांसल ऊतकात (समान रचना व कार्य असलेल्या पेशींच्या समूहात) व काही वनस्पतींच्या रसामध्ये हे आढळते. दह्यात किंवा ताकात हे असते असे कार्ल शेले यांनी १७८० साली प्रथम दाखवून दिले. दुधातील लॅक्टोज या शर्करेच्या किण्वनाने (आंबवण्याच्या क्रियेने) ते तयार होते हे नंतर कळून आले.
गुणधर्म : हे अम्ल पाण्यात व जलमिश्रणीय विद्रावकात (विरघळविणाऱ्या द्रव्यात) अतिशय त्वरित विरघळते. सर्वसाधारण कार्बनी विद्रावकात हे अविद्राव्य (न विरघळणारे) आहे. याची प्रकाशीय वलनक्षम [धुवित प्रकाशाचे कंपन प्रतल विशिष्ट कोनातून फिरविण्याची क्षमता असलेली ⟶ ध्रुवणमिति] अशी दोन रूपे असून ती वेगळी करण्यास कठीण, कमी तापमानास विरघळणारी व जलशोषक असतात. या कारणांमुळे लॅक्टिक अम्लाचा अभ्यास करणे सुरुवातीस फार कठीण गेले. तथापि नंतर त्याची वलनक्षम रूपे व त्याचे बरेच अनुजात (त्यापासून बनणारी इतर संयुगे) शुद्ध रूपात तयार करणे व त्यांचा सखोल अभ्यास करणे शक्य झाले.
या अम्लात एक कार्बन अणू असममित असल्यामुळे प्रकाशीय वलनाच्या दृष्टीने ते तीन रूपांत असते : (१) दक्षिणवलनी (कंपन प्रतल घड्याळाच्या काट्यांच्या विरुद्ध दिशेने फिरविणारे) व (२) वामवलनी (कंपन प्रतल घड्याळाच्या काट्यांच्या विरुद्ध दिशेने फिरविणारे)व (३) वलन नसलेले ही ती होत. त्रिमितीय आकृतिरूपाने ती सूत्र १ व २ प्रमाणे दाखविता येतात.

वलन नसलेले तिसरे रूप हे दोहोंचे मिश्रण असते. या मिश्रणातील दक्षिणवलनी रूपाचे वलन वामवलनी रूपाने नाहीसे केलेले असते, म्हणून याला बहिःपूरित रूप असेही म्हणतात.
रक्तात आढळणारे अम्ल दक्षिणवलनी आणि काही सूक्ष्मजीवांच्या किण्वन क्रियेमुळे दुधापासून तयार झालेले अम्ल वामवलनी रूपात आढळते. कोणत्याही रूपात ते जलशोषक असल्यामुळे पाकासारखे आढळते. तथापि विशिष्ट पद्धतीने स्फटिकीकरण करून ते शुद्ध रूपात मिळविता येते. त्याचा वितळबिंदू १८°सें. आहे व उकळबिंदू १५ मिमी. दाबाखाली १२२° से. आहे. २५° से. तापमानाला त्याचे विशिष्ट गुरुत्व १.२९४ असून ते पाण्यात व जलमिश्रणीय कार्बनी विद्रावकांत (अल्कोहॉल, ॲसिटोन इ.) विरघळते. ईथरमध्ये ते अविद्राव्य आहे. २०% किंवा त्यापेक्षा विरल जलीय विद्रावात ते एकवारिकाच्या (साध्या रेणूच्या) रूपात म्हणजे CH3.CH(OH).COOH या रूपात असते. जास्त संहतीच्या (विरघळलेल्या पदार्थाचे प्रमाण जास्त असलेल्या) विद्रावात अम्लातील OH व COOH या गटांच्या रासायनिक संयोगाने बनलेल्या स्वयं-एस्टरीकरणामुळे निरनिराळ्या लांबीच्या मालिका असलेली बहुवारिक (अनेक साध्या रेणूंच्या संयोगाने बनलेली) पॉलिलॅक्टिक अम्ले अस्तित्वात असतात. बाष्पीभवन केले असताही आंतर-रेणवीय एस्टरीकरणाने पॉलिएस्टरे तयार होतात. उदा., दोन रेणूंपासून बनलेले द्विवारिक एस्टर याला लॅक्टिल-लॅक्टिक अम्ल म्हणतात.
CH3.CH(OH).COOH + CH3.CH(OH).COOH
=CH3.CH(OH).COO.CHCH3.COOH+H2O
लॅक्टिल–लॅक्टिक अम्ल.
सूत्र ३. लॅक्टिक अम्लाच्या दोन रेणूंपासून बनणारे द्विवारिक एस्टर
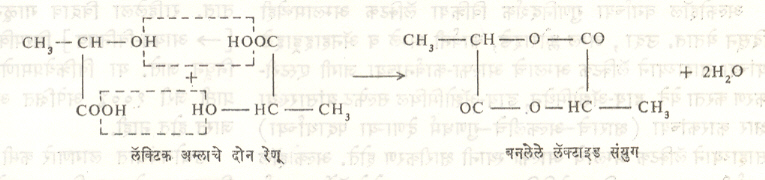
लॅक्टिक अम्ल तापविले असताही त्याच्या दोन रेणूंमध्ये वेगळ्या प्रकारे रासायनिक विक्रिया होते व सूत्र ४ प्रमाणे लॅक्टाइड बनते.
लॅक्टिक अम्लाच्या जलीय विद्रावाचे जसजसे संहतीकरण होत जाते (संहती वाढत जाते) तसतशी पॉलिलॅक्टिक अम्ले तयार होतात. ती त्रिवारिक, चतुर्वारिक इ. बहुवारिक रूपांत असतात. त्यांच्या संरचना सूत्र ५ मधील सामान्य सूत्राने दाखविता येतात.
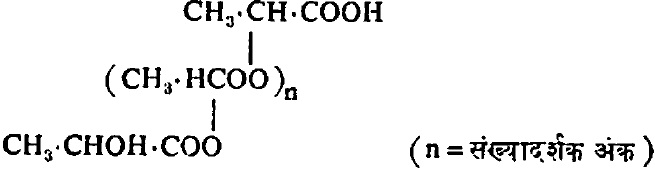
पॉलिलॅक्टिक अम्लामधील निरनिराळ्या घटकांमध्ये समतोल निर्माण होण्यास बराच वेळ लागतो पण अम्ल गुण नसलेले द्विवारिक म्हणजेच लॅक्टाइक जास्त प्रमाणात तयार होऊ शकते. अतिशय उच्च निर्वातात लॅक्टिक अम्लाचे निर्जलीकरण करताना किंवा कमी दाबाखाली उच्च तापमानाला त्याचे ऊर्ध्वपातन (उष्णतेने तयार झालेले बाष्प थंड करून घटक अलग करण्याची क्रिया) करतानाही लॅक्टाइड तयार होते.
लॅक्टिक अम्लाची बहुतेक सर्व लवणे जलविद्राव्य आहेत. अम्लीय उत्प्रेरकाच्या (विक्रियेचा वेग बदलणाऱ्या पदार्थाच्या) उपस्थितीत निरनिराळ्या अल्कोहॉलांबरोबर⇨एस्टरीकरण होऊन निरनिराळी लॅक्टिक एस्टरे तसेच काही पॉलिलॅक्टिक अम्लांचीही एस्टरे होतात. अल्कोहॉल जास्त प्रमाणात वापरल्यास पॉलिलॅक्टिक एस्टरे कमी प्रमाणात मिळतात. एस्टरांपासून पुनः लॅक्टिक अम्ल तयार करता येते. लॅक्टिक अम्ल, लॅक्टिक एस्टर किंवा लॅक्टिक अम्लाचे अनुजात तापविले असता त्याचे अपघटन (घटक अलग होण्याची क्रिया) होते. एस्टरापासून ॲसिटाल्डिहाइड (CH3.CHO), कार्बन (CO) व अनुरूप अल्कोहॉल (ROH) मिळतात.
खनिज अम्ल उत्प्रेरकाच्या उपस्थितीत व कमी तापमानाला लॅक्टिक एस्टरांचे स्वयं-अल्कोहॉली विच्छेदन (अल्कोहॉलाच्या विक्रियेने स्वयं-अपघटन होण्याची क्रिया) होऊन पॉलिलॅक्टिक अम्लाची एस्टरे मिळतात. ग्लायकॉलिक अम्लाचे एस्टर वगळल्यास इतर⇨वसाम्लाच्या एस्टरांच्या मानाने लॅक्टिक एस्टराचे जलीय विच्छेदन (पाण्याच्या विक्रियेने अपघटन होण्याची क्रिया) त्वरित होते, तथापि तुलनात्मक दृष्ट्या द्वितीय अल्कोहॉलाच्या लॅक्टेटाचे जलीय विच्छेदन प्राथमिक अल्कोहॉलाच्या लॅक्टेटाइतके सुलभ नसते. उत्प्रेरकांच्या सान्निध्यात लॅक्टिक एस्टराप्रमाणेच विविध अल्कोहॉलांमुळे लॅक्टाइडाचेही विच्छेदन होऊन लॅक्टिल-लॅक्टिक अम्लांची एस्टरे मिळतात. जास्त प्रमाणात उत्प्रेरक वापरल्यास एकवारिक लॅक्टिक एस्टरे मिळतात.
सूक्ष्म प्रमाणात खनिज अम्ले वापरल्यास पॉलिलॅक्टिक अम्ल तयार होते व फार जास्त प्रमाणात वापरल्यास ॲसिटाल्डिहाइड, कार्बन मोनॉक्साइड, फॉर्मिक अम्ल (HCOOH) व पाणी ही संयुगे मिळतात. विरल सल्फ्यूरिक अम्लाची विक्रिया होऊन ॲसिटाल्डिहाइड व फॉर्मिक अम्ल मिळते.
हायड्रीआयोडिक अम्लाने (Hl) लॅक्टिक अम्लाचे⇨क्षपण होऊन प्रोपिऑनिक अम्ल (CH3.CH2.COOH) मिळते.
अल्कोहॉल वर्गाच्या गुणनिदर्शक विक्रिया लॅक्टिक अम्लामध्येही दिसून येतात. उदा., अम्ल क्लोराइडे, कार्बनी अम्ले व ॲनहाइड्राइडे यांच्या साहाय्याने लॅक्टिक अम्लाचे आल्फा-कार्बनाच्या जागी एस्टरीकरण करता येते. डाय-ॲझोमिथेन डाय-ॲझोमिथिल सल्फेट यांसारख्या क्षार कारकांच्या (क्षाराचे-अल्कलीचे-गुणधर्म देणाऱ्या पदार्थाच्या) साहाय्याने लॅक्टिक अम्लाचे आल्फा स्थानी क्षारीकरण होते. अल्कोहॉल वर्गातील द्रव्यापासून मिळणारे विशिष्ट अनुजात उदा., क्लोरोफॉर्मेट, कार्बामेट व यूरेथेन हे लॅक्टिक अम्ल किंवा त्याचे एस्टर यांपासून अनुक्रमे फॉस्जीन, सायनिक अम्ल व आयसोसायनेट यांच्या विक्रियांनी मिळतात.
प्रयोगशाळेत लॅक्टिक अम्ल अनेक प्रक्रियांनी संश्लेषित करता येते. उदा., (१) ॲसिटाल्डिहाइड-सायनोहायड्रिनाचे (CH3.CHO.HCN) अम्लाच्या मदतीने जलीय विच्छेदन करून (२) आल्फामोनोहॅलोजन प्रोपिऑनिक अम्लाचे क्षाराच्या साहाय्याने जलीय विच्छेदन करून (३) पायरूव्हिक (कीटो प्रोपिऑनिक) अम्लाचे (CH3.CO.COOH) क्षपण करून (४) १:२ प्रोपिलीन ग्लायकॉलाचे (CH3.CHOH.CH2OH) उत्प्रेरकाच्या साहाय्याने ऑक्सिडीकरण करून (५) आयसोमॅलिक अम्ल [CH3.C(OH).(COOH)2] तापवून (६) ॲलॅनिनाची (आल्फा-ॲमिनो-प्रोपिऑनिक अम्ल) [CH3.CH(NH2).COOH] नायट्रस अम्लाशी विक्रिया घडवून.
उत्पादन : किण्वन व संश्लेषण अशा दोन पद्धतींनी लॅक्टिक अम्लाचे उत्पादन करता येते. यांपैकी किण्वन पद्धती अधिक प्रमाणात वापरतात.
किण्वन पद्धती : कार्बोहायड्रेटाचे किण्वन करून लॅक्टिक अम्ल तयार करतात. उपनिर्मित अथवा टाकाऊ समजल्या जाणाऱ्या कार्बोहायड्रेटांचा या कामी उपयोग केला जातो. लॅक्टोबॅसिलस डेलब्रुकाय या जातीचे सूक्ष्मजंतू ५०० से.तापमानाला जास्त कार्यप्रवण असतात, म्हणून ते अशा किण्वनात वापरतात. या पद्धतीने जास्त शुद्ध लॅक्टिक अम्ल मिळते. ग्लुकोज व इतर काही कार्बोहायड्रेटांचे स्ट्रेप्टोकॉकस, ल्युकॉनोस्टॉक व इतर काही प्रजातींतील जाती तसेच लॅक्टोबॅसिलस प्रजातीतील इतर जाती यांच्या द्वारे किण्वन करून लॅक्टिक अम्ल मिळते परंतु लॅक्टिक अम्लाच्या औद्योगिक उत्पादनासाठी त्यांचा फारसा उपयोग केला जात नाही.
कार्बोहायड्रेटाचे किण्वन करताना मिश्रणात कॅल्शियम कार्बोनेट जासत प्रमाणात वापरतात त्यामुळे तयार होणाऱ्या लॅक्टिक अम्लाचे उदासिनीकरण (अम्लता नाहीशी करण्याची क्रिया) होऊन कॅल्शियम लॅक्टेट हे लवण तयार होते व कार्बन डाय-ऑक्साइड निघून जातो. या पद्धतीने pH मूल्य [⟶पीएची मूल्य] फारसे कमी होत नाही व किण्वन चालू राहते कारण जर pH मूल्य कमी झाले, तर किण्वन बंद होते. शेवटी या किण्वन द्रवाचे प्रथम कॅल्शियम हायड्रॉक्साइडाने क्षारीकरण करतात, त्यामुळे मॅग्नेशियम हायड्रॉक्साइड, कॅल्शियम कार्बोनेट व इतर पदार्थांचे अवक्षेपण (न विरघळणाऱ्या साक्याच्या रूपात तयार होण्याची क्रिया) होते. ते गाळून निराळे करतात. सल्फ्युरिक अम्लाच्या साहाय्याने गालिताचे (गाळलेल्या द्रवाचे) अम्लीकरण केल्यावर लॅक्टिक अम्ल मिळते. कॅल्शियमाचे कॅल्शियम सल्फेटात रूपांतर होऊन त्याचा अवक्षेप होतो. तो गाळून वेगळा करतात. गालितामध्ये अशुद्ध लॅक्टिक अम्लाचे प्रमाण साधारणपणे १०% असते. संहतीकरण करून ते प्रमाण ५०% वाढवितात.
लॅक्टिक अम्लाचे शुद्धीकरण निरनिराळ्या पद्धतींनी करतात. लोणारी कोळशाच्या साहाय्याने त्यातील नायट्रोजनयुक्त व इतर कार्बनी अशुद्ध पदार्थ काढून टाकतात. तसेच लोखंड, तांबे व इतर जड धातूंची अपद्रव्ये सोडियम फेरोसायनाइडाने वेगळी करतात. राहिलेला विद्राव गाळून तो आयन-विनिमयक रेझिनामधून [⟶ आयन-विनिमय] झिरपवितात, त्यामुळे उरलेली सर्व अशुद्धता निघून जाते. या विक्रियेप्रमाणे सैद्धांतिक दृष्ट्या लॅक्टिक अम्लाची प्राप्ती जरी १००% अपेक्षित असली, तरी प्रत्यक्षात ती ८५% पेक्षा जास्त होत नाही.
उद्योगधंद्यात लागणारे कमी प्रतीचे लॅक्टिक अम्ल बनविण्यासाठी किण्वन द्रवाचे सल्फ्युरिक अम्लाने अम्लीकरण करून अवक्षेपित कॅल्शियम सल्फेट गाळून काढल्यावर राहिलेल्या गालिताचे संहतीकरण करतात.
खाण्यास योग्य असे लॅक्टिक अम्ल दोन पद्धतींनी तयार करता येते. पहिल्या पद्धतीत किण्वनासाठी अतिशुद्ध केलेली साखर व शुद्ध कॅल्शियम कार्बोनेट वापरतात. किण्वन पूर्ण झाल्यावर नेहमीप्रमाणेच किण्वन सल्फेट गाळून निराळे करतात. गालितांचे संहतीकरण करून ते सक्रियित (जास्त क्रियाशील) कार्बनामधून किंवा आयन-विनिमय रेझिनामधून झिरपू देतात. कॅल्शियम किंवा सोडियम फेरोससायनाइडाने लोखंड व तांबे काढून टाकतात आणि नंतर विरल करून योग्य ती विद्राव संहती मिळवितात.
दुसऱ्या पद्धतीत साखरेच्या कारखान्यातील मोलॅसिस (उसाच्या रसातील ज्या भागापासून साखरेचे स्फटिक साध्या प्रक्रियांनी तयार करता येत नाहीत असा भाग) किंवा दह्यातील दुग्धजल (व्हे) यांचे किण्वन करून मिळणारा कॅल्शियम लॅक्टेटाचा विद्राव गाळून घेतात. तो तापवून संहतीकरण करून थंड केला असता कॅल्शियम लॅक्टेटाचे स्फटिक मिळतात. हे स्फटिक गाळून वेगळे केल्यावर पाण्यात विरघळवून सल्फ्यूरिक अम्लाने त्याचे अम्लीकरण करतात व मिळणारे लॅक्टिक अम्ल बाष्पीकरणाने योग्य त्या संहतीस आणतात.
लॅक्टिक अम्लाच्या मिथिल एस्टराचे ऊर्ध्वपातन करून शुद्ध अम्ल मिळविण्याची पद्धतीही सोयीची आहे. त्यासाठी सल्फ्युरिक अम्ल हे उत्प्रेरक वापरून मिथॅनॉलाच्या साहाय्याने लॅक्टिक अम्लाचे प्रथम मिथिल एस्टर तयार करतात. त्याचे जलीय विच्छेदन करण्यासाठी एस्टर पाण्यात उकळतात व त्यामुळे अलग होणारे मिथेनॉल सतत काढून टाकतात. या पद्धतीने अम्ल जलीय विद्रावाच्या रूपात अतिशुद्ध असते.
संश्लेषण : लॅक्टोनायट्राइड [CH3.CH(OH).CN] म्हणजेच ॲसिटाल्डिहाइड सायनोहायड्रीक या संयुगापासून प्रयोगशाळेत लॅक्टिक अम्लाचे संश्लेषण करतात.
भारतात बडोदे येथील ॲलेंबिक केमिकल वर्क्स व कलकत्ता येथील कलकत्ता केमिकल्स या कंपन्या कॅल्शियम लॅक्टेट तयार करतात. बहुतेक सर्व लॅक्टिक अम्ल मात्र आयात करण्यात येते.
उपयोग : लॅक्टिक अम्लाचा उपयोग मुख्यत्वे खाद्यपदार्थात करतात. हे अम्ल अबाष्पनशील व जवळजवळ गंधहीन असले, तरी त्यास एक प्रकारचा सौम्य अम्लयुक्त स्वाद असतो. ते इतर ॲरोमेंटिक पदार्थांबरोबर अम्लीकारक म्हणून खाद्ये व पेये यांत वापरतात. लोणची, सॉस व तत्सम टिकाऊ खाद्यपदार्थात लॅक्टिक अम्ल परिरक्षक म्हणून वापरतात. ते द्रवरूप असल्याने उपयोगात आणण्यास जास्त सोयीचे असते, म्हणून ते बिअर, लोणी, सूप, जेली, स्वादकारक पदार्थ, सरबते वगैरे पदार्थात वापरतात.
मिथिल, एथिल व n-ब्युटिल ही लॅक्टेटे विद्रावक आहेत. ती तयार करण्यासाठी लॅक्टिक अम्ल लागते. उच्च तापमानाला उकळणारे लॅक्टिक एस्टर आणि लॅक्टिक व ॲडिपिक अम्लांच्या एस्टरांचे मिश्रण अनुक्रमे रेझिनामध्ये व पॉलिव्हिनिल क्लोराइडामध्ये प्लॅस्टिकीकारक (लवचिकपणा वाढविणारा पदार्थ) म्हणून वापरतात.
कातडी कमाविण्यासाठी तसेच विद्युत् विलेपन, विद्युत् झिलाई, विशिष्ट प्रकारची शाई, त्याचप्रमाणे लोकरीची व इतर वस्त्रे रंगविण्याच्या प्रक्रियेत लॅक्टिक अम्लाचा उपयोग करतात.
इतर द्रव्यांबरोबर लॅक्टिक अम्ल जंतुनाशक म्हणूनही वापरले जाते. उदा., n-डोडेसिल-अमाइन लॅक्टेट व n-डोडेसिल-अमाइन सिलिकेट यांचे मिश्रण जंतुनाशक व कवकनाशक (बुरशीसारख्या हरितद्रव्यरहित वनस्पतींचा नाश करणारे) म्हणून उपयोगात आणतात.
लॅक्टिक अम्लाच्या काही लवणांचे उपयोग पुढीलप्रमाणे आहेत : कॅल्शियम लॅक्टेट हे रक्तस्त्रावामध्ये रक्तक्लथनासाठी (रक्त गोठवण्यासाठी) वापरतात. तसेच ते जेलीमध्येही वापरतात. सोडियम लॅक्टेट हे ग्लिसरॉलाच्याऐवजी वापरता येते. स्वेदविरोधक म्हणून ॲल्युमिनियम लॅक्टेट आणि झिर्कोनियम लॅक्टेट यांचा उपयोग करतात. लहान मुलांच्या अन्नात तसेच पौष्टिक अन्नामध्ये कॉपर लॅक्टेट हा एक घटक असतो. काचेवर ओरखडे जाऊ नयेत म्हणून तीवर टिटॅनियम लॅक्टेटाचा पातळ थर देतात.
संदर्भ : 1. Casida, L. E. Industrial Microbiology, New York, 1968.
2. Faith, W. L. and others, Industrial Chemicals, New York, 1965.
3. Thoma, R. W. Ed. Industrial Microbiology, Stroudsburg pa. 1977.
पटवर्धन, सरिता अ.
“