रासायनिक विक्रिया : पृथ्वीवर विद्यमान असलेल्या अगणित पदार्थाचे स्वरूप वारंवार बदलत असते. पाण्याची वाफ होणे व वाफेचे पुन्हा पाणी होणे किंवा पाणी थंड झाल्यावर त्याचे बर्फात रूपांतर होणे या क्रिया नित्याच्या आहेत. पाणी, बर्फ व वाफ ही पाण्याची स्थित्यंतरे केवळ त्याची द्रव, वायू व घन अवस्था दर्शवितात पण या तीनही अवस्थांमध्ये पाण्याचे रासायनिक गुणधर्म बदलत नाहीत. अशा प्रकारच्या रूपांतरांना भौतिक रूपांतर म्हणतात. मानव व इतर प्राणी हरघडी श्वासोच्छ्वास करीत असतात. हवेतील ऑक्सिजन शरीरात घेऊन प्राणी कार्बन डाय-ऑक्साइड वायू बाहेर सोडतो. या विक्रियेचे स्वरूप वेगळे आहे. ऑक्सिजन शरीरात गेल्यावर कार्बनाशी संयोग पावून त्याचे कार्बन डाय-ऑक्साइडमध्ये रूपांतर होते म्हणजेच ऑक्सिजन व कार्बन या दोन पदार्थापासून तिसराच एक नवा पदार्थ तयार होतो. अशा रूपांतरांना रासायनिक रूपांतर म्हणतात. रासायनिक रूपांतर घडत असताना ज्या विक्रिया होत असतात, त्यांचे स्वरूप भौतिक रूपांतरापेक्षा फार निराळे असते. रासायनिक विक्रिया घडत असताना ऊर्जेची देवाण-घेवाण होत असते. विक्रियेच्या संपूर्ण अवधीत विक्रियाकारकांची (विक्रियेत भाग घेणाऱ्या पदार्थांची) व त्यांपासून प्राप्त होत असलेल्या उत्पादितांची एकूण संहती (प्रमाण) स्थिर राहते आणि विक्रियाकारकांपासून प्राप्त झालेल्या उत्पादितांचे गुणधर्म मूळ पदार्थांपेक्षा भिन्न असतात. विक्रियाकारकांचे एकूण द्रव्यमान व उत्पादितांचे एकूण द्रव्यमान समान असते, कारण या विक्रियेत द्रव्य निर्माणही होत नाही वा नष्टही होत नाही, तर फक्त अणूंची नवीन संयोगरूपाने मांडणी होते.
अणू व रेणू यांच्या संरचनांचा अभ्यास केल्यावर शास्त्रज्ञांना असे आढळून आले की , अणूंच्या बाह्य कक्षेत असलेले इलेक्ट्रॉनच रासायनिक विक्रियेत प्रामुख्याने भाग घेतात. अणूचा गाभा तसाच राहतो. यावरून रासायनिक विक्रिया होत असताना भिन्न अणूंच्या बाह्य इलेक्ट्रॉनांची परस्परक्रिया होत असते. या क्रियेतून अस्तित्वात असलेले बंध तुटतात किंवा नवीन बंध निर्माण होत असतात म्हणूनच बंधांचे भंजन किंवा नवीन बंध उत्पन्न होणे म्हणजेच रासायनिक विक्रिया होय. आधुनिक व्याख्या करताना बंध तुटणे किंवा नवीन बंध उत्पन्न होणे याचाच विचार केल्यामुळे बर्फाचे पाण्यात रूपांतर होण्याची क्रिया ही रासायनिक विक्रियाच आहे, असे म्हणावे लागेल. बर्फ पाण्यात रूपांतरित होत असताना बंध भंजन होत असल्यामुळेच पूर्वी भौतिक रूपांतर म्हणून ओळखली जाणारी ही क्रिया आता रासायनिक विक्रियेच्या श्रेणीत येते.
रासायनिक विक्रिया सूत्रांच्या साहाय्याने दाखविल्या जातात. जर A व B या दोन विक्रियाकारकांत विक्रिया घडून C व D हे पदार्थ प्राप्त झाले, तर A + B = C + D असे समीकरण मांडून विक्रिया घडल्याचे दर्शविले जाते. या समीकरणात विक्रियेच्या प्रारंभी असलेल्या व तीपासून प्राप्त होत असलेल्या पदार्थांचाच उल्लेख केला जातो परंतु अंतिम पदार्थ प्राप्त होण्याची क्रिया एकपदी (एकाच पायरीची) आहे किंवा ती निरनिराळ्या पायऱ्यांनी होते, याचा बोध होत नाही.
रासायनिक विक्रियांतून अंतिम पदार्थ एकदम क्वचितच मिळतात. बहुतेक सर्व विक्रिया पायरीने होत असतात परंतु या पायऱ्या कोणत्या आहेत, तसेच या निरनिराळ्या पायऱ्यांच्या दरम्यान कोणते मध्यस्थ पदार्थ बनतात हे प्रत्यक्षपणे जाणून घेणे सामान्यतः शक्य होत नाही. विक्रिया जरी एकपदी असली, तरी तिच्यात संक्रमण अवस्था असतेच आणि उत्तरोत्तर प्राप्त होणाऱ्या अवस्थांतून ती निर्माण होत असते. कोणतीही रासायनिक विक्रिया का व कशी घडते, विक्रियेच्या अखेरीला प्राप्त होणारे पदार्थ कसे निर्माण होतात यांचा अभ्यास केल्यास त्या विशिष्ट विक्रियेचा औद्योगिक अगर वैज्ञानिक दृष्टीने कशा प्रकारे उपयोग करून घेता येईल, याबद्दल माहिती प्राप्त करून घेणे शक्य होते. विक्रियांच्या वेगाचा अभ्यास करून विक्रियांच्या यंत्रणांची माहिती प्राप्त करून घेता येते आणि त्यानुसार औद्योगिक प्रमाणावर पदार्थांची निर्मिती करण्यासाठी योग्य तापमान, दाब , उत्प्रेरक (विक्रियेचा वेग बदलणारा पदार्थ) आदींची योजना करणे शक्य होते [⟶ रासायनिक गतिविज्ञान]. विक्रियेची यंत्रणा जाणून घेत असताना विक्रियेची संक्रमणावस्था, वेगवेगळ्या पायऱ्यांच्या काळात उत्पन्न होणारे मध्यस्थ पदार्थ किंवा मितस्थायी पदार्थ प्रत्यक्षपणे पृथक् रूपाने पाहता येत नाहीत. त्यांचे अस्तित्व मानून संपूर्ण विक्रिया कशी घडत असेल याबाबत यंत्रणा सुचवावी लागते. प्रायोगिक आधारावाचून यंत्रणा योग्य अथवा अयोग्य ठरविता येत नाही. विक्रियेचे मार्ग शोधून काढण्यासाठी शुद्ध गतिविज्ञान विक्रियेत प्राप्त होणाऱ्या दुय्यम फलांपासून काढलेली अनुमाने, ⇨त्रिमितीय रसायनशास्त्र व समस्थानिकीय मार्गण [⟶ मार्गण मूलद्रव्ये] यांचे फार साहाय्य होते.
वर्गीकरण : रासायनिक विक्रियांचा पद्धतशीर अभ्यास करण्यासाठी त्यांचे वर्गीकरण करणे आवश्यक आहे. वर्गीकरण करण्याच्या भिन्न पद्धती प्रचलित आहेत. रासायनिक विक्रिया घडत असताना बंध तुटतात किंवा नवीन बंध निर्माण होतात. बंध तुटून नवीन बंध निर्माण होताना ऊष्णता, प्रकाश किंवा विद्युत् या रूपांत ऊर्जेचे शोषण होते किंवा ती उत्सर्जित होते. प्रारंभिक विक्रियाकारकाचे बंध तुटण्याला लागणारी ऊर्जा नवीन बंध निर्माण होण्यासाठी आवश्यक असलेल्या ऊर्जेच्या तुलनेत कमी किंवा अधिक असू शकते. काही वेळा बंध-भंजनाला आवश्यक असणारी ऊर्जा नवीन बंध-निर्मितीसाठी आवश्यक असणाऱ्या ऊर्जेएवढीच असते. विक्रिया घडत असताना ऊर्जेचे उत्सर्जन झाले तर तिला ऊर्जादायी व ऊर्जेचे शोषण केले जात असल्यास तिला ऊर्जाग्राही विक्रिया म्हणतात. उत्सर्जित वा शोषित ऊर्जा उष्णतेच्या रूपात असेल, तर या विक्रियांना अनुक्रमे ऊष्मादायी व ऊष्माग्राही विक्रिया म्हणतात.
रसायनशास्त्रात कार्बनी व अकार्बनी असे दोन विभाग पाडून पदार्थांच्या गुणधर्माचा विचार केला जातो. हे वर्गीकरण सोईसाठी केलेले असून त्याला कोणताही सैद्धांतिक आधार नाही. रासायनिक विक्रियांचा अभ्यास करताना प्रामुख्याने अशा विक्रिया घडताना निर्माण होणाऱ्यास बंधाचा किंवा तुटणाऱ्या बंधाचाच विचार करावा लागतो आणि या दृष्टीने कार्बन व अकार्बनी विक्रिया असे वर्गीकरण करणे योग्य ठरते. कार्बनी संयुगे बनताना प्रामुख्याने सहसंयुजी बंध (संयुगातील घटक अणूंमध्ये दोन इलेक्ट्रॉनांची समान भागीदारी होऊन निर्माण होणारे बंध) निर्माण होतात आणि अकार्बनी संयुगांत प्रामुख्याने विद्युत् संयुजी किंवा आयनी बंध (संयुगातील जास्त इलेक्ट्रॉन असलेल्या अणूने आपले एक वा अधिक जादा इलेक्ट्रॉन दुसऱ्या अणूला पूर्णपणे दिल्याने व त्यामुळे दोन्ही अणू परस्परविरूद्ध विद्युत् भारित होऊन निर्माण होणारे बंध) निर्माण होतात.
कार्बनी विक्रिया : कार्बनी विक्रियांचे खालील चार वर्ग पडतात.
(१) प्रतिष्ठापन किंवा विष्ठापन विक्रिया : या विक्रियेत संयुगातील एका अणूची किंवा अणुगटाची जागा दुसरा अणू किंवा अणुगट किंवा घेतो. हिचे निर्देशन XY + Z ⟶ XZ +Y असे करतात. उदा., क्लोरोबेंझीन तयार करण्याच्या विक्रियेत बेंझिनातील एका हायड्रोजन अणूची जागा एक क्लोरीन अणू घेतो.
C6H6 + Cl2 ⟶ C6H6Cl + HCl
बेंझीन क्लोरीन क्लोरोबेंझीन हायड्रोक्लोरिक अम्ल
(२) समावेशक विक्रिया : हिच्यात दोन अगर अधिक पदर्थांच्या रेणूंची विक्रिया होऊन फक्त एकच पदार्थ तयार होतो. हिचे निर्देशन XY + Z ⟶ XYZ असे करतात. उदा., कार्बन व हायड्रोजन यांच्या सरळ संयोगाने ॲसिटिलीन वायू तयार होतो.
2C + H2 ⟶ C2H2
कार्बन हायड्रोजन ॲसिटिलीन
(३) निरसन विक्रिया : या विक्रियेत रेणूंपासून अणू, अणुगट अथवा आयन (विद्युत् भारित अणू , रेणू किंवा अणुगट) वियोजित होऊन असंतृप्त (ज्यात लगतच्या अणूंत एकापेक्षा अधिक बंध असून त्या ठिकाणी इतर अणूंचा अथवा अणुगटांचा समावेश होऊ शकतो असे) वा वलयी किंवा दोन्ही असलेले रेणू तयार होतात. हिचे निर्देशन XYZ ⟶ XY + Z असे करतात. उदा., अल्कोहॉलाच्या अम्ल उत्प्रेरित निर्जलीकरणाद्वारे अल्कीन हे एक द्विबंध असलेले संयुग बनते, टर-ब्युटिल अल्कोहॉल [(CH3)3 COH] हे अम्लीय उत्प्रेरकाबरोबर तापविल्यास त्यातील पाणी निघून जाऊन आयसो-ब्युटिलीन [(CH3)2 C = CH2 ] बनते.
(४) पुनर्विन्यास विक्रिया : हिच्यात रेणूतील अणूंची वा मूलकांची (विक्रियामालेत ज्यांत बदल होत नाहीत पण अलगपणे अस्तित्त्वात राहू शकत नाहीत अशा अणुसमुच्चयांची) पुन्हा मांडणी होऊन निराळ्या संरचनेचा व वेगळा गुणधर्म असलेला पदार्थ बनतो. हिचे निर्देशन XYZ ⟶ YXZ असे करतात. उदा., ॲलिल फिनिल ईथर (C3H5OC6H5) हे तापविले असता त्याचा पुनर्विन्यास होऊन ऑर्थो-ॲलिल-फिनॉल(ऑर्थो C3 H5C6H4OH) बनते.
बंध-भंजन : कार्बनी संयुग ज्या अणूंपासून बनलेले असते त्या अणूंमध्ये सहसंयुजी बंध असतात. विक्रिया होताना बंध-भंजन होते व नवीन बंध निर्माण होतात. हे सहसंयुजी बंध दोन प्रकारे तुटू शकतात.
(१) समांगी बंध-भंजन : A−B हा रेणू A व B या अणूंच्या सहसंयुजी बंधामुळे निर्माण झाला आहे (बंध आडव्या रेषेने दाखविला आहे). जर C या तिसऱ्या अणूशी विक्रिया करून A−C हा नवीन रेणू तयार होऊन B अणू मुक्त होत असेल, तर ही विक्रिया खालीलप्रमाणे दाखविता येईल.
A−B + C = A−C + B
A−B मधील बंध तुटतो आणि बंधाने जोडलेला प्रत्येक अणू सहसंयुजी इलेक्ट्रॉन जोडीतील एकेक इलेक्ट्रॉन ठेवून घेतो म्हणजेच
A−B किंवा A : B = A. + B.
या प्रकारच्या बंध-भंजनाला समांगी बंध-भंजन म्हणतात. या प्रकारच्या बंध-भंजनात मुक्त मूलके प्राप्त होतात [⟶ मुलके ] . त्यांचे अस्तित्व सिद्ध करण्यास त्याचे समचुंबकत्व [⟶ चुंबकत्व] उपयोगी पडते. ती फार अल्पायू असतात. मुक्त मूलक प्रकाशरासायनिक वा ऊष्मीय अपघटन (प्रकाशामुळे वा उष्णतेमुळे पदार्थांच्या रेणूचे तुकडे होणे )किंवा विद्युत् विच्छेदन (विद्युत् प्रवाहामुळे रेणूचे तुकडे होणे) या विक्रियांत निर्माण होतात. प्रकाश रासायनिक अपघटन : प्रकाशामुळे क्लोरीन रेणूचे रासायनिक अपघटन होते व त्याचे अणू प्राप्त होतात.
सूर्यप्रकाश
Cl – Cl ⟶ Cl∙ + Cl∙
मिथेनाचे क्लोरीनीकरण याच मार्गाने होते. क्लोरिनाचा एक अणू मिथेनाच्या रेणूच्या संपर्कात आल्यावर मिथेनापासून हायड्रोजनाचा एक अणू वेगळा करतो. त्यामुळे मिथिल मूलक व हायड्रोजन क्लोराइडाचा एक रेणू तयार होतात.
CH4 + Cl∙ ⟶ CH3∙ + HCl . . . (१)
अशा रीतीने प्राप्त झालेला मिथिल मुक्त मूलक क्लोरिनाच्या रेणूपासून एक अणू दूर करू शकतो. परिणामतः मिथिल क्लोराइड व क्लोरिनाचा अणू प्राप्त होतात.
CH3. + Cl2 ⟶ CH3Cl + Cl∙ . . . (२)
समी. (१) व (२) यांची बेरीज केल्यास खालील समीकरण प्राप्त होते.
CH4 + Cl∙ ⟶ CH3. + HCl
CH3∙ + Cl2 ⟶ CH3Cl + Cl∙
_______________
CH4 + Cl2 ⟶ CH3Cl + HCl
या प्रकारच्या विक्रियेस शृंखला विक्रिया म्हणतात. अशा विक्रियेत शृंखला प्रारंभ, शृंखला प्रसारण व शृंखला समाप्ती अशा तीन पायऱ्या असतात.
ऊष्मीय अपघटन : धातु-अल्किले तापविल्याने मुक्त मूलके प्राप्त होतात.
लेड टेट्राएथिल तापविल्याने एथिल मुक्त मूलक प्राप्त होते.
Pb (CH2.CH3)4 ⟶ Pb + 4CH3.CH2.
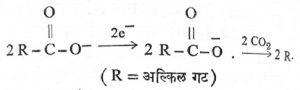
विद्युत् विच्छेदन : ए. डब्ल्यू. एच्. कोल्बे यांच्या विद्युत् विच्छेदन विक्रियेने हायड्रोकार्बन तयार करण्याच्या पद्धतीत प्रथम मुक्त मूलकेच निर्माण होतात.
येथे द्विवारिकीकरण (R –R) होते.
कार्बनी रसायनशास्त्रात मुक्त मूलकांच्या मदतीने प्रतिष्ठापन, समावेशन व पुनर्विन्यास विक्रिया होतात [⟶ मुलके].
(२) विषमांगी बंध-भंजन : A व B या अणूंपासून निर्माण झालेल्या कार्बनी रेणू A : B किंवा A−B असा दर्शविला जातो. या अणूंना जोडणारा बंध तुटल्यावर बंध बनविणारे दोन्ही इलेक्ट्रॉन एकाच अणूकडे राहिल्यास अशा बंध-भंजनाला विषमांगी बंध-भंजन म्हणतात.
A – B = A:– + B+
किंवा A – B = A+ + B:–
ज्या अणूवर धन विद्युत् भार असेल तो अणू कार्बनाचा असल्यास त्याला कार्बोनियम आयन असे म्हणतात. जर कार्बन अणूवर ऋण विद्युत् भार असेल, तर त्याला कार्बोनियन म्हणतात. अशा प्रकारे उत्पन्न झालेल्या आयनांच्या जोड्या क्षणजीवी असतात. आयन बनण्याची विक्रिया वायू प्रावस्थेत व ध्रुवीय विद्रावकांमध्ये (ज्यांतील रेणूंमध्ये धन व ऋण विद्युत् भारांचे कायम स्वरूपी अलगीकरण झालेले असते अशा विरघळविणाऱ्या पदार्थांमध्ये) सहजपणे घडू शकते. हे आयन जरी क्षणजीवी असले, तरी त्यांची अल्प मात्राही ते भाग घेत असलेल्या विक्रियांचे नियंत्रण करण्यास पुरेशी असते. अशा विक्रियांच्या नियंत्रणासाठी ते फार महत्त्वाचे कार्य करतात.
कार्बोनियम आयन भाग घेत असलेल्या विक्रिया विशेषतः पुढील तीन प्रकारच्या आहेत : (१) केंद्र-स्नेतहींशी (सहसंयुजी बंधाच्या निर्मितीसाठी दोन इलेक्ट्रॉन देणार्याय विक्रियाकारकांशी) संयोग, (२) प्रोटॉनाचे विलोपन आणि (३) संरचनेचा पुनर्विन्यास.
कार्बोनियन आयन हे अल्डॉल, पर्किन व क्लायसेन समावेश विक्रियांत भाग घेतात. यांशिवाय अल्किडीकरण, ग्रीन्यार विक्रियाकारकांच्या विक्रिया, व्ह्यूर्त्स , रीमर-हीमान इ विक्रिया आणि कीटोनाचे हॅलोजनीकरण वैगरे विक्रियांतही ते महत्त्वाचा भाग घेतात.
बंध-भंजनाच्या वेळी जी क्रिया होते तिच्या उलट क्रिया झाल्यास म्हणजेच दोन आयन किंवा मुक्त मूलके पुन्हा एकत्र आल्यास बंध निर्माण होतात.
अकार्बनी विक्रिया : अकार्बनी पदार्थात सामान्य: विद्युत् संयोजन होऊन विद्युत् संयुजी किंवा आयनी बंध बनतात. याचा अर्थ असा नव्हे की, अकार्बनी पदार्थात सहसंयुजी बंध नसतातच. खरे म्हणजे संपूर्णपणे आयनी किंवा संपूर्णपणे सहसंयुजी असे स्वरूप कोणत्याच रासायनिक बंधांचे नसते. प्रत्येक बंधात विद्युत् संयोजन आणि सहसंयोजन यांचे मिश्रणच असते. ज्या प्रकारच्या गुणांचा जास्त प्रभाव असतो ते नाव त्या बंधाला दिले जाते. काही वेळा तर आयनी बंधामुळे निर्माण झालेल्या रेणूचे संपूर्ण स्वरूपच सहसंयुजी रेणूसारखे होते. आता हायड्रोक्लोरिक अम्लानचा (HCl चा) रेणू हायड्रोजनाचा इलेक्ट्रॉन क्लोरिनाला दिला गेल्यामुळे तयार होतो परंतु हायड्रोजन आयनाने इलेक्ट्रॉन युग्माला आपल्याकडे आकर्षित करून घेतल्याने HCl मध्ये सहसंयुजी रेणूचे गुण दिसून येतात. पाणी मिसळताच मात्र त्याचे आयनीकरण होऊन H+ व Cl– आयन मिळतात.
आता आयनी बंध कसे उत्पन्न होतात याचा विचार करू. अणू विद्युत् दृष्ट्या उदासीन असतात म्हणजेच त्यांच्या केंद्रावर असलेला धन विद्युत् भार केंद्राभोवती विभिन्न कक्षांतून फिरणाऱ्या एकूण इलेक्ट्रॉनांएवढाच असतो. एखाद्या अणूतील किंवा त्यांच्या बाह्य कक्षेतील एक इलेक्ट्रॉन काढून टाकल्यास त्यावर असलेला धन विद्युत् भार एककाने अधिक होतो म्हणजेच तो ऋणायन (विद्युत् विच्छेदनात ऋणाग्राकडे आकर्षित होणारा आयन) बनतो परंतु हा इलेक्ट्रॉन दूर करण्यास ऊर्जा खर्च करावी लागते. या ऊर्जेस आयनीकरण वर्चस म्हणतात. या आयनांतील आणखी एक इलेक्ट्रॉन दूर केला, तर तो द्वि-भारित ऋणायन होईल परंतु दुसरा इलेक्ट्रॉन दूर करण्यास पहिल्या पेक्षा पुष्कळच जास्त ऊर्जा खर्च करावी लागते. ⇨आवर्त सारणीतील मूलद्रव्यांतील इलेक्ट्रॉन दूर करण्यास लागणारी ऊर्जा प्रत्येक मूलद्रव्याप्रमाणे बदलत जाते. हायड्रोजनाच्या बाबतीत ही क्रिया खालीलप्रमाणे दाखविता येईल.
H + ऊर्जा = H+ + इलेक्ट्रॉन
काही मूलद्रव्यांच्या अणूंमध्ये इलेक्ट्रॉन आकर्षित करण्याचा गुण दिसून येतो. याला इलेक्ट्रॉन आसक्ती म्हणतात. अशा प्रकारे इलेक्ट्रॉन आकर्षित केल्यावर तो अणू ऋण विद्युत् भारित आयन होतो. असे धन व ऋण विद्युत् भारित आयन एकमेकांजवळ आल्यावर त्यांच्यात विद्युत् स्थितिक आकर्षण उत्पन्न होऊन पदार्थाचा रेणू तयार होतो. रेणू तयार होण्यामध्ये इलेक्ट्रॉन आसक्ती व आयनीकरण वर्चस् या गुणांचाच फार प्रभाव असतो.
आयनी संयुगे नेहमीच तयार होतात असे नाही. अशा विक्रियांतील परस्पर ऊर्जा संबंधांवर संयुगांचे निर्माण होणे अवलंबून असते. संयुग तयार होताना जी स्थित्यंतरे होतात ती बोर्न-हाबर चक्रात दाखविलेली आहेत [⟶ रासायनिक संरचना].
इलेक्ट्रॉनांच्या देवघेवीमुळे होणाऱ्या आयनी विक्रियांची उदाहरणे म्हणजे विविध धातूंचे ⇨ऑक्सिडीभवन, ऑक्साइडांचे ⇨क्षपण, अन्योन्य प्रतिष्ठापन, द्विअपघटन, अम्ल व क्षार (अल्कली) यांचे उदासिनीकरण (अम्लता व क्षारता नाहीशी होणे) वगैरे होत. शरीरातील हाडांना लागणारे कॅल्शियम फॉस्फटासारखे पदार्थ शरीरात अशाच आयनी विक्रियांतून बनून योग्य ठिकाणी शोषिले जातात.
कार्बनी व अकार्बनी विक्रियांची तुलना : अकार्बनी विक्रियांची काही वैशिष्ट्ये आहेत. कार्बनी विक्रियांत रेणूचा सांगाडा प्रायः तसाच राहून विक्रिया होताना दिसतात. अकार्बनी विक्रियांत रेणूचे तुकडे होतात व नंतर त्यांची नव्याने जुळणी होऊन विक्रियेत तयार होणारे संयुग मिळते. अकार्बनी विक्रियांच्या क्षेत्रात संक्रमणी धातू आयन व संयुगे यांच्या रेडॉक्स (ऑक्सिडीकरण−क्षपण) विक्रियांच्या बाबत होणारी इलेक्ट्रॉनांची संक्रमणे विशेष सैद्धांतिक महत्त्वाची मानली गेली आहेत.
अकार्बनी विक्रिया कसकशा होतात याचा अभ्यास कार्बनी विक्रियांच्या यंत्रणा जाणण्याच्या पद्धतीनेच होतो पण त्यासाठी अधिक सूक्ष्मग्राही व संवेदनशील तंत्रे आता वापरली जातात.
विक्रिया यंत्रणा : आता केवळ विक्रियेचा मार्ग आणि संभाव्य यंत्रणा जाणून घेतल्याने रसायनशास्त्रज्ञांचे समाधान होत नाही. विक्रिया घडताना विक्रियाकारक रेणूंची प्रत्यक्ष टक्कर कशी होते व त्यांची टक्कर होण्यापूर्वीची ऊर्जा व स्थिती, तसेच उत्पादित रेणूची ऊर्जा, स्थिती, वितरणाची दिशा एवढेच नव्हे, तर उद्दीपित रेणूंच्या ऊर्जेची शक्य तर इलेक्ट्रॉनीय, स्थानांतर, स्पंद अशी विभागणी तसेच विक्रियेच्या महत्तम संभाव्यतेबद्दल जेवढे काही कळू शकेल ते जाणून घेण्याचा प्रयत्ने शास्त्रज्ञ करीत असतात. अशा विक्रिया घडणाऱ्या क्षणाचे जे गतिचित्र मिळते त्याला आता विक्रियेची यंत्रणा मानतात. ⇨रेणवीय शलाका व ⇨रासायनिक दीप्ती या तंत्रांच्या साहाय्याने विक्रियेच्या यंत्रेणेचे स्पष्टीकरण केले जाते.
⇨लेसर किरणांचा उपयोग करून विशिष्ट रासायनिक बंधाला मोजकी ऊर्जा पुरवून नेमक्या विक्रिया घडवून आणता येतात. अशा वेळी दुसऱ्या विक्रियाही टाळता येतात रासायनिक विक्रिया पद्धतिविशिष्ट असल्याने त्या ऊर्जा पुरवठ्याच्या पद्धतीनुसार घडताना आढळतात.
उत्प्रेरक : रासायनिक विक्रियेचा वेग बदलणाऱ्या पदार्थाला उत्प्रेरक असे म्हणतात. मात्र विक्रिया होताना या पदार्थाचा क्षय होत नाही. उदा., प्रयोगशाळेत पोटॅशियम क्लोरेट (KClO3) तापवून ऑक्सिजन तयार करण्याच्या विक्रियेचा वेग त्यात थोडेसे मँगॅनीज डाय-ऑक्साइड (MNO2) मिसळल्यास वाढतो. येथे मँगॅनीज डाय-ऑक्साइड उत्प्रेरक म्हणून कार्य करून अपघटन विक्रियेचा वेग वाढविते. उत्प्रेरक दिलेल्या विक्रियेतील उत्पादित पदार्थांची राशी वाढवीत नाही. उत्प्रेरक हा ⇨ऊष्मागतिकीच्या दृष्टीने अशक्य असलेल्या विक्रिया घडवून आणू शकत नाही. तो फक्त विक्रियेचा वेग वाढवू शकतो अथवा तो कमी तापमानास घडवून आणू शकतो.
ऋण उत्प्रेरक किंवा निरोधक यांचा रासायनिक विक्रियेचा वेग कमी करण्यासाठी उपयोग करतात. उदा., अस्थिर हायड्रोजन पेरॉक्साइडाच्या पाणी व ऑक्सिजन वायू यांत होणाऱ्यार अपघटनाचा वेग त्यात थोडेसे ॲसिटानिलाइड घातल्यास कमी होतो.
एंझाइमे ही जिवंत पेशीत तयार होणारे जटिल कार्बनी उत्प्रेरकच आहेत. झायमेज हे यीस्टमधील एंझाइम शर्करेच्या किण्वनाद्वारे (आंबण्याच्या क्रियेद्वारे) अल्कोहॉल व कार्बन डाय-ऑक्साइड तयार होण्याच्या विक्रियेत उत्प्रेरक म्हणून कार्य करते. चयापचन प्रक्रियांत (शरीरात सतत होणाऱ्या भौतीक व रासायनिक प्रक्रियांत) मोठ्या प्रथिन रेणूंचे लहान रेणूंत होणाऱ्या अपघटनाचे उत्प्रेरण पेप्सीन या पाचक एंझाइमाद्वारे होते.
पाहा : उत्प्रेरण; एंझाइमे; रासायनिक गतिविज्ञान.
संदर्भ :
- Cambdell, J. A., Why Do Chemical Reactions Occur? Englewood Cliffs, N. J., 1965.
- Cram, D. J., Hammond, G. S. Organic Chemistry, London, 1959.
- Pauling, L., The Nature of Chemical Bond, New Delhi, 1967.
- Sykes, P. A., Guide to Mechanism in Orgnic Chemistry, London, 1966.
- Snyder, M. K., Chemistry : Structure and Reactions, New York, 1966.
लेखक : ठकार, क. अ.; करवेलकर, ना. वि.; वैद्य, वि. गो.