मूलद्रव्ये : अधिभौतिकीय जगात आढळणारे सर्व पदार्थ (घन, द्रव वा वायू यांपैकी त्याची कोणतीही अवस्था असली तरी) हे ९२ प्रकारच्या भिन्न मूलद्रव्यांपासून निर्माण झाले आहेत, असे प्रयोगनिरीक्षणाने आढळते. कोणत्याही पदार्थाचे स्वरूप त्यामध्ये असणाऱ्या विविध मूलद्रव्यांची संख्या, त्यांची परस्पराच्या सापेक्ष असणारी परिमाणे यांवर अवलंबून तर असतेच पण त्यांमधील मूलद्रव्यांच्या अणूंची जडणघडण कशा प्रकारे झाली आहे यामुळे सुद्धा निश्चित होत असते. उदा., सजीव द्रव्याच्या निर्मितीकरिता निराळ्या तऱ्हेची अशी विशिष्ट मूलद्रव्ये आवश्यक आहेत असे नाही. सजीव प्राण्याच्या जड शरीरामध्ये इतरत्र भौतिकीय पदार्थामध्ये आढळणारी मूलद्रव्येच असतात पण त्यांपासून निर्माण झालेली संयुगे मात्र काही विशिष्ट गुणधर्मांची असतात हे खरे आहे. उदा., सजीव प्राण्यांमधील कार्बनी संयुगामधील रेणूची संरचना लांब साखळीच्या आकाराची असते असे आढळते. रासायनिक व भौतिकीय पद्धतींचा वापर करून अवकाशामधून पृथ्वीवर पडणारे अशनी व पृथ्वीचा प्रत्यक्ष कवच भाग यांची विश्लेषण केले असता किंवा सूर्य आणि यासारख्या इतर ताऱ्यांपासून मिळणाऱ्या प्रकाशाचा अभ्यास ⇨ वर्णपटविज्ञान तंत्राचा वापर करून केला असता असे कळते की, अवकाशातील द्रव्य व पृथ्वीवरील द्रव्य ही दोन्ही द्रव्ये एकाच प्रकारच्या रासायनिक रेणूंपासून बनविली गेली आहेत. हीलियम या मूलद्रव्याचा शोध सूर्यापासून येणाऱ्या प्रकाशाचा अभ्यास करीत असताना लागला आणि यानंतरच त्याचा शोध पृथ्वीवरील द्रव्यामध्ये लागला, ही या संदर्भात नमूद करण्याजोगती गोष्ट आहे. सूर्य व इतर तारे यांमध्ये अशा रीतीने सापडलेल्या इतर मूलद्रव्यांची नावे पुढीलप्रमाणे आहेत : हायड्रोजन, बोरॉन, कार्बन, नायट्रोजन, ऑक्सिजन, मॅग्नेशियम, सिलिकॉन, कॅल्शियम, टिटॅनियम, ॲल्यूमिनियम, जस्त व लोह [ ⟶ तारा आंतरतारकीय द्रव्य]. ९२ मूलद्रव्यांपैकी टेक्नेशियम, ॲस्टटीन व प्रोमेथियम ही मूलद्रव्ये निसर्गात आढळत नाहीत. ही मूलद्रव्ये प्रयोगशाळेत कृत्रिम रीत्या निर्माण करण्यात आली आहेत. ⇨ कणवेगवर्धक यंत्राच्या सहाय्याने मिळालेल्या उच्च ऊर्जाधारी कणांचा इतर मूलद्रव्याच्या अणूंवर भडिमार करून अणुकेंद्रीय विक्रिया घडवून आणता येतात. अशा विक्रियांमध्ये या मूलद्रव्यांची निर्मिती होते. याच रीतीचा उपयोग करून ९२ च्या पुढे १०९ या अणुक्रमांकापर्यंतची (अणुकेंद्रातील प्रोटॉनांच्या संस्थेला अणुक्रमांक म्हणतात) मूलद्रव्ये कृत्रिम रीतीने निर्माण करण्यात यश आले आहे. या मूलद्रव्यांस ⇨ युरेनियमोत्तर मूलद्रव्ये अशी संज्ञा दिली जाते. पुरातन काळच्या मानवास कार्बन, तांबे, सोने, लोखंड, शिसे, पारा, चांदी, गंधक व कथिल अशी फक्त नऊ मूलद्रव्ये माहीत झाली असावी, असे अनुमान केले गेले आहे. त्यास १८०० सालापर्यंत अंदाजे ३० मूलद्रव्ये माहीत झाली, तर १९०० सालापर्यंत ही संख्या ८० पर्यंत गेली होती, असा अंदाज करण्यात आला आहे.
प्रत्येक मूलद्रव्यावर विश्वकोशात स्वतंत्र नोंद असून तीत मूलद्रव्याच्या शोधाचा इतिहास, भौतिक व रासायनिक गुणधर्म, संयुगे, उपयोग वगैरे माहिती दिलेली आहे.
मूलद्रव्यांचे वितरण व त्यांची विपूलता : संपूर्ण विश्व, सूर्यकुल किंवा पृथ्वीच्या पृष्ठभागावरचे कवच यांमध्ये सापडणारी मूलद्रव्ये जरी वेगळी नसली, तरी या तीन विभागांत आढळणारे त्यांचे वितरण मुळीच एकसारखे असत नाही. उदा., फक्त नऊ मूलद्रव्यांपासून पृथ्वीच्या कवचाचा ९९·२५% भाग बनला आहे असे कळते. यामध्ये ऑक्सिजनाचा अंश ६०% तर सिलिकॉनाचा २०% ॲल्युमिनियमाचा ६·२५% व हायड्रोजनाचा २·७% आहे. पृथ्वीवरील भिन्न मूलद्रव्यांची विपुलता ठरविण्याकरिता त्याच्या कवचाबरोबर त्यावरीलसमुद्रातील द्रव्याचा पण समावेश केला, तर पृथ्वीवर हायड्रोजन मूलद्रव्य ॲल्यूमिनियमापेक्षा जास्त विपुल आहे असे दाखविता येते. पृथ्वीच्या अंतर्गाभ्याच्या संघटनाविषयी अप्रत्यक्ष पुराव्यावर आधारित असे ज्ञान उपलब्ध आहे. पृथ्वीच्या निरूढी परिबलाच्या (पृथ्वीच्या प्रत्येक घटकाचे द्रव्यमान व त्याचे विशिष्ट रेषेपासूनचे-अक्षापासूनचे-लंबांतर यांचा गुणाकार करून आणि मग सर्व घटकांकरिता मिळणाऱ्या अशा गुणाकारांची बेरीज करून मिळणाऱ्या राशीच्या) मूल्यावरून अंतर्गाभ्यातील केंद्रीय विभागात द्रव्यमानाचे केंद्रीकरण होते असे अनुमान करता येते. भूकंपविषयक प्रदत्तांवरून (गोळा केलेल्या माहितीवरून) या भागाची घनता ९·७ ग्रॅ./सेंमी.३ यापेक्षा अधिक प्रमाणाची असावी असा अंदाज करता येतो, तर इतर काही प्रयोगांमधून या भागातील अणुद्रव्याचा द्रव्यमानांक (अणुकेंद्रातील प्रोटॉन व न्यूट्रॉन यांची एकूण संख्या) २२ या प्रमाणाचा असावा असे सूचित होते. या सर्व गोष्टीचा साकल्याने विचार केला असता या भागामध्ये बहुतांशी द्रवरूप लोखंड तर काही प्रमाणात निकेल व कोबाल्ट तर काही कार्बन व गंधक अणू असावेत, असा निष्कर्ष काढता येतो. विश्वातील रिक्त अवकाशामध्ये बहुसंख्य हायड्रोजन व थोडेसे हीलियम अणू असतात, असे मानले जाते. भिन्न मूलद्रव्यांच्या अणूंची विश्वात, सूर्यकुलात व पृथ्वीच्या कवचात सापडणारी विपुलता मूल्ये कोष्टक क्र.१ मध्ये दिली आहेत. यांपैकी वैश्विक व सूर्यकुल विभागांतील मूलद्रव्य अणूंची विपुलता मूल्ये वैश्विक एककामध्ये (म्हणजे एक दशलक्ष सिलिकॉन अणूंच्या सापेक्ष) दिली आहेत, तर पृथ्वीच्या कवचामधील अणूंची विपुलता मूल्ये वजनाप्रमाणे दशलक्ष भागातील अंशाच्या स्वरूपात दिली आहेत. कोणत्याही एककाचा उपयोग केला, तरी भिन्न मूलद्रव्य अणूंच्या परस्पर सापेक्ष विपुलतेची कल्पना येऊ शकते.
मूलद्रव्याची विपुलता व उपलब्धता यांमध्ये अनेक कारणांमुळे सरळ संबंध सापडत नाही. पुरातन काळी जी मूलद्रव्ये ज्ञात झाली ती सर्वांत जास्त विपुल असल्यामुळे माहीत झाली असे म्हणणे पण कठीण होते. कारण यांपैकी काही असंयुगित व मुक्त स्वरूपात आढळत होती, तर काही खनिजांच्या स्वरूपात होती. या खनिजांचे शुद्धीकरण करणे सोपे असल्यामुळे त्याविषयीचे ज्ञान मनुष्यास सहज होऊ शकले असे म्हणता येते. ॲल्युमिनियम व टिटॅनियम या जरी वरील धातूंपेक्षा जास्त विपुल असल्या, तरी त्याचे त्यांच्या खनिजांपासून शुद्धीकरण करणे अवघड असल्यामुळे या मूलद्रव्यांचा शोध त्यानंतर बऱ्याच वर्षांनी लागला. या संदर्भात आणखी एका आविष्काराचा उल्लेख करणे आवश्यक आहे. विशिष्ट भूवैज्ञानिक प्रक्रियेमुळे काही ठराविक मूलद्रव्यांच्या स्थिर संयुगाच्या स्वरूपात असणाऱ्या खनिजाचे पृथ्वीवर काही विशिष्ट स्थानी अथवा प्रदेशात केंद्रीकरण होते. या केंद्रीकरणामुळे भिन्न मूलद्रव्यांच्या खाणी पृथ्वीवर निरनिराळ्या जागी आढळतात.
मूलद्रव्य अणूची अंतर्गत रचना : आधुनिक भौतिकीय सिद्धांताप्रमाणे प्रत्येक अणूमध्ये ज्यावर धन विद्युत् भार आहे असे एक अणुकेंद्र असून (व्यास अंदाजे १०-१२ सेंमी.) त्याच्या सभोवतालच्या अवकाशात (व्यास अंदाजे १०-८ सेंमी.) गतिमान इलेक्ट्रॉन फिरत असतात. अणुकेंद्रामध्ये भिन्न संख्येचे प्रोटॉन व न्यूट्रॉन हे दोनच घटक कण असतात. यांची द्रव्यमाने जवळजवळ एकसमान असतात. व ही दोन्ही इलेक्ट्रॉन द्रव्यमानाच्या १,८४० पटींनी जास्त असतात. अणुकेंद्रामध्ये ते एकमेकांशी मेसॉनाद्वारे निगडित केलेले असतात. ⇨ आवर्त सारणीमध्ये (अणूतील इलेक्ट्रॉन रचनेनुसार केलेल्या मूलद्रव्यांच्या कोष्टकरूप मांडणीमध्ये) मूलद्रव्याच्या क्रमांकास अणुक्रमांक (Z) असे म्हणतात. अणूमधील अणुकेंद्रीय प्रोटॉनांची संख्या व त्यांच्या सभोवर फिरणाऱ्या इलेक्ट्रॉनांची संख्या या दोन्ही संख्या व त्यांच्या सभोवार फिरणाऱ्या इलेक्ट्रॉनांची संख्या या दोन्ही संख्या एकच असून तिचे मूल्य Z एवढे असते असे प्रयोगाने दाखवितायेते. अणुकेंद्रात असणाऱ्या प्रोटॉन संख्येमुळे मूलद्रव्याची जात ठरत असते. कोणत्याही मूलद्रव्याच्या अणुकेंद्रात प्रोटॉन व न्यूट्रॉन यांची संख्या एकच असली पाहिजे, असा निर्बंध नसतो. सामान्यपणे या संख्या भिन्न असतात. अणुकेंद्रामधील प्रोटॉन संख्येत न्यूट्रॉनांची संख्या मिळविली असता जी संख्या मिळते तिला द्रव्यमानांक (A) असे म्हणतात. निरनिराळ्या द्रव्यमानांकांच्या पण एकाच अणुक्रमांकाच्या अणूची जात एकच असल्यामुळे त्यास समस्थानिक अणू असे म्हणतात. समस्थानिक अणूकरिता अणुक्रमांक एकच असला, तरी त्याकरिता द्रव्यमानांक विभिन्न असतात. उदा., अणुक्रमांक १० असणाऱ्या निऑन अणूकरिता २० व २२ हे द्रव्यमानांक असणारे दोन समस्थानिक प्रकार मिळतात. कोणत्याही अणूकरिता A व Z यांची मूल्ये दिल्यास त्याचे संपूर्ण निर्देशन होते. निसर्गात आढळणारा निऑन वायू हा अनेक समस्थानिक प्रकारांच्या मिश्रणाने बनलेला असतो. निऑन वायू कोठल्याही स्थानापासून किंवा कोणत्याही प्रकारे मिळवलेला असला, तरी त्यामधील समस्थानिक अणूंची सापेक्ष संहती (प्रमाण) तेवढीच असते असे आढळते. रासायनिक पद्धती वापरून निश्चित केलेले अणूचे द्रव्यमान हे त्यामध्ये असणाऱ्या समस्थानिक प्रकारांच्या मिश्रणाकरिता सरासरी अणुभार स्थिर असतो. अणूच्या निरनिराळ्या समस्थानिक घटक प्रकारांच्या विपुलतेवरून त्याचे सरासरी अणुभारमूल्य ठरत असते. सरासरी अणुभार स्थिर असल्यामुळे त्याच्या मूल्यावरून रासायनिक पद्धतीने अणूचे स्वरूप निश्चित करता येते. क्ष-किरण वणर्पटविज्ञानाद्वारे हेन्री मोझली यांनी मिळवलेली माहिती व आधुनिक काळात ⇨ द्रव्यमान वर्णपटविज्ञानाचा उपयोग करून मिळणारी माहिती यांमुळे अणूमधील प्रत्येक समस्थानिक घटक अणूचे द्रव्यमान अचूकपणे मापणे शक्य झाले आहे. त्यामुळे अणुद्रव्यमानाच्या मापनाकरिता रासायनिक पद्धत सध्या मागे पडली आहे.
निसर्गात निरनिराळ्या मूलद्रव्यांची अशी २६९ समस्थानिक रूपे आढळतात. मूलद्रव्यावर प्रयोगशाळेत उच्च ऊर्जाधारी कणांचा (उदा., प्रोटॉन, ड्यूटेरॉन, आल्फा) भडिमार करुन नवी समस्थानिक रूपे निर्माण करता येतात. या पद्धतीने सु. ९०० नव्या किरणोत्सर्गी (भेदक कण वा किरण बाहेर टाकणाऱ्या) समस्थानिक अणूंचा शोध लावण्यात आला आहे. कोष्टक क्र. २ मध्ये विविध मूलद्रव्यांकरिता सापडलेल्या समस्थानिक अणूंचे द्रव्यमानांक दिले आहेत. कोष्टकामधील एका स्तंभात दाखवलेले समस्थनिक अणू स्थिर स्वरूपाचे आहेत, तर दुसऱ्या स्तंभातील समस्थानिक द्रव्यमानांक मूलद्रव्याची किरणोत्सर्गी रूपे दर्शवितात.
किरणोत्सर्गी मूलद्रव्ये : आवर्त सारणीमध्ये द्रव्यमानांक ८२ याच्यापुढे असणारी सर्व मूलद्रव्ये अस्थिर आहेत. त्यामुळे त्यांचे स्वयंस्फूर्तपणे विघटन होऊन एका ठराविक त्वरेने दुसऱ्या मूलद्रव्यात रूपांतरण होत असते. या प्रक्रियेमध्ये मुक्त होणारी ऊर्जा अणूच्या बाहेर किंवा (उदा., गॅमा किरण) किंवा कण (उदा., आल्फा व बीटा कण) या स्वरूपात उत्सर्जित होत असते. निसर्गात आढळणाऱ्या किरणोत्सर्गी मूलद्रव्यांमध्ये तीन गट किंवा श्रेणी आहेत असे दिसते. यांपैकी पहिली ॲक्टिनियम श्रेणीची साखळी २३५ द्रव्यमानांक असणाऱ्या युरेनियम अणूपासून सुरुवात होऊन शेवटी तिचा अंत स्थिर स्वरूपाचा २०७ द्रव्यमानांक असलेल्या शिशाच्या समस्थानिक अणूमध्ये होतो. दुसरी थोरियम श्रेणीची २३२ द्रव्यमानांक असलेल्या थोरियम अणूपासून सुरुवात होऊन तिचा अंत अनेक साखळी टप्प्यांनंतर २०८ द्रव्यमानांक असलेल्या शिशाच्या अणूमध्ये होतो. तिसरी श्रेणी युरेनियम (२३८) या मूलद्रव्यापासून सुरू होऊन अनेक विघटन टप्प्यांनंतर तिचा अंत शिसे (२०६) मध्ये होतो. या श्रेणीच्याविघटन क्रियेमध्ये मिळणारे काही टप्पे आ.१ मध्ये दाखविले आहेत [ ⟶ किरणोत्सर्ग]. काही दशलक्ष वर्षानंतर सर्व किरणोत्सर्गी मूलद्रव्यांचे विघटन होऊन ती पृथ्वीतलावरून नष्ट झाली असतील अशा
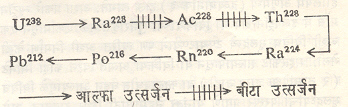
वेळी आवर्त सारणीमधील अणुसंख्या शिशाच्या अणूपाशी थांबेल असा निष्कर्ष या अभ्यासावरून काढता येतो. सध्या निसर्गात किरणोत्सर्गी द्रव्ये मिळतात, याचा अर्थ ती भूतकाळातील कोणत्या तरी एका क्षणी निर्माण झाली असावीत असा करता येतो. सध्या प्रयोगाने आढळणाऱ्या त्यांच्या संहतीवरून विश्व उत्पन्न होऊन किती वर्षे झाली याविषयीचा अंदाज या तर्कवादानुसार करता येतो. कार्बन (१४) या किरणोत्सर्गी कार्बन समस्थानिक अणूचा कालनिर्णयाकरिता याच तत्त्वावर उपयोग केला जातो [ ⟶ किरणोत्सर्गी कार्बन कालनिर्णय पद्धती]. किरणोत्सर्गी मूलद्रव्ये निसर्गामध्येच मिळतात असे नसून काही विशिष्ट स्थिर मूलद्रव्य कणावर ऊर्जाधारी कणाच्या भडिमाराने त्यांची प्रयोगशाळेत कृत्रिम रीत्या निर्मिती करता येते. कृत्रिम किरणोत्सर्ग या आविष्काराचा शोध प्रथम अर्नेस्ट रदरफर्ड यांनी १९१९ मध्ये लावला. या प्रयोगात नायट्रोजनावर आल्फा कणांचा भडिमार केला असता त्यापासून ऑक्सिजन व प्रोटॉन या कणांची निर्मिती होते, असे दाखविले होते. अल्फा कणांचा बोरॉन, मॅग्नेशियम किंवा ॲल्युमिनियम यांवर भडिमार केला असता त्यापासून प्रोटॉन, न्यूट्रॉन किंवा पॉझिट्रान यांचे उत्सर्जन होते पण आल्फा कणांचा भडिमार थांबविला असता प्रोटॉन व न्यूट्रॉन यांचे उत्सर्जन थांबते व पॉझिट्रॉनाचे उत्सर्जन काही विक्रियांकरिता कालानुसार चालूच राहते, असे झॉल्यो-क्यूरी या फ्रेंच शास्त्रज्ञांनी १९३३ मध्ये प्रथम दाखविले. याचा अर्थ असा होतो की, काही अणुकेंद्रीय विक्रियांमध्ये लक्ष्य द्रव्याचे किरणोत्सर्गी मूलद्रव्यामध्ये रूपांतर होत असले पाहिजे. नैसर्गिक रीत्या किरणोत्सर्गी असणाऱ्या मूलद्रव्याच्या अणूचा ज्या नियमानुसार क्षय होताना आढळतो, तोच नियम अशा कृत्रिम प्रकारे किरणोत्सर्गी बनविण्यात आलेल्या अणूच्या बाबतीत पाळला जातो असे प्रयोगाने आढळते. कोष्टक क्र. २ मध्ये दाखविलेले काही समस्थानिक अणू या प्रकारे उपलब्ध झाले आहेत, हे नमूद करणे आवश्यक आहे.
मूलद्रव्यांची उत्पत्ती व अवकाशातील सापेक्ष विपुलता : निरनिराळ्या मूलद्रव्यांची उत्पत्ती व त्यांची सध्या अवकाशात आढळणारी सापेक्ष परिमाणे (विपुलता पहा कोष्टक क्र. १) यांचे विशदीकरणे करण्याकरिता जी. ई. लमेअत्र व जॉर्ज गॅमो यांच्या महत्स्फोट (बिग बॅंग) सिद्धांताचा उपयोग केला जातो [ ⟶ विश्वोत्पत्तिशास्त्र]. या सिद्धांताप्रमाणे न्यूट्रॉन व विद्युत् चुंबकीय पारण (तरंगरूपी उर्जा) यांच्या मिश्रणापासून तयार झालेल्या अति-उच्च घनतेच्या यीलम या प्राथमिक द्रव्यगाभ्याच्या स्फोटापासून या विश्वाची सुरुवात सु. ५० अब्ज वर्षांपूर्वी झाली. स्फोटामुळे जेव्हा गाभ्यातील द्रव्याचे प्रसरण होऊ लागते तेव्हा त्यामध्ये न्यूट्रॉन विक्रिया सुरू झाल्या. त्यांमधील काही विक्रियांमध्ये इलेक्ट्रॉनांचे उत्सर्जन होऊन न्यूट्रॉनांचे प्रोटॉनांमध्ये रूपांतरण होऊ लागले. प्रोटॉनांद्वारे न्यूट्रॉनांचा ग्रास होऊ लागला, म्हणजे त्यायोगे ड्यूटेरियम या हायड्रोजनाच्या समस्थानिक अणूंची काही प्रमाणात निर्मिती होऊ लागली. ड्यूटेरियम जेव्हा परत एका न्यूट्रॉनाचा ग्रास करतो तेव्हा त्याचे ट्रिटियम या हायड्रोजनाच्या सर्वांत जड अशा समस्थानिकांत रूपांतरण सुरू होते. ट्रिटियम अणू हा किरणोत्सर्गी आहे. त्यामुळे तो जेव्हा एका इलेक्ट्रॉनाचे उत्सर्जन करतो तेव्हा त्याचे रूपांतरण हीलियम अणूमध्ये (द्रव्यमानांक ३) होऊ लागते. अशा प्रकारे न्यूट्रॉन ग्रास व इलेक्ट्रॉन क्षय या विक्रियांच्या पुनरावृत्तीमुळे एकामागून एक अशी विविध मूलद्रव्ये टप्प्याटप्प्याने पण त्वरित अशी निर्माण केली गेली. महत्स्फोट झाल्यापासून या विक्रिया अत्यंत त्वरेने काही मिनिटे (२ तासांपेक्षा जास्त नाही) या कालावधीत घडून आल्यामुळे विविध मूलद्रव्यांची परस्पर प्रमाणे यानंतर नेहमीसाठी स्थिर राहतात, असे समजले जाते. विश्वात सापडणारी भिन्न मूलद्रव्ये ही विश्वाच्या भूतकाळात जवळजवळ एकाच वेळी निर्माण झाली असे म्हणता येते. अशा प्रकारे निर्माण झालेल्या विविध अणूंपासून तारे, दीर्घिका (तारामंडळे) व ग्रह यांची नंतर निर्मिती झाली असे मानले जाते. या विशदीकरणाच्या पुष्ट्यर्थ दोन गोष्टी नमूद करता येतात. विविध मूलद्रव्यांची अणुकेंद्रे न्यूट्रॉनाचा ग्रास करतात, असे प्रयोगशाळेमधील प्रयोगांनी प्रत्यक्ष दाखविता येते. दुसरी गोष्ट ही की, निरनिराळ्या अणूंच्या विपुलतेचे प्रमाण त्यांच्या न्यूट्रॉन क्षमतेच्या व्यस्त प्रमाणात असते. या निष्कर्षाचा उपयोग केला असता विविध मूलद्रव्यांकरिता एकमेकांच्या सापेक्ष आढळणाऱ्या प्रमाणाचे बहुतांशी समाधानकारकपणे असे विशदीकरण करता येते. हार्किन्झ नियमासारखे (विषम द्रव्यमानांक असलेल्या समस्थानिकांची विपुलता त्यांच्या लगतच्या सम द्रव्यमानांक असलेल्या समस्थानिकांच्या विपुलतेपेक्षा कमी असते) विपुलतेविषयीचे अनेक नियम न्यूट्रॉन ग्रास परिकल्पनेने स्पष्ट होऊ शकतात. या मीमांसेप्रमाणे ज्यांचे विशदीकरण करता येत नाही अशा पण काही बाबी आहेत, हे नमूद करणे आवश्यक आहे. आवर्त सारणीमध्ये ५ व ८ या द्रव्यमानांकाकरिता स्थिर समस्थानिक अणू मिळत नाहीत. अशा बाबींचे विशदीकरण करण्याकरिता वर गृहीत धरलेल्या दोन विक्रियांच्या जोडीला अणुसंघटन (दोन हलक्या अणुकेंद्रांचा संयोग होऊन जड अणुकेंद्र तयार होणे) विक्रिया पण गृहीत धरावी लागते. या विक्रिया जड मूलद्रव्यांचे संश्लेषण (संयोगीकरण) करणाऱ्या प्रक्रियेला साहाय्यभूत होतात [ ⟶ अणुकेंद्रीय भौतिकी]. अणुकेंद्रीय जातींची निर्मिती व विपुलता वितरण यांचे पूर्ण स्पष्टीकरण मात्र वरील मीमांसेने मिळत नाही.
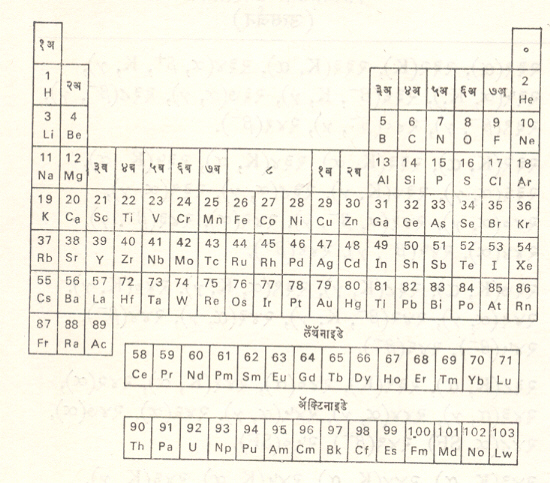
मूलद्रव्यांचे वर्गीकरण : आवर्त सारणीमध्ये मूलद्रव्यांची वर्गवारी प्राधान्यातः त्यांच्या रासायनिक गुणधर्मांच्या संदर्भात (विशेषतः संयुजेच्या म्हणजे इतर अणूंशी संयोग पावण्याच्या क्षमतेच्या) करण्यात आलेली आहे. मूलद्रव्यांची वर्गवारी अनेक अन्य प्रकारे पण करता येते. त्यांपैकी काही वर्गवारींचा खाली निर्देश केला आहे.
(१) अक्रिय वायू : यामध्ये Z = २, १०,१८, ३६, ५४ व ८६ या सहा मूलद्रव्यांचा समावेश होतो. या मूलद्रव्यांच्या अणूची रासायनिक क्रियाशीलता नगण्य स्वरूपाची असून त्यांचा गोठणबिंदू अतिशय कमी मूल्याचा असतो.
(२) धातू : या मूलद्रव्यांकरिता संयुजा इलेक्ट्रॉनांपैकी (अणूच्या बाह्यतम कवचातील इलेक्ट्रॉनांपैकी) काही मुक्त अवस्थेत जात असल्यामुळे ही मूलद्रव्ये विद्युत् संवाहक असतात.
(३) अधातू : सामान्यपणे या गटात १५ मूलद्रव्ये बसतात. या सर्वांमध्ये संयुजा इलेक्ट्रॉनांची संख्या मोठी असते.
(४) संक्रमणी मूलद्रव्ये : उच्च घनता व उच्च वितळबिंदू ही सामान्यतः लक्षणे असलेली सर्व धातवीय मूलद्रव्ये (Z = २१ ते ३१, ३९ ते ४९, ७१ ते ८१, ९० ते १०३) या गटात येतात. याकरिता संयुजा +३ ते +८ या मूल्यांमध्ये असते. या मूलद्रव्यांच्या अणूंना जटिल स्थिर आयन निर्मितीमध्ये भाग घेण्याची क्षमता असते. यामूलद्रव्यांपैकी बऱ्याच मूलद्रव्यांना नैसर्गिक रंग असतो व ती समचुंबकीय (चुंबकीय क्षेत्रात ठेवली असता क्षेत्राच्या दिशेशी समांतर असलेल्या दिशेत चुंबकीकरण होण्याचा) गुणधर्म दाखवितात. [ ⟶ संक्रमणी मूलद्रव्ये].
(५) विरल मृतिका : (Z = २१,३९,५७ ते ७१). या गटातील मूलद्रव्य अणूंना हायड्रोजन, नायट्रोजन, ऑक्सिजन यांसारख्या अधातू मूलद्रव्यांविषयी आसक्ती असल्यामुळे ते त्यांबरोबर रासायनिक संयुगे निर्माण करतात. यांना विशिष्ट चुंबकीय गुणधर्म असल्यामुळे त्यांचा अर्धसंवाहक प्रयुक्तींमध्ये [ ⟶ इलेक्ट्रॉनीय प्रयुक्ती] उपयोग केला जातो. [⟶ विरल मृत्तिका].
(६) अर्धसंवाहक : गॅलियम, सिलिनियम, जर्मेनियम व सिलिकॉन यांसारख्या मूलद्रव्यांचा या गटात समावेश होतो. योग्य अपद्रव्याचा उपयोग करून यांचा उपयोग अर्धसंवाहक प्रयुक्तीकरिता करण्यात येतो. [ ⟶ अर्धसंवाहक].
(७) ॲक्टिनाइड श्रेणी : अणुक्रमांक Z = ९० ते १०३ अथवा थोरियमापासून लॉरेन्सियमापर्यंतच्या मूलद्रव्यांचा या श्रेणीमध्ये समावेश होतो. ॲक्टिनियम (Z = ८९) या मूलद्रव्यापासून या श्रेणीला नाव मिळाले आहे. या श्रेणीमधील सर्व मूलद्रव्ये किरणोत्सर्गी असून त्यांचे कमी अणुभाराच्या मूलद्रव्यांमध्ये उत्स्फूर्तपणे विघटन होत असते. या श्रेणीपैकी थोरियम, प्रोटॅक्टिनियम, युरेनियम ही पहिली फक्त तीन मूलद्रव्ये निसर्गात सापडतात. यापुढील सर्व मूलद्रव्ये प्रयोगशाळेत कृत्रिम रीत्या तयार करण्यात आली आहेत. अशा प्रकारे निर्माण केलेली मूलद्रव्ये अत्यंत सूक्ष्म अशा प्रमाणात उपलब्ध होत असल्यामुळे त्यांपैकी सर्व मूलद्रव्यांकरिता भौतिक स्थिरांक अजून मिळालेले नाहीत (पहा कोष्टक क्र. १). थोरियम अणूच्या इलेक्ट्रॉन विन्यासाच्या (अणुकेंद्राभोवतील कवचांतील इलेक्ट्रॉनांच्या मांडणीच्या) शेवटच्या तीन उपकवचांमध्ये जी. टी. सीबॉर्ग यांच्या मताप्रमाणे 5f1 6d17s2 असे इलेक्ट्रॉन असतात, तर लॉरेन्सियमामध्ये 5f14 6d17s2 असा इलेक्ट्रॉन विन्यास आढळतो [ ⟶ अणु व आणवीय संरचना]. यावरून थोरियम (९०) पासून लॉरेन्सियम (१०३) या मूलद्रव्यापर्यंत इलेक्ट्रॉन विन्यास पाहिला असता त्यामध्ये अतिरिक्त इलेक्ट्रॉन 6d व 5f या उपकवचांत क्रमशः सामावले जातात. या सर्व मूलद्रव्यांच्या अंतिम कवचामध्ये असणारी इलेक्ट्रॉन संख्या एकसमान असल्यामुळे त्यांचे रासायनिक परिणाम, आणवीय वर्णपट व चुंबकीय गुणधर्म यांमध्ये मोठ्या प्रमाणात साम्य आढळते. यामुळे वरील सर्व मूलद्रव्यांचा समावेश आवर्त सारणीमधील (इलेक्ट्रॉन विन्यासानुसार केलेल्या वर्गीकरणातील) f वर्गात केला जातो. [ ⟶ किरणोत्सर्ग].
(८) युरेनियमोत्तर मूलद्रव्ये : या वर्गामध्ये वरील श्रेणीपैकी नेपच्यूनियम ते लॉरेन्सियम ही ११ मूलद्रव्ये व त्यानंतर प्रयोगशाळेत कृत्रिम रीत्या तयार केलेली अणुक्रमांक १०४, १०५, १०६, १०७, १०८, व १०९ ही मूलद्रव्ये येतात [ ⟶ युरेनियमोत्तर मूलद्रव्ये; मूलद्रव्ये, मानवनिर्मित]. अल्पजीवी नवीन मूलद्रव्यांच्या आयन अणूंचा क्षय होऊन त्यांपासून जे घटक निर्माण होतात त्यांचे अभिज्ञान करण्याकरिता (अस्तित्व ओळखण्याकरिता) अत्यंत कार्यक्षम अशी उपकरण योजना (SHIP) जर्मनीमध्ये विकसित करण्यात आली आहे. यामध्ये या घटकांवर विद्युत् स्थितिक व चुंबकीय क्षेत्रांचा उपयोग करून त्यांचे त्यांच्या गतिवेगानुसार अलगीकरण केले जाते व त्यांच्या विचलनावरून त्यांचे द्रव्यमान इ. गोष्टी गणितीय रीत्या गणन करता येतात. या उपकरण योजनेच्या संवेदनक्षमतेबद्दल पुढील दाखला दिला जातो. एक सबंध आगगाडी भरून असलेल्या वाळूपैकी एक कण अलग करून त्याचे अभिज्ञान करून घेण्याच्या क्रियेइतकीच वरील क्रिया कार्यक्षम आहे, असे म्हणता येते. जर्मनीतील डार्मस्टाट येथील जड आयन संशोधन प्रयोगशाळेत बिस्मथ (अणुक्रमांक ८३) अणूवर वेगवान लोह आयनांचा भडिमार केला असता त्यापासून १/५००० सेकंद आयुष्यकाल असणारा १०९ अणुक्रमांकाच्या मूलद्रव्याचा अणू निर्माण होतो, असा पुरावा अलीकडे प्रगट करण्यात आला आहे. या प्रयोगामध्ये तीन नवे अणू निर्माण होण्याची अपेक्षा होती, तरी प्रत्यक्षात असा एकच अणू निर्माण झाला व या एकाकी अणूचे अभिज्ञान नवी प्रायोगिक पद्धत करू शकली हे या संदर्भात लक्षात ठेवण्याजोगते आहे. या पद्धतीचा उपयोग करून अतिजड मूलद्रव्ये प्रयोगशाळेत निर्माण करण्याची आशा वाढली आहे.
(९) अतिजड मूलद्रव्ये : जेव्हा विश्व उत्पन्न झाले त्या वेळी त्यामध्ये अस्तित्वात असलेल्या गुरुत्वाकर्षणी क्षेत्राचे मूल्य पण खूप मोठे होते. या गोष्टीचे विशदीकरण करण्याकरिता त्या वेळी अतिजड मूलद्रव्ये उपस्थित असावी असे एक अनुमान केले जाते. मूलद्रव्याचा द्रव्यमानांक जसा वाढत जातो तशी त्याची अस्थिरताही वाढत जाते असे आढळत असल्यामुळे अशी जड मूलद्रव्ये जरी काही कारणांमुळे निर्माण झाली, तरी ती काही काळपर्यंतच अस्तित्वात राहणार, अशी अडचण या गृहितामध्ये राहते. आधुनिक सैद्धांतिक अभ्यासावरून असे कळते की, १०७–११० अणुक्रमांकाची मूलद्रव्ये जरी अस्थिर असली, तरी Z = ११४ च्या आसपासची मूलद्रव्ये सापेक्षतेने जास्त स्थिर असण्याचा संभव आहे. Z = ११४ व त्यावरील अणुक्रमांक असणाऱ्या मूलद्रव्यांना अतिजड मूलद्रव्ये अशी संज्ञा दिली गेली आहे. या मूलद्रव्यांचा अर्धायुकाल (मूळ अणुसंख्येपैकी निम्म्या अणूचा किरणोत्सर्गी क्षय होण्यास लागणारा काल) पृथ्वीच्या आयुष्यापेक्षा जास्त मूल्याचा असला, तर अतिजड मलद्रव्ये पृथ्वीवर काही विशिष्ट जागी निसर्गात मिळण्याची शक्यता सूचित होते. अशनीसारख्या पृथ्वीबाह्य पदार्थामध्ये [ ⟶ उल्का व अशनि] पण ते सापडण्याची शक्यता आहे. सैद्धांतिक मीमांसेप्रमाणे Z = ११४ यापुढील मूलद्रव्याचा जो क्षय होतो तो मुख्यतः स्वयंस्फूर्त भंजन क्रियेद्वारे होतो असे दाखविता येते. त्यामुळे ज्या द्रव्यामध्ये स्वयंस्फूर्त भंजनक्रिया होत आहे असे निरीक्षणाने आढळते त्यामध्ये अतिजड मूलद्रव्ये असण्याचा संभव असतो असे म्हणता येते. रशियामधील कॅस्पियन समुद्रामधील चेल्यिक्येन द्विपकल्पात काही गरम झरे आहेत. त्यांमधून बाहेर पडणारे पाणी व द्रव्ये ही पृथ्वीच्या खूप खोलवर असलेल्या विभागातून येत असावी, असा तर्क करण्यात येतो. या द्रव्यामध्ये स्वयंस्फूर्त भंजन क्रियाशीलता आढळते पण ती अतिजड मूलद्रव्यांमुळे आहे हे अजून निश्चितपणे सिद्ध झालेले नाही.
पॅसिफिक समुद्रामध्ये ४,५०० मी. खोलीवर सापडलेल्या शार्क माशाच्या सहा कोटी वर्षांपूर्वीच्या दाताच्या जीवाश्मामध्ये (शिळारूप अवशेषामध्ये) अतिजड मूलद्रव्यांचा शोध घेण्यात आला. समुद्रतळावर सापडणाऱ्या मॅंगॅनीझ गोट्यांची तपासणी करण्यात आली, पृथ्वीवर सापडलेल्या निरनिराळ्या प्रकारच्या अशनींचे विश्लेषण करण्यात आले पण त्यांमध्ये अतिजड मूलद्रव्ये मिळाली नाहीत. नव्या सैद्धांतिक संशोधनामुळे पूर्वी अंदाज केला होता त्यापेक्षा अतिजड मूलद्रव्ये जास्त अस्थिर असावीत असे वाटते. यावरून निसर्गामध्ये अतिजड मूलद्रव्ये मिळण्याची शक्यता कमी आहे या निष्कर्षाप्रत शास्त्रज्ञ आले आहेत. टंगस्टनासारख्या भारी द्रव्यमानाच्या काही धातूंवर अती शक्तीशाली (≈ २४ GeV) प्रोटॉनांचा भडिमार केला असता अतिजड मूलद्रव्ये निर्माण होतील अशी प्रथम कल्पना होती पण तीही खरी ठरली नाही. भारी द्रव्यमानाच्या समस्थानिक अणूंद्वारे शोषण किंवा दोन भारी द्रव्यमानांच्या अणुकेंद्रांच्या परस्पर आघातामुळे संघटन (तात्पुरते किंवा स्थायी) अशा प्रकारच्या अणुकेंद्रीय विक्रियेमध्ये अतिजड मूलद्रव्यांचे संश्लेषण करण्याचा संभव शिल्लक राहतो. प्रयोगशाळेत १९७० सालापासून जे प्रयोग करण्यात आले त्यांमध्ये हे उद्दिष्ट साध्य करता आलेले नाही. या सर्व घटनांचा विचार करता अतिजड मूलद्रव्यांचा शोध इतक्यात लागण्याचा संभव कमी दिसतो.
आणवीय इलेक्ट्रॉन विन्यास : अणुकेंद्राबाहेर फिरणाऱ्या इलेक्ट्रॉनांची संख्या अणुक्रमांकाएवढी असते आणि या संख्येवरून मूलद्रव्याचे रासायनिक गुणधर्म ठरविले जातात व त्याची जात पण निश्चित होते. या गोष्टीचा उल्लेख पूर्वी करण्यात आला आहे. दोन अणू एकमेकांजवळ आले असता त्यांमध्ये रासायनिक प्रक्रिया होऊन त्यायोगे विवक्षित संयुग निर्माण होणे शक्य आहे की नाही, हे या इलेक्ट्रॉनांवरूनच ठरत असते (विशेषतः अणूमधील सर्वांत दूर असणाऱ्या इलेक्ट्रॉनामुळे). याच कारणाकरिता समस्थानिक अणूंचे रासायनिक गुणधर्म जवळजवळ सारखेच असतात. अणूमध्ये निगडित असणाऱ्या इलेक्ट्रॉनांवर ⇨ पुंज सिद्धांताप्रमाणे काही कडक निर्बंध येतात. या सिद्धांतानुसार अणूच्या सभोवताली असणाऱ्या एकंदर अवकाशापैकी काही विशिष्ट मर्यादित अशा विभागामध्येच इलेक्ट्रॉन फिरू शकतात. चार पुंजांकांच्या साहाय्याने या निर्बंधांचे निर्देशन केले जाते. इलेक्ट्रॉन अणुकेंद्राच्या जितका जवळ जातो तितक्या प्रमाणात, त्याची ऊर्जा कमी होत जाते. अणुकेंद्रापासून एका ठराविक आंतरकक्षेत तो भ्रमण करू शकतो. याचा अर्थ असा होतो की, त्याला अणूमध्ये काही ठराविक उर्जा-पातळ्यांमध्येच रहावे लागते. या उर्जापातळ्यांव्यतिरिक्त असणारी ऊर्जामूल्ये इलेक्ट्रॉनाला धारण करता येत नाहीत. ज्या पुंजांकांच्या भिन्न मूल्यांमुळे या ऊर्जा-पातळ्या निश्चित होतात त्यांचे वर्णन खाली दिले आहे.
(१) n : या प्रधान पुंजांकामुळे अणूच्या आकारमानाचे (किंवा त्याच्या त्रिज्येचे) मूल्य ढोबळमानाने ठरविले जाते. आवर्त सारणीमधील मूलद्रव्यांकरिता याचे मूल्य १ ते ७ या मर्यादेत असते. यांपैकी n = १ अणुकेंद्राच्या सर्वांत जवळच्या इलेक्ट्रॉन निर्देशन करतो, तर n = ७ अणुकेंद्रापासून सर्वांत दूरचा इलेक्ट्रॉन दाखवितो. आणवीय इलेक्ट्रॉनाकरिता पृथक् व निश्चित ऊर्जेच्या अशा सात पातळ्या असतात. या सात ऊर्जा-पातळ्यांमधील इलेक्ट्रॉन अणुकेंद्रापासून सात निरनिराळ्या अंतरांवर असतात, असे म्हणता येते. यामुळे n या पुंजांकाने आणवीय इलेक्ट्रॉन ऊर्जा-पातळ्यांचे मोठ्या अंशात निर्देशन होते. अणुकेंद्रापासून सर्वांत दूर असे इलेक्ट्रॉन त्याच्याशी सर्वांत सैल अशा बंधनाने निगडित असतात. अशा इलेक्ट्रॉनांना संयुजा-इलेक्ट्रॉन असे म्हणतात. या इलेक्ट्रॉनांची ऊर्जा सर्वांत जास्त असल्यामुळे या इलेक्ट्रॉनांना अणूपासून मुक्त करण्याकरिता सर्वांत कमी ऊर्जा पुरवावी लागते. इलेक्ट्रॉनाला मुक्त केले असता शेष अणूचे धन विद्युत् भारित आयनामध्ये रूपांतर होते व या क्रियेमुळे एका आयन जोडीची निर्मिती होते. इलेक्ट्रॉन मुक्त करण्याकरिता जी अतिरिक्त ऊर्जा पुरवावी लागते तिचे मूल्य Vi या आयनीकरण विद्युत् वर्चस्वाच्या (पातळीच्या) स्वरूपात देतात (पहा कोष्टक क्र. १). या विद्युत् वर्चसामधून एक इलेक्ट्रॉन नेला असता इलेक्ट्रॉनाला जी ऊर्जा मिळते त्यावरून या ऊर्जेचे मापन करता येते.
(२) ι : इलेक्ट्रॉनाच्या गतिमार्गाकरिता उपलब्ध असणाऱ्या विशिष्ट घनफळाचा आकार ι या दुसऱ्या पुंजांक मूल्यावरून ठरत असतो. n व ι या पुंजांकांचे निर्देशन बऱ्याच वेळा अक्षराच्या स्वरूपात पण केले जाते. n = 1, 2, 3, … …, याकरिता K, L, M, … ही अक्षरे उपयोगात आणली जातात, तर ι = 0,1, 2, या किंमती अनुक्रमे s, p, d या अक्षरांनी निर्देशित केल्या जातात. n याच्या सापेक्ष ι याला 0,1, 2, …… n- lयांपैकी कोणतेही मूल्य असू शकते.
चुंबकीय पुंजांक (m) : एका ठराविक n व ι पुंजांकांच्या इलेक्ट्रॉनाकरिता m या पुंजांकाला – ι, -(ι –ι), …, (ι –ι), ι यांपैकी कोणतीही मूल्ये असू शकतात. m हा पुंजांक इलेक्ट्रॉनाचा एका ठराविक दिशेच्या सापेक्ष अवकाशातील त्याचा दिक् विन्यास निश्चित करीत असतो. [ ⟶ पुंजयामिकी].
इलेक्ट्रॉन परिवलन पुंजांक (परिवलनांक) : सर्व इलेक्ट्रॉन एकरूप असल्यामुळे त्यांच्याकरिता या पुंजांकाला फक्त ± 1/2एवढी दोनच मूल्ये असू शकतात. + 1/2परिवलन पुंजांक असणारा इलेक्ट्रॉन व – 1/2परिवलन पुंजांक असणारा इलेक्ट्रॉन यांच्या परिवलन अक्ष दिशा प्रतिसमांतर (समांतर परंतु विरुद्ध) असतात.
व्होल्फगांग पाउली यांच्या विवर्जन तत्त्वाप्रमाणे अणूमधील कोणत्याही दोन आणवीय इलेक्ट्रॉनांकरिता चारही पुंजांकांची मूल्ये एकसारखी असणे शक्य होत नाही. अणूमधील दोन इलेक्ट्रॉनांकरिता पहिल्या तीन पुंजांकांची मूल्ये एकच असून त्यांच्या परिवलन पुंजांकाच्या चिन्हामध्ये फरक असेल, तर ते दोन्ही इलेक्ट्रॉन एकाच भ्रमणकक्षेत किंवा कवचात आहेत, असे म्हटले जाते (कारण त्यांच्या ऊर्जामूल्यामध्ये फक्त थोडाच फरक असतो). पाउली मीमांसेप्रमाणे एका भ्रमणकक्षेत फक्त दोनच इलेक्ट्रॉन सामावू शकतात हे उघड होते. या सिद्धांताप्रमाणे n = 1 या पातळीमध्ये फक्त २, तर n = 2 मध्ये ८ इलेक्ट्रॉन सामावू शकतील असे दाखविता येते. अशा प्रकारे पाउली विवर्जन तत्त्वाचा उपयोग करून आवर्त सारणीमधील निरनिराळ्या मूलद्रव्यांमधील इलेक्ट्रॉन विन्यासाचे विशदीकरण करता येते. अणु केंद्राच्या सर्वांत बाहेर असणाऱ्या कवचामधील इलेक्ट्रॉनांवर [ ⟶ अणु व आणवीय संरचना] म्हणजेच संयुजा – इलेक्ट्रॉनांवर मूलद्रव्याचे रासायनिक, प्रकाशीय, वर्णपटवैज्ञानिक व विद्युत् गुणधर्म अवलंबून असतात. उदा., हीलियम या मूलद्रव्यामध्ये दोन इलेक्ट्रॉन असल्यामुळे त्याकरिता पहिले कवच (n = 1) संपृक्त (पूर्ण भरलेले) होते. निऑन या मूलद्रव्यामध्ये १० इलेक्ट्रॉन असल्यामुळे त्याकरिता n = 1 व n = 2 ही दोन्ही कवचे संपृक्त होतात. या कारणाकरिता हिलियम व निऑन यांना जवळजवळ शून्य प्रतीची रासायनिक क्रियाशीलता असते, असे स्पष्टीकरण मिळते. याच कारणाकरिता ही मूलद्रव्ये एकआणवीय (रेणूंमध्ये एकच अणू असलेल्या) स्वरूपात आढळतात व त्याचे गोठणबिंदू अतिशय नीच मूल्यांचे असतात (हीलियम गोठबिंदू – २७२·२० सें.).
संयुजा : काही थोडी मूलद्रव्ये सोडल्यास मूलद्रव्य अणूमध्ये सामान्यपणे दुसऱ्या अणूबरोबर रासायनिक संयोग करून संयुगे निर्माण करण्याची क्षमता असते. एका मूलद्रव्य अणूबरोबर संयोग करणारी हायड्रोजन अणूंची संख्या किंवा संयोगित होणाऱ्या ऑक्सिजन अणूंच्या संख्येच्या दुप्पट असणारी संख्या ही मूलद्रव्य अणूची संयुजा दाखविते. या नियमाप्रमाणे NH3, NO, NO2 या संयुजांमध्ये नायट्रोजन अणूची संयुजा अनुक्रमे ३, २, ४ एवढी आहे असे कळते. हायड्रोजन संयुजा +१ तर ऑक्सिजन संयुजा -२ आहे असे मानण्याची पण पद्धत आहे. या रीतीप्रमाणे कोणत्याही संयुगामध्ये धन व ऋण संयुजामूल्ये एकमेकांचे समतोलन करतात व त्यामुळे त्यामध्ये परिणामी संयुजामूल्य शून्य असावयास पाहिजे हे महत्त्वाचे तत्त्व स्पष्ट होते. बऱ्याच अणूंना एकापेक्षा अधिक संयुजामूल्ये मिळतात. यांपैकी प्रधान संयुजामूल्याचाच संबंध आवर्त सारणीमधील त्या अणूचे स्थान किंवा त्याच्या अंतर्गत इलेक्ट्रॉनाच्या विशिष्ट रचनेशी जोडता येतो. आधुनिक मीमांसेप्रमाणे संयुजेचे विशदीकरण करण्याकरिता जे तत्त्व वापरले जाते ते असे : सर्व मूलद्रव्ये त्यांच्या बाहेरच्या कवचात आठ इलेक्ट्रॉन संख्या (हायड्रोजन अणूकरिता ही संख्या दोन आहे) कोणत्या तरी प्रकारे आणण्याकरिता प्रयत्नशील असतात. हे उद्दिष्ट साध्य करण्याकरिता एक अणू दुसऱ्या अणूबरोबर परस्परक्रियेद्वारे आपल्या अतिरिक्त इलेक्ट्रॉनाचा त्याग तरी करतो किंवा कमी पडत असलेल्या इलेक्ट्रॉनाचे अपहरण करतो व हे जर शक्य नाही झाले, तर दोन्ही अणू इलेक्ट्रॉनाचा समाईकपणे वापर करताना आढळतात. वर्ग केलेला इलेक्ट्रॉन किंवा समाईक तऱ्हेने वापर केलेला इलेक्ट्रॉन यामुळे हे दोन अणू संबंधित होऊन त्यांमध्ये एक आकर्षणी बंध निर्माण होतो. क्रियेच्या स्वरूपानुसार बंधाचे दोन मुख्य प्रकार पडतात.
(१) विद्युत् संयुजा : या प्रकारच्या क्रियेमध्ये एका अणूपासून दुसऱ्या अणूकडे इलेक्ट्रॉनाचे प्रत्यक्ष स्थानांतरण केले जाऊन दोन्ही अणूंमध्ये इलेक्ट्रॉन अष्टक (किंवा हायड्रोजन अणूमध्ये दोन) निर्माण करण्याचे उद्दिष्ट साध्य करण्यात येते. उदा., सोडियम अणूमध्ये संपृक्त इलेक्ट्रॉन अष्टक कवचानंतरच्या पुढील अंतिम कवचात फक्त एकच इलेक्ट्रॉन असतो. याउलट क्लोरीन अणूमधील शेवटच्या कवचात सात इलेक्ट्रॉन असतात. सोडियम व क्लोरीन अणू एकमेकांच्या जवळ आले म्हणजे सोडियम अणू एक इलेक्ट्रॉन गमावतो म्हणजे त्या अणूजवळ संपृत्त्क इलेक्ट्रॉन अष्टक असलेले कवच राहते, तर क्लोरिनाला एक अतिरिक्त इलेक्ट्रॉन मिळून त्याच्या शेवटल्या कवचामध्ये पूर्ण इलेक्ट्रॉन अष्टक प्रस्थापित होते. इलेक्ट्रॉनाच्या स्थानांतरणामुळे सोडियम आणि क्लोरीन अणूंचे Na+ व Cl–अशा आयनांमध्ये अनुक्रमे रूपांतरण होते. या आयनांमध्ये त्यांच्या विरुद्ध तऱ्हेच्या विद्युत् भारांमध्ये जी आकर्षणी प्रेरणा मिळते तीमुळे त्यामधील रासायनिक बंध निर्माण होतो. अशा प्रकारच्या बंधामध्ये दिशिक परिणाम दिसत नाही. यापैकी Na+ स्थिर असून, Cl–हा आयन त्याभोवती एकाच अंतरावर पण निरनिराळ्या सापेक्ष दिशेत असेल, तरी त्यांमधील आकर्षणी प्रेरणेत बदल होणार नाही, असा याचा अर्थ होतो.
(२) सहसंयुजा : या प्रकारच्या अणुबंधामध्ये कार्यकारी तत्त्वाचे स्वरूप तेच असते म्हणजे प्रत्येक अणू त्याच्या सर्वांत बाहेरच्या कवचात इलेक्ट्रॉन अष्टक (हायड्रोजनामध्ये दोन) प्रस्थापित करण्याचा प्रयत्न करीत असतो पण या प्रकारात एका अणूपासून दुसऱ्या अणूकडे इलेक्ट्रॉन प्रत्यक्षात वर्ग होत नाही. या प्रकारचा बंध हायड्रोजन रेणूमधील दोन हायड्रोजन अणूंमध्ये मिळतो. दोन इलेक्ट्रॉनयुक्त असे कवच करण्याच्या प्रयत्नात दोन्ही अणू दोन्ही इलेक्ट्रॉनांचा समाईकपणे वापर करू लागतात. त्यामुळे कोणत्याही क्षणी एका अणूजवळ दोन इलेक्ट्रॉन, तर दुसऱ्यापाशी शून्य ही परिस्थिती किंवा याच्या बरोबर उलटी परिस्थिती निर्माण होते, असे मानले जाते. या प्रकाराच्या प्रतिरूपात दोन्ही इलेक्ट्रॉन दोन्ही अणूंभोवती भ्रमण कक्षेत फिरत आहेत अशी कल्पना करता येते. वर दिलेली वर्णने प्रत्यक्ष विक्रियेची सुलभ करून दिलेली विवेचने होत, हे लक्षात ठेवणे आवश्यक आहे. त्यांचे अचूक वर्णन पुंज सिद्धांताचा उपयोग करूनच देता येते. [ ⟶ संयुजा पुंज रसायनशास्त्र].
आणवीय आकारमान : एकाकी अणूभोवती असणाऱ्या इलेक्ट्रॉन मेघाची घनता फक्त अनंत अंतरावर शून्य होत असल्यामुळे आपण जेव्हा आणवीय त्रिज्येविषयी विवरण करू लागतो तेव्हा या संकल्पनेत स्वेच्छ असा बराच भाग आहे, हे आपल्या ध्यानात येते. एषणी (अणूमध्ये प्रविष्ट करून त्याचे मोजमाप करण्यासाठी वापरता येणारी प्रयुक्ती) गृहीत धरून तिच्या संदर्भात अणुत्रिज्येचे निर्देशन करणे हे त्यामुळे जास्त सयुक्तिक असे दिसते. अणुकेंद्रापासून ज्या निकटतम अंतरापर्यंत एषणी जाऊ शकते त्या अंतरास अणुत्रिज्या असे म्हणतात. त्रिज्येचे मूल्य वापरलेल्या एषणीच्या स्वरूपावर अवलंबून राहील हे स्पष्ट आहे. एषणी म्हणून त्याच मूलद्रव्याचा अणू वापरता येईल किंवा त्याच्या समीप असणाऱ्या रेणूमधील दुसऱ्या जातीच्या अणूचा पण उपयोग करता येईल किंवा स्फटिकामध्ये त्याच्या निकट असणाराभिन्न अणू पण वापरता येईल ⇨ द्रव्याच्या गत्यात्मक सिद्धांताप्रमाणे आदर्श वायूमधील अणूंमध्ये आंतरक्रिया नगण्य स्वरूपाची असते आणि त्यामधील अणू कठीण, स्थितिस्थापक (विकृती निर्माण) करणारी प्रेरणा काढून घेतल्यावर मूळ आकार धारण करणाऱ्या गोलकाप्रमाणे एकमेकांबरोबर आघात करतात. प्रत्यक्षात असा आदर्श वायू मिळत नाही. त्यामध्ये आंतरक्रिया होत असते. याचा विचार प्रथम व्हॅन डर व्हाल्स यांनी केला. वायू, घन व द्रव यांपैकी कोणत्याही अवस्थेत असणाऱ्या अणूचा विचार केला, तरी त्यामध्ये आंतरक्रिया नगण्य नसते असे कळते. अणु-अणूंमधील आंतरक्रियेच्या स्वरूपावरून अणुत्रिज्येचे मूल्य ठरत असते असे म्हणता येते. संयुगामधील रेणूची त्रिज्या जर त्यामधील घटक अणूंच्या त्रिज्यांच्या बेरजेबरोबर असेल, तरच या संकल्पनेचा उपयोग केल्याने आकलनास मदत होते. प्रत्यक्षात ही अट फक्त ढोबळमानाने पुरी केली जाते असे आढळते.एकाच अणूची त्रिज्या ही निरनिराळ्या रेणूंकरिता निरनिराळे मूल्य दाखविते, असे प्रयोगाने आढळून येते. या गोष्टीवरून अणुत्रिज्या या संकल्पनेच्या मर्यादा लक्षात येतात. आणवीय त्रिज्येमध्ये खालील चार प्रकार आढळतात.
(१) व्हॅन डर व्हाल्स त्रिज्या : परस्पर अबंधित विद्युत् भाररहित अणू एकमेकांच्या जवळ ज्या निकटतम अंतरापर्यंत येऊ शकतात त्यास व्हॅन डर व्हाल्स अणुत्रिज्या असे म्हणतात. अक्रिय वायूंखेरीज इतर द्रव्यांत या त्रिज्येचे मापन करणे सोपे नसते. प्रयोगाने आढळलेली त्रिज्यामूल्ये ढोबळमानाने ऋण विद्युत् भार असणाऱ्या आयन त्रिज्यां एवढी असतात असे आढळते. या व्याख्येमध्ये एकमेकांच्या जवळ येणारे अणू विद्युत् भाररहित आहेत व ते एकमेकांबरोबर रासायनिक बंध निर्माण करीत नाहीत, असे मानलेले आहे. अणुत्रिज्येएवढ्या अंतरावर दोन अणू आले असता त्यांमधील इलेक्ट्रॉनांमध्ये मिळणाऱ्या अपकर्षण प्रेरणेचे समतोलन एका अणूचे अणुकेंद्र व दुसऱ्या अणूचा इलेक्ट्रॉन यांमधील आकर्षण प्रेरणेमुळे पण होते.
(२) आयनी त्रिज्या : परस्पर अबंधित आयनीकृत दोन अणू एकमेकांच्या ज्या निकटतम अंतरापर्यंत येऊ शकतात त्यावरून त्यांची आयनी त्रिज्या निश्चित होते. घन स्फटिकामधील आयनाकरिता ही त्रिज्या निःसंदिग्धपणे मोजता येते. आवर्त सारणीमधील क्रमाने येणाऱ्या मूलद्रव्यांकरिता या त्रिज्येचे मूल्य सामान्यपणे सरळ प्रमाणात बदलताना आढळते. आयनी त्रिज्येइतक्या अंतरावर दोन अणू एकमेकांजवळ आले असता दोन आयनांमधील आकर्षणी प्रेरणेचे समतोलन अणूमधील इतर अबंधक इलेक्ट्रॉनांमध्ये मिळणाऱ्या अपकर्षणी प्रेरणेमुळे पण होऊ शकते.
(३) सहसंयुजी त्रिज्या : सहसंयुजी बंध निर्माण करणारे बंधक इलेक्ट्रॉन ज्या अणूंकरिता प्रकर्षाने स्थानांकित असतात, असे अणू ज्या निकटतम अंतरापर्यंत एकमेकांजवळ येऊ शकतात त्यावरून सहसंयुजी त्रिज्या मिळविता येते. या प्रकारच्या बंधामध्ये बंधक इलेक्ट्रॉन दोन अणूंमध्ये समाईकपणे वापरला जात असला, तरी तो धातवीय इलेक्ट्रॉनाप्रमाणे मुक्त नसतो. या दोन अणूंमधील काही ठराविक भागाच्या बाहेर तो जाऊ शकत नाही अथवा तो त्या विभागामध्ये स्थानांकित होत असतो. बंधक इलेक्ट्रॉन व दोन अणुकेंद्रे यांमधील आकर्षणी प्रेरणेचे समतोलन दोन अणूंच्या अबंधक इलेक्ट्रॉनांमध्ये मिळणाऱ्या अपकर्षणी प्रेरणेमुळे पण होते.
(४) धातवीय त्रिज्या : एकाच मूलद्रव्याच्या स्फटिकामधील अणूअणूंमध्ये जी आंतरक्रिया होते तीकरिता ही त्रिज्या विशेष उपयुक्त असते. धातूंमधील धन विद्युत् भारवाही आयन एकमेकांशेजारी असून त्यांमध्ये संवहन पट्टामधील गतिशील इलेक्ट्रॉनांमुळे बंधन निर्माण केले जाते. अशा बंधक इलेक्ट्रॉनाला अस्थानांकित असे म्हणतात. कारण हा इलेक्ट्रॉन धातुजालकामध्ये एका आयनाच्या प्रभावी क्षेत्रामधून दुसऱ्या आयनाच्या क्षेत्रामध्ये मुक्तपणे हालचाल करू शकतो. सहसंयुजी बंध निर्माण करणारे इलेक्ट्रॉन ज्या अणूंकरिता अस्थानांकित असतात असे अणू ज्या निकटतम अंतरापर्यंत एकमेकांजवळ पोहोचू शकतात त्यावरून धातवीय त्रिज्या निश्चित होते. या प्रकारची त्रिज्या फक्त धातवीय अणूंच्या बाबतीत सार्थ असते हे उघड आहे.
कोष्टकांसंबंधी खुलासा : कित्येक मूलद्रव्यांच्या अणुभाराच्या बाबतीत काही प्रमाणात अनिश्चितता आढळते. निसर्गात आढळणाऱ्या मूलद्रव्यामध्ये फक्त एकाच प्रकारचे अणू आहेत असे सामान्यपणे आढळत नाही. निरनिराळ्या समस्थानिक अणूंचे एका ठराविक टक्केवारीने झालेले मिश्रण असे त्यांचे स्वरूप असते. अशा मिश्रणापासून प्रयोगाने मिळालेला अणुभार हा त्यामध्ये असणाऱ्या समस्थानिकांच्या अणुभारांचे सरासरी मूल्य दर्शवितो. त्यामुळे ज्या स्थानापासून मूलद्रव्य मिळालेले असते त्यानुसार त्याच्या अणुभार मूल्यात थोडा फार फरक पडू शकतो. [ ⟶अणुभार].
कोष्टक क्र. २ मध्ये प्रत्येक मूलद्रव्याच्या ज्ञात स्थिर समस्थानिकांची द्रव्यमानांक मूल्ये दिली असून त्यांची निसर्गात आढळणारी विपुलता टक्केवारीच्या स्वरूपात कंसात दाखविली आहे.
विविध मूलद्रव्यांच्या ज्ञात किरणोत्सर्गी समस्थानिकांची द्रव्यमानांक मूल्ये कोष्टकात दिली असून त्याजवळील कंसात त्यांच्या उत्स्फूर्त विघटन क्रियेत उत्सर्जित होणाऱ्या किरणांची नावे दिली आहेत.
मूलद्रव्यांची वैश्विक, सूर्यकुल व पृथ्वीकवच विपुलता मूल्ये दिली आहेत. निरनिराळ्या शास्त्रज्ञांनी यांकरिता दिलेल्या मूल्यात बरीच तफावत आढळते. काही वेळा एक उपलब्ध मूल्य दुसऱ्या मूल्याच्या दहापटींनी सुद्धा जास्त असू शकते, हे लक्षात घेणे आवश्यक आहे.
कोष्टक क्र. १ मध्ये विविध मूलद्रव्यांकरिता पहिली आयनीकरण वर्चस् मूल्ये दिली आहेत. अणूमधील केंद्रापासून सर्वांत दूर असणाऱ्या संयुजा इलेक्ट्रॉनाला मुक्त करण्याकरिता लागणारी ऊर्जा यायोगे निर्देशित केली जाते. या मूल्यावरून द्रव्याची रासायनिक क्रियाशीलता व विद्युत् गुणधर्म यांविषयी कल्पना मिळू शकते.
कोष्टकामध्ये मूलद्रव्य घनता ही सामान्यपणे २०० से. या कोठी तापमानाकरिता दिली आहे. मात्र हायड्रोजन, नायट्रोजन इ. वायूंकरिता ही घनता त्यांच्या घन अवस्थेकरिता दिली असून, तद्नुरूप तापमाने तेथील कंसामध्ये दिली आहेत.
घनता व पदार्थांच्या वितळबिंदू मूल्यावरून पदार्थ अणूमधील असणाऱ्या बंधन प्रेरणेविषयी अंदाज करता येतो. मूलद्रव्याच्या (विशेषतः धातूच्या) वितळबिंदू व उकळबिंदू या मूल्यांची माहिती त्याच्या औद्यागिक उपयुक्ततेच्या दृष्टीने पण महत्त्वाची असते.
मूलद्रव्यांची घनता, वितळबिंदू व उकळबिंदू आणि चुंबकीय प्रवणता [ ⟶ चुंबकत्व] यांवरून त्याच्या अणूची संरचना व मूलद्रव्याच्या अणू-अणूंमधील बंधक प्रेरणा यांविषयी माहिती मिळविता येते. उपान्त्य अपूर्ण कक्षेमधील इलेक्ट्रॉन वितरणामुळे पदार्थांच्या चुंबकीय गुणधर्मावर मोठा परिणाम होतो असे आढळते. मूलद्रव्याची चुंबकीय प्रवणता मूल्ये कोष्टकामध्ये दिली आहेत. पदार्थाचे रासायनिक व विद्युत् गुणधर्म त्यामधील संयुजा-इलेक्ट्रॉनांमुळे मोठ्या प्रमाणात ठरविले जातात.
प्रत्येक मूलद्रव्याकरिता वैशिष्ट्यपूर्ण तरंगलांबीची एक तीव्रतम वर्णपटरेषा असते, त्यामुळे पदार्थाच्या उत्सर्जन वा शोषण वर्णपटातील या तीव्रतम वर्णपटरेषेच्या साहाय्याने त्यामधील मूलद्रव्याची ओळख करून घेता येते. सूर्यावरील वातावरणात हीलियम या मूलद्रव्याचे अस्तित्व याच पद्धतीने प्रस्थापित करण्यात आले.
| कोष्टकक्र १. मूलद्रव्ये व त्यांचे भौतिक गुणधर्म | |||||||||
| मूलद्रव्य | चिन्ह | अणु
क्रमांक |
अणुभार | वैश्विक विपुलता(c.a.u.) | सूर्यकुलविपुलता
(c.a.u.) |
पृथ्वीकवचविपुलता* | अणुत्रिज्या (Å) | आयनी त्रिजा (Å) | संयुजा |
| १ | २ | ३ | ४ | ५ | ६ | ७ | ८ | ९ | १० |
| हायड्रोजन | H | १ | १·००७९७ | २·६X१०१० | ४·८X१०१० | – | ०·३७ | – | १ |
| हीलियम | He | २ | ४·००२६ | ४·१X१०९ | ३·९X१०९ | ०·००३ | ०·९३ | – | ० |
| लिथियम | Li | ३ | ६·९३९ | ४५ | १६ | ६५ | १·५२ | ०·६० | १ |
| बेरिलियम | Be | ४ | ९·०१२२ | ०·६९ | ०·८१ | ६ | १·११ | ०·३१ | २ |
| बोरॉन | B | ५ | १०·८११ | २४ | ६·२ | ३ | ०·८८ | ०·२० | ३ |
| कार्बन | C | ६ | १२·०१११५ | १·३५X१०७ | १·७X१०७ | ३२० | ०.७७ | ०·१५ | ±४,२ |
| नायट्रोजन | N | ७ | १४·००६७ | २·४४X१०६ | ४·६X१०६ | ४६ | ०·७० | ०·७१ | -३, ५, २ |
| ऑक्सिजन | O | ८ | १५·९९९४ | २·३६X१०७ | ४·४X१०७ | ४६६००० | ०·६६ | ०·४० | -२ |
| प्ल्युओरीन | F | ९ | १८·९९८४ | १६०० | २५०० | -९०० | ०·६४ | ०·३६ | -१ |
| निऑन | Ne | १० | २०·१८३ | ८·६X१०६ | ४·४X१०६ | ०·००००७ | १·१२ | – | ० |
| सोडियम | Na | ११ | २२·९८९८ | ६·३२X१०४ | ३·५X१०४ | २८३०० | १·८६ | ०·९५ | १ |
| मॅग्नेशियम | Mg | १२ | २४·३१२ | १·०५०X१०६ | १·०४X१०६ | २९०० | १·६० | ०·६५ | २ |
| ॲल्युमिनियम | Al | १३ | २६·९८१५ | ८·५१X१०४ | ८·४X१०४ | ८१३०० | १·४३ | ०·५० | ३ |
| सिलिकॉन | Si | १४ | २८·०८६ | १X१०६ | १X१०६ | २७७२०० | १·१७ | ०·४१ | ४ |
| फॉस्फरस | P | १५ | ३०·९७३८ | १·२७X१०४ | ८१०० | ११८० | १·१० | २·१२ | ५, ± ३ |
| गंधक | S | १६ | ३२·०६४ | ५·०६X१०५ | ८X१०५ | ५२० | १·०४ | १·८४ | ६, ४,-२ |
| क्लोरीन | Cl | १७ | ३५·४५३ | ९X१०३ | २१०० | ३१४ | ०·९९ | १·८१ | ±१, ७,५ |
| आर्गॉन | Ar | १८ | ३९·९४८ | १·५X१०५ | ३·४X१०५ | ०·०४ | १·५४ | – | ० |
| पोटॅशियम | K | १९ | ३९·१०२ | ३२४० | २१०० | २५९०० | २·३१ | १·३३ | १ |
| कॅल्शियम | Ca | २० | ४०·०८ | ७·३६X१०४ | ७·२X१०४ | ३६३०० | १·९७ | ०·९९ | २ |
| स्कॅंडियम | Sc | २१ | ४४·९५६ | ३३ | ३५ | ५ | १·६० | ०·८१ | ३ |
| टिटॅनियम | Ti | २२ | ४७·९० | २३०० | २४०० | ४४०० | १·४६ | ०·६४ | ४,३ |
| व्हॅनेडियम | V | २३ | ५०·९४२ | ९०० | ५९० | १५० | १·३१ | ०·४ | ५, ४,२ |
| कोष्टकक्र १. मूलद्रव्ये व त्यांचे भौतिक गुणधर्म | |||||||
| पहिले आयनीकरण वर्चस्(इलेक्ट्रॉनव्होल्ट) | चुंबकीय
प्रवणता |
वितळबिंदू/गोठणबिंदू(० से.) | उकळबिंदू
(० से.) |
घनता(ग्रॅ./सेंमी.३)(२०० से.तापमान) | रंग व कोठीतापमानालाअवस्था | वर्णपटातीलतीव्रतम रेषेचीतरगलांबीÅ | संशोधक व शोधवर्ष |
| ११ | १२ | १३ | १४ | १५ | १६ | १७ | १८ |
| १३.६ | -१·९८ | -२५९·०६ | -२५२·७६ | ०·०७
(-२५३० से.) |
रंगहीन, वायू | १२१५·६६ | एच्. कॅव्हेंडिश (१७६६) |
| २४·६ | -०·४७ | -२७२·२ | -२६८·९ | ०·००१८० | रंगहीन, वायू | ५८४·३३ | डब्ल्यू.रॅग्झी, पी.टी.प्लेव्हे वएन्. लॅंग्ली (१८९५) |
| ५·४ | – | १८६ | १३३६ | ०·५३ | पांढरा, घन☨ | ६७०७·८५ | जे. आर्फव्हेडसन (१८१७),
आर्. बन्सन(१८५५) ए. मॅथिसन(१८५५) |
| ९·३ | – | १२८० | १५०० | १·८६ | पांढरा, घन☨ | २३४८·६१ | एल्.एन्. व्होक्लँ (१७९८) |
| ८·३ | – | २३०० | २५५० | २·३३ | काळा, घन | २४९७·७३ | डब्ल्यू. हॉमबर्ख(१७०२),
जे.एल्.गे-ल्यूसॅक व एल्. थेनार्ड (१८०८) |
| ११·३ | -३·५ | ३५७० | ३४७० | २·२२ (ग्रॅफाइट)/
३·५१(हिरा) |
काळा, घन /
पारदर्शक स्फटिक |
१६५७·०१ | प्राचीन |
| १४·५ | -०·४३ | -२१० | -१९६ | ०·८१०
(-१९६० से) |
रंगहीन, वायू | ११३४·९८ | डी.रदरफर्ड (१७७२) |
| १३·६ | १०६·३ | -२१९ | -१८३ | १·१३
(-१८४० से) |
रंगहीन, वायू | १३०२·१९ | जे.प्रीस्टली (१७७४) |
| १७·४ | – | -२२३ | -१८७ | १·१०८(द्रव)
(-१८७० से) |
पिवळसर,वायू | ९५४·८० | एच् म्वासां (१८८६) |
| २१·६ | -०·३३ | -२४८·६७ | -२४५·९ | ०·००९ | रंगहीन, वायू | ७३५·८९ | डब्ल्यू. रॅम्झी व एम्.डब्ल्यू.ट्रॅव्हर्झ (१८९८) |
| ५·१ | ०·६० | ९७·५ | ८८० | ०·९७ | पांढरा, घन☨ | ५८८९·९५ | एच्.डेव्ही (१८०७) |
| ७·६ | – | ६५० | ११०० | १·७४ | करडा, घन☨ | २८५२·१३ | एन्.ग्रू (१६९५) |
| ६·० | ०·६५ | ६६० | २२७० | २·७० | पांढरा, घन☨ | ३९६१·५३ | एच्.सी.ओर्स्टेड (१८२५) |
| ८·२ | -०·१३
(१८० से.) |
१४१४ | २३५५ | २·३३ | करडा, घन धात्वाभ | २५१६·११ | जे. बर्झीलियस (१८२४) वसॅन्तक्लेअर दव्हिल (१८५४) |
| ११·० | – | ४४·१(W) | २८० | १·८२ | तांबडा किंवा पांढरा घन | १७७४·९४ | एच्.ब्रांट (१६६९) |
| १०·४ | -०·४९ | ११९ | ४४५ | २·०६ | पिवळा, घन | १८०७·३१ | प्राचीन, ए.लव्हॉयझर(१७७७) |
| १३·० | – | -१०२ | -३५ | ०·००३२१ | हिरवट, वायू | १३४७·२ | के.डब्ल्यू.शेले व ए. लव्हॉयझर (१७७४) |
| १५·८ | -०·४८ | -१८९·२ | -१८५·७० | ०·००१८ | रंगहीन, वायू | १०४८·२२ | डब्ल्यू. रॅम्झी व जे. डब्ल्यू.
रॅली (१८९४) |
| ४·३ | ०·५२ | ६२·३ | ७६० | ०·८६ | पांढरा, घन☨ | ७६६४·९१ | एच्.डेव्ही (१८०७) |
| ६·१ | – | ८१० | १३०० | १·५५ | पांढरा, घन☨ | ४२२६·७३ | एच्.डेव्ही (१८०८) |
| ६·५ | – | १२०० | २४०० | ३ | पांढरा, घन☨ | ३९११·८१ | एल्.एफ्. निल्सॉन(१८७९), डी.मेंडेलेव्ह(१८६८) |
| ६·८ | – | १६६० | > ३००० | ४·५ | पांढरा, घन☨ | ३९९८·६४ | डब्ल्यू. ग्रेगर (१७९१) |
| ६.७ | १·४० (१८० से.) | १७१० | ३००० | ६·० | पांढरा, घन☨ | ४३७९·२४ | एन्.जी.सॅव्हस्ट्रम (१८३०),एफ्. व्हलर (१८३०) |
| कोष्टक क्र. १ (चालू) | |||||||||
| १ | २ | ३ | ४ | ५ | ६ | ७ | ८ | ९ | १० |
| क्रोमियम | Cr | २४ | ५१·९९६ | १·२४X१०४ | १·२४X१०४ | २०० | १·२५ | ०·५२ | ६,३,२ |
| मॅंगॅनीज | Mn | २५ | ५४·९३८० | ८८०० | ६२०० | १००० | १·२९ | ०·८० | ७,४,२,६,३ |
| लोखंड | Fe | २६ | ५५·८४७ | ८·९०X१०५ | २·५X१०५ | ५०००० | १·३६ | ०·७५ | ३,२ |
| कोबाल्ट | Co | २७ | ५८·९३३२ | २३०० | १९०० | २३ | १·२६ | ०·७२ | ३,२ |
| निकेल | Ni | २८ | ५८·७१ | ४·५७X१०४ | ४·५X१०४ | ८० | १·२४ | ०·७० | २,३ |
| तांबे | Cu | २९ | ६३·५४ | ९१९ | ४२० | ७० | १·२८ | ०·९६ | २,१ |
| जस्त | Zn | ३० | ६५·३७ | १५०० | ६३० | १३२ | १·३३ | ०.७४ | २ |
| गॅलियम | Ga | ३१ | ६९·७२ | ४५·५ | २८ | १५ | १·२२ | ०·६२ | ३ |
| जर्मेनयम | Ge | ३२ | ७२·५९ | १२६ | ७६ | ७ | १·२२ | ०·५३ | ४ |
| अर्सेनिक | As | ३३ | ७४·९२१६ | ४ | ३·८ | ५ | १·२१ | २·२२ | ५,±३ |
| सिलिनियम | Se | ३४ | ७८·९६ | ६८ | २७ | ०·०९ | १·१७ | १·९८ | ६,४,-२ |
| ब्रोमीन | Br | ३५ | ७९·९०९ | १३ | ५·४ | १·६ | १·१४ | १·९५ | ±१,५ |
| क्रिप्टॉन | Kr | ३६ | ८३·८० | ५१ | २५ | – | १·६९ | – | ० |
| रुबिडियम | Rb | ३७ | ८५·४७ | ५·९५ | ४·१ | ३१० | २·४४ | १·४८ | १ |
| स्ट्राँशियम | Sr | ३८ | ८७·६२ | ५८·४ | २५ | ३०० | २·१५ | १·१३ | २ |
| इट्रियम | Y | ३९ | ८८·९०५ | ४·६० | ४·७ | २८ | १·६२ | – | ३ |
| झिर्कोनियम | Zr | ४० | ९१·२२ | ३० | २३ | २२० | १·५७ | ०·८७ | ४ |
| निओबियम | Nb | ४१ | ९२·९०६ | १·१५ | ०·९० | २४ | १·४३ | ०·६९ | ५,३ |
| मॉलिब्डेनम | Mo | ४२ | ९५·९४ | २·५२ | २·५ | ˜१५ | १·३६ | ०·६२ | ६,३,५ |
| टेक्नेशियम | Tc | ४३ | [९९] | – | – | – | १·३ | – | ७ |
| रुथेनियम | Ru | ४४ | १०१·०७ | १·६ | १·८३ | ०·००१ | १·३३ | ०·८१ | ३,४,६,८ |
| ऱ्होडियम | Rh | ४५ | १०२·९०५ | ०·३३ | ०·३३ | ०·००१ | १·३४ | ०·८० | ३,४ |
| पॅलॅडियम | Pd | ४६ | १०६·४ | १·५ | १·३३ | ०·०१३ | १·३८ | ०·५० | २,४ |
| चांदी | Ag | ४७ | १०७·८७० | ०·५ | ०·३३ | ०·१ | १·४४ | १·२६ | १ |
| कॅडमियम | Cd | ४८ | ११२·४० | २·१२ | १·२ | ०·१३ | १·४९ | ०·९७ | २ |
| इंडियम | In | ४९ | ११४·८२ | ०·२१७ | ०·१० | ०·१ | १·६२ | ०·८१ | ३ |
| कथिल | Sn | ५० | ११८·६९ | ४·२२ | १·७ | ४० | १·४ | ०·७१ | ४,२ |
| अँटिमनी | Sb | ५१ | १२१·७५ | ०·३८१ | ०·२० | १ | १·४१ | ०·६२ | ३,५ |
| टेल्यूरियम | Te | ५२ | १२७·६० | ४·७ | ३·१ | ०·००२ | १·३७ | २·२१ | ४,६,-२ |
| क्र. १. चालू | |||||||
| ११ | १२ | १३ | १४ | १५ | १६ | १७ | १८ |
| ६·८ | ३·६ (१८० से) | १६०० | २२०० | ६·९ | पांढरा, घन☨ | ३५७८·६९ | एल्.एन्.व्होग्लॅं (१७९७) |
| ७·४ | ९·९(१८० से) | १२६० | १९०० | ७·४ | करडा, घन☨ | ४०३०·७६ | जे जी गान (१७७४) |
| ७·९ | लो. चुं. | १५३५ | ३००० | ७·९ | पांढरा, घन☨ | ३७३४·८७ | प्राचीन |
| ७·९ | लो. चुं. | १४९० | ३००० | ८·९ | करडा, घन☨ | ३४५३·५० | ए.एफ्.क्रून्स्टेट (अंदाजे १७५०) |
| ७·६ | लो. चुं. | १४५० | २९०० | ८·९ | पांढरा, घन☨ | ३४१४·७६ | ए.एफ्.क्रून्स्टेट (अंदाजे १७५०) |
| ७·६ | -०·०९ | १०८३ | २३०० | ८·९ | तांबडा, घन☨ | ३२४७·५४ | प्राचीन |
| ९·४ | – | ४१९ | ९०७ | ७·१ | पांढरा, घन☨ | २१३८·५६ | पॅरासेल्सस (सोळावे शतक), जे.एफ्. हेंगकेल (१७२०) |
| ६·० | – | २९·८ | २०७० | ५·९३ | करडा, घन☨ | ४१७२·०६ | एल्.द ब्वाबोद्राँ(१८७५) |
| ८·१ | – | ९५८ | २७०० | ५·३६ | करडा, घन☨ | २६५१·१८ | सी.विंक्लर(१८८६), डी. मेंडेलेव्ह (१८७१) |
| ९·८ | -०·३१
(१८० से) |
८१४ | ६१० | ५·७ | करडा, घन | १८९०·४३ | प्राचीन ए. मॅग्नस (१२५०),जी. ब्रॉट (१७३३) |
| ९·८ | – | २१७ | ६८५ | ४·८० | तांबडा / करडा, घन | १९६०·९१ | जे.बर्झीलियस (१८१७) |
| ११·८ | – | -७·३ | ५९ | ३·१ | तपकिरी, द्रव | १४८८·४ | ए.जे.बालार (१८२६) |
| १४·० | – | -१५७ | -१५२·९ | ०·००३७१ | रंगहीन, वायू | १२३५·८२ | डब्ल्यू. रॅग्झी व एम्.डब्ल्यू.ट्रॅव्हर्झ (१८९८) |
| ४·२ | – | ३८·५ | ७०० | १·५३ | पांढरा, घन☨ | ७८००·२३ | आर्.वन्सन व जी.आर्किरखोफ (१८६१) |
| ५·७ | – | ८०० | १३०० | २·६ | पांढरा, घन☨ | ४६०७·२३ | के.डब्ल्यू.शेले (१७९७),एच्.डेव्ही (१८०८) |
| ६·४ | – | १४९० | २५०० | ५·५ | पांढरा, घन☨ | ४१०२·३८ | जे.गॅडोलिन (१७९४),सी जी मूसांडर (१८४३) |
| ६·८ | – | १८६० | >२९०० | ६·४ | पांढरा, घन☨ | ३६०१·१९ | एम्.एच्.क्लापरोट (१७८९) |
| ६·९ | – | १९५० | ३३०० | ८·६ | करडा, घन☨ | ४०५८·९४ | सी.हॅचेट (१८०१) |
| ७·१ | – | २६२० | ३७०० | १०·२ | पांढरा, घन☨ | ३७९८·२५ | के.डब्ल्यू.शेले (१७७८) व पी.जे.थेल्म (१७८२) |
| ७·३ | – | २१०० | ४६०० | ११·५ | करडा, घन☨ | ३६३६·१० | सी.पेऱ्येव ई. सेग्रे (१९३७) |
| ७·४ | – | २४५० | >२७०० | १२·४ | करडा, घन☨ | ३७२८·१३ | सी.ई. क्लाउस (१८४४) |
| ७·५ | – | १९७० | ३७२७ | १२·४ | पांढरा, घन☨ | ३६९२·३६ | डब्ल्यू. क्लस्टन (१८०३) |
| ८·३ | – | १५५० | २२०० | १२·० | पांढरा, घन☨ | ३४०४·५८ | डब्ल्यू. क्लस्टन (१८०३) |
| ७.६ | -०·२० | ९६१ | १९५० | १०·५ | पांढरा, घन☨ | ३२८०·६८ | प्राचीन |
| ९.० | – | ३२१ | ११७० | ८·७ | पांढरा, घन☨ | २२८८·०२ | एफ्. श्ट्रोमायर (१८१७) |
| ५·८ | – | १५७ | १४५० | ७·२९ | पांढरा, घन☨ | ४५११·३२ | एफ्. राइश व टी. रिक्टर (१८६३) |
| ७·३ | – | २३२ | २३६२ | ७·३१ | पांढरा, घन☨ | २८३९·९९ | प्राचीन प्लिनी, गेबर |
| ८.६ | -०·८७
(१८० से) |
६३० | १३८० | ६·६ | करडा, घन☨ | २५९८·०५ | प्राचीन |
| ९·० | – | ४५० | १३९० | ६·२४ | करडा, घन☨ | २३८५·७६ | एफ्. फोन राइशस्टाइन (१७८२), एम्. एच्. क्लापरोट (१७९८), जे बर्झीलियस (१८३२) |
| कोष्टक क्र. १ चालू | |||||||||
| १ | २ | ३ | ४ | ५ | ६ | ७ | ८ | ९ | १० |
| आयोडीन | I | ५३ | १२·९०४४ | ०·८ | ०·४१ | ०·३ | १·३३ | २·१६ | -१,५,७ |
| झेनॉन | Xe | ५४ | १३१·३० | ४·० | ३·० | – | १·९० | – | ० |
| सिझियम | Cs | ५५ | १३२·९०५ | ०·५ | ०·२१ | ७ | २·६२ | १·६९ | १ |
| बेरियम | Ba | ५६ | १३७·३४ | ४·७ | ५·० | २५० | २·१७ | १·३५ | २ |
| लॅंथॅनम | La | ५७ | १३८·९१ | २·० | ०·४७ | १८ | १·८८ | १·१५ | ३ |
| सिरियम | Ce | ५८ | १४०·१२ | २·३ | १·३८ | – | १·८२ | १·०३ | ३,४ |
| प्रासिओडिमियम | Pr | ५९ | १४०·९०७ | ०·४ | ०·१९ | ९ | १·८३ | १·०१ | ३ |
| निओडिमियम | Nd | ६० | १४४·२४ | १·४ | ०·८८ | ३७ | १·८२ | ०·९९ | ३ |
| प्रोमेथियम | Pm | ६१ | (१४५) | – | – | – | – | – | ३ |
| समॅरियम | Sm | ६२ | १५०·३५ | ०·७ | ०·२८ | ८ | १·८० | ०·९६ | ३ |
| यूरोपियम | Eu | ६३ | १५१·९६ | ०·१९ | ०·१० | १·३ | २·०४ | ०·९५ | ३,२ |
| गॅडोलिनियम | Gd | ६४ | १५७·२५ | ०·६८ | ०·४३ | ८ | १·८० | ०·९४ | ३ |
| टर्बियम | Tb | ६५ | १५८·९२४ | ०·१० | ०·०६१ | ४·३ | १·७८ | ०.९२ | ३ |
| डिस्प्रोशियम | Dy | ६६ | १६२·५० | ०·५६ | ०·४५ | ५ | १·७७ | ०·९१ | ३ |
| होल्मियम | Ho | ६७ | १६४·९३० | ०.१२ | ०.०९३ | १.७ | १.७७ | ०.८९ | ३ |
| अर्बियम | Er | ६८ | १६७.२६ | ०·३२ | ०·२८ | ३·३ | १·७६ | ०·८८ | ३ |
| थुलियम | Tm | ६९ | १६८.९३४ | ०.०३ | ०.०४१ | ०.२७ | १.७५ | ०.८७ | ३ |
| इटर्बियम | Yb | ७० | १७३·०४ | ०·२१ | ०·२२ | ०·३३ | १·९४ | ०·९६ | ३,२ |
| ल्सुटेशिसम | Lu | ७१ | १७४·९७ | ०·०५ | ०·०३६ | ०·८ | १·७४ | ०·८५ | ३ |
| हाप्निवम | Hf | ७२ | १७८·४९ | ०·४४ | ०·३१ | ५ | १·५७ | ०·८४ | ४ |
| टँटॅलम | Ta | ७३ | १८०·९४८ | ०·०७ | ०·०१९ | २ | १·४३ | ०·६८ | ५ |
| टंगस्टन किंवा बुल्फ्रॅम | W | ७४ | १८३·८५ | ०·५ | ०·१६ | ˜७० | १·३७ | ०·६८ | ६ |
| ऱ्हीनियम | Re | ७५ | १८६·२ | ०·१४ | ०·०५९ | ०·००१ | १·३७ | – | ७,४,-१ |
| ऑस्मियम | Os | ७६ | १९०·२ | १·० | ०·८६ | ०·००१ | १·३४ | ०·८८ | ४,६,८ |
| इरिडियम | Ir | ७७ | १९२·२ | ०·८२ | ०·९६ | ०·००१ | १·३५ | ०·९२ | ३,४,६ |
| प्लॅटिनम | Pt | ७८ | १९५·०९ | १·६३ | १·४ | ०·००५ | १·३८ | ०·५२ | ४,२ |
| सोने | Au | ७९ | १९६·९६७ | ०·१५ | ०·१८ | ०·००५ | १·४४ | १·३७ | ३,१ |


| क्र. १. चालू | |||||||||
| १ | २ | ३ | ४ | ५ | ६ | ७ | ८ | ९ | १० |
| पारा | Hg | ८० | २००·५९ | ०·०२ | ०.६० | ~०·५ | १·५५ | १·१० | २,१ |
| थॅलियम | TI | ८१ | २०४·३७ | ०·०१ | ०·१३ | ~२ | १·७१ | ०·९५ | १,३ |
| शिसे | Pb | ८२ | २०७·१९ | २·९० | १·३ | १६ | १·७५ | ०·८४ | २,४ |
| बिस्मथ | Bi | ८३ | २०८·९८० | ०·०१ | ०·१९ | ०·२ | १·४६ | ०·७४ | ३,५ |
| पोलोनियम | Po | ८४ | (२१०) | – | – | लेशमात्र | १·४ | – | २,४ |
| ॲस्टटीन | At | ८५ | (२१०) | – | – | लेशमात्र | १·४० | – | – |
| रेडॉन | Rn | ८६ | (२२२) | – | – | लेशमात्र | २·२ | – | ० |
| फ्रान्सियम | Fr | ८७ | (२२३) | – | – | लेशमात्र | २·७ | – | १ |
| रेडियम | Ra | ८८ | (२२६·०५) | – | – | लेशमात्र | २·२० | १·५२ | २ |
| ॲक्टिनियम | Ac | ८९ | (२२७) | – | – | लेशमात्र | २·० | १·११ | ३ |
| थोरियम | Th | ९० | २३२·०३८ | ०·०३ | ०·०८ | १३ | १·६५ | – | ४ |
| प्रोटॅक्टिनियम | Pa | ९१ | (२३१) | – | – | लेशमात्र | – | – | ५ |
| युरेनियम | U | ९२ | २३८·०३ | ०·०१८ | ०·०२ | ४ | १·४२ | – | ६,५,४,३ |
| नेपच्यूनियम | Np | ९३ | (२३७) | – | – | – | – | – | ६,५,४,३ |
| प्लुटोनियम | Pu | ९४ | (२४२) | – | – | – | – | – | ६,५,४,३ |
| अमेरिसियम | Am | ९५ | (२४३) | – | – | – | – | – | ३ |
| क्यूरियम | Cm | ९६ | (२४७) | – | – | – | – | – | ३ |
| बर्केलियम | Bk | ९७ | (२४९) | – | – | – | – | – | ४,३ |
| कॅलिफोर्नियम | Cf | ९८ | (२५१) | – | – | – | – | – | ३ |
| आइन्स्टाइनियम | Es | ९९ | (२५४) | – | – | – | – | – | – |
| फेर्मियम | Fm | १०० | २५७ | – | – | – | – | – | – |
| क्र. १. चालू | |||||||
| ११ | १२ | १३ | १४ | १५ | १६ | १७ | १८ |
| १०·४ | -०·१७ | -३९ | ३५६·९ | १४·२ | पांढरा, द्रव† | १८४९·६८ | थीओफ्रॅस्टस (इ. स. पू. ३००), प्लिनी व डायस्कॅरिडीझ (इ. स. पू. पहिले शतक) |
| ६·१ | – | ३०४ | १४५७ | ११·६ | करडा, घन† | ३५१९·२४ | डब्ल्यू. क्रुक्स व सी. ए. लामी (१८६१) |
| ७·४ | -०·१२ | ३२८ | १९५५ | ११·३ | करडा, घन† | ४०५७·८३ | प्राचीन |
| ७·३ | -०·१२ | २७१ | १४५० | ९·८ | पांढरा, घन† | ३०६७·७२ | प्राचीन पॅरासेल्सस,
ॲग्रिकोला (१५४६), जे. एच्. पॉट (१७३९) |
| ८·४ | – | २५४ | ९६२ | ९·४ | करडा, काळा घन† | २४४९.९९ | प्येअर क्यूरी व मारी क्यूरी (१८९८) |
| – | – | २५० | ३५० | – | घन | – | डी. आर्. कॉर्सन, के. आर्. मॅकेंझी, ई. जी. सेग्रे (१९४०) |
| १०·७ | – | -११० | -६१·८ | ०·००९७ | रंगहीन, वायू | १७८६·०७ | एफ्. ई. डोर्न (१९००) |
| – | – | २८·५ | ६७० | १·८७ | घन | – | एम्. पेरी (१९३९) |
| ५·३ | – | ९६० | ११४० | ५ | पांढरा, घन† | ४८२५·९१ | प्येअर क्यूरी व मारी क्यूरी (१८९८) |
| ६·९ | – | १२३० | ३१०० | १०·१ | घन | – | ए. दव्यर्न (१८९९), एफ्. गीझेल (१९०२) |
| – | – | १८४५ | >३००० | ११·३ | पांढरा, घन† | ३७१९·४४ | जे. जे. बर्झीलियस (१८२८) |
| – | – | १२०० | ४००० | १५·४ | पांढरा, घन† | – | ओ. हान व एल्. माइटनर (१९१७), एफ्. सॉडी व जे. क्रॅन्स्टन (१९१७) |
| ४·० | १·७२ | ११५० | ३८०० | १८·७ | पांढरा, घन† | ३८१२·०० | एम्. एम्. पेटिगॉट (१८४१) |
| – | – | ६३७ | – | – | पांढरा, घन† | – | ई. एम्. मॅकमिलन व पी. एच्. आवेल्सन (१९४०) |
| – | – | ६४० | ३२३० | १९·८ | घन† | – | जी. टी. सीबॉर्ग, ई. एम्. मॅकमिलन, जे. डब्ल्यू. केनेडी व ए. सी. वाल (१९४०) |
| – | – | ९९५ | – | ११·८ | पांढरा, घन† | – | जी. टी. सीबॉर्ग, आर्. ए. जेम्स व एल्. ओ. मॉर्गन (९१४४–४५) |
| – | – | १३४० | – | – | पांढरा, घन† | – | जी. टी. सीबॉर्ग, आर्. ए. जेम्स, ए. धिओर्सो (१९४४) |
| – | – | – | – | – | – | – | एस्. जी. टॉम्पसन. ए. धिओर्सो व जी. टी. सीबॉर्ग (१९४९) |
| – | – | – | – | – | – | – | जी. टी. सीबॉर्ग, एस्. जी. टॉम्पसन, ए. धिओर्सो व के. स्ट्रीट (ज्युनी.) (१९५०) |
| – | – | – | – | – | – | – | ए. धिओर्सो (१९५२) |
| – | – | – | – | – | – | – | ए. धिओर्सो, एस्, जी. टॉम्पसन, जी. एच्. हिगिन्स, जी. टी. सीबॉर्ग (१९५३) |
| क्र. १. चालू | |||||||||
| १ | २ | ३ | ४ | ५ | ६ | ७ | ८ | ९ | १० |
| मेंडलेव्हियम | Md | १०१ | (२५६) | – | – | – | – | – | – |
| नोबेलियम | No | १०२ | (२५३) | – | – | – | – | – | – |
| लॉरेन्सियम | Lr | १०३ | २५७ | – | – | – | – | – | – |
| रदरफर्डियम | (Rf) | १०४ | २५७ | – | – | – | – | – | – |
| – | (Ha) | १०५ | २६० | – | – | – | – | – | – |
| – | – | १०६ | – | – | – | – | – | – | – |
| – | – | १०७ | – | – | – | – | – | – | – |
| – | – | १०८ | – | – | – | – | – | – | – |
| – | – | १०९ | – | – | – | – | – | – | – |
| – | – | ११० | – | – | – | – | – | – | – |
| c. a. u. –वैश्विक विपुलता एकक (दशलक्ष सिलिकॉन अणुसंख्येच्या सापेक्ष) | |||||||||
| क्र. १. चालू | |||||||
| ११ | १२ | १३ | १४ | १५ | १६ | १७ | १८ |
| – | – | – | – | – | – | – | ए. धिओर्सो, बी. जी. हार्वी, जी. आर्. शोपॅन, एस्.जी.
टॉम्पसन व जी. टू सीबॉर्ग (१९५५) |
| – | – | – | – | – | – | – | नोबेल इन्स्टिट्यूट (१९५७) |
| – | – | – | – | – | – | – | ए. धिओर्सो, टी. सिक्केलँड, ए. ई. लार्श व आर्. एम्.
लॅटिमर (१९६१) |
| – | – | – | – | – | – | – | – |
| – | – | – | – | – | – | – | ए. धिओर्सो आणि सहकारी (१९७०) |
| – | – | – | – | – | – | – | लॉरेन्स बर्कली लॅबोरेटरी (कॅलिफोर्निया) व जॉईंट रिसर्च (डूब्ना) (१९७४) |
| – | – | – | – | – | – | – | – |
| – | – | – | – | – | – | – | – |
| – | – | – | – | – | – | – | – |
| – | – | – | –– | – | – | – | – |
| *-दशलक्ष भागातील अंश वजनाप्रमाणे † धातू | |||||||
कोष्टकात अणुत्रिज्या, आयनी त्रिज्या आणि वर्णपटातील तीव्रतम रेषेची तरंगलांबी अँगस्ट्रॉम (Å) या एककात दिलेली आहेत. (१ Å= १०-१०मी.).
मूलद्रव्यांचे रासायनिक गुणधर्म मोठ्या प्रमाणात त्याच्या इलेक्ट्रॉन विन्यासावर अवलंबून असतात. आवर्त सारणीमधील एकंदर मूलद्रव्यांचे त्यांच्या इलेक्ट्रॉन विन्यासानुसार s, p, d, f ………. इ. वर्ग पाडता येतात. कोणत्याही एका वर्गातील सर्वमूलद्रव्यांचे रासायनिक गुणधर्म ढोबळमानाने एकसमान असे असल्यामुळे त्याचेसंकलित वर्णन एका ठिकाणी करणे सोईस्कर ठरते. अशा प्रकारचे वर्गानुसारतुलनात्मक व सापेक्ष वर्णन पुढे दिले आहे.
इलेक्ट्रॉन विन्यासाप्रमाणे मूलद्रव्यांचे वर्ग : आणवीय इलेक्ट्रॉन विन्यास लक्षात घेता मूलद्रव्यांचे पुढीलप्रमाणे वर्ग पडतात : ज्या मूलद्रव्यांच्या शेवटच्या कक्षेत s इलेक्ट्रॉन असतात त्यांना s वर्गमूलद्रव्ये म्हणतात व ज्यांच्या कक्षेत p इलेक्ट्रॉन असतात त्यांना p वर्गमूलद्रव्ये म्हणतात. s व p या दोन वर्गांच्या मध्ये येणारी मूलद्रव्ये d वर्ग किंवा संक्रमणी मूलद्रव्ये समजतात. त्यात उपांत्य परिकक्ष [⟶ पुंज रसायनशास्त्र] d चा विस्तार होत असतो. ज्या मूलद्रव्यांत उप-उपांत्य f परिकक्षाचा विस्तारहोत असतो त्यांना f वर्ग मूलद्रव्ये म्हणतात. बोर-टॉम्पसन आवर्त सारणीतील (कोष्टक क्र. ३ पृ. ८६२) गट १ अ व २ अ मधील मूलद्रव्ये s वर्गात आहेत. गट ३अ ते ७ अ व ० (शून्य) या गटांतील मूलद्रव्ये p वर्गात आहेत. गट १ ब ते गट ८मधील संक्रमणी मूलद्रव्ये ही d वर्गात मोडतात. लँथॅनाइड व ॲक्टिनाइडश्रेणींतील मूलद्रव्ये f वर्गातील होत. या निरनिराळ्या वर्गातील उभ्यास्तंभात असणाऱ्या मूलद्रव्यांचे गुणधर्म थोड्या फार फरकांने समान असतात. याविविध वर्गातील मूलद्रव्यांसंबंधीची माहिती थोडक्यात खाली दिली आहे. अधिकतपशीलवार माहिती प्रत्येक मूलद्रव्यावरील स्वतंत्र नोंदीत पहावी.
हायड्रोजन : हायड्रोजन हे आवर्त सारणीतील एक अणुक्रमांकाचे पहिल्या आवर्तातील व सर्वांत सोप्या संरचनेचे असे मूलद्रव्य आहे. केंद्रस्थानी + १ भाराचा प्रोटॉन व भोवती फिरणारा एक इलेक्ट्रॉन अशी याच्या अणूची रचनाआहे. गट १ मधील क्षारीय (अल्कली) धातूंमध्येही शेवटच्या परिकक्षात एकचइलेक्ट्रॉन असतो परंतु या धातूंचा कल तो इलेक्ट्रॉन दुसऱ्या मूलद्रव्यालादेण्याकडे व स्वतः ऋणायन (धन विद्युत् भारित व विद्युत् विच्छेदनातऋणाग्राकडे आकर्षिला जाणारा आयन) तयार करण्याकडे असतो. हायड्रोजनाचा कलइलेक्ट्रॉन गमावण्याकडे नसतो. तो सहसंयुजी बंध तयार करू शकतो. हायड्रोजन वहॅलोजने या दोहोंना अक्रिय वायूसारखी संरचना मिळविण्याकरिता एक इलेक्ट्रॉनकमी असतो. हॅलोजने तो पुष्कळशा विक्रियामध्ये सहज मिळवू शकतात व धनायानतयार होतो परंतु हायड्रोजनाला उच्च विद्युत् घनता असलेल्या (इलेक्ट्रॉनदेऊन टाकण्याची प्रवृत्ती असलेल्या) धातूबरोबरच्या विक्रियेतच हे शक्य असतेउदा., (Li+H–). हायड्रोजनाला आभासी हॅलोजन असेहीम्हणतात. हायड्रोजनाचा धन आयन होऊ शकतो. हायड्रोजन अणूला स्वतंत्र अस्तित्वनाही. दोन अणू सहसंयुजी बंधाने एकत्र येऊन त्याचा रेणू बनतो.
हायड्रोजनाचे गुणधर्म गट १ व गट ७ मधील मूलद्रव्यांसारखे नसले, तरी संरचनेतील साम्याच्या आधारे त्याला गट १ च्या वर व गट ७ च्या वर आवर्त सारणीत जागा दिली जाते. वास्तविक त्याचा स्वतःचा वेगळा गट मानून स्वतंत्र जागा द्यायला हवी.
त्याचे भौतिक व रासायनिक गुणधर्म इत्यांदींकरिता ‘हायड्रोजन’ ही नोंद पहावी.
S वर्ग मूलद्रव्ये : गट १ अ :[ लिथियम (Li), सोडियम (Na), पोटॅशियम (K), रुबिडियम (RB), सिझियम (Cs), आणि फ्रान्सियम (Fr) हायड्रोजन (H) सोडून]. या गटातील सर्व मूलद्रव्ये धातू आहेत. त्यांना क्षारीय धातू असे म्हणतात. त्यांच्यात बहुरूपता (दोन अगर अधिक भौतिक रूपांत अस्तित्वात असण्याचा गुणधर्म) नाही. सोडियम व पोटॅशियम निसर्गात खूप प्रमाणात आहेत. सिझियम विरल आहे. फ्रान्सियमाचे किरणोत्सर्गी समस्थानिक निसर्गात आढळत नाहीत. Fr(२२३) हा समस्थानिक सूक्ष्म प्रमाणात आहे. या गटातील मूलद्रव्यांचेवैशिष्ट्य असे की, त्यांच्या आणवीय संरचनेत बाहेरच्या कक्षेत फक्त एकच s इलेक्ट्रॉन आहे. तो s इलेक्ट्रॉन गोलीय परिकक्षेत आहे. आधीच्या कक्षालक्षात न घेता फक्त शेवटच्या परिकक्षेचे चित्रण केले, तर ते पुढीलप्रमाणेहोईल :
Li [He] 2 s1
Na [Ne] 3 s1
K [Ar] 4 s1
Rb [Kr] 5 s1
Cs [Xe] 6 s1
Fr [Rn] 7 s1
संयुजी इलेक्ट्रॉन निघून गेल्यावर अणूंची जी संरचना शिल्लक राहते ती अक्रिय वायूंच्या संरचनेसारखी असते. अक्रिय वायू कोणते ते चौकटी कंसात दिले आहे. (संपूर्ण इलेक्ट्रॉन विन्यासाकरिता ‘अणु व आणवीय संरचना’ ही नोंद पहावी).
या मूलद्रव्यांच्या इलेक्ट्रॉनीय संरचनेच्या सारखेपणामुळे त्यांच्यारासायनिक गुणधर्मांत सारखेपणा आढळतो. सर्व मूलद्रव्ये पांढऱ्या रंगाची, मऊ, अतिशय क्रियाशील व एकसंयुजी आहेत. यांची रंगहीन आयनी संयुगे बनतात. फक्तअम्ल मूलक (प्रतिष्ठापन करण्यात येणारा हायड्रोजन काढून टाकल्यावर उरणाराअम्लाचा रेणू) रंगीत असेल, तरच रंगीत संयुगे असतात उदा., क्रोमेटे आणिपरमँगॅनेटे. मूलद्रव्यांच्या अणूंच्या व आयनांच्या आकारमानावरून त्यांच्यागुणधर्माची कल्पना येते. अणूंच्या मोठ्या आकारमानामुळे त्यांची घनता कमीओहे. केंद्रापासून बाहेरची कक्षा दूर असल्यामुळे तिच्यातील इलेक्ट्रॉनकाढून घेणे सापेक्षतेने सोपे आहे. व त्यामुळे त्यांचे आयनीकरण वर्चस् कमीआहे. अणूच्या वाढत्या आकारमानाबरोबर त्याच्या शेवटच्या कक्षेतील इलेक्ट्रॉनकेंद्रापासून दूर होतो व केंद्राचे त्यावरील वर्चस्व कमी होते आणि त्यामुळे आयनीकरण वर्चस् कमी होत जाते. याचाच अर्थ असा की, लिथियमपासून सिझियमाकडे धन विद्युती वाढत जाते. या मूलद्रव्यांचे किरणीयन केल्यास (विद्युत् चुंबकीय प्रारण-तरंगरूपी ऊर्जा-पृष्ठावर पाडल्यास) त्यांतून इलेक्ट्रॉन उत्सर्जित होतात [⟶ प्रकाशविद्युत्]. त्यामुळे सिझियम व पोटॅशियम यांचा प्रकाशविद्युत् घटात उपयोग होतो. या मूलद्रव्यांचे इलेक्ट्रॉन वरची ऊर्जा पातळी गाठेपर्यंत उत्तेजित करता येतात, हे ज्वाला कसोटीत दिसून येते. या उत्तेजित स्थितीत दृश्य प्रकाशात निरनिराळे रंग दिसतात व मूळ ऊर्जा पातळीवर आल्यावर ते नाहीसे होतात. यांचे वितळबिंदू व उकळबिंदू मुळात कमी आहेत व अणूंचे आकारमान वाढत जाते तसे ते आणखी कमी होत जातात. या उभ्या स्तंभातील पहिले सदस्य मूलद्रव्य लिथियम हे इतरांपेक्षा वेगळे आहे. त्याचे गुणधर्म इतर मूलद्रव्यांपेक्षा थोडे वेगळे आहेत. आवर्त सारणीतील बहुतेक सर्व उभ्या स्तंभांतील पहिल्या सदस्य मूलद्रव्याचे गुणधर्म उरलेल्या मूलद्रव्यांपेक्षा निराळे असतात.
या गटातील मूलद्रव्यांच्या संयुगांची जालक ऊर्जा (आयनी स्फटिकातील आयन एकमेकांपासून अनंत अंतरापर्यंत विलग करण्यासाठी लागणारी ऊर्जा) वरून खाली म्हणजे Li ते Cs कमी होत जाते. लिथियम आयनाचे (Li+) पृष्ठफळ सर्वांत कमी असल्याने त्याच्या पृष्ठभागावर विद्युत् भाराची घनता जास्त असते. त्यामुळे Li+ आयन हा लिथियम संयुगांच्या स्फटिक जालकामध्ये घट्टपणे चिकटून राहातो वसंयुगांची विद्राव्यता (विरघळण्याची क्षमता) कमी होते. उदा., Li2C03 व Li3PO4ही संयुगे अविद्राव आहेत. ही संयुगांची विद्राव्यता H ते Cs वाढत जाते. Li2CO3 हे अविद्राव्य, तर Na2CO3 व K2CO3 ही विद्राव्य आहेत. या जालक ऊर्जेमुळे यांच्या हायड्रॉक्साइडांची क्षारकीयप्रबलता (धातवीय व OH आयन विलग होण्याचे प्रमाण) Li ते Cs वाढत जाते. CsOH व FrOH ही सर्वात प्रबल क्षारकीय आहेत. LiOH हे दुर्बल क्षारकीय आहे. LiOH पाण्यात विरघळविल्यास फार थोडे OH–गट निर्माण होतात कारण Li+ आयनावरील विद्युत् भारामुळे त्याचे OH– आयनाशी जास्त आकर्षण निर्माण होते.
| कोष्टक क्र.२. मूलद्रव्ये व त्यांचे समस्थानिक | |||
| अणुक्रमांक | मूलद्रवे | स्थिर समस्थानिक | किरणोत्सर्गी समस्थानिक |
| १ | हायड्रोजन | १(९९·९८),२(०·०१) | ३(β–) |
| २ | हीलियम | ३(१·३ X १०-४), ४(∽१००) | ५(α), ६(β–) |
| ३ | लिथियम | ६(७·५), ७(९२·५) | ५(α), ८(β–) |
| ४ | बेरिलियम | ९(१००) | ७(K, γ ), ८(α), १०(β–) |
| ५ | बोरॉन | १०(१८·७),११(८१·३) | ९(२α), १२(β–,γ) |
| ६ | कार्बन | १२(९८·९), १३(१·१) | १०(β+, γ ), ११(β+),१४(β–),
१५(β–, γ ) |
| ७ | नायट्रोजन | १४(९९·६२),१५(०·३८) | १२(β+), १३(β+),१६(β–,γ ), १७(β–) |
| ८ | ऑक्सीजन | १६(९९·७६),१७(०·०४),
१८(०·२०). |
१४(β+, γ), १५(β+),१९(β–, γ) |
| ९ | प्ल्युओरीन | १९(१००). | १७(β+), १८(β+),२०(β–, γ ), २१(β–) |
| १० | निऑन | २०(९०·८), १(<०·३),२२(८·९) | १८(β+), १९(β+),२३(β–, γ), २४(β–, γ) |
| ११ | सोडियम | २३(१००) | २०(β+), २१(β+),२२(β–,K, γ), २५(β–, γ) |
| १२ | मॅग्नेशियम | २४(७७·४),२५(११·५),२६(११·१) | २३(β+), २७(β–, γ), २८(β–, γ) |
| १३ | ॲल्युमिनियम | २७(१००) | २४(β+,γ), २५(β+,γ), २६(β+,Kγ),२८(β–, γ), २९(β–, γ) |
| १४ | सिलिकॉन | २८(९२·२१),२९(४·७०),
३०(३·०९) |
२७(β+),३१(β–, γ), ३२(β–) |
| १५ | फॉस्फरस | ३१(१००) | २८(β+,γ),
२९(β+,γ), ३० (β+),३२(β–),३३(β–), ३४(β–, γ) |
| १६ | गंधक | ३२(९५·०),३३(०·८),३४(४·२),
३६(०·०२) |
३१(β+),३५(β–),३७(β–, γ) |
| १७ | क्लोरीन | ३५(७५·४),३७(२४·६) | ३२(β+, γ), ३३(β+,γ), ३४(β+,γ), ३४(β–, K), ३८(β–, γ), ३९(β–, γ) |
| १८ | आर्गॉन | ३६(०·३३७),३८(०·०६१),
४०(९९·६०) |
३५(β+,γ), ३७(K), ३९(β–),४१(β–, γ) |
| १९ | पोटॅशियम | ३९(९३·१),४०(०·०१),४१(६·९) | ३८(β+,γ),४०(β–,K,γ), ४२(β–, γ), ४३(β–, γ), ४४(β–, γ) |
| २० | कॅल्शियम | ४०(९६·९६),४२(०·६४),४३, ४४(२·६),४६,४८. | ३९(β+), ४१(K), ४५(β–), ४७(β–, γ), ४९(β–, γ) |
| २१ | स्कॅंडियम | ४५(१००) | ४०(β+,γ),४१(β+), ४२(β+),
४३(β+,K,γ),४४(β+,K,γ), ४६(β–,γ), ४७(β–, γ),४८(β–, γ), ४९(b–) |
| २२ | टिटॅनियम | ४६(७·९३), ४७(७·२८),
४८(७३·९४), ४९(५·५१), ५०(५·३४) |
४४(K,γ), ४५(β+,γ), ५१(β–, γ) |
| २३ | व्हॅनेडियम | ५०(०·२५), ५१(९९·७५) | ४६(β+), ४७(β+),
४८(β+,K,γ), ४९(K), ५२(β–, γ) |
| २४ | क्रोमियम | ५०(४·३१), ५२(८३·७६),
५३(९·५५), ५४(२·३८) |
४८(K,γ), ४९(β+,γ),
५१(K,γ), ५५(β–) |
| २५ | मॅंगॅनीज | ५५(१००) | ५०(β+), ५१(β+), ५२(β+,K,γ ),५३(K), ५४(K,γ), ५६(β–,γ),
५७(β–, γ), |
| २६ | लोखंड | ५४(५·८२), ५६(९१·६६), ५७(२·१९), ५८(०·३३) | ५२(β+,K,γ ), ५३(β+,γ), ५५(K), ५९(β–, γ),
६०(β–, γ) |
| कोष्टक क्र. २. मूलद्रव्ये व त्यांचे समस्थानिक (पुढे चालू) | |||
| अण-क्रमांक | मूलद्रवे | स्थिर समस्थानिक | किरणोत्सर्गी समस्थानिक |
| २७ | कोबाल्ट | ५९(१००). | ५४(β+), ५५(β+,K,γ), ५६(β+,K,γ),५७(K,γ),
५८(β+,K,γ), ६०(β–, γ), ६१(β–, γ), ६२(β–, γ ) |
| २८ | निकेल | ५८(६७·८८), ६०(२६·२२), ६१, ६२(३·६६), ६४. | ५६(K,γ), ५७(β+,K,γ), ५९(K), ६३(β–), ६५(β–, γ),
६६(β–). |
| २९ | तांबे | ६३(६९·०९), ६५(३०·९१) | ५८(β+), ५९(β+,K,γ), ६०(β+,γ), ६१(β+,K,γ), ६२(β+,K,γ),६४(β–,β+,K ,γ),६६(β–, γ), ६७(β–, γ), |
| ३० | जस्त | ६४(४८·९), ६६(२७·८), ६७(४·१), ६८(१८·६), ७० | ६२(β+,K,γ), ६३(β+,K,γ), ६५(β+,K,γ),६९(β–, γ),
७१(β–, γ), ७२(β–, γ). |
| ३१ | गॅलियम | ६९(६०·१), ७१(३९·९) | ६४ (β+, γ), ६५(β+,K,γ),६६(β+,K,γ), ६७(K,γ),
६८(β+,K, γ), ७०(β–, γ), ७२(β–, γ),७३(β–) |
| ३२ | जर्मेनयम | ७०(२०·५२), ७२(२७·४३), ७३(७·७६), ७४(३६·५४), ७६(७·७६) | ६७(β+, γ),६८(K), ६९(β+,K, γ), ७१(K), ७५(β–, γ),
७७(β–, γ), ७८(β–, γ) |
| ३३ | अर्सेनिक | ७५(१००). | ६९(β+, γ), ७०(β+,K, γ), ७१(β+,K,γ), ७२(β+,K,γ),
७३(K), ७४(β+,β–,K, γ) , ७६(β–, γ), ७८(β–, γ), ७९(β–) |
| ३४ | सिलिनियम | ७४, ७६(९·०२), ७७(७·५८), ७८(२३·५२), ८०(४९·८२),
८२(९·१९) |
७२(K), ७३(β+,K, γ), ७५(K, γ), ७९(β–,γ), ८१(β–,γ),
८३(β–,γ), ८४(β–) |
| ३५ | ब्रोमीन | ७९(५०·५४), ८१(४९·४६). | ७५(β+,K, γ), ७६(β+,K, γ), ७७(β+,K, γ),
७८(β+,K, γ), ८०(β–,K, γ), ८२(β–, γ), ८३(β–,γ ), ८४(β–,γ), ८५(β–), ८७(β–,γ) |
| ३६ | क्रिप्टॉन | ७८, ८०, ८२(११·५०), ८३(११·४८), ८४(५७·०२), ८६(१७·४३) | ७६(β+, γ),७७(β+,K, γ), ७९(β+,K, γ), ८१(K, γ),
८४(β–,γ), ८७(β–,γ ), ८८(β–,γ), ८९(β–,γ) |
| ३७ | रुबिडियम | ८५(७२·२), ८७(२७·८). | ८१(β+,K, γ), ८२(β+,K,γ), ८३(K, γ),
८४(β+,β–,K, γ), ८६(β–,γ), ८७(β–), ८८(β–,γ), ८९(β–,γ), ९०(β–,γ ) |
| ३८ | स्ट्रॉंशियम | ८४, ८६(९·८६), ८७(७·०२), ८८(८२·५६) | ८२(K), ८३(β+,K, γ), ८५(K, γ), ८९(β–),९०(β–),
९१(β–,γ), ९२(β–,γ) |
| ३९ | इट्रियम | ८९(१००). | ८६(β+, γ), ८७(K, γ), ८८(K, γ), ९०(β–), ९१(β–, γ),
९२(β–, γ), ९३(β–,γ),९४(β–, γ) |
| ४० | झिर्कोनियम | ९०(५१·५), ९१(११·२), ९२(१७·१), ९४(१७·४), ९६(२·८). | ८७(β+,K, γ), ८८(K), ८९(β+,K, γ), ९३(β–),
९५(β–, γ), ९७(β–,γ) |
| ४१ | निओबियम | ९३(१००). | ९०(β+, γ), ९१(K, γ), ९२(K, γ), ९४(β–, γ), ९५(β–, γ),
९६(β–, γ), ९७(β–, γ) |
| ४२ | मॉलिब्डेनम | ९२(१५·८४), ९४(९·०४), ९५(१५·७२), ९६(१६·५३), ९७(९·४६), ९८(२३·७८),
१००(९·६३) |
९०(β+,K, γ), ९१(β+,K, γ), ९३(K, γ), ९९(β–, γ),
१०१(β–, γ) |
| ४३ | टेक्नेशियम | – | ९२(β–,K, γ), ९३(β+,K, γ), ९४(β+,K, γ), ९५(K, γ),
९६(K, γ), ९७(K, γ), ९८(β–, γ),९९(β–, γ), १००(β–, γ),१०१(β–,γ) |
| ४४ | रुथेनियम | ९६(५·५१), ९८(१·८७),
९९(१२·७२), १००(१२·६२), १०१(१७·०७), १०२(३१·६१), १०४(१८·५८) |
९५(β+,K, γ),९७(K, γ), १०३(β–, γ), १०५(β–, γ),
१०६(β–) |
| कोष्टक क्र.२. मूलद्रव्ये व त्यांचे समस्थानिक (पुढे चालू) | |||
| अण-क्रमांक | मूलद्रवे | स्थिर समस्थानिक (%) | किरणोत्सर्गी समस्थानिक (उत्सर्जन) |
| ४५ | ऱ्होडियम | १०३(१००) | ९९(β+,K, γ), १००(β+,K, γ),१०१(K, γ),
१०२(β+,β–,K, γ), १०४(β–,γ), १०५(β–, γ), १०६(β–, γ),१०७(β–, γ) |
| ४६ | पॅलॅडियम | १०२(१·०), १०४(११·०), १०५(२२·२), १०६(२७·२), १०८(२६·८), ११०(११·८) | १००(K, γ), १०१(β+,K, γ), १०३(K, γ), १०७(β–),
१०९(β–, γ), १११(β–, γ), ११२(β–, γ) |
| ४७ | चांदी | १०७(५१·४), १०९(४८·६) | १०४(β+,K, γ),१०५(K, γ), १०६(β+,K, γ),
१०८(β–,K,γ), ११०(β–, γ), १११(β–,γ), ११२(β–, γ), ११३(β–), ११४(β–), ११५(β–) |
| ४८ | कॅडमियम | १०६, १०८, ११०(१२·३२), १११(१२·६७), ११२(२४·१५), ११३(१२·२१), ११४(२८·९३), ११६(७·६१) | १०४(β+, γ), १०५(β+,K, γ), १०७(K, γ), १०९(K),
११५(β–,γ), ११७(β–, γ) |
| ४९ | इंडियम | ११३(४·२), ११(९५·८) | १०७(β+,γ), १०८(β+,γ),१०९(β+,K,γ),
११०(β+,K,γ), १११(K, γ), ११२(β–,β+,K, γ), ११४(β–,K,γ), ११५(β–,γ), ११६(β–,γ), ११७(β–,γ), |
| ५० | कथिल | ११२, ११४, ११५, ११६(१४·३०), ११७(७·६१), ११८(२४·३), ११९(८·५८), १२०(३२·८५), १२२(४·७२), १२४(५·९४) | १११(β+,K), ११३(K,γ), १२१(β–), १२३(β–, γ),
१२५(β–, γ) |
| ५१ | अँटिमनी | १२१(५७·२५), १२३(४२·७५) | ११६(β+,γ), ११७(β+,K,γ), ११८(β+,K,γ),
११९(K,γ), १२०(β+,K,γ), १२२(β–,K,γ), १२४(β–,γ), १२५(β–,γ), १२६(β–,γ), १२७(β–,γ) |
| ५२ | टेल्यूरियम | १२०, १२२(२·८३), १२३,
१२४(४·५९), १२५(६·९३), १२६(१८·७१), १२८(३१·८६), १३०(३४·४२) |
११८(K), ११९(K, γ), १२१(K,γ), १२७(β–, γ),
१२९(β–,γ), १३१(β–,γ), १३२(β–,γ), १३३(β–,γ) |
| ५३ | आयोडीन | १२७(१००) | १२२(β+),१२३(K,γ), १२४(β+,K,γ), १२५(K,γ),
१२६(β–,β+,K, γ), १२८(β–,K, γ), १२९(β–,γ), १३०(β–, γ),१३१(β–,γ), १३२(β–,γ),१३३(β–,γ), १३४(β–,γ), १३५(β–,γ), १३६(β–,γ) |
| ५४ | झेनॉन | १२४, १२६, १२८, १२९(२६·२३), १३०(४·०५), १३१(२१·१४), १३२(२६·९३), १३४(१०·५२), १३६(८·९३) | १२३(β+,γ),१२५(K, γ), १२७ (K, γ), १३३(β–,γ ),
१३५(β–,γ),१३७(β–,γ), १३८(β–,γ) |
| ५५ | सिझियम | १३३(१००) | १२५(β+,K,γ), १२६(β+,K,γ), १२७(β+,K,γ),
१२८(β+,K,γ), १२९(K,γ), १३०(β+,β–,K),१३१(K), १३२(K,γ), १३४(β–,γ), १३५(β–,γ), १३६(β–,γ), १३७(β–), १३८(β–,γ), १३९(β–) |
| ५६ | बेरियम | १३०, १३२, १३४(२·४२),
१३५(६·५९), १३६(७·८१), १३७(११·३२), १३८(७१·६६) |
१२८(K,γ), १२९(β+,γ), १३१(K,γ), १३३(K,γ),
१३९(β–,γ), १४०(β–,γ), १४१(β–,γ) |
| ५७ | लॅंथॅनम | १३८, १३९(९९·९१) | १३३(β+,γ),१३४(β+,K),१३५(K,γ), १३६(β+,K),
१३७(K), १४०(β–,γ), १४१(β–,γ), १४२(β–,γ) |
| कोष्टक क्र. २. मूलद्रव्ये व त्यांचे समस्थानिक (पुढे चालू) | |||
| अण-क्रमांक | मूलद्रवे | स्थिर समस्थानिक (%) | किरणोत्सर्गी समस्थानिक (उत्सर्जन) |
| ५८ | सिरियम | १३६, १३८, १४०(८८·४७), १४२(११·०८) | १३४(K), १३५(K), १३७(K, γ), १३९(K, γ), १४१(β–,γ),
१४३(β–,γ), १४४(β–,γ), १४५(β–,γ), १४६(β–,γ) |
| ५९ | प्रासिओडिमियम | १४१(१००) | १३८(β+,K,γ), १३९(β+,K,γ), १४०(β+,K), १४२(β–,γ),
१४३(β–), १४४(b–,γ), १४५(β–), १४६(β–,γ) |
| ६० | निओडिमियम | १४२(२७·११), १४३(१२·१७), १४४(२३·८५), १४५(८·३०), १४६(१७·२२), १४८(५·७३), १५०(५·६२) | १३९(β+,K,γ), १४०(K), १४१(β+,K,γ), १४७(β–,γ),
१४९(β–,γ), १५१(β–,γ) |
| ६१ | प्रोमेथियम | – | १४५(K),१४६(β–,γ),१४७(β–,γ),१४८(β–,γ),
१४९(β–,γ),१५०(β–,γ),१५१(β–,γ) |
| ६२ | समॅरियम | १४७(१५), १४८(११·२),
१४९(१३·८), १५०(७·४), १५२(२६·८), १५४(२२·७) |
१४३(β+), १४५(K,γ),१४६(α), १४७(α), १५१(β–,γ),
१५३(β–,γ), १५५(β–,γ), १५६(β–) |
| ६३ | यूरोपियम | १५१(४७·८), १५३(५२·२) | १४७(K,γ), १४८(K,γ), १४९(K,γ), १५०(β–),
१५२(β–,K,γ),१५४(β–,K,γ), १५५(β–,γ), १५६(β–,γ),१५७(β–,γ),१५८(β–,γ) |
| ६४ | गॅडोलिनियम | १५२, १५४(२·१५), १५५(१४·६०), १५६(२०·५), १५७(१५·७), १५८(२४·९), १६०(२१·९) | १५०(α), १५१(K,γ), १५३(K,γ), १५९(β–,γ ),
१६१(β–,γ) |
| ६५ | टर्बियम | १५९(१००) | १५६(K,β–,γ), १६०(β–,γ),१६१(β–,γ) |
| ६६ | डिस्प्रोशियम | १५६, १५८, १६०(२·२९), १६१(१८·९), १६२(२५·५),
१६३(२५), १६४(२८·२) |
१५७(K,γ), १५९(K), १६५(β–,γ), १६६(β–,γ) |
| ६७ | होल्मियम | १६५(१००) | १६०(K,γ), १६१(K,γ), १६२(K,γ), १६४(β–,K,γ),
१६६(β–,γ), १६७(β–,γ) |
| ६८ | अर्बियम | १६२, १६४, १६६(३३·४),
१६७(२२·९), १६८(२७·१), १७०(१४·९) |
१६०(K), १६१(β+,K,γ), १६३(K,γ), १६५(K,γ),
१६९(β–), १७१(β–),१७२(β–) |
| ६९ | थुलियम | १६९(१००) | १६५(K,γ), १६६(K, γ), १६७(K,γ),१६८(β–,K,γ),
१७०(β–), १७१(β–,γ), १७२(β–,γ) |
| ७० | इटर्बियम | १६८, १७०(३·०३), १७१(१४·३), १७२(२१·८), १७३(१६·२), १७४(३१·८), १७६(१२·७) | १६६(K), १६७(K, γ), १६९(K,γ),
१७५(β–, γ), १७७(β–, γ) |
| ७१ | ल्सुटेशिसम | १७५(९७·५), १७६(२·५) | १७०(K,γ),१७१(K,γ), १७२(β+,K,γ), १७३(K,γ),
१७४(β–,K,γ), १७६(β–,γ), १७७(β–,γ) |
| ७२ | हाप्निवम | १७४, १७६(५·२), १७७(१८·४), १७८(२७·१), १७९(१३·८), १८०(३५·३) | १७२(K,γ), १७३(K,γ),
१७५(K,γ),१८१(β–) |
| ७३ | टँटॅलम | १८०, १८१(९९·९८) | १७६(K, γ), १७७(K,γ), १७८(β+,K,γ), १७९(K,γ),
१८०(β–,K, γ), १८२(β–,γ), १८३(β–,γ), १८४(β–,γ), १८५(β–,γ), १८६(β–,γ) |
| ७४ | टंगस्टन किंवा बुल्फ्रॅम | १८०, १८२(२६·२), १८३(१४·२६), १८४(२०·७४), १८६(२८·८२) | १७६(K,γ), १७७(K,γ), १७८(K), १८०(α,γ), १८१(K,γ), १८५(β–,γ), ८१७(β–,γ), १८८(β–) |
| कोष्टक क्र. २. मूलद्रव्ये व त्यांचे समस्थानिक (पुढे चालू) | |||
| अण-क्रमांक | मूलद्रवे | स्थिर समस्थानिक (%) | किरणोत्सर्गी समस्थानिक (उत्सर्जन) |
| ७५ | ऱ्हीनियम | १८५(३७·१), १८७(६२·९) | १८२(K,γ ), १८३(K,γ), १८४(K,γ), १८६(β–,K,γ),
१८७(β–,γ), १८८(β–,γ), १८९(β–,γ), १९०(β–, γ) |
| ७६ | ऑस्मियम | १८४, १८६(१·५९), १८७(१·६८), १८८(१३·३), १८९(१६·१), १९०(२६·४), १९२(४१) | १८२(K), १८३(K,γ),
१८५(K, γ), १९१(β–,γ), १९३(β–,γ), १९४(β–) |
| ७७ | इरिडियम | १९१(३८·५), १९३(६१·५) | १८७(K,γ), १८८(K,γ), १८९(K,γ), १९०(β+,K, γ),
१९२(β–,K, γ),१९४(β–,γ ),१९५(β–,γ ), १९६(β–,γ), १९७(β–, γ), १९८(β–,γ) |
| ७८ | प्लॅटिनम | १९०, १९२, १९४(३२·८),
१९५(३३·७), १९६(२५·४), १९८(७·२) |
१८८(K, γ), १८९(K,γ), १९०(α), १९१(K,γ),
१९३(K,γ), १९७(β–,γ), १९९(β–,γ) |
| ७९ | सोने | १९७(१००) | १९१(K,γ),१९२(β+,K,γ), १९३(K,γ ),
१९४(β+,K, γ), १९५(K,γ), १९६(β–,K, γ), १९८(β–,γ), १९९(β–,γ), २००(β–, γ), २०१(β–,γ) |
| ८० | पारा | १९६, १९८(१०·१), १९९(१७), २००(२३·३), २०१(१३·२), २०२(२९·६), २०४(६·७) | १९२(β+,K,γ), १९३(K,γ), १९३(K,γ ), १९४(K,γ), १९५(K,γ), १९७(K,γ), २०३(β–,γ), २०५(β–,γ) |
| ८१ | थॅलियम | २०३(२९·५), २०५(७०·५) | १९८(K,γ), १९९(K,γ), २००(K,γ), २०१(K,γ),
२०२(K, γ), २०४(β–,K, γ), २०६(β–), २०७(β–,γ), २०८(β–,γ), २०९(β–,γ), २१०(β–) |
| ८२ | शिसे | २०४(१·३७), २०६(२६·२६), २०७(२०·८), २०८(५१·५५) | २००(K,γ), २०१(K,γ ), २०२(K,γ),२०३(K,γ),
२०५(K), २०९(β–), २१०(β–,γ),२११(β–,γ), २१२(β–, γ),२१४(β–,γ) |
| ८३ | बिस्मथ | २०९(१००) | २०५(K,γ), २०६(K,γ ), २०७(K,γ ),२०८(K),
२०९(α), २१०(α, β–), २११(α,γ), २१२(α,β–,γ), २१३(α,β–,γ), २१४(β–,γ), २१५(β–) |
| ८४ | पोलोनियम | – | २०८(α,γ), २०९(α,K,γ), २१०(α,γ),
२११(α,γ), २१२(α), २१३(α),२१४(α), २१५(α), २१६(α), २१७(α), २१८(α) |
| ८५ | ॲस्टटीन | – | २०९(α,K,γ), २१०(K,γ), २११(α,K,γ), २१५(α),
२१६(α), २१७(α), २१८(α), २१९(α,β–) |
| ८६ | रेडॉन | – | २१८(α,γ), २१९(α,γ), २२०(α,γ), २२१(α,β–),
२२२(α,γ) |
| ८७ | फ्रान्सियम | – | २२०(α), २२१(α,γ), २२२(β–), २२३(β–) |
| ८८ | रेडियम | – | २२३(α,γ), २२४(α,γ), २२५(β–,α), २२६(α,γ),
२२७(β–,γ), २२८(β–) |
| ८९ | ॲक्टिनियम | – | २२५(α), २२६(β–), २२७(α,β–), २२८(β–,γ),२२९(β–) |
| ९० | थोरियम | – | २२७(α,γ), २२८(α,γ), २२९(α), २३०(α,γ), २३१(β–,γ),
२३२(α,γ), २३३(β–), २३४(β–, γ) |
| ९१ | प्रोटॅक्टिनियम | – | २३० (β–,K, γ), २३१(α,γ), २३२(β–,γ), २३३(β–,γ),
२३४(β–,γ) |
| ९२ | युरेनियम | – | २३१(α,K, γ), २३२(α,γ),२३३(α,γ),२३४(α,γ),
२३५(α,γ),२३६(α,γ), २३७(β–,γ), २३८(α,γ), २३९(β–,γ), २४०(β–) |
| कोष्टक क्र. २. मूलद्रव्ये व त्यांचे समस्थानिक (पुढे चालू) | |||
| अण-क्रमांक | मूलद्रवे | स्थिर समस्थानिक (%) | किरणोत्सर्गी समस्थानिक (उत्सर्जन) |
| ९३ | नेपच्यूनियम | – | २३१(α), २३२(K), २३३(K,α), २३४(α,β+,K, γ),
२३५(α, K), २३६(β–,K, γ),२३७(α,γ), २३८(β–,γ), २३९(β–,γ), २४०(β–,γ), २४१(β–) |
| ९४ | प्लुटोनियम | – | २३२(K,α), २३३(K,α), २३४(K,α), २३५(K,α),
२३६(α,γ),२३७(K, γ), २३८(α, γ),२३९(α,γ), २४०(α, γ), २४१(α, β–, γ), २४२(α), २४३(β–,γ), २४४(α), २४५(β–,γ), २४६(β–) |
| ९५ | अमेरिसियम | – | २३७(K,α), २३८(K, γ), २३९(α,K, γ), २४०(K, γ),
२४१(α,γ), २४२(β–,K, γ), २४३(α, γ), २४४(β–), २४५(β–), २४६(β–) |
| ९६ | क्यूरियम | – | २३८(K, γ), २३९(K), २४०(α), २४१(K, γ), २४२(α),
२४३(α, γ), २४४(α, γ), २४५(α, γ), २४६(α), २४७(α), २४८(α,SF),२४९(β–), २५०(SF) |
| ९७ | बर्केलियम | – | २४३(K,α), २४४(K,α), २४५(K,α), २४६(K, γ),
२४७(α, γ), २४८(β–,K), २४९(α, β–, γ), २५०(β–,γ) |
| ९८ | कॅलिफोर्नियम | – | २४४(α, K), २४५(K,α), २४६(α), २४७( K), २४८(α),
२४९(α, γ), २५०(α, γ, SF),२५१(α), २५२(α, γ, SF), २५३(β–), २५४(SF) |
| ९९ | आइन्स्टाइनियम | – | २४५(α), २४६(K,α), २४८(K,α), २४९(K,α), २५०(K),
२५१(α, K), २५२(α), २५३(α, γ), २५४((α, β–, K, γ), २५५(b–), २५६(b–) |
| १०० | फेर्मियम | – | २४८(α), २४९(α), २५०(α),२५१(α, K), २५२(α),
२५३(α, K), २५४(α, SF), २५५(α, SF), २५६( SF) |
| १०१ | मेंडेलेव्हियम | – | २५५(K, α),२५६(K) |
| १०२ | नोबेलियम | – | २५३(α), २५४(α), २५५(α), २५६(α) |
| १०३ | लॉरेन्सियम | – | २५७(α) |
| १०४ | (रदरफर्डियम) | – | २५७, २५९, २५८? २६१ |
| १०५ | (हानियम) | – | २६०, २६१ ? |
| १०६ | – | २६३,२५९ | |
| टीप : K – इलेक्ट्रॉन ग्रास; SF – उत्स्फूर्त भंजन | |||
सर्वात प्रचल क्षारकीय आहेत. LiOH हे दुर्बल क्षारकीय आहे. LiOH पाण्यात विरघळविल्यास फार थोडे OH – गट निर्माण होतात. कारण Li + आयनावरील विद्युत् भारामुळे त्याचे OH – आयनाशी जास्त आकर्षण निर्माण होते.
या मूलद्रव्यांची ऑक्साइडे, पेरॉक्साइडे, सुपर ऑक्साइडे [⟶ ऑक्साइडे ] तयार होतात ती अशी :
| O2 | ||||||
| Li | ⟶ | Li2 O | ||||
| O2 | O2 | |||||
| Na | ⟶ | Na2O | ⟶ | Na2 O2 | ||
| O2 | O2 | O2 | ||||
| K | ⟶ | K2O | ⟶ | K2O2 | ⟶ | KO2 |
रूबिडियम व सिझियम यांची ऑक्साइडे पोटॅशियमाप्रमाणे होतात. Li3o2 हे अस्तित्वात आहे परंतु ते अन्योन्य प्रतिष्ठापनानेच करता येते. त्याचप्रमाणे NaO2 हे ऑक्सिजनाच्या उच्च दाबाखाली करता येते. LiO2 तयार होत नाही.
रासायनिक दृष्ट्या ही मूलद्रव्ये अत्यंत क्रियाशील आहेत व ती हवेमध्ये उघडी राहिल्यास जलदपणे काळवंडतात व त्यांची ऑक्साइडे पृष्ठभागावर तयार होतात. Li पासून Cs कडे मूलद्रव्यांची पाण्याशी होणारी विक्रिया इतक्या जोरदारपणेवाढत जाते की, K पासून पुढे विक्रियेत निघणारा हायड्रोजन आपोआप पेट घेतो.या धातू अमोनियात विरघळतात व निळ्या रंगाचा विद्राव मिळतो. वायुरूपअमोनियाशी पाण्यावरच्या विक्रियेसारखी विक्रिया होऊन हायड्रोजन निघतो वअमाइड तयार होते.
2M + 2NH3 ⟶2MNH2 + H2
अमाइड
(M = गट १ अ मधील कोणतीही धातू).
ही अमाइडे क्षारकीय असून हायड्रॉक्साइडांशी मिळतीजुळती आहेत. या सर्व धातू हायड्रोजनाशी विक्रिया करतात व त्यापासून हायड्राइडे तयार होतात. ही हायड्राइडे कार्बनी रसायनशास्त्रात क्षपणक [⟶ क्षपण] म्हणून उपयोगी पडतात. लिथियम ॲल्युमिनियम हायड्राइड Li(AIH4) हे सर्वांत महत्त्वाचे आहे.
या क्षारीय धातू कार्बनी अम्लातील हायड्रोजनाचे प्रतिष्ठापन करतात उदा., सोडियम ॲसिटेट, पोटॅशियम बेंझोएट इत्यादी. लिथियम मिथिल (LiCH3) व सोडियम एथिल (NA.C2H5) अशासारखी सहसंयुजी संयुगेही तयार करतात. मात्र या धातूंची आयनी त्रिज्याइतर धातूंपेक्षा मोठी असल्यामुळे या धातू सामान्यतः जटिल संयुगे तयार करीतनाहीत तथापि काही अपवादात्मक जटिल संयुगे ज्ञात आहेत.

कर्णसंबंध: लिथियम हे या गटातील इतर मूलद्रव्यांपेक्षा निराळे आहे. त्याचे साम्य दुसऱ्या गटातील मॅग्नेशियमाशी आहे. कारण Li व Mg यांची ध्रुवण शक्ती [आयन विद्युत भार/(आयन त्रिज्या)2 ] जवळजवळ सारखी आहे. गटातील पहिले सदस्य मूलद्रव्य त्याच्या उजव्या बाजूच्या गटातील दुसऱ्या सदस्य मूलद्रव्याशी गुणधर्माने सारखे असते. याला कर्णंसंबंध असे म्हणतात. तो आ. २ मध्ये दर्शविला आहे. कर्णसंबंधाचा आविष्कार वाढत्या अणुभाराबरोबर कमी होत जातो.
लिथियमाची त्याच्या गटातील इतर मूलद्रव्यांशी असलेली विसंगतता व दुसऱ्या गटातील मॅग्नेशियमाशी असलेले साम्य पुढील स्पष्टीकरणावरून दिसून येईल : (१) वितळबिंदू व उकळबिंदू इतरांपेक्षा उच्च. (२) इतर मूलद्रव्यांपेक्षा Li कठीण आहे. (३) Li ची ऑक्सिजनाबरोबरचीविक्रिया संथ होते व उच्च ऑक्साइडेतयार होत नाही. (४) Li ची विद्युत् घनता इतरांपेक्षा कमी असल्यामुळे त्याची Li2CO3, LiOH3 व LiOH ही संयुगे कमी स्थिर आहेत आणि त्यांचे थोड्याशा तापमानाने अपघटन होऊन (रेणूचे तुकडे होऊन) त्यांचे Li2O या संयुगात रूपांतर होते. त्याचे घन बायकार्बोनेट होत नाही. (५) गट २ मधील मूलद्रव्यांप्रमाणे Li चे नायट्राइड (Li3N) तयार होते. (६) मॅग्नेशियमाप्रमाणे LiCO3, Li3PO4 व LiF ही संयुगे पाण्यात अविद्राव्य किंवा किंचित विद्राव्य अशी आहेत. गट १अ मधील इतर मूलद्रव्यांशी संबंधित संयुगे विद्राव्य आहेत. (७) Li व Mg यामूलद्रव्यांची संयुगे तयार करण्याची प्रवृत्ती असल्याने त्यांची हॅलाइडे वअल्किले कार्बनी विद्रावकात (विरघळणाऱ्या पदार्थात) विद्राव्य आहेत.
गट २ अ : [⟶ बेरिलियम (Be), मॅग्नेशियम (Mg), कॅल्शियम (Ca), स्ट्राँशियम (Sr), बेरियम (Ba) व रेडियम (Ra)]. या गटातील सर्व मूलद्रव्ये धातू आहेत व त्यांच्यात बहुरूपता आढळतनाही. मॅग्नेशियम व कॅल्शियम निसर्गात सर्वत्र आढळतात. स्ट्राँशियम वबेरियम कमी प्रमाणात आढळतात. बेरिलियम अल्प प्रमाणात मिळते. रेडियम हेकिरणोत्सर्गी मूलद्रव्य पिचब्लेंड या खनिजात युरेनियमाच्या किरणोत्सर्गीविघटनाने तयार होते व ते अत्यल्प प्रमाणात मिळते. गट २ अ मध्ये दोनप्रकारची मूलद्रव्ये असल्याचे स्पष्टपणे दिसून येते. दुसऱ्या लघू आवर्तातीलबेरिलियम व तिसऱ्या लघू आवर्तातील मॅग्नेशियम यांच्यात बरेच साम्य दिसूनयेते परंतु उरलेल्या चार मूलद्रव्यांशी (Ca, Sr, Ba व Ra) त्यांचे तितकेसेसाम्य दिसत नाही. या चार मूलद्रव्यांच्या समूहाला क्षारीय मृत्तिका असेम्हणतात.रेडियम ही धातू किरणोत्सर्गाच्या दृष्टीने अधिक महत्त्वाची आहे.
या गटातील मूलद्रव्यांच्या आणवीय संरचनेत बाहेरच्या कक्षेत दोन इलेक्ट्रॉन आहेत. हे दोन संयुजी इलेक्ट्रॉन निघून गेले की, अणूंची जी संरचना शिल्लक राहते (आयन) ती अक्रिय वायूंच्या संरचनेसारखी असते. त्यांच्या भौतिक गुणधर्मांकरिता कोष्टक क्र. १ पहा.
या मूलद्रव्यांच्या अणूंचे आकारमान मोठे आहे परंतु तदनुरूप गट १ अ मधील मूलद्रव्यांच्या अणूंपेक्षा कमी आहे. याचे कारणअसे की, केंद्रावर असलेल्या जादा विद्युत् भारामुळे परिकक्षेतीलइलेक्ट्रॉन आत ओढले जातात. यामुळे या गटातीलमूलद्रव्ये गट १ अ मधीलमूलद्रव्यांपेक्षा जास्त घट्ट आणि कठीण आहेत. यांचे वितळबिंदू उच्च आहेत.ही मूलद्रव्ये द्विसंयुजी असून त्यांची संयुगे आयनी आहेत. यांचे आयनीकरणवर्चस् गट १ अ च्या मूलद्रव्यांपेक्षा जास्त आहे. कारण यांचे अणू लहानअसल्याने इलेक्ट्रॉन घट्ट धरून ठेवले जातात. तसेच एकदा दोन संयुजीइलेक्ट्रॉनांपैकी एक इलेक्ट्रॉन काढून घेतली की, दुसरा इलेक्ट्रॉनकाढण्याकरिता जास्तच ऊर्जा लागते व ती जवळ जवळ दुप्पट असते.
गट १ अ मूलद्रव्यांपेक्षा गट २ अ मूलद्रव्यांची संयुगे भरपूर स्फटिकजलयुक्त असतात उदा., MgCI2 .6H2O, CaCI2 .6H2O, MaCI2.2H2O इत्यादी. यांच्या द्विसंयुजी आयनांची संरचना अक्रिय वायूंच्या संरचनेसारखीअसल्यामुळे त्यांची संयुगे प्रतिचुंबकीय (चुंबकामुळे अपसरण होणारी व आपलीस्थिती चुंबकीय प्रेरणा रेषांना काटकोनात ठेवण्याची प्रवृत्ती असलेली) वरंगहीन असतात. फक्त अम्ल मूलक रंगीत असेल, तरच संयुगे रंगीत असतात. या धातूगट १ अ धातूंपेक्षा कमी धन विद्युती आहेत, तरी देखील त्यांची पाण्याशीविक्रिया होऊन हायड्रोजन व धातवीय हायड्रॉक्साइडे तयार होतात. हीहायड्रॉक्साइडे गट अ च्या हायड्रॉक्साइडांपेक्षा दुर्बल आहेत याचे कारणआयनांवरील जादा विद्युत् भार हे आहे. उदा., Ca2+ व OH- यांमधील आकर्षण जादा विद्युत् भारामुळे जास्त असते आणि स्वतंत्र OH- आयन थोडे उरतात आणि Na+ व OH– यांमधील कमी आकर्षणामुळे OH– आयन भरपूर असतात.
या गटातील मूलद्रव्यांची काही वैशिष्ट्ये खालीलप्रमाणे आहेत.
(१)गटात वरून खाली विद्युत् घनता वाढत जाते.
(२)जालक ऊर्जा कमी होत जाते. आयनांच्या पृष्टभागावरील धन विद्युत् भार बेरिलियमापासून रेडियमाकडे कमी होत जातो. त्यामुळे संयुगांची विद्राव्यता Be ते Ra अशी वाढत जाते. उदा.,
Mg(OH)2 Ca(OH) 2 Sr(OH) 2 व Ba(OH) 2
अविद्राव्य किंचित विद्राव्य विद्राव्य
(३)जालक ऊर्जा व जलसंयोगी ऊर्जा यांच्या प्रमाणावर विद्राव्यता अवलंबून असते. त्यामुळे काही वेळा विद्राव्यता कमीदेखील होत जाते. उदा.,
MgSO4 Ca SO4 Sr SO4 व Ba SO4
विद्राव्य किंचितविद्राव्य अविद्राव्य
(४)जलसंयोगी ऊर्जा Be ते Ra कमी होत जाते. याचा अर्थ मूलद्रव्यांच्या संयुगांत स्फटिकजल कमी होत जाते. उदा., MgSO4.7H2O, CaSO4.2H2O, BaSO4 (स्फटिकजल नाही).
क्षारीय मृत्तिका मूलद्रव्यांची पाण्याशी ताबडतोब विक्रिया होते आणि हायड्रोजन व हायड्रॉक्साइडे तयार होतात. मॅग्नेशियम फक्त उकळत्या पाण्याचे अपघटन करू शकते. बेरिलियमाची वाफेशी उच्च तापमानालादेखील विक्रिया होत नाही. या मूलद्रव्यांचे क्षारकीय बल Be पासून Ba पर्यंत वाढत जोते. हे त्यांच्या कार्बोनेटांच्या अपघटन तापमानावरून दिसून येते.
संयुग BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
अपघटन < १०० ५४० ९०० १२९० १३६०
तापमान (oसे.)
पेरॉक्साइडे तयार होण्याची सहजता वाढत जाते.
| O2 | ||||
| Mg | ⟶ | MgO | ||
| O2 | ||||
| Ca | ⟶ | CaO | ||
| O2 | O2 | |||
| Sr | ⟶ | SrO | ⟶ | SrO2 |
| O2 | O2 | |||
| Ba | ⟶ | BaO | ⟶ | BaO2 |
गट १ अ मधील मूलद्रव्यांसारखी यांची सुपर ऑक्साइडे तयार होत नाहीत. बेरिलियम व मॅग्नेशियम रेणवीय ऑक्सिजनाशी सरळ संयोग पावतात व त्यांची Beo व MgO अशी ऑक्साइडे तयार होतात. या विक्रियेत प्रकाश व उष्णता निर्माण होतात.
बेरिलियमाशिवाय इतर मूलद्रव्ये MH2 (M = धातू) अशी हायड्राइडे हायड्रोजनाशी संयोग करून तयार करतात. ही सर्वक्षपणके आहेत व पाण्याबरोबरील विक्रियेत हायड्रोजन तयार करतात. बेरिलियम वमॅग्नेशियम हायड्राइडे बहुधा सहसंयुगी बहुवारिके [⟶ बहुवारिकीकरण] आहेत व इतर हायड्राइडे आयनी आहेत. सर्व मूलद्रव्ये हॅलोजनाशी विक्रिया करून MX2 सारखी हॅलाइडे तयार करतात. यांची M3N2 अशा सूत्राची नाइट्राइडे तयार होतात. यांची कार्बाइडेही तयार होतात. Ca, Sr व Ba यांची MC2 अशी कार्बाइडे तयार होतात व पाण्याच्या विक्रियेने त्यांच्यापासून ॲसिटिलीन (C2H2) व हायड्रॉक्साइडे मिळतात. बेरिलियमाच्या बेरिलियमाच्या Be2C या कार्बाइडावर पाण्याची विक्रिया केल्यास ॲल्युमिनियमाच्या AI2C3 या कार्बाइडाप्रमाणे मिथेन (CH4) मिळतो. MgC2 तापविल्यास त्यापासून Mg2C3 असे कार्बाइड मिळते व ते पाण्याबरोबर ॲलिनीन (मिथिल ॲसिटिलीन) देते.
बेरिलियम व मॅग्नेशियम जटिल संयुगे तयार करतात. ⇨ हरितद्रव्य (क्लोरोफिल) हे मॅग्नेशियमाच्या जटिल संयुगाचे उत्तम उदाहरण होय. Ca, Sr, Ba ही मूलद्रव्ये प्रबल जटिल कारकाबरोबरच जटिल संयुगे तयार करू शकतात.ॲसिटिल ॲसिटोन व एथिलीन डायअमाइन टेट्राॲसिटिक अम्ल (EDTA) याविक्रियाकारकांशी त्यांची जटील संयुगे तयार होऊ शकतात.
कर्णसंबंध:या गटातील पहिले मूलद्रव्य बेरिलियम हे इतरांपासून गुणधर्मांनी निराळेआहे. त्याचे तिसऱ्या गटातील ॲल्युमिनियमाशी साधर्म्य आहे. पुढीलमुद्यांवरून त्याचे इतरांशी असलेले वेगळेपण व ॲल्युमिनियमाशी असलेलेसाधर्म्य विशद होईल : (१) बेरिलियमाचा अणू इतरांपेक्षा लहान असल्यानेत्यावर विद्युत् भाराची घनता जास्त आहे. त्यामुळे सहसंयुजी संयुगे तयारकरण्याची प्रवृत्ती इतरांपेक्षा जास्त आहे. त्यामुळे बेरिलियमाच्यासंयुगांचे वितळबिंदू इतरांच्या संयुगांच्या मानाने कमी आहेत. उदा., BeF2 चा वितळबिंदू ८०००से. आहे, तर इतरांच्या फ्ल्युओराइडांचा वितळबिंदू १३०००से. च्या आसपास आहे. (२) गट १ अ व गट २ अ यांतील मूलद्रव्यांची जटिलसंयुगे तयार करण्याची प्रवृत्ती नाही परंतु गट ३ अ मधीलमूलद्रव्यांप्रमाणे बेरिलियमाची जटिल संयुगे तयार होतात. (३) बेरिलियम धातूॲल्युमिनियम धातूप्रमाणे नायट्रिक अम्लाबरोबर निष्क्रिय होते. (४)बेरिलियम ॲल्युमिनियमाप्रमाणे उभयधर्मी आहे. तिच्यावर सोडियमहायड्रॉक्साइडाची विक्रिया होऊन हायड्रोजन निघतो व बेरिलेट तयार होते. अशाविक्रियेने ॲल्युमिनियमापासून ॲल्युमिनेटे तयार होतात. (५) Be2C व AI4C3 यांच्या जलीय विच्छेदनाने (पाण्याच्या विक्रियेने रेणूचे तुकडे होण्याच्या क्रियेने) मिथेन तयार होतो.
P वर्ग मूलद्रव्ये : गट ३ अ :[ बोरॉन (B), ॲल्युमिनियम (Al), गॅलियम (Ga), इंडियम (In), आणि थॅलियम (Tl)]. या गटातीलमूलद्रव्यांच्या अणूंचा इलेक्ट्रॉनविन्यास पाहता त्यांच्या शेवटच्याकक्षेत s परिकक्षेचे दोन व p परिकक्षेचे एक असे तीन इलेक्ट्रॉन आहेत.त्यामुळे त्यांची संयुजा तीन आहे असे दिसून येते. या गटात बोरॉन वॲल्युमिनियम यांचा एक व गॅलियम, इंडियम आणि थॅलियम यांचा एक असे दोन उपगटपडतात व त्यांच्या गुणधर्मातही फरक आढळतो. याचे कारण B व Al यांचे संयुजीइलेक्ट्रॉन गेले की, मागे अक्रिय वायूंची (He व Ne) संरचना शिल्लक राहते व Ga, In व Tl यांत ती असत नाही. या मूलद्रव्यांपैकी Al हे निसर्गात विपुलप्रमाणात आढळते आणि बाकीची अल्प प्रमाणात आढळतात.
बोरॉन हे मूलद्रव्य अधातू आहे आणि स्तंभात वरून खाली (B ⟶ Tl) धातवीय गुणविशेष वाढत जातो. Tl हे मूलद्रव्य पूर्णतया धातू आहे. तथापिया गटातील धातू दुर्बल आहेत. आयनांचे लहान आकारमान, त्यांचा उच्च विद्युत्भार व आयनीकरण वर्चसाचे उच्च मूल्य यांवरून या मूलद्रव्यांची संयुगेबव्हंशी सहसंयुजी आहेत, असे अनुमान काढता येते. बोरॉनाशिवाय इतर मूलद्रव्येफक्त p1 इलेक्ट्रॉन वापरून एक संयुजादेखील दाखवतात. B व Al यांची त्रिसंयुजी संयुगे तयार होतात. Al ची एकसंयुजी AICI व AIBr अशीसंयुगेही तयार होतात. Tl ची एकसंयुगे तयार करण्याचा कल सर्वांत अधिक आहे.
या मूलद्रव्यांची ऑक्साइडे त्रिसंयुजी आहेत. या ऑक्साइडांच्या गुणधर्मांवरून त्यांचा अधातवीय गुणविशेषापासून धातवीय गुणविशेष कसा वाढत जातो ते दिसून येते.
| B2O3 | Al2O3 | Ga2O3 | In2O3 | Tl2O3 |
| अम्लिय | उभयधर्मी | उभयधर्मी | क्षारीय | क्षारीय |
ही मूलद्रव्ये जटिल संयुगे तयार करतात. बोरॉनाची हायड्राइडे किंवा बोरोने [⟶ बोरॉन] तयार होतात. Al, Ga व In ही मूलद्रव्ये वैशिष्ट्यपूर्ण समरूपी तुरट्या तयार करतात. [⟶ तुरटी].
गट ४ अ: [कार्बन (C), सिलिकॉन (Si), जर्मेनियम (Ge), कथिल (Sn) आणि शिसे (Pb)]. या गटातील मूलद्रव्यांचा इलेक्ट्रॉन विन्यास असे दर्शवितो की, यांच्याअणूंच्या शेवटच्या कक्षेत s परिकक्षाचे दोन व p परिकक्षाचे दोन असे चारइलेक्ट्रॉन आहेत. यांची संयुजा चार होते परंतु कथिल व शिसे यांच्याबाबतीत दोन p– इलेक्ट्रॉन निघून गेले की, उरलेली s2 इलेक्ट्रॉनांची जोडी निष्क्रिय बनते व त्यांची संयुजा दोनही असू शकते. कार्बन व सिलिकॉन यांची संयुगे सहसंयुजी असतात. अधातूपासून धातूकडेजाण्याचा कल वाढत्या अणुक्रमांकाबरोबर वाढत जातो. कार्बन व सिलिकॉन हीमूलद्रव्ये अधातू आहेत व बाकीची धातू आहेत. कार्बन व कथिल बहुरूपतादर्शवितात.
कार्बन हा या गटातील पहिला सदस्य असून त्याचे वैशिष्ट्य म्हणजे साखळीसारखी व वलयी संयुगे तयार करणे [⟶ कार्बन]. कार्बनाची असंख्य संयुगे आहेत [⟶ कार्बनी रसायनशास्त्र ॲलिफॅटिक संयुगे ॲरोमॅटिक संयुगे]. सिलिकॉन काही अंशी कार्बनसारखी साखळी व वलयी संयुगे तयार करू शकते [⟶ सिलिकॉन]. कार्बन व सिलिकॉन ही इतरांपासून वेगळ्या गुणधर्मांची आहेत या गटातीलमूलद्रव्यांमध्ये फारसा सुसंवाद नाही. तथापि काही गुणधर्म सारखे आहेत, तेपुढीलप्रमाणे: (१) सर्वांची संयुजा ४ आहे कथिल व शिसे यांचीसंयुजा २ व ४आहे. (२) सर्व मूलद्रव्ये बहुरूपता दाखवितात.त्यातल्या त्यात विशेषकरूनकार्बन व कथिल, बहूरूपता ही असंक्रमणी मूलद्रव्यांत आवर्त सारणीतील गट ४, ५व ६ यांमधील मूलद्रव्यात दिसून येते. (३) सर्व मूलद्रव्ये XO2 या सूत्राची ऑक्साइडे तयार करतात.त्यात C, Si व Ge यांची ऑक्साइडे अम्लिय आहेत आणि Sn व Pb यांची उभयधर्मी आहेत. (४) सर्व MH4 सूत्राची हायड्राइडे तयार करतात.या हायड्राइडांचे स्थैर्य C ते Pb कमी होत जाते (५) सर्वांची XCI4 अशा सूत्राची द्रवरूप क्लोराइडे तयार होतात. (६) सर्व कार्बनी (जैव)संयुगे तयार करतात परंतु कार्बनाइतकी कोणीच तयार करत नाही. (७) कार्बन वसिलिकॉन यांचा वितळबिंदू अतिशय उच्च आहे.
गट ५ अ: [नायट्रोजन(N), फॉस्फरस(P), आर्सेनिक (As), अँटिमनी (Sb) आणि बिस्मथ(Bi)]. या गटातील मूलद्रव्यांच्या शेवटच्या कक्षेत s2 व p3 असे पाच इलेक्ट्रॉन आहेत. त्यामुळे त्यांची संयुजा ३ व ५ अशी आहे.नायट्रोजनाची संयुजा १ ते ५ आहे. चौथ्या गटाप्रमाणे हाही गट अधातू तेदुर्बल धातू असलेला आहे. नायट्रोजन व फॉस्फरस हे अधातू आहेत, आर्सेनिक हेधात्वाभ (धातू व अधातू या दोहोंचे गुणधर्म असलेले ) आहे आणि अँटिमनी वबिस्मथ या दुर्बल धातू आहेत.
संयुजा तीन : या स्तंभात वरून खाली (N ते Bi विद्युत् धनता गुणविशेष वाढत जातो. नायट्रोजन त्याच्या नायट्राइडामध्ये (LiN3) N3_ अशी विद्युत् ऋणता (इलेक्ट्रॉन आकर्षित करून ऋण विद्युत् भार वाढविण्याची प्रवृत्ती) दाखवतो. नायट्रोजनाची १+ते ५+अशा संयुजा त्याच्या ऑक्साइडांवरून दिसून येतात [⟶ नायट्रोजन]. सर्व मूलद्रव्ये तीन सहसंयुजा दाखवितात. P परिकक्षेतील तीन इलेक्ट्रॉनदुसऱ्या तीन इलेक्ट्रॉन देणाऱ्या मूलद्रव्यांशी सहसंयुजी बंध निर्माणकरतात उदा., NH3, PH3 इत्यादी. या बंधामुळे अष्टक तयार होते. गटात वरून खाली या सहसंयुजेचा विद्युत् संयुजेत बदल होतो उदा., As3+, Sb3+ वBi3+. याचे कारण s कक्षेतील दोन इलेक्ट्रॉन निष्किय होतात, असे मानले जाते.
संयुजा पाच : पाच ही सहसंयुजा नायट्रोजनाशिवाय इतर सर्व मूलद्रव्ये दाखवितात. नायट्रोजनाला ls2, 2s2 व 2p3 असेपरिकक्ष आहेत. पाच सहसंयुजेने दुसऱ्या कक्षेत ५ +५ =१० इलेक्ट्रॉन होतील परंतु त्या कक्षेत ८ पेक्षा जास्त इलेक्ट्रॉन मावू शकत नाहीत म्हणूननायट्रोजन पाच सहसंयुजा दाखवू शकत नाही.
या गटातील मूलद्रव्यांत भौतिक गुणधर्मांत हळूहळू संक्रमण होते. नायट्रोजन वायुरूप आहे. फॉस्फरस सहजगत्या बाष्पीभूत होणारे मूलद्रव्य आहे. इतर मूलद्रव्ये घनरूप असून त्यांचे वितळबिंदू तसे उच्च आहेत.
या गटातील सर्व मूलद्रव्यांची हायड्राइडे (XH3 X = गटातील कोणतेही मूलद्रव्य) वायुरूप आहेत. त्यांची स्थिरता व क्षारकीय गुणविशेष N ते Bi कमी होत जातात. अमोनिया (NH3) प्रबल क्षारकीय व तसा स्थिर आहे. फॉस्फाइन (PH3) हे दुर्बल क्षारकीय आहे. अर्साइन(AsH3) आणि स्टिबाइन (SbH3) अस्थिर असून त्यांत क्षारकीय गुणधर्म अजिबात नाहीत. बिस्मथाचे अतिशयअस्थिर असे हायड्राइड तयार होते व ते बहुधा अम्लीय असावे कारण तेक्षारामध्ये विरघळते.
या गटाची प्रारूपिक (नमुनेदार) ऑक्साइडे म्हणजे R2 O3 R2 व O5 (R = गटातीलकोणतेही मूलद्रव्य) ही होत. या ऑक्साइडांचा अम्लीय गुणविशेषनायट्रोजनापासून बिस्मथाकडे कमी होत जातो. नायट्रोजन व फॉस्फरस यांचीऑक्साइडे बरीचशी मिळतीजुळती आहेत. आर्सेनिक, अँटिमनी व बिस्मथ यांचीऑक्साइडे उभयधर्मी आहेत.
यांची हॅलाइडे पाण्याशी निरनिराळ्या तऱ्हेने विक्रिया करतात. नायट्रोजन ट्राय क्लोराइडाचे जलीय विच्छेदन होत नाही. बाकीची जलीय विच्छेद्य आहेत. इतर गटांप्रमाणे याही गटातील नायट्रोजन हा पहिला सदस्य बाकीच्या मूलद्रव्यांहून वेगळा आहे. नायट्रोजन बऱ्याच बाबतींत फॉस्फरसाशी समान आहे. नायट्रोजनाची पंचसंयुजी संयुगे फॉस्फरसाच्या पंचसंयुजी संयुगांपेक्षा कमी स्थिर आहेत.
फॉस्फरस व आर्सेनिक गुणधर्माने निकटवर्ती आहेत. बहुरूपता, क्षपणकारक हायड्राइडे, समान संरचनेची अम्ले व समान विक्रिया याबाबतींतत्यांच्यात पुष्कळ साम्य आहे. आर्सेनिक व अँटिमनी हे त्यांच्या गुणधर्मात वसंयुगांत गटामध्ये सर्वांत अधिक निकटवर्ती आहेत. बिस्मथ ही गटातीलवैशिष्ट्यपूर्ण धातू आहे.
गट ६ अ: [ऑक्सिजन(O), गंधक (S), सिलिनियम (Se), टेल्यूरियम (Te) आणि पोलोनियम (Po)]. यातील पहिल्या चार मूलद्रव्यांना (O, S, Se Te) चाल्कोजेन्स (निसर्गातखनिजे तयार करणारी मूलद्रव्ये) असे म्हणतात. पुष्कळशी धातवीय खनिजेऑक्साइडे किंवा सल्फाइडे आहेत. ऑक्सिजन व गंधक यांमध्ये अघातवीय गुणविशेषतीव्रतेने आहे आणि सिलिनियम व टेल्यूरियम यांमध्ये कमी प्रमाणात आहे.पोलोनियम किरणोत्सर्गी व अल्पजीवी आहे परंतु त्यात धातवीय गुणविशेष ठळकपणेदिसून येतो.
या मूलद्रव्यांच्या शेवटच्या कक्षेत s2 व p4 असे सहा संयुजा इलेक्ट्रॉन आहेत. ऑक्सिजनाने दोन इलेक्ट्रॉन घेतले म्हणजेत्याचे अष्टक पूर्ण होते म्हणून ऑक्सिजनाची संयुजा फक्त दोनच असू शकते.मात्र ती विद्युत् संयुजा किंवा सहसंयुजा असू शकते. घातवीय ऑक्साइडामध्येऑक्सिजन ऋणायन (O2-) म्हणून असतो. पाण्याच्या रेणूमध्ये तो सहसंयुजाबंधी असतो. ऑक्सिजनाला d परिकक्ष नसल्याने फक्त दोन हीच त्याची ऑक्सिडीकरण अवस्था [⟶ ऑक्सिडीभवन] असते.गटातील बाकीच्या मूलद्रव्यांना d परिकक्ष उपलब्धअसल्याने त्यांची संयुजा ४ व ६ असू शकते. गंधकाच्या बाबतीत त्याचे अणूउत्तेजित केले असता इलेक्ट्रॉन d परिकक्षेत जाऊन चार व सहा संयुजेची संयुगे तयार होऊ शकतात.

सल्फर हेक्झॅफ्ल्युओराइड(SF6) यामध्ये त्याची संयुजा सहा आहे.
या मूलद्रव्यांचे वितळबिंदू, उकळबिंदू, घनताइ. भौतिक गुणधर्म क्रमाने बदलत जातात. सर्व मूलद्रव्ये बहुरूपी आहेत. सर्व मूलद्रव्ये हायड्राइडे तयार करतात. त्यात पाणी (H2O) हे विशिष्ट आहे. बाकीच्या हायड्राइडांची स्थिरता O पासून Te कडे कमी होतजाते. गंधक ते टेल्यूरियम हायड्राइडांचा उकळबिंदू वाढत जातो. (H2S उकळबिंदू – ६१° ·८ से. H2Se – ४२° से. व H2Te 0° से.). S, Se व Te या मूलद्रव्यांची ऑक्साइडे आणि सल्फाइडे गुणधर्म व विक्रिया यांबाबत सर्वसाधारणपणे सारखी आहेत.
गंधक, सिलिनियम व टेल्यूरियम यांची नीचतर ऑक्साइडे अम्लीय आहेत. ऑक्साइडांची स्थिरता व अम्लीयता कमी होत जाते. टेल्यूरियम ऑक्साइड व पोलोनियम ऑक्साइड उभयधर्मी आहेत.
सिलिनियम, टेल्यूरियम व पोलोनियम ही जास्त विद्युत् घनता असलेली मूलद्रव्ये जटिल आयन तयार करू शकतात, उदा.,(SeF6)2+, (TeCl6)2+ आणि (PoCl6)2+ या आयनांची साधारणपणे क्षारीय धातू व अमोनिया यांपासून जटिल लवणे तयार होतात. उदा., K2(TeCl6), (NH4)2 (PoCl6).
गट ७ अ: [फ्ल्युओरीन (F), क्लोरीन (Cl), ब्रोमीन (Br), आयोडीन (I) आणि ॲस्टटीन (At)]. या गटातील सर्व मूलद्रव्यांच्या शेवटच्या संयुजा कक्षेत s2 p5 असे सात इलेक्ट्रॉन आहेत. बाहेरून एक इलेक्ट्रॉन घेऊन वा एकाइलेक्ट्रॉनाशी सहभाग करून अक्रिय वायूचे अष्टक सर्वात तयार होते. सर्वांचीसंयुजा एक आहे (विद्युत् संयुजी NaCI, CaBr2 व सहसंयुजी HCI, CI2 इ.).फ्ल्युओरिनाचीऑक्सिडीकरण अवस्था फक्त एक आहे कारण फ्ल्युओरीन हे सर्वाधिक विद्युत् ऋणताअसलेले आहे. विद्युत् ऋणता फ्ल्युओरीन ते ॲस्टटीन कमी होत जाते. बाकीच्यामूलद्रव्यांची ऑक्सिडीकरण अवस्था +१, +३, +५ व +७ अशीही असू शकते [⟶ हॅलोजन]. ही सर्व मूलद्रव्ये अधातू असून बहुरूपता दाखवत नाहीत. ॲस्टटीन हे मूलद्रव्य किरणोत्सर्गी आहे.
या गटातील मूलद्रव्यांचे गुणविशेष इतर गटांपेक्षा एकमेकांशी अधिक मिळतेजुळते आहेत. सर्व मूलद्रव्यांचे रेणू द्विआणवीय आहेत. फ्ल्युओरीन व क्लोरीन वायुरूप आहेत. ब्रोमीन द्रवरूप व आयोडीन घनरूप आहे. यांचे वितळबिंदू व उकळबिंदू वाढत्या अणुभाराबरोबर वाढत जातात. फ्ल्युओरिनाच्या रेणूमधील बंधन ऊर्जा कमी असते कारण अणूमध्ये अबंधक इलेक्ट्रॉनांचे प्रतिकर्षण चालू असते. क्लोरीन, ब्रोमीन व आयोडीन यांच्या रेणूत d परिकक्ष, बंध तयार होण्याकरिता उपलब्धहोऊ शकतो व त्यामुळे त्यांच्यात बंधन ऊर्जा जास्त असते. हॅलोजनांचे आयनीकरणवर्चस् अधिक असल्यामुळे इलेक्ट्रॉन गमावण्याची प्रवृत्ती त्यांच्यात कमीअसते. सर्व हॅलोजनांचे रेणू रंगीत आहेत. दृश्य प्रकाशाच्या शोषणामुळे हेरंग येतात. फ्ल्युओरीन जांभळ्या रंगाचे शोषण करतो म्हणून त्याचा रंग फिकटपिवळा दिसतो. आयोडीन पिवळ्या रंगाचे शोषण करतो म्हणून त्याचा रंग जांभळा दिसतो.
ही सर्व मूलद्रव्ये ऑक्सिडीकारक आहेत. फ्ल्युओरीन हे सर्वांत प्रबल ऑक्सिडीकारक आहे. सर्व मूलद्रव्ये धातू व अधातूंशी विक्रिया करतात. फ्ल्युओरीन हे अतिशय विक्रियाशील आहे. विक्रियाशीलता वाढत्या अणुभाराबरोबर कमी होत जाते. फ्ल्युओरिनाची अतिविक्रियाशीलता त्याच्या बंधाची उर्जा कमी असल्यामुळे आहे. विक्रियाशीलता हॅलोजनांच्या पाण्याशी होणाऱ्या विक्रियेवरून स्पष्ट होते.फ्ल्यूओरिन थंड पाण्याचे अपघटन सूर्यप्रकाशामध्ये व सावकाश होते.आयोडिनाची पाण्याशीविक्रिया होत नाही.
या गटातील सर्व मूलद्रव्यांची हायड्रोजन हॅलाइडे (HX) अम्ले आहेत.त्यांचे पाण्याबरोबर आयनीकरण होते (H+,X–). यांची लवणे तयार होतात. आयनीकरण हायड्रोफ्लुओरिक अम्लापासून (HF) हायड्रिआयोडिक अम्लांकडे(HI) वाढत जाते.हायड्रोजन-हॅलोजन यांमधील बंधनऊर्जा HF पासून HI कडे कमी होत जाते. धातविय हॅलाइडे ही बहुधा आयनीअसतात. एखाद्या धातूची क्लोराइडे, ब्रोमाइडे व आयोडाइडे बहुधा एक सारखीअसतात परंतु त्याच धातूची फ्ल्युओराइडे क्वचित असंगत असू शकतात. उदा.,AgF हे पाण्यात विद्राव्य आहे परंतु इतर सिल्व्हर हॅलाइडे अविद्राव्यआहेत. उलट CaF2 हे अविद्राव्य, तर कॅल्शियम हॅलाइडे(CaCI2, CaBr2 इ.) विद्राव्य आहेत. हॅलोजनांची ऑक्साइडे तयार होतात. ती अम्लधर्मी असून त्यांची पाण्याबरोबर अम्ले तयार होतात. F2O या फ्ल्यूओरिन ऑक्साइडाला ऑक्सिजन फ्ल्युओराइड असे म्हणतात कारणफ्ल्युओरिन ऑक्सिजनापेक्षा जास्त विद्युत् ऋण आहे व सूत्र लिहितानाविद्युत् ऋण मूलद्रव्य शेवटी लिहितात म्हणून फ्ल्युओरिन ऑक्साइड OF2 असे लिहितात.
ऑक्सिअम्लांमध्ये क्लोरिनाची ऑक्सिअम्ले महत्त्वाची आहेत [⟶ क्लोरिन]. त्यांची ऑक्सिडीकारकता ऑक्सिजन अणूंच्या वाढत्या संख्येबरोबर कमी होत जाते.
गट ० (शून्य) किंवा अभिजात वा अक्रिय वायू गट : [ हीलियम (He), निऑन (Ne), आर्गॉन (Ar), क्रिप्टॉन (Kr), झेनॉन (Xe) आणि रेडॉन (Rn)].या मूलद्रव्यांच्या शेवटच्या कक्षेत s2p6 असे आठ इलेक्ट्रॉन असतात.मात्र होलियमात फक्त s2 दोनचइलेक्ट्रॉन असतात. हिलियमाचे दोन इलेक्ट्रॉन त्याची कक्षा पूर्ण करतात. इतरांचे शेवटच्या कक्षेतील अष्टक पूर्ण झालेले असते. ही मूलद्रव्येदुसऱ्या मूलद्रव्यांना इलेक्ट्रॉन देत नाहीत व दुसऱ्याचा इलेक्ट्रॉन घेतनाहीत किंवा दुसऱ्या इलेक्ट्रॉनाशी सहभागीही होत नाहीत. म्हणूनच यामूलद्रव्यांना ⇨ अक्रिय वायु किंवा अभिजात वायू असे म्हणतात.इलेक्ट्रॉनांचा विनिमय होत नसल्यामुळे यांची संयुजा शून्य आहे. म्हणून यांना शून्य गटातील मूलद्रव्ये म्हणतात.मेंडेलेव्ह यांच्या आवर्त सारणीत त्यांना डावीकडे प्रथम स्थान दिले गेले होते म्हणजे संयुजेप्रमाणे ०, १, २, ३ असे गट ओळीने येतात परंतू इलेक्ट्रॉन विन्यास अभ्यासाने असेदिसून आले की, ही मूलद्रव्ये p वर्गातील मूलद्रव्ये आहेत व ती बोर-टॉम्पसनसारणीत उजव्या टोकास मांडली जातात.
या मूलद्रव्यांच्या अणूंची इलेक्ट्रॉन आसक्ती शून्य आहे त्यांचे आयनीकरण वर्चस् इतर कुठल्याही मूलद्रव्यांपेक्षा अधिक आहे.त्यामुळे ही मूलद्रव्ये एकआणवीय आहेत.हीलियम हे मूलद्रव्य अनन्य आहे.याचे घनीभवन दाबाखाली शक्य होते. याच्या दोन द्रवरूप स्थिती आहेत [⟶ हिलियम]. अलिकडे या मूलद्रव्यांची काही संयुगे बनविण्यात आली आहेत.
d वर्ग मूलद्रव्ये अथवा संक्रमणी मूलद्रव्ये :आवर्ती वर्गीकरणानुसार आतापर्यंत गट क्रमानूसार चर्चिलेलीमूलद्रव्येअ गट किंवा प्रातिनिधिक कुलातील मूलद्रव्ये होत.या s व p वर्गात मोडणाऱ्या मूलद्रव्यांचे वैशिष्ट्य म्हणजे मूलद्रव्यात गटक्रमानुसार शेवटच्या परिकक्षेत एका संयुजी इलेक्ट्रॉनाची भर होऊन १ अ ते ७ अगट तयार झालेले आहेत. यांतील उभ्या गटातील मूलद्रव्ये संयुजा, भौतिक वरासायनिक गुणधर्म या बाबतींत एकमेकांशी मिळतीजुळती आहेत. d वर्ग हा s व p या दोन वर्गांच्या मध्ये आहे [⟶ आवर्त सारणी].
या d वर्गातील मूलद्रव्यांना ‘संक्रमणी’ मूलद्रव्ये म्हणतात. संक्रमणीमूलद्रव्यांत इलेक्ट्रॉनांचे समावेशन आतल्या कक्षांमध्ये होते. हे समावेशनकाही मूलद्रव्यात उपांत्य कक्षेत व काहींच्या उपउपांत्य कक्षेत होते [⟶ अणु व आणवीय संरचना संक्रमणी मूलद्रव्ये].
ही सर्व मूलद्रव्ये धातू असून ती गट २ अ मधील धातूंप्रमाणे आहेत. संक्रमणीमूलद्रव्यांत काही संरचनात्मक दृष्ट्या वैशिष्ट्यपूर्ण, मूल्यवान वमिश्रधातू तयार करणारी अशी मूलद्रव्ये आहेत. त्यांचे आयन रंगीत असतात.
गट ३ ब: [स्कँडियम(Sc), इट्रियम (Y), लँथॅनम (La) आणि ॲक्टिनियम (Ac)]. या मूलद्रव्यांच्या शेवटच्या कक्षेत d1s2 असे तीन इलेक्ट्रॉन आहेत. यांची ऑक्सिडीकरण अवस्था तीन आहे. या मूलद्रव्यांचा काही वेळा ⇨ विरल मृत्तिका मूलद्रव्य गटात समावेश करतात. तथापि ही मूलद्रव्ये d वर्गातील असून विरल मृत्तिका f वर्गातील मूलद्रव्ये आहेत आवर्त सारणीतलँथॅनमाच्या जागेत सर्व विरल मृत्तिका मूलद्रव्ये एकत्र घातली जातात.
दोन s व एक d मिळून तीन इलेक्ट्रॉन निघून गेल्यावर मागे पूर्ण भरलेली कक्षा रहातअसल्यामुळे यांची संयुगे रंगहीन व प्रतिचुंबकीय आहेत. या धातू क्रियाशीलअसून त्यांचे वितळबिंदू उच्च आहेत. गट २ अ मधील धातूंप्रमाणे या धातूपाण्याशी विक्रिया करतात आणि त्यातून हायड्रोजन निघतो व त्यांचीहायड्रॉक्साइडे तयार होतात. स्कँडियम हायड्रॉक्साइड [Sc(OH)3] हे कॅल्शियम हायड्रॉक्साइडापेक्षा कमी क्षारकीय आहे व ॲल्युमिनियमहायड्रॉक्साइड या उभयधर्मी हायड्रॉक्साइडापेक्षा जास्त क्षारकीय आहे. हीक्षारकता गटामध्ये वाढत्या अणुभाराबरोबर वाढत जाते. या गटातील धातवीय आयनसाधारणपणे मोठे असल्याने यांची जटिल लवणे फारशी होत नाहीत. स्कँडियम आयनसर्वांत लहान असल्याने त्याची काही जटिल लवणे तयार होतात.
ॲक्टिनियम हे नेहमी युरेनियम व थोरियम यांच्याबरोबर संबंधित असल्याचेआढळते. त्याचे निसर्गात दोन समस्थानिक आढळतात व दोन्ही किरणोत्सर्गी आहेत.त्यांचे अर्धायुकाल २२ वर्षे व ६ तास असे आहेत.
गट ४ ब: [टिटॅनियम (Ti), झिर्कोनियम (Zr), हाफ्नियम (HF) आणि थोरियम (Th)]. या मूलद्रव्यांच्या संयुजी इलेक्ट्रॉनांचा विन्यास d2 s2 असा आहे. यातील थोरियम‘f’ वर्गात आहे. या मूलद्रव्यांत एकमेकांत साधर्म्य दिसून येते. विशेषतःझिर्कोनियम व हाफ्नियम यांचे रासायनिक गुणधर्म जवळजवळ एकरूप आहेत. याचेकारण लँथॅनाइड संकोचनामुळे [⟶ संक्रमणी मूलद्रव्ये] दोहोंच्या अणूंचे व आयनांची आकारमाने सारखी आहेत. या सर्वांत टिटॅनियम हेमहत्त्वाचे आहे. ते वजनाने हलके व क्षरण प्रतिरोधी (झीज होण्यास रोधकरणारे) असल्याने त्याचा फार उपयोग होतो.
या सर्व धातू दुर्बल धातू आहेत हे टिटॅनेटे यांसारख्या संयुगांवरून दिसून येते.त्यांचा अँटिमनी , बिस्मथ यांच्यासारखी क्षारीय लवणे तयार करण्याकडे विशेष कल आहे. यांचीमुख्य संयुजा चार आहे. काहींची २ व ३ या संयुजेचीसंयुगेही तयार होतात.चार संयुजेची संयुगे स्थिर आहेत. टिटॅनियम ट्रायक्लोराइड (TiCl3) हे प्रबळ क्षपणकारक आहे. ते घनफळात्मक विश्लेषणात वापरतात, तसेच कार्बनी रसायनवशास्त्रात क्षपणकारक म्हणून वापरतात.
टिटॅनियमाची TiOव Ti2O3 ही ऑक्साइडे क्षारकीय आहेत. TiO2, ZrO2 व HfO2 ही ऑक्साइडे उभयधर्मी आहेत. थोरियम ऑक्साइड ( ThO2) हे क्षारकीय आहे. यांची जटील लवणे तयार होतात. आयनीकरण वर्चस् उच्च असल्याने बहुशः सहसंयुजी संयुगे तयार करण्याकडेयांचा कल असतो.
गट ५ :ब [व्हॅनेडियम (V), निओबियम (Nb), टँटॅलम (Ta) आणि प्रोटॅक्टिनियम (Pa)]. या मूलद्रव्याच्या संयुजी इलेक्टॉनांचा विन्सास d3s2 असा आहे. प्रोटॅक्टिनियम ‘ f ’ वर्गात येते. ही मूलद्रव्ये विशेषशीक्रियाशील नाहीत. शिवाय त्यांच्या पृष्ठभागावर संरक्षक असा ऑक्साइडाचा पातळथर तयार होतो. त्यामुळेही अक्रियता दिसून येते. ही मूलद्रव्ये दुर्बलधातू आहेत. त्यांची उमयधर्मी ऑक्साइडे तयार होतात. त्यांचा क्षारकीय संयुगेतयार करण्याकडे कल आहे. अशा तऱ्हेचासारखेपणा ३ ब, ४ ब आणि ६ ब यांतीलमूलद्रव्यांशी दिसून येतो.
या मूलद्रव्यांची मुख्य ऑक्सिडीकरण अवस्था ५ आहे. तथापि त्यांच्या ऑक्सिडीकरण अवस्थांची व्याप्ती बरीच आहे.-१ पासून +५पर्यत ती असू शकते. कमी संयुजा असलेली आयनी संयुगे रंगीत असतात कारणत्यांत इलेक्ट्रॉनांचे अपूर्ण परिकक्ष असतात आणि त्यांत प्रकाश शोषण होतअसते. उदा., पंचसंयुजी व्हॅनेडियम संयुगे जर जस्ताने व अम्लाने क्षपण करूनकमी संयुजेची संयुगे मिळविली, तर रंगीत संयुगे मिळतात. ज्यांचे इलेक्ट्रॉनकक्ष पूर्ण असतात ती संयुगे रंगहीन असतात. व्हॅनेडियम संयुगांचे रंग असे :
| V5+ | ⟶ | V4+ | ⟶ | V 3+ | ⟶ | V2+ |
| रंगहीन | निळा | हिरवा | जांभळा |
या क्षपणाने Nb5+ पासून Nb3+ मिळते परंतु Ta5+ चे क्षपण होत नाही. कमी संयुजेची संयुगे V पासून→ Nb→ Ta → Pa या क्रमाने कमी स्थिर व तयार करण्यास कठीण असतात. V2+ संयुगे आयनी, क्षपणकारक व क्षारकीय आहेत व ती Fe2+ सारखी आहेत आणि V3+ आयन Fc3+ आयनासारखे आहेत.
लँथॅनाइड संकोचनामुळे Nb व Ta यांच्या आयनी व सहसंयुजी त्रिज्या सारख्या आहेत. त्यामुळे त्यांच्यातअभिन्नरूप साम्य आहे. त्या निसर्गात एकत्र आढळतात व एकमेकींपासून अलग करणेकठीण जाते.
या सर्व धातू सामान्य तापमानाला अक्रिय आहेत परंतु उच्च तापमानाला विक्रियाशील बनतात. निओबियम व टँटॅलम यांच्यावरहॅलोजनांची विक्रिया होऊन पेंटॅहॅलाइडे मिळतात. व्हॅनेडियमाची VF5, VCl4,VBr3, VI3 अशीहॅलाइडे तयार होतात. या धातूंची अपरिमाणात्मक (केवळ डाल्टन नियमांनुसार वाइलेक्ट्रॉनीय विवरणानुसार भाकीत केलेल्याच यथार्थ संघटनाप्रमाणे ज्यांचेसंघटन नाही अशी) हायड्राइडे तयार होतात. या धातूंची ऑक्सिजनाशी विक्रियाहोऊन पेंटॉक्साइडे मिळतात. व्हॅनेडियमाची VO (क्षारकीय व संयुजा 2+),V2 O3 क्षारकीय, सं. 3+), VO2 उभयधर्मी, सं.4+)व V2 O5) (उभयधर्मी, सं.5+) अशी ऑक्साइडे होतात. VO हे अपरिमाणात्मक आहे. त्याचे संघटन VOo.94-1·12 असे मांडता येईल. या धातू जटिल लवणे तयार करतात, उदा.,K4[V(CN)6].
गट ६ ब: [क्रोमियम Cr), मॉलिब्डेनम (Mo), टंगस्टन (W) आणि युरेनियम(U)].यातीलयुरेनियमट ‘f’ वर्गातील आहे. संक्रमणी मूलद्रव्यांतील हा एक निकटसंबंधी गटआहे. सापेक्षेतेने सर्वांची विक्रियाशीलता कमी आहे.सर्व दुर्बल धातूआहेत.ही मूलद्रव्ये अनु क्रमे क्रोमेट, मॉलिब्डेटे व टंगस्टेटे अशीसंयुगे तयार करतात. लँथॅनाइड सं कोचनामुळे मॉलिब्डेनम व टंगस्टन यांच्या अणूव आयन त्रिज्या सारख्या असल्याने त्यांचे गुणधर्म सारखे आहेत.विक्रियाशीलता वाढत्या अणुक्रमांकाने कमी होत जाते.ही मूलद्रव्ये बहुसंयुजी आहेत.
त्यांची कार्बोनिले तयार होतात यावरून त्यांची शून्य ऑक्सिडिकरण अवस्था दिसून येते. Cr(CO)6, Mo(CO)6 W(CO)6 अशा तयार होणाऱ्या कार्बोनिलांमध्येकार्बोनिल गटातील (CO) इलेक्ट्रॉनामुळे हे बंध तयार होतात.कमी दाबाखाली त्यांचे संप्लवन (घनअवस्थेतून सरळ वायुरूप अवस्थेत जाण्याची क्रिया) होते व ती कार्बनr विद्रावकात विद्राव्य आहेत.कार्बोनिले तापवल्यास त्यांचे अपघटन होऊनशुद्ध धातू मिळतात.
Cr3+ ही संयुगे सर्वाधिक स्थिर आहेत.संयुगांचे क्षारकीय गुणधर्म वाढत्या ऑक्सिडिकरण क्रमांकाबरोबर [⟶ ऑक्सिडिकरण] कमी होत जातात, असे त्यांच्या ऑक्साइडावरून दिसून येते.
| ऑक्साइडे | CrO | MoO2 | WO2 |
| क्षारीय | अम्ल व क्षार यांमध्ये अविद्राव्य | अविद्राव्य | |
| Cr2O2 | Mo2O5 | W2O5 | |
| उभयधर्मी | क्षारीय | ||
| CrO3 | MoO3 | WO3 | |
| अम्लीय | अम्लीय | अम्लीय |
क्रोमियम गटात शेवटच्या कक्षेत सहा इलेक्ट्रॉन असल्यामुळे या गटाचे काही गुणधर्म उच्च ऑक्सिडिकारक अवस्थेत ६ अ गटाप्रमाणे आहेत. उदा., CrO42-, SO42- आणि SeO42- यांच्यासंरचना चतुष्फलकी आहेत. क्षारीय धातूंची टंगस्टेटे हयड्रोजन किंवाटंगस्टन याबरोबर तापविली असता त्यांचे क्षपण होऊन निळ्या, जांभळ्या, तांबड्या व पिवळ्या रंगांचे काशांचे (ब्राँझांचे) प्रकार तयार होतात. त्यांचे रासायनिक सूत्र MxWO3 असे मांडता येइल. यातM म्हणजे सोडियम किंवा पोटॅशियम व x याचे मूल्य नेहमी एकापेक्षा कमी असते. ही विद्युत् संवाहक असतात.
क्रोमियमाची हेक्झॅहॅलाइडे होत नाहीत. इतरांची MoF6. WX6 (X = F, CI, Br), UF6 व UCI6 अशी हॅलाइडे मिळतात. ही सर्व हॅलाइडे बाष्पनशील आहेत. नैसर्गिक युरेनियमामधील U235 व U238 यांपासून मिळणाऱ्या UF6 या संयुगांची विसरण गती (रेणूंच्या उत्स्फूर्त हालचालीची व विखुरण्याची गती) वेगवेगळी असल्याने भंजनक्षम U235 मूलद्रव्य अणुबाँबकरिता अलग करणे शक्य होते.
ऑक्सिहॅलाइडांमध्ये क्रोमील क्लोराइड (CrO2 CI2) व मॉलिब्डेनिल क्लोराइड (MoO2 CI2 ) सहसंयुजी असून त्यांचे त्वरित जलीय विच्छेदन होते. टंगस्टेनिल क्लोराइडाचे जलीय विच्छेदन सावकाश होते. युरेनिल क्लोराइड (UO2 +CI2–) हे आयनी संयुग आहे. युरेनियमाची असिटेट व नायट्रेट ही संयुगे आयनी आहेत. (CrO2 CI2) हो गडद तांबड्या रंगाचे असून हा रंग येणे ही कसोटी क्लोराइड आयनाचे अभिज्ञान करण्यासाठी (अस्तित्व ओळखण्यासाठी) वापरतात. युरेनिल ॲसिटेटापासून स्फटिकी सोडियम युरेनिल असिटेट Na+[UO2(Ac)3]– मिळते व ही कसोटी सोडियम आयनाचे अभिज्ञान करण्यासाठी वापरतात.
क्रोमियम व याच गटातील इतर मुलद्रव्ये यांमध्ये फरक आहे. क्रोमियमाची ३+ ही ऑक्सिडीकरण अवस्था महत्त्वाची आहे. क्रोमियमाचे हिरव्या रंगाचे क्रोमियम सेस्क्वी ऑक्साइड ( Cr2O3 ) अमोनियम डायक्रोमेटाचे ऊष्मीय अपघटन करून मिळवतात.
(NH4 )2 Cr2O7 → N2 + 4H2O + Cr2O3CrCl3·6H2O या सूत्राचे तीन सजल समघटक (समान घटक मूलद्रव्ये व त्यांची प्रमाणे असलेले पण भिन्न संरचना असलेले पदार्थ) आहेत.
[Cr(H2 O)6]CI3 जांभळा रंग, तीन क्लोरीन आयन.[Cr(H2 O)5 CI].CI2· H2O फिकट हिरवा रंग, दोन क्लोरीन आयन. [Cr(H2O)4 CI2]CI·2H2O गडद हिरवा रंग, एक क्लोरीन आयन. क्रोमियम दुहेरी लवणे तयार करते. उदा., क्रोम तुरटी (ॲलम). या गटातील मूलद्रव्ये जटिल लवणे तयार करतात उदा., [Cr(NH3)6]3+, [CrCI6]3- इत्यादी. या मूलद्रव्यांचा अणुक्रमांक सम आहे.गट ७ ब : [मँगॅनीज (Mn), टेक्नेशियम (Tc) व ऱ्हीनियम (Re)]. निसर्गात मँगॅनीज हे ऱ्हीनियमापेक्षा जास्त प्रमाणात आढळते. टेक्नेशियम निसर्गात अजिबात आढळत नाही. ते फक्त किरणोत्सर्गी विक्रियांत तयार होते.
| 42Mo98 +ON1 | ⟶ | 42Mo99 | ⟶43Tc99 | + β– |
ऱ्हीनियम हे निसर्गात अत्यल्प आढळते. तिन्ही मूलद्रव्यांचे रासायनिक गुणधर्म जवळजवळ सारखे आहेत. मँगॅनीज थोडे वेगळे आहे.
मँगनीज हे आडव्या रांगेत क्रोमियम व लोह यांच्या मधे आहे. मँगॅनिजाचे काही रासायनिक गुणधर्म क्रोमियमासारखे तर काही गुणधर्म लोहासारखे आहेत. उदा., Cr2O3 व Mn2O3 या ऑक्साइडांची अम्लाशी विक्रिया केल्यास CR3+, Mn3+ लवणे तयार होतात. मात्र Mn3+ लवणे अस्थिर आहेत. क्षारांबरोबर क्रोमाइटे व मँगॅनाइटे तयार होतात. MnO3 वCrO3 ही ऑक्साइडे अम्लीय असून त्यांपासून अनुक्रमे मँगॅनेटे व क्रोमेटे तयार होतात. हिरव्या रंगाची मँगॅनेटे व पिवळ्या रंगाची क्रोमेटे ही समरूपी (भिन्न रासायनिक संघटन असलेली पण समान संरचना असलेली) आहेत. MnO हे ऑक्साइड लोहाच्या FeO या ऑक्साइडाशी समान आहे. दोन्हीपासून Mn2+ व Fe2+ अशी लवणे तयार होतात.Mn2O3 हे Fe2O3 प्रमाणे व Mn3O4 हेFe3o4 सारखे आहे. ही दोन्ही ऑक्साइडे मिश्र ऑक्साइडे आहेत (FeO+Fe2O3 व MnO+Mn2O3). इलेक्ट्रॉन विन्यासाप्रमाणे या मूलद्रव्यांची ऑक्सिडीकरण अवस्था सात आहे परंतु ही मूलद्रव्ये बहुसंयुजी आहेत. मँगॅनिजाची MnO (क्षारीय), Mn2O3 (उभयधर्मी), Mn3O4 (मिश्र), MnO2(उभयधर्मी), MnO3 व Mn2O7 (दोन्ही अम्लीय) अशी निरनिराळ्या संयुजांची ऑक्साइडे तयार होतात. ऱ्हीनियमाची ReO2,ReO3 व Re2O7 ही सर्व ऑक्साइडे अम्लीय आहेत.
नायट्रोजन, कार्बन, पाणी, दुर्बल व प्रबल अम्ले यांची मँगॅनिजावर विक्रिया होते, ऱ्हीनियमावर विक्रिया होत नाही, फक्त प्रबल अम्लामध्ये ते सावकाश विरघळते. हॅलोजेने, गंधक व ऑक्सिजन यांची दोहोंवरही विक्रिया होते. यांची [Mn2(CO)10], [Re(CO)1o] अशी कार्बोनिले होतात. ही मूलद्रव्ये जटिल लवणे तयार करतात, उदा., K6[Mn(CN)6].2 NH3, [MnCI4]– इ. मँगॅनिजाची लवणे रंगीत आहेत. Mn2+ ही गुलाबी रंगाची व Mn7+(KMnO4) या संयुजेची दाट जांभळ्या रंगाची आहेत. [Mn (Oxalate)3]3- हे उष्णतेला अस्थिर आहे. त्याचे ६०० से.ला अपघटन होते म्हणून परमँगॅनेट/ऑक्झॅलेट अनुमापन [⟶ अनुमापन] तापवलेल्या पाण्यात अनुमापन चंबू धरून करतात. पोटॅशियम परमँगॅनेट (KMnO4) हे महत्त्वाचे ऑक्सिडीकारक संयुग आहे.
गट ८ वा : लोह व प्लॅटिनम त्रयी: या गटात तीन आडव्या त्रया आहेत. पहिलीला लोह गट आणि दुसरी व तिसरीला मिळूनप्लॅटिनम गटातील मूलद्रव्ये असे मानले जाते. या गटातील उभ्या स्तंभाऐवजीआडव्या रांगेतील मूलद्रव्यांची तुलना करणे त्यांच्या गुणधर्माप्रमाणे योग्य होईल.
लोह त्रयी: [लोह (Fe), कोबाल्ट (Co) व निकेल (Ni)]. ही मूलद्रव्ये चांदीसारखी पांढरी, निसर्गात सर्वत्र आढळणारी, लोहचुंबकीय आणि प्लॅटिनम गटातीलमूलद्रव्यांपेक्षा अधिक क्रियाशील आहेत.अपूर्ण d परिकक्षेतीलइलेक्ट्रॉनांच्या परिवलन गतीमुळे लोहचुंबकत्व निर्माण होते, अशी मीमांसामांडण्यात आलेली आहे.लोह व प्लॅटिनम या दोन्ही गटांतील मूलद्रव्यांतवायूंचे पृष्ठशोषण करण्याचा गुणधर्म आढळून येतो. यांचा वायूविक्रियांमध्ये उत्प्रेरक (विक्रियेची गती बदलण्यासाठी वापरण्यात येणारा वस्वतः विक्रियेत भाग न घेणारा पदार्थ) म्हणून उपयोग होतो.क्रियाशीलता Fe ते Ni कमी होत जाते.
या मूलद्रव्यांच्या संयुजा २, ३, ४ व ६ अशा असल्या, तरी २ व ३ या संयुजा विशेष आढळतात.४ व ६ संयुजांचीकाही जटिल संयुजे तयार होतात.२ ही विद्युत् संयुजा तिन्ही मूलद्रव्येदाखवितात. Co व Ni या मूलद्रव्यांची २ ही स्थिर सयुजा आहे. लोहाची ३ ही संयुजा स्थिर आहे. द्विसंयुजी संयुगांतया मूलद्रव्यांचे Cr, Mn व Cu, Zn यांच्याशी साम्य आढळते. FeO, CoO व NiO (सर्व क्षारीय), Fe2O3 (उभयधर्मी), Co2O3 व Ni2O3(सजल), Fe3O4 व Co3O4 (मिश्र) व NiO2 (क्षारीयव सजल) अशी या मूलद्रव्यांची ऑक्सइडे होतात. यांची ऑक्सइडेआवर्त सारणीतील डाव्या बाजूच्या Cu व Zn यांच्याऑक्सइडांसारखी आहेत.यांची लवणे Fe2+ (हिरवा रंग), Co2+ (फिकट तांबडा रंग) व Ni2+(हिरवारंग), क्रोमियम, मँगॅनिज, तांबे व जस्त यांच्या लवणांप्रमाणे आहेत.त्रिसंयुजेचा कल Fe ते Ni कमी होत जातो.निकेलाची सर्व साधी संयुगेद्विसंयुजी आहेत.
या मूलद्रव्यांची आयनी त्रिज्या Fe ते Ni कमी होत जाते त्यामुळे जटिल लवणे तयार होण्याची क्षमता वाढत जाते. [Fe(CN)6]–, [Co(NH3)6]2+, अशा तऱ्हेचे जटिल आयन तयार होतात.रक्तातील तांबड्या पेशींमधील हीमोग्लोबिन (Fe), ब१२जीवनसत्व (Co), प्रशियन ब्ल्यू KFe[Fe(CN)6], सोडियम नायट्रोप्रुसाइड (ताबडा रंग) Na2 [Fe(CN)5 NO] 2H2O इ. संयुगे महत्वाची आहेत.
प्लॅटिनम गट: [रूथेनियम (Ru), ऱ्होडियम (Rh) आणि पॅलॅडियम (Pd) ऑस्मियम (Os), इरिडियम (Ir) आणि प्लॅटिनम (Pt)].या मूलद्रव्यांची क्रियाशीलता Ru ते Pd व Os ते Pt वाढत जाते. या धातू अक्रिय असल्याने निसर्गात थोड्याफार प्रमाणातधातूरूपात आढळतात. त्यांचे चांदी व सोने यांच्याशी साम्य आहे.या गटातीलमूलद्रव्यांचे भौतिक व रासायनिक गुणधर्म अगदी एकसारखे आहेत. पॅलॅडियमधातूशिवाय इतर सर्व धातू हायड्रोक्लोरिक, नायट्रिट व सल्फ्यूरिक या अम्लांतअविद्राव्य आहेत.Pd, Os व Pt अम्लराजात विद्राव्य आहेत परंतु Ru, Rh व Ir अम्लराजात देखील विद्राव्य नाहीत.ही मुलद्रव्ये लोह गटातीलमूलद्रव्यांप्रमाणे लोहचुंबकिय नाहीत मात्र वायुशोषण प्रबलपणे करतात.त्यामुळे Pd व Pt वायूंच्या विक्रियांत उत्तम उत्प्रेरक म्हणून उपयोगीपडतात.
लँथॅनाइड संकोचनामुळे दुसऱ्या व तिसऱ्या आवर्तातील संक्रमणी मूलद्रव्ये समान आहेत. त्यांच्या अणूंचे आकारमान सारखे असल्यामुळे Os, Ir व Pt यांची घनता Ru, Rh व Pd यांच्या जवळजवळ दुप्पट आहे. ही सर्व मूलद्रव्ये निसर्गात अत्यंत कमी प्रमाणात आढळतात.
या मूलद्रव्यांशी हॅलोजने उच्च तापमानाला विक्रिया करून हेक्झॅहॅलाइडे तयार करतात. उदा.,OsF6, IrF6, PtF6 इत्यादी.लोह व प्लॅटिनम गटांतील मूलद्रव्ये वैशिष्ट्यपूर्ण संक्रमणी मूलद्रव्ये आहेत.त्यांची वैशिष्ट्ये म्हणजे बदलती संयुजा, रंगीत संयुगे, उत्प्रेरक गुणधर्म व जटिल संयुगे तयार करण्याची क्षमता हीहोत. प्लॅटिनम गटातील मूलद्रव्यांची उच्च ऑक्सिडीकरण अवस्थांतील संयुगेस्थिर आहेत, साध्या आयनी अवस्थेचा अभाव आहे व ही मूलद्रव्ये लोह गटापेक्षाजास्त अभिजात आहेत.
गट १ ब : [तांबे (Cu),चांदी (Ag) आणि सोने(Au)]. या मूलद्रव्यांच्या अणूमध्येबाह्यकक्षेत गट १ अ प्रमाणे एक s इलेक्ट्रॉन आहे. अ गटात उपांत्य कक्षेतइलेक्ट्रॉनांचे अष्टक पूर्ण आहे व ब गटाच्या उपांत्य कक्षेत १० dइलेक्ट्रॉन असून s2, p6 वd10 मिळून १८ इलेक्ट्रॉन आहेत. गट १ अ मधील धातू ⇨ विद्युत् रासायनिक श्रेणीत (धातू व इतर पदार्थ त्यांच्य रासायनिक विक्रियाशीलतेप्रमाणे क्रमवार लावलेले आहेत अशा श्रेणीत अधिक विक्रियाशील वरच्या क्रमांकावर व कमी विक्रियाशील खालच्याक्रमांकावर) वरच्या क्रमांकाला आहेत व गट १ ब गटातील धातू शेवटी आहेत. हीमूलद्रव्ये ऑक्सिडीकारक नसलेल्या अम्लातून हायड्रोजन विस्थापित करू शकतनाहीत. या मूलद्रव्यांना अभिजात मूलद्रव्ये किंवा चलनी मूलद्रव्ये म्हणतात.अभिजातता Cu ⟶ Ag ⟶ Au अशी वाढत जाते. विद्युत् घनता गुणविशेष कमी होत जातो. सोने हे सापक्षेतःअक्रिय आहे. त्याचे प्लॅटिनम गटातील धातूंशी बऱ्याच बाबतींत साम्य आहे.
गट १ अ ची ऑक्साइडे व हायड्रॉक्साइडे प्रबल क्षारीय व पाण्यात विद्राव्य आहेत तांबे गटाची क्षीण क्षारीय व अविद्राव्य आहेत. सोडियम गटाची लवणे एकसंयुजीव रंगहीन आहेत. त्यांची जटिल लवणे प्रबल जटिल विक्रियाकारक वापरले तरचहोतात. तांबे गटाची मूलद्रव्ये बदलत्या संयुजेची, रंगीत व जटिल लवणे तयारकरण्याकडे कल असलेली अशी आहेत.
तांबे गटातील मूलद्रव्यांची संयुजा १, २ व ३ अशी आढळते परंतु स्थिर संयुगे Cu2+, Ag1+ व Au3+ या संयुजांची आहेत. क्युप्रस आयन (Cu+) हा अस्थिर आहे. क्युप्रिक (Cu2+) संयुगे स्थिर आहेत. आर्जेटस आयन (Ag+)हा स्थिर आहे. ऑयरस आयन (Au+) हा अस्थिर असून त्याचे त्वरित ऑयरिक आयनामध्ये (Au3+) रूपांतर होते. Cu+ व Au+ आयन त्यांच्या अविद्राव्य संयुगांत स्थिर असतात उदा., Cu2 CI2, Au2S. एक संयुजेची स्थिरता जटिल लवणामुळे असू शकते. उदा.,
Cu+ + 3CN- ⟶[Cu(CN)3]2-
Au+ + 2CN– ⟶ [Au(CN)2]–
द्विसंयुजा तयार होण्यात d इलेक्ट्रॉनांपैकी एक इलेक्ट्रॉन लागतो.चांदीची द्विसंयुजेची संयुगे बनत नाहीत. अपवादात्मक दोन संयुगे द्विसंयुजेची आहेत एक AgF2 व दुसरे AgO.काही जटिल लवणांत द्विसंयुजा स्थिर झालेली आढळते. या गटाची ऑक्साइडे क्षारीय आहेत. फक्त सोन्याचे Au2O3 हे ऑक्साइड उभयधर्मी आहे. सोने व चांदी यांची ऑक्साइडे तापवल्यास धातूमिळतात. सोन्याची द्विसंयुजेची संयुगे तयार होत नाहीत. तांब्याची मात्रसामान्यतः द्विसंयुजेची स्थिर संयुगे तयार होतात. क्युप्रिक लवणेसामान्यपणे निळ्या रंगाची असतात. निर्जल क्युप्रिक सल्फेट (CuSO4) हे रंगहीन असते.CuSO4· 5H2O निळ्या रंगाचे असते कारण त्यात [Cu(H2O)4]2+ हा जटिल आयन तयार होतो. तांब्याचे महत्त्वाचे जटिल लवण क्युप्राअमोनियम सल्फेट [Cu(NH3)4]SO4 याचा ⇨ कृत्रिम तंतू तयार करण्याकरिता उपयोग होतो. त्रिसंयुजी अवस्था सोन्याच्या बाबतीत दिसून येते. त्याचे AuF3 हे संयुग आयनी आहे. बाकीची ऑयरिक संयुगे बहुधा सहसंयुजी आढळतात. सोन्याची बहुसंख्य जटिल लवणे ज्ञात आहेत.
गट २ ब : [जस्त (Zn), कॅडमियम (Cd) आणि पारा (Hg)].या गटातील मूलद्रव्ये इतरसंक्रमणी मूलद्रव्यांपासून बऱ्याच बाबतींत वेगळी आहेत.गट १ ब प्रमाणेयाही गटातील उपांत्य कक्षा (d) १८ इलेक्ट्रॉनांनी पूर्ण भरलेली आहे वशेवटच्या ‘s’ कक्षेत दोन इलेक्ट्रॉन आहेत. यांची द्विसंयुजी संयुगे तयारहोतात कारण d परिकक्षेतील इलेक्ट्रॉन संयुजेसाठी उपलब्ध होत नाही. दोनऑक्सिडीकरण अवस्था हे या गटाचे वैशिष्ट्य आहे. पारा Hg1+ संयुगे तयार करतो परंतु ती द्विवारिकी (दोन रेणू एकत्र येऊन तयार होणारी) आहेत. उदा., मर्क्युरसक्लोराइड (Hg2 CI2) हे संयुग CI-Hg-Hg-CI असे आहे. त्यामुळे Hg1+आयन अस्थित्वात नाही. पाऱ्याच्या दोन अणूंमधील सहसंयुजी बंधामुळे मर्क्युरस आयन Hg22+ असा दर्शवितात.
इतर संक्रमणी मूलद्रव्यांप्रमाणे ही मूलद्रव्ये घावतीय आहेत परंतु ती बदलती संयुजा दाखवत नाहीत व त्यांची संयुगे रंगहीन आहेत.आयनीकरण वर्चसावरून तांबे गट जास्त विक्रियाशील वाटतो परंतु प्रत्यक्षातजस्त गट जास्त विक्रियाशील आहे.कारण जस्त गटातील मूलद्रव्यांचेवितळबिंदू व उकळबिंदू कमी आहेत. पारा हे कोठी तापमानाला द्रवरूप असणारेएकमेव धातवीय मूलद्रव्य आहे.
या गटाचे काही बाबतीत असंक्रमणी गट २ अ शी, विशेषतः क्षारीय मृत्तिका मूलद्रव्यांशी (Ca, Sr, Ba) साम्य आहे.दोहोंचा इलेक्ट्रॉन विन्यास-s2 आणि-d10s2 असा आहे.दोन्ही गटांतील मूलद्रव्ये द्विसंयुजी आहेत. दोहोंची सजल सल्फेटे समरूपी आहेत.त्यांची K2SO4’ HgSO4 – 6H2O आणि K2SO4 · MgSO4 · 6H2O ही दुहेरी लवणे समधर्मी आहेत.जस्त गट जास्त अभिजात, सहसंयुजी संयुगेकरण्याकडे कल असणारा, जटिल लवणे तयार करण्याचीक्षमता जास्त असलेला व कमीक्षारीय आहे.
सर्वसाधारणपणे गटातील पहिला सदस्य इतरांपेक्षा वेगळा असतो, तर या गटातजस्त व कॅडमियम हे रासायनिक दृष्ट्या जवळचे आहेत व तिसरा सदस्य पारा हावेगळा आहे.विक्रियाशीलता जस्तापासून पाऱ्याकडे कमी हेत जाते.जस्तकॅडमियम यांची विरल अम्लाशी विक्रिया होते.पारा फक्त ऑक्सिडीकारक अम्लाशीविक्रिया करतो. ॲल्युमिनियमप्रमाणे जस्त व कॅडियमाची क्षाराबरोबर विक्रियाहोऊन झिंकेट कॅडमियेट तयार होतात.
यांची ZnO, CdO व HgO अशी ऑक्साइडे तयार होतात. ZnO हे उभयधर्मी आहे. CdO व HgO ही ऑक्साइडे क्षारीय आहेत. ZnO व CdO यांचे संप्लवन होते यावरून तीबरीचशी सहसंयुजी असावीत. HgO तापवल्यास त्यापासून पारा धातू मिळते.हीविक्रिया चांदी व सोने यांप्रमाणे आहे.पारा ही अभिजात धातू समजली जाते. CdO व HgO ही अनुक्रमे तपकिरी व तांबड्या रंगाची आहेत परंतु या गटातीलमूलद्रव्यांची बहुतेक लवणे रंगहीन आहेत.जस्त व कॅडमियम यांची पेरॉक्साइडे (ZnO2, व CdO2) तयार होतात, इतर संक्रमणीमूलद्रव्यांची पेरॉक्साइडे तयार होत नाहीत.जस्त व कॅडमियम यांचीहायड्रॉक्साइडे तयार होतात, पाऱ्याचे तयार होत नाही.सर्वसाधारणपणे जस्तलवणे सजल व आर्द्रताशोषक आहेत. कॅडमियम हॅलाइडे स्वयंजटिल आयन तयार करतात उदा.,
CdCI2 ⇌ Cd2++2Cl–
Cd2++4Cl– ⇌ [CdCl4]2-
कॅडमियम आयोडाइन (CdI2) यात CdI+, CdI2, CdI3– आणि CdI42- यांचे मिश्रण असू शकते. या मूलद्रव्यांपासून जी हॅलाइडे तयार होतातत्यांमधील बंध प्रकारावर विद्यूत् ध्रुवण क्रियेचा (विद्युत् क्षेत्र लावूनधन आणि ऋण विद्यूत् भारांत सापेक्ष विस्थापन घडवून आणण्याच्या क्रियेचा) परिणाम होतो असे आढळते.यामधील धन आयनाची ध्रुवण शक्ती व ऋण आयनांची ध्रुवणक्षमता जास्त प्रमाणाच्या असतील, तर सहसंयुजी संयुगे तयार होण्याकडे वाढता कल दिसतो.धन आयनाची ध्रुवणशक्ती या गटात Zn → Cd→Hg या क्रमाने वाढत जाताना दिसते.ही सर्व मूलद्रव्ये जटिल लवणे तयार करतात. जटिल लवणे सायनाइड आयन (CN), अमोनिया (NH3), अमाइने, हॅलाइन आयन इत्यादींशी होऊ शकतात.
‘f’ वर्ग मूलद्रव्ये : लँथॅनाइड श्रेणी किंवा विरल मृत्तिका यातील मूलद्रव्ये (अणुक्रमांक ५८ ते ७१) व ॲक्टिनाइड श्रेणीतील मूलद्रव्ये (अणुक्रमांक ९० ते १०३) या वर्गात मोडतात. लँथॅनाइड श्रेणीतील मूलद्रव्यांची माहिती ‘विरलमृत्तिका’ या नोंदीत दिलेली आहे.ॲक्टिनाइड श्रेणीतीलमूलद्रव्यांसंबंधीच्या माहितीकरिता प्रस्तुत नोंदीत अगोदरच्या भागात दिलेलीमाहिती आणि ‘मूलद्रव्ये, मानवनिर्मित’ व ‘युरेनियमोत्तर मूलद्रव्ये’ यानोंदी पहाव्यात.
पहा : अणु व आणवीय संरचना; आवर्त सारणी; किरणोत्सर्ग; मूलद्रव्ये, मानवनिर्मित; युरेनियमोत्तर मूलद्रव्ये; विरल मृत्तिका; संक्रमणी मूलद्रव्ये; समस्थानिक. यांखेरीज प्रत्येक मूलद्रव्यांवरील नोंद.
संदर्भ : 1. Abbott, D. Inorganic Chemistry, Londan, 1965.
2. Allers, L. H. Abundance of the Elements. New York, 1961.
3. Brockington, J. Students Guide to Inorganic Chemistry, London, 1966.
4. Herrmann, G. Superheavy-Elements Research, Nature, 16 August 1979.
5. Jackson, D. F. Search for Superheavies, Nature, 20 April 1978.
6. Kaye, G. W. C.; Lady, T.H. Tables of Physical and Chemical constants, London, 1966.
7. Kondratyev, V. The Structure of Atoms and Molecules, Moscow.
8. Lagowski, J. J. The Structure of Atoms, New York, 1964.
9. Laidler, K.J.; Fordsmith, M. Chemical Elements, New York, 1970.
10. Lee, J. D. Concise Inorganic Chemistry, London 1973.
11. Oldenberg, O. Introduction to Atomic and Nuclear Physics, New York, 1966.
12. Seaborg. G.T. Man-Made Transuranium Elements, Englewood Cliffs, N. J. 1963.
चिपळोणकर, व. त्रिं.; घाटे, रा. वि.