मूलके : कित्येक पदार्थांच्या रासायनिक संघटनांमध्ये काही अणुसमुच्चय अभेद्य असल्याप्रमाणे अस्तित्वात राहतात असे आढळते. उदा., SO4 हा अणुसचमुच्चय सर्व सल्फेटांच्या आणि NO3 हा अणुसमुच्चय सर्व नायट्रेटांच्या संघटनात असतो. असे अणुसमुच्चय रासायनिक विक्रियांमध्ये दुसऱ्या अणूंचे अथवा अणुसमुच्चयांचे प्रतिष्ठापन करतात. तसेच ते स्वतः दुसऱ्या अणूंनी किंवा अणुसमुच्चयांनी प्रतिष्ठापित होतात. उदा.,
|
Na2SO4 |
+ |
BaCl2 |
= |
BaSO4 |
+ |
2NaCl |
|
सोडियम सल्फेट |
बेरियम क्लोराइड |
बेरियमसल्फेट |
सोडियम क्लोराइट |
सूत्र १. SO4 या अणुसमुच्चयाने क्लोरीन अणूंचे प्रतिष्ठापण किंवा क्लोरीन अणूंनी SO4 हा अणुसमुच्चय प्रतिष्ठापित होणे.
या विक्रियेत SO4 या अणुसमुच्चयाने BaCl2 मधील क्लोरीन अणूंचे प्रतिष्ठान केले आहे किंवा क्लोरीन अणूंनी SO4 हा अणुसमुच्चय प्रतिष्ठापित झाला आहे.
अशा अणुसमुच्चयांना विगमनाच्या (विद्युत् दृष्ट्या उदासीन रेणूपासून विद्युत् भारित अणू किंवा अणुसमुच्चय बनण्याच्या विक्रीयेच्या) संदर्भात मूलके किंवा मूलक आयन म्हणतात. इतरत्र त्यांचा उल्लेख गट असाही केला जातो. उदा., OH हा हायड्रॉक्सी गट.
कार्बनी रसायनशास्त्रात असे अनेक गट असून ते विविध प्रकारच्या संयुगांचे लाक्षणिक गट समजले जातात. उदा., COOH हा कार्बॉक्सी अम्लात असणारा कार्बॉक्सी गट हायड्रोकार्बनांमध्ये असणारे CH3, C2, H5 इ. अल्किल गट, कीटोने व आल्डिहाइडे यांतील हा CO कार्बोनिल गट इत्यादी.
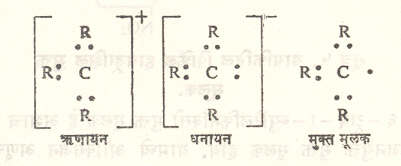
मुक्त मूलके : मिथिल, एथिल इ. मूलके स्वतंत्रपणे अस्तित्वात राहू शकत नाहीत अशी समजूत एकोणिसाव्या शतकाच्या अखेरपर्यंत होती परंतु १९०० सालानंतर झालेल्या संशोधनाने असे सिद्ध झाले आहे की, ही व अशी कित्येक मूलके कमी अधिक काल मुक्त रूपात अस्तित्वात असू शकतात. अशा मूलकांना ‘मुक्त मूलके’ ही संज्ञा लावतात. मुक्त मुलके व आयनी मूलके किंवा आयन यांमधील फरक लक्षात घेतला पाहिजे. आयनी मूलकांवर विद्युत् भार असतो, तसा मुक्त मूलकांवर नसतो. मुक्त मूलकात असणाऱ्या इलेक्ट्रॉनांची संख्या सर्वसामान्यपणे विषम असते व त्यांमध्ये एक (अथवा अधिक) इलेक्ट्रॉन अयुग्मित असतो. त्यामुळे मुक्त मूलके समचुंबकीय (चुंबकीय क्षेत्रात ठेवली असता त्यांचे चुंबकीकरण क्षेत्राच्या दिशेला समांतर असे होते) बनतात. तथापि सर्व समचुंबकीय पदार्थ मुक्त मूलक मानले जात नाहीत उदा., O2, NO, NO2, ClO2. हेच निराळ्या शब्दात सांगावयाचे तर असे म्हणता येईल की, मुक्त मूलकाच्या संघटनात रेणूमधील एका अणूची एक (अथवा अधिक) संयुजा (इतर अणूंशी किंवा अणूगटांशी संयोग पावण्याची क्षमता) अतृप्त असते. उदा., -CH3 या मिथिल मुक्त मूलकात कार्बनाच्या ४ संयुजांपैकी ३ संयुजा हायड्रौजन अणूंनी तृप्त झाल्या आहेत. पण चौथी अतृप्त आहे. इलेक्ट्रॉनीय संरचनेच्या दृष्टीने विचार केला, तर मूलकात कार्बन अणूच्या ४ इलेक्ट्रॉनांपैकी ३ इलेक्ट्रॉन, ३ हायड्रोजन अणूंच्या ३ इलेक्ट्रॉनांबरोबर युग्मित (जोडीदार असलेले) असून चौथा इलेक्ट्रॉन अयुग्मित राहिला आहे. ट्रायअल्किल मिथिल ऋणायन, ट्रायअरिल मिथिल धनायन आणि ट्रायअरिल मिथिल मुक्त मूलक यांच्या संरचना तुलनेसाठी सूत्र २ मध्ये दिल्या आहेत. (ऋणायन हा धन भारित आयन व धनायन हा ऋण भारित आयन असून विद्युत् विच्छेदनात ते अनुक्रमे ऋणाग्राकडे व धनाग्राकडे आकर्षिले जातात). मुक्त मूलकातील अयुग्मित इलेक्ट्रॉन मूलद्रव्यांच्या चिन्हाजवळ एक टिंब देऊन दाखविण्याची पद्धत आहे (उदा., मिथिल मुक्त मूलक H3C).
इ. स. १९०० मध्ये मोझेस गॉम्बर्ग यांनी ट्रायफिनिल मिथिल क्लोराइडावर चांदीची विक्रिया घडविली. या विक्रियेने हेक्झाफिनिल एथेन हे संयुग बनेल अशी अपेक्षा होती.
|
2(C6H5)3·CCl |
+ |
2Ag→ |
(C6H5)3-C-C(C6H5)3 |
+2AgCl |
|
ट्रायफिनिल मिथिल क्लोराइड |
चांदी |
हेक्झाफिनिल एथेन |
सिल्व्हर क्लोराइड |
सूत्र ३. हेक्झाफिनिल एथेनाची निर्मिती
तथापि या विक्रियेत हेक्झाफिनिल एथेनाच्या सोबतच त्याहून फार विक्रियाशील ट्रायफिनिल मिथिल मुक्त मूलक प्राप्त होतो व त्याचा बेंझिनामधील विद्राव पिवळा असतो. त्या मुक्त मूलकावर हवेतील ऑक्सीजनाची विक्रिया होऊन ट्रायफिनिल मिथील पेरॉक्साइड (C6H5) 3-C-O-O-C-(C6H5)3 हे संयुग व आयोडिनाच्या विक्रीयेने (C6H5) 3 I बनते असे दिसून आले. शिवाय हा विद्राव समचुंबकीय असतो असाही अनुभव आला. सूत्र ३ मधील विक्रिया कार्बन डाय-ऑक्साइडच्या वातावरणात घडविली व हवेशी संपर्क येणार नाही अशा तऱ्हेने विद्रावक (विरघळविणारा पदार्थ) काढून टाकला, तर हेक्झाफिनिल एथेन मिळते. बेंझिनामध्ये केलेला त्याचा विद्राव प्रथम वर्णहीन असतो परंतु हळूहळू तो पिवळा होऊ लागतो. पिवळा रंग ट्रायफिनिल मिथिल या मुक्त मूलकामुळे येतो. अशा गुणधर्मावरून विद्रावामध्ये हेक्झाफिनिल एथेनाचे ट्रायफिनिल मिथिल मुक्त मूलकांमध्ये काही प्रमाणात व्युत्क्रमी विगमन होते असे सिद्ध होते.
|
(C6H5)3-C-C-(C6H5)3 |
⇌ |
(C6H5)3-C+(C6H5)3-C |
|
हेक्झाफिनिल एथेन |
ट्रायफिनिल मिथिल मूलके |
सूत्र ४. हेक्झाफिनिल एथेनाचे विगमन
अशी मुक्त मूलके काही कार्बनी विद्रावकांतच टिकतात आणि हवा, पाणी व अम्ले यांच्या योगाने ती परिवर्तन पावतात व संयुगे बनवतात.
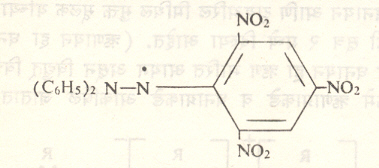
वरील मुक्त मूलकातील C6H5 ऐवजी C6H5-C6H4 (बायफिनिल) हा गट योजना, तर C6H5 – C6H4 – C.हे अधिक स्थिर मुक्त मूलक बनते. त्याचा बेंझिनामधील २–३% विद्राव घेतल्यास ५० से. तापमानावर पूर्णत्वाने अपघटन (रेणूचे तुकडे होण्याची क्रिया) होऊन हे मुक्त मूलक निर्माण होते, असे दिसून आले आहे. डायफिनिल पिक्रिल हायड्राझिल (सूत्र ५) हे जांभळ्या रंगाच्या घन पदार्थाच्या रूपात असणारे एक अत्यंत स्थिर मुक्त मूलक आहे.
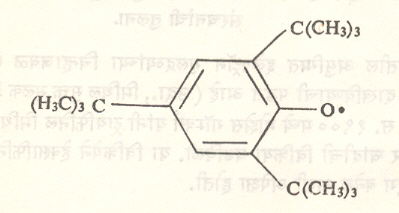
२, ४, ६ – ट्राय – t– ब्युटिलफिनॉक्सी मुक्त मूलक हे अशाच प्रकारचे ऑक्सिजनयुक्त मुक्त मूलक होय. यामध्ये ऑक्सीजन अणूचा एक इलेक्ट्रॉन अयुग्मित आहे.
 डायफिनिल हायड्रॉक्सिल अमाइनाच्या ऑक्सिडीकरणाने [→ऑक्सिडीभवन] डायफिनिल नायट्रोजन ऑक्साइड (C6H5)२-NO. हे मुक्त मूलक मिळते.
डायफिनिल हायड्रॉक्सिल अमाइनाच्या ऑक्सिडीकरणाने [→ऑक्सिडीभवन] डायफिनिल नायट्रोजन ऑक्साइड (C6H5)२-NO. हे मुक्त मूलक मिळते.
अल्पायू मुक्त मूलके : १९२९ मध्ये एफ्. पॅनेथ व डब्ल्यू. होफेडिट्झ यांनी बाष्परूपात मिथिल मुक्त मूलक बनविले. त्यासाठी त्यांनी कमी दाबावरील बाष्परूप टेट्रामिथिल लेड [Pb(CH3) 4] आणि हायड्रोजन यांचे मिश्रण एका क्वार्ट्झ काचेच्या नळीतून प्रवाहित केले. या नळीचा काही भाग सु. ८००० से. तापमानात त्यांनी तापविला तेव्हा नळीच्या आतील पृष्ठभागावर शिशाचा चकचकीत पातळ (आरशासारखा) थर जमला. टेट्रामिथिल लेडाचे अपघटन होऊन मिळणाऱ्या शिशापासूनच तो बनला होता, हे उघड आहे. त्यानंतर उरलेले बाष्पमिश्रण त्यांनी नळीमधून पुढे जाऊ दिले. तेथील भाग थंड असून त्यामध्ये अगोदरच वरील प्रकारचा शिशाचा चकचकीत थर निक्षेपित केलेला (साचलेला) होता. वायुमिश्रण त्यावरून गेले तेव्हा तो थर नाहीसा झाला. यावरून असा निष्कर्ष निघतो की, उष्णतेने टेट्रामिथिल लेडाचे अपघटन होऊन मिथिल मूलके व शिसे तयार होते. अगोदरच निक्षेपित केलेल्या शिशाच्या थरावरून जेव्हा बाष्पमिश्रण जाते तेव्हा मिथिल मूलके व शिसे यांचा रासायनिक संयोग होऊन टेट्रामिथिल लेड बनते व त्यामुळेच शिशाचा थर नाहीसा होतो. मिथिल मूलके अत्यंत विक्रियाशील असतात हेही या प्रयोगावरून स्पष्ट होते.
वायू अवस्थेत एथिल ·C2H5, प्रोपिल ·C3H7, हायड्रॉक्सील ·OH इ. अल्पायू मुक्त मूलके उष्णता व प्रकाश यांच्या योगाने योग्य संयुगांचे अपघटन करून, अल्किल हॅलाइडावर सोडियम बाष्पाची विक्रिया करून आणि कमी दाब असताना वायूमधून विद्युत् विसर्जन करून तयार करण्यात आली आहेत.
द्रवामध्ये विरघळलेल्या अवस्थेतही अल्पायू मूलके तयार करता येतात. उदा., डाय-ॲसिटील पेरॉक्साइडाचा विद्राव तापविला असता मिथिल मूलके व कार्बन डाय-ऑक्साइड निर्माण होतात.
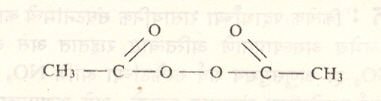
काही मुक्त मूलकांची अर्धायुष्ये : मिथिल ८ X१०-३ सेकंद, फिनिल सु. १०-२ सेकंद, बेंझिल सु.०·०५ ते ०·१ सेकंद, ट्रायफिनिल मिथिल बरेच स्थिर, डायफिनिल पिक्रिल हायड्राझिल घन रूपात दीर्घकाल स्थिर आढळते.
भिन्न संयुगांचे विगमन कमीजास्त प्रमाणात होते व कमीअधिक स्थिर मुक्त मूलके बनतात याची दोन मुख्य कारणे आहेत. ट्रायफिनिल मिथिल सारख्या मूलकातील फिनिल गटांच्या दाटीमुळे विक्रियांस निर्माण होणारा त्रिमितीय अडथळा हे एक आणि दुसरे म्हणजे अयुग्मित इलेक्ट्रॉनाचे अनुस्पंदन हे कारण जास्त महत्त्वाचे असते. ट्रायफिनिल मिथिल मूलकात हा इलेक्ट्रॉन तीन फिनिल गटांपैकी कोणत्याही एका गटात आणि त्यामधील कोणत्याही स्थानी किंवा मध्यवर्ती असलेल्या कार्बन अणूवर असू शकतो. अशा प्रकारे दहा वेगवेगळ्या संरचना होऊ शकतात. त्यांची कल्पना यावी यासाठी त्यांपैकी चार संरचना सूत्र ८ मध्ये दाखविल्या आहेत.
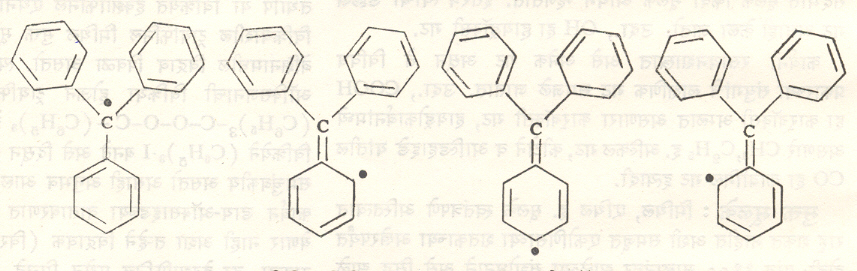
रेणू अशा भिन्न संरचना दाखवितो किंवा त्यांचे समतोल मिश्रण बनवतो असे नसून एकाच वेळी त्या सर्व संरचनांचे समावेशक धर्म व त्या सर्वांहून अधिकत्वाने असलेले स्थैर्य हे या अनुस्पंदन संरचनायुक्त संयुगाचे वैशिष्ट्य असते.
निर्मिती : मुक्त मूलकांची निर्मिती अनेक प्रकारे करता येते.
(१) उष्णतेने रेणूचे अपघटन केले असता मुक्त मूलके निर्माण होतात. त्यासाठी लागणारे तापमान, ज्या अणूंमध्ये बंध असेल त्याच्या बंध विगमन ऊर्जेवर अवलंबून असते. पेरॉक्साइडे व परएस्टरे यांचे अपघटन मध्यम तापमानास घडते म्हणून त्यांच्यापासून उष्णतेने मुक्त मूलके मिळविणे सोयीचे असते.
|
R – O – O – R |
उष्णता |
RO· + RO. |
|
पेरॉक्साइड |
⟶ |
मुक्त मूलके |
सूत्र ९. पेरॉक्साइडांचे अपघटन
कार्बनी ॲझो संयुगे, डायसल्फाइडे इत्यादींपासूनही उष्णतेने मुक्त मूलके निर्माण करता येतात. दोन कार्बन अणूंमधील बंधनाचे भंजन करण्यास फार उच्च तापमान लागते.
(२) २५००–३५०० Å (Å -अँगस्ट्रॉम, १ अँगस्ट्रॉम = १०-१० मी.) या तरंगलांबीच्या जंबुपार किरणांच्या (दृष्य वर्णपटातील जांभळ्या रंगाच्या पलीकडील अदृष्य किरणांच्या) अंगी ८२–११२ किकॅ. प्रती रेणू इतकी ऊर्जा असते. तिचा उपयोग करूनही मुक्त मूलके बनविता येतात. उदा., क्लोरीन रेणूचे जंबुपार किरणांनी अपघटन.
|
जंबुपार किरण |
||
|
Cl– Cl |
® |
Cl· + Cl· |
|
क्लोरीन रेणू |
क्लोराइड मुक्त मूलके |
सूत्र १०. क्लोरीन रेणूचे जंबुपार किरणांनी अपघटन
याप्रमाणेच २५३७ ते ३१३० Å चे जंबुपार किरण वापरून ॲसिटोन बाष्पाचे मिथिल क ॲसिटिक मुक्त मूलकांत अपघटन होते.
(३) रेडॉक्स विक्रियांचा उपयोग करूनही मुक्त मूलके बनविता येतात. फेरस आयन व कार्बनी हायड्रोपेरॉक्साइड यांमधील विक्रियेने सूत्र ११ मध्ये दाखविल्याप्रमाणे हायड्रॉक्सी मुक्त मूलके निर्माण होतात.
|
Fe++ |
+ |
R-O-OH |
→ |
Fe+++ |
+ |
RO. |
+ |
OH– |
|
फेरस आयन |
हायड्रो-पेरॉक्साइडसंयुग |
फेरिक आयन |
मुक्त मूलक |
हायड्रॉक्सील आयन |
सूत्र ११. फेरस आयनांच्या योगे हायड्रोपेरॉक्साइडांपासून मुक्त मूलके
(४) युक्त विक्रिया करणारे विद्राव त्वरेने एकमेकांत मिसळल्यास त्यात अल्पकाल समतोलात असणारी मध्यस्थ मुक्त व आयन मूलके उपलब्ध होऊ शकतात. उदा. TiCl3 व H2O2 यांच्या जलीय विद्रावात OH (हायड्रॉक्सिल) मुक्त मूलके मिळतात.
|
Ti3+ |
+ |
H2O2 |
® |
Ti4+ |
+ |
·OH |
+ |
OH- |
|
टिटॅनियम |
हायड्रौजन पेरॉक्साइड |
टिटॅनियम |
हायड्रॉक्सील मुक्त मूलक |
हायड्रॉक्सील आयन |
सूत्र १२. TiCl3 व H2O2 यांच्या जलीय विद्रावत OH मुक्त मूलक निर्मिती.
(५) क्ष-किरण, गॅमा किरण इ. उच्च ऊर्जायुक्त किरण व किरणोत्सर्गी (भेदक कण किंवा किरण बाहेर टाकणाऱ्या) मुलद्रव्यांपासून मिळणारे उच्च ऊर्जायुक्त कण वायुरूपातील रेणूंचे मुक्त मुलके व आयनांत अपघटन घडवून आणतात पण अशा विक्रियांचे नियंत्रण करता येत नाही.
अभिज्ञान व मापन : बहुसंख्य मुक्त मूलके अल्पायू असल्यामुळे त्यांचे अभिज्ञान (अस्तित्व ओळखणे) व मापन यांसाठी सूक्ष्मग्राही पद्धती वापराव्या लागतात.
एका पद्धतीत १, १ डायफिनिल-२, पिक्रिल हायड्राझिल या स्थिर व गडद जांभळ्या रंगाच्या मुक्त मूलकाचा उपयोग केला जातो. दुसऱ्या मुक्त मूलकांची त्याच्याशी विक्रिया झाली म्हणजे रंग फिका होत जातो. रंग फिका पडण्याचे प्रमाण मुक्त मूलकांच्या संहतीवर अवलंबून असते म्हणून मूळ रंगात मुक्त मूलकांमुळे पडलेला फरक वर्णभट प्रकाशमापकाने [→ प्रकाशमापन] मोजून मुक्त मूलकाचे प्रमाणे निश्चित करता येते.
एखाद्या प्रकाशरासायनिक विक्रियेत आयोडिनाचा समावेश केला, तर निर्माण होणाऱ्या मुक्त मूलकांच्या प्रमाणात त्या मूलकांची आयोडाइडे प्राप्त होतात. अशा तऱ्हेने विक्रियेतील सर्व मुक्त मूलके बद्ध करता येतात. योग्य परिस्थितीत वापरल्यास या पद्धतीने मुक्त मूलकांचे अभिज्ञान करता येते.
शोषण वर्णपटविज्ञानाने [→ वर्णपटविज्ञान] मुक्त मूलकांचे अभिज्ञान व मापन सुलभतेने करता येते. त्यासाठी [→ द्रव्यमान वर्णपटमापन] द्रव्यमान वर्णपटविज्ञान पद्धतीही उपयोगी पडते.
इलेक्ट्रॉन परिवलन अनुस्पंदन (इ. प. अ.) वर्णपटविज्ञान हे तंत्र घन, द्रव व वायू यांतील मुक्त मूलकांचे अभिज्ञान करण्यासाठी आणि मुक्त मूलकांची संरचना व त्यांतील अयुग्मित इलेक्ट्रॉनांचे वितरण ठरविण्याचे एक उत्कृष्ट आधुनिक तंत्र ठरले आहे.
इ. प. अ. तंत्र सूक्ष्मग्राही असून १०-९ (M) रेणू एवढ्या कमी प्रमाणातील मुक्त मूलकांचे अभिज्ञान त्याने होऊ शकते. या तंत्रावरून मिळणारा आलेख एक वा अधिक अयुग्मित इलेक्ट्रॉन असल्याचेही दाखवू शकते. म्हणूनच प्रत्येक मूलकाचा इलेक्ट्रॉन परिवलन अनुस्पंदन वर्णपट वैशिष्ट्यपूर्ण असतो व त्यावरून मूलकाच्या अभिज्ञानाबरोबर त्याची संरचनाही कळू शकते. उदा., CF3 च्या इ. प. अ. वर्णपटावरून या मूलकाची संरचनाही कोणस्तूपाकार (पिरॅमिडासारखी) असल्याचे आढळते. तसेच ट्रायफिनिल मिथिल मूलकात अयुग्मित इलेक्ट्रॉन पूर्ण मूलकावर पसरल्यासारखा असल्याचे अशा इ. प. अ. वर्णपटावरून आढळून येते.
रासायनिक विक्रिया : मुक्त मूलके विक्रियाशील असतात. दोन मूक्त मूलकांची परस्परांत विक्रिया होऊन समावेशनाने संयुगाचा रेणू बनतो, उदा., R¯ + R′. → R – R′ किंवा असमान विभाजन होते,
उदा., R + R′ – CH2 – CH2 → RH + R′CH = CH2.
मुक्त मूलके समावेशन, विष्ठापन (स्थलांतर) व पुनर्विन्यास या महत्त्वाच्या विक्रियांमध्ये भाग घेतात.
समावेशन : अतृप्त संयुगाचे सूर्यप्रकाशात बाष्परूपात वा अध्रुवी (ज्याच्या रेणूंमध्ये धन व ऋण भारांचे कायमचे विलगीकरण झालेले नाही अशा) विद्रावकात होणारे हॅलोजनीकरण (हॅलोजनाचा समावेश होण्याची विक्रिया) मुक्त मूलकांमुळेच घडून येते. उदा., टेट्राक्लोरोएथिलिनाचे सूर्यप्रकाशाने उत्प्रेरित क्लोरिनीकरण घडते तेव्हा प्रथम क्लोरीन रेणूपासून प्रकाशामुळे दोन क्लोराइड मुक्त मूलके बनतात. त्यानंतर एका क्लोरीन मुक्त मूलकाचे एका टेट्राक्लोरोएथिलीन रेणूत समावेशन होते व त्यामुळे दुसरे एक मुक्त मूलक तयार होते. त्याची क्लोरिनाच्या रेणूवर विक्रिया होऊन हेक्झाक्लोरोएथेन व एक क्लोराइड मुक्त मूलक बनते. या मुक्त मूलकाने दुसऱ्या टेट्राक्लोरोएथिलिनाच्या रेणूवर विक्रिया होऊन वरील प्रमाणेच विक्रिया आवर्तन सुरू होते. एकदा सुरू झाल्यावर स्वयंचिरस्थायी होणारी शृंखला विक्रिया ही मुक्त मूलकांनी घडविलेल्या विक्रियांचे प्रमुख लक्षण होय. [रासायनिक विक्रिया].
|
सूर्यप्रकाश |
||
|
Cl – Cl |
® |
Cl. + Cl. |
|
क्लोराइड मूलके |
|
CCl2 = CCl2 |
+ |
Cl. |
⟶ |
.CCl2 – CCl3 |
|
टेट्राक्लोरोएथिलीन |
क्लोराइड मूलक |
नवीन तयार झालेले मुक्त मूलक |
||
|
↑ |
↓ |
|||
|
Cl. |
+ |
CCl3 – CCl3 |
||
|
क्लोराइड मूलक |
हेक्झाक्लोरोएथेन |
सूत्र १३. मुक्त मूलकाने घडविलेली शृंखला विक्रिया
प्रोपिलीन व हायड्रोजन ब्रोमाइड यांची विक्रिया आयनी मध्यस्थांमुळे घडते तेव्हा आयोसोप्रोपिल ब्रोमाइड मिळते परंतु हीच विक्रिया
|
HBr |
||
|
CH3 – CH = CH2 |
→ |
CH3 – CHBr – CH3 |
|
प्रोपिलीन |
आयसोप्रोपिल ब्रोमाइड |
सूत्र १४. आयनी मध्यस्थामुळे घडणारी विक्रिया
पेरॉक्साइडांच्या उपस्थितीत घडविली, तर n-प्रोपिल ब्रोमाइड बनते. याचे कारण ही विक्रिया पेरॉक्साइडामुळे बनलेल्या मुक्त मूलकांमुळे घडून येते. तिची यंत्रणा सूत्र १५ मध्ये दर्शविल्याप्रमाणे आहे. (Ra. = पेरॉक्साइडापासून बनलेले मुक्त मूलक).
|
Ra. |
+ |
HBr |
→ |
RaH |
+ |
Br. |
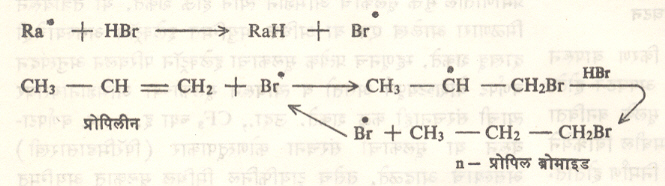
सूत्र १५. मुक्त मूलक मध्यस्थामुळे घडणारी विक्रिया
|
येथे CH3 |
-CH – |
CH2 |
|
। |
||
|
Br |
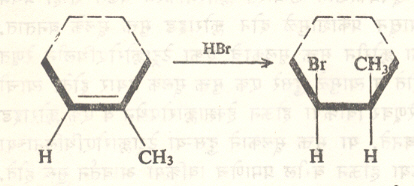
असे प्राथमिक स्वरूपाचे मुक्त मूलक झाले नाही कारणCH3-CH-CH2Br हे द्वितीयक मुक्त मूलक त्यापेक्षा जास्त स्थिर असते. अतृप्त संयुगात होणारे HBr चे मुक्त मूलकाने होणारे समावेशन त्रिमितिविशिष्ट असते. उदा., १, मिथिल सायक्लोहेक्झीनापासून सिस् (समपक्ष) १, ब्रोमो-२- मिथिल सायक्लोहेक्झेन बनते.
व्हिनिल बहुवारिकीकरण ही उद्योगधंद्यातील महत्त्वाची प्रक्रिया बेझॉइल पेरॉक्झाइडपासून निर्माण झालेल्या मुक्त मूलकांकरवी घडून येते [→ बहुवारिकीकरण]. त्यामध्ये प्रारंभ, प्रसारण व समाप्ती या तीन पायऱ्या असतात.
सूत्र १६. त्रिमितिविशिष्ट समावेशन
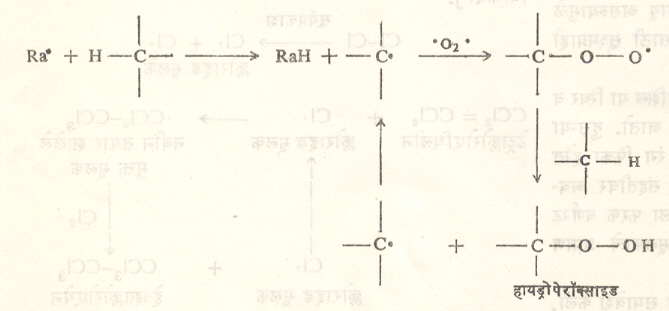
विष्ठापन : स्वयंऑक्सीडीकरण : कार्बनी संयुगावर सौम्य परिस्थितीत होणारा ऑक्सीजनाचा परिणाम मुक्त मूलकांमुळेच होतो. पदार्थांमध्ये सामान्यतः अल्प प्रमाणात काही धातवीय अशुद्धी असते. तिच्यामुळे ऑक्सीडीकरणात सुरुवात होते. पेरॉक्साईडांची त्यात भर पडली म्हणजे या विक्रियेस जास्त जोराने चालना मिळते. हवा व सूर्यप्रकाश यांच्या संपर्कात असणाऱ्या कार्बनी संयुगाचे ऑक्सीडीकरण होऊन अनेक कार्बनी संयुगांपासून सूत्र १७ मध्ये दर्शविल्याप्रमाणे हायड्रोपेरॉक्साइडे बनतात.
काही ठिकाणी तयार झालेले हायड्रोपेरॉक्साइडच विक्रियेला चालना देते व त्यामुळे विक्रिया स्वयंउत्प्रेरकी होते. आयसोप्रोपिल बेंझिनापासून फिनॉल व ॲसिटोन यांची निर्मिती व टेट्राडायड्रोनॅप्थालिनाचे टेट्रालोनात रूपांतर ही स्वयंऑक्सीडीकरणाची काही उदाहरणे होत. अँथ्रॅसिनासारख्या हायड्रोकार्बनांचे प्रकाशीय ऑक्सीडीकरण मुक्त मूलकाच्या योगेच घडून येते.
पुनर्विन्यास : ज्या मुक्त मूलकांमध्ये अरिल गटांची गर्दी झालेली असते त्यांच्या रासायनिक विक्रिया होताना पुनर्विन्यास होतो. उदा., सूत्र १८ मध्ये दाखविलेल्या (अ) या मुक्त मूलकातील CO घालविल्याने जे संयुग बनते ते बनताना मुक्त मूलकामध्ये सूत्रात दर्शविल्याप्रमाणे पुनर्विन्यास घडून येतो व (आ) हे मुक्त मूलक बनते.
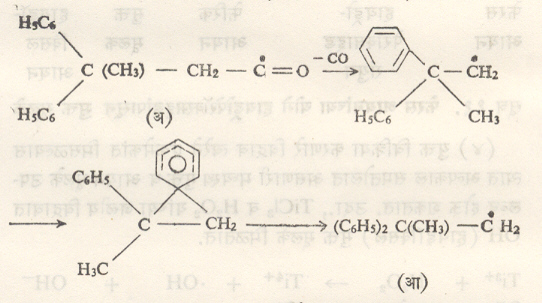
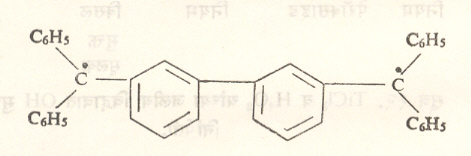 द्विमूलके : ज्या मुक्त मूलकांमध्ये दोन अयुग्मित इलेक्ट्रॉन असतात त्यांना ही संज्ञा लावतात. असे इलेक्ट्रॉन एकमेकांपासून दूर आणि त्रिमितीय दृष्टीने प्रतिबंधित असतील, तर त्यांची कार्यक्षेत्रे संपूर्णपणे अलग राहतात आणि द्विमूलकाचे रासायनिक व वर्णपटी गुणधर्म दोन स्वतंत्र मुक्त मूलकांसारखे आढळतात. उदा., सूत्र १९ मध्ये दर्शविलेले हायड्रोकार्बन संयुग. तथापि बऱ्याच द्विमूलकांच्या संरचना व त्रिमितीय मांडण्या अशा असतात की, त्यांतील दोन अयुग्मित इलेक्ट्रॉनांच्या कार्यक्षेत्रांचा काही भाग समान असतो. त्यामुळे या इलेक्ट्रॉनांमध्ये काही प्रमाणातचुंबकीय आंतरक्रिया असते. ही आंतरक्रिया ज्या प्रमाणात प्रबल असेल त्या प्रमाणात इलेक्ट्रॉन युग्मित झाल्यासारखे होतात. ही आंतरक्रिया क्षीण असेल, तर ते इलेक्ट्रॉन जवळजवळ अयुग्मितच राहतात. इलेक्ट्रॉन युग्मित असलेल्या द्विमूलकाला एकाकी मूलक आणि अयुग्मित इलेक्ट्रॉन असलेल्या द्विमूलकाला त्रिक् द्विमूलक ही संज्ञा लावतात.
द्विमूलके : ज्या मुक्त मूलकांमध्ये दोन अयुग्मित इलेक्ट्रॉन असतात त्यांना ही संज्ञा लावतात. असे इलेक्ट्रॉन एकमेकांपासून दूर आणि त्रिमितीय दृष्टीने प्रतिबंधित असतील, तर त्यांची कार्यक्षेत्रे संपूर्णपणे अलग राहतात आणि द्विमूलकाचे रासायनिक व वर्णपटी गुणधर्म दोन स्वतंत्र मुक्त मूलकांसारखे आढळतात. उदा., सूत्र १९ मध्ये दर्शविलेले हायड्रोकार्बन संयुग. तथापि बऱ्याच द्विमूलकांच्या संरचना व त्रिमितीय मांडण्या अशा असतात की, त्यांतील दोन अयुग्मित इलेक्ट्रॉनांच्या कार्यक्षेत्रांचा काही भाग समान असतो. त्यामुळे या इलेक्ट्रॉनांमध्ये काही प्रमाणातचुंबकीय आंतरक्रिया असते. ही आंतरक्रिया ज्या प्रमाणात प्रबल असेल त्या प्रमाणात इलेक्ट्रॉन युग्मित झाल्यासारखे होतात. ही आंतरक्रिया क्षीण असेल, तर ते इलेक्ट्रॉन जवळजवळ अयुग्मितच राहतात. इलेक्ट्रॉन युग्मित असलेल्या द्विमूलकाला एकाकी मूलक आणि अयुग्मित इलेक्ट्रॉन असलेल्या द्विमूलकाला त्रिक् द्विमूलक ही संज्ञा लावतात.
एकाकी द्विमूलके चुंबकाने अपसारित होतात, तर त्रिक् द्विमूलके आकर्षित होतात. आवश्यक असेल तेथे एकाकी इलेक्ट्रॉन उलटसुलट उभ्या बाणांनी व त्रिक् एकाच दिशेने असलेल्या दोन उभ्या बाणांनी दाखविले जातात.
निर्मिती : पॉलिमिथिलीन वर्गाची द्विमूलके बनविण्याची एक सामान्य पद्धत म्हणजे वायू अवस्थेत प्रकाशाच्या योगाने वलयी क्रिटोनाचे अपघटन घडविणे ही होय.
पॉलिमिथिलिनांच्या डायब्रोमो अनुजातांवर (त्यापासून बनलेल्या इतर संयुगांवर) सोडियम बाष्पाची विक्रिया घडविल्यानेही द्विमूलके बनतात (सूत्र २०).
|
BrCH2-(CH2)n-CH2Br |
+ 2Na |
⟶ |
|
|
पॉलिमिथिलीन डायब्रोमो अनुजात |
सोडियम |
||
|
CH2-(CH3)n-CH2 -CH2 + 2NaBr |
|||
|
द्विमूलक |
सोडियम ब्रोमाइड |
||
सूत्र २०. सोडियम बाष्प विक्रियेने द्विमूलक निर्मिती
ज्या वलयी हायड्रोकार्बनांमध्ये संयुजा बंधावर ताण असतो त्यापासून उष्णतेच्या योगाने संयुजा बंध तुटून द्विमूलक निर्माण होते. उदा. सूत्र २१ मधील विक्रिया.
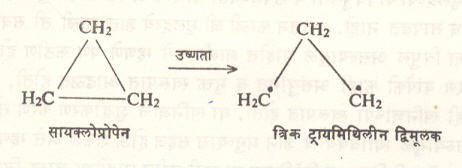
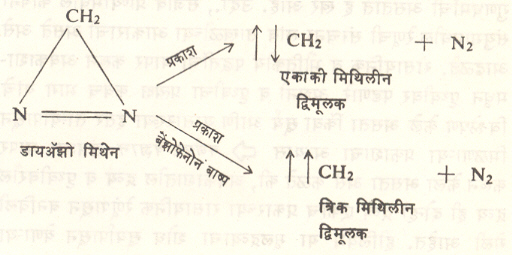
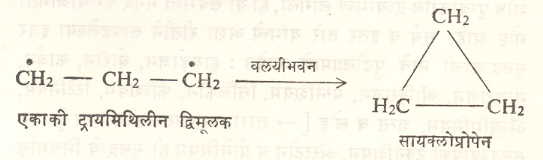
या पद्धतीने सामान्यतः त्रिक् पद्धतीचे द्विमूलक बनते. तथापि सायक्लोडाय-ॲझोप्रोपेनावर प्रकाशाची विक्रिया झाली म्हणजे एकाकी ट्रायमिथिल द्विमूलक मिळते (सूत्र २२). मिथिलीन द्विमूलकाचा एकाकी प्रकार डाय-ॲझोमिथेनाचे प्रकाशीय अपघटन केल्याने मिळतो. हेच अपघटन बेंझोफेनोनाच्या बाष्पाच्या उपस्थितीत घडविले, तर याचाच त्रिक् प्रकार मिळतो (सूत्र २३). द्विमूलके विक्रियाशील असतात. पण एकाकी व त्रिक् प्रकारानुसार विक्रियांत फरक आढळतो. उदा, ट्रायमिथिलीन द्विमूलकाच्या एकाकी प्रकारापासून वलयीभवनाने सायक्लोप्रोपेन बनते, तर त्रिक् प्रकारामधील हायड्रोजन अणूचे ⇨ समघटकीकरण होऊन प्रोपिलीन तयार होते. (सूत्र २४ व २५).
मिथिलीन द्विमूलक द्विबंधयुक्त संयुगात समाविष्ट होते. एकाकी प्रकार समाविष्ट होतो तेव्हा मूळ संयुगाची त्रिमितीय संरचना बदलत नाही परंतु त्रिक् प्रकाराचे समावेशन होते तेव्हा समपक्ष व विपक्ष या दोन्ही प्रकारांची संयुगे तयार होतात [→ त्रिमितीय रसायनशास्त्र].
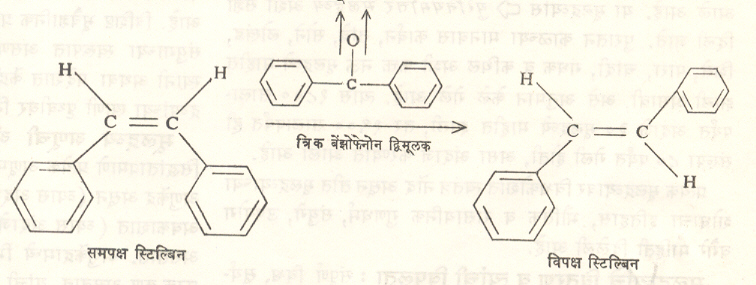
अनेक रासायनिक विक्रियांमुळे मुक्त मूलकांप्रमाणे द्विमूलके विक्रियाशील मध्यस्थ म्हणून कामगिरी बजावतात. उदा., समपक्ष स्टिल्बिनाचे
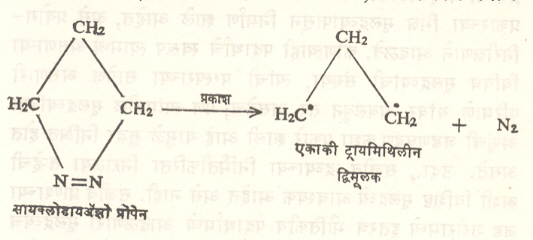
|
CH2-CH2-CH2 |
समघटकीकरण |
CH3-CH=CH2 |
|
त्रिक् ट्रायमिथिलीन द्विमूलक |
→ |
प्रोपिलीन |
सूत्र २५. समघटकीकरणाने प्रोपिलीनाची निर्मिती
विपक्ष स्टिल्बिनात जे समघटकीकरण होते ते त्रिक् बेंझोफेनोन द्विमूलकाच्या योगे घडून येते.
संदर्भ : 1. Huyser, E. S. Free Radical Chain Reactions, New York, 1971.
2. Kochi, J. K. Ed., Free Radicals, New York, 1973.
3. Pryor, W. A. Free Radicals, New York, 1964.
4. Pryor, W. A. Introduction to Free Radical Chemistry, Englewood Cliffs, N.J., 1966.
5. Sterling, C. J. M. Radicals in Organic Chemistry, London, 1965.
6. Sykes, P. A. Guidebook to Mechanism in Organic Chemistry, London, 1965.
केळकर, गो. रा.
“