मिश्रधातु : दोन किंवा अधिक घटक धातू असलेल्या मिश्रणास मिश्रधातू म्हणतात. अशा मूलभूत व्याख्येने मिश्रधातूंचे योग्य वर्णन करता येत नाही. मिश्रधातू ह्याच्या विरुद्ध शुद्ध धातू आहे. कोठल्याही धातूमधील अपद्रव्ये आपल्या मापनक्षमतेपेक्षा कमी असली म्हणजे ती धातू शुद्ध आहे असे समजले जाते परंतु मापनक्षमतेपेक्षा सूक्ष्म प्रमाणात इतर धातू त्या शुद्ध धातूत असतातच. त्यामुळे मूलभूत दृष्ट्या जगातील सर्व धातू या मिश्रधातूच समजल्या पाहिजेत. १९५० सालानंतर खूपच धातू (उदा., सिलिकॉन, जर्मेनियम) प्रथम अतिशुद्ध करून त्यांत अतिसूक्ष्म प्रमाणात विशिष्ट अपद्रव्ये मिसळून विविध प्रकारच्या आश्चर्यकारक इलेक्ट्रॉनीय गुणधर्मांच्या मिश्रधातू मिळविणे साध्य झाले आहे. [ → अर्धसंवाहक]. या आधुनिक सूक्ष्म मिश्रधातूंच्या शोधामुळे शुद्ध आणि मिश्र यांच्या नेमक्या व्याख्या करणे कठीण झाले आहे.
उपयोगाच्या दृष्टीने सुद्धा प्राचीन काळापासून शुद्ध धातू फार कमी वापरल्या जात आहेत. दागिने किंवा इतर किंमती वस्तूंसाठी वापरल्या जाणाऱ्या सोने, चांदी, प्लॅटिनम यांसारख्या किंवा उत्कृष्ट विद्युत् संवाहकतेसाठी वापरल्या जाणाऱ्या तांबे, ॲल्युमिनियम यांसारख्या धातूंची अपवादात्मक उदाहरणे सोडली, तर गुणधर्मांची अनुकूलता व कमी किंमतीच्या म्हणून मिश्रधातूच सर्व ठिकाणी प्रामुख्याने वापरल्या जातात. या कारणांमुळे मिश्रधातूची व्याप्ती फार मोठी आहे.
प्रस्तुत नोंदीत प्रथम मिश्रधातूंची सैद्धांतिक बैठक थोडक्यात दिली आहे त्यानंतर मिश्रधातू बनविण्याच्या पद्धतींचा आढावा घेतला आहे. काही उपचारांनी मिश्रधातूंचे बलसंवर्धन कसे करता येते, याबद्दलच्या स्थूल माहितीनंतर काही प्रमुख व विशिष्ट मिश्रधातूंसंबंधी माहिती दिलेली आहे. याव्यतिरिक्त कासे, पितळ, पोलाद व लोहमिश्रके या गटांच्या मिश्रधातूंची विशेष माहिती त्यांवरील स्वतंत्र नोंदींत दिलेली असून महत्त्वाच्या धातूंच्या मिश्रधातूंची माहिती त्या त्या धातूवरील नोंदीत समाविष्ट केलेली आहे.
इतिहास: कासे व सोन्याच्या मिश्रधातू मानवाला प्रागैतिहासिक काळापासून (इ. स. पू. सु. ४००० वर्षांपासून) माहीत आहे. सोन्यामध्ये तांबे किंवा चांदी मिसळून मिश्रधातू बनविण्याची कला प्राचीन काळापासून अवगत असून अशा मिश्रधातू तेंव्हा दागदागिन्यांसाठी व दातांत भरण्यासाठीही वापरल्या जात. अशा प्रकारे इट्रुस्कन, ग्रीक, रोमन, खाल्डियन, ईजिप्शियन, भारतीय व चिनी लोकांना धातुमिश्रणाची कला प्राचीन काळापासून अवगत होती, असे दिसून येते. रसार्णव यासारख्या प्राचीन भारतीय ग्रंथांत मिश्रधातू बनविणे, तिच्यावर संस्कार करणे व तिला विशिष्ट गुणधर्म प्राप्त करू देणे यांसंबंधी सांगोपांग माहिती दिली आहे. तथापि यांतील बरीचशी माहिती त्यातील कृतींचे तंत्र अस्तंगत झाल्याने ‘गूढ माहिती’ या सदरात टाकली जाते. कासे ही तांब्याची मिश्रधातू त्याच्यापेक्षा कठीण असल्याने भांडीकुंडी, पुतळे यांच्याप्रमाणेच हत्यारे, शस्त्रास्त्रे (उदा., सुऱ्या, भाल्याचे फाळ इ.) सुद्धा काशाची बनविण्यात येऊ लागली. अशी शस्त्रास्त्रे बनवू शकणाऱ्या जमातींनी इतरांवर वर्चस्व मिळविले होते. अशा तऱ्हेने मानवी संस्कृतीवर या मिश्रधातूचा प्रभाव काही सहस्त्र वर्षे टिकून राहिला व त्यामुळे या कालखंडाला ‘कास्य (ब्राँझ) युग’ म्हणतात. यानंतरच्या काळात लोखंडाच्या मिश्रधातूंचा प्रभाव वाढून लोहयुग सुरू झाले.
सर हेन्री बेसेमर यांनी १८५६ मध्ये शोधून काढलेली प्रक्रिया हा मिश्रधातुनिर्मितीमधील महत्त्वाचा टप्पा आहे. या प्रक्रियेने बिडापासून अर्ध्या तासात अर्ध्या टनापर्यंत पोलाद बनविता येऊ लागले (तत्पूर्वी यासाठी कित्येक दिवस लागत). के. डब्ल्यू. सीमेन्स यांनी खुल्या चुल्याची भट्टी तर पॉल ल्वी तूसँ एरू यांनी विजेची भट्टी शोधली. त्यामुळे पोलादाचे प्रकार व गुणवत्ता यांत खूप सुधारणा झाल्या. १८६१ साली हेन्री सी. सॉर्बी यांनी इंग्लंडमध्ये मिश्रधातूंच्या विकासार्थ एक प्रतिष्ठान स्थापन केले. माक्स फोन लौए, डब्ल्यू. एच्. व डब्ल्यू. एल्. ब्रॅग यांनी १८१२ मध्ये मिश्रधातूंच्या स्फटिकांची संरचना क्ष-किरण विश्लेषणाच्या साहाय्याने निश्चित करण्याची पद्धत विकसित केली.
विसाव्या शतकाच्या मध्यास नवीन प्रकारच्या मिश्रधातू बनविण्याचे प्रयत्न विशेष जोमाने होऊ लागले (उदा., अण्वस्त्रे आणि अणुऊर्जानिर्मिती यांमध्ये लागणाऱ्या मिश्रधातू). तद्नंतर अत्यंत शुद्ध (१० अब्ज अणूंमागे अशुद्धीचा एक अणू) धातू बनविण्याचे प्रयत्न होऊ लागले. या धातू काही अर्धसंवाहक इलेक्ट्रॉनीय प्रयुक्तींसाठी आवश्यक असून त्यांत खास इलेक्ट्रॉनीय गुणधर्म येण्यासाठी अत्यंत अल्प परंतु अचूक प्रमाणात अपद्रव्यांचे मिश्रण होणे आवश्यक असते. सध्या विशेषेकरून उच्चतापासह साधनांसाठी उपयुक्त अशा मिश्रधातू बनविण्याचे प्रयत्न चालू आहेत. याकरिता धातवीय द्रव्याच्या सर्व भागांत सूक्ष्म व अतिसूक्ष्म अधातवीय कण किंवा तंतू विखरून घालावे लागतात. अतिवेगवान विमाने व अति-उच्च तापमानाच्या उर्जाउद्गमांचे नियमन करून अधिक कार्यक्षम शक्ति-उद्गमांचा विकास करणे या दृष्टीने ह्या मिश्रधातू महत्त्वाच्या आहेत. अशा तऱ्हेने हजारो मिश्रधातू बनविण्यात आल्या असून त्यांत दरवर्षी भर पडत आहे. व त्यांसाठी विविध मूलद्रव्ये वापरण्यात येत आहेत.
विसाव्या शतकामध्ये मिश्रधातूंच्या स्फटिकी संरचना आणि त्यांमधील वाहक इलेक्ट्रॉनांची हालचाल यांवरील मूलभूत ज्ञानात खूपच भर पडली आहे. मानवजातीच्या इतिहासात पुरातन काळापासून मिश्रधातू वापरात आहेत. अशा मिश्रधातू बनविताना कोणत्या धातूचे दुसऱ्या कोणत्या धातूत मिश्रण केले असता कोणत्या विशिष्ट गुणधर्माची मिश्रधातू मिळते, हे सैद्धांतिक बैठक माहीत नसतानाही अवगत होते. आजही काही अपवादात्मक उदाहरणे सोडली, तर सामान्य वापरातील मिश्रधातू अनुमानाने किंवा सैद्धांतिक बैठक न समजता केलेल्या व यशस्वी ठरलेल्या सूत्राप्रमाणेच बनविल्या जातात. अशा मिश्रधातूंच्या घटकांविषयी एकस्वे (पेटंटे) घेतली जातात. त्यामुळे मिश्रधातू निर्माण करणे हे आजही बऱ्याच अंशी अनुमानाचेच कार्य राहिलेले आहे.
मिश्रधातूंची सैद्धांतिक बैठक: घटक धातूंच्या संख्येप्रमाणे मिश्रधातू द्विघटक (पितळ, कासे), त्रिघटक [अगंज (स्टेनलेस) पोलादे] किंवा बहुघटक अशा विभागता येतील. यांपैकी द्विघटक मिश्रधातूंची सैद्धांतिक बैठक खूपशा सुसंबद्ध रीतीने सांगता येते. दोनापेक्षा जास्त घटक असणाऱ्या मिश्रधातूंची स्फटिक संरचना व प्रावस्था [→ प्रावस्था नियम] यांमध्ये गुंतागुंत असल्याने त्याबद्दल नेटके सैद्धांतिक विवेचन करता येते नाही.
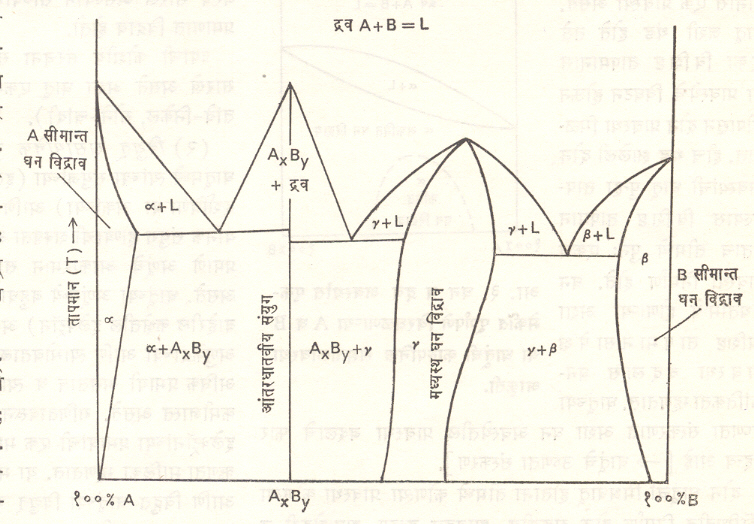
शुद्ध धातूमध्ये घन व द्रव स्थितीत एकच प्रावस्था असते. त्यामुळे सूक्ष्मदर्शकातून पाहिल्यास त्यामध्ये स्फटिक कणांशिवाय काहीही दिसत नाही. ⇨ घन विद्राव सोडल्यास इतर मिश्रधातूंमध्ये सूक्ष्मदर्शकातून अनेक प्रावस्था दिसतात या प्रावस्थामध्ये धातूच्या वाढत्या अगर उतरत्या तापमानाप्रमाणे फरक पडतो. मिश्रधातूच्या गुणधर्माचे मूळ तिच्यामधील प्रावस्था व तिच्यामध्ये तापमानाने होणारे बदल यांमध्ये मुख्यतः असते. A व B असे घटक धातू असलेली मिश्रधातू घेतल्यास या मिश्रधातूच्या घटकांची व्याप्ती १००% A ते १००% B अशी असू शकते. या दोन टोकांमध्ये असलेल्या सर्व मिश्रधातू A व B च्याच असतात फक्त त्यांच्या प्रमाणात फरक असतो. A व B च्या अशा सर्व शक्य असलेल्या मिश्रधातूंमधील प्रावस्थांत तापमानाप्रमाणे कसा बदल होतो हे त्यांच्या (प्रावस्था) समतोलावस्था आकृतीवरून समजते [→ समतोलावस्था आकृत्या]. द्विघटकाप्रमाणे तीन किंवा जास्त घटक असलेल्या मिश्रधातूंची समतोलावस्था आकृती काढणे व ती सहज समजणे कठीण असते.
A व B हे घटक असलेल्या मिश्रधातू अनेक प्रकारच्या प्रावस्थांच्या असू शकतात. यातील सर्व शक्यतांच्या प्रावस्था दाखविणारी एक काल्पनिक समतोलावस्था आ. १ मध्ये दाखविली आहे.
 रसायनशास्त्रामध्ये जसे विद्राव असतात (उदा., मीठ व पाणी), तसेच विद्राव धातूंमध्ये घन अवस्थेत असतात. घन धातूंची आणवीय संरचना त्रिमितीय स्फटिक जालक हे एकक कोशांचे बनलेले असून त्या प्रत्येक कोशातील निरनिराळ्या स्थानांवर धातूचे अणू स्थापन झालेले असतात. विद्रुत (विरघळणारी) धातू जेव्हा विद्रावक (विरघळविणाऱ्या) धातूमध्ये विरघळते त्यावेळी विद्रुत धातूचे अणू विद्रावकाच्या कोशात बसून घन विद्राव तयार होतात. समतोलावस्था आकृतीच्या (आ. १) दोन्ही टोकांना (α, β ) असे घन विद्राव निर्माण होतात. आकृतीच्या दोन्ही टोकांना किंवा सीमांना हे विद्राव निर्माण होत असल्याने त्यांना सीमान्त घन विद्राव म्हणतात.
रसायनशास्त्रामध्ये जसे विद्राव असतात (उदा., मीठ व पाणी), तसेच विद्राव धातूंमध्ये घन अवस्थेत असतात. घन धातूंची आणवीय संरचना त्रिमितीय स्फटिक जालक हे एकक कोशांचे बनलेले असून त्या प्रत्येक कोशातील निरनिराळ्या स्थानांवर धातूचे अणू स्थापन झालेले असतात. विद्रुत (विरघळणारी) धातू जेव्हा विद्रावक (विरघळविणाऱ्या) धातूमध्ये विरघळते त्यावेळी विद्रुत धातूचे अणू विद्रावकाच्या कोशात बसून घन विद्राव तयार होतात. समतोलावस्था आकृतीच्या (आ. १) दोन्ही टोकांना (α, β ) असे घन विद्राव निर्माण होतात. आकृतीच्या दोन्ही टोकांना किंवा सीमांना हे विद्राव निर्माण होत असल्याने त्यांना सीमान्त घन विद्राव म्हणतात.
सीमान्त घन विद्राव दोन प्रकारांचे असतात. जेव्हा विद्रुत धातूचे अणू विद्रावकाच्या अणूंना बाजूला करून कोशात त्यांच्या जागेवर बसतात तेव्हा होणाऱ्या घन विद्रावाला प्रतिष्ठाप्य घन विद्राव म्हणतात. दुसऱ्या प्रकारात विद्रुत धातूचे अणू लहान आकारमानाचे असल्यास विद्रावकाच्या कोशातील नैसर्गिक पोकळ्यांमध्ये जाऊन बसतात. अशा प्रकारच्या घन विद्रावाला आंतरकोशीय विद्राव म्हणतात. प्रतिष्ठाप्य आणि आंतरकोशीय विद्रावांची कल्पना आ. २ वरून येईल.
काही धातू (उदा., निकेल व तांबे) घन अवस्थेत एकमेकींत पूर्णपणे विरघळतात. त्यावेळी मिळणारी समतोलावस्था आ. ३ मध्ये दाखविली आहे.
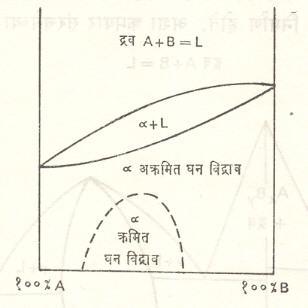 सामान्यपणे घन विद्राव निर्माण होताना विद्रुत व विद्रावक अणूंच्या कोशामधील संरचनेला क्रमवारता नसते [आ. २ (अ)]. अशा विद्रावाला अक्रमित विद्राव म्हणतात. काही परिस्थितींत तापमान बदलल्यावर अक्रमित संरचना जाऊन पूर्णपणे क्रमवार संरचना निर्माण होते. अशा क्रमवार संरचनेच्या विद्रावाला क्रमित तापमान विद्राव म्हणतात. आ. २ (इ) मध्ये अशी क्रमित संरचना दाखविली आहे व आ. ३ मध्ये क्रमित → अक्रमित रूपांतर आकृतीच्या तळभागात दाखविले आहे. काही अपवाद सोडल्यास घन विद्राव काही मर्यादेपर्यंत होतात. विद्रावाची मर्यादा संपल्यावर मिश्रधातूंमध्ये संयुगे निर्माण होतात, त्यांस आंतरधातवीय संयुगे म्हणतात. ही संयुगे दोन प्रकारची असतात. पहिल्या प्रकारची संयुगे रासायनिक संयुगाप्रमाणे असून त्यांना विशिष्ट रासायनिक सूत्र असते (उदा., Fe3C, MgZn2). दुसऱ्या प्रकारच्या संयुगांचे संघटन घन विद्रावाप्रमाणे असते व त्यामधील घटकांचे प्रमाण थोडेफार बदलू शकते. वरील दोन्ही प्रकारची संयुगे समतोलावस्था आकृतीच्या मधील भागात येत असल्याने त्यास मध्यस्थ प्रावस्था असे म्हणतात. आ.१ मध्ये या मध्यस्थ प्रावस्था AXBY व γ अशा दाखविल्या आहेत. मध्यस्थ प्रावस्थांच्या बाजूचे घन विद्राव व त्या प्रावस्था ह्यांची संयुक्त घडण असलेले भाग समतोलावस्था आकृतीत α + AXBY, AXBY + γ , γ + β असे दाखविले आहेत. काही मिश्रधातूंमध्ये (उदा., पोलाद, कासे) घन अवस्थेत उच्च तापमानास एक प्रावस्था असते. धातू जशी थंड होते तसे एका विशिष्ट तापमानास या प्रावस्थेचे विघटन होऊन तीपासून दोन प्रावस्था मिळतात. हीच थंड झालेली दोन प्रावस्थांची धातू पुन्हा तापवल्यास विशिष्ट तापमान येताच तीमध्ये पुनः एकच प्रावस्था निर्माण होते. घन स्थितीमध्ये होणाऱ्या अशा विशिष्ट तापमानसापेक्ष प्रावस्था बदलास घनक्रांतिकता म्हणतात. धातूंच्या उष्णता संस्करणात अशा घन अवस्थेतील प्रावस्था बदलाचे फार महत्त्व आहे. [→ धातूंचे उष्णता संस्करण].
सामान्यपणे घन विद्राव निर्माण होताना विद्रुत व विद्रावक अणूंच्या कोशामधील संरचनेला क्रमवारता नसते [आ. २ (अ)]. अशा विद्रावाला अक्रमित विद्राव म्हणतात. काही परिस्थितींत तापमान बदलल्यावर अक्रमित संरचना जाऊन पूर्णपणे क्रमवार संरचना निर्माण होते. अशा क्रमवार संरचनेच्या विद्रावाला क्रमित तापमान विद्राव म्हणतात. आ. २ (इ) मध्ये अशी क्रमित संरचना दाखविली आहे व आ. ३ मध्ये क्रमित → अक्रमित रूपांतर आकृतीच्या तळभागात दाखविले आहे. काही अपवाद सोडल्यास घन विद्राव काही मर्यादेपर्यंत होतात. विद्रावाची मर्यादा संपल्यावर मिश्रधातूंमध्ये संयुगे निर्माण होतात, त्यांस आंतरधातवीय संयुगे म्हणतात. ही संयुगे दोन प्रकारची असतात. पहिल्या प्रकारची संयुगे रासायनिक संयुगाप्रमाणे असून त्यांना विशिष्ट रासायनिक सूत्र असते (उदा., Fe3C, MgZn2). दुसऱ्या प्रकारच्या संयुगांचे संघटन घन विद्रावाप्रमाणे असते व त्यामधील घटकांचे प्रमाण थोडेफार बदलू शकते. वरील दोन्ही प्रकारची संयुगे समतोलावस्था आकृतीच्या मधील भागात येत असल्याने त्यास मध्यस्थ प्रावस्था असे म्हणतात. आ.१ मध्ये या मध्यस्थ प्रावस्था AXBY व γ अशा दाखविल्या आहेत. मध्यस्थ प्रावस्थांच्या बाजूचे घन विद्राव व त्या प्रावस्था ह्यांची संयुक्त घडण असलेले भाग समतोलावस्था आकृतीत α + AXBY, AXBY + γ , γ + β असे दाखविले आहेत. काही मिश्रधातूंमध्ये (उदा., पोलाद, कासे) घन अवस्थेत उच्च तापमानास एक प्रावस्था असते. धातू जशी थंड होते तसे एका विशिष्ट तापमानास या प्रावस्थेचे विघटन होऊन तीपासून दोन प्रावस्था मिळतात. हीच थंड झालेली दोन प्रावस्थांची धातू पुन्हा तापवल्यास विशिष्ट तापमान येताच तीमध्ये पुनः एकच प्रावस्था निर्माण होते. घन स्थितीमध्ये होणाऱ्या अशा विशिष्ट तापमानसापेक्ष प्रावस्था बदलास घनक्रांतिकता म्हणतात. धातूंच्या उष्णता संस्करणात अशा घन अवस्थेतील प्रावस्था बदलाचे फार महत्त्व आहे. [→ धातूंचे उष्णता संस्करण].
दोन धातूंची मिश्रधातू होताना तीमध्ये कोणत्या प्रावस्था कोणत्या परिस्थितीत निर्माण होऊ शकतील, ह्याबद्दल डब्ल्यू. ह्यूम-रोदरी व त्यांचे सहकारी यांनी काही नियमवजा ठोकताळे तयार केलेले आहेत. त्यांची थोडक्यात रूपरेषा खाली दिलेली आहे.
सीमान्त किंवा प्राथमिक विद्रावाचे नियम : प्रतिष्ठाप्य घन विद्रावामध्ये विद्रुत धातूचे अणू विद्रावक धातूच्या कोशात जाऊन बसत असल्याने अशी प्रतिष्ठापना कोणत्या परिस्थितीत व किती मर्यादेपर्यंत होईल याबद्दलचे अनुमान खालील गोष्टींवरून करता येते.
(१) अणूंचे सापेक्ष आकारमान : प्रत्येक अणू हा चेंडूप्रमाणे गोलाकार आहे असे मानले, तर त्याला आणवीय व्यास असतो. अणूंच्या संरचनेने कोश व जालक बनताना कोशाची मापे आणवीय व्यासावरून ठरतात. विद्रुत अणू विद्रावकाच्या कोशात स्थानापन्न होताना तो विद्रावकाच्या अणूपेक्षा आकारमानाने फार मोठा अगर लहान असल्यास तो स्थानापन्न होताना कोशामध्ये फार ताण उत्पन्न होतो. अशा आंतरिक ताणामुळे विद्राव अस्थिर होतो (टिकून राहत नाही). साधारणपणे दोन्ही धातूंच्या अणूंच्या व्यासात १५% पेक्षा कमी फरक असेल, तर प्रतिष्ठाप्य घन विद्रावाची शक्यता वाढते. उदा., तांबे ही विद्रावक आणि जस्त व कॅडमियम या विद्रुत धातू असल्यास घन विद्राव खालीलप्रमाणे होतो.
|
विद्रावक धातू |
विद्रुत धातू |
तुलनात्मक आणवीय व्यास |
विद्राव्यता (अणू %) |
|
तांबे |
जस्त |
४·२% |
३८·४ |
|
तांबे |
कॅडमियम |
१६·५% |
१·७ |
यावरून असे दिसते की, जस्त व तांबे यांचे आणवीय आकारमान बरेच सारखे असल्याने तांब्यामध्ये जस्ताचा कॅडमियमापेक्षा जास्त प्रमाणात विद्राव होतो.
ज्यांची कोशीय संरचना सारखी असते आणि आकारमानही सारखे असते अशा धातू एकमेकींत संपूर्णपणे विरघळतात (उदा.,तांबे-निकेल, सोने-चांदी).
(२) विद्युत् रासायनिक गुणधर्म : जर विद्रावक व विद्रुत धातूंमध्ये त्यांच्या संयुजांच्या (इतर अणूंशी संयोग पावण्याच्या क्षमता दर्शविणाऱ्या अंकांच्या) आणि अणुबंधनाच्या अनुकूलतेमुळे रासायनिक संयुग होण्याची शक्यता असली, तर वरील परिच्छेदात दिल्याप्रमाणे अणूंचे आकारमान सारखे असूनही घन विद्राव्यता कमी असते. धातूंच्या अणूंमध्ये बहुधा १ किंवा २ संयुजा इलेक्ट्रॉन (सर्वांत बाहेरील कक्षेतील इलेक्ट्रॉन) असतात. हे संयुजा इलेक्ट्रॉन धातूच्या अणुकेंद्राच्या आणि त्याभोवतालच्या इलेक्ट्रॉनांच्या परिणामांमुळे कमी अधिक प्रभावी असतात व त्यामुळे त्यांच्यातील अणुबंधनाची ऊर्जा कमीजास्त असते. गणितावरून सर्व मूलद्रव्यांच्या अणूंसाठी संयुजा इलेक्ट्रॉनांच्या प्रभावांची एक मालिका तयार केली आहे. तिला विद्युत् ऋणता मालिका म्हणतात. या मालिकेवरून असे दिसते की, विद्रावक आणि विद्रुत धातूंच्या विद्युत् ऋणतेमध्ये ± ०·४ पेक्षा जास्त फरक असल्यास आणवीय आकारमान अनुकूल असूनसुद्धा विद्राव्यता कमी असते. उदा., मॅग्नेशियम विद्रावक व अँटिमनी विद्रुत धातू असल्यास दोघींचा आणवीय व्यास जवळजवळ सारखा असूनसुद्धा या धातू एकमेकींत विरघळत नाहीत. मात्र त्यांपासून Mg3Sb2 हे स्थिर संयुग तयार होते.
(३) सापेक्ष संयुजा : आणवीय आकारमान आणि विद्युत् रासायनिक गुणधर्म अनुकूल असले, तर असे दिसून येते की, कमी संयुजेच्या धातूमध्ये जास्त संयुजेची धातू अधिक प्रमाणात विरघळते. उदा., सिलिकॉनाची संयुजा ४ आहे व तांब्याची संयुजा २ आहे. त्यामुळे तांब्यामध्ये सिलिकॉन जास्त विरघळते (१४ आणवीय %). याउलट सिलिकॉनमध्ये तांबे अत्यंत कमी प्रमाणात (२%) विरघळते.
(४) संयुजा इलेक्ट्रॉनांचे संख्याबल : वरील तिन्ही बाबी अनुकूल असल्यास विद्राव्यता किती प्रमाणात असेल हे त्या मिश्रधातूमधील घटक धातूंतील संयुजा इलेक्ट्रॉनांच्या संख्याबलावर अवलंबून असते. उदा., तांबे आणि जस्त या घटक धातू असल्यास तांब्यामध्ये प्रत्येक अणूमागे एक संयुजा इलेक्ट्रॉन असतो, तर जस्तामध्ये दोन संयुजा इलेक्ट्रॉन असतात. ८०% तांबे आणि २०% जस्ताचे अणू असलेली मिश्रधातू असल्यास १०० मिश्रधातू अणूंमागे ८० + ४० = १२० संयुजा इलेक्ट्रॉन असतात म्हणजे संयुजा इलेक्ट्रॉनाचे संख्याबल
|
१२० |
= १·२ |
|
१०० |
असते.
विद्रावक धातू एक संयुजेची व विद्रुत धातू दोन संयुजेची असल्यास १·४ संख्याबलापर्यंत विद्राव्यता असते. विद्राव्य धातूची संयुजा २ किंवा ३ असल्यास विद्राव्यता कमी-कमी होते.
सर्व मिश्रधातू वरील चार नियमांमध्ये काटेकोरपणे बसतात असे नाही पण सर्वसामान्यपणे हे नियम वास्तवाशी जुळतात म्हणून त्यांस ठोकताळे असे म्हटले आहे.
आंतरकोशीय घन विद्राव : जेव्हा विद्रुत अणूंचे आकारमान विद्रावक अणूंपेक्षा खूपच लहान असते त्या वेळी विद्रुत अणू विद्रावकाच्या कोशातील नैसर्गिक पोकळ्यांत जाऊन बसतात व आंतरकोशीय घन विद्राव तयार होतो. कोशाच्या प्रकाराप्रमाणे त्यामधील पोकळ्यांचे आकारमान ठरलेले असते. उदा., फलककेंद्रित कोशामध्ये अणूच्या व्यासाच्या ०·४१% एवढी पोकळी असते, तर शरीरकेंद्रित कोशातील पोकळी ०·२९% एवढी असते [→ स्फटिकविज्ञान].
कार्बन, नायट्रोजन, बोरॉन, हायड्रोजन यांचे अणू लहान आकारमानाचे असल्याने ते लोखंड, निकेल, कोबाल्ट यांसारख्या धातूंमध्ये विरघळताना आंतरकोशीय विद्राव मिळतो. काही वेळा विद्रुत अणूचे आकारमान पुरेसे लहान नसल्यास ते विद्रावकाच्या पोकळीत बसताना कोशावर ताण निर्माण करतात. अशा ताणनिर्मितीमध्येच पोलादाच्या उष्णता संस्करणाचे तत्त्व आहे. [→ पोलाद].
मध्यस्थ प्रावस्था : समतोलावस्था आकृतीच्या मधील भागात या प्रावस्था असतात. या प्रावस्था म्हणजे धातूंची संयुगे असून त्या संयुजा संयुगे व इलेक्ट्रॉनीय संयुगे अशा दोन प्रकारच्या असतात.या दोन्हीही संयुगांना आंतरधातवीय संयुगे म्हणतात.
संयुजा संयुगे: ही संयुगे रासायनिक संयुगांप्रमाणे घटक धातूंच्या संयुजेवर आधारित असतात. त्यांची कोशीय संरचनाही सोडियम क्लोराइड, कॅल्शियम फ्ल्युओराइड यांसारख्या रासायनिक संयुगांप्रमाणे असते. यातील आंतरआणवीय बंध सहसंयुजी (ज्यात प्रत्येक अणूने एक इलेक्ट्रॉन देऊन इलेक्ट्रॉनांची जोडी तयार झाल्याने बनलेल्या) किंवा आयनीय (एका अणूतील एक वा अधिक इलेक्ट्रॉन दुसऱ्या अणूत संपूर्णपणे स्थानांतरित झाल्याने बनलेल्या) प्रकारचा असतो. AuNi, AuZn ह्या प्रकारच्या संयुगांची रचना NaCl प्रमाणे असते. काही संयुगांमधील आणवीय बंध थोडा आयनी व थोडा सहसंयुजी असा मिश्र प्रकारचा असतो (उदा., NiAs).घटक धातूंच्या आणवीय आकारमानांत खूप फरक असल्यास आंतरकोशीय संयुगे बनतात. उदा., कार्बन, नायट्रोजन ह्यांचे आणवीय आकारमान लोखंड, क्रोमियम या धातूंच्या आणवीय आकारमानापेक्षा लहान असल्याने CrN, VC यांसारखी संयुगे आंतरकोशीय घडणीची असतात. घटक धातूंच्या आणवीय व्यासांचे प्रमाण २०–३०% पर्यंत असल्यास प्रतिष्ठापित संयुगे निर्माण होतात. ह्या संयुगांचे रासायनिक सूत्र AB2 असे असते.उदा., MgCu2, TiCo2 वगैरे.
संयुजा संयुगे अत्यंत कठीण व ठिसूळ असतात. मिश्रधातूमध्ये ही संयुगे योग्य प्रमाणात व सर्वत्र सारखी विखुरलेल्या प्रावस्थेत असल्यास मिश्रधातूचे ताणबल वाढते परंतु प्रमाण वाढल्यास मिश्रधातू ठिसूळ बनते. आयनीय व सहसंयुजा बंधांमुळे ह्या संयुगांची विद्युत् व उष्णता संवाहकता फार कमी असते. अशा संयुगांमध्ये विशिष्ट अपद्रव्ये मिसळल्यास त्यांपासून प्रभावी अर्धसंवाहक तयार करता येतात.
इलेक्ट्रॉनीय संयुगे: ही संयुगे त्यांमधील अणू व उपलब्ध संयुजा इलेक्ट्रॉन ह्यांच्या प्रमाणावर अवलंबून असतात. त्यामुळे त्यांना एकच रासायनिक सूत्र नसते. म्हणजेच संयुग असूनही त्यामधील घटकांचे प्रमाण बदलू शकते. या संयुगांतील आंतरआणवीय बंध धातवीय प्रकारचा असतो. ही संयुगे बऱ्याच प्रमाणात घन विद्रावासारखी असल्याने त्यास मध्यस्थ घन विद्राव असेही म्हणतात. ह्या संयुगांमध्ये इलेक्ट्रॉन व अणू यांचे प्रमाण ३:२, २१:१३, ७:४ असे असते. उदा., ३:२ वर्गाची संयुगे ही β पितळाप्रमाणे असणारी संयुगे असून CuZn, Cu3Al अशा सूत्राची असतात व त्यांचा कोश शरीरकेंद्री असतो. २१:१३ वर्गाच्या संयुगांची रचना γ पितळाप्रमाणे चौकोनी कोशाची असते. Cu9Al4, Ni5Zn21 ही संयुगे ह्या वर्गात येतात. ७:४ वर्गातील संयुगे ε पितळाप्रमाणे असतात व त्यात Cu3Sn, CuZn3 अशी संयुगे असतात.
वरील सर्व संयुगे तांबे व जस्त ह्यांच्या मिश्रधातू वर्गात सापडतात [→ पितळ] म्हणून त्यांच्या वर्गीकरणास β,γ, εपितळ अशी नावे दिलेली आहेत.
इलेक्ट्रॉनीय संयुगेही ठिसूळ व कठीण असतात, परंतु त्यांतील धातवीय अणुबंधामुळे त्यांची विद्युत् व उष्णता संवाहकता चांगली असते.
क्रमित कोशीय विद्राव : सामान्यपणे घन विद्रावांच्या आणवीय संरचनेत घटक धातूंच्या जागांमध्ये क्रमवारता किंवा नियमितता नसते. अशा अनियमित संरचनेस अक्रमित विद्राव म्हणतात. घटक धातूंच्या स्वतःच्या अणूंमधील आकर्षण सारखे असल्यास अक्रमित रचना मिळते. जर घटक धातूंच्या अणूंमधील परस्पर आकर्षण जास्त असेल, तर क्रमित रचना मिळते [आ. २ (इ)]. क्रमित ⇄ अक्रमित हा बदल तापमान सापेक्ष असतो. अशा नियमित किंवा क्रमित आणवीय संरचना असलेल्या कोशास परम कोश म्हणतात. β पितळ, AuCu3, काही अगंज पोलादे यांमध्ये क्रमित-अक्रमित बदल दिसून येतो. क्रमित मिश्रधातू अक्रमित मिश्रधातूंपेक्षा जास्त बलवान असतात.
बहुघटकीय मिश्रधातू : दोनपेक्षा जास्त घटक असणाऱ्या मिश्रधातूंच्या घटनेविषयी नियम नाहीत. जर तीमधील दोन घटक प्रधान घटक असतील, तर त्यांच्या मिश्रधातूवर इतर घटक धातूंचा काय परिणाम होईल त्याबद्दल अनुमान करता येते [→ पोलाद]. उदा., तिसरा घटक घन विद्रावात सामील होईल किंवा एखाद्या मध्यस्थ प्रावस्थेमध्ये राहील किंवा तो स्वतःची निराळी प्रावस्था निर्माण करील याबद्दल अनुमान करता येते पण निश्चित घटना कशी असेल, हे नियमांच्या आधारे वर्तविता येत नाही.
मिश्रधातू बनविण्याच्या पद्धती: उत्पादनाच्या दृष्टीने मिश्रधातूंचे ‘स्थूल’ व ‘सूक्ष्म’ असे वर्गीकरण करावे लागेल, कारण दोन्हीच्या उत्पादन पद्धती भिन्न आहेत.
स्थूल मिश्रधातू : सामान्य वापरातील व घटकांचे लक्षणीय प्रमाण असलेल्या मिश्रधातू बनविण्याची प्रमुख पद्धत म्हणजे प्रमुख घटक धातू वितळवून तीत घटक धातू टाकणे (मिश्रण करणे) अशी आहे. घटक धातूंच्या वितळण्याच्या तापमानात जर खूप फरक असेल, तर जास्त तापमानाला वितळणारा घटक प्रथम वितळवून घेऊन त्यात इतर घटक टाकतात. उत्पादनाचा खर्च कमी करण्यासाठी तसेच घटक धातू असलेल्या मोडीच्या (भंगाराच्या) मिश्रधातूचा उपयोग करून फक्त कमी पडणारे घटक त्यात टाकतात. वितळलेल्या धातूच्या पृष्ठभागाचा व हवेचा संपर्क होऊन ऑक्सिडीकरण होण्याची (ऑक्सिजनाशी संयोग होण्याची) शक्यता असल्यास पृष्ठभागावर कोळशाची पूड किंवा इतर क्षपणकारक [→ क्षपण] पदार्थ अभिवाह (द्रवरूप धातूचा पातळपणा वाढविण्यासाठी व मलद्रव्ये धातुमळीच्या रूपात निघून जाण्यासाठी टाकण्यात येणारे पदार्थ) म्हणून वापरतात. घटक धातू सर्वत्र सारखी मिसळावी म्हणून वितळलेले मिश्रण ढवळतात. काही वेळा वितळलेल्या मिश्रणात बुडबुडे निर्माण करणारे रसायन टाकून त्यायोगे ढवळण्याची क्रिया करतात आणि बुडबुड्यांच्या बरोबर धातूने शोषलेली वायुरूप अपद्रव्येही बाहेर काढतात. मिश्रणामध्ये टाकताना त्यांचे सहज मिश्रण व्हावे म्हणून घटक धातू त्यांच्या प्रधान मिश्रकाच्या स्वरूपात टाकणे अधिक सोईचे असते. फेरोकॉपर, क्युप्रोमँगॅनीज, फॉस्फरकॉपर अशी विविध प्रधान मिश्रके यासाठी वापरतात. धातू वितळविण्यासाठी विजेवर किंवा तेलावर चालणाऱ्या भट्ट्या वापरतात [→ भट्टी]. काही किंमती मिश्रधातू बनविण्यासाठी खास निर्वात भट्ट्याही वापरतात. तयार झालेली मिश्रधातू साच्यात ओतून घेतात.
स्थूल मिश्रधातू बनविण्याच्या दुसऱ्या प्रमुख पद्धतीत घटक धातूंची चूर्णे योग्य प्रमाणात घेऊन ते मिश्रण साच्यात दाबतात. तयार झालेला कच्चा आकार तापवून त्याचे तापपिंडन (नियंत्रित वातावरण असलेल्या भट्टीत कमी अधिक काळ भाजण्याची क्रिया) करतात. या पद्धतीत धातू वितळविण्याची क्रिया होत नसल्याने कोणत्याही घटक प्रमाणाची किंवा वितळविण्यास कठीण अशी मिश्रधातूही बनविता येते, तसेच धातू व अधातू यांची मिश्रणेही बनविता येतात. [ → चूर्ण धातुविज्ञान].
बऱ्याच यंत्र भागांसाठी गाभ्यामध्ये एक व पृष्ठभागावर दुसऱ्या प्रकारचे घटक असलेली संमिश्र मिश्रधातू लागते. मूळ मिश्रधातू योग्य त्या तापमानास योग्य त्या माध्यमात ठेवल्यास माध्यमातील घटक धातूच्या पृष्ठभागात विसरण क्रियेने (औष्णिक क्षुब्धतेमुळे अणू परस्परांत मिसळण्याच्या क्रियेने) शिरतात व पृष्ठभागावर निराळी मिश्रधातू निर्माण होते. अशा क्रियेने पोलादाच्या पृष्ठभागावर कार्बन, नायट्रोजन, बोरॉन, ॲल्युमिनियम, सिलिकॉन यांसारखे घटक आणून मूळ पोलादाच्या पृष्ठकाठिण्यात व संक्षारण रोधकतेत (गंजण्यास वा इतर रासायनिक प्रक्रियांनी नाश पावण्यास प्रतिबंध करण्याच्या क्षमतेत) सुधारणा करता येते [→ पोलाद]. विसरणाने धातूत शिरलेले घटक पृष्ठाच्या १ मिमी. पेक्षा जास्त आत जात नाहीत.
अलीकडेच धातूच्या पृष्ठभागावर इतर घटक धातूंच्या आयनांचे (विद्युत् भारित अणूंचे) आरोपण करून विविध पृष्ठीय गुणधर्मांच्या मिश्रधातू मिळविण्यात आल्या आहेत. या पद्धतीत शिरकाव करावयाच्या घटकाचे आयन निर्माण करून ते अतिवेगाने धातूच्या पृष्ठभागावर फेकतात. पृष्ठभागावर वेगाने आपटल्याने आयन धातू पृष्ठावरील कोशांत जाऊन बसतात. अशा आयन प्रतिष्ठापनेमुळे कोशाच्या आंतरिक शक्तीमध्ये बदल होतात, तसेच आयनावरील विद्युत् भारामुळे पृष्ठभागावरील विद्युत् क्षेत्रातही बदल होतो. आयन आरोपणामुळे पृष्ठभागाचे काठिण्य, संक्षारण, विद्युत् संवहन वगैरे अनेक गुणधर्मांत आश्चर्यकारक फरक पडतात. आयन निर्माण करणे व त्यास वेग देणे यासाठी गुंतागुंतीची यंत्ररचना लागत असल्याने ही पद्धत अजून मोठ्या प्रमाणात वापरात आलेली नाही.
सूक्ष्म मिश्रधातू : सिलिकॉन व जर्मेनियम ह्या धातूंची विद्युत् संवाहकता त्यांमधील अपद्रव्यांचे नियंत्रण केले असता बदलता येते [→ अर्धसंवाहक]. अशा अपद्रव्यांचे धातूतील प्रमाण काही दशलक्ष भागांत एक ते चार इतके सूक्ष्म असते. यासाठी प्रथम सिलिकॉन व जर्मेनियमाची भागशः ऊर्ध्वपातनाने (निरनिराळे उकळबिंदू असलेल्या घटकांच्या मिश्रणातील घटक अलग करण्याच्या क्रियेने) परमशुद्धी करून घेतात. नंतर परमशुद्ध धातूमध्ये ॲल्युमिनियम, बोरॉन, फॉस्फरस यांसारखी योग्य ती अपद्रव्ये सूक्ष्म प्रमाणात मिसळून तयार झालेल्या मिश्रधातूचा मंद शीतनाने किंवा द्रवातून बीजारोपणाने मंद घनीभवन करून ओढून एक स्फटिकीय आकार मिळवितात व तो कापून त्यापासून ट्रँझिस्टरसारखी अर्धसंवाहक प्रयुक्ती बनवितात [→ ट्रँझिस्टर तंत्रविद्या]. ⇨ लेसर प्रकाश शलाका मिळविण्यासाठी गॅलियम-इंडियम-आर्सेनिक यांसारख्या धातूंची संयुगेही अशाच प्रकारे बनवितात. प्रथम घटक धातू परमशुद्ध अवस्थेत आणून त्या निर्वात स्थितीत एकत्र वितळवून संयुग बनवितात व नंतर त्यात योग्य ती अपद्रव्ये मिसळून त्याचा एक स्फटिक बनवितात. अर्धसंवाहक तपयुग्मासाठी (दोन निरनिराळ्या अर्धसंवाहकांच्या एकत्रित केलेल्या एकीकडील टोकांचे तापमान उच्च व दुसऱ्या एकत्रित टोकांचे तापमान कमी ठेवून विद्युत् प्रवाह मिळविणाऱ्या प्रयुक्तीसाठी) लागणारी अँटिमनी, टेल्यूरियम, बिस्मथ यांची संयुगेही ह्या पद्धतीने बनवितात.
मिश्रधातूंचे वर्गीकरण : उपयोगांची व घटकांची फारच विविधता असल्याने मिश्रधातूंच्या वर्गीकरणाच्या अनेक पद्धती आहेत.
सैद्धांतिक दृष्टीने स्थूल मिश्रधातू व सूक्ष्म मिश्रधातू असे आणि घटकांच्या दृष्टीने द्वि, त्रि किंवा बहुघटकीय असे वर्गीकरण होईल. सामान्य व अभियांत्रिकीय उपयोगातील मिश्रधातूंमध्ये घटकांचे प्रमाण ०·०१% पेक्षा जास्त असते म्हणून त्यांना स्थूल आणि इलेक्ट्रॉनिकीय क्षेत्रात वापरल्या जाणाऱ्या अर्धसंवाहक मिश्रधातूमध्ये घटकाचे प्रमाण १०−५ % एवढे कमी असल्याने तिला सूक्ष्म मिश्रधातू म्हणता येईल.
घटक धातूमध्ये प्रधान असलेल्या घटकावरून वर्गीकरण केल्यासही तांब्याच्या मिश्रधातू (पितळ, कासे), निकेलाच्या मिश्रधातू (मोनेल, इंकोनेल), लोखंडाच्या मिश्रधातू (मिश्र पोलादे) अशी निरनिराळ्या गटांत विभागणी करता येते. तसेच लोखंडाच्या सर्व मिश्रधातू ‘लोहीय’ व इतर सर्व मिश्रधातू ‘अलोहोय’असेही वर्गीकरण करतात.
गुणधर्म व उपयोग ह्या दृष्टीने केलेले वर्गीकरण व्यवहारात जास्त उपयोगी आहे. चुंबकीय मिश्रधातू, विद्युत् तापनाच्या मिश्रधातू, दाबसाचा पद्धतीने ओतकामासाठी वापरावयाच्या मिश्रधातू, किंमती धातूंच्या मिश्रधातू, संक्षारणरोधी मिश्रधातू, उच्च तापसह व उच्च बलसह मिश्रधातू, वैद्यकीय मिश्रधातू असे अनेक मिश्रधातू गट बनतात.
मिश्रधातूंचे बलसंवर्धन : नुसत्या मिश्रणाने सुद्धा मिश्रधातूचे बल मूळ धातूपेक्षा बहुतेक वेळी जास्त असते. त्याहीपेक्षा बलसंवर्धन करावयाचे असल्यास काही पद्धती आहेत.
घन विद्राव ही एकच प्रावस्था असलेल्या मिश्रधातूंच्या घटनेत तापमानाने विशेष फरक पडत नाही. उदा., ७०:३० पितळ, ६०:४० मोनेल वगैरे. अशा मिश्रधातूंचे बल तीवर शीतवरूपण क्रिया करून वाढवता येते. शीतविरूपणाने धातूच्या कोशात आंतरिक ताण व विस्थापने (स्थानभ्रंश) निर्माण होऊन ताणबल वाढते. मात्र ही वाढ काही विशिष्ट तापमानापर्यंतच टिकते. धातू ह्या तापमानापेक्षा जास्त तापल्यास पुन्हा मऊ होते.
काही मिश्रधातूंमध्ये विद्युत् धातूची घन विद्रावामधील विद्राव्यता उतरत्या तापमानाबरोबर कमी कमी होत जाते. उदा., ॲल्युमिनियम व तांबे यांची ड्युराल्युमिनासारखी मिश्रधातू. अशा मिश्रधातूंचे बलसंवर्धन विद्युत् धातूच्या नियंत्रित अवक्षपणाने करता येते [→धातूंचे अवक्षेपण कठिनीकरण].
पोलाद आणि काही प्रकारच्या कासे व इतर तांब्याच्या मिश्रधातूंमध्ये घन अवस्थेत घनक्रांतिक प्रावस्था बदल असतो. या घनक्रांतिक बदलाच्या आधारे विविध उष्णता संस्करणाच्या पद्धतींनी बलसंवर्धन करता येते [ → पोलाद धातूंचे उष्णता संस्करण].
उच्च तापमानास ताणाखाली असलेल्या धातूंचे विसर्पण [ → धातूंचे यांत्रिक गुणधर्म] होऊन ते ओघळतात. विसर्पण क्रिया धातूतील स्थानभ्रंशाच्या सरकण्यामुळे होते. मिश्रधातूमध्ये ॲल्युमिनासारखा कठीण घटक सूक्ष्म आकारमानात सारखा विखुरलेला असल्यास विसर्पण खूप कमी होते. सॅप (SAP) ही ॲल्युमिनियमाची मिश्रधातू या प्रकारची आहे.
उच्च तापमानास धातूंचा हवेशी म्हणजेच ऑक्सिजनाशी संपर्क आल्यास त्यांचे झपाट्याने ऑक्सिडीभवन होऊन ती निकामी होते. असे क्षरण रोखण्यासाठी धातूमध्ये ॲल्युमिनियम हा घटक कमी प्रमाणात (सु. २%) घालतात. उच्च तापमानास पृष्ठावरील ॲल्युमिनियमाचे ऑक्सिडीभवन होऊन ॲल्युमिनेचा सूक्ष्म थर निर्माण होतो व पुढील ऑक्सिडीभवन थांबते. कँथाल ह्या लोखंड आणि क्रोमियम यांच्या मिश्रधातूमध्ये २% ॲल्युमिनियम घातल्याने ही मिश्रधातू १,३५०° से. लाही टिकते.
काही मिश्रधातू द्रव स्थितीतून घन अवस्थेत येताना एकाच विवक्षित तापमानास त्यांचे घनीभवन होते आणि घन झालेल्या धातूत दोन प्रावस्था असतात. अशा विशिष्ट तापमान सापेक्ष घनीभवनास द्रवणक्रांतिकता म्हणतात. द्रवणक्रांतिक घटक प्रमाण असलेल्या मिश्रधातूंमध्ये एक प्रावस्था अत्यंत सूक्ष्म प्रमाणात विखुरलेल्या स्वरूपात असते. ही प्रावस्था दुसऱ्या प्रावस्थेपेक्षा कठीण असते. त्या मिश्रधातूच्या शीतनावर नियंत्रण करून विखुरलेली प्रावस्था सूक्ष्म धाग्यांच्या स्वरूपात आणल्यास संमिश्र किंवा संयुक्त मिश्रधातू मिळते. अशी संमिश्र व धाग्यांच्या स्वरूपात एक प्रावस्था असणारी मिश्रधातू खूप ताण घेऊ शकते. या दृष्टीने बलसंवर्धन करण्याचे प्रयत्न झाले, याच वेळी ग्रॅफाइट, कार्बन, ॲल्युमिना, काच यांसारख्या विविध पदार्थांचे धागे व इपॉक्सीसारखी प्लॅस्टिके उपलब्ध झाल्याने मिश्रधातूमधील अशा प्रकारच्या बलसंवर्धनाला फारसा प्रतिसाद मिळाला नाही.
काही विशिष्ट मिश्रधातू : मिश्रधातूंची संख्या व व्याप्ती फारच प्रचंड आहे. त्यामुळे सर्व मिश्रधातूंची माहिती येथे देणे शक्य नसल्याने काही विशेष उपयोगाच्या व महत्त्वाच्या मिश्रधातूंचीच माहिती येथे दिली आहे. कासे, गनमेटल, जर्मन सिल्व्हर, नायक्रोम, पारदमेल, पितळ, पोलाद, बॅबिट व मोनेल या मिश्रधातूंवर स्वतंत्र नोंदी असून तांबे, ॲल्युमिनियम वगैरे धातूंवरील नोंदींत त्या त्या मिश्रधातूंची माहिती दिली आहे.
गलनक्षम मिश्रधातू : (शीघ्र द्रवीभवन होणाऱ्या मिश्रधातू). अन्न शिजविण्यासाठी वापरण्यात येणारे वाफधारक दाबपात्र (प्रेशर कुकर) किंवा बाष्पजनक यासारख्या उपकरणांमध्ये बाष्पाचे तापमान विशिष्ट मर्यादेपलीकडे जाणे धोक्याचे असते. विशिष्ट तापमानास झटकन वितळून कोंडलेल्या वाफेस सुरक्षित रीतीने उपकरणाबाहेर जाण्यास वाट करून देण्यासाठी गलनक्षम किंवा शीघ्र द्रवीभवन होणाऱ्या मिश्रधातूची झडप वापरतात. विद्युत् मंडलामध्येही जास्त प्रवाहाने यंत्रणेला धोका पोहचू नये म्हणून अशा मिश्रधातूची ⇨ वितळतार वापरतात.
या मिश्रधातू बिस्मथ, शिसे, कथिल, कॅडमियम, जस्त अशा घटकांच्या बनविलेल्या असतात. घटकांच्या प्रमाणानुसार ५०° ते २५०° से. या दरम्यानच्या विवक्षित तापमानास वितळणाऱ्या मिश्रधातू उपलब्ध आहेत. उदा., ५०% बिस्मथ, २७% शिसे, १३% कथिल, १०% कॅडमियम हे घटक असलेली मिश्रधातू ५०° सें. तापमानास वितळते. ह्या मिश्रधातूस ‘वुड’ यांची मिश्रधातू असेही म्हणतात.
भट्टीत तापविण्यासाठी ठेवलेल्या वस्तूचे तापमान योग्य तितके झाले आहे की नाही हे कळण्यासाठी ह्याच प्रकारच्या शीघ्र द्रवीभवन होणाऱ्या पण उच्च तापमानास (५००° ते १,१००° से.) वितळणाऱ्या मिश्रधातू उपलब्ध आहेत. या मिश्रधातू खडूच्या स्वरूपात मिळतात. या खडूने खूण करून वस्तू भट्टीत ठेवतात. विशिष्ट तापमान आले की, खडूची खूण वितळलेली दिसते.
गलनीय मिश्रधातू बहुधा द्रवणक्रांतिक असल्याने त्या ठराविक तापमानास वितळतात.
स्मृतिक्षम मिश्रधातू : पोलादासारख्या काही मिश्रधातूंमध्ये घन क्रांतिक बदलाने मार्टेन्साइटासारखी असंतुलित प्रावस्था ऑस्टेनाइट या संतुलित प्रावस्थेपासून शीघ्र शीतनाने मिळवता येते [ → पोलाद]. ज्या वेळी मार्टेन्साइट निर्माण होऊन ऑस्टेनाइट वाढत जाते त्या वेळी ते मार्टेन्साइटभोवतालच्या प्रावस्थेत (ऑस्टेनाइटामध्ये) दाब निर्माण करते. हा दाब प्रथम स्थितिस्थापक (दाब काढून घेतल्यावर मूळ स्थिती पुन्हा प्राप्त होऊ देणारा) व स्थितिस्थापकतेची मर्यादा संपल्यावर आकार्य (कोणताही आकार घेऊ शकणारा) प्रकारचा असतो. स्थितिस्थापक अवस्थेमध्ये दोन्ही प्रावस्थांचे दाब संतुलन झाल्यास ती मिश्रधातू ऊष्मास्थितिस्थापक अवस्थेत आहे, असे म्हणतात. अशा प्रकारचे मार्टेन्साइटी बदल आणि ऊष्मास्थितिस्थापकता असणाऱ्या मिश्रधातूंना आकार बदलाची ‘स्मृती’ असते म्हणून त्यांना स्मृतिक्षम मिश्रधातू म्हणतात.
स्मृतिक्षम मिश्रधातू प्रथम उच्च तापमानास आणून तिला योग्य तो आकार देतात आणि नंतर शीघ्र शीतनाने तीमध्ये ऊष्मास्थितिस्थापकतेत असलेली मार्टेन्साइटी प्रावस्था निर्माण करतात. अशी प्रक्रिया केलेला यंत्रभाग वापरात असताना त्यामध्ये आकार बदल झाल्यास तो भाग जर पुन्हा घडविण्याच्या तापमानास तापवला, तर त्यास पुन्हा मूळ आकार प्राप्त होतो म्हणजेच त्या धातूला त्याच्या मूळ आकाराची तापमान सापेक्ष स्मृती असते.
५०% निकेल, ४९% टिटॅनियम, १% ॲल्युमिनियम अशा घटकांची ‘निटिनॉल’ नावाची मिश्रधातू ७३% तांबे, २१% जस्त, १% ॲल्युमिनियम या घटकांचे पितळ आणि १·४% कार्बनाचे पोलाद या स्मृतिक्षम मिश्रधातू आहेत.
⇨ तापनियंत्रक, अतिशीत तापमानास वापरावयाच्या नळ्यांचे सांधे, मणक्यातील विकृत झालेल्या हाडांच्या जागी बसविण्याचे कृत्रिम भाग यांसाठी स्मृतिक्षम मिश्रधातू उपयोगात आणले जात आहेत.
अतिसंवाहक (शून्य विद्युत् रोधी) मिश्रधातू : उतरत्या तापमानाबरोबर बहुतेक धातूंचा विद्युत् रोध कमी कमी होत जातो. काही मिश्रधातूंचा विद्युत् रोध विशिष्ट तापमानास पूर्णपणे नाहीसा होतो म्हणजे तिला अतिसंवाहकता प्राप्त होते. अशा अवस्थेत विद्युत् प्रवाह वाहून नेताना तीमध्ये उष्णता निर्माण होत नाही व म्हणून प्रवाह संवाहकतेच्या मर्यादा नष्ट होतात. निओबिय-कथिल, व्हॅनेडियम-कथिल ह्यांच्या मिश्रधातू ५°–१०° के. इतक्या कमी तापमानास असल्यास अतिसंवाहक बनतात. उच्च शक्तीची विद्युत् जनित्र, चलित्रे (मोटर्स), अत्युच्च चुंबकीय क्षेत्राची निर्मिती वगैरे उपयोगांसाठी अतिसंवाहक मिश्रधातू वापरल्या जातात. मात्र त्या सतत कमी तापमानासच ठेवाव्या लागत असल्याने त्या वापरून बनवलेली उपकरणे वापरताना अतिशीतनाची यंत्रणाही वापरावी लागते.
वैद्यकीय मिश्रधातू : मानवी शरीरातील रोग किंवा अपघाती बिघाड ह्यावरील उपाययोजनेसाठी पुरातन कालापासून मिश्रधातूंचा उपयोग होत आहे. मिश्रधातूंचा औषधी उपयोग सध्या प्रचलित नाही. दंतवैद्यक व अस्थिवैद्यकामध्ये मात्र मिश्रधातूंचा उपयोग वाढत आहे.
पितळ, जस्त, चांदी, पारा यांची भस्मे रसार्णव व इतर रसशास्त्र ग्रंथांत वर्णिली आहेत. ही भस्मे बनविण्याच्या पद्धतीही दिलेल्या आहेत. त्यावरून भस्मे ही सूक्ष्म मिश्रधातू आणि सेंद्रिय रसायने ह्यांची मिश्रणे असावीत, असा अंदाज करता येतो.
मोडलेल्या व सांधता न येणाऱ्या हाडांच्या जागेवर धातूंची कृत्रिम हाडे किंवा मूळ हाडाला आधार देण्यासाठी मिश्रधातूच्या दांड्या, पट्ट्या वगैरेंचा वापर अस्थिवैद्यकात होतो. अशा शरीरांतर्गत वापरावयाच्या मिश्रधातू शरीरातील विविध प्रकारांच्या द्रवांच्या संपर्कात येत असल्याने त्यांचे संक्षारण होण्याची फार शक्यता असते. संक्षारण न होणाऱ्या आणि स्नायूसारख्या अंतर्गत अवयवांशी सहज पृष्ठसाधर्म्य असणाऱ्या मिश्रधातूच अस्थिवैद्यकात वापराव्या लागतात. मुख्यतः ८% निकेल व ८% क्रोमियम यांचे अगंज पोलाद व टिटॅनियमाच्या काही मिश्रधातू हाडांच्या जागी वापरतात. मूळ हाडांना जशी वाढ किंवा झीज असते तशी अर्थात कृत्रिम हाडांना नसते.
दंतवैद्यकामध्ये मिश्रधातूंचा उपयोग अनेक वर्षे होत आहे. किडलेल्या दातातील पोकळ्या भरण्यासाठी चांदीच्या मिश्रधातूचा पारदमेल (पारा व अन्य धातू यांची मिश्रधातू) वापरतात. यामध्ये ५० ते ७०% चांदी, ४५ ते २५% कथिल, ०·५ ते २% तांबे व ०·१ ते १% जस्त असते. काही मिश्रधातूंत ०·५ ते १% सोनेही असते. या मिश्रधातूचे चूर्ण समभाग पाऱ्याबरोबर खलून त्याचा पारदमेल तयार करून दातात भरतात. फुटलेल्या दंताग्रावर पूर्वी सोन्याची टोपी बसवीत असत. सोने महाग झाल्यामुळे आता ८–१०% ॲल्युमिनियम व तांबे यांची सोन्याच्याच रंगाची मिश्रधातू वापरतात. नकली दात किंवा कवळ्या बनविण्यासाठी व्हायटालियम ही मिश्रधातू वापरतात. व्हायटालियमामध्ये २०–३०% कोबाल्ट, २०–३०% क्रोमियम, ३–८% मॉलिब्डेनम व ५–२०% निकेल असते. ही मिश्रधातू वितळविण्यास कठीण व महाग असते.
हृदय गतिकारक हे इलेक्ट्रॉनिक उपकरण शरीरामध्येच ठेवून त्याने हृदयाच्या ठोक्यांचे विद्युत स्पंदांद्वारे नियमन करतात. अशा शरीरांतर्गत आरोपण केलेल्या यंत्रणांना विद्युत् रासायनिक संक्षारणाचा धोका असल्याने त्यासाठी सोने, प्लॅटिनम यांच्या मिश्रधातू वापरतात.
तपयुग्म मिश्रधातू: दोन भिन्न धातूंच्या विद्युत् मंडलाला तपयुग्म म्हणतात [→ विद्युत्]. अशा मंडलाचे जोड भिन्न तापमानास असले, तर त्यामध्ये तापमानाच्या फरकाच्या प्रमाणात विद्युत् प्रवाह निर्माण होतो. याउलट जर बाहेरून विद्युत् प्रवाह मंडलात सोडल्यास एक जोड थंड व दुसरा गरम होतो. तापविद्युताच्या या दोन्हीही परिणामांवर आधारित विद्युत् उपकरणे बनवलेली असून त्यासाठी विद्युत् मंडलामध्ये वापरावयाच्या विशिष्ट मिश्रधातूंच्या जोड्या उपलब्ध आहेत.
उच्च तापमान मोजण्यासाठी वापरण्यात येणाऱ्या तपयुग्मात एक मिश्रधातू क्रोमेल (९०% निकेल, ९·५% क्रोमियम, ०·५% मँगॅनीज) आणि दुसरी मिश्रधातू ॲल्युमेल (२·५% मँगॅनीज, २% ॲल्युमिनियम, १% सिलिकॉन, शेष निकेल) अशा असतात. हे तपयुग्म १,२००° से. पर्यंतचे तापमान मोजू शकते. किंमती मिश्रधातूंची तपयुग्मेही उपलब्ध आहेत. यामध्ये प्लॅटिनम व प्लॅटिनम -१०% ऱ्होडियम आणि टंगस्टन व टंगस्टन-इरिडियम अशी तपयुग्मे असून ती १,५००° ते १,९००° से. पर्यंत वापरतात [→ तापमापन].
तापविद्युताचा सुरुवातीस दिलेला उलट परिणाम वापरून गेल्या काही वर्षांत अयांत्रिक शीतपेट्या तयार केल्या गेल्या आहेत. या शीतपट्यांमध्ये बिस्मथ टेल्युराइड (Bi2Te3), बिस्मथ सिलिनियम (Bi2Se3), इंडियम-आर्सेनाइड (InAs) यांसारखी आंतरधातवीय संयुगांची तपयुग्मे वापरतात. ही संयुगे मुळात विद्युत् संवाहक नसतात. त्यांमध्ये बोरॉन, फॉस्फरस यांसारखी अपद्रव्ये मिसळून त्यांत अर्धसंवाहकता आणतात. या तपयुग्माचा थंड जोड शीतपेटीत बसविलेला असतो. त्यातून विद्युत् प्रवाह सोडल्यावर शीत जोडाचे तापमान उतरून पेटी थंड होते. अर्थात पेटीबाहेर असलेला जोड तापतो. विद्युत् प्रवाहाची दिशा बदलल्यास शीतपेटीचे उष्णपेटीतही रूपांतर होते. अशा पेट्यांमध्ये यांत्रिक भाग नसल्याने त्या अत्यंत सुटसुटीत असतात व त्यांना देखभालीचा खर्च नसतो.
उच्च तापसह मिश्रधातू : भट्ट्या, बाष्पित्र (बॉयलर), झोत (जेट) व टरबाइन यंत्रे, क्षेपणास्त्रे, रॉकेट यांमधील काही यंत्रभाग उच्च तापमानास ठेवावे लागतात. उच्च तापमानास विसर्पण व संक्षारण या दोन्ही क्रियांनी धातूचे बल अत्यंत कमी होते. अशा परिस्थितीत टिकणाऱ्या अनेक मिश्रधातू आहेत.
निकेलावर आधारित असलेल्या मिश्रधातूंमध्ये इंकोनेल (६०%निकेल, २५% क्रोमियम, १५% कोबाल्ट, १% ॲल्युमिनियम), निमॉनिक (३४% निकेल, २०% क्रोमियम, १% मँगॅनीज, १०% मॉलिब्डेनम), हॅस्टॉलाय (४७% निकेल, २२% क्रोमियम, २०% लोखंड,१% मॉलिब्डेनम), युडिमेट (५२% निकेल, १९% क्रोमियम, ९% मॉलिब्डेनम, ३·५% टिटॅनियम, ४·५% ॲल्युमिनियम) हे प्रमुख गट आहेत. याचप्रमाणे कोबाल्ट, क्रोमियम, मॉलिब्डेनम, टंगस्टन यांवर आधारित असे बरेच उच्च तापसह मिश्रधातू गट आहेत. संक्षारण परिस्थितीत व विसर्पणामुळे कमी होणाऱ्या बलाचा अंदाज करून त्याप्रमाणे या मिश्रधातूंची निवड करावी लागते.
विद्युत् स्पर्शकाच्या मिश्रधातू : विद्युत् उपकरणांमध्ये जेथे उपकरणात जाणारा विद्युत् प्रवाह जोडला किंवा तोडला जातो त्या ठिकाणी स्पर्शक मिश्रधातू वापरतात. प्रवाह तोडला किंवा जोडला जाताना स्पर्शकांमध्ये स्फुल्लिंग (ठिणगी) पडते व स्पर्शकाच्या अग्राची झीज होते. अशा अग्रांसाठी चांदी, सोने, टंगस्टन, पॅलॅडियम ह्यांच्या मिश्रधातू वापरतात. या मिश्रधातूंची किंमत फार असल्याने संपूर्ण स्पर्शकासाठी त्या न वापरता फक्त अग्रासाठी त्यांचा वापर करतात. यांत चांदीच्या मिश्रधातू (७०–९०% चांदी, १०–२०% तांबे, ५–१०% प्लॅटिनम, पॅलॅडियम, सोने वगैरे), प्लॅटिनमाच्या मिश्रधातू (९०–९६% प्लॅटिनम,५–१०% इरिडियम, रूथेनियम, टंगस्टन वगैरे), पॅलॅडियमाच्या मिश्रधातू (४५–९५% पॅलॅडियम, ३०–४०% सोने किंवा चांदी, १०% रूथेनियम, तांबे वगैरे), सोन्याच्या मिश्रधातू (४०–९०% सोने, १०–२५% तांबे, २०–२५% चांदी, १–५% प्लॅटिनम) यांचा समावेश होतो.
वरील मिश्रधातूंव्यतिरिक्त चांदी व कॅडमियम ऑक्साइड, चांदी व टंगस्टन कार्बाइड, चांदी व ग्रॅफाइट अशा मिश्रधातूही उच्च विद्युत् प्रवाहाच्या मंडल खंडकामधील (मंडलातील विद्युत् प्रवाह एका ठराविक मूल्यापेक्षा जास्त झाल्यास मंडल आपोआप खंडित करणाऱ्या विद्युत् चुंबकीय प्रयुक्तीमधील) स्पर्शकांसाठी वापरतात.
तापनियंत्रकाच्या मिश्रधातू : भिन्न ऊष्मीय प्रसरणांक (१० से. तापमान वाढविल्यास एकक लांबीत होणारी वाढ) असलेल्या दोन मिश्रधातूंच्या पट्ट्या परस्परांना लांबीला समांतर अशा जोडून बनविलेली जोडपट्टी तापविल्यास ती उष्णतेने सरळ प्रसरण न पावता तापमानाच्या प्रमाणात वाकते. ह्या गुणधर्माचा उपयोग घरगुती वापराच्या उपकरणामध्ये तापनियंत्रणासाठी करतात. विद्युत् प्रवाहमापक किंवा दाबमापकासारख्या विद्युत् उपकरणांमध्ये निर्माण होणाऱ्या उष्णतेची भरपाई करण्यासाठीही या मिश्रधातू वापरतात. अशा द्विधातवीय पट्टीमध्ये एक धातू जास्त प्रसरणांकाची आणि एक कमी प्रसरणांकाची असते. उदा., ७५% लोखंड, २२% निकेल, ३% क्रोमियम यांची मिश्रधातू जास्त प्रसरणांकाची आणि ६४% लोखंड, ३६% निकेल ही मिश्रधातू कमी प्रसरणांकाची अशा वापरून बनविलेली पट्टी ३०° ते १५०° से. पर्यंतच्या तापनियंत्रणासाठी वापरतात. [→ तापनियंत्रक].
कमी प्रसरणांकाच्या मिश्रधातू : सर्व धातू वाढत्या तापमानाबरोबर प्रसरण पावत असल्याने मोजमाप करणाऱ्या उपकरणांत प्रसरणांमुळे मूलभूत चूक राहण्याची शक्यता असते आणि त्यामुळे त्या उपकरणांनी मोजलेली मापे तापमान सापेक्ष रहातात. अशा उपकरणांमध्ये विशिष्ट भागांसाठी तापमानाबरोबर अत्यंत कमी प्रसरण होणाऱ्या मिश्रधातू वापरतात. उदा., इनव्हार या मिश्रधातूमध्ये ३६% निकेल, ६३% लोखंड व अल्पप्रमाणात मँगॅनीज, सिलिकॉन वगैरे घटक असतात. निलव्हार ह्या मिश्रधातूत ३१% निकेल, ४% कोबाल्ट व ६३% लोखंड असते.
याच प्रकारच्या कमी प्रसरणांकाच्या मिश्रधातू काच व धातू यांच्या जोडामध्ये वापरतात. विजेचे दिवे, क्ष-किरण नलिका, इलेक्ट्रॉनीय नलिका (व्हॉल्व्ह) वगैंरेमध्ये त्या वापरतात. काचेशी सहज जोड होण्यासाठी धातूवर बोरॉन ऑक्साइडाचा थर चढवतात.
चुंबकीयमिश्रधातू: सर्व प्रकारच्या विद्युत् उपकरणांमध्ये स्थायी (टिकाऊ) किंवा अस्थायी चुंबकीय धातू लागतात. अस्थायी चुंबकासाठी सामान्यपणे १–३% सिलिकॉन असलेले पोलाद वापरतात. जास्त कंपनसंख्येसाठी किंवा अधिक प्रभावी चुंबकीय गुणधर्मासाठी म्यू मेटल (७७% निकेल, ७% तांबे, १·५% मॉलिब्डेनम व शेष लोखंड), परमिंडूर (५०% कोबाल्ट, ५०% लोखंड) यांसारख्या खास मिश्रधातू वापरतात [ → विद्युत् चुंबक पोलाद].
स्वस्त व सामान्य उपयोगाच्या स्थायी चुंबकासाठी १% जास्त कार्बन असलेले पोलाद वापरतात. प्रभावी चुंबकासाठी ॲलनिको (१०% ॲल्युमिनियम, १७% निकेल, १२·५% कोबाल्ट, ६% तांबे व शेष लोखंड), क्यूनिको (५% तांबे, २५% निकेल, ३०% कोबाल्ट व शेष लोखंड) अशा मिश्रधातू वापरतात. ॲलनिको, क्यूनिको यांसारख्या मिश्रधातू अत्यंत महाग असतात व त्या कठीण असल्याने त्यांचे कर्तन किंवा रूपण करता येत नाही.
अलीकडे लोखंड, बेरियम, टिटॅनियम ह्यांच्या ऑक्साइडांपासून बनविलेल्या ‘फेराइट’ नावाच्या चुंबकीय पदार्थाचा नवीन गट उपलब्ध झाला आहे [→ फेराइटे]. यामध्ये सिरियम, इट्रियम यांसारख्या विरल मृत्तिका धातूंची ऑक्साइडे थोड्या प्रमाणात घालून अत्यंत प्रभावी स्थायी व अस्थायी चुंबक मिळतात. मिश्रधातूंपेक्षा फेराइट चुंबक खूप स्वस्त असतात.
हलक्या वजनाच्या मिश्रधातू: मोटारी, विमाने, रॉकेटे यांसारख्या वाहतूक करणाऱ्या यंत्रणांची सामान अगर वजन वाहून नेण्याची शक्ती त्यांचे स्वतःचे वजन कमी असल्यास वाढते. यासाठी अशा यंत्रणांमध्ये हलक्या वजनाच्या पण पोलादाइतकीच ताकद असणाऱ्या मिश्रधातू वापरतात. या गटामध्ये ॲल्युमिनियम, मॅग्नेशियम व टिटॅनियम यांच्या मिश्रधातू आहेत.
ॲल्युमिनियमच्या प्रमुख मिश्रधातू ड्युराल्युमीन प्रकारच्या आहेत. यामध्ये ४–६% तांबे, ०·५–१% मँगॅनीज व मॅग्नेशियम, १% लोखंड, ०·५% क्रोमियम असे घटक असतात. ह्या मिश्रधातूंचे अवक्षेपण कठिनीकरण करता येते. १ ते ६% सिलिकॉन असलेल्या मिश्रधातू ओतकामासाठी वापरतात.
३–८% ॲल्युमिनियम, १–२% थोरियम व जस्त असलेल्या मॅग्नेशियमच्या मिश्रधातू सळई, पत्रा अशा घडीव आकारासाठी वापरतात. ६–१०% ॲल्युमिनियम, १% जस्त, १–२% बेरिलियम व थोरियम वगैरे अशा घटकांच्या मॅग्नेशियमच्या मिश्रधातू ओतकामासाठी वापरतात.
लढाऊ विमाने, रॉकेटे यांसाठी टिटॅनियमाच्या मिश्रधातू वापरतात, कारण त्यांना ५००°–६००° से. तापमानापर्यंतही भरपूर ताकद असते व त्या संक्षारणरोधीही असतात ३% ॲल्युमिनियम, ५% क्रोमियम ६% ॲल्युमिनियम, ४% व्हॅनेडियम २% लोखंड, २% क्रोमियम, २% मॉलिब्डेनम असे घटक टिटॅनियमाच्या मिश्रधातूंमध्ये असतात. टिटॅनियम ओतकामासाठी फारसे वापरत नाहीत.
झिर्कोनियमाच्या काही मिश्रधातू अणुभट्टीतील युरेनियमासारख्या आणवीय इंधनांच्या कवचासाठी वापरतात. झिर्कोनियमाच्या मिश्रधातूंमध्ये १–५% कथिल व ०·१५ ते ०·५ निकेल, लोखंड व क्रोमियम हे घटक असतात. निर्वात जागेतील शेष वायू शोषण्यासाठी आणि छायाचित्र काढावयाच्या वेळी वापरावयाच्या स्फुरदीपात (फ्लॅशमध्ये) झिर्कोनियमाच्या मिश्रधातू वापरतात.
विद्युत् रोधक मिश्रधातू: रोधक तापनाने [→ विद्युत् तापन] उष्णता निर्माण करण्याच्या टोस्टर, इस्त्री, गरम पेटी (ओव्हन) यांसारख्या घरगुती उपकरणांत आणि भट्ट्यांसारख्या औद्योगिक उपकरणांत उच्च तापमानाला ऑक्सिडीकरण न होणाऱ्या व पुरेसे ताणबल असणाऱ्या मिश्रधातू वापरतात. यांत निकेल-क्रोमियमच्या मिश्रधातूंमध्ये १५–२०% क्रोमियम, ३५ ते ८०% निकेल व शेष लोखंड हा एक ⇨ नायक्रोम नावाचा गट आहे. २०–४०% क्रोमियम, ५–७% ॲल्युमिनियम, १–२% कोबाल्ट, निकेल वगैरे व शेष लोखंड असा कँथाल नावाचा गट आहे या मिश्रधातू १,१००°–१,३५०° से. पर्यंत वापरता येतात.
तापमानाच्या बदलाप्रमाणे विद्युत् रोध न बदलणारे रोधक विद्युत् उपकरणामध्ये उपयोगी असतात. कॉन्स्टन्टन (४५% ते ६०% तांबे, ०·१% ते २% लोखंड, मँगॅनीज वगैरे व शेष निकेल) या मिश्रधातूचा विद्युत्रोध १५°–९०° से. पर्यंत स्थिर असतो.
संक्षारणरोधी मिश्रधातू : संक्षारणाची क्रिया संक्षारण माध्यम व तापमान यांवर मुख्यतः अवलंबून असते. त्यामुळे सर्व माध्यमांत व सर्व तापमानांना टिकणाऱ्या मिश्रधातू नाहीत. प्रत्येक वेळी परिस्थिती लक्षात घेऊन मिश्रधातूची निवड करावी लागते. अगंज पोलादे ही निरनिराळ्या प्रकारांची आहेत [ → पोलाद]. २०% क्रोमियम, २४% निकेल, ६% मॉलिब्डेनम हे घटक असलेले पोलाद समुद्री वातावरणाच्या संक्षारणास टिकू शकते. २०% क्रोमियम, ३३% निकेल, ४% तांबे असलेले पोलाद रासायनिक उपकरणांसाठी वापरतात. तांबे, कथिल व ॲल्युमिनियम यांची ॲल्युमिनियम कासे ही मिश्रधातूही मीठ व तत्सम पदार्थांच्यामुळे होणाऱ्या संक्षारणाला टिकते. टंगस्टन, मॉलिब्डेनम, टिटॅनियम कोलंबियम यांच्या मिश्रधातू उच्च तापामानासही अम्लांच्या संक्षारणास टिकतात. इंकोनेल (५४% निकेल, २२% क्रोमियम, १२% कोबाल्ट, ६% मॉलिब्डेनम), कॉनेल (६८% निकेल, ३०% तांबे, २% लोखंड) या निकेलावर आधारित असलेल्या मिश्रधातूही पाणी, रसायने व ४००° से. तापमान यांस टिकतात. योग्य विद्युत् विलेपनानेही मिश्रधातूंचे संक्षारण कमी करता येते. [→ धातूंचे मुलामे].
मौल्यवान मिश्रधातू: दागिने व इतर शोभेच्या वस्तू सोडून अभियांत्रिकी क्षेत्रातही सोने, चांदी, प्लॅटिनम यांच्या मिश्रधातू विद्युत् संवाहक, स्पर्शक वगैरेंमध्ये वापरतात. दागिन्यांचा रंग म्हणजे दिखाऊपणा कायम ठेऊन किंमत कमी करण्यासाठी सोन्यात तांबे किंवा चांदी मिसळतात. प्लॅटिनमच्या काही मिश्रधातू विशिष्ट भट्ट्यांसाठी रोधक तापक म्हणूनही वापरतात.
मिश्रधातू निगम : अणुऊर्जा, वीजनिर्मिती, अवकाशविज्ञान, इलेक्ट्रॉनिकी, तसेच रासायनिक उद्योग, अभियांत्रिकीय व उपकरणयोजना उद्योग इ. अत्याधुनिक क्षेत्रांमध्ये विविध धातू, जटिल व मोक्याच्या (राष्ट्राच्या संरक्षणाच्या दृष्टीने वा युद्धासाठी अथवा उद्योगधंद्यांसाठी अत्यावश्यक असलेल्या) मिश्रधातू वगैरेंची आवश्यकता असते. भारताला या धातू व मिश्रधातू पूर्वी आयातच कराव्या लागत. त्यामुळे त्या देशातल्या देशात बनविण्यासाठी सार्वजनिक क्षेत्रातील हा उपक्रम १९७३ मध्ये हैदराबाद येथे सुरू करण्यात आला. १९७९ मध्ये फेब्रुवारी महिन्यात येथील कार्य सुरू होऊन मार्चमध्ये टंगस्टन व मॉलिब्डेनम यांचे संयंत्र सुरू झाले. १९८० मध्ये या उपक्रमाचा दुसरा टप्पा सुरू झाला तेव्हा येथे १,०५० कर्मचारी (१८० पेक्षा अधिक अभियंते) होते. जुलै १९८३ मध्ये येथील व्यापारी उत्पादन सुरू झाले.
निर्वातात व खास वितळविण्याच्या सोयी, संगणकाच्या नियंत्रणाखाली झटपट काम करणारे घडवण दाबयंत्र, अत्यंत अचूक जाडीचे पत्रे व पट्ट्या बनविणारी शीत व उष्ण लाटण यंत्रे, मानवी केसापेक्षा बारीक तारा काढण्याची सोय वगैरे सुविधा येथे आहेत.
शिवाय निकेल व कोबाल्ट यांच्या, तसेच लोखंडाच्या उच्च बलाच्या मिश्रधातू, खास प्रकारची अगंज पोलादे, टिटॅनियम व तिच्या मिश्रधातू, चुंबकीय मिश्रधातू, विमान उद्योगातील महत्त्वाच्या टंगस्टन व मॉलिब्डेनम यांच्या मिश्रधातू इ. बनविण्याचे कार्य येथे चालू आहे.
पहा : कासे गन मेटल चूर्ण धातुविज्ञान जर्मन सिल्व्हर नायक्रोम पारदमेल पितळ पोलाद बॅबिट मिश्रधातू मोनेल धातु लोखंड व पोलाद उद्योग लोहमिश्रके.
संदर्भ : 1. Brick, R. M. and others, Structures and Properties of Alloys, New York, 1965.
2. Darken, L. S. Gurry, R. W. Physical Chemistry of Metals, Tokyo, 1953.
3. Hume-Rothery, W. Raynor. G. V. Electrons, Metals and Alloys, London. 1962.
4. Lyman, T. and Others, Ed., Metals Handbook Vol.1, Metals Park, 1976.
5. Perkins J., Ed., Shape Memory Effects in Alloys, New York, 1975.
6. Reed-Hill, R. E. Physical Metallurgy Principles, New York, 1973.
7. Samans, C. H. Engineering Metals and Their Alloys, New York, 1957.
8. Smith M. C. Alloy Series in Physical Metallurgy, Bombay, 1962.
9. Wolman, N. E. Metzier, R. J. Engineering Alloys, Metals Park, 1973.
देशमुख, य. वि. ठाकूर, अ. ना.
“