फेराइटे : ‘फेराइट’ ही संज्ञा निरनिराळ्या प्रकारे वापरण्यात येते. रासायनिक दृष्ट्या ती XOFe2O3 किंवा X2+Fe23+O4z- ( X = द्विसंयुजी धातूचा आयन द्विसंयुजी म्हणजे इतर अणूंशी संयोग पावण्याची क्षमता दर्शविणारा अंक २ असलेल्या आणि आयन म्हणजे विद्युत् भारित अणू, रेणू वा अणुगट) हे सामान्य सूत्र असलेल्या संयुगांकरिता म्हणजे फेरिक ऑक्साइड (Fe2O3)याबरोबर द्विसंयुजी धातूंच्या ऑक्साइडांचा संयोग होऊन बनलेल्या संयुगांकरिता वापरण्यात येते. मॅग्नेटाइट (Fe3O4 किंवा FeOFe2O3)हे नैसर्गिक फेराइट आहे. Mg, Mn, Co, Ni इत्यादी एकएकेट्या द्विसंयुजी धातूंचे आयन वा त्यांच्या मिश्रणाने बनलेले मिश्र आयन असलेली अनेक फेराइटे संश्लेषणाने (कृत्रिम रीतीने) आधुनिक काळात बनविण्यात आलेली आहेत. Fe23+ आयनाऐवजी Al3+ व Cr3+ असे त्रिसंयुजीआयन असलेली फेराइटेही आहेत. अनेक फेराइटांना खास चुंबकीय गुणधर्म असून विविध इलेक्ट्रॉनीय साधनांत, उदा., विशिष्ट प्रकारची रोहित्र (विद्युत् दाब बदलण्यासाठी वापरण्यात येणारी साधने), संगणकातील (गणकयंत्रातील) स्मरण घटक, ध्वनिमुद्रणातील आलेखक शीर्ष [⟶ ध्वनिमुद्रण आणि पुनरुत्पादन], सूक्ष्मतरंग प्रयुक्ती [⟶ सूक्ष्मतरंग], रेडिओ ग्राहीतील आकाशक (एरियल) इत्यादींमध्ये त्यांचा उपयोग करण्यात येतो. या दृष्टीने फेराइट ही संज्ञा लोह हा प्रमुख धातवीय घटक असलेल्या सर्व चुंबकीय ऑक्साइडांना लावण्यात येते. यानुसार स्पिनेल, पेरोव्हस्काइट व गार्नेट [⟶ गार्नेट गट] या खनिजांप्रमाणे तसेच षट्कोणी (उदा., मॅग्नेटोप्लंबाइट) स्फटिक संरचना असलेल्या चुंबकीय ऑक्साइडांचा फेराइटांत समावेश करण्यात येतो. उपयोगाच्या दृष्टीने स्पिनेल स्फटिक संरचना असलेली फेराइटे विशेष महत्त्वाची आहेत. इलेक्ट्रॉनीय उद्योगात प्रत्यक्षात फेराइट ही संज्ञा तांत्रिक दृष्ट्या उपयुक्त अशा कोणत्याही चुंबकीय ऑक्साइडाला लावण्यात येते आणि त्यात रासायनिक संघटन वा स्फटिक संरचना अभिप्रेत नसून केवळ त्याच्या गुणधर्मांच्या संदर्भात ती वापरण्यात येते.
फेराइटांना लोखंडाप्रमाणे सर्व लोहचुंबकीय गुणधर्म असतात पण त्यांचे प्रमाण कमी प्रतीचे असते. फेराइटाचे चुंबकीकरण केले असता त्यामध्ये संपृक्तता, मंदायन वक्र [⟶ चुंबकत्व] इ. परिणाम आढळून येतात. त्याचे तापमान क्यूरी तापमानापेक्षा (प्येअर क्यूरी या भौतिकीविज्ञांच्या नावाने ओळखण्यात येणाऱ्या व ज्या विशिष्ट तापमानाला पदार्थाच्या चुंबकीय गुणधर्मात बदल होतो त्या तापमानापेक्षा) जास्त केले असता, त्यामधील लोहचुंबकत्व नष्ट होते. लोखंडामध्ये जसे चुंबकीय दृष्ट्या मृदू व कठीण असे लोहचुंबकीय प्रकार असतात त्याचप्रमाणे फेराइटांमध्ये सुद्धा हे दोन प्रकार आढळतात. मृदू लोखंड अंतरक (विद्युत् प्रवाह वाहक तारेचे वेटोळे ज्यावर गुंडाळण्यात येते तो गाभा) म्हणून विद्युत् चुंबकात वापरले जाते. विद्युत् चुंबकाच्या भोवती असलेल्या वेटोळ्यामध्ये जोपर्यंत विद्युत् प्रवाह वाहत असतो, तोपर्यंतच लोखंडी अंतरक चुंबकत्व दाखवितो. वेटोळ्यामधील विद्युत् प्रवाह थांबविला असता, लोखंडाचे चुंबकत्व जवळजवळ नष्ट होते. याउलट कठीण लोखंडाच्या-पोलाद या प्रकाराच्या-अंतरकाचे चुंबकीकरण केल्यास ते लवकर नष्ट होत नाही, म्हणून त्यापासून चिरचुंबक (कायम चुंबक) बनविता येतो. फेराइटाच्या रासायनिक संघटनांत योग्य ते बदल करून या दोन प्रकारची फेराइटे तयार करता येतात. थेलीझ या ग्रीक शास्त्रज्ञांनी इ. स. पू. ६०० मध्ये मॅग्नेटाइट अथवा फेरस फेराइटामध्ये चुंबकीय गुणधर्म असल्याचा शोध लावला असला, तरी फेराइटांचा इलेक्ट्रॉनिकीमध्ये मोठ्या प्रमाणात उपयोग यानंतर अनेक शतकांनी म्हणजे १९३३-४५ या कालखंडात हॉलंडमध्ये जे. एल्. स्नोक आदि शास्त्रज्ञांनी या द्रव्यावर केलेल्या संशोधनानंतर होऊ लागला.
स्पिनेल फेराइटे : रासायनिक दृष्ट्या या प्रकारच्या एकेरी किंवा सरळ फेराइटाचे स्वरूप सूत्राने खालीलप्रमाणे दाखविता येते.
XOFe2O3 अथवा X2+Fe23+O42-
येथे X = द्विसंयुजी धातू आयन आहे. हा धातू आयन Mg, Mn, Fe, Co, Ni, Cu, Zn, Cd यांसारखा कोणताही असू शकेल किंवा तो यांपैकी कोणत्याही धातूचे मिश्रण करून झालेला मिश्र आयन असू शकेल. मिश्र आयनाचा अंतर्भाव केल्यामुळे तयार झालेल्या फेराइटास ‘मिश्र फेराइट’ असे म्हणतात. उदा.,
(१)(Ni0.42+ Zn0.62+) Fe23+O42-
(२)(Li0.5+ Fe0.5+) Fe23+O42-
यात Ni व Zn या चिन्हांच्या खाली दिलेले अंक त्यांच्या मिश्रणाचे प्रमाण दाखवितात. काही वेळेला Fe23+ आयनाच्या ऐवजी Al3+, Cr3+ असे त्रिसंयुजी आयन प्रस्थापित केले जातात. ही विक्रिया करण्याचे कारण पुढे स्पष्ट केले आहे.
स्पिनेल स्फटिकामध्ये ऑक्सिजन आयन घनीय आकृतिबंधात रचलेले असतात, तर यांमधील आंतरकोशीय (स्फटिक कोशातील अणूंच्या वा आयनांच्या नेहमीच्या स्थानांव्यतिरिक्त असलेल्या) जागा आकारमानाने लहान असे धातूचे आयन व्यापतात. स्पिनेल स्फटिकाच्या एका घटक कोशामध्ये ३२ ऑक्सिजन आयन असतात, तर धातू आयनाकरिता त्यामध्ये ८ चतुष्कफलकीय (A)स्थाने तर १६ अष्टफलकीय स्थाने (B) उपलब्ध असतात [⟶ स्फटिकविज्ञान]. A स्थानामधील X भोवती ४ ऑक्सिजन आयन असतात, तर B स्थानामधील X भोवती ६ ऑक्सिजन आयन असतात. स्फटिकात प्रवेशित झालेले धातू आयन X जर A स्थानावर असतील, तर स्फटिक संरचना प्रसामान्य आहे असे म्हणतात. याउलट जर X आयन B स्थाने व्यापत असतील, तर स्फटिक संरचना व्यस्त स्वरूपाची आहे असे म्हणतात. B स्थानांवर असणारे आयन जर चौरस कंसाच्या आत लिहून निर्देशित केले, तर X2+ [Fe23+] O42- हे सूत्र प्रसामान्य स्फटिक संरचना, तर Fe3+ [X2+ Fe3+] O42- व्यस्त संरचना दाखविते. Zn यासारखे काही आयन A स्थाने पटकावितात, तर इतर बहुतेक सर्व आयन B स्थाने पसंत करतात. फेराइटामध्ये अशा तऱ्हेने धातू आयनाकरिता एकापेक्षा जास्त प्रकारची स्थाने उपलब्ध असतात (A किंवा B) किंवा त्यामध्ये एकापेक्षा जास्त तऱ्हेचे आयन प्रकार उपलब्ध असतात (उदा., Fe23+, X2+)किंवा काही प्रकारांमध्ये या दोन्हीही गोष्टी एकाच वेळी उपस्थित असतात.
X2+ हे फक्त द्विसंयुजी आहे, तर Fe हे दोन्ही द्विसंयुजी व त्रिसंयुजी आहे. या गोष्टीचाच विचार केला, तर X2+ आयनानी A स्थाने अधिमान्यतेने व्यापावी तर Fe3+ आयन हे B स्थानावर रहावेत, असे सकृत्दर्शनी वाटेल पण प्रत्यक्षात व्यस्त संरचनेच्या फेराइटांमध्ये पदार्थामधील निम्मे Fe3+ आयन A स्थानावर आढळतात, तर उरलेले Fe3+ आयन व सगळे X2+ आयन स्फटिकातील B स्थानेच अडवून बसले आहेत असे दिसते. A व B स्थानपरत्वे वितरण निश्चित करण्याकरिता संयुजांशिवाय (१) धातू आयनाचा व्यास, (२) स्फटिक जालकाची विद्युत् स्थैतिक ऊर्जा, (३) आयनाभोवतालच्या इलेक्ट्रॉनीय विन्यासाचा (कक्षांतील इलेक्ट्रॉनांच्या मांडणीचा) त्याच्या पलीकडे असणाऱ्या ऑक्सिजन आयन विन्यासाबरोबर असलेला सुजोड इ. गोष्टीसुद्धा विचारात घेणे आवश्यक ठरते असे दिसते.
फेराइटाच्या अंगभूत चुंबकत्वाचे सूक्ष्म मानीय स्तरावर विशदीकरण एल्. नील यांनी दिले. फेराइटामध्ये आढळणाऱ्या चुंबकत्वाला ‘फेरिमॅग्नेटिझम’ (लोहीचुंबकत्व) हे नाव त्यांनीच प्रथम १९४८ मध्ये दिले. नील यांच्या विशदीकरणातील कल्पना काही प्रमाणात अंगभूत लोहचुंबकत्वाची मीमांसा करण्याकरिता वापरण्यात आलेल्या कल्पनांसारख्या आहेत. लोहचुंबकत्व मीमांसेप्रमाणे या प्रकारच्या पदार्थातील घटक अणूंना चुंबकीय परिबल [⟶ चुंबकत्व] असते व ते मुख्यत्वेकरून इलेक्ट्रॉन परिवलनामुळे [⟶ अणुकेंद्रीय व आणवीय परिबले] निर्माण होते. निकटवर्ती अणूंमध्ये एक विनिमय प्रकारची परस्परक्रिया होऊन एका ठराविक लघुक्षेत्रात असलेल्या सर्व अणूंची इलेक्ट्रॉन परिवलने एकमेकांशी समांतर केली जातात. यामुळे संपूर्ण लघुक्षेत्राला प्रभावी चुंबकीय परिबल प्राप्त होते [⟶ चुंबकत्व]. फेराइटामधील घटक अणूंना सुद्धा चुंबकीय परिबले असतात व ती इलेक्ट्रॉन परिवलनामुळेच निर्माण होतात. स्फटिकातील A आणि B या स्थानांवर असणाऱ्या आयनांमध्ये एक मात्र निराळ्याच प्रकारची विनिमय परस्परक्रिया होऊन परिणामी त्यांची इलेक्ट्रॉन परिवलने (समांतराऐवजी) प्रतिसमांतर (समांतर परंतु विरूद्ध दिशेतील) केली जातात. या क्रियेमध्ये सभोवताली असलेले ऑक्सिजन अणू एक महत्त्वाचा भाग उचलतात. व्यस्त स्पिनेल फेराइट स्फटिकाच्या A व B स्थानांवरील आयनांच्या इलेक्ट्रॉन परिवलनांची मांडणी आ. १ मध्ये दाखविली आहे. A व B स्थानांवर असणाऱ्या Fe3+ आयनांची संख्या

सारखी असल्यामुळे त्यामुळे मिळणारी चुंबकीय परिबले एकमेकांस छेद देतात. B स्थानांवर असलेल्या X2+ आयनांमुळेच पदार्थाला चुंबकत्व प्राप्त होते, असा याचा अर्थ होतो.
Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+ या धातूंच्या आयनांची चुंबकीय परिबले अनुक्रमे ५, ४, ३, २, १, ० MB (MB = बोर मॅग्नेटॉन नील्स बोर या भौतिकीविज्ञांच्या नावाने ओळखण्यात येणारे चुंबकीय परिबलाचे एकक) एवढी असतात. हे आयन असणाऱ्या एकेरी स्पिनेल फेराइटांचे अंगभूत चुंबकत्व याच प्रमाणात असावे, असा निष्कर्ष वरील मीमांसेप्रमाणे मिळतो. हा निष्कर्ष बरोबर आहे हे प्रयोगाने दाखविता येते. Fe3+ व X2+ आयनांचे स्फटिकात प्रत्यक्षात असणारे A व B स्थानांवरील वितरण न्यूट्रॉन विवर्तन वापरून [⟶ रेणवीय भौतिकी] प्रयोगाने काढता येते. अशा प्रकारचे प्रयोग नील यांच्या मीमांसेला पुष्टी देतात.
नील मीमांसेप्रमाणे Mn फेराइटाचे चुंबकीय परिबल ५ MB पेक्षा जास्त असू शकणार नाही असे दिसते. फेराइटामध्ये जर ZnFe2O4 हे फेराइट मिसळले, तर मात्र अंगभूत चुंबकत्वाचे प्रमाण वाढविता येते. कारण ZnFe2O4 हे प्रसामान्य फेराइट आहे. यामधील Zn आयन स्फटिकातील A स्थाने व्यापतात व Zn आयनाचे चुंबकीय परिबल शून्य आहे. या कारणाकरिता या दोन प्रकारच्या फेराइटांचे मिश्रण केल्यास A स्थानावर असलेल्या काही Fe23+ आयनांची जागा Zn आयन घेतात. यामुळे पदार्थाच्या एकंदर अंगभूत चुंबकत्वात वाढ होते. याउलट फेराइटामध्ये Al3+ सारखा अचुंबकीय आयन घातला, तर तो B स्थान अधिमान्यतेने पसंत करीत असल्यामुळे या स्थानावरील काही Fe3+ आयनांची जागा हे आयन घेतात. या क्रियेमुळे एकंदर पदार्थाच्या चुंबकत्वाचे मूल्य कमी होते. वरील दोन प्रक्रियांत होणाऱ्या फरकाचे विशदीकरण खालील सूत्राने करता येते.
| ( | Zna2+ | Fe1-a3+ | ) | [ | X1-a2+ | Fe1+a3+ | ] | O42- |
या सूत्रात A स्थानावर Fe3+ आयनांच्या ऐवजी Zn आयन घातले आहेत, तर B स्थानावरील काही Fe3+ आयनांच्या ऐवजी X2+ आयन घातले आहेत, असे गृहीत धरले आहे. X2+ आयनाचे चुंबकीय परिबल mMB, लोह-आयनाचे परिबल ५MB व Zn2+ आयनाने शून्य असे धरले, तर मिश्र फेराइटाचे चुंबकीय परिबल
{10 (a) + m (1-a) } MB
एवढे होते, असे दाखविता येते. येथे m < ५ स्थानांवरील Zn2+ चे प्रमाण (a) वाढविले असता परिबलात होणारी वाढ व X2+ च्या ऐवजी Al3+ सारखे अचुंबकीय आयन (m = ०) घातल्यास त्यामुळे परिबलात होणारी घट या दोन्ही गोष्टींचा खुलासा होतो. Al3+ आयन फेराइटामध्ये घातल्यामुळे त्याच्या विद्युत् रोधकतेत फार मोठ्या प्रमाणात वाढ होते. वरील निष्कर्ष बरोबर आहेत, हे प्रयोगाने दाखविता येते. हे निष्कर्ष नील मीमांसेपासून निघतात. त्यामुळे वरील प्रयोग नील मीमासेला पुष्टी देतात. फेराइटामध्ये Zn आयनांचे प्रमाण वाढविले असता त्याच्या क्यूरी तापमानात घट होते असेही आढळते.
फेराइटाच्या अंगभूत चुंबकत्वाचे (जे त्यामध्ये मिळणाऱ्या चुंबकत्वाचे महत्तम मूल्य दाखविते) गणन करण्याकरिता वर वर्णन केलेली रीत खरे पाहिले असता पदार्थाचे तापमान निरपेक्ष शून्य बिंदूवर (-२७३०·१५ से.) असेल तेव्हाच यथार्थ ठरेल. पदार्थाचे तापमान वाढविले असता आयनाच्या इतस्ततः ऊष्मीय गतिज ऊर्जेत वाढ होते. आयनांमध्ये कार्य करणाऱ्या परस्पर क्रियेमुळे जी त्यांची नियमित मांडणी होते तिला त्यांच्या ऊष्मीय गतीमुळे नेहमीच अडथळा होतो. याचा परिणाम असा होतो की, तापमानात वाढ झाली असता पदार्थाच्या अंगभूत चुंबकत्वामध्ये घट होत जाते आणि तापमान क्यूरी बिंदूपर्यंत वाढविले, तर हे चुंबकत्व जवळजवळ संपूर्णपणे नष्ट होते. बहुतेक सर्व फेराइटांकरिता क्यूरी तापमान बिंदू १०००-६००० से. या कक्षेत मिळतो.
लोहचुंबकीय धातूशी तुलना करता फेराइटांची विद्युत् रोधकता उच्च प्रतीची (≈ १०-१०१० ओहम-सेंमी.) म्हणजे त्याच्या १०६-१०१५ पटींंनी जास्त असते. फेराइटांच्या पार्यतेचे [⟶ चुंबकत्व] मूल्य (१००-५,०००) खूप मोठे असून μQ (येथे μ ही पार्यता असून Q हा Q-गुणांक-साठणारी ऊर्जा व नष्ट होणारी ऊर्जा यांचे गुणोत्तर-आहे) याचे मूल्य फारच उच्च प्रतीचे असते. या सर्व गुणधर्मांमुळे फेराइटांचा उपयोग इलेक्ट्रॉनिकीमध्ये निरनिराळ्या मंडलांत मोठ्या प्रमाणात होतो. याचे वर्णन पुढे केलेले आहे.
फेराइटे हे मृदीय (उच्च तापमानाला अधातवीय खनिजे भाजून तयार करण्यात येणाऱ्या विटा, कौले यांसारख्या पदार्थांच्या) स्वरूपाचे पदार्थ आहेत. त्यामुळे त्यांचे बरेचसे भौतिकीय गुणधर्म व ते तयार करण्याकरिता वापरात असलेल्या पद्धती मृदीय पदार्थाकरिता वापरात असणाऱ्या पद्धतींसारख्याच आहेत.
तयार करण्याच्या मुख्य पद्धती : (१) ऑक्साइडांचे तापपिंडन : (उष्णतेच्या साहाय्याने एकसंधीकरण). या पद्धतीत इष्ट ऑक्साइडे योग्य प्रमाणात घेऊन सद्रव मिश्रण व गोलिका-दळण [लोखंडी चेंडूच्या साहाय्याने पदार्थाचे सूक्ष्म चूर्ण तयार करणे⟶ आकारमान-लघुकरण] या रीतीने त्यांचे अत्यंत बारीक चूर्ण केले जाते. त्यानंतर त्यामध्ये आवश्यक तेथे काही कार्बनी संयुगे बंधकद्रव्ये म्हणून मिसळतात व दाब देऊन जरूर तो आकार आणतात. नंतर या नमुन्यांना उच्च तापमानापर्यंत (≈ १,०००० से.) तापवितात. त्यामुळे त्यांचे तापपिंडन होते. त्यानंतर त्यांचे शीतन करतात. तापपिंडनासाठी वापरलेले तापमान व नंतर केलेले शीतन यांचे नियंत्रण करावे लागते. कारण या दोन गोष्टींवर उत्पादित फेराइटाचे विद्युत् चुंबकीय गुणधर्म मोठ्या प्रमाणात अवलंबून असतात, असे दिसून आले आहे.
या पद्धतीमध्ये मुख्यतः पुढील दोष आहेत : (१) तापपिंडनाकरिता लागणारे तापमान फार उच्च असल्यामुळे त्याकरिता व्यवहार्य योजना करणे अवघड पडते, (२) उत्पादनासाठी बराच कालावधी लागतो. व (३) फेराइट नमुन्यात अपद्रव्याचा शिरकाव होण्याची शक्यता असते.
(२) ऊष्मीय अपघटन : (उष्णतेने रेणूचे तुकडे पाडण्याची क्रिया). ही पद्धत मॅग्नेशियम फेराइटासारखी फेराइटे तयार करण्यासाठी उपयोगी पडते. मॅग्नेशियम कार्बोनेट हे सहज उपलब्ध असणारे संयुग आणि फेरिक ऑक्साइड योग्य प्रमाणात मिसळून व एकत्र दळून त्याची बारीक पूड करतात आणि ते मिश्रण ५०००-६००० से. तापमानापर्यंत तापवितात. मॅग्नेशियम कार्बोनेटाचे अपघटन होऊन मॅग्नेशियम ऑक्साइड व कार्बन डाय-ऑक्साइड वायू निर्माण होतात. फेरिक ऑक्साइड तसेच राहते. या विक्रियेत बाहेर पडणाऱ्या कार्बन डाय-ऑक्साइड वायूमुळे Fe2O3 व MgO यांचे मिश्रण चांगले होते. नंतर हे मिश्रण
Fe2O3 + MgCO3 = Fe2O3 + MgO + Co2
फेरिक मॅग्नेशियम फेरिक मॅग्नेशियम कार्बन
ऑक्साइड कार्बोनेट ऑक्साइड ऑक्साइड डाय-ऑक्साइड
थंड करून व दळून ते तापपिंडनासाठी ४००० से. तापमानापर्यंत तापविले म्हणजे मॅग्नेशियम फेराइट मिळते.
(३) अवक्षेपण पद्धत : (न विरघळणाऱ्या साक्याच्या रूपात पदार्थ मिळविणे). फेराइट तयार करण्याच्या कोणत्याही पद्धतीत घटक ऑक्साइडांचे अत्यंत सूक्ष्म कण बनविणे आणि त्यांचे एकजीव मिश्रण करणे आवश्यक असते. हे दोन्ही हेतू सह-अवक्षेपण पद्धतीने साध्य होतात. या पद्धतीत प्रथम त्या त्या धातूची नायट्रेटे किंवा सल्फेटे यांचे विद्राव एकत्र करतात आणि योग्य विक्रियाकारकाने धातूंची हायड्रॉक्साइडे किंवा कार्बोनेटे एकत्र अवक्षेपित करतात. मिळालेला अवक्षेप गाळून, धुवून व सुकवून गोलिका-दळण पद्धतीने त्याचे चूर्ण करतात व उच्च तापमान वापरून त्याचे तापपिंडन करतात. या पद्धतीत तापपिंडनाकरिता कमी तापमान चालते.
तयार केलेले फेराइट बहुस्फटिकी स्वरूपाचे असून त्यामध्ये काही प्रमाणात हवेमुळे पडलेली छिद्रे असतात. फेराइटाचे विद्युत् चुंबकीय गुणधर्म त्यामधील सच्छिद्रता व त्यातील कणांचे आकारमान या दोन्ही गोष्टींवर अवलंबून असतात. तयार केलेल्या नमुन्याची सच्छिद्रता तापपिंडनाकरिता वापरलेल्या उच्च तापमानाचे मूल्य व एकंदर तापन काल यांमुळे निश्चित होते. उदा., Ni-Zi हे मिश्र फेराइट १,३००० से. तापमानाला ऑक्सिजनामध्ये तापवून ते हळूहळू थंड होऊ दिले, तर त्याची रोधकता ५·४ X १०५ ओहम-सेंमी. एवढी असते, तर तेच फेराइट हवेमध्ये १,३००० से. तापमानाला नेऊन जर एकदम थंड केले, तर त्याची रोधकता फक्त १·१ X १०३ ओहम-सेंमी. एवढी होते. फेराइट जर एकदम थंड केले, तर त्यामध्ये आंतरिक ताण निर्माण होण्याचा संभव असतो. या ताणामुळे त्याचा मंदायन वक्र व सूक्ष्म तरंग कंप्रतांना (१-१०० गिगॅहर्ट्झ कंप्रतांना कंप्रता म्हणजे एका सेकंदात होणारी कंपनांची संख्या) असणारे गुणधर्म यांवर परिणाम होतो असे आढळते. आंतरिक ताण टाळण्याकरिता फेराइट हळूहळू थंड करणे श्रेयस्कर असते. सी. ग्वीलो यांनी असे दाखविले आहे की, जर फेराइटामधील कणांचे आकारमान ५ मायक्रॉनपासून २० मायक्रॉनपर्यंत (१ मायक्रॉन = १०-६ मी.) वाढविले, तर त्याची प्रारंभिक पार्यता ५०० पासून ४,००० पर्यंत वाढते. [पदार्थाच्या विचुंबकीय अवस्थेमध्ये अथवा त्यावर अल्प परमप्रसराचे (मध्यम स्थितीपासून लंब दिशेने होणाऱ्या कमाल स्थानांतरणाचे) प्रत्यावर्ती (उलटसुलट दिशा होणारे) चुंबकीय क्षेत्र लावले असता पदार्थाच्या पार्यतेचे जे मूल्य असते त्याला प्रारंभिक पार्यता म्हणतात]. वरील उदाहरणावरून हे लक्षात येईल की, जे गुणधर्म फेराइटामध्ये अपेक्षित असतील, त्याप्रमाणे त्याचे संघटन, तापपिंडनाचे तापमान, त्यातील कणांचे आकारमान, तापनाचा कालावधी व ते थंड होऊ देण्याकरिता वापरलेली रीत या सर्वात इष्ट असा बदल करावा लागतो.
योग्य ते गुणधर्म मिळविण्याकरिता फेरिक ऑक्साइडामध्ये एकाच द्विसंयुजी धातूचा आयन न घालता एकाच वेळी दोन धातूंचे आयन मिश्र रूपात घातले जातात.
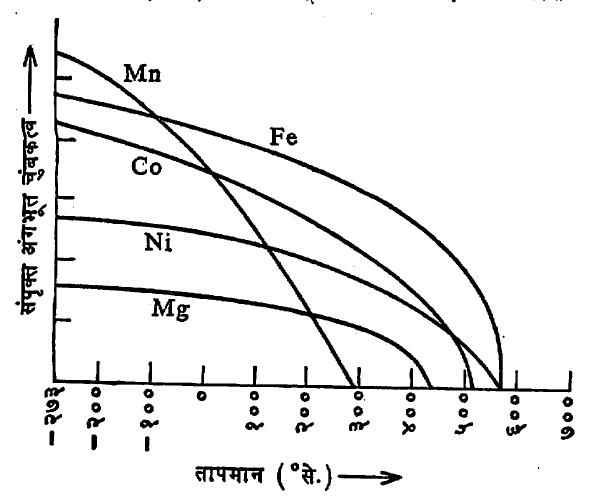
कोष्टक क्र. १ मध्ये काही एकेरी स्पिनेल फेराइटांचे प्रकार व त्यांचे गुणधर्म दिलेले आहेत. या कोष्टकात पदार्थ संपृक्त केले असता त्यांच्या अंगभूत चुंबकत्वाची मिळणारी मूल्ये दिली आहेत. संपृक्त अवस्थेत चुंबकत्व महत्तम होते.
कोष्टक क्र. १. एकेरी स्पिनेल फेराइटांचे प्रकार व त्यांचे गुणधर्म
| फेराइट | अंगभूत चुंबकत्व
(बोर मॅग्नेटॉन) |
क्यूरी तापमान
० से. |
प्रारंभिक पार्यता
μa |
|
| सैद्धांतिक | प्रायोगिक | |||
| MnFe2O4
NiFe2O4 MgFe2O4 ZnFe2O4 CoFe2O4 |
५
२ ० ० ३ |
४·६
२·३ १·१ ० ३·३ |
३००
५८५ ४४० — ५२० |
२५०
१० १० — > १ |
तापमान वाढविले असता अंगभूत चुंबकत्वात घट होत जाऊन क्यूरी तापमानाला चुंबकत्व नष्ट होते हे आ. २ मधील वक्रावरून दिसते.
मिश्र फेराइटे : इलेक्ट्रॉनिकीमध्ये विशेष उपयुक्त ठरलेल्या मिश्र फेराइटांचे प्रकार व गुणधर्म ( कोठी – सर्वसाधारण – तापमानाकरिता) कोष्टक क्र. २ मध्ये दाखविले आहेत. या फेराइटांचा मृदू फेराइटे म्हणून उपयोग केला जातो.
कोष्टक क्र. २ काही मिश्र फेराइटांचे प्रकार व गुणधर्म
| फेराइट | संपृक्त प्रवर्तन | प्रारंभिक पार्यता (μa) | tan δm | क्यूरी तापमान ०से. |
| १६NiO + १७ZnO
९NiO + १८ZnO + १MgO १२ZnO+१७ MnO aMg + aMn |
३,१००
३,२४० ३,६०० — |
३३०
४३० ७७० — |
०·०००९
०·०००७ ०·००१६ — |
२६०
१७० — १३० |
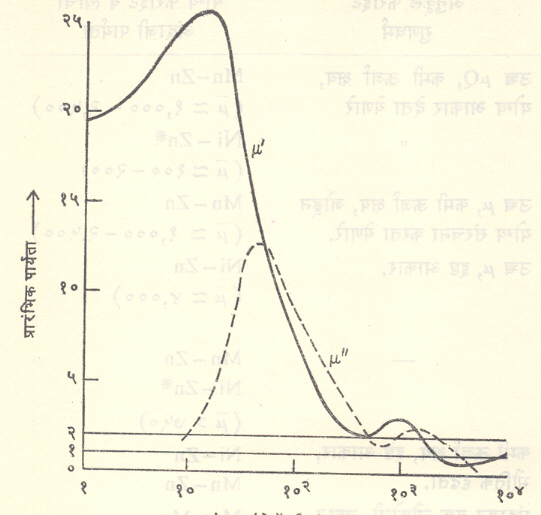
वरील कोष्टकात tan δm = 1/ Q असून Q हा Q- गुणाक आहे. सामान्यपणे Mg, Mn, Zn या धातू असणाऱ्या फेराइटांची रोधकताउच्च प्रतीची असते असे आढळते. प्रारंभिक पार्यतेत तापमानानुसार विशेष बदल होतो. क्यूरी तापमान बिंदूच्या जवळपास तिच्या मूल्यात एकदम फार मोठी वाढ होते.
आ. ३ मध्ये ZnaFe1-a [Ni1-aFe1+a] O4 या फेराइटाच्या प्रारंभिक पार्यतेमध्ये (μa) होणारा बदल a = ०·७० व ०·५० या दोन मूल्यांकरिता दाखविला आहे.
उपयोग : इलेक्ट्रॉनिकी व इतर अभियांत्रिकी क्षेत्रांत फेराइटांचा जो फार मोठ्या प्रमाणात उपयोग होऊ लागला आहे, त्याची अनेक कारणे आहेत. फेराइटांचे आकारमान लहान असते. त्यांच्या उपयोजनामुळे कमी खर्चात उच्च कार्यक्षमता मिळू शकते. फेराइटांचे काही महत्त्वाचे उपयोग कोष्टक क्र. ३ मध्ये दाखविले आहेत.
प्रवर्तक रोहित्र व आकाशक यांमधील अंतरकाच्या कार्यक्षमतेचे मूल्यमापन करण्याकरिता μQ या राशीचा उपयोग केला जातो. हीमधील Q गुणकांचे मूल्य
| ωL | या सूत्ररूपात दाखविता येते. यात ω= |
| R |
2 π f ( f = कंप्रता), L प्रवर्तकत्व आणि R हा अंतरकामध्ये निरनिराळ्या प्रक्रियांमुळे होणारा विद्युत् चुंबकीय ऊर्जा क्षय आहे. रेडिओ ग्राहीच्या आकाशकाकरिता फेराइटाचा (साधारणपणे ०·६—१·८ सेंमी. व्यास व २—२० सेंमी. लांब) दांडा घेऊन त्याभोवती तारेचे वेटोळे केलेले असते. फेराइटाच्या उच्च μQ मूल्यामुळे (Ni — Zn फेराइटाकरिता μQ= २, ००,००० तर लोह चूर्णाकरिता μQ = २०००) या आकाशकाची संवेदनक्षमता हवा हे अंतरक असलेल्या आकाशकापेक्षा कित्येक पटींनी जास्त असते. रेडिओ स्थानकापासून दूर अंतरावर मिळणारे विद्युत् संदेश दुर्बल होतात. असे दुर्बल संदेश पकडण्याकरिता साधा आकाशक म्हणून घराच्या छपरावर लांब तार लावावी लागते. याऐवजी रेडिओ ग्राहीमध्ये फेराइट आकाशक बसविल्यास हे काहीही न करता असे संदेश स्पष्ट स्वरूपात मिळू शकतात. हे कार्य फेराइटाच्या उच्च μQ मूल्यामुळेच शक्य होते. फेराइट अंतरक असल्यामुळे आकाशकाला बऱ्याच वेळा दिशीय गुणधर्म येतो, म्हणजे त्याची कार्यक्षमता वा संवेदनक्षमता एका ठराविक दिशेत महत्तम आहे असे आढळते.
फेराइटांमधील विद्युत् चुंबकीय ऊर्जा क्षय प्रक्रिया : कोष्टक क्र. ३ मध्ये फेराइटांचे विविध उपयोग नमूद करताना (विशेषतः पहिल्या ६ प्रकारांकरिता) विद्युत् चुंबकीय ऊर्जा क्षयाचे प्रमाणही नमूद केले आहे. फेराइटांमध्ये होणाऱ्या विविध ऊर्जा क्षय प्रक्रियांचे खाली संक्षेपाने विवरण केले आहे.
आवर्त प्रवाहामुळे होणारा ऊर्जा क्षय : (चुंबकीय स्रोतामधील बदलामुळे विद्युत् संवाहक द्रव्यात प्रवर्तित होणाऱ्या विद्युत् प्रवाहाला आवर्त प्रवाह म्हणतात). d या जाडीच्या व p या रोधकतेच्या चुंबकीय अंतरकावर f कंप्रतेचे प्रत्यावर्ती चुंबकीय क्षेत्र लावले, तर त्यात प्रवर्तित होणाऱ्या विद्युत् प्रवाहाचे अंती ऊष्मीय ऊर्जेत रूपांतर होऊन, या प्रकारे होणाऱ्या
| ऊर्जा क्षयाचे प्रमाण | d2f | यावर अवलंबून राहते, असे दाखविता येते. फेराइटामध्ये योग्य |
| p |
त्या धातू वापरल्या असता त्याची रोधकता खूप प्रमाणात वाढते व त्यामध्ये अशा प्रकारे होणाऱ्या ऊर्जा क्षयाचे प्रमाण महत्त्वाचे नसते. फेराइटामध्ये असलेली लघुक्षेत्रे व त्यांच्या सीमा यांचा विचार केल्यास यामध्ये होणारा ऊर्जा क्षय वरील सूत्राने मूल्यापेक्षा जास्त असतो, असे दाखविता येते. कारण या परिस्थितीत लघुक्षेत्र सीमांच्या आसपासच्याच विभागात आवर्त प्रवाहामुळे होणाऱ्या ऊर्जा क्षयाचे स्थानिकीकरण होण्याकडे प्रवृत्ती असते असे दिसते.
मंदायनामुळे होणारा ऊर्जा क्षय : कोणत्याही चुंबकीय पदार्थाला एका संपूर्ण चुंबकीकरण आवर्तनामधून नेले असता मंदायन वलयाच्या क्षेत्रफळाने दर्शविलेल्या चुंबकीय ऊर्जेचे ऊष्मीय प्रकारात रूपांतर होऊन ही ऊर्जा क्षय पावते. या प्रकारचा ऊर्जा क्षय प्रत्यावर्ती चुंबकीय क्षेत्राच्या परमप्रसरावर अवलंबून राहतो. पदार्थाचे चुंबकीकरण (१) लघुक्षेत्र सीमांचे विस्थापन व (२) लघुक्षेत्रांचे दिक्विन्यास ( दिशांची मांडणी) या दोन क्रियांमुळे होते. प्रत्यावर्ती चुंबकीय क्षेत्राची कंप्रता वाढविली असता यांपैकी दुसरी क्रिया जास्त महत्त्वाची ठरत असल्याने मंदायनामुळे होणाऱ्या ऊर्जा क्षयाचे प्रमाणही उच्च कंप्रतेस कमी होते.
प्रत्यावर्ती चुंबकीय क्षेत्राचा परमप्रसर कमी मूल्याचा असून त्याची कंप्रता खूप जास्त असेल (मेगॅहर्ट्झ), तर वरील प्रक्रियांशिवाय आणखी
काही ऊर्जा क्षय प्रक्रिया होऊ शकतात. यांपैकी काहींचे विशदीकरण स्नोक यांनी दिले आहे.
फेराइटांमधील कंप्रता-अवलंबी ऊर्जा क्षय प्रक्रिया : या परिणामाचे विवेचन करण्याकरिता प्रारंभिक पार्यता μ = μ’ — jμ” या सदसत् स्वरूपात [→ संख्या] मांडणे सोईचे ठरते (j = √-1). B = चुंबकीय प्रवर्तन व H = चुंबकीकरण क्षेत्र असेल, तर
B = (μ’ – j μ’‘ ) H
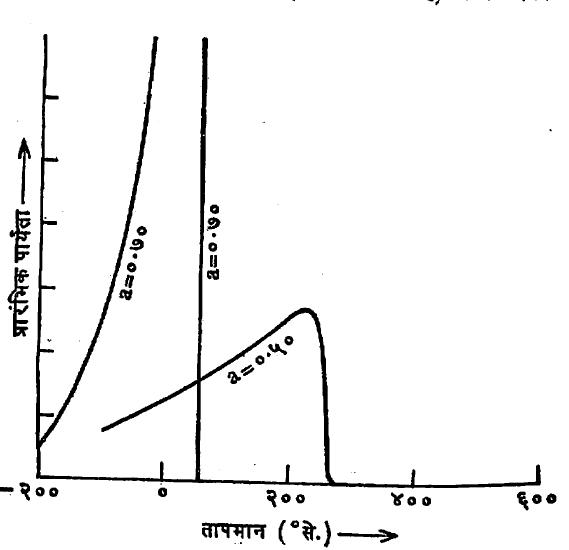
पदार्थांमध्ये सर्व प्रकारे होणारा ऊर्जा क्षय (प्रतिसेकंद) = ωHB sin δB या सूत्राने मिळतो, असे दाखविता येते. येथे ω = 2πf आणि tan δB = μ’‘ /μ’ मॅग्नेशियम फेराइटाच्या μ’ व μ’‘ मध्ये कंप्रतेनुसार होणारा बदल आ. ४ मध्ये दाखविला आहे.
आकृतीमध्ये ५० मेगॅहर्ट्झच्या जवळपास मिळणारे अनुस्पंदन शिखर हे लघुक्षेत्र सीमांमध्ये निर्माण होणाऱ्या आंदोलनामुळे होते असे दाखविता येते. चुंबकीय क्षेत्र लावले असता पदार्थांमध्ये निर्माण होणाऱ्या चुंबकत्वाचा काही भाग त्यामधील लघुक्षेत्र सीमा बदलल्यामुळे किंवा त्यांचे विस्थापन झाल्यामुळे निर्माण होते याचा मागे उल्लेख आला आहे [→ चुंबकत्व]. चुंबकीय क्षेत्र जर प्रत्यावर्ती असेल, तर त्यामुळे या सीमांची आंदोलने सुरू होतात. आंदोलन करणारी लघुक्षेत्र प्रणाली संदमक (आंदोलनांच्या परमप्रसर कमी करणाऱ्या) माध्यमात आंदोलने करणाऱ्या एका ठराविक द्रव्यमानाच्या वस्तूबरोबर समतुल्य समजता येते. त्यामुळे लघुक्षेत्र सीमांना स्वतःची अशी अशा नैसर्गिक आंदोलन कंप्रता असते असे दाखविता येते. लावलेल्या प्रत्यावर्ती चुंबकीय क्षेत्राची कंप्रता या नैसर्गिक कंप्रता मूल्याएवढी होते, तेव्हा अनुस्पंदन परिणाम दिसून येतो. या कंप्रतेस ऊर्जेचे शोषण महत्तम असते.
 १,२०० मेगॅहर्ट्झ कंप्रतेला जे दुसरे लहान शिखर मिळते ते स्नोक यांच्या मते लोहीचुंबकीय परिवलन अनुस्पंदनामुळे मिळते. हा परिणाम जे. एच्. ई. ग्रिफिथ्स यांनी १९४६ साली शोधून काढलेल्या लोहचुंबकी परिवलन अनुस्पंदनासारखा आहे. या आविष्कारामध्ये पदार्थावरून बाहेरून लावलेले किंवा आंतरिक असे एक स्थिर चुंबकीय क्षेत्र असते, तर त्यावर त्याच वेळी उच्च कंप्रतेचे प्रत्यावर्ती असे दुसरे चुंबकीय क्षेत्र स्थिर क्षेत्राशी समांतर किंवा लंब दिशेत कार्य करीत असते. या परिस्थितीत एक विशिष्ट परिवलन अनुस्पंदन परिणाम मिळतो. अनेक वेळा हा अनुस्पंदन परिणाम एका ठराविक कंप्रतेला न दिसता एका कंप्रता पट्ट्यात आढळतो. याचे कारण मात्र अजून नीटसे समजले नाही. जर पदार्थाच्या पृष्ठभागावर ताण असेल, तर या कंप्रता पट्ट्याच्या मर्यादा जास्त रुंद होतात, असे मात्र प्रयोगाद्वारे दिसते.
१,२०० मेगॅहर्ट्झ कंप्रतेला जे दुसरे लहान शिखर मिळते ते स्नोक यांच्या मते लोहीचुंबकीय परिवलन अनुस्पंदनामुळे मिळते. हा परिणाम जे. एच्. ई. ग्रिफिथ्स यांनी १९४६ साली शोधून काढलेल्या लोहचुंबकी परिवलन अनुस्पंदनासारखा आहे. या आविष्कारामध्ये पदार्थावरून बाहेरून लावलेले किंवा आंतरिक असे एक स्थिर चुंबकीय क्षेत्र असते, तर त्यावर त्याच वेळी उच्च कंप्रतेचे प्रत्यावर्ती असे दुसरे चुंबकीय क्षेत्र स्थिर क्षेत्राशी समांतर किंवा लंब दिशेत कार्य करीत असते. या परिस्थितीत एक विशिष्ट परिवलन अनुस्पंदन परिणाम मिळतो. अनेक वेळा हा अनुस्पंदन परिणाम एका ठराविक कंप्रतेला न दिसता एका कंप्रता पट्ट्यात आढळतो. याचे कारण मात्र अजून नीटसे समजले नाही. जर पदार्थाच्या पृष्ठभागावर ताण असेल, तर या कंप्रता पट्ट्याच्या मर्यादा जास्त रुंद होतात, असे मात्र प्रयोगाद्वारे दिसते.
 उच्च कंप्रतेच्या प्रत्यावर्ती चुंबकीय क्षेत्राच्या बाबतीत आणखी एक प्रकारचा अनुस्पंदन परिणाम आढळतो. जर पदार्थाची परिमाणे प्रत्यावर्ती चुंबकीय क्षेत्राच्या तरंगलांबी मूल्याच्या जवळपास असतील, तर
उच्च कंप्रतेच्या प्रत्यावर्ती चुंबकीय क्षेत्राच्या बाबतीत आणखी एक प्रकारचा अनुस्पंदन परिणाम आढळतो. जर पदार्थाची परिमाणे प्रत्यावर्ती चुंबकीय क्षेत्राच्या तरंगलांबी मूल्याच्या जवळपास असतील, तर
काही सीमा अटींमुळे पदार्थांमध्ये अप्रगामी (स्थिर) तरंग आकृतिबंध [→ तरंग गति] निर्माण होणे शक्य होते. या परिस्थितीत होणाऱ्या अनुस्पंदन परिणामास परिमाणात्मक अनुस्पंदन असे म्हणतात. Mn-Zn फेराइटाचा १·२५ x २·५ चौ.सेंमी. तुकडा घेतला, तर त्यामध्ये या प्रकारच्या परिणामामुळे पार्यतेचे मूल्य १·५ मेगॅहर्ट्झ नंतर एकदम कमी होते. कंप्रतेचे हे मूल्य पदार्थाच्या परिमाणाप्रमाणे बदलते असे दाखविता येते.
फेराइटांचा सूक्ष्मतरंग मंडलांत क्षीणन व इतर कार्याकरिता केला जाणारा वापर करील अनुस्पंदन परिणामावर आधारित आहे.
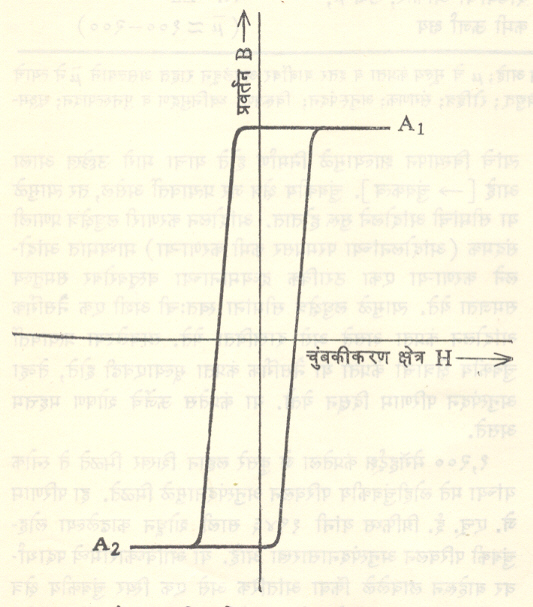
संगणकाकरिता फेराइटे : आधुनिक अंकीय संगणकात [→ संगणक] तार्किक व स्मरण प्रयुक्तींमध्ये, संग्राहक कार्याकरिता फेराइट अंतरकांचा उपयोग केला जातो. फेराइटाच्या संघटनेत योग्य तो फेरफार करून त्याचे मंदावन वलय चौकोनी आकाराचे केले जाते (आ. ५). आकृतीत दाखविल्याप्रमाणे फेराइटाला A1 व A2 अशा दोन भिन्न व स्पष्ट अशा स्थिर अवस्था असतात. A1 अवस्थेत चुंबकत्व धन प्रकारचे मानले, तर A2 अवस्थेत ते ऋण प्रकारचे होईल. संगणकामध्ये द्विमान पद्धती वापरलेली असते. त्यामधील ० व १ या अवस्थांशी वरील अवस्था समरूप आहेत, असे मानता येईल. संग्राहक कार्याकरिता फेराइट जर वापरावयाचे असेल, तर त्याकरिता (१) दमनकारी प्रेरणेचे मूल्य कमी असावे, (२) अवशेषी चुंबकत्वाचे प्रमाण उच्च असावे, (३) ऊर्जा क्षय प्रक्रियेमुळे निर्माण होणारा विलंब काल अत्यल्प असावा. अशा प्रकारच्या फेराइटांवर लावलेल्या चुंबकीय क्षेत्रात आकस्मिक बदल करून त्याच्या अवस्थेत त्वरेने बदल करता येतो. म्हणजे फेराइट A1 अवस्थेतून A2 अवस्थेत (अथवा उलट) ‘स्विच’ केले जाते. प्रत्यक्षात अंतरक गोल कडीच्या आकाराचा असून त्याच्या केंद्रातून जाणाऱ्या विद्युत् वाहक तारांमधून योग्य मूल्याचा विद्युत प्रवाह स्पंद पाठवून A1 ⇌ A2 हे अवस्थांतर घडवून आणता येते. फेराइट प्रयुक्तीची किंमतसुद्धा कमी असते.
चिरचुंबकाकरिता फेराइटे : फेराइट वापरून इष्ट आकाराचे प्रभावी चिरचुंबक बनविता येतात. बनविलेले चुंबक जर ढिसूळ होतात असे वाटले, तर त्याकरिता फेराइट चूर्णात प्लॅस्टिक बंधक द्रव्य घालून नंतर त्यावर दाब देऊन त्यास योग्य तो आकार देता येतो. स्थिर चुंबकाकरिता वापरण्यात येणाऱ्या फेराइटामध्ये दमनकारी प्रेरणा उच्च प्रतीची व उच्च मूल्याचे अवशेषी चुंबकत्व असावे लागते. मृदीय प्रकारचा ऑक्साइड चिरचुंबक वायू. काटो व टी. टाकी यांनी जपानमध्ये १९३३ साली CoO·Fe2O3 हे फेराइट वापरून प्रथम तयार केला. सध्या या कार्याकरिता BaO·6Fe2O3 या फेराइटाचा उपयोग केला जातो. याकरिता दमनकारी प्रेरणा Hc = १,७५० ओर्स्टेड या प्रतीची असते.
स्पिनेल व्यतिरिक्त इतर प्रकारची फेराइटे : स्पिनेल व्यतिरिक्त (१) गार्नेट, (२) पेरोव्हस्काइट व (३) षट्कोनी स्फटिक संरचनेची फेराइटे उपलब्ध आहेत. गार्नेट स्फटिक संरचना असणाऱ्या फेराइटाचे संघटन 3X2O3·5Fe2O3 या सूत्राने दिले जाते. येथे X = Sm, Eu, Gd, Yb, Y इ. विरल मृतिका धातू असू शकते. या सर्व धातू त्रिसंयुजी आहेत. गार्नेट प्रकारच्या फेराइटांच्या बाबतीत पुढील गुणधर्म आढळून येतात : (१) उच्च रोधकता असते. (२) सूक्ष्मतरंग कंप्रतेकरिता त्यामध्ये अल्प ऊर्जा क्षय होतो. (३) त्याचे एकेरी स्फटिक अनेक वेळा पारदर्शक असतात. त्यामुळे या फेराइटांसंबंधी संशोधन करणे सुलभ होते.
XO·Fe2O3 मध्ये X = Ca2+, Ba2+, Sr2+ यासारखा धातू आयन असेल, तर त्यामुळे पेरोव्हस्काइट प्रकारची फेराइटे मिळतात. या प्रकारामध्ये लोखंडाच्या आयनाऐवजी Mn अथवा Co चे आयन सुद्धा वापरता येतात. बनणाऱ्या उत्पादनाचे लोहचुंबकीय गुणधर्म त्याच्या घटकद्रव्यांच्या तुलनेत जास्त उच्च प्रतीचे असू शकतात, असे अनेक वेळा आढळते.
षट्कोणी स्फटिक संरचनेच्या फेराइटाकरिता XO·6 Fe2 O3 हे सर्वसामान्य सूत्र लागू पडते. येथे X हा Ba2+, Sr2+, Pb2+ यासारखा कोणताही मोठ्या आकारमानाचा आयन असू शकतो. चिरचुंबकाकरिता वापरण्यात येणाऱ्या Ba फेराइटाचे स्फटिक याच प्रकारचे असतात. या प्रकारच्या फेराइटामध्ये चुंबकीकरण उच्च प्रतीचे असते. या प्रकारामध्ये क्यूरी तापमान सामान्यपणे ४००º ते ५००º से. या दरम्यान असते.
पहा : चुंबकत्व.
संदर्भ : 1. Belov, K. P. Magnetic Transitions, New York, 1961.
2. Brailsford, F. Physical Principles of Magnetism, London, 1966.
3. Chikazumi, S. Physics of Magnetism, New York, 1964.
4. Clarricoats, P. J. B Microwave Ferrites, New York, 1961.
5. Hadfield, D., Ed., Permanent Magnets and Magnetism, London, 1962.
6. Smit, J. Wijn, H. P. J. Ferrites, New York, 1959.
7. Waldron, R. A. Ferrites : An Introduction for Microwave Engineers, Princeton, 1961.
चिपळोणकर, व. त्रिं.