अम्ल – ॲनहायड्राइडे : अम्लातून पाण्याचा एक किंवा अधिक रेणू काढून टाकल्यावर उत्पन्न होणाऱ्या संयुगांना अम्ल-ॲनहायड्राइडे म्हणतात. सामान्यतः अम्ल-ॲनहायड्राइडात पाण्याची भर घालून मूळ अम्ल तयार करता येते. अकार्बनी रसायनशास्त्रातील अधातूंच्या (धातूंचे गुणधर्म नसलेल्या मूलद्रव्यांच्या) ऑक्साइडांना अम्ल-ॲनहायड्राइडे मानता येईल. परंतु अम्ल-ॲनहायड्राइडे ही संज्ञा कार्बनी रसायनशास्त्रात काही विशिष्ट अर्थाने वापरली जाते. कार्बनी अम्लातील दोन COOH गटांतून पाण्याचा एक रेणू काढून टाकल्याने तयार होणाऱ्या संयुगास ‘अम्ल-ॲनहायड्राइड’ म्हणतात. हे पुढील समीकरणावरून कळून येईल :
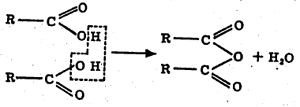
ज्या अम्ल-रेणूत एकच COOH गट असतो त्याचे दोन रेणू घ्यावे लागतात. परंतु अम्ल-रेणूत दोन COOH गट असतील तर एकाच रेणूपासून ॲनहायड्राइड मिळते.
अनेक कार्बनी ॲनहायड्राइडांचे सूत्र RCO.O.cOR असे असते. RCO या गटाला ‘ॲसिल-गट’ असे म्हणतात. अनेक संयुगांतील दोन्ही ॲसिल-गट एकाच प्रकारचे असतात. अम्ल-ॲनहायड्राइडांची नावे संबंधित अम्लांवरून दिली जातात. उदा.,
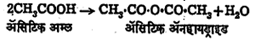
अम्ल-ॲनहायड्राइडे तयार करण्याच्या कृती : (१) सामान्यतः अम्ल-क्लोराइड व अम्लाचे निर्जल सोडियमी लवण यांच्या विक्रियेने अम्ल-ॲनहायड्राइडे तयार केली जातात.

व्यापारी उत्पादनात मात्र प्रत्यक्ष अम्ल-क्लोराइड वापरण्यात येत नाही. त्याऐवजी अम्लाचे सोडियमी लवण व योग्य प्रमाणात घेतलेला फॉस्फरस ऑक्सिक्लोराइड यांच्या विक्रियेने तयार झालेल्या अम्ल-क्लोराइडाची सोडियम लवणाशी विक्रिया करून अम्ल-ॲनहायड्राइड मिळवितात.
(२) कार्बॉक्सिलिक अम्ल व ॲसिटिलीन यांचा उत्प्रेरकीय (विक्रियेमध्ये स्वतः भाग न घेता विक्रियेची गती वाढविणारा पदार्थ वापरणे, ⟶ उत्प्रेरण) पद्धतीने संयोग घडवून आणल्यास एथिलिडीन डाय-एस्टर CH3·CH (OOCR) 2 हा पदार्थ तयार होतो व तो तापविल्याने अम्ल-ॲनहायड्राइड व ॲसिटाल्डिहाइड हे पदार्थ तयार होतात. अम्ल-ॲनहायड्राइडे तयार करण्याची ही अत्याधुनिक पद्धती होय.
(३) आणखी एक नवीन पद्धती अशी आहे : ॲसिटोनाच्या भंजनाने (फोडून घटक वेगळे करण्याने) ‘कीटीन’ नावाचा पदार्थ मिळतो. कीटीन व कार्बॉक्सिलिक अम्ल यांच्या संयोगाने अम्ल-ॲनहायड्राइडांची निर्मिती होते.
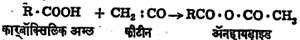
येथे R हा CH3 गट असेल तर ॲसिटिक ॲनहायड्राइड तयार होईल. तो CH3 हून भिन्न असेल तर दोन वेगवेगळ्या अम्लांपासून बनलेले मिश्र ॲनहायड्राइड मिळेल, हे उघड आहे.
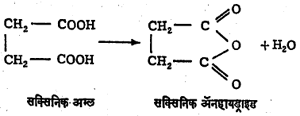
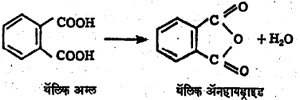
गुणधर्म : फॉर्मिक अम्लाचे निर्जलीकरण (पाणी काढून टाकण्याची क्रिया) केल्यावर कार्बन मोनॉक्साइड मिळतो. पण हा अपवाद सोडला तर इतर कार्बॉक्सिलिक अम्लांपासून अम्ल-ॲनहायड्राइडे मिळतात. एकाच रेणूमध्ये दोन कार्बॉक्सिलिक गट असलेले, सक्सिनिक अम्ल किंवा थॅलिक अम्ल तापविल्याने त्यांची अम्ल-ॲनहायड्राइडे मिळू शकतात. परंतु सामान्यतः केवळ अम्ले तापवून अम्ल-ॲनहायड्राइडे तयार करता येत नाहीत.
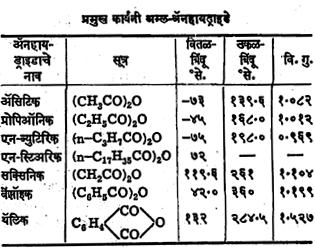
ज्या अम्लांत बारापर्यंत कार्बन-अणू आहेत अशा सामान्य अम्लांची ॲनहायड्राइडे द्रवरूप असतात. ॲसिटिक ॲनहायड्राइड हे द्रव असून त्याला तिखट चुरचुरणारा वास येतो. अम्ल-ॲनहायड्राइडांचा ⇨ रेणुभार ती ज्या अम्लांपासून तयार झाली, त्यांच्या रेणुभारांच्या जवळजवळ दुप्पट असतो. त्यांचा उकळबिंदूही अम्लांपेक्षा थोडा उच्च असतो.
पाण्याची विक्रिया होऊन अम्ल-ॲनहायड्राइडांपासून त्यांची मूळची अम्ले मिळतात. अल्कोहॉलांशी विक्रिया होऊन एस्टरे व अमोनियाशी विक्रिया होऊन ⇨ अमाइडे मिळतात.
उपयोग: सेल्युलोज, सेल्युलोज ॲसिटेट, ॲस्पिरीन वगैरे पदार्थ औद्योगिक प्रमाणावर तयार करण्यासाठी अम्ल-ॲनहायड्राइडांचा उपयोग केला जातो. एस्टरे तयार करण्यासाठी अम्ल-ॲनहायड्राइडांचा मोठ्या प्रमाणात उपयोग होतो. ॲसिटिक ॲनहायड्राइड व मिथिल आणि एथिल अल्कोहॉले यांच्या विक्रियेने मिथिल ॲसिटेट व एथिल ॲसिटेट ही मिळतात. त्यांचा विद्रावक (विरघळविणारा पदार्थ) म्हणून उपयोग होतो. उच्च रेणुभारांच्या अल्कोहॉलांपासून तयार झालेल्या ॲसिटेटांचा उपयोग सुघट्ट्यकारक (प्लॅस्टिसायझर—हा पदार्थ मिश्रणात घातला असता चिकटपणा निर्माण करतो) म्हणून प्लॅस्टिकांच्या व कृत्रिम रेझिनांच्या धंद्यात करतात. गॅसोलीन, कृत्रिम रबर, प्लॅस्टिक इ. पदार्थ तयार करण्याच्या प्रक्रियांत महत्त्वाच्या असलेल्या ⇨ फ्रीडेल-क्राफ्ट-विक्रियेत अम्ल-ॲनहायड्राइडां-चा उपयोग केला जातो.
संदर्भ : Fieser, L. F. Fieser, M. Organic Chemistry, Bombay, 1962.
कट्टी, ना. गो.