ॲरोमॅटिक संयुगे : कार्बनी संयुगांच्या एका मोठ्या वर्गाचे नाव. ज्या संयुगांमध्ये बेंझीन वलय आहे किंवा बेंझिनाचे वैशिष्ट्य असणारी समवलयी (एकाच प्रकारचे अणू असलेले वलय असणारी) अथवा विषमवलयी (निरनिराळ्या प्रकारचे अणू असलेले वलय असणारी) संरचना (अणूंची मांडणी) आहे, अशा संयुगांचा समावेश या वर्गात होतो.
या वर्गाला ‘ॲरोमॅटिक’ म्हणजे ‘सुगंधी’ हे नाव पडण्याचे कारण असे की, या वर्गातील जी संयुगे प्रथम उपलब्ध झाली त्यांना सुवास होता. पण कालांतराने असे दिसून आले की, ज्यांना सुवास नाही अशीही अनेक संयुगे या वर्गात मोडतात. त्यामुळे हे नाव यथार्थ नाही तथापि ते रूढ झाले असल्यामुळे वापरात आहे. या वर्गात हायड्रोकार्बने व त्यांचे अनुजात (एका संयुगापासून तयार केलेली दुसरी संयुगे) यांचा समावेश होतो. या वर्गाची जी विशिष्ट लक्षणे आहेत त्यांपैकी महत्त्वाची पुढील प्रमाणे होत. संरचनेत द्विबंध (दोन जोडलेले बंध, → संयुजा) असूनही समावेशन (दोन अणू वा अणुगटांचा समावेश होऊन द्विबंधांऐवजी एकच बंध निर्माण होण्याच्या) विक्रियांपेक्षा प्रतिष्ठापन (एक अणू काढून त्या ठिकाणी दुसरा अणू बसविण्याच्या) विक्रिया जास्त सुकरतेने घडून येतात. ऑक्सिडीकारक [→ ऑक्सिडीभवन] विक्रियांमध्ये वलयी संरचना निष्क्रिय राहते, पण वलयाला जोडलेल्या पार्श्वशाखा (बाजूला जोडलेल्या अणूंनी तयार झालेल्या शाखा) असल्यास त्यांचे ऑक्सिडीकरण होते. या वर्गातील संयुगांची हॅलाइडे ॲलिफॅटिक हॅलाइडांसारखी विक्रियाशील नसतात, अमाइनांचा क्षारक (अम्लाशी विक्रिया झाल्यास लवण तयार होण्याचा) गुणधर्म दुर्बल असतो व हायड्रॉक्सी अनुजात अम्लधर्मी असतात.
बेंझीन हा ॲरोमॅटिक हायड्रोकार्बनांपैकी सर्वांत महत्त्वाचा व त्यांचा प्रतिनिधी समजला जातो. त्याचे विशिष्ट गुणधर्म हे ॲरोमॅटिक हायड्रोकार्बनांचे विशिष्ट गुणधर्म समजले जातात. तसेच गुणधर्म असणाऱ्या हायड्रोकार्बनांचाही समावेश ॲरोमॅटिक हायड्रोकार्बनांत केला जातो. बेंझिनाचे गुणधर्म कळल्यावर एकूण ॲरोमॅटिक हायड्रोकार्बनांच्या गुणधर्मांची कल्पना येते. म्हणून प्रथम बेंझिनाचे गुणधर्म दिलेले आहेत.
बेंझीन : (C6H6). वर्णहीन द्रव, उकळबिंदू ८०० से., वितळबिंदू ५·५० से., वि.गु. ०·८८. त्याला एक प्रकारचा वास असतो. ते पाण्यात मिसळत नाही, पण अल्कोहॉलात व ईथरात सर्व प्रमाणांत मिसळते. ते ज्वलनक्षम (लवकर पेट घेणारे) असून जळताना धूर होतो व ज्योत प्रदीप्त असते.
रासायनिक गुणधर्म : बेंझीन अत्यंत स्थिर आहे. ज्वलनाखेरीज इतर कोणत्याही विक्रियेने त्याच्या रेणूचे खंड पाडणे अत्यंत कठीण असते. सांद्र (जास्त प्रमाण असलेल्या) क्षार (अल्कली) विद्रावाबरोबर उकळण्याचा त्याच्यावर परिणाम होत नाही. तसेच क्रोमिक अम्ल किंवा पोटॅशियम परमँगॅनेट यांसारख्या प्रबल ऑक्सिडीकारक पदार्थांच्या सांद्र विद्रावांबरोबर तापविले तरी त्याच्यावर मंद विक्रियाच होते व त्याचे अपघटन होऊन (घटक पदार्थ सुटे होऊन) कार्बन डाय-ऑक्साइड, पाणी व लेशमात्र इतर काही पदार्थ तयार होतात.
प्रतिष्ठापित अनुजात : काही विशिष्ट परिस्थितीत बेंझिनाची प्रतिष्ठापित (संयुगातील एक अणू काढून त्या जागी दुसरा अणू बसविलेली) संयुगे तयार होऊ शकतात. सामान्य तापमानालाही सांद्र नायट्रिक अम्लाची बेंझिनावर क्रिया होते व बेंझिनातील एका हायड्रोजनाच्या जागी एकसंयुजी [→ संयुजा] -NO2 गट येऊन नायट्रोबेंझीन तयार होते.
|
C6H6 |
+ |
HNO3 |
→ |
C6H5NO2 |
+ |
H2O |
|
बेंझीन |
नायट्रिक अम्ल |
नायट्रोबेंझीन |
पाणी |
सांद्र सल्फ्यूरिक अम्लाची विक्रिया सामान्य तापमानास अगदी मंदपणे व उच्च तापमानात अधिक वेगाने होऊन बेंझीन सल्फॉनिक अम्ल तयार होते.
|
C6H6 |
+ |
H2SO4 |
→ |
C6H5·SO3H |
+ |
H2O |
|
बेंझीन |
सल्फ्यूरिक अम्ल |
बेंझीन सल्फॉनिक अम्ल |
पाणी |
प्रत्यक्ष सूर्यप्रकाशात नसताना व सामान्य तापमानास बेंझिनावर क्लोरीन व ब्रोमीन यांची क्रिया अगदी सावकाश होऊन क्लोरोबेंझीन C6H5Cl, डायक्लोरोबेंझीन C6H4Cl2, ब्रोमोबेंझीन C6H5Br इ. प्रतिष्ठापित संयुगे तयार होतात. उत्प्रेरकाच्या (प्रत्यक्ष विक्रियेत भाग न घेता ती जलद घडवून आणणाऱ्या पदार्थाच्या) सान्निध्यात मात्र सामान्य तापमानास व अंधारातही वरील विक्रिया सहज घडून येतात.
समावेशक संयुगे : सूर्यप्रकाशात व ऑक्सिजन नसताना क्लोरीन किंवा ब्रोमीन यांचे बेंझिनात सरळसरळ समावेशन (अंतर्भाव) होते व बेंझीन हेक्झॅक्लोराइड (C6H6Cl6) किंवा बेंझीन हेक्झॅब्रोमाइड तयार होते.
बेंझीन हे पॅराफिनांसारखे स्थिर असले तरी त्याच्या रासायनिक विक्रिया पॅराफिनांपेक्षा अगदी वेगळ्या आहेत हे वरील वर्णनावरून दिसून येईल. उदा., सल्फ्यूरिक किंवा नायट्रिक अम्लांची बेंझिनावर सहज विक्रिया होते तशी पॅराफिनांवर (अल्केनांवर) होत नाही. अतृप्त (काही संयुजा मुक्त असलेले) अशा हायड्रोकार्बनांच्या अल्किनांच्या (ओलेफिनांच्या) व अल्काइनांच्या (ॲसिटिलिनांच्या) व बेंझिनाच्या रासायनिक गुणधर्मांतही बराच भेद आहे. त्यांच्या मानाने बेंझीन हे कमी अतृप्त आहे. उदा., एथिलीन (CH2 : CH2) किंवा ॲसिटिलीन (CH ≡ CH) व हॅलोजने यांची समावेशक विक्रिया सुलभपणे होते व एथिलीन ब्रोमाइड (C2H2Br2) व ॲसिटिलीन ब्रोमाइड (C2H2Br4) यांसारखी संयुगे तयार होतात. उलट सामान्य परिस्थितीत व तापमानास बेंझिनापासून समावेशक संयुग न मिळता प्रतिष्ठापित संयुग मिळते.
|
C6H6 |
+ |
Br2 |
→ |
C6H5.Br |
+ |
HBr |
|
बेंझीन |
ब्रोमीन |
ब्रोमोबेंझीन |
हायड्रोमीक अम्ल |
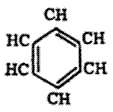
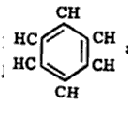
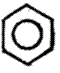
बेंझीनाचे संरचना सूत्र दर्शविण्याच्या पद्धती : बेंझीनाचे संरचना सूत्र
|
|
असे किंवा |
|
असे असून ते |
|
असे, |
|
असे किंवा नुसते |
|
असे लिहिले जाते. एकाच अणूने (किंवा अणूच्या एकाच गटाने) प्रतिष्ठापित अशा बेंझिनाचे संरचना सूत्र दाखवावयाचे असेल, तर प्रतिष्ठापित झालेला अणू (किंवा गट) तेवढाच दाखविण्याचा प्रघात आहे. इतर हायड्रोजन अणू दाखविले जात नाहीत. उदा., क्लोरोबेंझिनाचे C6H5Cl संरचना सूत्र![]() असे आहे व टोल्यूइनाचे C6C5CH3 संरचना सूत्र
असे आहे व टोल्यूइनाचे C6C5CH3 संरचना सूत्र ![]() असे दाखविले जाते. बेंझीनातील सहाही अणू सारखेच असल्यामुळे षट्कोनाच्या कोणत्याही एका कोनाशी प्रतिष्ठापित गट दाखविला तरी चालते.
असे दाखविले जाते. बेंझीनातील सहाही अणू सारखेच असल्यामुळे षट्कोनाच्या कोणत्याही एका कोनाशी प्रतिष्ठापित गट दाखविला तरी चालते.
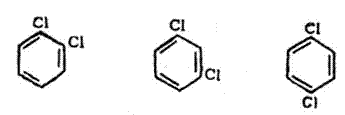 |
||
|
ऑर्थो -डायक्लोरोबेंझीन |
मेटा-डायक्लोरोबेंझीन |
पॅरा-डायक्लोरोबेंझीन |
एकाऐवजी दोन अणूंचे (किंवा गटांचे) प्रतिष्ठापन झाल्यास तीन समघटक (रेणूतील अणूंची संख्या व त्यांचे प्रकार सारखेच असलेले पण गुणधर्म व संरचना निराळी असणारे पदार्थ) तयार होतात व त्यांच्यातील भेद दाखविण्यासाठी पुढील पद्धती वापरली जाते. प्रतिष्ठापित अणूंच्या स्थानावरुन त्यांना बाजूच्या तक्त्यात दाखविल्याप्रमाणे ऑर्थो, मेटा व पॅरा अशी नावे दिली जातात.
ट्रायक्लोरोबेंझिनाचे C6H3Cl3 तीन समघटक मिळालेले आहेत. त्यांच्यातील क्लोरिनाच्या अणूंची स्थाने दर्शविण्यासाठी वलयातील कार्बनाच्या अणूंना अनुघटी (घड्याळाच्या काट्यांच्या हालचालीच्या दिशेने) क्रमांक कल्पिले जातात व प्रतिष्ठापित अणूंचे क्रमांक देऊन समघटकांस नावे दिली जातात. ट्रायक्लोरोबेंझिनाच्या तीन समघटकांची नावे व संरचना-सूत्रे खाली दिली आहेत.
 |
||
|
१,२,३ ट्रायक्लोरोबेंझीन |
१,२,४ ट्रायक्लोरोबेंझीन |
१,३,५ ट्रायक्लोरोबेंझीन |
बेंझिनाचे अनुजात : हॅलोजन, NO2, SO3H, NH2, OH व इतर कित्येक गट बेंझिनाच्या वलयात प्रतिष्ठापन करून घालता येतात. त्याचप्रमाणे वलयाला अनेक प्रकारच्या लहान-मोठ्या शाखा जोडणे शक्य असते. त्यामुळे बेंझिनापासून व इतर ॲरोमॅटिक हायड्रोकार्बनांपासून शेकडो प्रकारचे अनुजात तयार करता येतात. त्यांपैकी पुष्कळशी संयुगे रंजकद्रव्ये, औषधे, जंतुनाशके, संवेदनाहारके, खाद्यपेयांना स्वाद देणारे पदार्थ इ. तयार करण्यासाठी वापरली जातात व त्यामुळे उद्योगधंद्याच्या दृष्टीने ती अत्यंत महत्त्वाची आहेत.
अनुजातांचे गुणधर्म : एखादा गट प्रत्यक्ष बेंझिनाच्या वलयाला जोडला गेला असला, तर त्याचे गुणधर्म तो बेंझिनाच्या पार्श्वशाखेस जोडला गेला असतानाच्या गुणधर्मांहून सामान्यतः भिन्न असतात. उदा., (१) बेंझिनाच्या वलयाला -OH गट जोडून तयार होणारी फिनॉले सापेक्षतः प्रबल (पाण्यात लवकर विगमन म्हणजे रेणूंचे साध्या रेणूंत व अणूंत रूपांतर होणारी) अम्ले असतात (उदा., फिनॉल, C6H5OH), पण बेंझिनाच्या पार्श्वशाखेला तोच गट जोडला गेल्यास दुर्बल (पाण्याहूनही दुर्बल) अम्ले, अल्कोहॉले तयार होतात. उदा., बेंझाइल अल्कोहॉल, C6H5CH2OH. (२) प्रत्यक्ष वलयाला जोडला गेलेला -NH2 म्हणजे ॲमिनो गट, अमोनियापेक्षा किंवा ॲलिफॅटिक अमाइनांपेक्षा, कमी क्षारकीय असतो. पण खनिज अम्लांच्या विरल विद्रावांशी त्याची विक्रिया होऊन लवणे तयार होतात.
|
C6H5NH2 |
+ |
HCl |
→ |
C6H5NH3Cl |
|
ॲनिलीन |
हायड्रोक्लोरिक अम्ल |
ॲनिलीन हायड्रोक्लोराइड |
अशा लवणांवर सु. ०० से. तापमानात होणारी नायट्रस अम्लाची विक्रिया ॲलिफॅटिक अमाइनावरील त्याच अम्लाच्या विक्रियेपेक्षा अगदी भिन्न असते. येथे नायट्रोजन विमुक्त न होता डायाझोनियम लवणे तयार होतात. उदा.,
|
C6H5NH3+Cl– |
+ |
NO2H |
→ |
C6H5N2+Cl– |
+ |
2H2O |
|
ॲनिलीन हायड्रोक्लोराइड |
नायट्रस अम्ल |
बेंझीन डायझोनियम क्लोराइड |
पाणी |
प्राप्ती : दगडी कोळशाचे उच्च तापमानला शुष्क भंजक ⇨ऊर्ध्वपातन केल्यास अनेक संयुगे मिळतात. त्यांच्यात जी हायड्रोकार्बनी संयुगे असतात, ती अधिकांशी ॲरोमॅटिक वर्गातील असतात व त्यांच्यापासून उद्योगधंद्यास लागणारे बेंझीन, टोल्यूइन, झायलीन, नॅप्थॅलीन व अँथ्रॅसीन हे पदार्थ मिळविले जातात. खनिज तेलापासून मिळणाऱ्या पॅराफिनांचे उत्प्रेरकांच्या मदतीने वलयीकरण करून किंवा दगडी कोळशाच्या ऊर्ध्वपातनाने मिळणाऱ्या सायक्लोपॅराफिनांचा हायड्रोजननिरास करून (हायड्रोजन अणू काढून टाकून) टोल्यूइन, झायलिने व बेंझीन तयार करण्याच्या कृतींचा शोध अलीकडे लागला आहे. अमेरिकेच्या संयुक्त संस्थानांत या कृती मोठ्या प्रमाणात वापरल्या जातात व त्यांच्यामुळे होणारे उत्पादन दगडी कोळशापासून होणाऱ्या उत्पादनापेक्षा पुष्कळच अधिक होऊ लागले आहे.
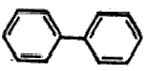
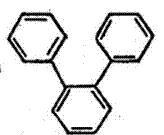
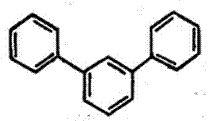
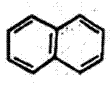
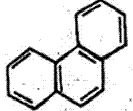
ॲरोमॅटिक संयुगांचे वर्गीकरण : हे पुढीलप्रमाणे करता येते : (१) बेंझीन व त्याचे अनुजात. (२) दोन अथवा अधिक बेंझीन वलये एकमेकांस एकेका कार्बन अणूने जोडल्यामूळे झालेली बायफिनिल, टरफिनिल इ. संयुगे व त्यांचे अनुजात. (३) दोन अथवा अधिक बेंझीन वलये एकमेकांस शेजारच्या दोन कार्बन अणूंनी जोडून झालेल्या संरचना ज्यांमध्ये आहेत अशी संयुगे. उदा., नॅप्थॅलीन, अँथ्रॅसीन, फेनँथ्रीन, ॲसिनॅप्थीन इ. व त्यांचे अनुजात. (४) एक अथवा अनेक बेंझीन वलये ज्यांमध्ये समाविष्ट आहेत अशी विषमवलयी संयुगे. उदा., इंडोल, क्विनोलीन, आयसोक्विनोलीन, ॲक्रिडीन, फेनाझीन, कार्बॅझोल, बेंझोथायोफीन इ. व त्यांचे अनुजात. (५) बेंझिनेतर समवलयी व विषमवलयी संयुगे, उदा., ॲझ्यूलीन, पायरॉल, फुरान, थायोफीन इ. व त्यांचे अनुजात.
काही प्रमुख ॲरोमॅटिक हायड्रोकार्बनांची नावे व सूत्रे शेजारील तक्त्यात दिलेली आहेत.
|
प्रमुख ॲरोमॅटिक हायड्रोकार्बन संयुगे |
|||||
|
संयुगांचे नांव |
रेणवीय सूत्र |
संरचना सूत्र |
उकळबिंदू ०° से. |
||
|
बेंझीन |
C6H6 |
|
८० |
||
|
टोल्यूइन |
C7H8 |
|
१११ |
||
|
झायलीन |
C8H10 |
||||
|
चार समघटक खालीलप्रमाणे |
|||||
|
(१) |
ऑर्थो-झायलीन |
|
१४४ |
||
|
(२) |
मेटा-झायलीन |
|
१३९ |
||
|
(३) |
पॅरा-झायलीन |
 |
१३८ |
||
|
(४) |
एथिल बेंझीन |
|
१३६ |
||
|
क्युमीन |
C9H12 |
|
१५२ |
||
|
एकमेकांस जोडलेली वलये |
उकळबिंदू ०° से. |
वितळबिंदू ०° से. |
|||
|
बायफिनिल |
C12H10 |
|
२५६ |
६९ |
|
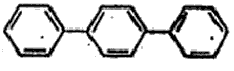
|
पॅरा-डायफिनिल बेंझीन |
C18H14 |
 |
३७६ |
२१३ |
|
|
ऑर्थो-डाय फिनिल बेंझीन |
C18H14 |
|
३३२ |
५७ |
|
|
मेटा-डाय फिनिल बेंझीन |
C18H14 |
|
३६३ |
८७ |
|
|
जुळी वलये |
|||||
|
नॅप्थॅलीन |
C10H8 |
|
२१८ |
८० |
|
|
अँथ्रॅसीन |
C14H10 |
|
३४० |
२१७ |
|
|
फेनँथ्रीन |
C14H10 |
|
३४० |
१००० |
|
|
ॲसिनॅप्थीन (नॅप्थॅलीन-एथिलीन) |
C12H10 |
|
२७८ |
९५·४ |
|
|
एक अथवा अधिक बेंझीनवलययुक्त विषमवलयी संयुगे |
|||||
|
इंडॉल |
C8H7N |
|
२५३ |
५२ |
|
|
क्विनोलीन |
C9H7N |
|
२३७ |
१५·६ |
|
|
आयसोक्विनोलीन |
C9H7N |
|
२४३ |
२६·५ |
|
|
ॲक्रिडीन |
C13H9N |
|
३४३ |
११० |
|
|
फेनाझीन |
C12H8N2 |
|
३६० पेक्षा अधिक |
१७० |
|
|
कार् बॅझोल |
C12H9N |
|
३५४ |
२४६ |
|
|
बेंझोथायोफीन |
C8H6S |
|
२२१ |
३१ |
|
|
बेंझीनेतर सम- व विषम- वलयी संयुगे |
|||||
|
ॲझ्यूलीन |
C10H8 |
|
– |
९९ |
|
|
पायरॉल |
C4H5N |
|
१३१ |
-२४ |
|
|
फुरान |
C4H4O |
|
३१ |
– |
|
|
थायोफीन |
C4H4S |
|
८४ |
-३८·३ |
|
बेंझिनामध्ये व बेंझिनेतर काही संयुगांत जे ॲरोमॅटिक गुणधर्म आढळतात त्यांचे स्पष्टीकरण पुढीलप्रमाणे केले जाते.
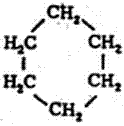
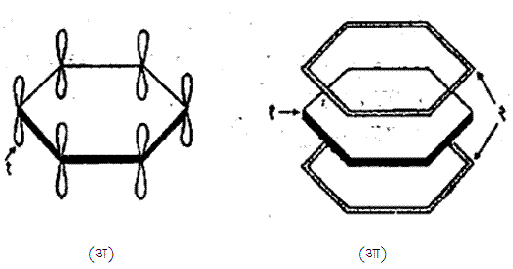
बेंझीन वलयातील कार्बन अणू एकमेकांना द्विबंधाने जोडलेले आहेत. आधुनिक सिद्धांतानुसार अशा कार्बन अणूमधील तीन इलेक्ट्रॉनांची तीन ऑर्बिटले (अणूकेंद्राभोवती फिरणाऱ्या इलेक्ट्रॉनांच्या कक्षाऑर्बिटल हे विशिष्ट ऊर्जास्थिती किंवा पुंजयामिकीतील तरंग फलन दर्शविते व त्यावरून एखाद्या विशिष्ट ठिकाणी इलेक्ट्रॉन आढळण्याची संभाव्यता काढता येते, → पुंजयामिकी) संकर पावतात (एकमेकांत शिरतात) व एका प्रतलात एकमेकांशी १२०० कोन करून राहतात. उरलेल्या चौथ्या इलेक्ट्रॉनाचे जे ऑर्बिटल असते ते या प्रतलाशी लंबरेषेत येते. ते ऑर्बिटल म्हणजे २pz ऑर्बिटल (डंबेलच्या आकाराचे व z अक्षाच्या दिशेतील p ऊर्जास्थितीतील ऑर्बिटल) होय. बेंझीन वलयातील कार्बन अणूंची संकर पावलेली ऑर्बिटले एकमेकांवर पडून शेजारच्या दोन कार्बन अणूंत बंध निर्माण झालेले असतात. त्याचप्रमाणे प्रत्येक कार्बनाचे एक ऑर्बिटल उपयोगात येऊन हायड्रोजनाच्या अणूंशी बंध निर्माण झालेले असतात. अशा रचनेमुळे बेंझीन वलयातील कार्बन अणू एका प्रतलात व २pz ऑर्बिटले त्या प्रतलाला लंबरूप व एकमेकांशी समांतर होतात. त्यामुळे बेंझीन वलयाच्या वर व खाली, वलयाच्या प्रतलाला समांतर असे, ऋणविद्युत् भारी प्रदेश निर्माण होतात. यामुळे वलयाला स्थिरता येते. ॲरोमॅटिक गुणांचे कारण ही स्थिरताच होय.
ज्या संयुगांत अशा सहा इलेक्ट्रॉनांचे षट्क होते ती संयुगे ॲरोमॅटिक गुण दाखवितात. सर्व इलेक्ट्रॉन कार्बन अणूंचेच असले पाहिजेत असे नाही. इतर अणूंनी ते पुरविले तरीही कार्यभाग साधतो. काही विषमवलयी संयुगे ॲरोमॅटिक गुणधर्म दाखवितात ती यामुळे.
उदा., थायोफिनामध्ये चार इलेक्ट्रॉन चार कार्बन अणूंपासून व दोन इलेक्ट्रॉन गंधक अणूपासून मिळतात व षट्क पुरे होते. तसेच फुरानामध्ये दोन इलेक्ट्रॉन गंधक अणूपासून मिळतात व षट्क पुरे होते. तसेच फुरानामध्ये दोन इलेक्ट्रॉन ऑक्सिजन अणूपासून व बाकीचे चार कार्बन अणूंपासून मिळतात.
पहा : अमाइने अँथ्रॅसीन कार्बनी रसायनशास्त्र झायलीन टोल्यूइन नॅप्थॅलीन बेंझीन.
संदर्भ : 1. Bayer, H. Organic Chemistry, London, 1963.
2. Fieser, L. F. Fieser, M. Organic Chemistry, Bombay, 1962.
3. Finar, I. L. Organic Chemistry, London, 1962.
केळकर, क. वा.
“