आवर्त सारणी : ही रासायनिक मूलद्रव्यांच्या वर्गीकरणाची एक योजना आहे. लव्हॉयझर (१७४३–९४) यांनी मूलद्रव्यांचे धातू किंवा अधातू असे दोन वर्ग केले होते पण त्या काळी फारच थोडी मूलद्रव्ये माहीत होती. एकोणिसाव्या शतकाच्या पूर्वार्धात पुष्कळ नव्या मूलद्रव्यांचा शोध लागला. तसेच त्यांचे ⇨ अणुभार व त्यांच्या संयुगांचे गुणधर्म यांविषयी बरीच माहिती उपलब्ध झाली. त्या माहितीचा उपयोग करून रासायनिक मूलद्रव्यांचे वर्गीकरण करण्याचे प्रयत्न झाले. डबेरायनर यांना असे दिसून आले की, साधारण सारखे गुणधर्म असलेल्या मूलद्रव्यांचे अणुभार जवळ जवळ सारखे असतात [उदा., लोह (Fe), कोबाल्ट (Co), निकेल (Ni)] किंवा अशा मूलद्रव्यांचे अणुभार नियमितपणे वाढत जातात. [उदा., क्लोरीन (Cl), ब्रोमीन (Br), आयोडीन (I)]. मूलद्रव्यांतील अशा नियमित संबंधांना त्यांनी त्रिक-नियम असे नाव दिले होते. त्यांना असे आढळून आले की, लिथियम (Li), सोडियम (Na), पोटॅशियम (K) यांच्या अणुभारांची तुलना केली, तर सोडियमाचा अणुभार (२३) हा लिथियमाच्या (७) व पोटॅशियमाच्या (३९) अणुभारांच्या मधला आहे. त्यांनी असेही भाकीत केले होते की, हॅलोजनांच्या गटातील (अधातवीय मूलद्रव्यांच्या एका गटातील) ब्रोमिनाचा अणुभार क्लोरीन (३५·५) व आयोडीन (१२७) यांच्या अणुभारांच्या मधला असला पाहिजे व तो जवळजवळ ८० असल्याचे पुढे आढळून आले.
न्यूलँड्झ यांनी १८६४ साली सप्तकाचा नियम या नावाची एक कल्पना सुचविली. त्याकाळी ज्ञात असलेली मूलद्रव्ये त्यांनी त्यांच्या अणुभारांच्या चढत्या क्रमाने मांडली व त्यांना अनुक्रमांक दिले. तेव्हा त्यांना असे दिसून आले की, कोणत्याही अनुक्रमांकापासून सुरुवात केली, तर सात क्रमांक सोडल्यावर येणाऱ्या मूलद्रव्याचे गुणधर्म हे सुरुवातीच्या मूलद्रव्याच्या गुणधर्मांसारखे असतात.
| H | Li | Be | B | C | N | O |
| 2 | ||||||
| F | Na | Mg | A1 | Si | P | S |
| 9 | ||||||
| C1 | K | Ca | Cr | Ti | Mn | Fe |
| 16 | ||||||
|
न्यूलँड्झ सारणी |
||||||
या सारणीतील क्र. २ चे मूलद्रव्य लिथियम (Li) याचे गुणधर्म क्र. ९ च्या सोडियम (Na) या मूलद्रव्यासारखे आहेत. परंतु त्या काळी कित्येक मूलद्रव्ये अज्ञात होती व ज्ञात मूलद्रव्यांचे अणुभारही बिनचूक माहीत नव्हते. त्यामुळे ही योजना समाधानकारक झाली नाही व मान्यता पावली नाही उलट तिची हेटाळणीच झाली.
मेंडेलेव्ह यांनी आपली आवर्त सारणी योजना १८६९ साली मांडली. त्यांना असे दिसून आले होते की, अणुभाराच्या चढत्या क्रमाने मूलद्रव्ये मांडली म्हणजे काही अवधीनंतर सारखेच गुणधर्म असलेली मूलद्रव्ये पुन्हा भेटतात, म्हणून त्यांनी असा सिद्धांत मांडला की, मूलद्रव्यांचे गुणधर्म हे त्यांच्या अणुभारांची आवर्ती फलने (पुनरावृत्ती दर्शविणारे परस्परसंबंध) होत. मेंडेलेव्ह यांच्या काळी जी मूलद्रव्ये ज्ञात होती ती त्यांनी वाढत्या अणुभाराप्रमाणे व एका विशिष्ट आराखड्यास अनुसरून मांडली व तशा मांडणीवरून समान गुणधर्मांची पुनरावृत्ती कशी होते हे दाखवून दिले.
मेंडेलेव्ह योजनेचे वैशिष्ट्य म्हणजे त्यांनी मूलद्रव्यांची मांडणी करताना गुणधर्मांनुसार त्यांना स्थाने दिली. त्यामुळे काही स्थाने रिकामी राहिली. त्या ठिकाणी मूलद्रव्ये असली पाहिजेत व ती पुढे सापडण्याची शक्यता आहे, असे त्यांनी प्रतिपादन केले. इतकेच नव्हे तर त्या मूलद्रव्यांचे गुणधर्म काय असू शकतील, याचेही भविष्य वर्तविले. कालांतराने त्यांनी केलेले भाकीत खरे ठरले व ही मांडणी मान्यता पावली. त्यांच्या आराखड्यात काही आडव्या व काही उभ्या रांगा होत्या. आडव्या रांगांना त्यांनी आवर्त व उभ्या रांगांना गट अशी नावे दिली होती. काही गटांचे त्यांनी उपगटही कल्पिले होते.
मेंडेलेव्ह यांच्या मूळ सारणीत भर घालून तयार केलेली सारणी कोष्टक क्र. १ मध्ये दिली आहे. या सारणीतील कंसात दाखविलेली मूलद्रव्ये, मेंडेलेव्ह यांनी सारणी केली तेव्हा ज्ञात नव्हती. सारणीतील त्यांच्या जागा रिकाम्या ठेवल्या होत्या. तसेच शून्य क्रमांकाचा म्हणून जो गट त्यात दाखविलेला आहे तो मागाहून घातलेला आहे.
या सारणीवरून असे दिसून येईल की, कोणताही एखादा गट घेतला तर त्यातील मूलद्रव्यांची संयुजा [अणूंची परस्परांशी संयोग पावण्याची क्षमता, → संयुजा] सामान्यतः सारखीच असते. त्यांच्या रासायनिक व भौतिक गुणधर्मांत साम्य असते आणि त्यांच्यापासून जी संयुगे तयार होतात तीही समानधर्मी असतात. तसेच एखाद्या गटातील मूलद्रव्यांच्या गुणधर्मात जे भेद आढळतात ते वरून खाली व नियमित प्रमाणात झालेले आढळतात. उदा., फ्ल्युओरीन ते आयोडीन ही सातव्या गटातील मूलद्रव्ये घ्या. त्यांच्या भौतिक गुणधर्मात कसे फरक पडतात हे कोष्टक क्र. २ वरून कळून येईल.
सारणीतील पहिल्या गटात Li, Na, K इ. क्षारीय (अल्कली) धातू आहेत. त्यांच्या गुणधर्मांतही लक्षात येण्याजोगी साम्ये आहेत. तसेच त्या गटातील लिथियमापासून उत्तरोत्तर खालच्या मूलद्रव्यांच्या रासायनिक व भौतिक गुणधर्मांत जे बदल घडून येतात तेही नियमित प्रमाणात घडून आलेले दिसतात.
एकाच आवर्तातील, म्हणजे आडव्या रांगेतील, मूलद्रव्ये अनुक्रमे घेतली, तर त्यांच्यात साम्य दिसत नाही पण त्यांच्या संयुजा व गुणधर्म यांत जे बदल घडून येतात ते पद्धतशीर झालेले दिसतात.
कोष्टक क्र. १. मेंडेलेव्ह यांच्या आवर्तसारणीचे आधुनिक स्वरूप
| गट | ० |
१ |
२ |
३ |
४ |
५ |
६ |
७ |
८ |
|||||||
| उपगट | अ | ब | अ | ब | अ | ब | अ | ब | अ | ब | अ | ब | अ | ब | ||
| १ ला आवर्त | (He) | H | ||||||||||||||
| २ रा आवर्त | (Ne) | Li | Be | B | C | N | O | F | ||||||||
| ३ रा आवर्त | (Ar) | Na | Mg | Al | Si | P | S | Cl | ||||||||
| ४ था आवर्त | (Kr) | K | Cu | Ca | Zn | (Ga) | (Sc) | (Ge) | Ti | As | V | Se | Cr | Br | Mn | Fe Co Ni |
| ५ वा आवर्त | (Xe) | Rb | Ag | Sr | Cd | In | Y | Sn | Zr | Sb | Nb | Te | Mo | I | (TC) | Ru Rh Pd |
| ६ वा आवर्त | (Rn) | Cs | Au | Ba | Hg | Tl | La+
विरल मृत्तिका |
Pb | (Hf) | Bi | Ta | (Po) | W | (At) | (Re) | Os Ir Pt |
| ७ वा आवर्त | (Fr) | (Ra) | (Ac) | Th | (Pa) | U | ||||||||||
उदा., तिसऱ्या आवर्तातील मूलद्रव्यांचे कोष्टक क्र. ३ मध्ये दिलेले गुणधर्म पहा.
मेंडेलेव्ह यांच्या सारणीत बोरॉन व ॲल्युमिनियम यांच्यानंतर तिसऱ्या गटात दोन व सिलिकॉनानंतर चवथ्या गटात एक अशा तीन जागा रिकाम्या होत्या. त्या जागी मूलद्रव्ये असणे शक्य आहे, असे भाकित त्यांनी केले होते. त्या जागांतील मूलद्रव्यांना एका (eka)- बोरॉन, एका-ॲल्युमिनियम व एका-सिलिकॉन अशी नावे त्यांनी सुचविली होती. पुढे १९०० सालापर्यंत त्या तिहींचा शोध लागला व त्यांचे गुणधर्म व अणुभारही मेंडेलेव्ह यांनी केलेल्या भाकिताशी जमले. एका-बोरॉनाला स्कँडियम, एका-ॲल्युमिनियमाला गॅलियम व एका-सिलिकॉनाला जर्मेनियम अशी नावे दिली गेली आहेत.
कोष्टक क्र. २. ७ अ गटातील मूलद्रव्यांच्या भौतिक गुणधर्माचा कल
| गुणधर्म/ मूलद्रव्य | ०से. वितळ बिंदू | ०से. उकळ बिंदू | ०से. क्रांतिक तपमान | घन पदार्थाचे वि. गु. | किकॅ./मोल सुप्त उष्णता | रूप | बाष्पाचा रंग |
| फ्ल्युओरीन | -२२० | -१८८ | -१२९ | १·३ | १·६ | वायू | फिका हिरवट – पिवळा |
| क्लोरीन | -१०२ | -३४ | १४५ | १·९ | ४·४ | वायू | हिरवट–पिवळा |
| ब्रोमीन | -७ | ५९ | ३१० | ३·४ | ७·४ | द्रव | काळसर – तांबडा |
| आयोडीन | ११४ | १८४ | ५५० | ४·९ | १०·४ | घन | जांभळा |
क्रांतिक तापमान : ज्या तापमानापेक्षा जास्त तापमानात आणि कितीही दाब वाढविला तरी एखादा पदार्थ वायुरूप अवस्थेतच रहातो ते तापमान. सुप्त उष्णता : पदार्थाचे तापमान न बदलता त्याची अवस्था बदलण्यासाठी लागणारी उष्णता (किलो कॅलरी/मोल, मोल हे रेणुभाराचे परिमाण आहे).
मेंडेलेव्ह यांच्या काळी काही मूलद्रव्यांचे अणुभार व काहींच्या संयुजाही अचूक माहीत नव्हत्या. त्यांच्या एकूण गुणधर्मांवरून त्यांचे सारणीतील स्थान कोठे असेल याचा अंदाज करून काही मूलद्रव्यांचे अणुभार व संयुजा मेंडेलेव्ह यांनी निश्चित केल्या. उदा., बेरिलियमाचा सममूल्यभार (एक भार हायड्रोजनाबरोबर संयोग पावणारा मूलद्रव्याचा भार) ४·५४ असून त्याचे अल्युमिनियमाशी बरेच साम्य आहे म्हणून ते त्रिसंयुजी असावे व त्याचा अणुभार सु. १३·९ असावा अशी कल्पना होती. मेंडेलेव्ह यांनी असे दाखवून दिले की कार्बन (१२) व नायट्रोजन (१४) यांच्यामध्ये बेरिलियमाला योग्य अशी जागा नाही. तेथे त्याला स्थान दिले, तर त्याचे गुणधर्म त्याच्या स्थानाला अनुरूप असे असणार नाहीत. पण लिथियम व बोरॉन यांच्यामध्ये असलेल्या रिकाम्या जागेत त्याला बसविता येईल. तेथे बसविल्यावर ते अर्थातच द्विसंयुजी होते म्हणून ते त्रिसंयुजी मानणे चूक होते. त्याचा त्रिसंयुजी मानून काढलेला अणुभारही चूक होता. द्विसंयुजेनुसार त्याचा अणुभार २ × ४·५४ = ९·०८ ठरतो व ते मूलद्रव्य योग्य जागी बसते.
इतर मूलद्रव्यांच्या अणुभारांचा पडताळा पाहण्यासाठीही मेंडेलेव्ह यांनी आपल्या सारणीचा उपयोग केला. उदा., इंडियम हे द्विसंयुजी आहे, अशा चुकीच्या कल्पनेमुळे त्याचा अणुभार ७५·५ अशा ठरविला होता. परंतु सारणीतील स्थानावरून ते त्रिसंयुजी असले पाहिजे व म्हणून त्याचा अणुभार ११३·४ असला पाहिजे, असे त्यांनी दाखवून दिले व पुढे या गोष्टीस दुजोरा मिळाला. तशाच पद्धतीने त्यांनी युरेनियमाचा अणुभार ११९ नसून २३८ आहे असे दाखविले.
वाढत्या अणुभारास अनुसरून मूलद्रव्यांची पहिल्या कोष्टकात दाखविल्यासारखी सारणी तयार केली म्हणजे मूलद्रव्यांच्या गुणधर्मांत आवर्तिता असते, असे एकंदरीत दिसून येते. पण तिच्यात काही उणिवा राहतातच. अणुभार कितीही अचूक मापलेला असला तरी काही मूलद्रव्ये अशी आहेत की, सारणीतील योग्य अशा जागी ती बसत नाहीत.
कोष्टक क्र. ३. तिसऱ्या आवर्तामधील मूलद्रव्यांच्या गुणधर्माचा कल
| मूलद्रव्ये | Na | Mg | Al | Si | P | S | Cl | A |
| हायड्राइडे | NaH | MgH2 | AlH3 | SiH4 | PH3 | H2S | HCl | – |
| मुख्य संयुजा | १ | २ | ३ | ४ | ३ | २ | १ | ० |
| ऑक्साइडे | Na2O | MgO | Al2O3 | SiO2 | P3O3
(P2O5) |
SO2
(SO3) |
Cl2O | – |
| ऑक्साइडाचे लक्षण | प्रबल क्षारकीय | क्षारकीय | उभयधर्मी | दुर्बल अम्लीय | अम्लीय | प्रबल | अम्लीय | – |
| वितळ बिंदू०से. | ९८ | ६५० | ६६० | १४१० | ६०० | ११९ | -१०२ | -१८९ |
| उकळ बिंदू०से. | ८८३ | ११०० | २४०० | २४८० | १००० | ४४४ | -३४ | -१८६ |
| वि.गु. | ०·९७ | १·७ | २·७ | २·४ | २·३ | २·१ | १·६ | १·४ |
| विद्युत ऋणता | विद्युत् ऋणतेमध्ये क्रमशः वाढ → | |||||||
विद्युत ऋणता : संयुजी इलेक्ट्रॉनाला आकर्षित करून धरून ठेवण्याची व ऋण विद्युत भार वाढविण्याची प्रवृत्ती
क्षारकीय : अम्लाशी विक्रिया झाल्यास लवण तयार होण्याचा गुणधर्म
उदा., केवळ अणुभारांच्या अनुक्रमाने मांडल्यास पोटॅशियम हे आरगॉनाच्या, आयोडीन हे टेल्युरियमाच्या, निकेल हे कोबाल्टाच्या व प्रोटॅक्टिनियम हे थोरियमाच्या आधी सारणीत येईल. पण अशा स्थानी मांडल्यावर त्यांचे गुणधर्म त्यांच्या स्थानाशी सुसंगत दिसत नाहीत. अशा विसंगती उद्भवण्याची कारणे पुढे विसाव्या शतकाच्या दुसऱ्या दशकात कळून आली. मूलद्रव्यांचा अणुभार व त्यांचे रासायनिक गुणधर्म यांच्यात निकट संबंध असतो यात शंका नाही. परंतु एखाद्या मूलद्रव्याचे गुणधर्म हे वस्तुतः त्यांच्या अणुक्रमांकावर, म्हणजे त्या त्या अणुकेंद्रात किती प्रोटॉन आहेत किंवा त्याच्यात किती केंद्रबाह्य इलेक्ट्रॉन आहेत, यांवर अवलंबून असतात. अणुभाराऐवजी अणुक्रमांक (अक्र.) वापरून सारणी तयार केली म्हणजे कोणत्याच विसंगती उद्भवत नाहीत. म्हणून आधुनिक आवर्त सारणीत मूलद्रव्याचे स्थान ठरविताना अणुभार न वापरता अणुक्रमांक वापरून मांडणी केली जाते.
मेंडेलेव्ह यांच्या कल्पनेस अनुसरून तयार केलेल्या सारणीत सात आवर्त व नऊ गट आहेत. हायड्रोजनाच्या अंगी विशेष गुणधर्म आहेत त्यामुळे पहिल्या आवर्तात त्याच्या शिवाय दुसरे मूलद्रव्य नाही. दुसऱ्या व तिसऱ्या आवर्तंना लघु-आवर्त म्हणतात. त्या प्रत्येकात आठ मूलद्रव्ये आहेत व त्यांना त्या त्या गटांची नमुनेदार मूलद्रव्ये असे म्हणतात. चौथ्या , पाचव्या व सहाव्या आवर्तांना दीर्घ-आवर्त म्हणतात. त्यांच्यात बरीच अधिक मूलद्रव्ये असून त्यांच्यातील १ ते ७ या गटांचे अ व ब असे दोन उपगट केलेले आहेत. उदा., पहिल्या गटातील अ उपगटात पोटॅशियम (K), रुबिडियम (Rb) व सीझियम (Cs) यांचा आणि ब उपगटात तांबे (Cu), चांदी (Ag) व सोने (Au) यांचा सामावेश होतो. सर्वांत अधिक अणुभार असणारी मूलद्रव्ये सातव्या आवर्तात आहेत व ती सर्व किरणोत्सर्गी आहेत.
मेंडेलेव्ह यांना असे दिसून आले होते की, (१) लोह, कोबाल्ट व निकेल ही मूलद्रव्यांची त्रयी किंवा (२) रुथेनियम, ऱ्होडियम व पॅलॅडियम यांची त्रयी किंवा (३) ऑस्मियम, इरिडियम व प्लॅटिनम यांची त्रयी घेतली, तर तिच्यापैकी प्रत्येक मूलद्रव्याच्या गुणधर्मांत व तिच्या शेजारच्या म्हणजे सारणीत तिच्या आधी व नंतर असणाऱ्या मूलद्रव्यांच्या गुणधर्मात जो फरक असतो, तो अल्पसाच असतो.
कोष्टक क्र. ४. बोर – टॉमसन यांची आधुनिक आवर्त सारणी
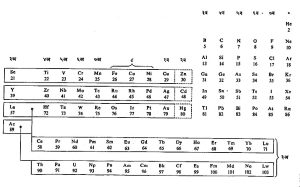
उदा., लोह, कोबाल्ट व निकेल यांचे गुणधर्म व लोहापूर्वीच्या क्रमांकाचे मँगॅनीज व निकेलाच्या नंतरच्या क्रमांकाचे तांबे यांच्या रासायनिक गुणधर्मात अनेक साम्ये आढळतात. त्याप्रमाणेच ऑस्मियम, इरिडियम व प्लॅटिनम ही मूलद्रव्ये आणि र्हीनियम व सोने यांच्या रासायनिक गुणधर्मांत साम्ये आढळतात. मेंडेलेव्ह यांनी वरील तीन त्रयींचा एक वेगळा गट केला होता व त्या मूलद्रव्यांना त्यांनी संक्रमणी मूलद्रव्ये नाव दिले होते. रासायनिक गुणधर्मांचे साम्य लक्षात घेतले, तर इतर कित्येक मूलद्रव्यांचा समावेश संक्रमणी मूलद्रव्यांत करावा लागतो व मेंडेलेव्ह यांच्या यादीत भर घालावी लागते. स्कँडियम अक्र. २१ ते जस्त अक्र. ३० यांना सामान्य संक्रमणी मूलद्रव्ये म्हणतात. इट्रियम अक्र. ३९ ते कॅडमियम अक्र. ४८ पर्यंतची त्याचप्रमाणे लॅंथॅनम अक्र. ५७ ते पारा अक्र. ८० पर्यंतची मूलद्रव्येही सामान्य संक्रमणी मूलद्रव्ये होत. लँथॅनमाच्या नंतरच्या व अक्र. ५८ असणाऱ्या सिरियमापासून तो अक्र. ७१ असणाऱ्या ल्युटेशियमापर्यंतची मूलद्रव्येही संक्रमणी आहेत. ती सर्व मिळून होणाऱ्या मूलद्रव्यांच्या मालेला लँथॅनॉने किंवा विरल मृत्तिका असे नाव दिले गेले आहे. अशाच संक्रमणी मूलद्रव्यांची आणखी एक माला ॲक्टिनियम अक्र. ८९ नंतर अक्र. १०३ पर्यंत आढळते. ती सर्व मूलद्रव्ये मिळून होणाऱ्या मालेला अक्टिनॉने किंवा अक्टिनियम माला असे नाव दिले गेले आहे. लँथॅनॉने व अक्टिनॉने या दोन्ही मालांना आंतरिक संक्रमण माला म्हणतात. या मालांच्या घटकांच्या रासायनिक गुणधर्मांच्या बाबतीतही संक्रमण झालेले आढळते.
आवर्त सारणीची मूळ कल्पना मेंडेलव्ह यांची आहे. तिच्यात मूलद्रव्यांच्या अणूंची संरचना, इलेक्ट्रॉनांची मांडणी इ. माहितीची भर घालून आधुनिक सारण्या बनविण्यात आलेल्या आहेत. अशा सारण्यांतील मूलद्रव्यांची मांडणी अर्थात वाढत्या अणुक्रमांकास अनुसरून केलेली असते. अशा सारण्यांपैकी बोर-टॉमसन यांच्या योजनेवर आधारलेली विस्तारीत आवर्त सारणी कोष्टक क्र. ४ मध्ये दिलेली आहे.
लॉरेन्सियम या १०३ अणुक्रमांकाच्या मूलद्रव्यानंतर १९६४ साली १०४ अणुक्रमांकाचे मूलद्रव्य रशियातील डूबनॉ प्रयोगशाळेतील फ्लेराव व त्यांचे सहकारी यांनी शोधून काढले. याला कुरचॅटोव्हियम हे नाव सुचविण्यात आले आहे. त्यानंतर १९७० मध्ये ए. घिओर्सो यांनी लॉरेन्स रेडिएशन प्रयोगशाळेत संशोधन करून अणुक्रमांक १०५ ह्या मूलद्रव्याचा शोध लावला व त्याला हानियम हे नाव सुचविले.
१०३ पेक्षा जास्त अणुक्रमांक असलेल्या मूलद्रव्यांना अक्टिनियमोत्तर मूलद्रव्ये म्हणतात. भारी समस्थानिकावर (अणुक्रमांक तोच पण अणुभार भिन्न असलेल्या त्या मूलद्रव्याच्या प्रकारावर) जड आयनांच्या (विद्युत् भारीत अणू, रेणू वा अणुगट यांच्या) माऱ्याने अक्टिनियमोत्तर मूलद्रव्ये बनविता येतात. आणवीय अस्थिरतेमुळे या श्रेणीतील मूलद्रव्यांची संख्या आणि गुणधर्म निश्चित करणे कठीण आहे. तथापि अणुक्रमांक १०४ ते ११८ या मूलद्रव्यांच्या रासायनिक गुणधर्मांची अटकळ शास्त्रज्ञांनी केली आहे व आवर्त सारणीतील त्यांची स्थाने अंदाजाने ठरविली आहेत. उदा., अणुक्रमांक ११८, ११९ व १२० यांची स्थाने अनुक्रमे फ्रॅन्सियम (८७), रेडियम (८८) व अक्टिनियम (८९) यांच्या खाली ठरविली आहेत. अणुक्रमांक ११४ ते १२६ या मर्यादेतील मूलद्रव्यांचे अस्तित्व आणि गुणधर्म यांविषयी शास्त्रज्ञांना फार कुतूहल आहे.
संदर्भ : 1. Abbot, D. Inorganic Chemistry, London, 1965.
2. Hicks, J. Comprehensive Chemistry, London, 1963.
कारेकर, न. वि.