आल्डिहाइडे : कार्बनी संयुगांच्या एका वर्गाचे नाव. या संयुगांत 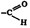 हा (आल्डिहाइडो) लाक्षणिक गट असून तो कार्बन शृंखला (अनेक कार्बन अणू एकमेकांना जोडल्याने बनलेली मालिका) अथवा वलय (मालिकेची मोकळी टोके एकमेंकास जोडल्यामुळे बनलेली रचना) यांना जोडलेला असतो. या शृंखला तृप्त किंवा अतृप्त (शृंखलेतील कार्बन अणू एकमेंकास एका बंधाने जोडलेले असतात ती तृप्तएकापेक्षा अधिक बंधांनी जोडलेली असतात ती अतृप्त होय) असू शकतात आणि वलये अरोमॅटिक , [→ अरोमॅटिक संयुगे], ॲलिसायक्लिक किंवा विषमघटकी (वलयाचा एखादा घटक कार्बनेतर अणू असलेली) यांपैकी कोणतीही असतात.
हा (आल्डिहाइडो) लाक्षणिक गट असून तो कार्बन शृंखला (अनेक कार्बन अणू एकमेकांना जोडल्याने बनलेली मालिका) अथवा वलय (मालिकेची मोकळी टोके एकमेंकास जोडल्यामुळे बनलेली रचना) यांना जोडलेला असतो. या शृंखला तृप्त किंवा अतृप्त (शृंखलेतील कार्बन अणू एकमेंकास एका बंधाने जोडलेले असतात ती तृप्तएकापेक्षा अधिक बंधांनी जोडलेली असतात ती अतृप्त होय) असू शकतात आणि वलये अरोमॅटिक , [→ अरोमॅटिक संयुगे], ॲलिसायक्लिक किंवा विषमघटकी (वलयाचा एखादा घटक कार्बनेतर अणू असलेली) यांपैकी कोणतीही असतात.
नामकरण पद्धती : एखाद्या आल्डिहाइडाचे ऑक्सिडीकरण [→ ऑक्सिडीभवन] केले असता जे अम्ल सिद्ध होईल, त्याच्या नावावरून त्या आल्डिहाइडाला नाव दिले जाते. त्याकरिता अम्लाच्या नावातील ‘इक’ हे अंत्य पद काढून त्या जागी ‘आल्डिहाइड’ हे पद ठेवतात. उदा., CH3-CH2-CHO या आल्डिहाइडापासून CH3CH2.COOH हे प्रोपिऑनिक अम्ल होते म्हणून त्या आल्डिहाइडाचे नाव प्रोपिऑनाल्डिहाइड असे बनते. आल्डिहाइडाच्या संरचनेत प्रतिष्ठापित (एक अणू किंवा अणुगट काढून त्याजागी दुसरा बसविलेला) गट असतील, तर त्यांचा उल्लेख त्यांच्या स्थानांसह केला जातो. त्याकरिता आल्डिहाइडो गटाच्या शेजारच्या कार्बन अणूपासून सुरुवात करून शृंखलेतील कार्बन अणूंचा क्रम १, २, ३ अथवाa, b, g या अक्षरांनी दाखविला जातो. उदा.,
CH3
।
HOCH2–CH2–CH–CHO याचे नाव α-मिथिल -γ-
3 2 1
α β γ हायड्रॉक्सी प्रोपिऑनाल्डिहाइड किंवा १ – मिथिल – ३ – हायड्रॉक्सी प्रोपिऑनाल्डिहाइड असे होते.
इंटरनॅशनल युनियन ऑफ प्युअर अँड ॲप्लाइड केमिस्ट्री या संस्थेने ठरविलेल्या पद्धतीने नावे देताना विशिष्ट आल्डिहाइडाचे नाव त्यातील कार्बन अणूंच्या संख्येइतके कार्बन अणू असलेल्या हायड्रोकार्बनाच्या नावावरून दिले जाते. त्याकरिता त्या हायड्रोकार्बनाच्या नावापुढे ‘आल’ हे पद जोडतात (इंग्रजी संज्ञेत हायड्रोकार्बनाच्या नावातील अंत्य e गाळून मग al हे पद लावावे लागते.) उदा., CH3CHO ह्याचे नाव, दोन कार्बन अणू असलेल्या एथेन या हायड्रोकार्बनावरून एथेनाल व CH3CH2·CHO ह्याचे, प्रोपेनावरून प्रोपेनाल असे होते. प्रतिष्ठापित गट असतील, तर त्यांचा निर्देश कार्बन अणूंना पुढीलप्रमाणे क्रमांक देऊन केला जातो.
CH3
।
HO.CH2–CH2–CH–CH2–CHO ३–मिथिल–हायड्रॉक्सी पेंटेनाल.
5 4 3 2 1
ज्याठिकाणी या पद्धतींनी सोईस्कर नाव देता येत नाही, तेथे त्या विशिष्ट आल्डिहाइडापासून बनणाऱ्या अम्लाचे नाव ‘कार्बॉक्सी’ हे अंत्य पद लावून प्रथम बनवितात व त्यावरून त्या आल्डिहाइडाचे नाव ‘कार्बॉक्स-आल्डिहाइड’ हे शब्द अंती ठेवून बनवितात. प्रतिष्ठापित गटांचा उल्लेख कार्बन अणूंना क्रमांक देऊन वरीलप्रमाणेच केला जातो. येथे ज्या कार्बन अणूला CHO गट जोडलेला असेल त्याला क्रमांक १ दिला जातो.
उदा., 
या आल्डिहाइडाचे नाव, ३-मिथिल सायक्लोपेंटेन कार्बॉक्स-आल्डिहाइड असे होते.
ॲलिफॅटिक [ → ॲलिफॅटिक संयुगे] आल्डिहाइडे आणि ॲरोमॅटिक आल्डिहाइडे असे आल्डिहाइडांचे दोन विभाग कल्पिले जातात. ज्यांच्या संरचनेत आल्डिहाइडो गट कार्बन शृंखलेला जोडलेला असतो, त्यांची गणना पहिल्या विभागात आणि ज्यांच्या संरचनेत ॲरोमॅटिक वलय आहे, त्यांची दुसऱ्या विभागात केली जाते.
उपस्थिती : अल्प रेणुभाराची (रेणूमधील अणूंच्या भारांची बेरीज) ॲलिफॅटिक आल्डिहाइडे सामान्यतः निसर्गात आढळत नाहीत पण असिटाल्डिहाइड CH3CHO हे अपवाद आहे. ते सफरचंदात असते. कॅप्रिलाल्डिहाइड C7H15CHO व पेलार्गॉनिक आल्डिहाइड C8H17CHO ही काही सुगंधी वनस्पतींच्या तेलांत सापडतात. सिट्राल
CHO
।
(CH3)2–C= CH–CH2–CH2·C=CH
।
CH3 हे अतृप्त आल्डिहाइड गवती चहाच्या तेलाचा मुख्य घटक आहे. बेंझाल्डिहाइड C6H5CHO हे कडू बदामाच्या तेलात, सिनॅमाल्डिहाइड (सिनॅमिक आल्डिहाइड) C6H5CH=CH-CHO दालचिनीच्या तेलात, व्हॅनिलीन HO-C6H5(OCH3)·CHO व्हॅनिलाच्या शेंगात व सिट्रोनेलाल
CH3–C=CH–CH2–CH2–CH–CH2–CHO
।
CH3 हे गुलाबाच्या तेलात असते. ग्लुकोज आणि तत्सम शर्करांमध्ये आल्डिहाइडो गट हायड्रॉक्सी गटांसह उपस्थित असतो.
आल्डिहाइडे सामान्यतः अल्कोहॉलांपेक्षा जास्त बाष्पनशील (उडून जाणारी) असतात म्हणून आल्डिहाइड तयार होता क्षणीच ऊर्ध्वपातनाने (तापवून व वाफ थंड करून) विक्रिया-मिश्रणातून ते वेगळे काढले म्हणजे त्यांचे अनिष्ट ऑक्सिडीभवन टळते. ऑक्सिडीकारक म्हणून मँगॅनीज डाय-ऑक्साइड किंवा पोटॅशियम डायक्रोमेट व सल्फ्यूरिक अम्ल यांचे मिश्रण वापरतात.
आल्डिहाइडे व त्यांचे गुणधर्म
|
नाव |
सूत्र |
द्रवांक° से. |
द्रवांक° से. |
|
फॉर्मालिडहाइड |
H·CHO |
-९२·० |
-२१·० |
|
ॲसिटाल्डिहाइड |
CH3·CHO |
-१२३·५ |
२१·० |
|
प्रोपिऑनाल्डिहाइड |
CH3·CH2.CHO |
-८०·० |
४९·० |
|
ब्युटिराल्डिहाइड |
CH3·CH2·CH2·CHO |
-९७·० |
७५·० |
|
व्हॅलिराल्डहाइड |
CH3·(CH2)3–CHO |
-९१·५ |
१०३·४ |
|
ॲक्रोलीन |
CH2=CH–CHO |
-८७·७ |
५१·१ |
|
क्रोटोनाल्डिहाइड |
CH3–CH=CH–CHO |
-६९·० |
१०२·१ |
|
सक्सिन डाय-आल्डिहाइड |
OHC–CH2–CH2–CHO |
…. |
१६९·१७ |
|
क्लोरल |
C·CL3–CHO |
-५७·७ |
९८·० |
|
बेंझाल्डिहाइड |
C6H3–CHO |
-५६·० |
१७९·५ |
|
सॅलिसिलाल्डिहाइड |
o–HO–C6H4–CHO |
-७·० |
१९६·५ |
|
ॲनिसाल्डिहाइड |
p–H3CO.C6H4CH |
२·५ |
२४७·८ |
|
व्हॅनिलिकाल्डिहाइड(व्हनिलीन) |
m–(H3CO)p–(HO) C6H3–CHO |
८१·८३ |
२८५·० |
|
फिनिल ॲसिटाल्डिहाइड |
C6H5CH2–CHO |
….. |
१९४·० |
|
सिनॅमिक आल्डिहाइड |
C6H5CH=CH–CHO |
-७·५ |
२५१·९ |
|
फुरफुराल |
C4H3–CHO |
-३६·५ |
१६१·७ |
|
R3CH2.OH |
(O) |
R.CHO |
+ H2O |
|
प्राथमिक अल्कोहॉल |
→ |
आल्डिहाइड |
अल्कोहॉलाचे बाष्प व हवा यांचे मिश्रण २५०० से. तापमानास सिल्व्हर ऑक्साइडावरून जाऊ दिल्यानेही ही विक्रिया घडून येते.
(२) एकमेकांशेजारच्या दोन कार्बन अणूंना जोडलेले OH गट ज्या ग्लायकॉलांच्या संरचनेत असतात, त्यांचे ऑक्सिडीकरण लेड टेट्राअसिटेटाने किंवा परआयोडिक अम्लाने केले, तर आल्डिहाइडांचे अथवा आल्डिहाइड आणि कीटोन यांचे मिश्रण मिळते.
|
i) |
R–CH–CH–R’ |
(O) |
R.CHO |
+ R’CHO |
|
| | |
→ |
आल्डिहाइडे |
||
|
OH OH |
||||
|
ग्लायकॉल |
||||
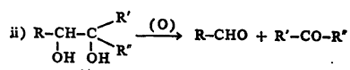
ग्लायकॉल आल्डिहाइड कीटोन
(३) ओलेफिनांचे ओझोनीकरण (ओझोन O3 याच्याशी संयोग) : R–CH = CH–R’ यासारख्या ओलेफिनाचे ओझोनीकरण केल्याने ओझोनाइड नावाचे समावेशी (इतर अणू किंवा अणुगट सामावून घेतलेले) संयुग मिळते. त्याचे जलीय विच्छेदन (पाण्याचे H व OH या विभागांच्या रूपाने संयुगात भर घालून त्याचे तुकडे करणे) किंवा हायड्रोजनीकरण (हायड्रोजन अणू रेणूत घालणे) केल्यास आल्डिहाइडे मिळू शकतात.
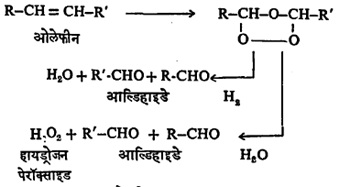
(४) प्राथमिक अल्कोहॉले २००°–३००° से. तापमानास तांबे किंवा कॉपर क्रोमेट यांच्या सान्निध्यात आणली तर त्यांचा हायड्रोजननिरास (रेणूतून हायड्रोजन अणू काढून घेणे) होतो व आल्डिहाइडे बनतात. ही पद्धत बाष्पनशील आल्डिहाइडांचे औद्योगिक उत्पादन करण्यास उपयोगी पडते. उदा.,
|
R·CH2·OH |
– |
R·CHO |
+ H2O |
|
प्राथमिक अल्कोहॉल |
आल्डिहाइड |
हायड्रोजन |
क्लोरल म्हणजे ट्रायक्लोर-असिटाल्डिहाइड C·Cl3–CHO हे प्रतिष्ठापित आल्डिहाइड एथेनॉलवर क्लोरिनाची विक्रिया केल्याने बनते. यामध्ये मिथिल गटातील तिन्ही हायड्रोजनांचे क्लोरिनाने प्रतिष्ठापन होते आणि तसेच CH2OH गटाचे ऑक्सिडीकरण होऊन CHO हा गट बनतो.
(५) उत्प्रेरकाच्या (विक्रियेमध्ये स्वत: भाग न घेता विक्रियेची गती वाढविणाऱ्या पदार्थाच्या) सान्निध्यात (कोबाल्ट ऑक्टाकार्बोनिल) उच्च दाब व उच्च तापमान वापरल्यास ओलेफिनांवर कार्बन मोनॉक्साइड व हायड्रोजन यांची विक्रिया होते व आल्डिहाइडे बनतात.

या विक्रियेला ‘हायड्रोफॉर्मायलेशन’ म्हणतात.
(६) अम्ल क्लोराइडापासून : बेरियम सल्फेटाच्या उपस्थितीत पॅलॅडियम धातू उत्प्रेरक व हायड्रोजन वायू क्षपणकारक [ → क्षपण] म्हणून वापरल्यास अम्ल क्लोराइडांचे क्षपण होऊन आल्डिहाइडे बनतात. बेरियम सल्फेटाच्या किंवा अल्प प्रमाणात क्विनोलीन व गंधक यांच्या उपस्थितीमुळे आल्डिहाइडाचे अधिक क्षपण होणे टळते.
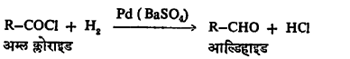
(७) ग्रीन्यार विक्रियाकारकाचा [→ ग्रीन्यार विक्रिया] उपयोग करून अल्किल ऑर्थोफॉर्मेटांपासून आल्डिहाइडे तयार करता येतात. प्रथम आल्डिहाइड, असिटालाच्या रूपात तयार होते व विरल अम्लाच्या योगाने त्याचे जलीय विच्छेदन केले म्हणजे आल्डिहाइड मिळते.

डायएथिल फॉर्मामाइडापासूनही या पद्धतीने आल्डिहाइडे मिळविता येतात.

(८) कॅल्शियम फॉर्मेट आणि त्याच वर्गातील दुसऱ्या एखाद्या अम्लाचे कॅल्शियम लवण यांच्या मिश्रणाचे उच्च तापमान देऊन विच्छेदन (रेणूचे तुकडे करणे) केले तर आल्डिहाइडे मिळतात.

यात काही उपविक्रियांमुळे आल्डिहाइडाचा उतारा कमी येतो व त्यामुळे ही पद्धत विशेष वापरीत नाहीत.
कॅल्शियम लवणांऐवजी त्या त्या अम्लाच्या वाफेचे मिश्रण ३००० से. तापमानास, मँगॅनस ऑक्साइडावरून नेल्यानेही आल्डिहाइडे बनतात.
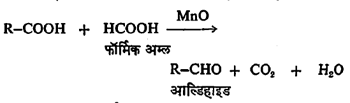
या पद्धतींशिवाय अरोमॅटिक आल्डिहाइडांच्या निर्मितीकरिता विशेष उपयोगी पडणाऱ्याही काही विक्रिया आहेत. त्या पुढे दिल्या आहेत:
(अ) बेंझीन वलयाला जोडून असलेल्या मिथिल गटातील दोन हायड्रोजन अणूंचे दोन क्लोरीन अणूंनी प्रतिष्ठापन केले म्हणजे बेंझल क्लोराइड बनते. त्याचे लोहचूर्ण या उत्प्रेरकाच्या सान्निध्यात जलीय विच्छेदन केले, तर बेंझाल्डिहाइड बनते.

(आ) मिथिल प्रतिष्ठापित बेंझिनाचे क्रोमिक अम्ल आणि असिटिक अनहायड्राइडाने ऑक्सिडीकरण केल्यानेही आल्डिहाइड बनते.

(इ) अरोमॅटिक वलयांशी (Ar) फॉर्मिलगटाचे (CHO) संयोजन करूनही अरोमॅटिक आल्डिहाइडे बनविता येतात. त्याकरिता अरोमॅटिक हायड्रोकार्बन मोनॉक्साइड व हायड्रोजन क्लोराइड यांचे मिश्रण अल्युमिनियम क्लोराइड किंवा क्यप्रस क्लोराइड या प्रवर्तकांच्या (रासायनिक विक्रियेस चालना देणाऱ्या पदार्थाच्या) सान्निध्यात तापवितात. या पद्धतीला ‘गॅटरमन-कॉख’ विक्रिया म्हणतात. झिंक सायनाइड आणि हायड्रोक्लोरिक अम्ल वापरूनही हा कार्यभाग साधतो.
ArH + Zn (CN)2 + 2HCI →
झिंक सायनाइड
H2O
ArCH=NCH=NH-ZnCl2 —–→ ArCHO आल्डिहाइड
(ई) फिनॉलिक आल्डिहाइडे बनविण्याकरिता उपयोगी पडणारी एक प्रसिद्ध विक्रिया म्हणजे रीमर-टीमान विक्रिया होय. ही विक्रिया विवक्षित फिनॉल, क्लोरोफॉर्म आणि क्षार (अल्कली) यांच्या अल्कोहॉली मिश्रणात घडून येते व फिनॉलातील OH गटाच्या ऑर्थो आणि पॅरा स्थानी CHO गट असलेली आल्डिहाइडे निर्माण होतात. फिनॉलापासून या पद्धतीने सॅलिसिल आल्डिहाइड व पॅराहायड्राक्सिबेंझाल्डिहाइड बनते.

(उ) या पद्धतींखेरीज वेगवेगळ्या संयुगांपासून सुरुवात करून इष्ट रासायनिक विक्रियांनी आल्डिहाइडे मिळविण्याच्या कृती माहीत आहेत आणि प्रसंगविशेषी आवश्यकतेप्रमाणे त्यांचा उपयोग केला जातो. उदा., अरोमॅटिक नायट्राइलांपासून ‘स्टीफन विक्रियेने’ आल्डिहाइडे बनविता येतात. हायड्रझाइडांचा, अनिलाइडांचा आणि बेंझिल हॅलाइडांचाही उपयोग या कामी होतो.यातील संबंधित विक्रिया अनुक्रमे ‘मॅकफॅजेन-स्टीव्हेंझ’, ‘सोन-म्यूलर’ आणि ‘सॉम्मेलेट’ विक्रिया म्हणून प्रसिद्ध आहेत.
औद्योगिक उत्पादनामध्ये जो कच्चा माल सुकरतेने उपलब्ध होत असेल, त्यास अनुसरून काही विशिष्ट आल्डिहाइडांकरिता उपयोगी पडतील अशा विशेष पद्धतीही सिद्ध केल्या गेल्या आहेत. उदा., नैसर्गिक वायू (खनिज इंधन वायू), मिथेन व इतर हायड्रोकार्बने यांपासून ऑक्सिडीकरणाने फॉर्माल्डिहाइड बनवितात. ब्युटेनाच्या ऑक्सिडिकरणाने किंवा असिटिलिनापासून मर्क्युरस सल्फेट व सल्फ्यूरिक अम्ल यांच्या विक्रियेने उद्योगधंद्यांत वापरण्यासाठी मोठ्या प्रमाणावर असिटाल्डिहाइड बनविले जाते [ → असिटाल्डिहाइड].
भौतिक गुणधर्म : या वर्गातील फॉर्माल्डिहाइड व असिटाल्डि हाइड ही संयुगे वायुरूप आहेत. बाकीची सर्व द्रव अथवा घनरूप आहेत. चारपर्यंत कार्बन अणू असलेली आल्डिहाइडे पाण्यात विद्राव्य (विरघळणारी) असून पाच किंवा त्यापेक्षा जास्त कार्बन अणू असलेली आल्डिहाइडे उत्तरोत्तर जास्त अविद्राव्य होत जातात. अल्कोहॉल, ईथर इ. कार्बनी विद्रावकांत ती विरघळतात. पाच ते सात कार्बन अणू असलेल्या अलिफँटिक आल्डिहाइडांना तिखट दुर्गंध येतो परंतु आठ ते चौदा कार्बन अणूंची आल्डिहाइडे सुवासिक असून त्यांचा उपयोग सुगंधी द्रव्ये म्हणून होतो. अरोमॅटिक आल्डिहाइडे सामान्यतः सुवासिक असतात.
रासायनिक गुणधर्म : आल्डिहाइडांच्या संरचनेत कार्बोनिल गट 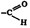 असल्यामुळे ती अत्यंत विक्रियाशील आहेत. ऑक्सिडीकरण, क्षपण व अनेक तर्हेच्या संघनन (सारखे अथा भिन्न रेणू रासायनिक विक्रियेने जोडले जाऊन पाणी, अल्कोहॉल वा तत्सम द्रव्यांचे रेणू तयार होणे) आणि समावेशन (अणू अथवा अणुगट रेणूत सामावून घेणे) विक्रिया यांमध्ये ती भाग घेतात. आल्डिहाइडांचे बहुवारिकीकरणही (एकाच पदार्थाचे अनेक रेणू एकत्र येऊन मोठा रेणू बनणे) होते.
असल्यामुळे ती अत्यंत विक्रियाशील आहेत. ऑक्सिडीकरण, क्षपण व अनेक तर्हेच्या संघनन (सारखे अथा भिन्न रेणू रासायनिक विक्रियेने जोडले जाऊन पाणी, अल्कोहॉल वा तत्सम द्रव्यांचे रेणू तयार होणे) आणि समावेशन (अणू अथवा अणुगट रेणूत सामावून घेणे) विक्रिया यांमध्ये ती भाग घेतात. आल्डिहाइडांचे बहुवारिकीकरणही (एकाच पदार्थाचे अनेक रेणू एकत्र येऊन मोठा रेणू बनणे) होते.
(१) ऑक्सिडीकरण : आल्डिहाइडांचे आक्सिडीकरण होऊन अम्ले बनतात. या विक्रियेचा उपयोग कार्बनी अम्ले बनविण्याकरिता केला जातो.
ऑक्सिडीकारक म्हणून हवेचा उपयोग करून व उत्प्रेरक वापरून बाष्पावस्थेत किंवा क्रोमिक अम्लाचा उपयोग करून द्रवावस्थेत ही विक्रिया घडवू न आणता येते.
‘टोलेन्स विक्रियाकारक’ (अमोनियात विद्रुत म्हणजे विरघळलेले सिल्व्हर ऑक्साइड) व ‘फेलिंग विक्रियाकारक’ (क्षार विद्रावातील क्यूप्रिक ऑक्साइड) हे अत्यंत सौम्य ऑक्सिडीकारक आहेत. ते अतृप्त आल्डिहाइडे किंवा ऑक्सिडीकरण होईल असे गट ज्यांमध्ये आहेत अशा आल्डिहाइडांच्या कार्बोनिल गटाचेच ऑक्सिडीकरण करतात.
(२) क्षपण : (अ) प्लॅटिनम किंवा रॅने निकेल यांच्या उपस्थितीत हायड्रोजन वापरून क्षपणक्रिया केल्यास आल्डिहाइडांपासून प्राथमिक अल्कोहॉले मिळतात.

(आ) अल्युमिनियम आयसोप्रोपॉक्साइडाने (मीरविन-पाँडोर्फव्हेलें विक्रिया) क्षपण केल्यास अतृप्त आल्डिहाइडांपासून अतृप्त अल्कोहॉले मिळविता येतात.
(इ) वोल्फ-किश्नर क्षपणक्रियेने आल्डिहाइडांपासून हायड्रोकार्बने तयार होतात. या विक्रियेकरिता संबंधित आल्डिहाइडे, हायड्रॅझिनाचा जलविद्राव, सोडियम हायड्राक्साइड आणि उच्च तापमानास उकळणारा डायएथिलिन ग्लायकॉल किंवा तत्सम विद्रावक यांचे मिश्रण तापवितात.
(ई) ज्या आल्डिहाइडांमध्ये गटाशेजारच्या कार्बन अणूला (a स्थानी) जोडून हायड्रोजन अणू जोडलेला नसतो. (उदा., बेंझाल्डिहाइड) अशा आल्डिहाइडांवर सोडियम हायड्राक्साइडाची किंवा दुसऱ्या प्रबल क्षाराची विक्रिया होते व एकाच रेणूचे क्षपण व दुसऱ्याचे ऑक्सिडीकरण एकाच वेळ घडून येते. या विक्रियेला ‘कान्नीद्झारो विक्रिया’ म्हणतात.
|
2C6H5CHO |
NaOH |
C6H5COONa |
+ |
C6H5CH2OH |
|
→ |
||||
|
बेंझाल्डिहाइड |
सोडियम बेंझोएट |
बेंझिल अल्कोहॉल |
(उ) बेंझाल्डिहाइडाचे दोन रेणू घेण्याऐवजी जर त्याच एक रेणू व फॉर्माल्डिहाइडाचा एक रेणू असे मिश्रण वापरले तर बेंझिल अल्कोहॉल व सोडियम फॉर्मेट बनते. म्हणजेच येथे बेंझाल्डिहाइडाचे फक्त क्षपण व फॉर्माल्डिहाइडाचे फक्त ऑक्सिडीकरण होते. हा विक्रिया प्रकार ‘विवेचक कान्नीद्झारो विक्रिया’ म्हणून प्रसिद्ध आहे.
|
NaOH |
||||||
|
C6H5CHO |
+ |
HCHO |
→ |
|||
|
बेंझाल्डिहाइड |
फॉर्माल्डिहाइड |
|||||
|
C6H5CH2OH |
+ |
HCOONa |
||||
|
बेंझिल अल्कोहॉल |
सोडियम फॉर्मेट |
|||||
(ऊ) अल्यमिनियम अल्कॉक्साइडांच्या उत्प्रेरक क्रियेने आल्डिहाइडाच्या दोन रेणूंपासून एस्टराचा एक रेणू मिळतो. येथेही एका रेणूचे ऑक्सिडिकरण व दुसऱ्याचे क्षपण घडून येते आणि त्यामुळे बनलेल्या अल्कोहॉल व अम्ल यांचा संयोग होऊन एस्टर बनते. या विक्रियेला ‘टिशूशेंको विक्रिया’ म्हणतात.
कान्नीद्झारो विक्रिया a – स्थानी हायड्रोजन नसलेल्या आल्डिहाइडांवरच घडते तसे बंधन या विक्रियेत नाही. त्यामुळे असिटाल्डिहाइडापासून या विक्रियेने एथिल असिटेट बनविता येते.
(३) संघनन विक्रिया : (अ) अल्कोहॉलांच्या विक्रियेने आल्डिहाइडांपासून प्रथम सेमी-असिटाले आणि शेवटी असिटाले तयार होतात. उदा.,
असिटालांपासून अम्लीय (अम्लाच्या साहाय्याने) जलीय विच्छेदनाने आल्डिहाइडे परत मिळविता येतात.
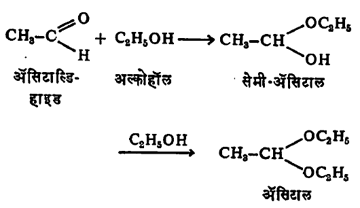
आल्डिहाइडापेक्षा असिटाले जास्त स्थिर असल्यामुळे एखाद्या क्षारीय विक्रियेत किंवा ऑक्सिडीकरणात आल्डिहाइडावर विक्रिया होण्याची जर भीती असेल, तर त्याचे प्रथम असिटालात रूपांतर करतात व इष्ट विक्रिया घडवून आणल्यावर अम्लाच्या विक्रियेने आल्डिहाइड परत मिळवितात.
(आ) थायो-अल्कोहॉलांबरोबर विक्रिया केल्याने मरकॅप्टॉले बनतात.

(इ) आल्डिहाइडे आणि प्राथमिक अमाइने यांपासून अनिले मिळतात.
|
R-CHO |
+ |
R’NH2 |
→ |
R-CH=NR’ |
+ |
H2O |
|
आल्डिहाइड |
प्राथमिक अमाइन |
अनिल |
अरोमॅटिक अमाइनांपासून मिळणार्या अनिलांना ‘शिफ क्षारके’ असे म्हणतात. या वर्गाच्या अनेक संयुगांचा उपयोग प्रतिऑक्सिडीकारके (ऑक्सिडीकरणास विरोध करणारी संयुगे) म्हणून आणि रबर उद्योगात विक्रियांचा वेग वाढविण्यासाठी होतो.
(ई) फॉस्फरस पेंटाक्लोराइडाबरोबर विक्रिया होऊन डायक्लोराइडे मिळतात.
|
R-CHO |
+ |
PCI5 |
– |
R-CH – Cl2 |
+ |
POCI3 |
|
आल्डिहाइड |
फॉस्फरस पेंटाक्लोराइड |
डायक्लोराइड |
फॉस्फरस ऑक्सिक्लोराइड |
(उ) पर्किन विक्रिया : या विक्रियेने अरोमॅटिक आल्डिहाइडे आणि कार्बनी अम्ल अनहायड्राइडे यांचा संयोग होऊन a, b-अतृप्त (संरचनेत द्विबंध किंवा त्रिबंध असलेली) कार्बनी अम्ले मिळतात.
(ऊ) अरोमॅटिक आल्डिहाइडांचा एस्टरांबरोबरही संयोग होतो व a, b-अतृप्त एस्टरे बनतात. या विक्रियेला ‘क्लायसेन संघनन’ म्हणतात.
(ए) ग्रीन्यार विक्रिया: आल्डिहाइडे आणि ग्रीन्यार विक्रियाकारक यांचा संयोग होऊन प्रथम जटिल संयुगे तयार होतात व त्यांच्या जलीय विच्छेदनाने द्वितीयक अल्कोहॉले मिळतात.
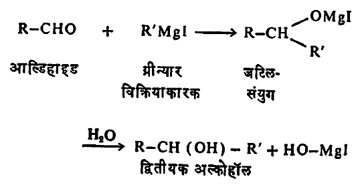
फॉर्माल्डिहाइडापासून मात्र या विक्रियेने प्राथमिक अल्कोहॉले मिळतात.
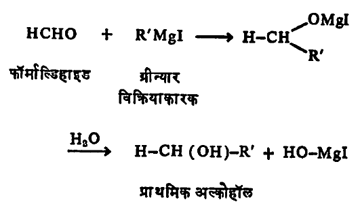
(ऐ) आल्डिहाइडे आणि हायड्रॉक्सिल अमाइन (NH2OH) यांची विक्रिया होऊन ऑक्झाइमे बनतात.
|
R-CHO |
+ |
NH2OH |
→ |
R-CH=NOH |
+ |
H2O |
|
आल्डिहाइड |
हायड्रॉक्सिल अमाइन |
ऑक्झाइम |
(ओ) त्याचप्रमाणे हायड्रॅझीन NH2-NH2 याच्याशी विक्रिया होऊन हायड्रोझोन नामक संयुगे मिळतात.
|
R-CHO |
+ |
NH2-NH2 |
→ |
R-CH=N-NH2 |
+ |
H2O |
|
आल्डिहाइड |
हायड्रॅझीन |
हायड्राझोन |
इतरत्र उल्लेख केलेल्या वोल्फ-किश्नर क्षपणक्रियेत आल्डिहाइडाचा प्रथम हायड्राझोन बनतो व त्याचे क्षपण होऊन हायड्रोकार्बन बनते.
|
R-CHO |
→ |
R-CH=N-NH2 |
→ |
R-CH3 |
+ |
N2 |
|
आल्डिहाइड |
हायड्रॅझोन |
हायड्रोकार्बन |
(औ) आल्डिहाइडाची फिनिल हायड्रॅझीन C6H5NH-NH2 या विक्रियाकारकाबरोबर विक्रिया होऊन फिनिल हायड्रोझोने बनतात.
|
R-CHO + C6H5NH-NH2 |
→ |
R-CH=N-NH-C6H5 |
|
आल्डिहाइड फिनिल हायड्रॅझीन |
फिनिल हायड्रॅझोन |
(अं) सेमीकार्बझाइड H2N-CO-NH-NH2 याबरोबर विक्रिया होऊन सेमीकार्बझोन संयुगे मिळतात.
|
R-CHO |
+ |
H2N-CO-NH-NH2 → |
||
|
आल्डिहाइड |
सेमीकार्बझाइड |
|||
|
R-CH=N-CO-NH-NH2 + H2O |
||||
|
सेमीकार्बझाइड |
||||
(अः) अल्डॉल संघनन: आल्डिहाइडांच्या दोन रेणूंमध्ये विक्रिया होऊन हायड्रॉक्सी आल्डिहाइडे (अल्डॉले) बनतात. ही विक्रिया दाहक सोडा इ. क्षारीय संयुगांनी उत्प्रेरित होते. उदा.,
CH3-CHO + CH3-CHO→CH3CH-(OH)-CH2-CHO
ॲसिटाल्डिहाइड अल्डॉल
दोन वेगवेगळ्या आल्डिहाइडांच्या रेणूंमध्येही अशी विक्रिया होऊ शकते व दोन वेगळी अल्डॉले तयार होतात.

(क) बेंझॉइन संघनन : अरोमॅटिक आल्डिहाइडाचे दोन रेणू क्षार सायनाइड उत्प्रेरकाच्या उपस्थितीत संयोग पावतात व a-हायड्रॉक्सी कीटोने बनवितात. उदा.,
|
OH |
||
|
NaCN |
| |
|
|
C6H5CHO + C6H5CHO |
→ |
C6H5CH-CO-C6H5 |
|
बेंझाल्डिहाइड |
बेंझॉइन |
(ख) दोन आल्डिहाइडांपैकी एक जर अरोमॅटिक आल्डिहाइड असेल, तर सोडियम हायड्रॉक्साइड हा उत्प्रेरक वापरून a, b-अतृप्त आल्डिहाइड बनविता येते. उदा.,
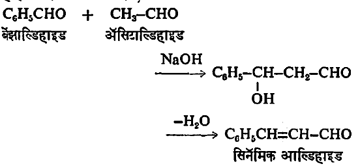
या विक्रियेला क्लायसेन श्मिट विक्रिया म्हणतात.
प्रथमतःच अल्डॉल घेऊन व त्याचे निर्जलीकरण करूनही a, b-अतृप्त आल्डिहाइडे तयार करता येतात.
(४) समावेशन विक्रिया : (अ) सोडियम बायसल्फाइटाबरोबर समावेशन होऊन स्फटिकी संयुगे मिळतात.
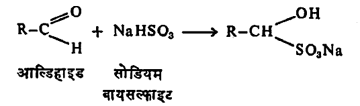
आल्डिहाइडे इतर संयुगांपासून वेगळी करण्याकरिता आणि शुद्ध रूपात मिळविण्या-करिता या विक्रियेचा उपयोग होतो.
(आ) हायड्रोजन सायनाइडाच्या विक्रियेने सायनोहायड्रीन नामक समावेशी संयुगे बनतात.
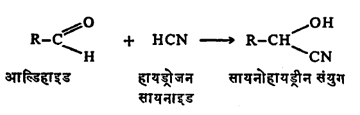
वरील बायसल्फाइट समावेशी संयुगावर सोडियम सायनाइडाची विक्रिया केल्यानेही ते बनतात.
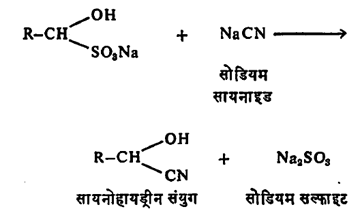
सायनोहायड्रिनांचे जलीय विच्छेदन केल्यास a- हायड्रॉक्सी अम्ले बनतात व त्यांचे निर्जलीकरण केल्या a, b-अतृप्त अम्ले सिद्ध होतात. उदा.,

आर्द्र सिल्व्हर ऑक्साइडाच्या विक्रियेने सायनोहायड्रिनांपासून आल्डिहाइडे परत मिळविता येतात.
(इ) क्रियाशील (रासायनिक विक्रियेत भाग घेऊ शकणारा) मिथिलीन गट (CH2) ज्यांच्या संरचनेत आहे अशा म्हणजे मॅलोनिक एस्टर, असिटो-असिटिक एस्टर इ. संयुगांशी, क्षारक (अम्लाशी विक्रिया झाल्यास लवणे देणाऱ्या) उत्प्रेरकांच्या सान्निध्यात आल्डिहाइडांची विक्रिया होते. यांपासून बनणारी संयुगे अनेक संश्लेषणामध्ये मध्यस्थ (अंतिम संयुग मिळण्याच्या मार्गातील एक टप्पा) म्हणून उपयोगी पडतात.
(५) बहुवारिकीकरण : फॉर्माल्डिहाइड आणि असिटाल्डिहाइड यांची अनेक बहुवारिके बनतात. पॅराफॉर्माल्डिहाइड

संयुगे फॉर्माल्डिहाइडांची बहुवारिके आहेत. असिटाल्डिहाइडाच्या अनुक्रमे ३ व ४ रेणूंपासून पॅराआल्डिहाइड व मेटाआल्डिहाइड ही बहुवारिके बनतात.

आल्डिहाइडांचे परीक्षण : एखादे कार्बनी संयुग आल्डिहाइड वर्गातील आहे की काय हे ओळखण्याकरिता प्रारंभी वर्णन केलेली टोलेन्स विक्रियाकारकाबरोबर होणारी विक्रिया उपयोगी पडते. या विक्रियेने चांदीचा जो अवक्षेप (साका) मिळतो तो परीक्षानळीच्या पृष्ठभागावर बसून त्याला आरशासारखा चकचकीत बनवितो म्हणून याला चांदीच्या आरशाची परीक्षा असेही म्हणतात. फेलिंग विद्रावाबरोबर आल्डिहाइडे तांबूस रंगाचा अवक्षेप निर्माण करतात. याशिवाय सल्फर डाय-ऑक्साइडाने विरंजित (वर्णहीन) केलेला मॅजिंटा (मंजिष्ठ) रंगाचा विद्राव (शिफ विक्रियाकारक) आल्डिहाइडे पुन्हा रंगीत करतात.
सोडियम बायसल्फाइटाच्या संतृप्त (जास्तीत जास्त जितका पदार्थ विरघळणे शक्य आहे तितका विरघळलेला असलेल्या) विद्रावाबरोबर स्फटिकी लवणे बनविण्याचा आल्डिहाइडांचा गुणही परीक्षणाकरिता उपयोगी पडतो.
वर्ग निश्चित केल्यावर संबंधित संयुग नक्की कोणते आल्डिहाइड आहे हे ठरविण्याकरिता ऑक्झाइमे, फिनिल हायड्राझोने किंवा सेमीकार्बझोने हे अनुजात (साध्या रासायनिक विक्रियेने तयार होणारे संयुग) उपयोगी पडतात. त्यांचे द्रवांक काढले म्हणजे त्यावरून विवक्षित आल्डिहाइड निश्चित करता येते.
याशिवाय पोटॅशियम परमॅंगॅनेट किंवा हायड्रोजन पेरॉक्साइड इ. ऑक्सिडीकारकांनी आल्डिहाइडांचे अम्लांत रूपांतर करून त्या अम्लांपासून फिनासिल एस्टरे, अमाइडे किंवा अनिलाइडे इ. अनुजात बनविले व त्यांचे द्रवांक काढले, तर त्यावरून ज्ञात आल्डिहाइडे ओळखता येतात.
उपयोग : फिनॉल-फॉर्माल्डिहाइड, यूरिया-फॉर्माल्डिहाइड व मेलामाइन-फॉर्माल्डिहाइड या नावांनी प्रसिद्ध असलेल्या प्लॅस्टिकांच्या उत्पादनात फॉर्माल्डिहाइड वापरले जाते. क्लोरल या आल्डिहाइडाचा उपयोग डीडीटी हे कीटकनाशक तयार करण्याकरिता होतो. काही आल्डिहाइडे सुगंधी द्रव्ये म्हणून वापरतात व काहींचा उपयोग अम्ले, रंग इत्यादींच्या उत्पादनात होतो.
पहा : ॲसिटाल्डिहाइड, फॉर्माल्डिहाइड
संदर्भ: 1. Fieser, L. F. Fieser, M., Organic Chemistry, Bombay, 1962.
2. Finar, I. L., Organic Chemistry, London, 1962.
ठकार, क. अ.
“