ओझोन : ऑक्सिजन या मूलद्रव्याचे उच्च ऊर्जा असलेले एक बहुरूप (एकाच मूलद्रव्याच्या त्याच अवस्थेतील भिन्न रूपांपैकी एक). रासायनिक सूत्र O3. वायुरूपात ऑक्सिजनाच्या प्रत्येक रेणूत दोन अणू असतात, तर वायुरूपातील ओझोनाच्या प्रत्येक रेणूत तीन अणू असतात. ओझोन वायूचा वर्ण निळा असतो पण द्रव व घन स्थितीत तो अपारदर्शक व शाईसारखा निळाकाळा दिसतो.
एम्. व्हॅन मारुम यांना १७८५ मध्ये विद्युत् यंत्रांच्याजवळ विशिष्ट प्रकारचा वास येतो असे प्रथम आढळले. १८४० मध्ये सी. एफ्. शोएनबाइन यांनी तो वास एक नवीन वायूमुळे येतो हे सिद्ध केले व Ozein म्हणजे वास येणे या ग्रीक शब्दावरून त्याला ओझोन हे नाव दिले. १८७२ मध्ये बी. ब्रॉडी यांनी ओझोनाचा रेणू ऑक्सिजनाचे तीन अणू एकत्र येऊन बनलेला असतो असे सिद्ध केले.
उपस्थिती : पृथ्वीच्या वातावरणात ओझोन निरनिराळ्या प्रमाणांत आढळतो. पृथ्वीच्या पृष्ठाजवळ ग्रामीण भागात त्याचे प्रमाण हवेच्या आकारमानाच्या ०·०२ – ०·०३ दशलक्षांश एवढे असते. शहरी भागात त्याहून कमी असते पण दाट धुक्याच्या वातावरणात ते वाढते. समुद्रकिनारी ओझोनाचे प्रमाण बरेच असते. २१ किमी. उंचीवरील वातावरणात जंबुपार किरणांच्या (सूर्यप्रकाशाच्या वर्णपटातील जांभळ्या वर्णाच्या पलीकडे असलेल्या अदृश्य किरणांच्या) ऑक्सिजनावरील क्रियेने ओझोन तयार होतो. २१ ते २६ किमी. या स्थितांबर भागात त्याचे प्रमाण फार मोठे असते. म्हणून त्या भागाला ‘ओझोनाचा पट्टा’ असे म्हणतात. कमी तरंगलांबी असलेल्या किरणांचे ऑक्सिजनाकडून शोषण होऊन ओझोन तयार होतो. त्यामुळे त्या किरणांपासून पृथ्वीवरील जीवसृष्टीचा बचाव होतो.
निर्मिती : निःशब्द विद्युत् विसर्जन (आवाज न होता विजेचे विसर्जन करण्याच्या) पद्धतीने मोठ्या प्रमाणात ओझोन तयार करतात. यामध्ये उच्च विद्युत् दाब असलेल्या प्रत्यावर्ती (उलट सुलट दिशेने वाहणाऱ्या) विद्युत् प्रवाहाच्या विद्युत् विसर्जनातून वायुरूप ऑक्सिजन किंवा हवा यांचा प्रवाह जाऊ देतात. प्रथम ऑक्सिजनाचे अणू तयार होतात. त्यांपैकी काही अणू ऑक्सिजनाच्या रेणूशी एकजीव होऊन ओझोन बनतो.
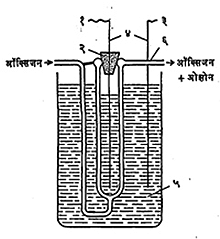
ओझोन तयार करण्यासाठी वापरावयाची उपकरणे : (१) एकमेकींत बसणाऱ्या समकेंद्रीय नलिकांची व (२) एकमेकांशेजारी असणाऱ्या पत्र्यांऱ्याच्या रचनेची असतात. या उपकरणांपासून मिळणाऱ्या वायूत ओझोन १ – १०% (वजनी) असतो. कोरडी हवा किंवा कोरडा ऑक्सिजन वापरून, प्रशीतन करून (तापमान कमी करून) वातावरणीय दाबापेक्षा थोडा जास्त दाब वापरून व विद्युत् विसर्जनाचा वेग वाढवून ओझोन जास्त प्रमाणात मिळविता येतो.
गुणधर्म व उपयोग : रेणुभार ४८, सापेक्ष घनता (हवा = १) १·६५८, उकळबिंदू – ११२० से., वितळबिंदू – १९३० से. (घन स्थितीत), वायू स्थितीत घनता (०० से. ला, १ वातावरणीय दाबास) २·१५४ ग्रॅ. / लि., द्रव स्थितीत (-१११·९०से. ला) १·३५४ ग्रॅ. /मिलि., (-१८३० से. ला) १·५७३ ग्रॅ. /मिलि. पाण्यात थोडा विद्राव्य (विरघळतो). टर्पेंटाइन, दालचिनी तेल इ. बाष्पनशील (उडून जाणाऱ्या) तेलांत जास्त प्रमाणात विद्राव्य. द्रव स्थितीत स्फोटक असतो.
विद्युत् उपकरणांत ठिणगी पडल्यास हवेत ओझोन तयार होतो. त्यामुळे बऱ्याच लोकांना ओझोनाचा उग्र वास परिचित आहे. ओझोनामुळे श्लेष्मल त्वचेचा (नाजूक त्वचेचा) क्षोभ होतो. मानव व इतर प्राण्यांना तो अपायकारक आहे. हवेत ओझोनाचे प्रमाण ०·१ दशलक्षांशापेक्षा जास्त असले तर फार वेळ त्या हवेत श्वासोच्छ्वास करणे धोक्याचे आहे.
शुद्ध ओझोन किंवा जास्त प्रमाणात ओझोन असलेले ओझोनऑक्सिजन मिश्रण यात ठिणगी पडल्यास किंवा त्यास अन्य प्रकारे उत्तेजन मिळाल्यास स्फोट होतो. ही विक्रिया ओझोन, वायू किंवा द्रव स्थितीत असेल तरीही होते.
तापमान -१७९·९० से. पेक्षा जास्त असेल, तर द्रव ओझोन व द्रव ऑक्सिजन एकमेकांत कोणत्याही प्रमाणात मिसळतात.
ओझोन ऑक्सिजनापेक्षा प्रबल ऑक्सिडीकारक (एखाद्या पदार्थात ऑक्सिजनाचा समावेश करणारा म्हणजे ऑक्सिडीकरण करण्यास मदत करणारा पदार्थ) आहे. त्यामुळे त्याने ऑक्सिडीकरण केले, तर जास्त उष्णता निर्माण होते व ओझोनाने ऑक्सिजनापेक्षा कमी तापमानाला ऑक्सिडीकरण सुरू होते.
क्लोरिनापेक्षा ओझोनाने पाणी जलद जंतुविरहित होते. दूषित पाण्याला दुर्गंध व मचुळपणा देणाऱ्या पदार्थांचे ऑक्सिडीकरणही त्याने लवकर होते. या गुणधर्माचा उपयोग लक्षात घेऊन पाश्चात्त्य देशांत पाणी शुद्धीकरणासाठी ओझोन वापरतात. हायड्रोजन पेरॉक्साइड, क्लोरीन व सफ्लर डाय-ऑक्साइडापेक्षा जलयुक्त ओझोनाने पाण्याच्या उपस्थितीत विरंजन (रंग नाहीसा करण्याची क्रिया) जलद होते.
शीतगृहाच्या हवेत १-३ दशलक्षांश भाग ओझोन ठेवल्यास अन्नपदार्थांवर बुरशी धरण्यास व जंतूंच्या अनिष्ट क्रियांस विरोध होतो.
अतृप्त कार्बनी संयुगातील (ज्याच्या संरचनेतील कार्बन अणू एकमेकांस एकापेक्षा जास्त बंधांनी जोडलेले असतात अशा संयुगातील) द्विबंधावर अगर त्रिबंधावर ओझोनाची विक्रिया -१००० से. इतक्या कमी तापमानासही होते व ओझोनाइडे (कार्बनी संयुगातील द्विसंघाला ओझोन रेणू जोडल्याने तयार होणारी स्फोटक कार्बनी संयुगे) तयार होतात. या ओझोनाइडांपासून जलीय विच्छेदनाने (पाण्याच्या विक्रियेने घटक सुटे होण्याने), ऑक्सिडीकरणाने, ⇨क्षपणाने किंवा ऊष्मीय अपघटनाने मुख्यतः आल्डिहाइडे, कीटोने किंवा कार्बोक्सिलिक अम्ले मिळतात.
हवेतील ओझोनामुळे रबरावर अनिष्ट परिणाम होतो. टायर इ. रबरी वस्तूंना तडे जातात. त्यामुळे रबरी वस्तू बनविताना त्यात प्रतिऑक्सिडीकारक (ऑक्सिडीकरणास विरोध करणाऱ्या) पदार्थांचा समावेश करावा लागतो. ओझोन-प्रतिकारी संश्लेषित (घटक द्रव्यांपासून कृत्रिम रीतीने बनविलेली) रबरेही साध्य झाली आहेत.
बरीच ओझोनाइडे स्फोटक असल्याने ओझोनीकरण (ओझोनाचा समावेश करण्याची क्रिया) करताना खबरदारी घ्यावी लागते. ओझोनीय विच्छेदन (ओझोनाच्या क्रियेने रेणूचे तुकडे पाडणे) ही विक्रिया ॲझेलाइक अम्ल, कॉर्टिसोनासारखी औषधे व संश्लेषित लिंग हॉर्मोने तयार करताना वापरतात. ॲझेलाइक अम्लांच्या ⇨एस्टरीकरणाने एक प्रकारचे प्लॅस्टिसायझर (प्लॅस्टिक पदार्थांचे लवचिकपणा इ. गुणधर्म सुधारण्याकरिता त्यांत घालण्यात येणारा पदार्थ) तयार होते.
अभिज्ञान : ओझोन व पोटॅशियम आयोडाइड यांची विक्रिया होऊन आयोडीन मिळते. ओझोन-ऑक्सिजनाचे मिश्रण पोटॅशियम आयोडाइडाच्या उदासीन (अम्लीय वा क्षारकीय म्हणजे अम्लाशी विक्रिया होऊन लवणे देण्याचा गुणधर्म नसणाऱ्या) विद्रावात मिसळले, तर मुक्त झालेल्या आयोडिनावरून ओझोनाचे अस्तित्व सिद्ध करता येते.
संदर्भ : Partington, J. R. General and Inorganic Chemistry, London, 1966.
जमदाडे, ज. वि.
“