एस्टरे : रासायनिक संयुगांचा एक वर्ग. कार्बनी अथवा अकार्बनी अम्लातील अम्लीय हायड्रोजनाच्या जागी ॲलिफॅटिक (CH3, C2H5 अशा स्वरूपाचे) ॲरोमॅटिक (C6H5 अशा वलयी स्वरूपाचे) किंवा विषमवलयी (कार्बन व हायड्रोजन अणू आणि नायट्रोजन, गंधक किंवा ऑक्सिजन यांपैकी एखादा अणू यांनी बनलेले वलय असलेला) मूलक (विक्रियांमध्ये तसाच रहाणारा परंतु सामान्यत: वेगळे अस्तित्व नसणारा अणूंचा गट) घातले म्हणजे या संयुगाचे रासायनिक सूत्र तयार होते. अल्कोहॉले किंवा फिनॉले यांचा अम्लांशी किंवा त्यांच्या योग्य अनुजाताशी (एखाद्या संयुगापासून तयार केलेल्या दुसऱ्या संयुगाशी) रासायनिक संयोग केल्यास ही संयुगे बनतात. अम्लाशी संयोग होताना सामान्यत: अम्लातील अम्लीय हायड्रोजन व अल्कोहॉल किंवा फिनॉल यांतील हायड्रॉक्सिल गट (OH) यापासून पाण्याचा रेणू बनून तो बाहेर पडतो. परंतु अम्ल जर कार्बॉक्सिलिक श्रेणीचे (ज्यांच्या घटनेत COOH गट असतो अशा) असेल, तर त्यातील हायड्रॉक्सिल गट व अल्कोहॉल किंवा फिनॉल यांतील हायड्रोजन अणू यांच्या संयोगाने पाण्याचा रेणू बनतो असे दिसून आले आहे.
|
HX |
+ |
R.OH |
= |
RX |
+ |
H2O |
|
अम्ल |
अल्कोहॉल अथवा फिनॉल |
एस्टर |
पाणी |
येथे X = CI, NO3, HSO4 इ. R = अल्किल अथवा अरिल गट.
|
HX |
+ |
R.OH |
= |
RX |
+ |
H2O |
|
अम्ल |
अल्कोहॉल अथवा फिनॉल |
एस्टर |
पाणी |
येथे X = CI, NO3, HSO4 इ. R = अल्किल अथवा अरिल गट.
|
R-COOH |
+ |
R’ OH |
= |
R.COOR’ |
+ |
H2O |
|
कार्बॉक्सिलिक अम्ल |
अल्कोहॉल अथवा फिनॉल |
एस्टर |
पाणी |
येथे R’ व R = अल्किल अथवा अरिल गट.
नैसर्गिक पदार्थात कित्येक एस्टरे आढळतात. उदा., अनेक फळाफुलांचे सुवास व स्वाद त्यांमध्ये असणाऱ्या कमी रेणुभाराच्या बाष्पनशील (बाष्परूपाने उडून जाणाऱ्या) एस्टरांमुळे आलेले असतात. वनस्पतिज व प्राणिज तेले व चरब्या या वसाम्ले आणि ग्लिसरीन (तीन हायड्रॉक्सिल गट असलेले एक अल्कोहॉल) यांपासून झालेली एस्टरे होत. मेणांमध्ये सामान्यत: उच्च रेणुभाराची ॲलिफॅटिक अल्कोहॉले किंवा स्टिरॉल श्रेणीची अल्कोहॉले आणि वसाम्ले यांच्या एस्टरांचा भरणा असतो.
नामकरण : एखाद्या एस्टराचे जलीय विच्छेदन केले (पाण्याच्या विक्रियेने घटक सुटे केले) म्हणजे अम्ल आणि अल्कोहॉल (अथवा फिनॉल) हे त्याचे घटक वेगळे होतात. त्यांच्या नावांचा उपयोग एस्टरांच्या नामकरणासाठी केला जातो. ज्या एस्टरापासून ॲसिटिक अम्ल मिळते त्याच्या नावात ॲसिटेट हे पद व ज्यांच्यापासून बेंझॉइक अम्ल मिळते त्यांच्या नावात बेंझोएट हे पद शेवटी असते. संपूर्ण नावाकरिता जलीय विच्छेदनाने जे अल्कोहॉल अथवा फिनॉल मिळेल त्यातील कार्बनी गटाचे नाव प्रथम घेतात. उदा., ज्या एस्टरापासून जलीय विच्छेदनाने ॲसिटिक अम्ल व मिथिल अल्कोहॉल मिळेल त्याचे नाव मिथिल ॲसिटेट. ज्यापासून बेंझॉइक अम्ल व प्रोपिऑनिक अल्कोहॉल मिळेल ते प्रोपिऑनिल बेंझोएट व ज्यापासून पामिटिक अम्ल व सेटिल अल्कोहॉल मिळेल ते सेटिल पामिटेट होय. संबंधित अम्ले व अल्कोहॉले यांमध्ये प्रतिष्ठापित गट असतील, तर त्यांचाही उल्लेख त्यांच्या स्थाननिर्देशक चिन्हांसह केला जातो. हा निर्देशक मजकूर वरील पदांच्या मध्ये येतो. उदा., वरील सूत्र. [→ एस्टरीकरण].
गुणधर्म : कार्बॉक्सिलिक अम्लांपासून बनलेली एस्टरे सामान्यत: द्रवरूप किंवा घनरूप असून त्यांना वास असतो. मिथिल आणि एथिल एस्टरांचे उकळबिंदू घटक अम्लांच्या उकळबिंदूपेक्षा ४० ते ६० अंशांनी कमी असतात. कमी रेणुभाराची एस्टरे थोडीफार जलविद्राव्य (पाण्यात विरघळणारी) असतात. पण रेणुभार जसजसा वाढत जातो तसतशी जलविद्राव्यता कमी होते. बहुतेक सर्व कार्बनी विद्रावकांत (विरघळणाऱ्या पदार्थात) एस्टरे विरघळतात.
अम्लांशी तुलना केल्यास त्यांची एस्टरे उष्णतेच्या बाबतीत जास्त स्थिर असतात. त्यामुळे ऊर्ध्वपातन (वाफ थंड करून द्रव मिळविण्याची प्रक्रिया) करताना एखाद्या अम्लाचे अपघटन होण्याची (मूळ रेणूचे तुकडे पडून लहान रेणु अथवा अणू बनण्याची) जेथे भिती असेल व शुद्ध अम्ल मिळवावयाचे असेल, तर प्रथम त्याचे एस्टरीकरण (एस्टर बनविणे) करून ऊर्ध्वपातन करतात अणि नंतर ऊर्ध्वपातित एस्टरापासून जलीय विच्छेदनाने अम्ल मिळवितात.
ग्रीन्यार विक्रियाकारकामुळे [→ ग्रीन्यार विक्रिया] एस्टरांपासून तृतीयक अल्कोहॉले [→ अल्कोहॉले] बनतात :
|
H2O |
|||||||
|
R.COOR |
+ |
2R” – MgX |
→ |
||||
|
एस्टर |
ग्रीन्यार विक्रियाकारक |
||||||
|
R” |
|||||||
|
| |
|||||||
|
R |
– |
C |
– |
R” + MgOHX |
|||
|
| |
|||||||
|
OH |
|||||||
|
तृतीयक अल्कोहॉल |
|||||||
अल्किक फॉर्मेटापासून मात्र द्वितीयक अल्कोहॉल मिळते:
|
R” |
||||||
|
| |
||||||
|
H.COOR’ |
+ |
2R”-MgX ® |
H – |
C |
-OH |
|
|
अल्किल फॉर्मेट |
ग्रीन्यार |
½ |
||||
|
विक्रियाकारक |
R” |
|||||
|
द्वितीयक अल्कोहॉल |
||||||
एस्टरांचे क्षपण [→ क्षपण] केल्यास दोन अल्कोहॉले बनतात. एकामधील कार्बनांची संख्या अम्लाच्या कार्बनाच्या संख्येएवढी असते. हे अल्कोहॉल एस्टरातील अम्लाचे क्षपण होऊन बनलेले असते. सोडियम धातू आणि सामान्यत: एथिल अल्कोहॉल यांच्याबरोबर एस्टराचे पश्चवाहन (उष्णतेने झालेल्या एस्टराच्या वाफेला द्रवरूप करून परत विक्रियामिश्रणात आणण्याची क्रिया) केल्याने वरील विक्रिया घडून येते. या विक्रियेत सोडियम व अल्कोहॉल यांपासून निर्माण झालेला हायड्रोजन क्षपण घडवून आणतो.

ज्या ठिकाणी विक्रियेकरिता उच्च तापमानाची आवश्यकता असते तेथे एथिल अल्कोहॉलाऐवजी ब्युटिल अल्कोहॉल वापरतात. उदा., CH3-(CH2)2-CH = CH (CH2)7.COOC4H9 ब्युटिल ओलिएट प्रत्यक्ष हायड्रोजन वायू वापरून उच्च दाब व उत्प्रेस्क (विक्रियेत भाग न घेता विक्रिया जलद किंवा कमी तापमानास घडावी यासाठी वापरलेला पदार्थ, कॉपर क्रोमाइट) यांच्या उपस्थितीत असेच क्षपण घडवून आणता येते :

या पद्धतीने खोबरेल तेलाचे (लॉरिक अम्लाचे ग्लिसराइड) हायड्रोजनीकरण करून (संयुगात हायड्रोजनाचा प्रवेश करवून) लॉरिक अल्कोहॉल औद्योगिक प्रमाणावर बनविता येते.
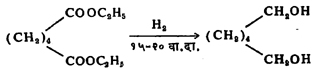
जलीय विच्छेदन : ज्या विक्रियेत H व OH हे पाण्याचे घटक संयुगाचे विच्छेदन घडवून आणतात त्या विक्रियेला जलीय विच्छेदन म्हणतात. एस्टराच्या जलीय विच्छेदनाने अल्कोहॉल आणि अम्ल निर्माण होते. अल्कोहॉल व अम्ल यांच्या रासायनिक संयुगाने एस्टर बनते व ही विक्रिया सल्फ्यूरिक अम्ल किंवा हायड्रोक्लोरिक अम्ल यांनी उत्प्रेरित होते. ही विक्रिया व्युत्क्रमी (उलट व सुलट होणारी) आहे, म्हणून अतिरिक्त पाणी घेऊन त्यात सल्फ्यूरिक अम्ल किंवा हायड्रोक्लोरिक अम्ल आणि एस्टर मिसळले व मिश्रणाचे पश्चवाहन केले, तर एस्टराचे जलीय विच्छेदन होते. अम्लाऐवजी क्षार (अम्लाशी विक्रिया झाल्यास लवण देणारा पदार्थ, अल्कली) वापरून हीच विक्रिया जास्त सोईस्करपणे घडवून आणता येते.
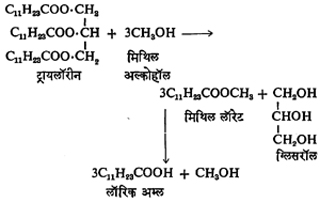
अल्कोहॉलीय विच्छेदन किंवा एस्टर-विनिमय : एखाद्या अम्लाचे मिथिल एस्टर अतिरिक्त एथिल अल्कोहॉलाबरोबर मिसळून हायड्रोक्लोरिक किंवा सल्फ्यूरिक अम्लाच्या उपस्थितीत पश्चवाहन केले, तर पुष्कळशा मिथिल एस्टराचे एथिल एस्टरात रूपांतर होते. यालाच अल्कोहॉलीय विच्छेदन (अल्कोहॉलातील OR व H या घटकांची भर घालून एखाद्या रेणूचे तुकडे पाडणे) किंवा एस्टर-विनिमय म्हणतात. अशाच प्रकारे दुसर्या एस्टरांचेही मिथिल एस्टरात रूपांतर करता येते. या गुणधर्माचा उपयोग ट्रायलॉरिनापासून प्रथम मिथिल लॉरेट आणि त्यापासून लॉरिक अम्ल तयार करण्याकरिता केला जातो. यामध्ये ग्लिसरॉल हे उपपदार्थ (मुख्य पदार्थाबरोबर मिलणारा दुसरा पदार्थ) म्हणून मिळते.
अमोनियी विच्छेदन : अमोनियाच्या घटकांचा उपयोग करून एखाद्या रेणूचे तुकडे पाडणे म्हणजे अमोनिया विच्छेदन होय. एस्टरे आणि अमोनिया यांची विक्रिया होऊन अमाइडे बनतात. येथे H व NH2 हे अमोनियाचे घटक विच्छेदनात भाग घेतात. ही विक्रिया सामान्यत: अमोनियाचा जलविद्राव किंवा अल्कोहॉली विद्राव वापरून नेहमीच्या तापमानात घडवून आणता येते.
|
R.COOR ’ |
+ |
H.NH2 |
→ |
R.CO. NH2 |
+ |
R’.OH |
|
एस्टर |
अमोनिया |
अमाइड |
उपयोग : कित्येक फळांचे स्वाद त्यांत असणाऱ्या एस्टरांमुळेच आलेले असतात. म्हणून खाद्ये आणि पेये यांमध्ये वापरण्याकरिता जी कृत्रिम सुगंधी मिश्रणे बनवितात त्यांत अनेक संश्लेषित (कृत्रिम रीतीने बनविलेली) एस्टरे वापरतात उदा., स्ट्रॉबेरीसारखा वास यावा म्हणून एथिल ॲसिटेट, ॲमिल ॲसिटेट, एथिल ब्यूटिरेट व एथिल फॉर्मेट या एस्टरांचे मिश्रण रास्पबेरीसारखा वासाकरिता एथिल ॲसिटेट, एथिल ब्यूटिरेट, ॲमिल ॲसिटेट, ॲमिल फॉर्मेट, ॲमिल ब्यूटिरेट, बेंझिल ब्यूटिरेट या एस्टरांची वेगवेगळ्या प्रमाणात केलेली मिश्रणे. एथिल ब्यूटिरेटाच्या विरल विद्रावाला अननसासारखा, एथिल सिनॅमेटाच्या विद्रावाला स्ट्रॉबेरीसारखा आणि ॲमिल ॲसिटेटाच्या विद्रावाला केळ्यासारखा वास असतो.
मिथिल ॲक्रिलेट, एथिल ॲक्रिलेट व इतर ॲक्रिलिक एस्टरे आणि मेथॅ ॲक्रिलेटे यांचे बहुवारिकीकरण (एकापेक्षा जास्त रेणू एकत्र येऊन त्यांपासून मोठा रेणू बनणे) होऊन जी बहुवारिकी एस्टरे मिळतात, त्यांचा उपयोग प्लॅस्टिके म्हणून, साचे वापरून वस्तू बनविण्यासाठी व आसंजके (वस्तू चिकटविण्याचा गुण असलेले पदार्थ) म्हणून होतो. सेल्युलोज ॲसिटेट व तत्सम एस्टरांचाही असाच उपयोग होतो.
बहुक्षारिकी अम्ले आणि बहुहायड्रॉक्सिली अल्कोहॉले यांच्यापासून मिळणाऱ्या एस्टरांना अल्किड रेझिने म्हणतात. उदा., ग्लिसरॉल व थॅलिक अम्ल यांपासून बनणारे ग्लिप्टॉल नामक एस्टर. याचा उपयोग वस्तूच्या पृष्ठभागावर संरक्षक व आकर्षक थर बसावा म्हणून लावतात. त्या व काही प्रमाणात संधानक (घट्ट होऊन वस्तू एकजीव करणारा पदार्थ) व बंधक (मिश्रणाचे घटक एकत्र ठेवणारा पदार्थ) म्हणून होतो.
टेरेप्थॅलिक अम्ल व एथिलीन ग्लायकॉल यांच्यापासून बनणाऱ्या एस्टराचे बहुवारिकीकरण करून ‘टेरिलीन’ नामक संश्लिष्ट तंतू बनविले जातात. व्हिनिल ॲसिटेट व व्हिनिल क्लोराइड या एस्टरांच्या संयोगाने व बहुवारिकीकरणाने ‘व्हिनिल्’ नामक संश्लिष्ट तंतू मिळतात.
संदर्भ : Fieser, L. F. Fieser, M. Organic Chemistry, Bombay, 1962.
देशपांडे, ज. र.
|
R.COOR ’ |
+ |
H.NH2 |
→ |
R.CO. NH2 |
+ |
R’.OH |
|
एस्टर |
अमोनिया |
अमाइड |
“