तेले व वसा : कार्बनी संयुगांचा एक वर्ग. जी संयुगे नेहमीच्या तापमानास द्रवरूप असतात त्यांना तेले आणि जी अर्धघन किंवा पूर्ण घनरूप असतात त्यांना वसा, मेद किंवा चरबी या संज्ञा दिल्या जातात (प्रस्तुत लेखात यापुढे मेद ही संज्ञा वापरली आहे) परंतु रासायनिक दृष्टीने त्यामध्ये फरक नाही. ग्लिसरीन व मेदाम्ले [→ वसाम्ले] यांची ही एस्टरे [→ एस्टरीकरण] असल्यामुळे यांना मेदाम्लांची ग्लिसराइडे असेही म्हणतात. तेले व मेदे ही वनस्पती व प्राणी या दोहोंतही आढळतात.
स्पर्शास ओशट किवा स्निग्ध, पाण्यात अविद्राव्य (न विरघळणारी) आणि कार्बनी विद्रावकात (विरघळविणाऱ्या पदार्थात) विद्राव्य हे यांचे सामान्य गुणधर्म होत. अशाच गुणधर्मांचे आणि मेदाम्लापासून बनलेले आणखीही कित्येक पदार्थ आहेत म्हणून अशा सर्व प्राणिजन्य व वनस्पतिजन्य पदार्थांचा एक व्यापक वर्ग कल्पिला जातो, त्याला ‘लिपीट’ वर्ग म्हणतात [→ लिपिडे] तेले व मेदे हा या वर्गाचा एक विभाग आहे.
चंदनाचे खोड, रोशाचे गवत इत्यादींपासून मिळणाऱ्या सुगंधी द्रवासही आपण अनुक्रमे चंदनाचे तेल व रोशाचे तेल असे म्हणतो परंतु त्यांच्या रासायनिक संघटना (घटक रेणूंमधील अणूंच्या रचना) भिन्न आहेत. म्हणून त्यांचा समावेश ‘बाष्पनशील तेले’ (बाष्परूपाने उडून जाणारी तेले) या वेगळ्या वर्गात केला जातो [→ बाष्पनशील तेले] त्याचप्रमाणे रॉकेल, डीझेल तेल इत्यादींच्या संघटनाही तेले व मेदे किंवा बाष्पनशील तेले यांपेक्षा निराळ्या आहेत म्हणून ती खनिज तेले या वर्गात मोडतात [→ खनिज तेल].
इतिहास : अन्नाचा एक महत्त्वाचा घटक म्हणून मेदे मनुष्यास प्राचीन कालापासून माहित आहेत. यज्ञातील आहुतीसाठी तुपाचा वापर मुक्तपणे होत असे. दिव्यामध्ये जळण म्हणून फार पूर्वीपासून वनस्पतींची तेले वापरली जात. आयुर्वेदात अनुपान म्हणून आणि शक्तिदायक म्हणून तुपाची योजना केलेली आढळते. इ. स. पू. स. १००० वर्षे ईजिप्शियन लोकांनी ऑलिव्ह तेल, मेद आणि चुना यांचे मिश्रण वंगण म्हणून वापरले होते. प्लिनी (इ. स. २३–७९) या रोमन ग्रंथकर्त्यांनी Historia Naturalis या आपल्या ग्रंथात कठीण (सोडियमाची लवणे असलेला) व मऊ (पोटॅशियमाची लवणे असलेला) साबण यांचे विवेचन केले आहे. लाकडी सामान, भिंती इत्यादींच्या पृष्ठभागाला काही तेले लावली आणि वाळू दिली, ती त्या पृष्ठभागांचे हवा आणि पाणी यांपासून संरक्षण होऊन त्या टिकतात, हे एइशियस यांनी सहाव्या शतकात दाखविले. चित्र रंगविण्याच्या ‘टेंपेरा’ या पद्धतीत रंग म्हणून वापरावयाची पिजंके (पाण्यात न विरघळणारी रंगीत चूर्णे) मेद व पाणी यांचे पायस (मेद व पाणी एकमेकांत मिसळून दुधासारखा केलेला द्रव) करून व त्यात मिसळून वापरीत असे आढळते. तेलाचा थर लवकर सुकावा म्हणून ह्यूबर्ट व यान व्हान आयिक यांनी पंधराव्या शकतात त्यात रासायनिक पदार्थ मिसळल्याची नोंद आहे. एरंडेलाचा उपयोग वंगण म्हणून व औषधी योजनेत रेचक म्हणून पूर्वीपासून केलेला आढळतो.
वनस्पतींपासून तेल काढण्याची पद्धत फार पूर्वीपासून चिनी, हिंदू, ईजिप्शियन व फिनिशियन लोकांना माहित होती. त्यासाठी ते आदिम स्वरूपाचे तेलघाणे व दाबयंत्रे वापरीत असत. उखळ, चक्कीचा दगड व पाचर दाबयंत्र अशा साधनांचा वापरही त्यांनी केलेला आढळतो. ग्रीक व रोमन लोक तेल काढण्याच्या विद्येत निपुण होते, असे उल्लेख होमर व प्लिनी यांच्या ग्रंथांत दिसून येतात. या लोकांनी तेल काढण्याच्या पद्धतीत सुधारणा केल्या. त्यांची सुधारलेली पद्धत मध्ययुगीन काळातही वापरली जात होती. तेल काढण्यासाठी भरडलेला पदार्थ घेऊन तो तापविणे अथवा वाफविणे या क्रिया करण्याचा प्रयत्न प्रथम कधी झाला याविषयी उल्लेख आढळत नाहीत. सतराव्या व अठराव्या शतकांत तेल काढण्याचा उपकरणात महत्त्वाच्या सुधारणा झाल्या. सतराव्या शतकात हॉलंडमध्ये शोधून काढण्यात आलेल्या दाबयंत्राचा वापर एकोणिसाव्या शतकाच्या सुरुवातीपर्यंत होता. १७५२ मध्ये स्मीटन यांनी एक लाटण–यंत्र बनविले. तेल काढण्यापूर्वी तेलबिया भरडून घेण्यासाठी वापरतात त्या आधुनिक यंत्रात त्याचेच तत्त्व वापरलेले आहे. १७९५ मध्ये जोझेफ यांनी बनविलेल्या जलदाब यंत्राचा उपयोग तेल काढण्यासाठी करण्यात आला. व्ही. डी. अँडरसन यांनी १८७६ मध्ये अमेरिकेत ‘एक्सपेलर’ या नावाने स्कू दाबयंत्राचा वापर केला. १८४३ मध्ये जेसी फिशर यांनी इंग्लडंमध्ये विद्रवक निष्कर्षण पद्धत प्रथम उपयोगात आणली परंतु तांत्रिक अडचणी आणि धोके यांमुळे ही पद्धत त्या वेळी फारशी प्रचारात येऊ शकली नाही. त्यानंतर जर्मनीमध्ये या पद्धतीत बऱ्याच सुधारणा होऊन ती मोठ्या प्रमाणावर वापरली जाऊ लागली. तेल काढावयाच्या पदार्थावरील टरफले, साली अथवा त्यांत मिसळून आलेले इतर पदार्थ वेगळे करण्याची साधने उपलब्ध झाल्यापासून तेल उद्योगात प्रगती झाली. तेलामध्ये तरंगत राहणारी किंवा कलिल स्वरूपात [→ कलिल] विरघळलेली अपद्रव्ये तशीच मुक्त मेदाम्ले काढून टाकून परिष्कृत तेल तयार करण्यासाठी वाफ, विरंजक मृत्तिका, सक्रियित कोळसा, खनिज अम्ले, सोडियम हायड्रॉक्साइड, सोडियम कार्बोनेट इ. रसायने वापरण्याच्या पद्धती अठराव्या शतकाच्या अखेरीस प्रचारात आल्या.
तेले व मेदे यांच्या संरचना आणि घटक यांसंबंधीच्या संशोधनातील प्रगतीचे महत्त्वाचे टप्पे खाली दिले आहेत.
| वर्ष | संशोधक | कामाचे स्वरूप व निष्कर्ष |
| १७७९ | के. डब्ल्यू. शेले | लिथार्जचा उपयोग करून ऑलिव्ह तेलाचे विच्छेदन केले. यातून ग्लिसरीन मिळाले. |
| १८१५ | एम्. ई. शव्ह्रल | मेदांचे व तेलांचे रासायनिक स्वरूप सिद्ध केले. |
| १८१९ | जे. जे. ई. पाउटेट | ओलेइक अम्लाचे समघटकीकरण करून इलॅइडिक अम्ल मिळविले. |
| १८२८ | सी. ए. गुसेरो | तृप्त व अतृप्त मेदाम्लांच्या मिश्रणातून अतृप्त मेदाम्ले वेगळी केली. |
| १८४१ | एफ्. व्हेरेनट्रॅप | ओलेइक अम्ल व क्षार यांचे मिश्रण तापविले असता पामिटिक व ॲसिटिक ही अम्ले बनतात, हे सिद्ध केले. |
| १८७९ | कोएट्सडॉर्फर | जलीय विच्छेदनाच्या साहाय्याने मेदाम्लांचे सरासरी रेणुभार काढण्याची पद्धत प्रसिद्ध केली. |
| १९१५ | आयरव फिशर | जवसाच्या तेलाचे विश्लेषण पूर्ण झाले. |
| १९३१ | आयर | |
| १९३२ | सी. बार्कर | |
| १९२६ | स्मेडले–मॅक्लीन | बुरशीला एथिल ॲसिटेट किंवा एथिल अल्कोहॉल अन्न म्हणून पुरविले, तर मेदाम्लांची निर्मिती होते, हे सिद्ध केले. |
| १९२७ | टी. पी. हिल्डिच व सी. एच्. ली | मेदांतील ग्लिसराइडांचा अभ्यास. |
| १९४५ | एन्. एफ्. लिपमान | यकृतातील को–एंझाइमामुळे ॲसिटेटाचे संश्लेषण होते व त्यापासून दीर्घ शृंखला असलेली संयुगे बनून त्यांचे मेदाम्लांत रूपांतर होते, हे दाखविले. |
| १९५७ ते १९६१ | एस्. जे. वॅकिल व सहकारी | प्राण्यांतील मेदाम्लांची निर्मिती ॲसिटिल को–एंझाइमामुळे कशी होते, याचा सखोल अभ्यास. |
| [विच्छेदन म्हणजे रेणूचे तुकडे पाडणे जलीय विच्छेदन म्हणजे पाण्याच्या विक्रियेने रेणूचे तुकडे पाडणे समघटकीकरण म्हणजे रेणूतील घटक कायम ठेवून त्यांच्या संरचनेत किंवा त्रिमितीय मांडणीत बदल घडविण्याची विक्रिया तृप्त मेदाम्ले म्हणजे ज्यांच्या शृखंलेतील कार्बन अणू एकमेकांस एकबंधाने जोडले गेले आहेत, अशा संरचनेची मेदाम्ले अतृप्त मेदाम्ले म्हणजे ज्यांच्या शृखंलेतील कार्बन अणू एकमेकांस दोन किंवा तीन बंदांनी जोडले गेले आहेत अशी मेदाम्ले को–एंझाइम म्हणजे सजीव पेशीत तयार होणारे व जीवरासायनिक विक्रिया घडून येण्यास मदत संयुगाबरोबर–म्हणजे एंझाइमाबरोबर–आढळणारा व त्याच्या क्रियाशीलतेस आवश्यक पदार्थ.] | ||
मेदांचे घटक व त्यांच्या संघटना : मेदांचे घटक, ग्लिसरीन या तीन हायड्रॉक्सी (OH) गट असलेल्या अल्कोहॉलातील हायड्रॉक्सी गटांचा मेदाम्लांच्या तीन रेणूंतील कार्बॉक्सिल (COOH) गटांशी रासायनिक संयोग होऊन बनलेली एस्टरे, म्हणजेच ग्लिसराइडे होत. कोणतेही मेद संपूर्णपणे एकाच ग्लिसराइडाचे बनलेले नसते, तर अनेक ग्लिसराइडांचे मिश्रण असते.
या ग्लिसराइडांमध्ये असणारी अम्ले सामान्यतः कार्बन अणूंची संख्या सम (२, ४, ६, … इ.) असलेली, एक कार्बॉक्सिल गट असलेली व कार्बन अणूंची सरळ शृखंला असलेली आहेत. त्यांमध्ये तृप्त व अतृप्त या दोन्ही वर्गांची अम्ले आढळतात. अतृप्त अम्लांमध्ये एक, दोन व तीन द्विबंध (शृखंलेतील कार्बन अणू दोन बंधांनी एकमेकांस जोडले गेले म्हणजे होतो तो) असलेली आणि त्याचप्रमाणे एकांतरीत द्विबंध (कार्बन शृखंलेत किंवा वलयात एक द्विबंध त्यानंतर एक बंध पुन्हा द्विबंध अशी एकाआड एक द्विबंधांची रचना) असलेल्या अम्लांचाही समावेश होतो. त्रिबंध असलेलीही काही अम्ले मेदांमध्ये आढळून आली आहेत.
ज्यांच्या संरचनेत कार्बन अणूंची सरळ किंवा वलय असलेली शाखा आहे, शृखंलेतील कार्बन अणूंची संख्या विषम (१, ३, ५, ७, … इ.) आहे किंवा हायड्रॉक्सी (OH) व एपॉक्सी गट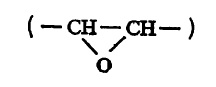
आहेत, अशीही काही अम्ले मेदांमध्ये आढळतात. ती वरील नियमाला अपवाद होत.
पूर्वीपासून माहित असलेल्या काही मेदाम्लांना विशेष नावे आहेत. उदा., ब्युटिरिक, स्टिअरिक, ओलेइक, लिनोलीइक, लिनोलीनिक, रिसिनोलिइक इ. इतर अम्लांची नावे जिनीव्हा नामकरण पद्धतीनुसार बनविलेली आहेत [→ वसाम्ले].
मेदाचे जलीय विच्छेदन केले म्हणजे जी अम्ले मिळतात त्यावरून त्यापासून बनलेली ग्लिसराइडे ही त्या मेदाचे घटक आहेत एवढे सिद्ध होते परंतु त्या ग्लिसराइडांच्या संघटनांचे स्पष्टीकरण होत नाही. उदा., एखाद्या मेदापासून स्टिअरिक (C17H35COOH) हे तृप्त अम्ल आणि ओलेइक (C17H33COOH) हे अतृप्त अम्ल जर मिळत असेल, तर त्यापासून पुढे दाखविल्याप्रमाणे सहा वेगवेगळी ग्लिसराइडे बनू शकतील.
| CH2·O·CO·C17H35 | CH2·O·CO·C17H33 |
| | | | |
| CH·O·CO·C17H35 | CH2·O·CO·C17H33 |
| | | | |
| CH2·O·CO·C17H35 | CH2·O·CO·C17H33 |
| (१) तृप्त मेदाम्लाचे ट्राय–स्टिअरीन. असे ट्राय–ग्लिसराइड S3 या संज्ञेने दाखवितात. | (२) अतृप्त मेदाम्लाचे ट्रायओलेइन. असे ट्राय–ग्लिसराइड U3 या संज्ञेने दाखवितात. |
| CH 2 ·O·CO·C17H35 | CH2·O·CO·C17H35 |
| | | | |
| CH·O·CO·C17H35 | CH2·O·CO·C17H35 |
| | | | |
| CH2·O·CO·C17H35 | CH2·O·CO·C17H33 |
| (३) | (४) |
| (३) व (४) या दोन्ही संयुगांना मोनो–ओलिओ डाय–स्टिअरीन म्हणतात. संघटनेत तृप्त अम्लापासून बनलेले दोन व अतप्त अम्लापासून बनलेला एक गट असल्यामुळे अशी संघटना US2 या संज्ञेने दाखवितात. | |
| CH2·O·CO·C17H33 | CH2·O·CO·C17H33 |
| | | | |
| CH·O·CO·C17H35 | CH2·O·CO·C17H33 |
| | | | |
| CH2·O·CO·C17H33 | CH2·O·CO·C17H35 |
| (५) | (६) |
| (५) व (६) या संयुगाना मोनो–स्टिअरो डाय–ओलेइन म्हणतात व अशा संघटना SU2 या संज्ञेने दर्शवितात. | |
प्रत्यक्षात मात्र असे आढळते की, मेदापासून मिळणाऱ्या एकूण मेदाम्लांत एखादे विशिष्ट मेदाम्ल ६५% पेक्षा जास्त असेल, तरच संपूर्णपणे त्या एकट्या मेदाम्लापासून बनलेले ट्राय–ग्लिसराइड (वरील उदाहरणातील S3 किंवा U3 सारखे) त्यात काही प्रमाणात असते. एरवी ग्लिसरिनाच्या रेणूंमध्ये मेदाम्ल रेणूंची वाटणी ‘समान वाटप पद्धतीने’ होऊन बनणाऱ्या ग्लिसराइडांच्या मिश्रणाचे ते मेद बनलेले असते, हे तत्त्व टी. पी. हिल्डिच यांनी प्रथम मांडले. बहुसंख्य मेदांमध्ये व विशेषतः बीजांपासून मिळणाऱ्या मेदांत तसेच जलचरांच्या मेदांत अशा तऱ्हेची वाटणी दिसून येते.
यदृच्छेने होईल तशी वाटणी काही ठिकाणी झालेली आढळते, तिला ‘यदृच्छ वाटप पद्धत’ म्हणतात. मोठाल्या स्थलचर (जमिनीवर राहणाऱ्या) प्राण्यांच्या मेदांत या पद्धतीने बनलेली ग्लिसराइडे असतात.
या दोन्ही वाटप पद्धतींना मध्यवर्ती अशी आणखी एक वाटप पद्धत फळांची आवरणे, पक्षी, डुक्कर, कृंतक (कुरतडणाऱ्या प्राण्यांच्या) गणातील प्राणी यांच्यातील मेदांच्या घटक–ग्लिसराइडांत आढळते, तिला ‘निर्बंधित यदृच्छ वाटप पद्धत’ म्हणतात.
आर्. जे. व्हॅनडर व्हाल आणि त्यांचे सहकारी मॅट्सन व व्होलपेन हाइन यांना असे दाखविले आहे की, अग्निपिंडातील (उदराच्या वरच्या भागात असलेल्या व पचन क्रियेसाठी आवश्यक असलेल्या ग्रंथीतील) लायपेज या एंझाइमाच्या उपयोगाने मेदांचे जलीय विच्छेदन विवेचक तऱ्हेने होते व त्यावरून त्यांनी निष्कर्ष काढला की, मेदात ओलेइक व लिनोलीइक ही अतृप्त मेदाम्ले असतील, तर ती ग्लिसरिनाच्या रेणूतील मधल्या कार्बन अणूला जोडलेल्या हायड्रॉक्सी गटाशी प्रथम संयोग पावतात आणि त्यानंतर इतर तृप्त व अतृप्त मेदाम्ले ग्लिसरिनाच्या पहिल्या व तिसऱ्या कार्बन अणूला जोडलेल्या हायड्रॉक्सी गटाशी ‘यदृच्छ पद्धतीने’ संयोग पावतात. एफ्. डी. गनस्टोन यांच्या संशोधनानेही हेच सिद्ध झाले आहे.
एखाद्या मेदात असलेली ग्लिसराइडे कोणती यापेक्षा त्यासंबंधी पुढील दोन गोष्टी माहित असणे आवश्यक असते : (१) ग्लिसराइडांच्या जाती म्हणजे त्यांमध्ये असलेली अम्ले तृप्त आहेत का अतृप्त आहेत व त्यांमधील कार्बन शृखंलांत किती कार्बन अणू आहेत आणि (२) ग्लिसराइडांची प्रमाणे. ग्लिसराइडांच्या जातीवरून त्या मेदाचे भौतिक गुणधर्म ठरतात. उदा., वितळबिंदू. त्यांच्या प्रमाणावर रासायनिक गुणधर्म अवलंबून असतात. उदा., आयोडिन मूल्य.
भौतिक गुणधर्म : मेदे शद्ध रूपात वर्णहीन, गंधहीन व ओशट असून कोणत्याही तापमानास पाण्यात मिसळत नाहीत. काही मेदांना जो विशिष्ट रंग, वास किंवा चव असते ती त्यांमध्ये असणाऱ्या आनुषंगिक द्रव्यांमुळे असते. उदा., खोबरेलाचा वास त्यामध्ये मिश्रित असलेल्या नोनिल मिथिल कीटोनामुळे व पाम तेलाचा वास बीटा अयोनोनामुळे आलेला असतो. काही मेदे पाण्यात काही प्रमाणात विद्राव्य आहेत असेही वाटते, पण ती विद्राव्यता मेदाची नसून त्यात असलेल्या मेदेतर घटकांची असते.
शूद्ध मेद हे एकच संयुग नसून अनेक ग्लिसराइडांचे मिश्रण असते. ग्लिसराइडे बहुरूप स्फटिक असून त्यांचे वितळबिंदू वेगवेगळे असतात. त्यामुळे शुद्ध मेद चटकन न वितळता दोन–तीन अंशांच्या मर्यादेत वितळते म्हणून घनरूप मेदांचे वितळबिंदू व द्रवरूप मेदांचे घनीभवन बिंदू (द्रवरूपातून घनरूपात येण्याचे तापमान) दोन–तीन अंशांच्या टप्प्यात लिहिण्याचा प्रघात आहे. यामुळेच केवळ वितळबिंदूवरून मेदातील ग्लिसराईडे कोणती आहेत ते ओळखता येत नाही. उदा., बोर्निओटॅलो व दुधातील मेद यांचे सरासरी वितळबिंदू अनुक्रमे ३८° से. व ३७° से. आहेत परंतु त्यामधील घटकद्रव्यांत पुष्कळ फरक आहे.
मानक वैज्ञानिक संस्थांनी मेदांचे वितळबिंदू व घनीभवन बिंदू यांना प्रमाण निर्देशांकांत स्थान दिले आहे हे खरे, पण केवळ या अंकांवरून मेदाच्या शुद्धाशुद्धतेविषयी (किंवा दुसऱ्या अर्थाने भेसळीविषयी) माहिती मिळू शकत नाही.
व्यावसायिक उपयोगाच्या दृष्टीने मात्र वितळबिंदूला महत्त्व आहे. उदा., मेदाचे हायड्रोजनीकरण (रेणूमध्ये हायड्रोजन अणूंचा समावेश करणे) करताना वेळोवेळी वितळबिंदू तपासला, तर हायड्रोजनीकरण कोणत्या टप्प्यापर्यंत झाले आहे याची कल्पना येते.
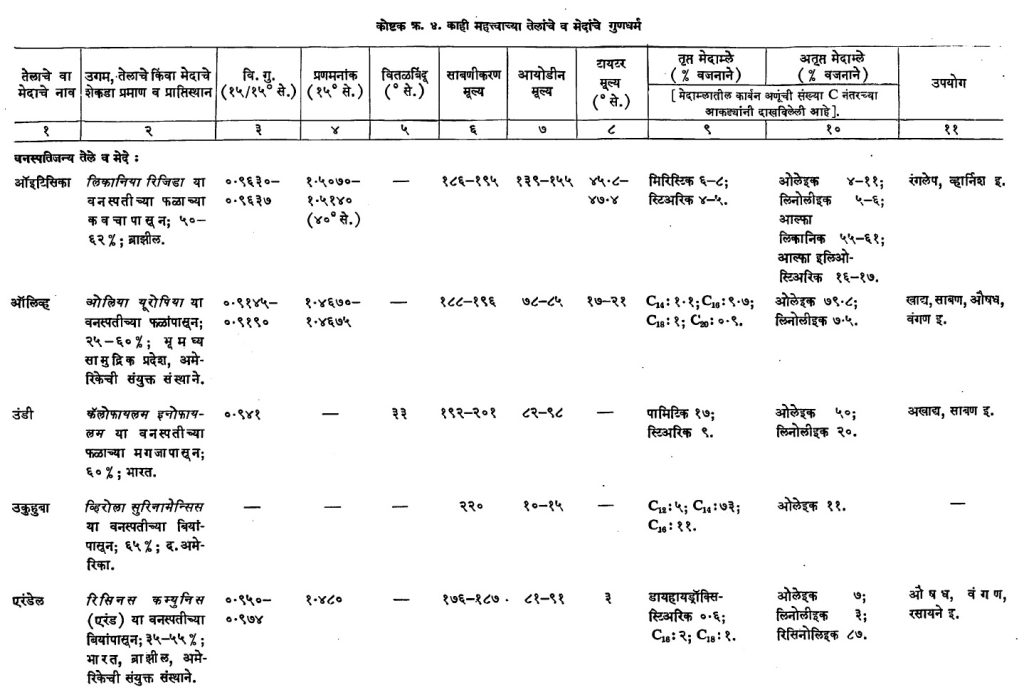
मेदाच्या जलीय विच्छेदनानंतर एकूण मेदाम्लांचा वितळबिंदू किंवा टायटर मूल्य हाही एक प्रमाण निर्देशक मानला जातो. हा निर्देशांक काढण्याकरिता वितळलेले मेद विशिष्ट मापाच्या परीक्षा नळीत घेऊन व ढवळणे चालू ठेवून क्रमाक्रमाने ते थंड करतात. ज्या क्षणी ते घनरूपात येते त्या वेळेचे तापमान म्हणजेच हे मूल्य होय. काटेकोरपणा येण्यासाठी ढवळण्याकरिताही तापमापक वापरतात. मेद घनरूपात येताना सुप्त उष्णता बाहेर पडते. ती केव्हा पडते ते तापमापकाने कळते व नेमके त्या वेळचे मूल्य मोजता येते. टायटर मूल्य हेही व्यावसायिक दृष्टीने उपयुक्त आहे. साबण बनविण्याचा व्यवसायात मेदाम्लाच्या टायटर मूल्यावरून ते साबणासाठी वापरता येईल किंवा नाही, हे अजमावता येते. दोन मेदांच्या मेदांम्लांचे टायटर मूल्य सारखे असले, तरी त्यांतील घटक मेदाम्ले वेगळी असू शकतात. उदा., खोबरेल व तिळाचे तेल यांच्या मेदांम्लांची टायटर मूल्ये २०°–२४° से. व २०°–२५° से. आहेत परंतु त्यांतील मेदाम्ले भिन्न आहेत. (कोष्टक क्र. ४ पाहा.)
मेदांचे वितळबिंदू –२५° से. ते ५५° से. या तापमान मर्यादेत असतात. मेदांमध्ये असलेल्या अतृप्त मेदाम्लांचे प्रमाण आणि त्या अम्लातील अतृप्त बंधांची संख्या ही जसजशी वाढत जाईल तसतसा वितळबिंदू कमीकमी होत जातो.
प्रकाश शोषण : दृश्य वर्णपट मर्यादेत (४०० mμ–८०० mμ तरंगलांबी १ mμ = १०–७ सेमी.) शूद्ध मेदे संपूर्ण पारदर्शक आहेत परंतु जंबुपार (वर्णपटातील जांभळ्या रंगाच्या पलीकडील अदृश्य १०० mμ–४०० mμ) व अवरक्त (वर्णपटातील तांबड्या रंगाच्या अलीकडील अदृश्य २·५μ–२५ μ १ μ = १०–४ सेमी.) किरणांच्या मर्यादेत काही मेदे प्रकाश शोषण करतात. ज्या मेदांमध्ये एकातंरीत अतृप्त बंध असलेली मेदाम्ले आहेत अशी मेदे जंबुपार प्रारणापैकी २०० mμ–४०० mμ या मर्यादेतील तरंगलांबींच्या काही प्रारणांचे शोषण करतात. दोन एकांतरीत अतृप्त बंध असलेली मेदे २३४ mμ या ठिकाणी व तीन एकांतरीत द्विबंध असलेली मेदे २७० mμ या ठिकाणी तीव्र शोषण करतात. उदा., टुंग तेलातील
| CH–CH=CH–(CH2)3–CH3 |
| || |
| CH–CH=CH–(CH2)7–COOH |
| इलिओस्टिअरिक अम्ल |
| CH3–(CH2)4–CH=CH–CH2–CH |
| || |
| HOOC–(CH2)7–HC |
| लिनोलीइक अम्ल |
| CH–CH2–CH=CH–CH2–CH3 |
| || |
| CH–CH2–CH=CH–(CH2)7–COOH |
| लिनोलीनिक अम्ल |
यांच्यातील द्विबंध एकांतरीत नाहीत परंतु क्षार व एथिलीन ग्लायकॉल यांबरोबर ती १८०° से. तापमानास तापविली, तर हे द्विबंध एकांतरीत होतात व मग ती वरीलप्रमाणे जंबुपार प्रारणाचे शोषण करतात व त्यावरून मेदातील त्यांची प्रमाणे काढता येतात. तृप्त मेदाम्ले, एकच अतृप्त बंध असलेली मेदाम्ले, विपक्ष मेदाम्ले व एकातंरीत अतृप्त बंध नसलेली मेदाम्ले जंबुपार प्रारणाचे शोषण अतिशय कमी प्रमाणात करतात. त्यामुळे त्यांची प्रमाणे ठरविण्यासाठी या गुणधर्मांचा उपयोग होत नाही.
अ जीवनसत्त्व ३२५ mμ या ठिकाणी तीव्र शोषण दाखविते त्यामुळे मेदात हे जीवनसत्त्व विरघळलेले असेल, तर त्याचे अस्तित्व या शोषणाने ओळखता येते. α β अतृप्त बंध असलेले संयुग विशिष्ट ठिकाणी जंबुपार प्रारणाचे शोषण करते.
काही मेदांत विपक्ष मेदाम्ले असतात. हायड्रोजनीकरणातही अशी मेदाम्ले बनतात. ती १०·३० μ या ठिकाणी अवरक्त प्रारणाचे शोषण करतात. मेदाच्या घटनेत असलेले हायड्रोक्सी, एपॉक्सी व कार्बोनिल (CO) गट विशेष ठिकाणी शोषण करताता व त्यावरून त्यांचे अस्तित्व सिद्ध करता येते.
क्ष–किरण चित्र : मेदामध्ये असलेल्या मेदाम्लांचे शुद्ध रूपातील स्फटिक क्ष–किरणांच्या मदतीने तपासले, तर त्यातील कार्बन अणूंच्या संख्येनुसार विशिष्ट चित्रे दर्शवितात. त्यांच्या अभ्यासावरून मेदाम्लातील कार्बन अणूंची संख्या व रेणूतील अणुरचनेसंबंधी माहिती मिळते. मात्र याकरिता स्फटिक अत्यंत शुद्ध असावा लागतो. अन्यथा चित्र अस्पष्ट येते व त्यावरून निष्कर्ष काढणे कठीण जाते.
श्यानता : (द्रवाचा दाट-पातळपणा) ज्या मेदांच्या मेदाम्लांत अतृप्त बंधांचे प्रमाण जास्त असते म्हणजेच ज्यांचे आयोडीन मूल्य (१०० ग्रॅ. मेदाबरोबर किती ग्रॅम आयोडीन संयोग पावते तो अंक) जास्त असते अशी मेदे द्रवरूप असतात व त्यांची श्यानता कमी असते. द्रवरूप मेदांचे हायड्राजनीकरण करीत गेल्यास त्यांचा वितळबिंदू वाढत जातो व श्यानताही वाढत जाते. खाद्य तेलांच्या तपासणीच्या दृष्टीने या गुणधर्माला महत्त्व नसले, तरी वंगण वगैरेंसारख्या व्यावसायिक कारणांसाठी मेदाच्या या गुणाचा निर्देशांक माहीत असणे जरूर आहे. शुष्कन तेलांचे (हवेने वाळून ज्यांचा कोरडा थर बनतो अशा) बहुवारिकीकरण (विशिष्ट अणुसमुच्चय पुनःपुन्हा जोडले जाऊन जटिल रेणू तयार होण्याची क्रिया) झाले, तर त्याची श्यानता खूप वाढते. मेदामध्ये असणाऱ्या मेदाम्लांत जर हायड्रॉक्सी गट असतील (उदा., एरंडेल तेल), तर त्यांची श्यानता जास्त असते.
विशिष्ट गुरूत्व : बहुतेक मेदांचे वि. गु. ०·९१ ते ०·९५ यांच्या दरम्यान असते. दोन मेदांचा सरासरी रेणुभार सारखा असला, तर ज्यांत अतृप्त मेदाम्ल जास्त प्रमाणात असेल त्याचे वि. गु. कमी असते. उदा., सरसूचे तेल व जपानी मेण यांचे सरासरी रेणुभार सारखे आहेत, पण सरसूच्या तेलात अतृप्त मेदाम्ल जास्त आहे. त्यांची विशिष्ट गुरुत्वे सरसूचे तेल ०·९१ व जपानी मेण ०·९९ अशी असते.
प्रणमनांक : (हवेपेक्षा भिन्न घनता असलेल्या पारदर्शक पदार्थातील प्रकाशवेग व हवेतील प्रकाशवेग यांचे गुणोत्तर दाखविणारा अंक) तृप्त व अतृप्त मेदे (तसेच तृप्त व अतृप्त मेदाम्ले) यांच्या प्रणमनांकांत बराच फरक आढळतो. अतृप्त बंधांच्या वाढीबरोबर (आयोडीन मूल्यात वाढ) व त्यांच्या प्रकारानुसार मेदांच्या प्रणमनांकांत वाढ होत जाते. उदा., भुईभूग तेलाचे आयोडिन मूल्य ८५–१०० व प्रणमनांक १·१५८ आहे, तर जवस तेलाचे आयोडीन मूल्य १७०–१८५ व प्रमाणांक १·४६९ आहे. मेदांच्या रेणुभारांच्या फरकानुसारही प्रणमनांकात फरक पडतो.
अतृप्त मेदांचे हायड्रोजनीकरण होताना आयोडीन मूल्य व प्रणमनांक या दोहोंतही घट होत जाते. यावरून अनेक अतृप्त मेदांच्या या दोन्ही निर्देशकांच्या संबंध दाखविणारे आलेख तयार करतात. प्रणमनमापकाने प्रणमनांक काढण्यास फार वेळ लागत नाही. तो मोजून आलेखाच्या साहाय्याने कोणत्याही मेदाच्या तृप्तीकरणाचे प्रमाण काढणे शक्य होते. तसेच शुष्कन तेलावर काही प्रक्रिया सुरू असताना त्या प्रक्रियांचे प्रमाण काढण्यास प्रणमनांकांचा उपयोग होतो. तूप, तेल व प्राणिज मेदे यांच्या प्रमणनांकात बराच फरक असल्याने तुपाची शूद्धता अजमावण्यास प्रणमनांकाचे साहाय्य होते.
झाइस ब्युटिरो–प्रमणनांकमापक या उपकरणात १·४२२० ते १·४८९५ या प्रणमनांक मर्यादेचे १०० सारखे भाग केलेले असतात. त्यानुसार येणाऱ्या पदार्थाच्या प्रणमनांक मूल्याला ब्युटिरो–प्रणमनांक मूल्य ‘ब्युटिरो रिफ्रॅक्टोमेट्रिक व्हॅल्यू’ (बी. आर. व्हॅल्यू) म्हणतात. लोणी, तूप इ. पदार्थांचे प्रणमनांक मूल्य या मापक्रमात मोजून त्यांची शूद्धाशुद्धता ठरविता येते.
प्रकाशीय परिवलन : संयुगाच्या किंवा त्याच्या विद्रावाच्या अंगी असलेला त्यातून जाणाऱ्या ध्रुवित (एकाच प्रतलात कंप पावणाऱ्या) प्रकाशाचे प्रतल उजवीकडे किंवा डावीकडे वळविण्याचा गुणधर्म. याचे मूल्य दर्शविणाऱ्या अंकाला विशिष्ट परिवलन म्हणतात व ते १० सेंमी. लांबीच्या विद्रावाच्या स्तंभातून ध्रुवित प्रकाशाच्या परिवलनाचा कोन भागिले विद्रावातील क्रियाशील पदार्थाची संहती (प्रमाण) यांच्या बरोबर असते.
रिसिनोलेइक, हिद्नोकार्पिक व चौलमूग्रिक आणि तत्सम मेदाम्ले असलेल्या मेदामध्येच प्रकाशीय परिवलन दिसून येते. उदा., एरंडेल व कडू कवठीचे तेल यांची विशिष्ट परिवलने अनुक्रमे + ७·५° ते ९·०° व + ५०° ते ५५° अशी आहेत.
विशिष्ट उष्णता : (एक ग्रॅम पदार्थाचे तापमान १° से. ने वाढविण्यास लागणाऱ्या उष्णतेचे कॅलरीतील मूल्य) रेणूभार जास्त असलेल्या ग्लिसराइडांची विशिष्ट उष्णता जास्त असते. त्यांतील अतृप्त बंधांचे प्रमाण जसजसे वाढते तसतशी त्यांची विशिष्ट उष्णता कमी होते. हायड्रोजनीकरण केल्याने अतृप्त बंधांची संख्या कमी होते. सरकीच्या तेलावर ही प्रक्रीया क्रमशः केल्यास विशिष्ट उष्णता कशी बदलत जाते, ते पुढील आकड्यांवरून दिसून येईल.
| सरकीचे तेल | आयोडीन मूल्य | विशिष्ट उष्णता
(ग्रॅम–कॅलरी/ग्रॅम) |
| हायड्रोजनीकरणापूर्वी | १०७ | २०·६ |
| हायड्रोजनीकरण अंशतः झाल्यावर | ५९·५ | २७·४ |
| हायड्रोजनीकरण जवळजवळ पूर्ण झाल्यावर | ०·९ | ४४·३ |
धूम्रबिंदू, ज्वलनबिंदू व ज्वालाबिंदू : विशिष्ट विक्रियांसाठी अगर उपयोगासाठी मेदे तापविण्याची गरज असते. याकरिता त्याचे अपघटन (मोठ्या रेणूचे लहान लहान रेणूंत तुकडे पडणे) कोणत्या तापमानास होईल व कितपत होईल याची कल्पना येण्यासाठी मेद तापवू लागल्यावर कोणत्या तापमानास त्यातून विरल व निळसर धूर सतत निघू लागतो (धूम्रबिंदू) व आणखी तापविल्यावर कोणत्या तापमानास ते पेट घेते (ज्वलनबिंदू) व नंतर सतत जळत राहते (ज्वालाबिंदू) यांविषयी माहिती असणे आवश्यक असते. ग्लिसराइडांपेक्षा मेदाम्लांचे विघटन कमी तापमानास होते. त्यामुळे मेदांचे हे बिंदू त्यात असणाऱ्या मुक्त मेदाम्लांच्या प्रमाणावर अवलंबून असतात. सरकीच्या किंवा शेंगदाण्याच्या तेलाच्या बाबतीत मुक्त मेदाम्लाचे प्रमाण व वरील बिंदूंची मूल्ये यांचे संबंध पुढील आकड्यावरून लक्षात येतील.
| मेदातील मुक्त मेदाम्लाचे प्रमाण
(%) |
धूम्रबिंदू
(० से.) |
ज्वलनबिंदू
(० से.) |
ज्वालाबिंदू
(० से.) |
| ०·०१ | २३२ | ३३० | ३६२ |
| १०० | ९५ | १७० | २२० |
मुक्त मेदाम्ले कमी रेणुभाराची असल्यास त्यांचे अपघटन कमी तापमानास होते. मेदाच्या अतृप्तीमुळे यात फारसा फरक पडत नाही.
समघटकता : तेच व तितकेच अणू रेणूमध्ये असून त्यांच्या संरचना किंवा त्रिमितीय मांडण्या भिन्न असल्यामुळे वेगवेगळ्या गुणधर्माची संयुगे बनण्याचा गुणधर्म [→ समघटकता].
नैसर्गिक मेदात असणारे ओलेइक अम्ल समपक्षरूपी असते. त्याची संरचना अशी दर्शवितात. गंधक, सिलिनियम, नायट्रस अम्ल इत्यादींच्या विक्रियेमुळे या अम्लाच्या सु. ६६% भागाचे विपक्षरूप समघटकात–इलॅइडिक अम्लात–रूपातंर होते.
| H3C–(CH2)7–C–H |
| || |
| HOOC–(CH2)7–C–H |
| H3C–(CH2)7–C–H |
| || |
| H–C–(CH2)7–COOH |
या अम्लांचे गुणधर्म वेगळे आहेत. उदा., ओलेइक अम्लाचा वितळबिंदू १६° से. आहे, तर इलॅइडिक अम्लाचा ४३·५° से. आहे.
एकापेक्षा जास्त अतृप्त बंध असणाऱ्या मेदाम्लात अतृप्त बंधांची जरी संख्या तीच असली, तरी त्यांची स्थाने भिन्न असल्यास समघटकता निर्माण होते. उदा., लिनोलीनिक आणि इलिओस्टिअरिक अम्ले.
| CH–CH2–CH=CH–CH2=CH3 |
| || |
| CH–CH2–CH=CH–(CH2)7–COOH |
| लिनोलीनिक अम्ल |
| CH–CH =CH–(CH2)3–CH3 |
| || |
| CH–CH=CH–(CH2)7–COOH |
| इलिओस्टिअरिक अम्ल |
| CH3–(CH2)4–CH=CH–CH2–CH=CH–(CH2)7–COOH |
| लिनोलीइक अम्ल |
नैसर्गिक लिनोलीइक अम्ल समपक्ष–समपक्ष आहे. ओलेइक अम्ल CH3–(CH2)7–CH=CH–(CH2)7–COOH. लिनोलीइक अम्लापासून ओलेइक अम्लाचे संश्लेषण करताना लिनोलीइकाचे विपक्ष रूपही निर्माण होते व त्यामुळे लिनोलीइक अम्लाचे पुढील चार समघटक होतात : (१) समपक्ष–समपक्ष, (२) समपक्ष–विपक्ष, (३) विपक्ष–समपक्ष आणि (४) विपक्ष–विपक्ष.
विद्राव्यता : ईथर, क्लोरोफॉर्म, पेट्रोलियम विद्रावक, बेंझीन व टोल्यूइन या कार्बनी विद्रावकांत मेदे सुलभतेने विरघळतात व अल्कोहॉलात फार कमी विरघळतात. मेदात जेवढे अतृप्त बंध अधिक तितकी त्याची विद्राव्यता अधिक असते आणि त्यातील ग्लिसराइडांचे रेणुभार जेवढे जास्त तेवढी विद्राव्यता अधिक असते आणि त्यातील ग्लिसराइडांचे रेणुभार जेवढे जास्त तेवढी विद्राव्यता कमी असते.
रासायनिक गुणधर्म : मेदे एस्टर वर्गाची संयुगे असल्यामुळे क्षारांच्या योगाने त्यांचे विच्छेदन होते, याला क्षारीय विच्छेदन (क्षारातील OH व उरलेल्या भाग यांच्या योगाने एखाद्या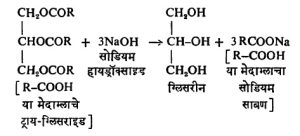 रेणूचे खंड पडणे) असे म्हणतात. उदा., सोडियम हायड्रॉक्साइड हा क्षार वापरल्यास पुढे दिल्याप्रमाणे रासायनिक विक्रिया घडून येते.
रेणूचे खंड पडणे) असे म्हणतात. उदा., सोडियम हायड्रॉक्साइड हा क्षार वापरल्यास पुढे दिल्याप्रमाणे रासायनिक विक्रिया घडून येते.
ज्या धातूचा क्षार वापरला असेल त्याला अनुरूप असा त्या धातूचा साबण बनतो. उदा., पोटॅशियम हायड्रॉक्साइडाने पोटॅश साबण. विक्रियेचे तापमान, क्षार, विद्रावाची संहती व विक्रियेसाठी वापरलेला विद्रावक या सर्वांवर विक्रियेची गती अवलंबून असते. सोडियम व पेटॅशियम यांच्या क्षारांनी होणारे विच्छेदन जलद होते. यांचे साबण पाण्यात विरघळतात. १ ग्रॅम मेदाचे क्षारीय विच्छेदन करण्यासाठी लागणारे पोटॅशियम हायड्रॉक्साइड मिलिग्रॅमामध्ये व्यक्त केले म्हणजे येणाऱ्या अंकाला त्या मेदाचा क्षारीय विच्छेदनांक किंवा साबणीकरण मूल्य म्हणतात. कॅल्शियम व मॅग्नेशियम यांच्या क्षारांनी विक्रिया फार सावकाश होते, या धातूंचे साबण पाण्यात अविद्राव्य असतात. हे तेलात काही प्रमाणात विरघळतात. असे विद्राव वंगण म्हणून उपयोगी पडतात. शिसे, मँगॅनीज व कथिल या धातूंच्या क्षारांनी अशी विक्रिया घडवून आणणे फार कठीण असते.
जलीय विच्छेदन : अशीच विच्छेदन विक्रिया योग्य तापमान, दाब आणि उत्प्रेरक (विक्रियेत स्वतः भाग न घेता विक्रियेची गती वाढविणारा वा ती कमी तापमानास घडवून आणणारा पदार्थ) यांची योजना केली असता पाण्यानेही घडवून आणता येते. या क्रियेला जलीय विच्छेदन म्हणतात आणि तिच्यामुळे ग्लिसरीन व वरील विक्रियेतील साबणाऐवजी मेदाम्ल निर्माण होते. उदा., एका अखंडित प्रकियेत झिंक ऑक्साइड हा उत्प्रेरक तेलात विरघळवून घेतला असता, २५०° से. तापमान आणि ४५·७० किग्रॅ/सेमीं२. इतका दाब ठेवल्यास तेलाचे जलीय विच्छेदन घडून येते, यालाच ‘मेद–विघटन’ म्हणतात.
मेदामध्ये पाणी मिसळून, १००° से. तापमानास ‘व्टिचेल विक्रियाकारक’ (ई. व्टिचेल यांच्या नावाने ओळखण्यात येणारा) उत्प्रेरक वापरून मेद–विपाटन घडविता येते. व्टिचेल विक्रियाकारक हा एखादे मेदाम्ल व बेंझीन किंवा नॅप्थॅलीन यांच्या मिश्रणावर सल्फ्यूरिक अम्लाची विक्रिया करून बनवितात. एरंडाच्या बियांमध्ये असणाऱ्या मेदविच्छेदी एंझाइमांचाही या कामी उपयोग करता येतो. येथे ग्लिसरीन हा एक महत्त्वाचा पदार्थ उपपदार्थ म्हणून मिळतो.
अल्कोहॉली विच्छेदन : मिथिल किंवा एथिल अल्कोहोल (विरघळण्यास लागणाऱ्या प्रमाणापेक्षा सु. २० ते ६०% जास्त) यांच्या बरोबर क्षार वा अम्ल ह्या उत्प्रेरकांच्या उपस्थितीत मेदाचे पश्चवाहन (विक्रिया मिश्रणातील द्रवाची उष्णतेने झालेली वाफ द्रवरूप करून विक्रिया मिश्रणात परत आणण्याची क्रिया) केल्यास मेदातील अम्लांची अनुक्रमे मिथिल व एथिल एस्टरे बनतात. या विक्रियेत मेदाच्या संघटनेतील ग्लिसरीन (रेणुभार ९२·०८) या अल्कोहॉलाची जागा त्याच्यापेक्षा कमी रेणुभार असलेल्या मिथिल अल्कोहॉल (रे. भा. ३२) व एथिल अल्कोहॉल (रे. भा. ४६) या कमी रेणूभार असलेल्या अल्कोहॉलांनी घेतली जाते.
एखाद्या मेदावर त्याच्या संघटनेत असलेल्या अम्लापेक्षा कमी रेणुभार असलेल्या अम्लाची उत्प्रेरकाच्या उपस्थितीत विक्रिया घडविली, तर कमी रेणुभार असलेल्या अम्लाचे ग्लिसराइड बनते व मूळची जास्त रेणुभार असलेली अम्ले सुटी होतात.
सोडियम व अल्कोहॉल यांचा उपयोग करून ⇨ क्षपण करण्याची जी पद्धत आहे, तिच्या उपयोगाने मेदांपासून त्यांच्या संघटनेत असलेल्या अम्लांची अनुरूप अल्कोहॉले बनतात. अतृप्त अम्लांतील द्विबंधावर या विक्रियेत परिणाम होत नाही.
कॉपर क्रोमाइट हा उत्प्रेरक वापरल्यास २०°–४०° से. तापमानात, १०० ते २०० वातावरणे इतका दाब घालून असेच क्षपण घडवून अल्कोहॉले बनविता येतात. ही प्रक्रिया मोठ्या प्रमाणावर मेद अल्कोहॉले बनविण्यासाठी वापरतात. या प्रकियेत अतृप्त मेदाम्लातील द्बिबंधावरही अंशतः परिणाम होण्याचा संभव असतो.
हायड्रोजनीकरण : निकेल, प्लॅटिनम व पॅलॅडियम या उत्प्रेरकांच्या साहाय्याने मेदांच्या संघटनेतील अतृप्त बंधांचे हायड्रोजनाने तृप्तीकरण होते. हायड्रोजनीकरण समाधानकारक होणे हे उत्प्रेरक, विक्रियेसाठी वापरलेला दाब, तापमान, मेदातील अतृप्त बंधांचे स्वरूप व मिश्रण घुसळण्याचा वेग वा सर्वांवर अवलंबून असते. द्रवरूप अतृप्त बंध जास्त असतात. हायड्रोजनीकरणाने त्यांचा वितळबिंदू वाढतो व व्यावहारिक उपयोगाच्या दृष्टीने ती जास्त सोयीची होतात [→ हायड्रोजनीकरण].
हायड्रोजनीकरण क्रियेत उत्प्रेरक विषबाधित होऊ नये म्हणून प्रथमच मेदे शुद्ध करून घ्यावी लागतात. त्यानंतर ही विक्रिया झाल्यावर मिळणारी मेदे कमीअधिक घनरूप, गंधहीन आणि स्वच्छ असतात. अतृप्त बंधांचे प्रमाण कमी झाल्यामुळे ही मेदे मूळ मेदांपेक्षा जास्त टिकाऊ बनतात. भुइर्मुभाचे आणि सरकीचे तेल यांचे हायड्रोजनीकरण करून मिळणारी मेदे साबणनिर्मितीसाठी वापरतात. मेदातील मेदाम्लांच्या कार्बन शृखंलेत एकापेक्षा अधिक अतृप्त बंध असल्यास हायड्रोजनीकरणाने त्यापासून प्रथम एक अतृप्त बंध असल्यास हायड्रोजनीकरणाने त्यापासून प्रथम एक अतृप्त बंध असलेले घटक निर्माण होतात आणि नंतर त्यांचे संपूर्ण तृप्तीकरण सुरू होते. मेदातील लिनोलीइक व लिनोलीनिक अम्लांच्या संघटनेतील अतृप्त बंधांचे हायड्रोजनीकरणे होत होत ती जेव्हा एक अतृप्त बंधाच्या मर्यादेपर्यंत येतात त्या वेळेपर्यंत त्यांचे समपक्ष ओलेइक व विपक्ष ओलेइक असे दोन्ही समघटक अनुक्रमे १ : २ या प्रमाणात झालेले असतात आणि पुढच्या हायड्रोजनीकरणामध्ये या समघटकांचे हे प्रमाण कामय राखले जाते. मेदांचे पूर्ण तृप्तीकरण होण्याच्या आधीच या विपक्ष घटकांमुळे मेदांचे वितळबिंदू बरेच वाढतात. आणि त्यामुळे पाहिजे ते वितळबिदू व आयोडिन मूल्य मिळण्यासाठी हायड्रोजनीकरण पूर्णतेस नेण्याची गरज नसते सारखीच अतृप्ती असलेल्या पण रेणुभारात फरक असलेल्या घटकांच्या हायड्रोजनीकरणात कमी रेणुभार असलेल्या घटकावर विक्रिया जास्त लवकर होते.
इतर समावेशक विक्रिया : (इतर अणू वा अणुगट रेणूत सामावून घेणाऱ्या विकिया). मेदात असलेल्या अतृप्त बंधांचे तृप्तीकरण क्लोरीन, ब्रोमीन व आयोडीन या मूलद्रव्यांनीही होते. एका अतृप्त बंधात या मूलद्रव्यांचे दोन अणू समाविष्ट होतात. समावेशन क्रिया पूर्ण होणे हे मुख्यत्वेकरून (१) अतृप्त बंधाचे स्वरूप, (२) या मूलद्रव्यांचे विक्रियेच्या वेळी असणारे स्वरूप, (३) समावेशन विक्रियेकरिता वापरलेले विद्रावक, (४) विक्रियेचे तापमान इत्यादींवर अवलंबून असते. आयोडीन मोनोक्लोराइड आणि आयोडीन मोनोब्रोमाइड या संयुगांच्या ॲसिटिक अम्ल विद्रावाच्या द्वारे आयोडिनाचे समावेशन जास्तीत जास्त पूर्ण होते. अतृप्त बंधांची मोजणी करण्यासाठी ही विक्रिया वापरतात.
दोन किंवा तीन एकाकी ( इतस्ततः असलेले, एकांतरित नसलेले) द्विबंध असतील, तर ब्रोमिनाचे समावेश करून व मिळणारी संयुगे वेगळी करून–ही पेट्रोलियम ईथरात न विरघळणारी असतात–व त्यांचे वितळबिंदू काढून त्यावरून ते टेट्राब्रोमो आहे का हेक्झॅब्रोमो आहे हे अजमावतात व त्यांच्या वजनावरून टेट्राब्रोमाईड किंवा हेक्झॅब्रोमाइड मूल्य ठरवितात. या मूल्यांवरून अतृप्त बंधांची संख्या ठरविता येते. मात्र समावेशनाची क्रिया पूर्ण झालेली असली पाहिजे आणि द्विबंधात समावेशन होण्याखेरीज इतर विक्रिया होऊन त्यात ब्रोमीन अणूंचा विनियोग झालेला नसावा. उदा., क्वचित प्रसंगी अम्ल गटाच्या शेजारच्या कार्बन अणूला जोडलेले हायड्रोजन अणू ब्रोमीन अणूंनी प्रतिष्ठापित केले जातात.
एकांतरित द्विबंधांचे तृप्तीकरण पूर्णत्वास जाणे कठीण असते. अशा द्विबंधांचे मापन करण्यासाठी मॅलेइक ॲनहायड्राइडाबरोबर अशा बंधांची होणारी विक्रिया वापरता येते. दोन एकातंरीत द्विबंधांच्या स्थानी हे संयुग जोडले जाते व त्याच वेळी एका द्विबंधाचे स्थानांतर होते.
अलीकडे जंबुपार प्रारण शोषणाचे मापन करून एकांतरित द्विबंधांची उपस्थिती ठरविली जाते.
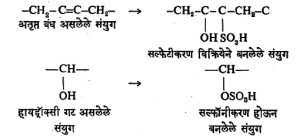 संहत सल्फ्यूरिक अम्लाने किंवा विशेषतः सल्फर ट्रायऑक्साइडाने हायड्रॉक्सी गटाचे ⇨ सल्फॉनीकरण (एक वा अधिक सल्फोनिक अम्ल गटांचा समावेश होण्याची क्रिया) होते व अतृप्त बंधांचे सल्फेटीकरण (सल्फेट गटाचा समावेश होण्याची क्रिया) होते.
संहत सल्फ्यूरिक अम्लाने किंवा विशेषतः सल्फर ट्रायऑक्साइडाने हायड्रॉक्सी गटाचे ⇨ सल्फॉनीकरण (एक वा अधिक सल्फोनिक अम्ल गटांचा समावेश होण्याची क्रिया) होते व अतृप्त बंधांचे सल्फेटीकरण (सल्फेट गटाचा समावेश होण्याची क्रिया) होते.
ऑक्सिडीभवन : (संयुगाच्या रेणूत ऑक्सिजनाचा समावेश होण्याची क्रिया) मेदांचा वास व चव यांमध्ये कालातरांने बदल होतो. काही मेदे साठवणीत खवट होतात. (उदा., खोबरेल, तूप) काही द्रवरूप मेदांचा थर एखाद्या पृष्ठभागास लावला, तर वाळून घनरूप होतो (उदा., जवसाचे तेल) हा नेहमीचा अनुभव आहे. ह्या बदलांचा संबंध मेदांच्या घटक मेदाम्लांतील अतृप्त बंधांच्या हवेतील ऑक्सीजनामुळे होणाऱ्या ऑक्सिडीभवनाशी जोडला जातो. यालाच स्वयंऑक्सिडीभवन असेही म्हणतात. यामध्ये अतृप्त बंधाच्या शेजारच्या मिथिलीन (= CH2) गटात हवेतील ऑक्सिजनाचे दोन अणू समाविष्ट होऊन हायड्रोपेरॉक्साइड तयार होते.
| –CH2–CH=CH– | + O2 → | -CH-CH=CH- |
| | | ||
| O.OH | ||
| अतृप्त बंध असलेले संयुग | हायड्रोपेरॉक्साइड | |
हे हायड्रोपेरॉक्साइड अस्थिर असल्यामुळे अपघटन पावते आणि त्यापासून तीन ते अकरा या मर्यादेत कार्बन अणूंची संख्या असलेली तृप्त व अतृप्त आल्डिहाइडे, कीटोने आणि मेदाम्ले बनतात. या संयुगांमुळे प्रारंभी उल्लेख केलेले बदल मुख्यतः घडून येतात. यांशिवाय ह्या संयुगांच्या मूळच्या घटकातील अतृप्त बंधांशीही विक्रिया होतात. या विक्रिया बऱ्याच गुंतागुतींच्या असून त्यांचा अभ्यास अजून पूर्णपणे झालेला नाही. प्रमुख ऑक्सिडीकारकांच्यामुळे होणाऱ्या विक्रिया पुढीलप्रमाणे आहेत.
पोटॅशियम परमॅंगॅनेट हा विक्रियाकारक या कामी फार वापरला जातो. विरल क्षारीय विद्रवात याच्या क्रियेने अम्लात अतृप्त बंध असल्यास त्या बंधांच्या ठिकाणी दोन हायड्रॉक्सी गट येऊन हायड्रॉक्सी अम्ल बनते. अनुकूल परिस्थितीत यांचे आणखी ऑक्सीडीभवन होऊ शकते.
ॲसिटोन किंवा ॲसिटिक अम्ल यातील विद्रावाच्या रूपात हा विक्रियाकारक वापरल्याने अतृप्त मेदाम्लातील द्विबंधांच्या ठिकाणी विच्छेदन होते. मेदामध्ये असणाऱ्या अम्लांच्या संरचना ठरविण्यासाठी ही विक्रिया फार उपयोगी पडते.
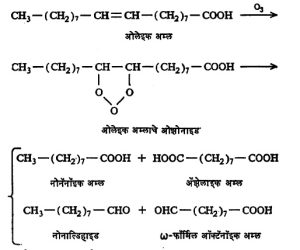 अतृप्त बंध असलेल्या अम्लापासून ओझोन या विक्रियाकारकाने ओझोनाइड नावाचे समावेशक संयुग प्रथम बनते. त्याच्या जलीय विच्छेदनाने अनेक द्रव्ये मिळतात. त्यांच्या अभिज्ञानाने मूळ अतृप्त अम्लात द्विबंध कोठे होते ते ठरविता येते. उदा., ओलेइक अम्लापासून नोनॅनॉइक अम्ल, ॲझेलाइक अम्ल आणि नोनाल्डिहाइड व ω–फॉर्मिल ऑक्टॅनॉइक अम्ल ही संयुगे मिळतात.
अतृप्त बंध असलेल्या अम्लापासून ओझोन या विक्रियाकारकाने ओझोनाइड नावाचे समावेशक संयुग प्रथम बनते. त्याच्या जलीय विच्छेदनाने अनेक द्रव्ये मिळतात. त्यांच्या अभिज्ञानाने मूळ अतृप्त अम्लात द्विबंध कोठे होते ते ठरविता येते. उदा., ओलेइक अम्लापासून नोनॅनॉइक अम्ल, ॲझेलाइक अम्ल आणि नोनाल्डिहाइड व ω–फॉर्मिल ऑक्टॅनॉइक अम्ल ही संयुगे मिळतात.
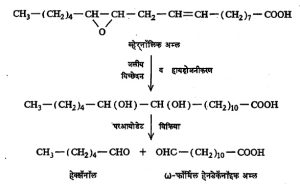
पोटॅशियम परआयोडेट आणि सल्फ्युरिक अम्ल यांच्या विक्रियेने परआयोडिक अम्ल बनते. तसेच रेड लेड (Pb3O4)आणि ॲसिटिक अम्ल यांपासून लेड टेट्राॲसिटेट मिळते. परआयोडिक अम्ल व लेड टेट्राॲसिटेट हे विक्रियाकारक मेदाम्लात दोन हायड्रॉक्सी गट एकमेकांशेजारच्या कार्बन अणूंना जोडलले असतील, तर त्यांचे ऑक्सिडीकरण घडवून दोन अल्डिहाइडे निर्माण करतात. अम्लामध्ये अतृप्त बंध असल्यास त्यावर सामान्यतः विक्रिया होत नाही, हे या विक्रियाकारकांचे वैशिष्ट्य आहे. उदा., एरंडेलामध्ये असणाऱ्या ९ : १० डायहायड्रॉक्सिस्टिअरिक अम्लाची संरचना परआयोडेटाने ऑक्सिडीकरण केल्याने नोनॅनाल व ω–फॉर्मिल ऑक्टॅनॉइक अम्ल ही संयुगे बनतात, यावरून ठरविण्यात आली.
| CH3–(CH2)7–CHOH–CHOH–(CH2)7–COOH | |||
| ९:१० डायहायड्रोक्सिस्टिअरिक अम्ल | |||
| → | CH3–(CH2)7–CHO | + | OHC–(CH2)7–COOH |
| नोनॅनाल | ω –फॉर्मिल ऑक्टॅनॉइक अम्ल | ||
 मेदाम्लामध्ये एपॉक्सी गट असेल, तर त्याचे स्थान ठरविण्यासाठी प्रथम एपॉक्सी गटाचे दोन निकटवर्ती हायड्रॉक्सी गटात रूपांतर करतात व नंतर परआयोडेटाने ऑक्सिडीकरण घडवितात त्यामुळे हायड्रोक्सी गट जोडले असलेल्या कार्बन अणूंच्यामध्ये अपघटन होऊन दोन संयुगे बनतात. त्यांच्या संरचनांवरून एपॉक्सी गट कोठे होता ते ठरविता येते. उदा., व्हेर्नॉलिक अम्ल.
मेदाम्लामध्ये एपॉक्सी गट असेल, तर त्याचे स्थान ठरविण्यासाठी प्रथम एपॉक्सी गटाचे दोन निकटवर्ती हायड्रॉक्सी गटात रूपांतर करतात व नंतर परआयोडेटाने ऑक्सिडीकरण घडवितात त्यामुळे हायड्रोक्सी गट जोडले असलेल्या कार्बन अणूंच्यामध्ये अपघटन होऊन दोन संयुगे बनतात. त्यांच्या संरचनांवरून एपॉक्सी गट कोठे होता ते ठरविता येते. उदा., व्हेर्नॉलिक अम्ल.
उष्मीय बहुवारिकीकरण : अतृप्त बंध ज्यांच्या संघटनेत आहेत अशा मेदांचे (ऑक्सिजनाचा संपर्क असो वा नसो) तापमानात वाढ झाल्यास बहुवारिकीकरण घडून येते. अतृप्त बंध एकांतरीत असल्यास बहुवारिकीकरण जास्त त्वरेने घडते (उदा., टुंग तेल) व जास्त रेणुभार असलेली घनरूप किंवा जेलरूप [फळांच्या जेलीसारखी थलथलीत → जेल] बहुवारिके तयार होतात. असे मेद एखाद्या वस्तूच्या पृष्ठभागावर लावले, तर बहुवारिकीकरण नेहमीच्या तापमानासही संथपणे होते आणि त्या पृष्ठावर 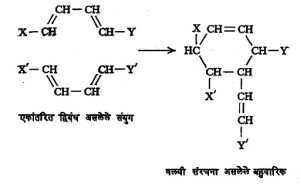 बहुवारिकाचा थर बसतो व वस्तूचे हवा, पाणी यांपासून संरक्षण होते. रोगणे व तेलरंग यांचा संरक्षक गुणधर्म याच क्रियेवर आधारलेला आहे. असे बहुवारिकीकरण पुढील सूत्रांप्रमाणे होऊन वलयी (कार्बन शृखंलेची टोके एकमेकांस जोडली जाऊन होणाऱ्या रचनेची) संयुगे तयार होतात.
बहुवारिकाचा थर बसतो व वस्तूचे हवा, पाणी यांपासून संरक्षण होते. रोगणे व तेलरंग यांचा संरक्षक गुणधर्म याच क्रियेवर आधारलेला आहे. असे बहुवारिकीकरण पुढील सूत्रांप्रमाणे होऊन वलयी (कार्बन शृखंलेची टोके एकमेकांस जोडली जाऊन होणाऱ्या रचनेची) संयुगे तयार होतात.
बहुवारिकीकरणाबरोबरच ऑक्सिडीकरणही होत असेल, तर त्यामुळे बनलेली संयुगेही–आल्डिहाइडे, कीटोने इ. तयार होतात.
मेदे व मेदाम्ले यांचे निसर्गातील संश्लेषण व कार्य : प्राण्यांच्या शरीरात मेदांची निर्मिती पुढील कारणांसाठी होत असावी : (१) शरीराला मेदापासून मिळणारी उष्णता प्रत्येक ग्रॅमला ९·३ किलोकॅलरी (किकॅ.) इतकी आहे. प्रथिने व कार्बोहायड्रेटे यांच्या प्रत्येकी एक ग्रॅमपासून ४·१ किकॅ. उष्णता मिळते म्हणून मेद हा शरीरातील शक्तीचा साठा आहे. (२) मेदांची उष्णता संवाहकता फार कमी आहे. त्यामुळे कातडीच्या आत असलेल्या मेदाच्या थरामुळे बाहेरच्या थंडीपासून प्राण्यांचे संरक्षण होते. (३) स्टेरॉले, अ, ड आणि ई जीवनसत्त्वे आणि कॅरोटिनॉइडे मेदात विरघळलेल्या स्थितीत असतात. त्यामुळे शरीराच्या निरननिराळ्या भागांना या आवश्यक संयुगांचा पुरवठा मेदांच्या द्वारे होत राहतो. (४) शरीराच्या वाढीचे प्रमाण टिकविण्यासाठी, कातडीचे काही रोग होऊ नयेत म्हणून, केसांची वाढ चांगली व्हावी यासाठी दुसऱ्याही काही विकृतीपासून उदा., रोहिणीविलेपी विकार (मेदद्रव्ये व कोलेस्टेरॉल यांचा रोहिणीच्या आतील भागात थर साचून त्या खंडित होणे) संरक्षण व्हावे म्हणून मेदांत असलेल्या लिनोलीइक या अम्लाची मुख्यात्वे व लिनोलीनिक अम्लाची काही प्रमाणात पुष्कळ प्राण्यांना जरूरी असते. (५) वनस्पतींच्या बियांमध्ये जी मेदे असतात त्यांचा उपयोग साठविलेले अन्न म्हणून अंकूर वाढीच्या वेळी होतो. पाम व ऑलिव्ह यांच्या फलावरणात (फळाच्या सालीच्या आतील भागात) मेदांचा मोठा साठा असतो. त्याचा त्या फळांना कसा उपयोग होत असेल, हे अजून पूर्णपणे समजलेले नाही.
कोणतेही फल कच्चे असताना त्यात स्टार्चाचे प्रमाण भरपूर असते पण मेदाचा जवळजवळ संपूर्ण अभाव असतो. फळ परिपक्व झाले म्हणजे त्यात मेद आढळते. यावरून १९०२ मध्ये ई. उलमान या शास्त्रज्ञांनी असे सुचविले की, स्टार्चापासून एंझाइमाच्या मदतीने मेदाचे संश्लेषण होते. ड्यू सा ब्ल्यू यांच्या याअगोदरच्या (१८९६) आणि जे. व्हाल्ले (१९०३) व आयव्हॅनोव्ह यांच्या त्यानंतरच्या संशोधनाने या मतास पुष्टी मिळाली.
थंड हवामानात बियांची वाढ होत असताना त्यांतील अतृप्त मेदाम्लांचे प्रमाण जास्त असते व हवेच्या तापमानाप्रमाणे त्यात पुष्कळ फरक पडतो. तृप्त मेदाम्लांच्या प्रमाणात त्यामानाने फारसा बदल होत नाही. नैसर्गिक मेदांच्या संघटनेत जी मेदाम्ले असतात त्यामधील कार्बन अणूंची संख्या सम असते. घटक मेदाम्लांपैकी ८०% ओलेइक आणि लिनोलीइक ही मेदाम्ले असतात. ह्या दोन गोष्टींचा विचार करून मेदाम्लांच्या उत्पत्तीचा विचार केला जातो. ई. एफ्. आर्मस्ट्राँग आणि ॲलन यांनी असे सुचविले होते की, कार्बोहायड्रेटातील ग्लुकोज व फ्रुक्टोज यांच्यापासून तीन कार्बन अणू एकत्र असलेले खंड प्रथम तयार होतात व नंतर त्यांचे एकीकरण होऊन C6, C9 व C12 असे मोठे खंड बनतात. ओलेइक व लिनोलीइक मेदाम्लांच्या अतृप्त बंधांची जागा या तत्त्वात बरोबर बसते परंतु या मताला पुरावा मिळाला नाही.
इ. स. १९२६ मध्ये स्मेडले–मॅक्लीन यांना असे दिसून आले की, बुरशीला एथिल ॲसिटेट किंवा एथिल अल्कोहॉल अन्न म्हणून दिले, तर त्या बुरशीयुक्त पदार्थांत मेदाम्लांचे संश्लेषण झालेले आढळते. त्यानंतर या विषयात चिन्हित ॲसिटेटाच्या [ज्यामध्ये चिन्हित–किरणोत्सर्गी (म्हणजे भेदक कण वा किरण बाहेर टाकणारा)–कार्बन अणू आहे अशा ॲसिटेटाच्या] साहाय्याने जे संशोधन झाले त्यातून असे निष्पन्न झाले की, मेदाम्लांची उत्पत्ती दोन कार्बन अणू असलेल्या ॲसिटेट या एककापासून होते. प्रथिने, कार्बोहायड्रेटे आणि मेदे या सर्व अन्न घटकांच्या ऑक्सिडीकरणाने C2 एकके मिळत असल्यामुळे वरीलपैकी कोणत्याही संयुगापासून मेदाम्लांची निर्मिती होऊ शकते. प्राण्यांच्या यकृतात असणाऱ्या हायड्रोजननिरासकारी (हायड्रोजन काढून टाकणाऱ्या) एंझाइमांच्या क्रियेने मेदांच्या हायड्रोजननिरास होऊन अतृप्त बंध त्यांत निर्माण होतात. फळे व बिया यांमध्येही अशाच तऱ्हेने अतृप्त मेदाम्लांची उत्पत्ती होते. एफ्. लिपमान यांना १९४५ मध्ये असे आढळून आले की, डुकराच्या यकृतात जे को–एझाइम–ए असते, त्याच्या योगाने ॲसिटेट या C2 एककाचे संघनन (दोन वा अधिक रेणूंची जोडणी) होऊन दीर्घ शृखंला असलेली संयुगे तयार होतात. को–एंझाइमामधील मरकॅप्टो गट ॲसिटेटाशी संघनित होऊन कार्बन शृखंलेची लांबी वाढत जाते.
| CH3·CO–SCoA | + | CH3·CO–SCoA |
| ॲसिटील को–एंझाइम–ए | ॲसिटील को–एंझाइम–ए | |
| → CH3·CO·CH2·CO–SCoA | ||
एंझाइमाच्या सान्निध्यात CH3·CO·CH2·CO याचे CH3·CH2·CH2CO असे रूपातंर होते. एस्.जे. वॅकिल व त्यांचे सहकारी यांनी केलेल्या संशोधनाचे वरील उपपत्तीस पुष्टी मिळाली आहे.
प्राण्यांनी खाल्लेल्या अन्नातील मेदांचे संपूर्ण ऑक्सिडीभवन होऊन त्यांचे दुसऱ्या शरीरमेदात रूपांतर होते असे नसून अन्नातील मेद घटकांचे पचनमार्गात लायपेज व यासारख्या एंझाइमांबरोबर पायसीकरण (मेद व पाणी यांचा दुधासारखा मिलाफ होण्याची क्रिया) होते आणि आंशिक जलीय विच्छेदन (रेणूच्या काही अंशाचे जलीय विच्छेदन) घडून मोनो व डाय ग्लिसराइडे बनतात. त्यामुळे निर्माण झालेली मेदाम्ले, आंशिक जलीय विच्छेदन होऊन बनलेली ग्लिसराइडे आणि ग्लिसरीन यांपासून शरीरास आवश्यक असलेल्या ग्लिसराइडांचे संश्लेषण होते व आतड्यातून त्यांचे शोषण होते. रवंथ करणाऱ्या दुभत्या जनावरांना अन्नातून दिलेल्या मेदानुरूप त्यांच्या तुपात (दुधातील चरबीत) बदल होतात. या विषयातील प्रयोगातून टी. पी. हिल्डिच यांनी असे अनुमान काढले आहे की, अन्नातून मिळणाऱ्या मेदांपैकी काही भाग पचनमार्गातून जसाच्या तसा प्रथम रक्तात शोषला जातो व दुग्ध ग्रंथीत असणाऱ्या C2 एककांपासून आखूड शृखंलांची मेदे संश्लेषित होतात.
वर्गीकरण : मेदांचे वर्गीकरण वेगवेगळे प्रकारे करता येते परंतु प्राणिजन्य मेदे व वनस्पतिजन्य मेदे असे विभाग करण्याची पद्धत जास्त सयुक्तिक असल्यामुळे तीच येथे स्वीकारली आहे.
प्राणिजन्य मेदे : यांचे जलचर व स्थलचर प्राण्यांपासून मिळणारी मेदे असे उपवर्ग करण्यात येतात.
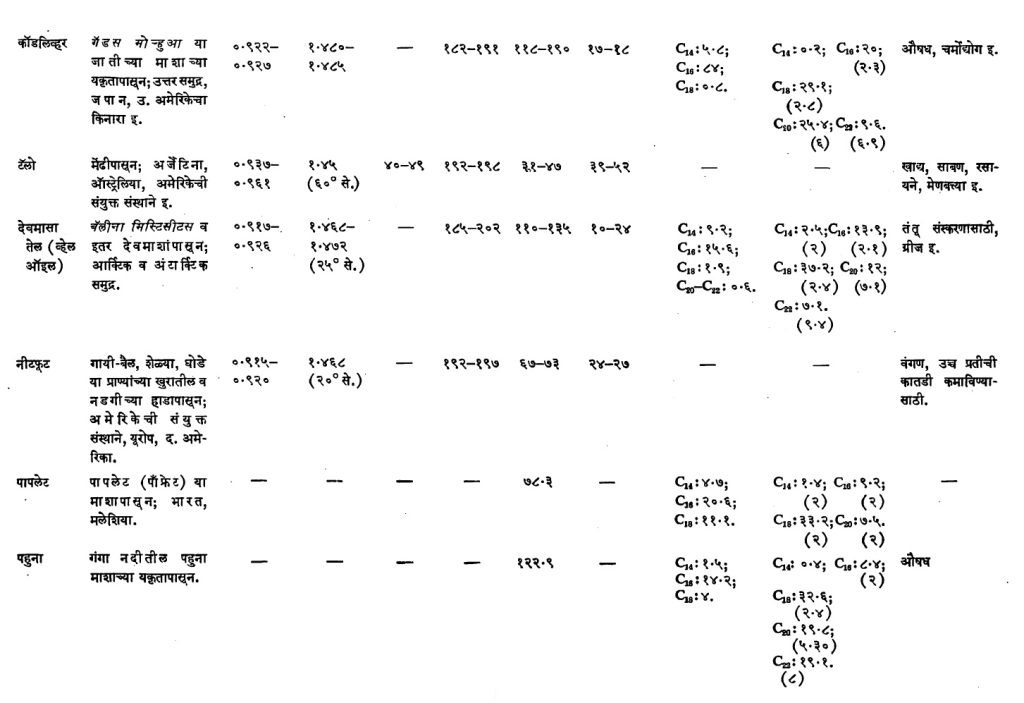
जलचर प्राण्यांपासून मिळणारी मेदे : समुद्रात व गोड्या जलाशयात आढळून येणारे लहानमोठे सर्व जातींचे मासे, खेकड्यांसारखे लहान प्राणी व मगरीसारखे मोठे प्राणी यांपासून मिळणाऱ्या मेदांचा अंतर्भाव या उपवर्गात होतो. उद्योगधंद्यांच्या दृष्टीने पाहता कॉड, शार्क व व्हेल या माशांच्या सर्व शरीरातील आणि त्याचप्रमाणे यकृतासारख्या विशिष्ठ भागातील मेदांचे उत्पादन मोठ्या प्रमाणावर केले जाते. या वर्गातील मेदांचे जलीय विच्छेदन करून मिळणाऱ्या मेदाम्लांत एक व अनेक अतृप्त बंध असलेली आणि C14 ते C28 या मर्यादेत कार्बन अणूंची संख्या सम असलेली अम्ले असतात आणि C18 व C20 या अम्लांचे प्रमाण जास्त असते. कार्बन अणूंची संख्या एकच असून त्यामधील अतृप्तता भिन्न असलेल्या मेदाम्लाचे प्रमाण काटेकोर ठरविणे कठीण असते, म्हणून अशा घटक संयुगांची सरासरी अतृप्ती कोष्टक क्र. ४ मध्ये त्या त्या मेदाम्लाच्या प्रमाणाच्या आकड्याच्या खाली कंसात दर्शविली आहे. तृप्त मेदाग्लांपैकी C16 घटकाचे प्रमाण सर्वात जास्त म्हणजे १०–१२% असते. एकाच जातीचे प्राणी जर भिन्न भिन्न ठिकाणी वावरत असतील आणि त्या त्या ठिकाणचे पाणी व इतर परिस्थिती यांत फरक असेल, तर त्यांच्या मेदाम्लांच्या प्रमाणात फरक आढळतो. उदा., काही इलास्मोब्रॅंक माशांच्या यकृतातील मेदात क्षार–अविच्छेदनीय भाग ( क्षाराने ज्यावर रासायनिक विक्रिया होत नाही असा भाग) १ ते २% असतो, तर काहीच्या बाबतीत हेच प्रमाण १०–१५% इतके जास्त असते. या वर्गातील मेदांत क्षार–अविच्छेदनीय भागात कोलेस्टेरॉलाचे प्रमाण बरेच असून ग्लिसरीन व सेलॅचिल, शिमिल व बॅटिल या अल्कोहॉलांच्या संयोगाने झालेली ईथरे आणि स्क्वॅलीन (C30H40) हे हायड्रोकार्बन आढळते. पौष्टिक म्हणून प्रसिद्ध असलेल्या कॉड माशाच्या यकृताच्या मेदात अ आणि ड ही जीवनसत्त्वे हे महत्त्वाचे घटक असतात. यकृताच्या वजनाच्या ४० ते ६०% मेद निघते. शरीरातील व यकृतामधील मेदे वेगवेगळी काढतात. शुद्ध केलेल्या शरीरमेदांचा उपयोग खाण्यासाठी व मुख्यत्वेकरून साबण, वंगण व तेलरंग यांसाठी केला जातो. कोष्टक क्र. ४ मध्ये या वर्गातील काही मेदांतील मेदाम्लांची प्रमाणे दिली आहेत (या कोष्टकातील प्राणिजन्य मेदे–कॉड, देवमासा, पहूना, पापलेट, मेनहाडेन, शार्क, सार्डिन, सील व हेरिंग यांसंबंधीची माहिती पहावी). ही मेदे सर्वसाधारण हवेच्या तापमानाला द्रवरूप असतात, याचे कारण त्यांत अनेक अतृप्त बंध असलेल्या मेदाम्लांचे प्रमाण ७० ते ९०% असते. या मेदाच्या आयोडीन मूल्यांवरून हे दिसून येते.
स्थलचर प्राण्यांपासून मिळणारी मेदे : जमिनीवरील प्राण्यांत उंदरापासून ते थेट हत्तीएवढ्या मोठ्या प्राण्यांपर्यंत सर्व प्रकारचे व आकारमानाचे लहानमोठे प्राणी येतात. सरपटणारे प्राणी, पक्षी, उंदीर यांसारख्या लहान प्राण्यांच्या शरीरातील मेदांचे विश्लेषण संशोधकांनी केलेले आहे परंतु ही मेदे कोणत्याच दृष्टीने महत्त्वाची नसल्यामुळे त्यांची माहिती येथे दिलेली नाही. मोठे प्राणी उदा., घोडा, गाय, म्हैस, डुक्कर व शेळी या प्रत्येकापासून मिळणाऱ्या मेदांचे तीन प्रकार आहेत : (अ) एकंदर शरीरातील मेद, (आ) त्यांचे यकृत, विशिष्ट अवयव किंवा रक्तातील मेदे, (इ) सस्तन प्राण्यांच्या बाबतीत त्यांच्या दुधातील मेदे.
(आ) प्रकारातील मेदांचे संशोधन बरेचसे सैद्धांतिक दृष्टीने झालेले आहे. (अ) आणि (इ) या प्रकारांतील मेदांचे संशोधन उपयुक्ततेच्या दृष्टीने पूर्णपणे झालेले आहे. खाद्य व उद्योगधंद्याच्या दृष्टीने (अ) प्रकारातील मेदे आणि खाद्य म्हणून (इ) प्रकारातील मेदे महत्त्वाची आहेत. (अ) आणि (इ) पैकी काही मेदांच्या
कोष्टक क्र. १. काही प्राण्यांच्या शरीरमेदातील मेदाम्ले व त्यांची टक्केवारी (वजनी).
| मेदाम्ले प्रकार
व कार्बनसंख्या |
घोडा
(इंग्लिश) |
उंट
(भारतीय) |
हत्ती
(भारतीय) |
बैल
(इंग्लिश) |
गाय
(भारतीय) |
| तृप्त | |||||
| C12 | ०·४ | — | — | — | ०·१ |
| C14 | ४·५ | ४·९ | ६·६ | ३·० | ४·५ |
| C16 | २४·९ | ३३·९ | ४४·१ | २९·२ | ४१·४ |
| C18 | ४·७ | २९·० | ६·५ | २१·० | २४·३ |
| C20 | ०·२ | — | — | ०·४ | ०·५ |
| अतृप्त | |||||
| C14 | — | ०·७ | १·० | ०·६ | ०·४ |
| C16 | ६·८ | ५·३ | ४·५ | २·७ | १·३ |
| C18 (ओलेइक) | ३३·७ | २६·२ | २६·५ | ४१·१ | २६·४ |
| C18 (लिनोलीइक) | ५·२ | — | ६·४ | १·८ | १·० |
| C18 (लिनोलीनिक) | १६·३ | — | ०·५ | — | — |
| C20 ते C22 | २·३ | — | २·९ | ०·२ | ०·१ |
मेदाम्लांच्या प्रमाणाची टक्केवारी कोष्टक क्र. १ व २ मध्ये दिलेली आहे. प्राण्यांना मेदयुक्त आहार दिला असता त्यांचे शरीरमेदात आणि सस्तन प्राण्यांच्या बाबतीत त्यांच्या दुधातील मेदात (मलई, लोणी किंवा तूप यांत) फरक पडतो. आहारातील मेदाच्या मेदाम्लाशी या फरकाचा संबंध दाखविता येतो. गायींना मेदयुक्त अन्न दिल्याने त्यांच्या दुधातील मेद-घटकांमधील मेदाम्लांच्या प्रमाणात कसे बदल होतात, ते कोष्टक क्र. ३ वरून दिसून येईल. या अन्नात योजलेल्या मेदांचे विश्लेषण खाली दिले आहे. कोष्टक क्र. १ मधील आकड्यांवरून हे दिसून येईल की, प्राण्यांच्या शरीरमेदाच्या मेदाम्लात एकूण मेदाम्लांच्या सु. ३० ते ५०% भाग C16 आणि C18 या दोन तृप्त मेदाम्लांनी व्यापलेला आहे, तर उरलेल्यापैकी २५ ते ४०% ओलेइक अम्ल आहे. या मेदातील मेदाम्लांत एकूण अतृप्त बंध जलचर प्राण्यांच्या मेदांतील मेदाम्लांशी तुलना करता (कोष्टक क्र. ४) पुष्कळच कमी आहेत. या मेदांचे वितळबिंदू साधारणपणे ३०° से.च्या वर असल्यामुळे ती घनरूप असतात. गाय व म्हैस यांच्या दुधातील मेदात C4, C6, C8 व C10 ह्या तृप्त मेदाम्लांचे मिळून प्रमाण एकूण मेदाम्लांच्या सु. ७–१०% असते. सर्व रवंथ करणाऱ्या प्राण्यांचा विचार केल्यास हे प्रमाण ५–३०% असू शकते. हे प्रमाण बाष्प–उर्ध्वपातनाने (तापविलेल्या द्रवातून वाफ बुडबुड्यांच्या रूपाने जाऊ देऊन घटक अलग करण्याच्या पद्धतीने) काढतात. या मेदाम्लांचे ह्या प्रमाणात असणारे अस्तित्व हे या मेदांचे वैशिष्ट्य होय. खोबरेल तेल व पाम मगज तेल (पाम केर्नेल ऑइल) यांच्या मेदांत मात्र ही C6, C8 व C10 तृप्त मेदाम्लेही असतात परंतु C4 घटक फक्त दुधातील मेदाच्या मेदाम्लांतच असतो (लोणी हे दुधातील मेद व १६ ते २०% पाणी यांचे पायस होय. त्यातील मेदाम्लांची टक्केवारी देताना ती निर्जलीकरण केलेल्या लोण्यातील आहे असे समजावे.)
कोष्टक क्र. २. निरनिराळ्या प्राण्यांच्या दुधामधील मेदांतील घटक मेदाम्ले व त्यांची टक्केवारी (वजनी). (अगदी अल्प प्रमाणात असलेल्या अतृप्त मेदाम्लांचा यांत वेगळा समावेश केलेला नाही.)
| मेदाम्ले प्रकार
व कार्बनसंख्या |
मेंढी
(भारतीय) |
म्हैस
(भारतीय) |
गाय
(भारतीय) |
गाय
(इंग्लिश) |
म्हैस
(तुर्की) |
उंटीण
(भारतीय) |
| तृप्त | ||||||
| C4 | ३·३ | ४·१ | ३·३ | ४·४ | ४·३ | २·१ |
| C6 | २·८ | १·४ | २·१ | १·४ | १·३ | ०·९ |
| C8 | ३·८ | ०·९ | १·० | १·८ | ०·४ | ०·६ |
| C10 | ७·८ | १·७ | २·३ | १·९ | अत्यल्प | १·४ |
| C12 | ५·४ | २·८ | ३·७ | ३·१ | ३·० | ४·६ |
| C14 | १२·२ | १०·१ | ५·८ | ९·३ | ७·३ | ७·३ |
| C16 | २३·५ | ३१·१ | ३०·० | २७·५ | २६·१ | २९·३ |
| C18 (स्टिअरिक) | ६·९ | ११·२ | ११·२ | १२·२ | १६·५ | ११·१ |
| C20 व जास्त लांबीची | १·९ | ०·९ | — | १·० | ३·३ | — |
| अतृप्त | ||||||
| ओलेइक | २८·३ | ३३·२ | ३५·५ | ३३·१ | ३५·८ | ३८·८ |
| लिनोलीइक | ४·१ | २·६ | ५·१ | ३·१ | २·० | ३·८ |
| C20 ते C22 | — | — | — | १·२ | — | — |
कोष्टक क्र. ३ मधील मेदाम्लांच्या प्रमाणांवरून असे दिसून येईल की, अन्नातून दिलेल्या मेदात जर अतृप्त बंध असलेल्या मेदाम्लांचे प्रमाण जास्त असेल, तर दुधामधील मेदातील मेदाम्लांतही अतृप्त वर्गातील मेदाम्लांचे प्रमाण वाढते. टी. पी. हिल्डिच यांच्या मताला या प्रयोगाने बळकटी येते.
वनस्पतिजन्य मेदे : फळाच्या मगजातून (गरातून) मिळणारी व बियांपासून मिळणारी मेदे सर्वांना परिचित आहेत. वनस्पतीच्या खोड, मूळ, फुले यांच्यापासूनही मेदे मिळतात पण अशी उदाहरणे थोडी आहेत. सामान्यतः या भागांत मेदांचे प्रमाणही अत्यल्प असते. मोठ्या प्रमाणात आढळणाऱ्या वनस्पतिजन्य मेदांची वर्गवारी खालीलप्रमाणे करण्यात येते : (१) फळांच्या मगजातील मेदे व (२) बियांपासून मिळणारी. यांपैकी दुसरा वर्ग अतिशय मोठा असून या वर्गाचे त्यांच्यातील घटक मेदाम्लांच्या टक्केवारीतील साम्यानुसार उपभाग पाडले जातात. या मेदांत पामिटिक, ओलेइक, लिनोलीइक व लिनोलीनिक ही मेदाम्ले प्रामुख्याने आढळतात आणि वनस्पतींच्या जातीनुसार एकाच वर्गातील वनस्पतीच्या बियांपासून मिळणाऱ्या मेदात एखादे विशिष्ट मेदाम्ल आढळून येते. उदा., इरुसिक अम्ल (१३ डूकोसेनॉइक C22 अम्ल) क्रुसिफेरी आणि ट्रोपिओलेसी या कुलांतील वनस्पतींच्या बियांतील मेदात असते, तर इलिओस्टिअरिक अम्ल हे ॲल्युराइट्स कॉर्डेटा आणि ॲल्युराइट्स फोर्डाय या वनस्पतींच्या बियांतील मेदात आढळते. तसेच रिसिनोलिइक अम्ल हे एरंड (रिसिनस कम्युनिस) या वनस्पतीतील आणि यूफोर्बिएसी व ओलिएसी या कुलांतील बऱ्याच वनस्पतींमधील मेदांतील मेदाम्लांत सापडते.
वनस्पतिजन्य मेदे प्राणिजन्य मेदांपेक्षा किंवा संश्लिष्ट मेदांपेक्षा जास्त टिकाऊ स्वरूपाची असतात, कारण या मेदांत अत्यंत थोड्या प्रमाणात असणारे परंतु अतिशय महत्त्वाचे प्रतिऑक्सिडीकारक (ऑक्सिडीकरण होण्यास विरोध करणारे) घटक असतात. हे घटक म्हणजे α, β, व γ टोकोफेरॉले हे होत. यांपैकी α घटकालाच ई जीवनसत्त्व म्हणतात. हे पदार्थ मेदांचे ऑक्सिडीकरण नेमके कसे थोपवून धरतात, याची नीट उकल अजून झालेली नाही. अशाच गुणधर्मांचे आणखी काही घटक मेदांमध्ये आढळतात. उदा., सरकीच्या तेलातील गॉसिपॉल, तिळाच्या तेलातील सिसॅमोलीन व सिसॅमीन वगैरे. अखाद्य तेलांत असणारी काही संयुगे उदा., लिंबोणीच्या तेलातील निंबीन, करंजेल तेलातील करंजीन ही सर्व प्रतिऑक्सिडीकारक द्रव्येच आहेत.
वनस्पतिजन्य मेदांच्या निरनिराळ्या वर्गांतील मेदांचे काही गुणधर्म व त्याच्या मेदाम्लांची प्रमाणे पुढे दिली आहेत.
फळांच्या आवरणातील मेदे : या वर्गातील मेदांची संख्या मोजकीच आहे. मूळ प. अफिक्रेतील ⇨ तेल माडाच्या (ऑइल पामच्या) फळांच्या बाह्य मांसल भागांपासून ३०–६०% तेल (पाम तेल) मिळते. या वर्गातील हे महत्त्वाचे मेद होय. याचे उत्पादन फार मोठ्या प्रमाणावर होते. खाद्य तेल म्हणून व साबण तयार करण्यासाठी याचा उपयोग करतात. या मेदाचा वितळबिंदू २७°–५०° से. असतो. ‘चिनी वनस्पतिज टॅलो’ आणि ‘जपानी मेण’ ही मेदे या वर्गातीलच आहेत. पाम तेलात पामिटिक आणि ओलेइक ही अम्ले प्रत्येकी ४० टक्क्यांच्या जवळपास असल्यामुळे या मेदात थोड्या प्रमाणात ट्रायपामिटीन व ट्रायओलेइन असते, असे आढळले आहे. कोष्टक क्र. ४ मध्ये फळांच्या मगजापासून मिळणाऱ्या काही मेदांचे (ऑलिव्ह तेल, चिनी वनस्पतिज टॅलो, जपानी मेण, पाम तेल) विश्लेषण दिले आहे. या वर्गातील मेदांची घटक मेदाम्ले अगदी मोजकीच असतात.
कोष्टक क्र. ३ गायीच्या अन्नात विशिष्ट मेदाचा समावेश केला असता तिच्या दुधामधील मेदातील मेदाम्लांत पडणारा फरक, टक्केवारी मेदाम्लांच्या रेणूच्या प्रमाणात (अन्नातून दिलेल्या मेदाच्या खालीच त्याची आयोडीन मूल्यांची व्याप्ती कंसात दिली आहे).
| दुधामधील मेदातील मेदाम्ले | खोबरेल तेल
(७५–१०५) |
सोयाबीन तेल
(१२०–१४०) |
जवसाचे तेल
(१७०–२००) |
कॉडलिव्हर तेल
(१४०–१८०) |
| तृप्त | ||||
| C4 | ९·० | ९·६ | ११·२ | ६·१ |
| C6 | ३·९ | ३·० | ४·१ | २·० |
| C8 | १·७ | २·८ | २·१ | ०·८ |
| C10 | ४·३ | ५·१ | ३·१ | १·८ |
| C12 | ८·३ | ७·५ | ३·६ | ३·९ |
| C14 | १७·२ | १०·७ | ४·६ | ७·१ |
| C16 (पामिटिक) | २४·१ | २३·७ | २०·० | २२·४ |
| C18 (स्टिअरिक) | ३·९ | ६·७ | ८·२ | ६·० |
| C20 ते C22 | – | ०·९ | ०·४ | ०·५ |
| अतृप्त | ||||
| C18 (ओलेइक) | २५·०७ | २७·० | ३२·८ | ३८·८ |
| C18 (दोन अतृप्त बंध असलेली) | १·९ | ३·० | ५·० | ४·४ |
| C20 ते C22 | – | – | ०·९ | ६·२ |
बीजजन्य मेदे : खोबरेल तेल व तेल माडाच्या बीजाच्या मगजापासून मिळणारे तेल (पाम मगज तेल) ही या वर्गातील फार मोठ्या प्रमाणावर उत्पादन केली जाणारी मेदे असून खाद्य तेल व साबण तयार करण्यासाठी यांचा उपयोग करतात. नारळ व तेल माड या दोन्हींच्या मोठ्या बागा असतात. पाम तेल (फलावरणाचे) आणि पाम मगज तेल यांतील फरक लक्षात घेण्यासारखा आहे. या वर्गातील मेदात C8 ते C20 तृप्त मेदाम्ले जवळजवळ ८०–९०% असून उरलेला बहुतेक भाग अतृप्त मेदाम्लाने (ओलेइक) व्यापलेला असतो. यात तृप्त मेदाम्लांपैकी लॉरिक अम्ल ३८–५२% आणि स्टिअरिक व लिनोलीइक १–३ टक्केच असते. या मेदांच्या ग्लिसराइडांमध्ये मोनोमिरिस्टिलडायलॉरिल मोठ्या प्रमाणात आढळून येते आणि हे या मेदातील या दोन मेदाम्लांच्या प्रमाणावरून लक्षात येईल. ब्राझील आणि आफ्रिका येथे अनुक्रमे उत्पादन केली जाणारी मुरूमुरू आणि बाबासू मेदे याच वर्गातील असून फार उपयोगी आहेत. वरील प्रदेशांतून ही इंग्लंड, अमेरिका येथेही निर्यात होतात. या वर्गातील मेदांचा वितळबिंदू २५°–३०° से. असून यांच्या घटक मेदाम्लांतील C8 ते C12 या मेदाम्लांचे प्रमाण लक्षात घेण्यासारखे आहे. फक्त दुधाच्या मेदातील मेदाम्लात अशी कमी कार्बन अणू असलेली मेदाम्ले असतात. कोष्टक क्र. ४ मध्ये या वर्गातील काही मेदांची (खोबरे, पाम मगज तेल, बाबासू व मुरूमुरू) मेदाम्ले आणि मेदांची आयोडीन मूल्ये व साबणीकरण मूल्ये दिलेली आहेत.
ज्यांचे वितळबिंदू साधारण २५° से.पेक्षा जास्त आहेत अशा बीजजन्य मेदांचे त्यांतील प्रमुख घटक मेदाम्लानुसार मुख्यतः दोन वर्ग पाडता येतील : (१) ज्यांच्या मेदाम्लांत लॉरिक (C12) व मिरिस्टिक (C14) अम्ले हे प्रमुख घटक आहेत आणि (२) ज्यांत पामिटिक (C16) किंवा स्टिअरिक (C18) अम्ल प्रमुख घटक आहेत अशी मेदे.
या जातीच्या मेदांचे उत्पादन फार मोठ्या प्रमाणावर केले जात नाही परंतु यांच्या मेदाम्लांत एक किंवा दोन घटक मेदाम्ले एवढ्या मोठ्या प्रमाणात असतात की, ही मेदाम्ले खास उपयोगाकरिता शुद्ध स्वरूपात हवी असल्यास या मेदांपासून तयार करता येतात. एरवी बऱ्याच मेदाम्लांच्या मिश्रणातून एखादे शुद्ध मेदाम्ल वेगळे काढणे फारच कष्टाचे असते. या वर्गापैकी काही मेदांचे उत्पादन भारतात होते. कोष्टक क्र. ४ मध्ये या वर्गांपैकी किंकानेला (खकन), कोकम, कोको बटर, पिशा व बोर्निओ टॅलो या विशेष मेदांचे विश्लेषण दिले आहे. यांतील काही अखाद्या असून त्यांची थोडी माहिती पुढे दिली आहे.
सर्वसाधारण हवेच्या तापमानाला द्रवरूप असणाऱ्या वनस्पतिज मेदांचे तीन वर्ग पडतात : (अ) शुष्कन (पूर्णपणे वाळणारी) मेदे (आयोडीन मूल्य १३० पेक्षा जास्त असलेली), (आ) अर्धशुष्कन (अर्धवट वाळणारी) मेदे (आयोडीन मूल्य ९०–१३०) आणि (इ) अशुष्कन (न वाळणारी) मेदे (आयोडीन मूल्य ९० पेक्षा कमी असलेली). कोष्टक क्र. ४ मध्ये या तीनही वर्गांतील काही महत्त्वाची मेदे (एरंडी, करडी, कारळे, जवस, टुंग, तीळ, पेरिल्ला, भुईमूग, मोहरी, राई, सरकी, सोयाबीन व सूर्यफूल) व त्यांची घटक मेदाम्ले दिली आहेत. या मेदांना मराठीत ‘तेल’ या नावानेच संबोधिले जाते म्हणून त्यांच्या विशेष माहितीत त्यांचा तेल असाच उल्लेख केलेला आहे. उदा., करडीचे तेल, शेंगदाण्याचे (भुईमुगाचे) तेल. (अ) वर्गातील मेदांचा उपयोग मुख्यतः तेलरंगांसाठी व रोगण म्हणून केला जातो. भागशः हायड्रोजनीकरण करून नंतर यांचा साबण व वंगण यांकरिताही काही प्रमाणात उपयोग करतात. (आ) व (इ) वर्गांतील मेदे मुख्यतः खाद्य मेदे असून त्यांचे उत्पादन फार मोठ्या प्रमाणावर होते.
खाद्य व अखाद्य मेदे : मेदांचे खाद्य मेदे आणि अखाद्य मेदे हे वर्गीकरण थोडेसे गोंधळात टाकणारे आहे. या वर्गीकरणाचा मूळचा, पाश्चात्त्य देशांत समजला जाणारा अर्थ म्हणजे अनुक्रमे खाण्याकरिता व उद्योग व्यवसायात उपयोगात आणली जाणारी मेदे हा होय. त्या देशांत ज्यांचे शुद्धीकरण केलेले नाही अशी मेदे अखाद्य गणली जातात. साधारणपणे मेदातील मुक्त मेदाम्ले व त्यात खाण्यास अयोग्य असलेली शुद्धीकरणाने काढून टाकल्याल ते मेद खाण्यास योग्य होते. कडूलिंबाच्या बियांचे तेल, करंजीचे तेल (करंजेल) हीसुद्धा खाण्यायोग्य करता येतील परंतु ते अतिशय खर्चाचे होईल आणि किफायतशीर होणार नाही म्हणून ही मेदे व्यावसायिक कारणांसाठीच वापरणे श्रेयस्कर ठरते व त्यांना अखाद्य मेदे म्हटले जाते.
भारतात खाद्य आणि अखाद्य या वर्गीकरणाकडे लक्ष जाण्याचे कारण म्हणजे भारतात खाद्य समजली जाणारी मेदे खाण्यासाठी तसेच साबण, वंगण, तेलरंग, व्हार्निश यांकरिता व मेदाम्लांपासून बनणारी रसायने या सर्वांसाठी वापरली जातात. या एकूण गरजेच्या मानाने त्यांचे उत्पादन अपुरे असल्यामुळे परदेशातून मोठ्या प्रमाणावर मेदांची आयात करावी लागते. ही आयात थांबवावयाची असेल, तर खाद्य मेदे खाण्यासाठीच वापरून उरलेली व्यावसायिक कारणासाठी उपयोगात आणली पाहिजेत आणि याशिवाय या दुसऱ्या कारणांसाठी आवश्यक असलेल्या मेदांचा पुरवठा अखाद्य मेदांतून झाला पाहिजे. ही अखाद्य मेदे म्हणजे लिंबोणीचे तेल, किंकानेला मेद, करंजेल, महुआ तेल वगैरे. भारतात प्राणिजन्य मेदे अखाद्य समजतात त्यामुळे त्यांचेही उत्पादन वाढवल्यास व्यावसायिक कारणासाठी लागणाऱ्या मेदांची पुष्कळशी गरज याने भागेल. या सर्वांच्या जोडीला मेदांच्या शुद्धीकरणातून मिळणारी मुक्त मेदाम्लेही उपयोगात आणता येतील.
वनस्पतिजन्य अखाद्य मेदांसंबंधी बरीचशी उपयुक्त माहिती १९५० सालानंतर मिळविली गेली आहे. कोष्टक क्र. ५ मध्ये यांचे उत्पादन भारतात कोणत्या प्रदेशात होते याची माहिती दिली आहे. यांपैकी काही मेदांचा उपयोग साबणासारख्या व्यवसायातून केला जात आहे परंतु असेही आढळून आले आहे की, या साबणांची प्रत चांगली नसते. या मेदांचे शुद्धीकरण करून व्यवसायात त्यांचा उपयोग करणे महाग पडेल. याकरिता पर्याय म्हणून त्यांचे जलीय विच्छेदन करून मिळणारी मेदाम्ले ऊर्ध्वपातनाने शुद्ध करून त्यांचा व्यवसायात उपयोग करणे शक्य होईल. या पद्धतीने ग्लिसरिनासारखा महत्त्वाचा पदार्थही अनायासे मिळू शकेल. या दृष्टीने कोष्टक क्र. ५ मध्ये दिलेली तेले महत्त्वाची आहेत. कोष्टक क्र. ४ मध्ये यांपैकी नहूर व साल सोडून बाकीच्या मेदांचे संश्लेषण आलेले आहे.
| कोष्टक क्र. ५. भारतातील अखाद्य वनस्पतिजन्य मेदे | |
| मेदाचे नाव | उत्पादन करणारे प्रदेश |
| लिंबोणीचे तेल (नीम तेल) | महाराष्ट्र, कर्नाटक, तमिळनाडू, गुजरात, आंध्र प्रदेश, उत्तर प्रदेश. |
| महुआ तेल | महाराष्ट्र, गुजरात, बिहार, उत्तर प्रदेश व मध्य प्रदेश. |
| करंजेल | महाराष्ट्र, कर्नाटक, तमिळनाडू. |
| किंकानेला | गुजरात, राजस्थान, पंजाब. |
| उंडी | केरळ, ओरिसा, महाराष्ट्र, कर्नाटक. |
| पिसा | कर्नाटक, महाराष्ट्र. |
| कोकम | कर्नाटक, महाराष्ट्र. |
| कुसुम तेल | प. बंगाल, ओरिसा. |
| नहूर | आसाम, केरळ, प. बंगाल. |
| साल | उ. प्रदेश, प. बंगाल, ओरिसा. |
मॅलोटस फिलिपीनेन्सिस (उ. प्रदेश) या झाडाच्या बियांपासून मिळणारे कमला तेल जलद वाळणारे तेल म्हणून उपयोगी आहे. बियांमध्ये सु. ३२% तेल असते व त्याच्या मेदाम्लांत एकांतरीत तीन अतृप्त बंध असलेले कमलोलेनिक मेदाम्ल ५८% असते. त्यामुळे त्यात जलद वाळण्याचा गुणधर्म असतो परंतु या बिया फारच थोड्या प्रमाणात गोळा केल्या जातात.
अखाद्य मेदांच्या बियांच्या उत्पादनासंबंधी मिळत असलेल्या माहितीत विसंगती आढळते. तेलबिया गोळा करण्याच्या व्यवसायाचा, खेडुतांना कामधंदा मिळेल आणि मिळकत होईल, या दृष्टीने उपयोग केला गेला पाहिजे.
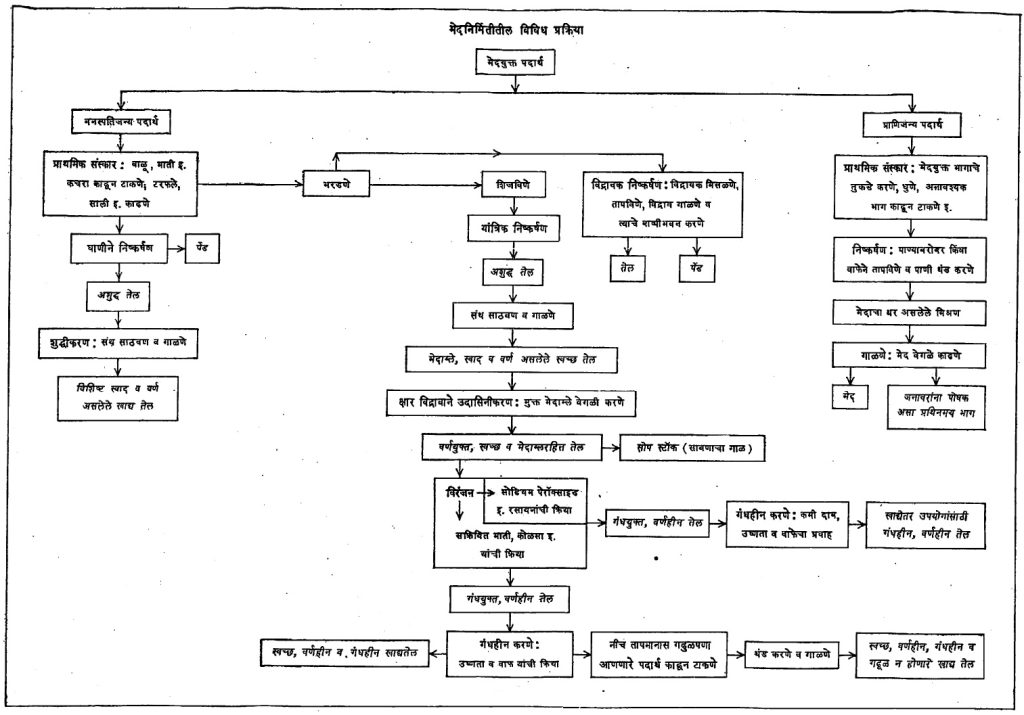
निष्कर्षण : मेदयुक्त पदार्थांपासून मेदांचे मोठ्या प्रमाणावर निष्कर्षण करण्यापूर्वी हे पदार्थ सुस्थितीत आहेत किंवा नाहीत याची तपासणी करणे जरूर असते. प्राणिजन्य पदार्थ थोड्या अवधीत नासतात व त्यामुळे त्यांतील मेदे (चरबी) शक्य तेवढ्या लवकर काढावी लागतात. तेलबिया पुष्कळ काळ टिकतात, त्यामुळे जरूरीप्रमाणे त्यांचे निष्कर्षण सावकाशीने केले तरी चालते. वनस्पतिजन्य व प्राणिजन्य पदार्थांत असणारी एंझाइमे मेदांचे संश्लेषण आणि विच्छेदन अशा दोन्ही क्रिया करण्यास पात्र असल्यामुळे निष्कर्षणासाठी साठवून ठेवलेल्या पदार्थांत विच्छेदनाची क्रिया सुरू झाल्यास मेदात मुक्त मेदाम्लांचे प्रमाण वाढते. त्याचप्रमाणे या पदार्थांच्या पेशींमधून आणि पृष्ठभागावर जंतूंची किंवा बुरशीची वाढ सुरू झाल्यास त्यामुळेही मेदसंयुगांचे अपघटन होते व परिणामी हे घटक (केव्हा केव्हा अपायकारक असलेलेही) निष्कर्षणाच्या वेळी मेदात उतरतात. मेदयुक्त पदार्थ चांगल्या स्थितीत आहेत असे निश्चित झाल्यानंतरच त्यांचे मोठ्या प्रमाणावर निष्कर्षण करतात. नित्योपयोगी खाद्य मेदांच्या बिया किंवा फळातील मेदयुक्त मगज यांमध्ये पाणी, मेद, प्रथिने व इतर घटक यांची प्रमाणे काय असतात, हे संदर्भ ग्रंथांतून दिलेले असते.
मेदयुक्त पदार्थांपासून मेदाचे निष्कर्षण करण्याच्या विषयात झालेली प्रगती ही मुख्यतः पुढील ध्येये डोळ्यापुढे ठेवून झालेली आहे : (अ) पदार्थात असलेल्या मेदाचे जास्तीत जास्त निष्कर्षण व्हावे. (आ) त्यात मेदाव्यतिरिक्त अन्नपदार्थ येऊ नयेत व मेदाची प्रत कमी होऊ नये. (इ) मेद वजा जाता उरलेली पेंड चांगल्या प्रतीची मिळावी, कारण तीत प्रथिनांचा भाग फार मोठा असतो व जनावरांना ती सकस खाद्य म्हणून उपयोगात येते.
मेदयुक्त पदार्थांपासून प्रत्यक्ष मेद काढण्याच्या क्रियेपूर्वी, मेदाचे प्रमाण जास्तीत जास्त निघून यावे यासाठी त्या पदार्थांवर काही प्राथमिक संस्कार केले जातात. उदा., तेलबियांच्या वर टरफल किंवा कठीण आवरण असल्यास सोईस्कर यंत्राने ते काढून टाकून त्या ठेचतात.
प्राणिजन्य व वनस्पतिजन्य पदार्थांपासून मेद काढण्याच्या पद्धतींनी माहिती खाली दिली आहे.
प्राणिजन्य पदार्थांपासून मेदांचे निष्कर्षण : रेंडरिंग : ही पद्धत अलीकडे मुख्यतः प्राणिज पदार्थापासून मेद काढण्यासाठी वापरली जाते. तथापि ऑलिव्ह, पाम, कोकम बिया इत्यादींतील सहज निघणारे तेल मिळविण्यासाठी काही प्रमाणात ही अजूनही वापरली जाते. मेदयुक्त पदार्थ पाण्याबरोबर किंवा वाफेच्या साहाय्याने उकळला म्हणजे त्यातील मेद बाहेर पडते आणि पाणी व मेद यांचे मिश्रण बनते. ते थंड केले म्हणजे मेदाचा थर पाण्यावर तरंगतो तो वेगळा काढून घेतात.
या पद्धतीने मांस, मासे व तत्सम प्राणिज पदार्थांपासून मेद मिळविण्यासाठी प्रथम एखाद्या विशिष्ट अवयवाचे मेद काढावयाचे असेल, तर तो अवयव (उदा., यकृत) वेगळा करून घेतात व यंत्राच्या सहाय्याने त्याचे बारीक तुकडे करून ते पाण्याने धुतात व हाडे, तंतुमय आवरण इ. अनावश्यक भाग काढून टाकतात. अशा तऱ्हेने उरलेल्या पदार्थात ७०–९०% एवढे मेद असते. मेद वजा जाता जो चोथा उरतो त्यात प्रथिने भरपूर असतात. प्राण्यांना पौष्टिक खाद्य म्हणून त्याचा उपयोग होतो. हाडे व तंतुमय भाग यांपासून १०–१५% दुय्यम दर्जाचे मेद मिळते. देवमाशाचा जो मेदयुक्त भाग (ब्लबर) असतो त्यात ७०% मेद असते आणि अशा एका माशापासून सु. १२ ते १७ टन मेद मिळते. ब्लबराचे लहान तुकडे केल्यानंतर त्यातील मेद काढण्यासाठी शुष्क रेंडरिंग व आर्द्र रेंडरिंग अशा दोन पद्धती आहेत. यांपैकी दुसरी जास्त प्रमाणावर वापरली जाते. पहिल्या पद्धतीत पदार्थाचे तुकडे मोठ्या पात्रात घालून तापवितात. या पात्राला बाहेरून वाफेने उष्णता देण्यासाठी आवरण असते व आतील पदार्थ हालविला जाण्यासाठी पट्ट्या असलेली फिरती ढवळणी असते. मेदयुक्त पदार्थ विशिष्ट मर्यादेपर्यंत तापवून झाल्यानंतर या कढत मिश्रणातून वितळलेल्या मेदाचा भाग वेगळा काढतात. ही क्रिया बंद भांड्यात अर्धनिर्वात स्थितीत केल्यास मिळणारे मेद जास्त चांगल्या प्रतीचे असते. आर्द्रपद्धतीत पदार्थाचे तुकडे पाण्याबरोबर काही तास शिजवितात व तरंगून वर आलेला मेदाचा थर वेगळा करतात. आर्द्र पद्धतीत वाफेच्या जास्त दाबाखाली सुद्धा पदार्थ शिजविणे प्रचारात आहे. बंद भांड्यात वाफ सोडून दर चौ. सेंमी.ला २·८–४·२ किग्रॅ. वाफेच्या दाबाखाली ४–६ तास पदार्थ शिजवितात व नंतर मेद वेगळे करतात. खाण्यासाठी काढलेले मेद आर्द्र पद्धतीनेच काढलेले असते व ते रंग, वास, चव या सर्व दृष्टींनी शुष्क पद्धतीतून मिळणाऱ्या मेदापेक्षा सरस असते. वाफेच्या जास्त दाबाखाली निष्कर्षण केले असता मेदाचा उतारा ९९% पर्यंत पडतो. वरीलप्रमाणे कोणत्याही पद्धतीने मेद काढले, तरी शेवटी त्यात मिसळून राहिलेले पाणी काढून टाकण्यासाठी निरनिराळी केंद्रोत्सारित्रे (भिन्न सापेक्ष घनता असलेले पदार्थ वेगळे करण्याची साधने) उपयोगात आणतात. केंद्रोत्सारित्राच्या वरच्या तोटीमधून मिळणारे मेद स्वच्छ व जलरहित असते. किंगन, टिटान, डे लाव्हाल, शार्पलेस अशा उत्तमोत्तम केंद्रोत्सारी पद्धती उपलब्ध आहेत. आर्द्र पद्धतीत काही वेळा विरल क्षार विद्राव, एंझाइम किंवा काही रसायने यांचा उपयोग करतात. त्यामुळे मेद लवकर वेगळे होते व मेदाची गुणवत्ताही सुधारते.
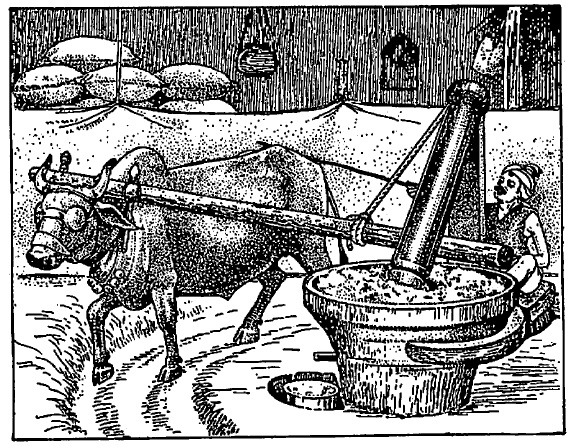
वनस्पतिजन्य पदार्थांपासून मेदांचे निष्कर्षण : दाबाच्या योगाने निष्कर्षण : भुईमूग, तीळ, करडई इत्यादींच्या बियांपासून तेल काढण्यासाठी दगडी घाण्याचा उपयोग पूर्वापार चालत आलेला आहे. या घाण्यात एक दगडी उखळी असून तीमध्ये एक वजनदार लाकडी दांडा (लाट) बैलाच्या शक्तीने फिरविला जातो. उखळीत तेलबिया घातल्या म्हणजे लाटेच्या दाबाने त्या चिरडल्या जाऊन त्यामधील तेल बाहेर पडते. नंतर लाट बाहेर काढून उखळीतील तेल, त्यात तेल, त्यात कापड बुडवून व ते बाहेर काढून पिळून मिळवितात. या घाणीचा एक सुधारलेला प्रकार म्हणजे कोलू घाणी. या घाणीची उखळी लाकडी असून तिच्या बुडाला भोक ठेवलेले असते. त्यातून तेल बाहेर पडते त्यामुळे लाट बाहेर काढणे व कापडाने तेल शोषण करून घेणे हे श्रम वाचतात. यातील लाटेला बोजापाट लावून त्यावर वजने ठेवतात. त्यामुळे दाबात वाढ होऊन तेलाचा उताराही वाढतो. महाराष्ट्र शासनाने तयार केलेल्या नव्या घाणीत उखळी काँक्रिटची बनविलेली असून बोजापाट लाटेच्या माथ्यावर लोंबता ठेवलेला आहे. या योजनेमुळे घर्षणामुळे वाया जाणारी बैलाची शक्ती वाचते व शिवाय जास्त दाब उपलब्ध होऊन तेलाचे प्रमाणही वाढते. यात गोलक धारवे (बॉल बेअरिंग्ज) वापरले असल्यामुळे ही चालविण्यास हलकी असते. एका बैलाच्या शक्तीने ८ तासात दगडी घाणीने ४० किग्रॅ. कोलू घाणीने ४८ किग्रॅ. व नव्या घाणीने ९० किग्रॅ. तेलबियांचे तेल काढता येते. लाट फिरविण्यासाठी या घाणीत डीझेल एंजिन किंवा विद्युत शक्तीही वापरता येते.
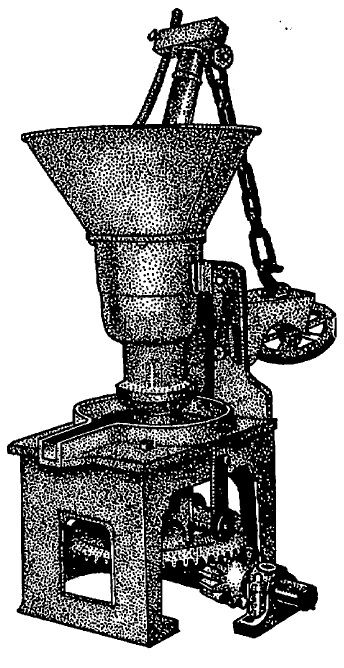
यांत्रिक दाबाच्या साहाय्याने निष्कर्षण : मोठ्या प्रमाणावर व तेलाचा उतारा उच्च पडेल अशा तऱ्हेने निष्कर्षण करण्यासाठी यांत्रिक दाबाचा उपयोग केला जातो. शिवाय त्यापूर्वी तेलबियांवर काही प्राथमिक प्रक्रिया करून घ्याव्या लागतात. या पद्धतीत अनेक टप्पे आहेत. सुरूवातीस लिहिल्याप्रमाणे बियांच्या नमुन्यांची तपासणी झाली की, चाळणीवजा यंत्रांच्या योगाने त्यांमधील रेवाळ माती, खडे, काटक्या यांसारखे अनिष्ट पदार्थ दूर करतात. साफ करण्याच्या क्रियेतील हा पहिला टप्पा होय. दुसरा टप्पा म्हणजे बियांच्या वरील टरफल अगर साल काढून आतील मगज वेगळा करणे हा उदा., भुईमुगाच्या शेंगांपासून दाणे वेगळे करण्याची क्रिया, कापसातील सरकी काढून टाकण्याच्या यंत्रातून (जिनमधून) आलेल्या सरकीवर उरलेला कापूस (लिंट) प्रथम काढून घेऊन मगच सरकीचे टरफल काढून टाकतात. नंतर टरफलासहित बियांचे मगज भरडून बारीक करतात. हा तिसरा टप्पा होय. याला भरडा म्हणू या. हा भरडा नंतर विवक्षित पाण्याचे प्रमाण आणि तापमान (१००°-११०° से.) वापरून शिजविला जातो. याकरिता योजलेल्या अनेक साधनांपैकी स्टॅक कुकर हे एक साधन आहे. हे एक ०·६–२·० मी. व्यासाचे उभट पीप असून त्यात एकावर एक असे ३ ते ६ कप्पे असतात. कप्प्यांचे तळ पोकळ असून त्यातून वाफ जाईल अशी योजना असते. कप्प्यात भरलेला पदार्थ फिरविला जावा म्हणून तळावर फिरक्या असतात आणि त्या पिपाच्या मध्यातून जाणाऱ्या उभ्या व फिरत्या दांड्याला जोडलेल्या असतात. कप्प्यांच्या तळाला खिडक्या असून त्यांतून वरच्या कप्यातील पदार्थ खालच्या कप्यात पडतो. सर्वांत वरच्या कप्यात वाफ सोडलेली असते. तळच्या कप्प्यामधून हवेच्या झोताने भरड्यातील अतिरिकत पाणी काढून टाकले जाते. सर्व कप्प्यांच्या मधून खाली आलेला माल अवश्य तेवढा शिजलेला व पाण्याचे प्रमाण यथायोग्य असलेला असतो. भरडलेल्या बिया (अगर मगज) शिजविल्याने पुढील गोष्टी घडून येतात : (अ) बियांवर वाफ सोडून त्या शिजविल्या जात असल्यामुळे त्या मऊ होतात आणि त्यावर अपायकारक बुरशी अथवा जंतू असल्यास त्यांचा नाश होतो. (आ) बियांतील प्रथिनांचे किलाटन (न विरघळणाऱ्या साक्याच्या स्वरूपात रूपांतर) झाल्यामुळे त्यातील तेलाचे सूक्ष्म थेंब एकत्रित होऊन मोठे थेंब बनतात. (इ) पापुद्र्यांमधील छिद्रे उमलली जातात. (ई) बियांतील पाण्याचे प्रमाण वाढले गेल्यामुळे त्यांची तेल पकडून ठेवण्याची पात्रता कमी होते. या सर्वांचा परिणाम म्हणजे एरवी मेद काढण्यासाठी जेवढा दाब वापरावा लागला असता त्याच्यापेक्षा अनेक पटींनी कमी दाब वापरून जास्त प्रमाणात तेल निघते.
काही बाबतींत, या शिजविण्याच्या क्रियेच्या वेळी योग्य ते pH मू्ल्य [→ पीएच मू्ल्य] राखल्यास काही चांगले परिणाम दिसतात. उदा. शिजविताना pH मू्ल्य ठेवल्यास सरकीपासून मिळणाऱ्या तेलात गॉसिपॉलाचे प्रमाण अगदी कमी असते. साठवणीने त्याचा रंग बदलत नाही व शुद्धीकरण प्रक्रियेत तेल कमी वाया जाते. पेंडीमध्ये मात्र गॉसिपॉलाचे प्रमाण वाढते.
काही मेदबिया दाबयंत्रात घालण्यापूर्वी शिजवीत नाहीत. या पद्धतीने निष्कर्षण करण्याच्या पद्धतीला शीत पद्धत म्हणतात. एरंडेल आणि चांगल्या प्रतीचे ऑलिव्ह तेल शीत पद्धतीने काढतात.
शिजविलेला भरडा लगेच दाबयंत्रात घालून तेल व पेंड मिळविणे हा पाचवा आणि शेवटचा टप्पा होय. यातून मेदाचे जास्तीत जास्त निष्कर्षण होणे हे त्यावर दिला जाणारा दाब, जास्तीत जास्त दाब किती वेळ ठेवला होता, दाब दिला जात असताना पदार्थाचे तापमान किती होते व त्या तापमानाला मेदाची श्यानता किती आहे, या सर्वांवर अवलंबून असते.
दाबयंत्रांनी मेद काढण्याचे दोन प्रमुख प्रकार आहेत. एकात निष्कर्षण करण्याचा पदार्थ हप्त्याहप्त्याने यंत्रात भरला जातो व त्याचे निष्कर्षण झाल्यानंतर पेंड काढून घेऊन पुन्हा नवीन पदार्थ भरण्यात येतो. साहजिकच निष्कर्षणाची क्रिया पदार्थ पुन्हा भरून होईपर्यंत बंद राहते. या प्रकाराच्या निष्कर्षण यंत्राची रचना अशी असते की, एका बाजूने पदार्थ यंत्रात भरला जातो आणि दुसऱ्या बाजूने मेद व पेंड वेगळे होऊन बाहेर पडतात. ही क्रिया सतत चालू शकते आणि म्हणून हिला अखंडित प्रक्रिया म्हणता येईल.
खंडित निष्कर्षण प्रक्रिया : खंडित प्रक्रियेत दाब देण्यासाठी जलशक्तीचा उपयोग करतात. खंडित प्रक्रियेतसुद्धा खुली खंडित प्रक्रिया आणि बंद खंडित प्रक्रिया असे दोन पर्याय असून प्रत्येकी दोन प्रकारची यंत्रे उपलब्ध आहेत. खुल्या पद्धतीत शिजवून व ठेचून घेतलेल्या बिया गाळण कापडात गुंडाळून, गठ्ठे करून, जाळीदार पत्र्यात किंवा जाळीच्या पेटीसारख्या साच्यात ठेवून दाबयंत्रात घालतात. या जाळ्या किंवा साचे यांची रचना अशी असते की, दाब पडला असता हे जाळीदार पत्रे किंवा साच्यांचे तळ आणि झाकण ठराविक आसाच्या आधारे सरकतात. त्यामुळे गाळण कापडातील पदार्थ दाबला जाऊन मेद बाहेर पडते. जाळ्या वापरल्या जाणाऱ्या यंत्रात साचे वापरल्या जाणाऱ्या यंत्रापेक्षा जास्त पदार्थ एकावेळी भरता येतो. साच्यांचे आकारमान साधारणतः ८७·५ X ३५ X ५ सें.मी. असून असे १५–१६ पेटी साचे यंत्रात मावतात. या यंत्रातून २४ तासात १० टन भुईमुगाच्या शेंगांचे तेल काढता येते. या खुल्या खंडित प्रक्रियेत प्रत्यक्ष पदार्थांवर दर चौ. सें.मी. स ११६–१३० किग्रॅ. पर्यंत दाब पडतो. जास्त दाब दिल्यास गाळण कापड फाटण्याची भीती असते. पदार्थ भरलेले गठ्ठे किंवा साचे यंत्रात ठेवण्यापासून तो तेल निघेपर्यंत व साच्यातील पेंड काढून टाकण्याच्या संपूर्ण क्रियेस सु. ३६ मिनिटे लागतात. पैकी ६ मिनिटे जास्तीत जास्त दाब येण्याची आणि २६ मिनिटे मेद पूर्णपणे वाहून येण्यास लागतात. निष्कर्षणाचे तापमान ९०°–९५° से. असते. शिजविण्याच्या क्रियेतून मिळालेली उष्णता व दाब दिल्यामुळे वाढणारी उष्णता या दोन्हींमुळे हे तापमान कायम ठेवता येते. खंडित प्रक्रियेत पदार्थ भरण्यास व पेंड काढून घेण्यास वेगळी योजना करावी लागते. बंद खंडित प्रक्रियेत शिजविलेल्या आणि ठेचून घेतलेल्या बिया मोठ्या जाळीदार पिपात किंवा पिजंऱ्यात ठेवतात. गाळण कापडाची यात आवश्यकता नसते. त्यामुळे जास्त दाबाखाली निष्कर्षण करता येते. पिपाच्या उंचीचा गोलाकार पृष्ठभाग ३–४ जाळ्यांच्या थरांचा बनविलेला असतो. आतल्या बाजूने जाड जाळी व बाहेरील बाजूस बारीक जाळी अशी रचना असते. दट्ट्यासारख्या यांत्रिक साधनाने पिपाच्या तळाकडून किंवा झाकणाकडून दाब देऊन दुसरी बाजू पक्की ठेवल्यास पदार्थ दाबला जाऊन जाळीतून गाळलेले तेल बाहेर पडते. निष्कर्षण झाल्यानंतर ही पिपे बाजू्ला घेऊन त्यातील पेंड काढून पुन्हा पदार्थ भरून ती दाबयंत्रात बसवतात. एरंडीसारख्या पदार्थांचे तेल काढताना उच्च तापमान चालत नाही परंतु पूर्ण मेद निघण्यासाठी जास्त दाब द्यावा लागतो. बंद खंडित पद्धतीत हे शक्य होते. खोबरे व पाम मगज यांची तेलेही या पद्धतीने काढतात. बाजूने जाळी ठेवण्याऐवजी तळाला जाळी ठेवल्यास आणि पिपाला बाहेरून वाफ सोडण्यासाठी आवरणाची तजवीज केलेली असल्यास जास्त तापमानालासुद्धा निष्कर्षण करता येते. कोको बटरसारख्या जास्त वितळबिंदू असलेल्या मेदांचे निष्कर्षण अशा यंत्रसामग्रीने करतात. खंडित पद्धतीत पेंडीत ५–६% मेद शिल्लक राहते.

अखंडित निष्कर्षण प्रक्रिया : स्क्रू पद्धतीची दाबयंत्रे वापरात येऊ लागल्यापासून खंडित पद्धत मागे पडू लागली आहे. आपल्या रोजच्या व्यवहारात दाण्याचे पीठ करण्याचे स्क्रू पद्धतीचा आडवा दांडा असलेले जे यंत्र आपण वापरतो, त्याच तत्त्वावर या दाबयंत्राची रचना असते. या पद्धतीने निष्कर्षण सतत चालू ठेवता येते. मजुरी कमी पडते व कोणत्याही मेदबियांकरिता यंत्रातील भागात बदल न करता ते वापरता येते. गाळणी कापडाचा उपयोग करावा लागत नाही. मात्र आवश्यक तो जास्त दाब निर्माण करण्यासाठी यांत्रिक शक्ती जास्त लागते. अशा दाबयंत्रामध्ये स्क्रूसारखे फिरते दांडे असलेले दोन भाग असतात. उभ्या दांड्याच्या योगाने थोडासा दाब दिला असता सहजासहजी बाहेर पडलेले मेद वेगळे होऊन येते व पदार्थ आडवा स्क्रू–दांडा असलेल्या नळीत येतो. या ठिकाणी त्यावर दर चौ.मिमी. स ७·८७–२३·६२ किग्रॅ. एवढा दाब दिला जातो आणि जवळजवळ सर्व मेद बाहेर पडते. या पद्धतीत पेंडीमध्ये ३–५% मेद शिल्लक असते. मेद गाळले जाण्याची योजना स्क्रू–दांड्याच्या बाजूने परंतु त्याला लंबरूप असलेल्या निरनिराळ्या अंतरांवर असलेल्या जाळीदार पत्र्यांच्या मदतीने केलेली असते. या जाळ्यांच्या मध्ये पेंड साठते व मेद गाळून बाहेर येते. या पद्धतीत यांत्रिक दाब एवढा असतो की, त्यामुळे बाहेर येणाऱ्या मेदाचे तापमान खूप वाढते. ते तसेच राहिल्यास यंत्राच्या दृष्टीने ते हानिकारक असते. शिवाय अशा जास्त तापमानाला मेदाचे अपघटन होऊन मेदाची प्रत कमी होण्याचा धोका असतो. याकरिता दांडा फिरत असलेल्या नळीच्या बाहेरील बाजूने गार केलेले, अगोदर काढलेले मेद किंवा पाणी खेळविलेले असते. यामुळे यंत्राचे व मेदाचे तापमान योग्य तितके राखले जाते. यंत्रात भरल्या जाणाऱ्या बिया आधी ठेचून व शिजवून घेतलेल्या असतात हे सुरूवातीला सांगितले आहेच. काही यंत्रसामग्रीत स्क्रू दाबयंत्राच्या वरील बाजूस बिया ठेचून निघण्याची व शिजविण्याची सोय असते आणि अशा तयार झालेल्या बिया स्कू–दांड्याच्या नळीत सरळ ओतल्या जातात.
विद्रावक निष्कर्षण : काही बियांत मेदाचे प्रमाण फार कमी असते. दाबयंत्राने त्यांचे निष्कर्षण केल्यास आणि सामान्यतः २–३% मेद पेंडीत राहते, अशावेळी त्या बियांचे विद्रावकाने निष्कर्षण करणे हिताचे असते. कारण अशा निष्कर्षणानंतर पेंडीमध्ये फक्त ०·५–१% एवढेच मेद शिल्ल्क राहते. विद्रावक निष्कर्षणासाठी मुख्यत्वेकरून मोठ्या प्रमाणावर हेक्झेन (उकळबिंदू ६५°–६८° से.) आणि क्वचित ट्रायक्लोरोएथिलिनासारखे क्लोरिनयुक्त विद्रावक (उकळबिंदू ८७° से.) वापरतात. अर्थातच ज्या देशात हे विद्रावक मुबलक व स्वस्त मिळतात अशा ठिकाणीच ही निष्कर्षण पद्धती फायद्याची ठरते.
या पद्धतीने निष्कर्षण करण्यासाठी लागणाऱ्या यंत्रसामग्रीचे तीन भाग पडतात : (१) निष्कर्षणासाठी पदार्थ ठेवण्याचे पात्र (अर्कपात्र), (२) विद्राव जमा करण्याचे भांडे, (३) विद्रावातून विद्रावक काढून टाकण्यासाठी ऊर्ध्वपातन करण्याकरिता लागणारी सामग्री. यात विद्रावाला उष्णता देण्याची योजना व विद्रावकाच्या बाष्पाचे पूर्णतया द्रवीभवन व्हावे यासाठी चांगल्या प्रतीचे शीतक आणि मेदामधून व पेंडीमधून वाफेच्या मदतीने विद्रावक पूर्णपणे काढून टाकण्याची सोयही येते. विद्रावकाने मेदांचे निष्कर्षण केल्यास त्यांचे तापमान कधीच जास्त होत नाही. त्यामुळे मेद व पेंड या दोन्हींची प्रत चांगली राहते. मेदाचे उत्पादन जास्त होते. पेंडीमध्ये मेदाचे प्रमाण कमी असल्यामुळे ती कृत्रिम तंतू, प्लॅस्टिके इत्यादींच्या उत्पादनासाठी उपयोगी पडते. पेंडीत प्रथिनांचे प्रमाण वाढल्याने ती पशुखाद्य व खत याकरिता सरस ठरते. याबरोबरच काही तोटेही या निष्कर्षण पद्धतीत आहेत. मुख्य तोटा म्हणजे हेक्झेन किंवा पेट्रोलियम विद्रावक वापरताना आग लागण्याचा धोका सतत असतो. त्यामुळे आगप्रतिबंधक उपायांची तरतूद कायम ठेवावी लागते. क्लोरिनयुक्त विद्रावकांचा उपयोग केल्यास आगीचा धोका राहत नाही परंतु हे विद्रावक मेद किंवा पेंड यामध्ये जरी सूक्ष्म प्रमाणात शिल्लक राहिले, तरी ते मेद खाण्याच्या दृष्टीने किंवा पेंड जनावरांना देण्याच्या दृष्टीने अपायकारक असते.
विद्रावकाने निष्कर्षण करण्याचे दोन प्रकार आहेत : (१) खंडित प्रक्रिया आणि (२) अखंडीत प्रक्रिया वापरून. या दोन्ही पद्धतीमध्ये, विशेषतः अखंडीत प्रक्रियेत, अर्कपात्राच्या रचनेत यंत्रज्ञांनी इतके कौशल्य व विविधता वापरली आहे की, त्यामुळे अर्कपात्राचे ३०–४० नमुने वापरात आहेत. यातील काही मेर्झ, बोलमान, अँडरसन, केनेडी, लूर्गी, डिस्मेट, फिल्ट्रेक्स, नंबियार (भारतीय) या नावांनी प्रसिद्ध आहेत. कोणत्याही चांगल्या रितीने चालविलेल्या निष्कर्षण पद्धतीत एक टन मेदबीया अगर पेढींमध्ये ०·७% पेक्षा जास्त विद्रावकाचा तोटा येत नाही.
शुद्धीकरण : मेदांचे शुद्धीकरण केल्याशिवाय साधारणपणे ती मेदे खाद्य म्हणून वापरत नाहीत (लोणी हे याला अपवाद आहे.) भारतात अजूनही दाबयंत्राने काढलेली वनस्पतीजन्य तेले फक्त गाळून घेऊन वापरतात. (याचे कारण मेदांच्या उपयोगाच्या विवेचनात पुढे दिले आहे.) शुद्ध केलेल्या मेदांचा खप त्यामानाने फारसा नाही. मात्र हायड्रोजनीकरण केलेली मेदे वापरण्यास सोयीची असल्यामुळे फार मोठ्या प्रमाणावर उपयोगात येऊ लागली आहेत. हायड्रोजनीकरणाच्या पद्धतीत मेदांचे शुद्धीकरण हे प्राथमिक गरजेचे आहे. [वनस्पती → १ हायड्रोजनीकरण] मेदांच्या शुद्धीकरण संस्काराचे मुख्य चार भाग पडतात: (१) मेदात अविद्राव्य असलेली, तरंगणारी आणि कलिलवृत्ती (सुक्ष्म कणांच्या स्वरूपात लोंबकळत राहणारी) संयुगे वेगळी करणे (२) मुक्त मेदाम्ले काढून टाकणे (३) मेदांचे विरंजन (रंग काढून टाकण्याची क्रिया) करणे आणि (४) मेदे गंधहीन करणे, शुद्ध केलेल्या मेदांचा उपयोग ज्या कारणासाठी करावयाचा आहे त्यानुसार वरीलपैकी एक–दोन किंवा अधिक शुद्धीकरण संस्कार मेदावर केले जातात. भुईमूग, तीळ, करडई इत्यांदींची तेले काही वेळ साठविली व त्यातील गाळ खाली बसल्यावर निवळलेले तेल गाळून घेतले तरी पुरेशी शुद्ध होतात. काही वेळा (उदा. वरील तेले खराब असल्यास) तेलातील मुक्त मेदाम्ले, तेलाचे ४०° ते ८०° से. तापमानास दाहक (कॉस्टिक) सोड्याच्या किंवा धुण्याच्या जलीय विद्रावाने उदासिनीकरण (क्षारीय वा अम्लीय गुणधर्म नसलेल्या पदार्थात रुपांतर करण्याची प्रक्रिया) केल्यास काढून टाकता येतात. हे मिश्रण नंतर काही वेळ स्थिर ठेवल्यास मुक्त मेदाम्लांच्या साबणाचा गाळ (फूट्स किंवा सोपस्टॉक) खाली बसतो. या गाळाबरोबरच मेदातील पुष्कळशी रंगद्रव्ये निघून जातात. वरचे गढूळ मेद गरम पाण्याबरोबर ढवळून धुऊन टाकतात. मेदात उरलेले पाणी मेद निर्वात स्थितीत गरम करून ढवळले म्हणजे निघून जाते. या सर्व संस्कारामुळे मेदात असलेली प्रतिऑक्सिडीकारक संयुगेही नाश पावतात, त्यामुळे अशी शुद्ध केलेली मेदे मुळ मेदांपेक्षा लवकर खराब व खवट होणे शक्य असते परंतु ती दिसण्यास स्वच्छ व बरीचशी वर्णहीन असतात. क्षाराऐवजी सल्फ्यूरीक अम्लाचा संस्कार अखाद्य मेदावर करण्याची पद्धत आहे, यानेही मेद स्वच्छ होते व त्याचा रंग कमी होतो. वरील शुद्धीकरणानंतर शिल्लक असलेली रंगाची छटा पूर्णपणे काढून टाकण्यासाठी दोन पद्धती उपलब्ध आहेत. मेदाचा उपयोग खाण्यासाठी करावयाचा असेल, तर मेदात १००°–१०५° सें तापमानाला १ ते ५% पर्यंत सक्रियित (अधिक क्रियाशील केलेली) माती, मुलतानी माती (फुलर्स अर्थ) किंवा सक्रियित कोळसा मिसळतात व मिश्रण सु. अर्धा तास चांगले घुसळतात आणि त्यानंतर मिश्रण गाळून घेतात. या संस्काराने मेदाचा सर्व रंग निघून जातोच असे नाही, थोडाफार शिल्लक राहतो. तोही नाहिसा करावयाचा असेल तर पुढील दुसरी पद्दत वापरतात. या पद्धतीत वरील मेदावर सोडियम पेरॉक्साइड, सोडियम डायक्रोमेट व सोडियम हायपोक्लोराइट यापैकी एखाद्या रसायनाच्या जलीय विरल विद्रावाची विक्रिया घडवून आणतात.
वरीलप्रमाणे मेदाम्लरहित व वर्णहिन मेद तयार झाल्यावर मेदाला येणारा वास घालवण्यासाठी वास देणारे घटक (आल्डिहाइडे, किटोने, टर्पिने किंवा हायड्रोकार्बने) काढून टाकणे ही मेदाच्या शुद्धीकरणातील शेवटची पायरी होय. त्याकरिता विशिष्ट रचनेचे गंधहारक पात्र वापरतात. यामध्ये मेद १६०°–२००° से. या तापमानाला, दाब ५ ते १० मिमि. इतका ठेवून त्यातून उत्तप्त वाफ ६ ते ८ तास जाऊ देतात. या वाफेबरोबर वरील घटक निघून जातात. जवळजवळ निर्वातस्थिती वापरल्यामुळे मेद संयुगांना इजा पोहोचत नाही. गंधहारक क्रिया संपल्यावर मेद निर्वात स्थितीतच ८०°–९०° से. तापमानापर्यंत थंड करून गाळतात. गंधहीन करण्याच्या पद्धतीतही खंडित व अखंडित असे प्रकार आहेत.
उच्च वितळबिंदू असलेली ग्लिसराइडे अगर मेणसदृश संयुगे काही तेलांतून काढून टाकण्याचा प्रघात अमेरिका व युरोपमध्ये आहे. ज्या क्रियेने हे साधतात तिला ‘विंटरायझेशन’ असे म्हणतात. सरकीचे व मक्याचे तेल यासाठी वापरतात. तेल हळुहळू थंड करू लागल्यावर जरा गढूळ दिसू लागले की, त्या तापमानाला (अदमासे १५° से.) बरेच तास ठेवतात आणि नंतर त्याच तापमानात गाळतात. ही क्रिया केलेले तेल खाण्यात ‘सॅलड ऑइल’ म्हणून वापरले जाते.
शुद्ध केलेल्या मेदांचे सरासरी भौतिक व रासायनिक गुणधर्माचे निर्देशांक आणि त्यांची व्याप्ती त्या त्या देशातील मानक संस्थांनी संदर्भ ग्रंथांतून प्रसिद्ध केलेली असते.
वरीलप्रमाणे कमीजास्त शुद्द केलेल्या मेदांचे, विशेषतः ज्यांत अतृप्त मेदाम्लांचे प्रमाण बरेच आहे अशांचे, हायड्रोजनीकरण केल्याने जास्त वितळबिंदूंची शुद्ध स्वरुपातील मेदे मिळतात.
विश्लेषण व तपासणी करण्याच्या पद्धती : मेदात ग्लिसराइडे कोणती आहेत, मेदाची घटक मेदाम्ले कोणती व त्यांची प्रमाणे काय आहेत, मेदात स्टेरॉलांसारखी इतर संयुगे कोणती आहेत व काही अपायकारक द्रव्ये आहेत काय हे ठरविण्यासाठी मेदांचे संपूर्ण विश्लेषण करावे लागते. नित्याच्या व्यवहारात यातून मिळणाऱ्या सर्व माहितीचा फारसा उपयोग होत नसला, तरी मेदांचा सखोल अभ्यास त्याशिवाय पूर्ण होत नाही. ॲल्युमिना, सिलिका जेल किंवा यासारख्या द्रव्यांचा उपयोग करून स्तंभवर्णलेखन [→ वर्णलेखन] केल्यास केवळ तृप्त मेदाम्लांपासून तृप्त व अतृप्त या दोन्ही तऱ्हांच्या मेदाम्लांपासून आणि केवळ अतृप्त मेदाम्लांपासून बनलेली ग्लिसराइडे, तसेच मोनो-, डाय व ट्राय-ग्लिसराइडे पण वेगळी करता येतात. शुद्ध गिल्सराइडांचे तनुस्तर-वर्णलेखन केले असता मिळणाऱ्या माहितीच्या मदतीने ती कोणती आहेत हे ओळखता येते किंवा या प्रत्येक वगार्ची ग्लिसराइडे वेगवेगळी घेऊन व त्यांचे जलीय विच्छेदन करून मिळणारी घटक मेदाम्ले कोणती आहेत हे पाहून, त्यावरून ग्लिसराइडाच्या रेणूच्या संरचनेची कल्पना येते. ॲसिटोन या विद्रावकात मेद विरघळून ०° से. तापमानाच्या खाली निरनिराळ्या तापमानांना भागशः स्फटिकीकरण करून मिळालेल्या वेगवेगळ्या भागांची वरीलप्रमाणे तपासणी केल्यास मेदामधील ग्लिसराइडांची घडण कळते.
मेदामधील घटक मेदाम्ले निश्चित करण्यासाठी मेदाचे क्षाराने जलीय विच्छेदन करावे लागते. या विक्रियेने बनणाऱ्या साबणांचे ईथर विद्रावकाने निष्कर्षण केल्यास ईछरामध्ये मेदामधील क्षार अविच्छेदनीय भाग विरघळतो. त्याचे विश्लेषण करून त्यामध्ये स्टेरॉले आणि इतर संयुगे कोणती आहेत हे ठरवितात. अपायकारक संयुगे या ठिकाणी मिळण्याची बरीच शक्यता असते. ईश्वराने निष्कर्षण केल्यानंतर साबणाचे अम्लीकरण केले म्हणजे मेदातील एकूण मेदाम्लांचे मिश्रण मिळते. साधारणपणे C10 पर्यंतची मेदाम्ले मिश्रणाचे ऊर्ध्वपातन केले असता वाफेबरोबर बाहेर पडतात. उरलेल्या मेदाम्लांचे शिसे वा सोयीस्कर मूलद्रव्यांचे साबण बनवून त्या मिश्रणातील तृप्त व अतृप्त मेदाम्लांचे साबण योग्य त्या विद्रावकाच्या मदतीने वेगळे करता येतात. यांचे पुन्हा अम्लीकरण करून मिळणाऱ्या मेदाम्लांची एस्टरे बनवितात व त्यांचे कमी दाबाखाली भागश: ऊर्ध्वपातन [→ उर्ध्वपातन] करतात आणि त्यापासून मिळणाऱ्या भागांचे क्षारीय विच्छेदनांक व आयोडीन मूल्य ठरवितात. त्यावरून त्यातील घटक मेदाम्लांचे प्रमाण गणिताने काढता येते. एकूण मेदाम्लांचे साबण करून, विश्लेषण करण्याऐवजी त्यांचे कमी तापमानाला (-६०° से.पर्यंत) विद्रावकातून (ॲसिटोन) भागशः स्फटिकीकरण करून, मिळणाऱ्या मेदाम्लांची एस्टरे करून आणि त्यांचे भागशः उर्ध्वपातन करून वरीलप्रमाणेच मेदातील घटक मेदाम्लांची प्रमाणे काढता येतात. अलीकडे वायुवर्णलेखनाच्या [→ वर्णलेखन] पद्धतीमुळे हे काम सोपे झाले आहे. या पद्धतीने मेदाच्या एकूण मेदाम्लांच्या एस्टर मिश्रणाचा एक मिग्रॅ.पेक्षा कमी अंश घेऊन त्यातील सर्व घटक व त्यांची प्रमाणे अचूक ठरविता येतात.
निरनिराळ्या व्यवसायांत मेदांचा जो उपयोग केला जातो त्या दृष्टीने मेदांचे वरीलप्रमाणे काटेकोर विश्लेषण करणे आवश्यक नसते. बहुतेक मेदांचे अनेक नमुने तपासून त्यांच्या वेगवेगळ्या गुणधर्मांच्या मूल्यांची व्याप्ती ठरविलेली असते. हे ठरविताना संदर्भ ग्रंथातून दिलेल्या अधिकृत तपासणी पद्धतींचाच अवलंब केला जातो. थोड्या कालांतराने अनुभवाप्रमाणे या अधिकृत पद्धतीतूनही आवश्यक ते थोडेफार बदल सुचविले जातात. या मूळ व सुधारित पद्धती अमेरिकन ऑइल केमिस्ट्स सोसायटी (A, O. C. S.) ब्रिटिश स्टॅंडर्डस् इन्स्टिट्यूट (B. S. I.), भारतीय मानक संस्था (इंडियन स्टॅंडर्ड्स इन्स्टिट्यूट (I. S. I.) आणि ⇨ ॲगमार्कसारखे दर्जा व विशुद्धता निदेर्शित करणारे चिन्ह पूर्ण तपासणीनंतर वापरावयास परवानगी देणाऱ्या सरकारी संस्था यांसारख्या अधिकृत संस्था आणि प्रयोगशाळा वेळोवेळी संदर्भ ग्रंथातून प्रसिद्ध करतात. येथे तपासणी पद्धती पूर्ण दिलेली नाही. फक्त काही अधिकृत पद्धतींचे सैद्धांतिक विवेचन आणि काही रासायनिक तपासणींचे व्यवहारातील उपयोग थोडक्यात दिलेले आहेत.
घनरूपात असणाऱ्या मेदांकरिता वितळबिंदूचे निरनिराळे टप्पे म्हणजेच मृदुभवनबिंदू, वितळबिंदू आणि वहनबिंदू (मेद वितळून वाहू लागल्यावर विशिष्ट उपकरणातील छिद्रात अर्धगोलाकृती फुगवटा निमार्ण होतो ते तापमान) ही तापमाने ठरविणे जास्त महत्त्वाचे असते. याकरिता वापरावयाची विशिष्ट उपकरणे, तपासण्याचे नमुने कोणत्या तापमानाला किती वेळ ठेवून मग त्यांना उष्णता द्यावयाची, कोणत्या वेगाने त्याला उष्णता द्यावयाची यासंबंधीच्या संपूर्ण सूचना अधिकृत पद्धतीत मिळतात. एच्. डब्ल्यू. वाइली यांची वितळबिंदू ठरविण्याची पद्धत सर्वमान्य आहे. या पद्धतीत मेदाची एक लहानशी चकती अल्कोहॉल व पाणी यांच्या मिश्रणात गोलाकार होईपर्यंत तापवितात. द्रवरूपात असणाऱ्या मेदांकरिता धूसरबिंदू आणि घनीभवन बिंदू यांना महत्त्व आहे. द्रवरूपातील मेदाचे तापमान थंड मिश्रणाच्या साहाय्याने कमी करीत असताना, प्रथम ज्या तापमानाला त्यात गढूळपणा दिसू लागतो तो धूसरबिंदू आणि ज्यावेळी त्याचे पूर्ण घनीभवन होऊन तो अपारदशर्क होतो ते तापमान म्हणजे घनीभवन बिंदू होय.
अशुद्ध मेदांना बहुधा पिवळट किंवा पिवळट तांबूस असा थोडाफार रंग असतो. काही अखाद्य तेले गडद पिवळ्या वा गडद तांबूस वर्णाची असतात. मेदांच्या वर्णछटा लव्हिबॉंड वर्णछटामापकाच्या साहाय्याने कमीअधिक गडद पिवळ्या व तांबड्या काचांच्या पट्ट्या वापरून बनणाऱ्या वर्णछटांशी तुलना करून मोजतात. वर्णाची तुलना करण्यासाठी वेसन वर्णमापकही वापरतात. वर्णप्रकाशमापकानेही वर्णाचे विश्लेषण करता येते [→ वर्णमापन].
मेदांची श्यानता, विशिष्ट गुरूत्व व प्रकाशीय परिवलन ठरविण्याच्या अधिकृत पद्धती आहेतच. औष्णिक स्थैर्य अजमावण्यासाठी मेदांचे धूम-, ज्वाला- व ज्वलन-बिंदू मोजतात. त्याकरिता क्लीव्हलंड पेल्याचा उपयोग करतात.
मेदांचे प्रमाणित क्षार विद्रावाबरोबर (१) ⇨ अनुमापन करून मुक्त मेदाम्लांक (२) क्षारीय विच्छेदन करून क्षारीय विच्छेदनांक आणि (३) ॲसिटिलीकरण व पुन्हा क्षारीय विच्छेदन करून ॲसिटील अंक काढतात. हे अंक म्हणजे एक ग्रॅम मेदाकरिता प्रत्येक वेळी लागणारे पोटॅशिअम हायड्रॉक्साइडाचे मिग्रॅ. मध्ये व्यक्त केलेले वजन होय. ॲसिटील अंकावून मेदातील मुक्त हायड्रॉक्सी गटांची मोजणी होते, मुक्त मेदाम्लांक जेवढा कमी तेवढी मेदाची प्रत चांगली समजली जाते. मेदाचे आयोडीन मूल्य हा एक महत्त्वाचा प्रमाण मानलेला निर्देशांक असून त्यामुळे मेदातील एकूण अतृप्त बंधांचे मापन होते. मात्र घटक मेदाम्लात एकांतरित अतृप्त बंध असल्यास सर्व अतृप्त बंधांचे मापन होत नाही. याचे कारण मागे गुणधर्मांच्या विवेचनात आलेलेच आहे. वाइस आणि हानुस यांच्या आयोडीन मूल्य ठरविण्याच्या पद्धती जास्त मान्यता पावलेल्या आहेत. पहिलीत आयोडीन मोनोक्लोराइड (ICI) आणि दुसऱ्यात आयोडीन मोनोब्रोमाइड (IBr) ही रसायने अतृप्त बंधाच्या बरोबर आयोडीन समावेशनाचे होण्यासाठी वापरतात. ही रसायने जरूरीपेक्षा १००% जास्त प्रमाणात मेदाच्या नमुन्याबरोबर मिसळतात व ठराविक वेळानंतर अतिरिक्त आयोडीन उलट अनुमापन करून मोजतात. रोझेनमुंड–कुनहेन व ह्युबल यांच्या अशा आणखी दोन पद्धतीनीही आयोडीन मूल्य काढतात. १०० ग्रॅम मेदाने जितक्या ग्रॅम आयोडिनाचे शोषण केले असेल, त्याला त्या मेदाचे आयोडिन मूल्य काढतात. १०० ग्रॅम मेदाने जितक्या ग्रॅम आयोडिनाचे शोषण केले असेल, त्याला त्या मेदाचे आयोडीन मूल्य म्हणतात. मेदाच्या एकूण घटक मेदाम्लांतील लिनोलीइक व लिनोलीनिक या अतृप्त मेदाम्लांचे प्रमाण जंबुपर किरणांच्या २३४ mμ व २७० mμ या तरंगलांबीच्या ठिकाणी मिळणाऱ्या शोषणावरून ठरवितात, हे पूर्वी दिलेलेच आहे. यासाठी १०० मिग्रॅ. नमुन्याचे एथिलीन ग्लायकॉलामध्ये क्षाराने समघटकात रूपांतर करून त्या मिश्रणाचा मिथिल अल्कोहॉलमध्ये जंबुपार किरणांचा शोषण वर्णपट काढतात.
काही मेदांत (उदा. लोणी, खोबरेल तेल) C16 पेक्षा कार्बन अणूंची मेदाम्ले असतात. राइखर्ट–माइस्ल मूल्य (आर्. एम्. मूल्य), पोलेन्स्की मूल्य व किरख्नर मूल्य ही मूल्ये वरील मेदाम्लांच्या प्रमाणांचे दर्शक आहेत. ५ ग्रॅ. मेदाचे जलीय विच्छेदन करून मिळणाऱ्या एकूण मेदाम्लांचे बाष्प–ऊर्ध्वपातन करून मिळणाऱ्या बाष्पनशील परंतु पाण्यात विद्राव्य असणाऱ्या मेदाम्लांच्या उदासिनीकरणासाठी ०·१ सममूल्य क्षाराचा जेवढा मिलिलिटर विद्राव लागतो त्याला आर्. एम्. मूल्य म्हणतात. (विद्रावात विरघळलेल्या पदार्थाचे प्रमाण एक लिटर विद्रावकात एक ग्रॅम–रेणवीय भाराइतके असल्यास त्याला सममूल्य विद्राव म्हणतात). या मूल्यावरून C4 व C6 या मेदाम्लांचे एकूण प्रमाण कळते. (आर्. एम्. मूल्य : तूप २१–३४ खोबरेल तेल ३–४). लोण्याच्या एखाद्या नमुन्याच्या तपासणीत हे मूल्य २१ पेक्षा कमी आल्यास स्वाभाविकच त्यात दुसऱ्या मेदाची भेसळ असली पाहिजे असे अनुमान निघते. वरील प्रकरेच मिळालेल्या बाष्पनशील परंतु पाण्यात अविद्राव्य मेदाम्लाचे उदासिनीकरण करण्यास ०·१ सममूल्य क्षार विद्रावाचे जेवढे मिलिलिटर लागतात, त्याला पोलेन्स्की मूल्य म्हणतात. यावरून C8, C10 व C12 मेदाम्लांचे प्रमाण कळते. किरख्नर मूल्यावरून आर. एम. मूल्यात अंतर्भूत असलेल्या V4 या घटकाचे फक्त प्रमाण कळू शकते.
मेदांचे ऑक्सिडीकरण झाले आहे का, खवटपणा किती आला आहे, ऑक्सिडीकरणामुळे ते खाण्यास निरूपयोगी झाले किंवा कसे या गोष्टी ठरविण्यासाठी खालील तपासणी पद्धती मान्यता पावल्या आहेत. स्विफ्ट स्थिरत्व परीक्षा घेण्यासाठी मेदाचा नमुना ९७.७° से. ला.(किंवा सुधारित पद्धतीत ११०° से. ला) ठेवून त्यातून सतत हवा प्रवाहित करतात. यामुळे मेदाचे ऑक्सिडीकरण होण्यास किती तास लागतात ते पाहतात. अमेरिकन सोसायटी फॉर टेस्टिंग मटेरियल्स या संस्थेची प्रमाण मानलेली ऑक्सिजन बाँब पद्धत सी. एफ्. झेरार यांनी सुधारली असून या पद्धतीने मेदाचा नमुना ऑक्सिजनाचा ठराविक दाब दिला असता किती ऑक्सिजनाचे शोषण करतो हे मोजतात. शाल पद्धतीत मेदाच्या नमुन्याचे ६०° से. ला ठराविक ऑक्सिडीकरण होण्यास किती वेळ लागतो ते काढतात. चांगल्या मेदाच्या बाबतीत या गुणधर्माची मूल्ये किती असतात, ते संदर्भ ग्रंथात दिलेले असते. ज्या मेदांचे ऑक्सिडीकरण झाले आहे त्यातील आल्डिहाइडांचे प्रमाण क्राइस किंवा शिफ यांच्या पद्धतीने ठरवितात. या पद्धतीत नमुन्यात आल्डिहाइडे असल्यास अनुक्रमे फ्ल्युओरोग्लुसिनाल व हायड्रोक्लोरिक अम्ल यांच्याबरोबर तांबडा रंग आणि विरंजित फुशिन विद्रावाबरोबर जांभळा रंग मिळतो. यांच्या मापनाने ऑक्सिडीभवन किती झाले आहे हे आजमावतात. ली यांच्या पद्धतीत मेदाचे पेरॉक्साइड मूल्य मेदाच्या नमुन्याने ठराविक पोटॅशिअम आयोडाइडामधील किती आयोडीन बाहेर टाकले यावरून काढतात.
मेदातील पाण्याच्या अंशाचे प्रमाण काढण्यासाठी वजन केलेला मेदाचा नमुना १३०° से. ला तापवितात व नंतर त्याचे वजन केले, तर कमी झालेल्या वजनावरून त्यातील पाण्याचे प्रमाण कळते. मेदात टोइल्यून किंवा झायलीन मिसळून त्याचे ऊर्ध्वपातन केल्यास त्याच्याबरोबर मेदातील पाणी निघून जाते. कार्ल फिशर विक्रियाकारकाने (आयोडीन, सल्फर डाय–ऑक्साइड आणि पिरिडीन यांच्या मिथिल अल्कोहॉलात केलेल्या विद्रावाने) सूक्ष्म प्रमाणात असलेले मेदातील पाण्याचे प्रमाणही बिनचूक काढता येते.
वजन केलेल्या नमुन्याचे पूर्ण ज्वलन करून शिल्लक राहिलेल्या राखेवरून अकाबर्नी भागाचे प्रमाण निश्चित होते.
बाजारात जास्त किंमतीच्या मेदात स्वस्त मिळणाऱ्या मेदाची भेसळ केलेली असल्यास काही तपासणी पद्धतीवरून अशा भेसळीचा अंदाज करता येतो. काही मेदे विशिष्ट विक्रियाकारकांबरोबर ठराविक रंग देतात. कोष्टक क्र. ६ मध्ये अशा तऱ्हेच्या काही चाचणी परीक्षांचा सारांश दिला आहे.
वनस्पतिजन्य मेदात स्वस्त असलेल्या प्राणिजन्य मेदाची भेसळ असू शकते तसेच लोणी वा तुपात, त्यापेक्षा स्वस्त असलेल्या वनस्पतिजन्य मेदाची भेसळ केली जाते. अशावेळी तपासणी नमुन्यातील स्टेरॉल घटकांचे डिजिटोनीन किंवा तत्सम पदार्थाबरोबर जटिल संयुग बनवून आणि ते वेगळे करून त्यापासून मूळ स्टेरॉलांची पुननिर्मिती करतात. ही स्टेरॉले व त्यांची ॲसिटेटे यांच्या वितळबिंदूवरून त्यात कोलेस्टेरॉल आहे की स्टिग्मास्टेरॉल आहे हे कळते. वनस्पतिजन्य मेदात कोलेस्टेरॉल मिळाल्यास व लोणी किंवा तुपात स्टिग्मास्टेरॉल्य आढळल्यास त्यात अनुक्रमे प्राणिजन्य व वनस्पतिजन्य मेदांची भेसळ आहे हे कळते. तुपामध्ये किंवा लोण्यामध्ये हायड्रोजनीकरण केलेल्या वनस्पतिजन्य मेदाची भेसळ मोठ्या प्रमाणावर होऊ शकते. ती सोप्या पद्धतीने हुडकता यावी म्हणून हायड्रोजनीकरण करावयाच्या मेदात विशिष्ट प्रमाणात तिळाचे तेल असलेच पाहिजे, असा सरकारी नियम बऱ्याच ठिकाणी आहे. त्यामुळे अशी भेसळ केल्यास लोणी अगर तुपाच्या बाऊडोइन परीक्षेने ते समजू शकते.
उपयोग : मेदांचा सर्वांत मोठा उपयोग अन्न म्हणून किंवा खाद्यपदार्थ तयार करण्याच्या कृतीत होतो. उदा., कणकेत मिसळणे, तळणे, फोडणी देणे, अपद्रव्ये नसलेली सर्व मेदे यासाठी वापरता येतात. भारतामध्ये भुईमूग, करडई, मोहरी, सरकी, खोबरे आणि तीळ यांची तेले आणि प्राणिजन्य मेदांपैकी लोणी व तूप ही यासाठी वापरतात. पाश्च्यात्य देशात वनस्पतिजन्य मेदांपैकी सोयाबीन, सरकी, भुईमूग, सूर्यफुलाचे बी, ऑलिव्ह व पाम यांची तेले, मार्गारीन आणि टॅलो लार्ड व लोणी ही प्राणिजन्य मेदे यांचा याच कारणासाठी उपयोग होतो.
अशी मेदे शुद्ध (निर्मेदाम्ल, वर्णहीन व गंधहीन) केल्यानंतरच पाश्चिमात्य लोक खाण्यासाठी वापरतात. भारतात मात्र अजून तरी मोठ्या प्रमाणात फक्त गाळलेले तेल वापरले जाते. याचे एक कारण भारतीयांना मेदांचे मूळचे विशिष्ट वास, वर्ण व रूची असलेली तेलेच जास्त करून आवडतात आणि दुसरे म्हणजे पूर्ण शुद्ध केलेली तेले विकत घेणे अनेकांना अजून परवडत नाही. खाद्य तेलांसाठी त्या त्या देशातल मानक संस्थांनी गुणधर्माचे प्रमाण निर्देशांक निश्चित केलेले आहेत.
लार्ड या प्राणिजन्य मेदाला अमेरिकेत अतिशय मागणी आहे. यासारख्या भौतिक गुणधमार्ची मेदे द्रवरूप वनस्पतिज मेदांचे थोडेसे हायडोजनीकरण करून आणि त्यांची सोइस्कर मिश्रणे करून बनविता येतात. त्यांना प्लॅस्टिक शॉटर्निंग म्हणतात.
सॅलड ऑइल व प्लॅस्टिक शॉर्टनिंग यांच्या प्रमाणेच पाश्च्यात्य देशात लोण्याच्या बरोबरीने त्याच्यासारखे भौतिक गुणधर्म असलेले पायसरूपातील मेदांचे मिश्रण खाद्यमेद म्हणून लोकप्रिय आहे, त्याला मार्गारीन म्हणतात. हे बनविण्यासाठी पाम, तीळ यांची तेले व लार्ड यांपैकी सोईस्कर मेदांचे मिश्रण ८०% घेऊन आणि त्यात आयसोओलेइक अम्ल जास्त तयार होईल, अशा पद्धतीने हायड्रोजनीकरण केलेले सोयाबिनचे किंवा सरकीचे तेल मिसळून आणि उरलेला भाग म्हणून विरजण लावलेले दूध व थोड्या प्रमाणात अ आणि ड जीवनसत्त्वे, लेसिथीन, खाद्यरंग व डाय–ॲसिटील (लोण्यासारखा वास देणारे संयुग) यांची भर घालून त्याचे पायस बनवितात. नंतर ते ०° ते १०° से. तापमानास थंड करून अनेक तास मळतात अगर व्होटेटर नावाच्या यंत्रातून काढतात. यामुळे त्याला लोण्यासारखे रूप येते. थंड असतानाच त्याच्या हव्या तशा लहानमोठ्या वड्या पाडून त्या कागदात गुंडाळतात.
| कोष्टक क्र. ६. मेदातील भेसळ ओळखण्यासंबंधीच्या काही चाचणी परीक्षा | ||||
| चाचणी परीक्षेचे नाव किंवा स्वरूप | कोणत्या मेदाचे अस्तित्व कळते | मेदातील कोणत्या विशेष घटकांमुळे रंग मिळतो त्याचे नाव | चाचणी परीक्षेत वापरला जाणारा विक्रियाकारक | चाचणी परीक्षेत मिळणारा मिश्रणाचा रंग किंवा इतर विशेष माहिती |
| हालफेन परीक्षा | सरकीचे तेल, कॅपोक तेल, बाओबाब तेल. | गॉसीपॉल किंवा तत्सम घटक | मेद + ॲमिल अल्कोहॉल + १% गंधक असलेले कार्बन डायसल्फाइड. | गडद तांबडा रंग.
(सरकीचे तेल २५०° से. ला तापविलेले असल्यास किंवा त्याचे हायड्रोजनीकरण केलेले असल्यास असा रंग मिळत नाही). |
| बाऊडोइन परीक्षा | तिळाचे तेल, हायड्रोजनीकरण केलेले तिळाचे तेल. | सिसेमॉल | मेद + तीव्र हायड्रोक्लोरिक अम्ल + साखर. | गुलाबी तांबडा रंग. मिश्रणात २% पर्यंत तिळाचे तेल असले, तरी ओळखता येते. |
| व्हिलाव्हेशिया परीक्षा | तिळाचे तेल, हायड्रोजनीकरण केलेले तिळाचे तेल. | सिसेमॉल | मेद + तीव्र हायड्रोक्लोरिक अम्ल + फुरफुराल. | गुलाबी तांबडा रंग. मिश्रणात २% पर्यंत तिळाचे तेल असले, तरी ओळखता येते. |
| उकळलेल्या मेदाची तपासणी | उकळलेले मेद. | — | ॲनिलीन आणि ब्रोमीन यांच्यापासून कार्बन टेट्राक्लोराइडामध्ये केलेला विक्रियाकारक. | तपकिरी रंग. |
| विद्रावकाने निष्कर्षण केलेल्या मेदात क्लोरीनयुक्त विद्रावक शिल्लक आहे का ते तपासणे | — | क्लोरीनयुक्त विद्रावक | मेदाचा थेंब तांब्याच्या तारेवर घेऊन बन्सन ज्योतीवर जाळणे (निळ्या ज्योतीवर). | ज्योत हिरव्या रंगाची दिसते. |
| व्हॅलेन्टा परीक्षा किंवा क्रिस्मर परीक्षा | जास्त घनीभवन बिंदू असलेली मेदे. | — | मेदाच्या नमुन्याचे ॲसिटिक अम्ल किंवा अल्कोहॉलामधील विद्राव हळहळू थंड करीत गेल्यास गढूळपणा येतो. त्या वेळच्या तापमानाची नोंद करणे. | प्रत्येक मेदाकरिता या पद्धतीने गढूळपणा येण्याचे तापमान निश्चित केलेले आहे. त्यापेक्षा जास्त तापमानाला असा गढूळपणा आल्यास जास्त घनीभवन बिंदू असलेले मेद भेसळ केले आहे, असे समजून येते. |
साबण व संश्लिष्ट प्रक्षालके : मेदांचा खाद्य उपयोगासाठी जो खप आहे त्याच्या खालोखाल त्यांचा किंवा त्यांच्यापासून मिळणाऱ्या मेदाम्लांचा खप साबण आणि संश्लिष्ट प्रक्षालकांच्या उत्पादनासाठी होतो. C12 ते C18 या लांबीच्या मेदाम्लांचे सोडियम आणि पोटॅशिअम साबण सर्वांत जास्त उपयोगी असतात. कारण या लांबीच्या कार्बन शृंखला असलेल्या मेदाम्लांच्या साबणात जलस्नेह (पाण्याचे आकर्षण) व जलद्वेष या विरोधी गुणधमार्चा समन्वय साधलेला असतो. बहुतेक मेदे वरील लांबीच्या मेदाम्लांची ग्लिसराइडे असल्यामुळे त्यापासून क्षारीय विच्छेदनाने मिळणारे सोडियम किंवा पोटॅशियम साबण उपयुक्त ठरतात. साबणातील कार्बन अणूंची शृंखला कापडातील साठलेल्या तेलकट भागाशी संलग्न राहते आणि अम्ल गटाशी संयोग पावलेला धातूच्या लवणाचा भाग त्याला पाण्याकडे ओढतो. या क्रियेतून तेलकट भाग कापडापासून सुटा होतो व त्यामुळे मोकळा झालेला मळ हा मळ–साबण या स्वरूपात धुवून जातो.
कोणत्याही मेदापासून साबण बनविता येईल हे जरी खरे असले, तरी प्रक्षालक म्हणून उपयोगी पडण्यासाठी त्यात आवश्यक असणाऱ्या गुणधर्मांचा (पाण्यात विरघळणे, टिकणे, झीज फार न होणे, फेस देणे, जास्तीत जास्त प्रक्षालन करणे) समन्वय साधण्याकरिता तीन प्रकारच्या तेलांच्या मिश्रणापासून साबण बनविला जातो (१) खोबरेल पाम बीज मेद किंवा बाबासू मेद (२) भुईमूग, सरकी, ऑलिव्ह व लिंबोणी यांची पातळ तेले आणि (३) प्राणिजन्य चरबी, महुआ तेल, पाम मेद व हायड्रोजनीकृत मेद यासारखी घट्ट मेदे. यापैकी एक एक तेल कोणते व किती प्रमाणात घ्यावयाचे हे त्याची उपलब्धता, किंमत, प्रत व साबणापासून अपेक्षित गुणधर्म यावर अवलंबून असते.
अंग धुण्याचा, कपड्याचा व दाढीचा असे साबणाचे मुख्य प्रकार आहेत. दाढीचा साबण अर्ध–उकळण पद्धतीने करतात. त्यात थोडेसे ग्लिसरिनाचे प्रमाण तसेच राखून ठेवतात व ०·५ ते १% स्टिअरिक अम्ल मिसळतात. अंगाचे व दाढीचे साबण तयार करताना त्यातील क्षार पूर्णपणे धुवून गेला आहे, याची खात्री करून घ्यावी लागते. दाढीचा साबण पाण्यात जास्त विद्राव्य होण्यासाठी त्यात पोटॅशियम साबणही काही प्रमाणात मिसळावा लागतो कारण कोणत्याही मेदाम्लाचा पोटॅशियम साबण सोडियम साबणापेक्षा पाण्यात जास्त विद्राव्य असतो. साबणात १०–३०% पर्यंत पाणी असते.
मेदाम्लातील कार्बॉक्सी गटाऐवजी दुसरे जलस्नेही गट ज्यामध्ये आहेत असे पदार्थ साबणाप्रमाणेच प्रक्षालक किंवा पायसकारक आणि आर्द्रकारक (म्हणजे पदार्थ भिजण्याची क्रिया सुलभ करणारे) म्हणून फार उपयुक्त ठरले आहेत, यांनाच संश्लिष्ट प्रक्षालके म्हणतात. हे पदार्थ खनिज तेलातील काही संयुगांपासून तसेच मेदाम्लांपासून तयार करतात. ही प्रक्षालके साबणापेक्षा पाण्यामध्ये जास्त व लवकर विरघळतात आणि त्यांची कापडातील मळ काढून टाकण्याची क्षमता विशेषतः अफेनद (ज्यामध्ये कॅल्शिअम व मॅग्नेशियम बाय कार्बोनेट किंवा सल्फेट विरघळलेली असतात व ज्यात साबणाचा फेस होत नाही अशा) पाण्यात जास्त असते. यामुळे धंद्याचा कल साबण करण्यापेक्षा मेदातील मेदाम्ले वेगळी करून त्यांच्यापासून निरनिराळे उपयुक्त पदार्थ करण्याकडे अधिक वाढलेला आहे.
मेदाम्लापासून अनेक उपयुक्त पदार्थ तयार केले जातात. पैकी काही पुढे दिलेले आहेत. एरंडेलापासून सेबॅसिक व ॲझेलाइक ही द्विधारक (ज्यामध्ये दोन COOH गट आहेत अशी.) अम्ले तयार करता येतात. त्यांचा एस्टरे, वंगणे व संश्लिष्ट प्लॅस्टिके बनवण्याकडे उपयोग होतो. ग्लिसरीन मोनोलॉरेटापासून तयार केलेले सोडीयम ग्लिसरीन मोनोलॉरेट सल्फेट हे एक सौम्य पण प्रभावी प्रक्षालक आहे. ग्लिसरीन मोनोस्टिअरेट व मोनोओलिएट ही फार उच्च पायसकारके आहेत. तसेच एरंडेलापासून मिळणारे टर्की रेड ऑईल १९ व्या शतकापासून कापड धंद्यात आर्द्रकारक व पायसकारक म्हणून प्रख्यात आहेत. स्टिअरिक, आलेइक, लिनोलिनिक, रिसिनोलिइक इत्यादी मेदाम्लांची निरनिराळ्या धातूंबरोबर (अल्युमिनिअम, कॅल्शिअम, कोबाल्ट, जस्त, शिसे इ.) झालेली संयुगे, वंगणे, सौंदर्यप्रसाधने, रबर, कापड, कागद, व्हर्निशे, बांधकाम इ. विविध धंद्यात कोठे ना कोठेतरी वापरली जातात. ओलेइक आम्लाचे एपॉक्सिकरण (संयुगात एपॉक्सी गट निर्माण करण्याची क्रिया) करून व नंतर एस्टरे बनवून ती उष्मीय स्वैर्यकारके व प्लॅस्टिकीकारके (नम्यता, शान्यता, मऊपणा इत्यादी गुणधर्म अंतिम वस्तूत आणण्यासाठी मिसळण्यात येणारे पदार्थ) म्हणून पीव्हीसी रेझिनाबरोबर वापरतात. [→ पृष्ठक्रियाकारके साबण].
पृष्ठ–संरक्षक रंग व व्हार्निशे (रोगणे) : मेदांच्या गुणधर्मांच्या विवेचनात उष्मीय बहुवारिकीकरण याविषयी जो भाग आलेला आहे, तोच या व्यवसायाचा पाया आहे. अतृप्त बंध असलेल्या ग्लिसराइडांची मेदे (उदा. जवसाचे तेल, सोयाबीन व टुंग ही तेले आणि निर्जलीकृत एरंडेल तेल वगैरे) पातळ थरामध्ये पसरली असता वाळतात व अशा तऱ्हेने तयार झालेल्या थराने वस्तूंच्या पृष्ठभागांचे हवा, पाणी यांपासून संरक्षण होते. असे करीत असताना या तेलात पिंजक, पाइन, रेझीन यासारखे पदार्थ व टर्पेंटाइनसारखा विरलकारक जरुरीपुरता मिसळून वस्तुंवर त्याचा थर दिल्यास वस्तुचे संरक्षण होऊन शिवाय ती सुशोभितही दिसते. अशा मिश्रणांना तैलरंग म्हणतात. वाळणाऱ्या तेलात रेझीन व तत्सम नैसर्गिक वा संश्लिष्ट पदार्थ आणि तेल लवकर वाळण्यास मदत करणारे विशिष्ट पदार्थ (शिसे, मॅंगनेज, कोबाल्ट यांची ऑक्साइडे) मिसळून ती जास्त तापमानाला तापवितात, यांना रोगणे किंवा व्हार्निशे म्हणतात. रोगणामध्ये उष्णतेने बहुवारिकीकरण घडवून आणलेली वाळणारी तेले मिसळल्यास रोगणाचा पोत सुधारतो आणि ती जलद वाळतात व त्यांचा थर जास्त टिकाऊ होतो. या कारणासाठी ही तेले पूर्वी उघड्या कढयांतून विस्तवावर उकळीत असत. आता ती बंद पात्रात व निष्क्रियवातावरणात २३२° ते ३३०° से. तापमानास विजेच्या सहाय्याने तापवितात. त्यामुळे त्या मेदात एकांतरीत अतृप्त बंध आणि वलयी संयुगे तयार होतात आणि लवकर वाळण्याचा गुणधर्म येतो.
नवीन प्रचारात आलेले पायसी रंग, संश्लिष्ट रेझिनांचे रंग व एनॅमल रंग हे कार्बनी विद्रावकात तयार करतात. यांच्या थराचा टिकाऊपणा व वाळण्यासाठी लागणारा कमी वेळ यामुळे हे तैलरंग किंवा रोगणे यापेक्षा फारच सरस ठरतात आणि म्हणून वाळणाऱ्या तेलाचा या व्यवसायातील खप बराच कमी होत चाललेला आहे [→ रंगलेप].
वंगण तेले व ग्रिजे : मेदांचा वंगण म्हणून उपयोग फार प्राचीन असला तरी खनिज तेलापासून तयार करण्यात येणारी वंगणे मुबलक व स्वस्त मिळू लागल्यामुळे या व्यवसायातील मेदांची जागा खनिज तेलजन्य वंगणांनी घेतली आहे. कारण ही वंगणे लवकर चिकट होत नाहीत आणि त्यांचे अपघटन व ऑक्सिडीकरण अतिशय सावकाश होते. असे जरी असले तरी मेदे, मेदाम्ले आणि मेदाम्लांचे काही अनुजात (एका संयुगापासून तयार केलेली दुसरी संयुगे) स्वतंत्रपणे किंवा खनिजतेलाच्या समवेत घर्षण होणाऱ्या दोन भागांच्या मध्ये टाकल्यास त्यांचा चिवट परंतु ओशट असा थर घर्षण होणाऱ्या पृष्ठभागावर पकड धरतो. या ओशटपणामुळे घर्षण कमी झाल्याने ते भाग तापत नाहीत व त्यांची झीजही कमी होते. याचे कारण असे देतात की, मेदाम्लांतील किंवा त्याच्या अनुजातील अम्ल गटाच्या बाजूचे टोक धातूच्या पृष्ठभागावरील कणांशी बद्ध होऊन राहते व त्यातील कार्बन अणूंच्या शृंखला पृष्ठभागाशी समांतर होऊन ओशट थर तयार होतो. त्यामुळे ते पृष्ठभाग एकमेकांवरून सुलभपणे सरकतात. तथापि मोठ्या शक्तीच्या यंत्रांच्या ज्या भागावर जास्त दाब येतो व तापमान वाढण्याची शक्यता असते तेथे द्रवरूप वंगणे फारशी उपयोगी ठरत नाहीत. अशा ठिकारी अर्धवट घनरुप असणारी वंगण ग्रीजेच वापरावी लागतात. मेदाम्लांचे कॅल्शियम, लिथियम, ॲल्यूमिनियम, शिसे या धातूंचे साबण किंवा त्यांची मिश्रणे तापविलेल्या खनिजतेलात मिसळून घेतल्यास खळीसारखे पदार्थ तयार होतात त्यांनाच वंगण ग्रीजे म्हणतात. ही तयार करण्याकरिता मेदांचे क्षारीय विच्छेदन करुन त्यात योग्य त्या धातूंची लवणे मिसळून ते मिश्रण उघड्या कढयांत तापवितात व त्यात खनिज तेल मिसळून मिश्रण एकजीव करतात. त्यात आवश्यकतेप्रमाणे रंग व ग्लिसरीन हे पदार्थही काही प्रमाणात घालतात. [→ वंगण]
मेदांच्या या प्रमुख उपयोगांव्यतिरिक्त इतर अनेक लहानसहान उद्योगधंद्यात मेदे व मेदाम्ले यांचा उपयोग होतो. मेदांचे हायड्रोजनिकरण, एपॉक्सिकरण, सहबहुवारिकीकरण व क्लोरिनीकरण करुन मिळणारे पदार्थ मेणबत्त्यांकरीता, रबर व्यवसायात आणि प्लॅस्टिक पदार्थ म्हणून तसेच मेदाम्लांपासून मिळणारी मेद अल्कोहॉले, अमाइने, अमाइडे, कीटोने व नायट्राइले हे पदार्थ जसेच्या तसे किंवा त्यांचेपासून आणखी रासायनिक क्रिया करून मिळणारे पदार्थ, प्रक्षालके, प्लॅस्टीकीकारके, वंगणे यांसाठी वापरतात. मेदाम्लांची अमाइने रबर व्यवसायात आणि कापड उद्योगात आवश्यक आहेत. कातडी कमावण्याच्या उद्योगात जलचर प्राण्यांपासून मिळणाऱ्या मेदाने चांगल्या प्रकारची मऊ कातडी तयार करता येतात. एरंडेल तेलाचा रबरी गॅसकेटांवर अनिष्ट परिणाम होत नाही त्यामुळे ती वापरली आहेत. अशा ठिकाणी व वाहनांच्या द्रवप्रेरीत गतिरोधकावरील द्रव पदार्थात याच तेलाचा भाग जास्त असतो. एरंडेल रेचक म्हणून सर्वमान्य आहे, तर कॉडलिव्हर तेल व माशांची तेले त्यांतील अ आणि ड जीवनसत्वामुळे शक्तीवर्धक म्हणून मोठ्या प्रमाणावर वापरली जातात. बदामाचे व ऑलिव्हाचे तेल यांचा औषधी मलमे व तेले यांमध्ये आणि कातडीला नितळपणा येण्यासाठी उपयोग करतात.
जागतिक उत्पादन : जागतिक तेल उत्पादनांपैकी ९०% तेलाचे उत्पादन वनस्पतींच्या व प्राण्यांच्या सु. २० जातींपासून करण्यात येते. यातील बराच भाग खाण्यासाठीच वापरला जातो. पूर्वी तेल काढण्याचे कारखाने तेलयुक्त पदार्थ जेथे उत्पन्न होतात तेथे नव्हते तर मार्से, रॉटरडॅम, लिव्हरपूल, हल, हॅंबर्गऱ्हार्बर्ग इ. औद्योगिक शहरी होते. तेथे तेलाचे उत्पादन मोठ्या प्रमाणावर होत असे. तथापि त्यांना वाहतुकीचा जादा खर्च पडत असल्यामुळे व उष्ण कटिबंधीय प्रदेशात तेलनिर्मितीचे नवीन कारखाने निघाल्यामुळे वरील शहरांचे महत्त्व तेलनिर्मितीच्या दृष्टीने आता कमी झाले आहे.
इ. स. १९७० मध्ये जगाची लोकसंख्या १९५० च्या लोकसंख्येच्या ४४ टक्क्यांनी वाढली, तर तेलाचे जागतिक उत्पादन १९५० च्या ७३ टक्क्यांनी वाढले, वनस्पतिजन्य खाद्य तेलांपैकी सोयाबीन, सूर्यफूल व राई (सरसू) यांच्या तेलनिर्मितीत बरीच वाढ झाली, पण माड तेलात अल्प वाढ झाली. औद्योगिक उपयोगाच्या व प्राणिजन्य तेलात लोकसंख्येच्या वाढीच्या प्रमाणात वाढ झाली. देवमाशांची मोठ्या प्रमाणावर शिकार झाल्यामुळे नंतर त्यांच्या तेलाच्या उत्पादनात घट झालेली आढळते.
भारतीय उद्योग : वनस्पतिजन्य मेदे हीच मुख्यत्वेकरून भारतात उपलब्ध व वापरात असल्याने त्यांची उपलब्धता तेलबियांच्या पिकांना
| कोष्टक क्र. ७. भारतातील तेलबियांचे उत्पादन | ||||||||
| वर्ष | भुईमूग
(हजार टन) |
सरसू व मोहरी
(हजार टन) |
तीळ
(हजार टन) |
जवस
(हजार टन) |
एरंडी
(हजार टन) |
सर्व तेलबियांचे | ||
| लागवडीखालील क्षेत्र
(हजार हेक्टर) |
उत्पादन
(हजार टन) |
हेक्टरी उत्पादन
(किग्रॅ.) |
||||||
| १९६०–६१ | ४,८१२ | १,३४७ | ३१८ | ३९८ | १०७ | १३,७७० | ६,९८२ | ५०७ |
| १९६५–६६ | ४,२३० | १,२७६ | ४२५ | ३३५ | ८० | १४,९२८ | ६,३४६ | ४२५ |
| १९६६–६७ | ४,४११ | १,२२८ | ४१६ | २६० | ११० | १४,९९४ | ६,४२५ | ४२९ |
| १९६७–६८ | ५,७३१ | १,५६८ | ४४५ | ४३८ | १२१ | १५,६६७ | ८,३०३ | ५३० |
| १९६८–६९ | ४,४७५ | १,५७२ | ४१५ | ३५२ | १११ | १४,५८४ | ६,९२५ | ४७५ |
| १९६९–७० | ५,१३० | १,५६४ | ४८८ | ४६९ | १२३ | १४,८१२ | ७,७३४ | ५२२ |
| १९७०–७१ | ६,१११ | १,९७५ | ५६२ | ४७४ | १३६ | १५,४१८ | ९,२५९ | ६०१ |
| १९७१–७२ | ५,७१२ | १,४५१ | ४५९ | ५१० | १४४ | १५,५९७ | ८,२७५ | ५३१ |
| १९७३–७४ | ५,९३२ | १,७०४ | ४८४ | ५०४ | २२९ | १५,४५१ | ८,८५३ | ८४५ |
| १९७४–७५ | ४,९९० | २,२११ | ४०८ | ५३७ | २१६ | १५,५८६ | ८,३६३ | ६१६ |
आणि तेलझाडांना किती जमीन उपलब्ध आहे व हेक्टरी बियांचे उत्पादन किती होते अगर दर हेक्टरात झाडांची संख्या किती आहे, यांवर अवलंबून आहे. यात तीन प्रकार आहेत: (१) दर वर्षी निघणारे
| कोष्टक क्र. ८. महाराष्ट्रातील तेलबियाचे उत्पादन (१९७३-७४) | ||
| तेलबिया | क्षेत्र
(हजार हेक्टर) |
उत्पादन
(हजार टन) |
| भुईमूग | ६५६·७ | ४८५·५ |
| सरसू व मोहरी | ४·२ | ०·८ |
| तीळ | १५३·३ | ३८·९ |
| जवस | २२२·४ | ४५·४ |
| एरंडी | ४·० | १·० |
| एकूण | १,०४०·६ | ५७१·६ |
शेतातील पीक, उदा., भुईमूग, जवस, तीळ, एरंडी, करडई इ., (२) नियमित लागवड केलेल्या नारळासारख्या झाडापासून आणि (३) जंगली व डोंगरी प्रदेशात आणि रस्त्यांच्या कडेला उगवणाऱ्या झाडांच्या तेलबियांपासून उदा., मोह (महुआ), साल, निंबोणी, करंब, पिशा वगैरे. पहिल्या प्रकाराखाली (कापूस सोडून) अदमासे १,५०,९१,००० हे. जमीन (सर्व शेतजमिनीच्या १/१०) आहे. यात फारशी वाढ होणे शक्य नाही. शिवाय भारतातील हेक्टरी उत्पन्नही फार कमी आहे. उदा., भारतात भुईमूग व तीळ यांचे हेक्टरी उत्पन्न अनुक्रमे ७७० किग्रॅ. व १७५ किग्रॅ. आहे, तर परदेशात भुईमुगाचे प्रमाण हेक्टरी ३,५०० किग्रॅ. (इस्त्राएल) व तिळाचे १००० किग्रॅ. (ईजिप्त) आहे. याचा अर्थ असा की, शेतीच्या पद्धतीत व यंत्रणेत शास्त्रीयरित्या मोठ्या प्रमाणावर फरक घडवून आणला, तरच उत्पादनात खूप भर पडून अनेक वर्षे तेलाची भासत असलेली टंचाई दूर करता येईल.
भारतात माणशी वषार्ला सु. २·६ किग्रॅ. खाद्य मेदे मिळू शकतात (१९७२–७३), तर हेच प्रमाण इतर देशांत २०–३० किग्रॅ. आहे (संतुलित आहारात माणशी १६ किग्रॅ. तरी खाद्य मेदे असावीत).
उत्पादन : यांत्रिक व गावठी अशा दोन्ही पद्धतींनी सर्व भारतभर मेदांचे उत्पादन होते. यांत्रिक पद्धतीत अनेक प्रकारची दाबयंत्रे (एक्स्पेलर) व यांत्रिक घाण्या येतात, ज्यांच्यापाशी मोठ्या क्षमतेची अनेक दाबयंत्रे आहेत अशा मोठ्या तेलगिरण्या १९७१ साली सु. २,००० (क्षमता २५ लाख टन) होत्या. लहान दाबयंत्रे किंवा यांत्रिक घाण्या चालविणाऱ्या १०,००० (क्षमता २५ लाख टन) गिरण्या होत्या. बैलघाणे सु. दोन लाखांच्यावर (क्षमता १० लाख टन) होते व त्यापैकी खादी व ग्रामोद्योग आयोग प्रमाणित ४२,००० होत्या. सुधारित बैलघाण्यांचा प्रसार होऊन त्यांची क्षमता वाढावी म्हणून खादी व ग्रामोद्योग आयोग बरीच खटपट करीत आहे.
तेलगिरण्यांतून निघणाऱ्या पेंडीत जे ६–८% तेल असते ते काढण्याकरिता विद्रावक निष्कर्षणाच्या नव्या पद्धतीवर उभारलेले ११० कारखाने १९५६–६६ च्या दरम्यान स्थापन झाले आहेत. तत्पूर्वी असे कारखाने आठ–दहाच होते. यावरून या उद्योगाची जलद वाढ लक्षात येईल. याचा फायदा म्हणजे पेंडीतील ६०,००० टन तेल व भाताच्या कोंड्यातल ६०,००० टन तेल ही नव्यानेच मिळू लागली.
वनस्पती तूप : या धंद्याचे १९३० साली अवघे २–३ कारखाने होते ते आता ५२ आहेत. १९७३ साली या करखान्यांची उत्पादनक्षमता १०,६७,००० टन होती, परंतु प्रत्यक्षात उत्पादन ४,६६,००० टन झाले.
साबण : तेलगिरण्याप्रमाणे या धंद्यातही लहान कारखानदारांचा वाटा मोठा आहे. १९७० साली मोठे कारखाने ४५ होते व त्यातून ३ लाख टन साबण (कपड्याचा व अंगाचा) तयार झाला तर मध्यम व लहान कारखाने सु. ३,५०० असून ते सु. ४ लाख टन साबण बनवित होते. हा साबण मुख्यतः कपड्यांचा असून बहुतकरून दुय्यम प्रतीचा असतो.
तेलाच्या टंचाईमुळे चांगला साबण माफक किंमतीत मिळणे कठीण झाले आहे. कपड्यांच्या धुलाईकरिता, तसेच कापडाच्या गिरण्या व अनेक कारखाने यातील अनेक क्रियांकरिता साबणाऐवजी आता संश्लिष्ट प्रक्षालके व पृष्ठक्रियाकारके वापरात येऊ लागली आहेत. यांचे संश्लेषण खनिज तेल व तज्जन्य संयुगांपासून होत असल्याने त्यांचा मेदांशी संबंध नाही. १९७५ साली अशा पृष्ठक्रियाकारकांचे उत्पादन करणारे ३५ कारखाने होते व त्यांचे उत्पादन ७५,००० टन होते.
मेदाम्ले व ग्लिसरीन : १९७१ मध्ये मेदांचे जलीय विच्छेदन करून त्यातून मेदाम्ले मिळविणारे दहा कारखाने होते. त्यातून २०,००० टन मेदाम्ले (स्टिअरिक, लॉरिक, ओलेइक वगैरे) तयार होतात. यांच्याबरोबर ग्लिसरीनही उप–पदार्थ म्हणून मिळते. साबणांच्या मोठ्या कारखान्यातही ग्लिसरीन वेगळे करण्याकरिता यंत्रसामग्री असते. १९७१ मध्ये ग्लिसरीन तयार करणारे १० कारखाने होते व त्यांचे उत्पादन १०,००० टन होते.
रोगणे व रंग : या धंद्याने बरीच प्रगती केली असून भारतात १९७१ साली ३०० लहानमोठ्या कारखान्यांतून ७० कोटी रू. किंमतीचा निरनिराळ्या जातींचा व प्रतींचा माल तयार झाला.
मालांच्या प्रती व मानके : मेदांचे पुढील तीन मुख्य उपयोग आहेत : शरीरपोषण, स्वच्छता टिकविणे व वंगणे म्हणून. हे उपयोग प्रत्येक माणसाच्या दैनंदिन व्यवहारात इतके महत्त्वाचे आहेत की, त्याकरिता जो हरतऱ्हेचा माल कारखानदार पुरवितात त्याच्या प्रतीवर नियंत्रणे असणे राष्ट्रीय व सामाजिकदृष्ट्या फार जरूरीचे आहे. विशेषतः या क्षेत्रात मालात भेसळ, प्रतीत ढिलाई आणि किंमतीची अस्थिरता ही दोषत्रयी जास्त प्रकर्षाने दिसून येते. मालाची प्रत व निर्भेळपणा सुधारावा या दृष्टीने भारतीय मानक संस्थेने तेलबिया, सर्व जातींची मेदे, मेदाम्ले, साबण इ. पदार्थांकरिता मानके तयार केली आहेत.
व्यापार : विसाव्या शतकाच्या सुरूवातीस भारतातून हजारो टन तेलबियांचीच निर्यात होत असे. त्यांपासून बनविलेला पक्का माल (उदा., साबण, मेद, रोगणे, रंग इ. पदार्थ) आयात केला जात असे. पहिल्या महायुद्धानंतर हे चित्र बदलले. काही विदेशी कारखान्यांनी येथेच कारखाने उभारले, तर काही स्वदेशी कारखाने निघाले व त्यातून बराचसा पक्का माल येथेच तयार होऊ लागला. तेलबियांची निर्यात जरा कमी होऊन आता मेदे निर्यात होऊ लागली. दुसऱ्या महायुद्धानंतर हे चित्र पुन्हा पालटले. देशातच तेलाचा पुरवठा अपुरा पडू लागल्याने तेलबिया व तेले यांच्या निर्यातीवर सरकारने नियंत्रण आणले आणि १९६० सालानंतर त्यांची निर्यात खूपच कमी झाली आहे. १९५०–५१ मध्ये २४·२ कोटी रू., १९६०–६१ ११·६ कोटी रू., १९७२–७३ मध्ये ७४·७ कोटी रू., १९७३–७४ मध्ये १७०·४ कोटी रू. १९७४–७५ मध्ये ९६ कोटी रू. किंमतीच्या तेलबियांची भारतातून निर्यात करण्यात आली. उलट सोयाबीन, राई, पाम तेल, खोबरे, प्राणिजन्य मेद इत्यादींची बऱ्याच प्रमाणावर आयात होऊ लागली. १९६९–७० साली ८,००० टन, १९७०–७१ मध्ये ८०,००० टन, १९७१–७२ मध्ये, १,०३,००० टन, १९७२–७३ मध्ये ५३,००० टन, व १९७३–७४ मध्ये, १,८०,००० टन आयात झाली.
तेलाची टंचाई सुरू झाल्याने तेलबिया व तेले यांचे भाव प्रमाणाबाहेर वाढले. त्यामुळे आंतरराष्ट्रीय बाजारपेठेत भारतीय भुईमूग, एरंडी इत्यादींचे एका वेळेचे अग्रस्थान नाहीसे झाले आहे.
याउलट विद्रावक निष्कर्षण उद्योग निघाल्यापासून जी तेलविरहीत पेंड निघू लागली तिला मात्र खूपच मागणी येऊ लागली व तिने निर्यातीत लक्षवेधक भर घातली आहे.
तेलबिया, तेलविरहीत पेंड व वनस्पतिजन्य तेलातील इतर अवशिष्ट पदार्थ यांच्या नियार्तीपासून भारताला १९७२–७३ मध्ये ७४·७७ कोटी रूपयांचे व १९७३–७४ मध्ये १७०·६ कोटी रूपयांचे परकीय चलन मिळाले. १९७२–७३ मध्ये १० लाख टन व १९७३–७४ मध्ये १२·२ लाख टन मालाची निर्यात झाली. १९७३–७४ मध्ये विद्रावक निष्कर्षित भुईमूग पेंडीमुळे १२१·१८ कोटी रू. (७,९५,८२९ टन) मिळाले, तर १९७२–७३ मध्ये ५८·५२ कोटी रू. (७,३५,२७५ टन) मिळाले होते. १९७३–७४ साली सर्वांत अधिक जपानला (२६·१५ कोटी रू.) व त्या खालोखाल ब्रिटन, नेदर्लंड्स, जर्मनी, डेन्मार्क इ. वीस देशांना निर्यात झाली. जवसाच्या पेंडीमुळे १९७२–७३ साली ९ कोटी रू. (७२,३५९ टन) मिळाले. ही पेंड नेदलर्डंस, पोलंड, जर्मनी इ. देशांना निर्यात केली [→ पेंड].
दाबयंत्राने काढलेल्या तेलापेक्षा घाण्याचे तेल जास्त पौष्टिक असते, अशा समजुतीमुळे आणि त्याच्या विशिष्ट स्वादामुळे भारतात घाण्याचे तेल मोठ्या प्रमाणावर वापरले जाते. तेलघाणा हा प्राचीन काळापासून चालत आलेला एक कुटिरोद्योग आहे. १९३१ मध्ये या धंद्यात ५·३ लाख लोक काम करीत होते १९५१ मध्ये त्यांची संख्या २·५ लाख झाली व १९६१ मध्ये २·३ लाखावर आली. एकंदर तेल उत्पादनात १९५६–७१ या काळात जरी ४४% वाढ झाली असती, तरी तेल घाण्याच्या धंद्यातील कामगारांची संख्या बरीच कमी झाली आहे. १९५७ मध्ये खादी व ग्रामोद्योग आयोगाने या उद्योगात लक्ष घालण्यास सुरूवात केली. १९६०–६१ मध्ये या आयोगामार्फत एकंदर ४,४७७ घाणे चालू होते व उत्पादन १३·५५ कोटी रुपयांचे होते १९७०–७१ मध्ये घाण्यांची संख्या ४,८७७ झाली व उत्पादन २१·२९ कोटी रू. झाले. यात ३२,००० लोकांना कामधंदा मिळाला. आयोगाकडील एकूण घाण्यांपैकी सु. १/३ घाणे सुधारित प्रकारचे आहेत. या उद्योगाच्या प्रगतीसाठी तीळ व करडई ही गळिताची धान्ये केवळ घाण्यांच्या उपयोगासाठी राखून ठेवली जावीत, अशी शिफारस करण्यात आली आहे.
भारतात रिजनल रिसर्च लॅबोरेटरी (हैदराबाद), ऑइल टेक्नॉलॉजिकल रिसर्च इन्स्टिट्यूट (अनंतपूर, आंध्र प्रदेश), टाटा ऑइल मिल्स (मुंबई), हिंदुस्थान लिव्हर रिसर्च सेंटर (मुंबई) इ. सरकारी आणि खाजगी संशोधन संस्थांमध्ये तेलांविषयी संशोधन करण्यात येते, तसेच या संस्थांमधून तेलांसंबंधीचे तांत्रिक शिक्षण देण्याची सोय आहे. द जर्नल ऑफ द ऑइल टेक्नॉलॉजिस्ट ॲसोसिएशन ऑफ इंडिया (मुंबई), इंडियन जर्नल ऑफ टेक्नॉलॉजी (नवी दिल्ली), जर्नल ऑफ इंडियन इन्स्टिट्यूट ऑफ सायन्स (बंगलोर), इंडियन ऑइल अँड सोप जर्नल (कलकत्ता), जर्नल ऑफ फूड सायन्स अँड टेक्नॉलॉजी (म्हैसूर) इ. नियतकालिके तेलांविषयक माहिती प्रसिद्ध करतात.
उत्पादनात वाढ करण्याचे प्रयत्न : खाद्य तेलांचे उत्पादन वाढविण्यासाठी सुधारित बीजांचा आणि योग्य खतांचा वापर करून हेक्टरी उत्पादनाचे प्रमाण वाढविणे याबरोबरच परंपरागत उपयोगात असलेल्या तेलबियांशिवाय तेल देणारी अन्य बीजे व पदार्थ यांचा उपयोग जास्त प्रमाणावर करणे अगत्याचे आहे. या दृष्टीने सोयाबिनाच्या तेलाला महत्त्व आहे. या तेलाचा वनस्पती तूप बनविण्यासाठी होणारा उपयोग दिवसेंदिवस वाढत असून देशात होणारे उत्पादन कमी पडते म्हणून त्याची आयात करावी लागते. १९७४–७५ मध्ये २५,००० टन सोयाबीन तेल भारतात आयात झाले. या बियांतील तेल काढून घेतल्यावर राहणारी पेंडही तीत असलेल्या प्रथिनांमुळे फार उपयुक्त आहे. मध्यप्रदेश, उत्तर प्रदेश, महाराष्ट्र व गुजरात या राज्यात सोयाबिनाची लागवड करण्याचे शेतकी खात्याने ठरविले आहे. सूर्यफूल हे सु. तीन महिन्यांत होणारे पीक असून याच्या बियांचे तेल खाण्यास योग्य ठरले आहे. १९७१–७२ मध्ये ९०० हे. जमीन याच्या लागवडीसाठी वापरण्यात आली. त्याचे उत्पादन हेक्टरी ८०० किग्रॅ. पडले, सुधारणा केल्यास हे हेक्टरी दोन टनांइतके वाढविता येणे शक्य आहे. तांदळाच्या कोंड्यात असलेले तेल ४,००,००० टन उपलब्ध होणे शक्य आहे. आज त्याचे उत्पादन ६०,००० टन इतकेच आहे. सुधारलेल्या कार्यक्षम पद्धती वापरल्या तर सरकीपासून ३,२०,००० टन खाद्य तेल मिळविता येईल.
| कोष्टक क्र. ९. १९७३–७४ या सालातील उत्पादन व १९७४–७९ या कालखंडातील उद्दिष्ट उत्पादन | ||||||
| तेलबिया | १९७३–७४ या सालातील उत्पादन | १९७४–७९ या कालखंडातील उद्दिष्ट उत्पादन | ||||
| क्षेत्र
(लाख हेक्टर) |
हेक्टरी उत्पादन
(किग्रॅ.) |
उत्पादन
(लाख टन) |
क्षेत्र
(लाख हेक्टर) |
हेक्टरी उत्पादन
(किग्रॅ.) |
उत्पादन
(लाख टन) |
|
| भुईमूग | ७५·० | ८०० | ६०·० | ८०·० | ९६१ | ६·५७ |
| सरसू व मोहरी | ३३·० | ५७६ | १९·० | ३५·० | ६२९ | २२·० |
| तीळ | २५·० | २०८ | ५·२ | २७·० | २५१ | ६·५ |
| जवस | १७·० | २७६ | ४·७ | १७·० | २८८ | ४·९ |
| एरंडी | ४·० | ३५० | १·४ | ५·० | ४६० | २·३ |
| सोयाबीन | १·० | ७०० | ७·० | ४·३ | ९३० | ४·० |
| सूर्यफूल | ३·५ | ८५७ | ३·० | ९·३ | ९७० | ९·० |
निरनिराळ्या तेलबियांपासून १९७४–७९ या कालखंडातील उत्पादनाच्या उद्दिष्टांचे आकडे कोष्टक क्र. ९ मध्ये दिले आहेत.
पहा : तूप, बाष्पनशील तेले, मार्गारीन, मेण, लिपिडे, लोणी, वनस्पति–१, साबण, हायड्रोजनीकरण
संदर्भ : 1. Daniel, S., Ed, Balley’s Industrial Oils and Fat Products, New York, 1964.
2. Eckey, E. W. Vegetable Fats and Oils, New York, 1954.
3. Gunstone, F. D. An Introduction to the Chemistry of Fats and Fatty Acids, Bombay, 1960.
4. Hilditch, T. P, Williams, P. N. The Chemical Constitution of Natural Fats, London, 1964.
5. Kirschenbaur, H. G. Fats and Oils–An Outline of their Chemistry and Technology, New York,1960.
म्हसकर, व्यं. वा.