ॲल्युमिनियम: धातुरूप मूलद्रव्य. रासायनिक चिन्ह : Al. अणुक्रमांक (अणूमधील प्रोटॉनची संख्या ) १३ अणुभार २६·९८ विद्युत् विन्यास (इलेक्ट्रॉनांची अणूमधील मांडणी ) २, ८, ३ आवर्त सारणी (मूलद्रव्यांची कोष्टकरूपाने केलेली विशिष्ट मांडणी ) गट ३ वि.गु. २·६९९ वितळबिंदू ६५९·८० से. उकळ- बिंदू २३००० से. समस्थानिक (अणुक्रमांक तोच पण अणुभार भिन्न असलेला त्याच मूलद्रव्याचा प्रकार) नैसर्गिक २७ किरणोत्सर्गी (किरण बाहेर फेकण्याचा गुण असणारा) २६ संयुजा ३ [→ संयुजा] ही धातू हलकी, रुप्यासारख्या रंगाची व चकचकीत असते. शुद्ध धातू मऊ असते.
ॲल्युमिनियम ही पृथ्वीच्या कवचातील धातूंपैकी सर्वांत विपुल असून भाराने कवचाच्या ८·१३% इतकी भरते, परंतु ती नेहमी संयुगांच्या स्वरूपात असते. सामान्य खडकांतील व मातीतील ॲल्युमिनियमाची बहुतेक सर्व खनिजे अशी आहेत की, त्यांच्यापासून ती किफायतशीर रीतीने वेगळी काढता येत नाहीत. बॉक्साइट हे एकच खनिज असे आहे की, ज्याच्यापासून ती किफायतशीरपणे मिळविता येते. शिवाय ग्रीनलंडातील क्रायोलाइटापासूनही अल्पशी ॲल्युमिनियम धातू मिळविली जाते [→क्रायोलाइट बॉक्साइट.]
ॲल्युमिनियम क्लोराइडाचे सोडियमाने ⇨क्षपण करून व्हलर यांनी १८२७ साली शुद्ध ॲल्युमिनियम धातू काढली होती. १८२५ मध्ये ओर्स्टेड यांनी प्रथम विद्युत् विच्छेदन करून (विजेच्या प्रवाहाने रेणूंचे तुकडे करून) ॲल्युमिनियम क्लोराइड मिळविले. त्याच्यात पारा व पोटॅशियम घालून पारदमेल (पाऱ्याबरोबर होणारी मिश्रधातू) तयार केले व त्याच्यापासून ॲल्युमिनियम धातू मिळविली. पण ही धातू मिळविण्याच्या काटकसरीच्या पद्धतीचा शोध लागण्यास सुमारे ६० वर्षे उलटावी लागली. १८८६ साली अमेरिकेतील चार्ल्स मार्टिन हॉल व फ्रान्समधील पॉल ल्वी तूसँ एरू यांनी स्वतंत्रपणे प्रयोग करून वितळविलेल्या क्रायोलाइटाच्या रसात ॲल्युमिना (Al2O3) विरघळवून व तिचे विद्युत् विच्छेदन पद्धतीने क्षपण करून ॲल्युमिनियम धातू मिळविण्याच्या पद्धतीचा शोध लाविला. ॲल्युमिनियमाच्या उत्पादनासाठी आता हीच पद्धती वापरली जाते.
धातूचे निष्कर्षण : या धातूच्या निष्कर्षणाचे (कड्याच्या धातूपासून धातू मिळविणे) दोन महत्त्वाचे टप्पे आहेत. पहिला म्हणजे धातुपाषाणांपासून (कच्च्या धातूपासून) शुद्ध ॲल्युमिना मिळविणे व दुसरा म्हणजे ॲल्युमिनेचे विद्युत् विच्छेदन करून निव्वळ धातू मिळविणे.
(१) धातुपाषाणां पासून शुद्ध ॲल्युमिनेचे क्षपण : प्रथम ॲल्युमिनियमाचे धातुपाषाण म्हणजे बॉक्साइट शुद्ध करून घेतात. ॲल्युमिनियम धातूत लोह व सिलिका यांचा अंशही असला तरी तिचे गुणधर्म बदलतात. प्रत्यक्ष ॲल्युमिनियम धातूतील अशी मूलद्रव्ये काढून टाकणे अत्यंत अवघड असते. म्हणून बॉक्साइटापासून शुद्ध ॲल्युमिना काढून घेऊन नंतरच तिचे विद्युत् विच्छेदन केले जाते.
बायर यांच्या पद्धतीत कच्च्या धातुपाषाणाची पूड करून ती सोडियम हायड्रॉक्साइडाच्या सांद्र (सोडियम हायड्रॉक्साइड जास्त प्रमाणात असणाऱ्या), उष्ण व दाबाखाली असलेल्या विद्रावात मिसळून शिजविली जाते. यात Al2 O3 +2OH–→ 2AlO2 + H2O– ही विक्रिया होऊन सोडियम ॲल्युमिनेटाचा विद्राव तयार होतो. थोड्या सिलिकेचे सोडियम सिलिकेट होऊन तेही विद्रावात विरघळते. परंतु फेरिक ऑक्साइड व टिटॅनियम डाय-ऑक्साइड ही न विरघळता विद्रावात लोंबत राहतात. त्यानंतर विद्राव विरल करून गाळण्याने गाळल्यावर लोह, टिटॅनियम इ. ऑक्साइडांचा चिखलासारखा अविद्राव्य चोथा वेगळा काढला जातो. गाळून मिळालेल्या विद्रावात बीज क्रियेसाठी (साका तयार होण्याच्या क्रियेसाठी ) शुद्ध ॲल्युमिनियम हायड्रॉक्साइडाचे [AI (OH)3] स्फटिक मिसळून तो कित्येक दिवस ढवळतात. विद्रावातील सर्व ॲल्युमिनियम हायड्रॉक्साइड अवक्षेपित होते (साक्याच्या रूपात खाली बसते), पण सिलिका अवक्षेपित होत नाही. विद्राव गाळून घेतल्यावर ॲल्युमिनियम हायड्रॉक्साइडाचा चोथा स्वच्छ धुतात व सु. १,१००० से. तापमानास तापवितात.
2 AI (HO)3 → AI2O3 + 3H2O
ॲल्युमिनियम हायड्रॉक्साइड ॲल्युमिना
अशा रीतीने शुद्ध AI2O3 ॲल्युमिनेची शुभ्र पांढरी पूड मिळते. ॲल्युमिनियम हायड्रॉक्साइड काढून घेतल्यावर उरणारा सोडियम हायड्रॉक्साइडाचा विद्राव सांद्र करून पुनः वापरला जातो. सु. ८० किग्रॅ. बॉक्साइटापासून व सु. ३ किग्रॅ. सोडियम हायड्रॉक्साइड वापरून ४० किग्रॅ. ॲल्युमिना मिळते.
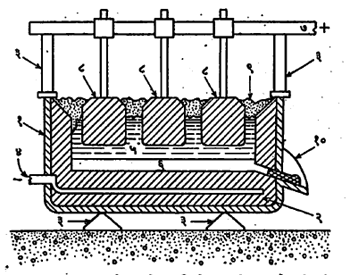
(२) विद्युत् विच्छेदन पद्धतीने ॲल्युमिनेचे क्षपण: सोबतच्या आकृतीमध्ये दाखविल्यासारखी विद्युत् विच्छेदन भट्टी वापरून ॲल्युमिनेपासून धातू वेगळी केली जाते. या आकृतीतील (१) ही कार्बनाचे अस्तर असलेली पोलादी टाकी आहे. तिचे कार्बनी अस्तर ऋणाग्र (विद्युत् पुरवठ्याचे ऋण टोक) असते. टाकीत कार्बनाची अनेक धनाग्रे लोंबत राहतील अशी रीतीने बसविलेली असतात. टाकीत क्रायोलाइट घालून ते वितळल्यावर त्याच्यात शुद्ध केलेली ॲल्युमिना विरघळवितात व ९२०—९९०० से. तापमानात विद्युत् विच्छेदन केल्यास तिचे क्षपण होते. ऋणाग्रालगत ॲल्युमिनियम विमुक्त होते व ती बुडून टाकीच्या तळाशी द्रव अवस्थेत साचते. तळाजवळील एका नळाद्वारे तळाशी साचलेली धातू काढून घेतली जाते. धनाग्राजवळ ऑक्सिजन विमुक्त होत असतो. त्यामुळे धनाग्र हळूहळू जळून जात असते, परंतु त्याच्या ज्वलनाच्या उष्णतेमुळे टाकीतील वितळलेल्या द्रवाचे तापमान टिकून राहण्यास मदत होते.
ॲल्युमिनियम धातूचे उत्पादन फायदेशीर होण्यासाठी अत्यंत आवश्यक गोष्ट म्हणजे विजेचा भरपूर व स्वस्त पुरवठा असणे ही होय. तसा पुरवठा असला म्हणजे अतिशय दूरच्या ठिकाणाहूनही बॉक्साइट आणून त्याच्यापासून धातू काढणे परवडते. उदा., जर्मनी व कॅनडा हे ॲल्युमिनियम धातूच्या उत्पादनात अग्रेसर आहेत, पण त्यांना लागणारे बॉक्साइट परदेशातून आणले जाते.
ॲल्युमिनियम धातू तयार करणे व तिच्यावर निरनिराळे संस्कार करून व्यवहारोपयोगी वस्तू बनविणे अशा दोन्ही प्रकारचे उद्योग भारतात करण्यात येतात.
ठाकूर, अ. ना.
ॲल्युमिनियम धातूचे मुख्य गुण म्हणजे तिचा हलकेपणा, वजनाच्या मानाने उच्च बल (बळकटपणा), क्षरण-प्रतिकार (गंजण्यास विरोध) व सापेक्षतः उच्च विद्युत्संवाहकता आणि उष्णतासंवाहकता हे होत. ॲल्युमिनियमाचा आणखी एक महत्त्वाचा गुण म्हणजे तिच्या मिश्रधातू बनवून कठिणपणा इ. गुण वाढविता येतात. ॲल्युमिनियम किंवा तिच्या मिश्रधातू यांचे ओतकाम, घडीवकाम, लाटण, डाग देणे, पिळून किंवा ओढून तार काढणे व मुद्रांमध्ये (डायमध्ये) दाबून वस्तू तयार करणे इ. कार्ये करता येतात.
उघड्या जागी असताना या धातूवर ऑक्साइडचा अतिशय पातळ व जवळजवळ अदृश्य पण अभेद्य असा पापुद्रा तयार होतो व त्याच्यामुळे ही धातू गंज-प्रतिरोधी होते.
रासायनिक गुणधर्म: ॲल्युमिनियम हवेत तापविल्यावर [4A1 + 3O2→2AI2O3] ॲल्युमिना तयार होते. धातूवर थंड किंवा उष्ण पाण्याचा परिणाम होत नाही. पण लाल होईपर्यंत तापविल्यावर तिच्यावर वाफेचा पुढील परिणाम होतो :
2AI + 3H2O → AI2O3 + 3H2
विरल किंवा सांद्र हायड्रोक्लोरिक अम्लाचा ॲल्युमिनियमावर पुढीलप्रमाणे परिणाम होतो :
2AI + 6HCI → 2AICI3 + 3H2
ॲल्युमिनियम क्लोराइड
विरल सफ्ल्यूरिक अम्लामुळे धातूच्या पृष्ठावर अविद्राव्य क्षारकीय (अम्लाशी विक्रिया होऊन लवण देणाऱ्या) सल्फेटाचा पातळ थर तयार होतो. त्यामुळे आतील धातूवर अम्लाची विशेषशी क्रिया होत नाही. उष्ण, सांद्र अम्लाची विक्रिया होऊन ॲल्युमिनियम सल्फेट व सल्फर डाय-ऑक्साइड तयार होतो.
2AI + 6H2SO4 → AI2 (SO4) + 6H2O + 3SO2
ॲल्युमिनियम सल्फेट सल्फर डाय-ऑक्साइड
ॲल्युमिनियम व दाहक क्षारांचे (अल्कलींचे) विद्राव यांच्या विक्रियेने ॲल्युमिनेटे व हायड्रोजन तयार होतो.
2AI + 2NaOH + 2H2O → 2NaAIO2 + 3H2
सोडियम ॲल्युमिनेट
हॅलोजने (क्लोरीन, ब्रोमीन इ.), गंधक किंवा ऑक्सिजन यांच्याबरोबर तापविल्यावर ॲल्युमिनियमाची व त्यांची संयुगे सरळसरळ तयार होतात.
ॲल्युमिनियमाचे ऑक्सिजनाशी इतके तीव्र बंधुत्व आहे की, Cr2O3, Fe2O3इ. कित्येक धातूंच्या ऑक्साइडांपासून त्यांच्यातील निव्वळ धातू मिळविण्यासाठी ॲल्युमिनियमाचा उपयोग करतात.
[→ थर्माइट].दामले, ज. वि.
संयुगे: (१) ॲल्युमिनियम सेस्क्किऑक्साइड किंवा ॲल्युमिना: Al2O3. कुरुविंद, माणिक, नील इ. खनिजांच्या स्वरूपात ॲल्युमिना आढळते. पण तिचे औद्योगिक उत्पादन मुख्यत: निसर्गात आढळणाऱ्या बॉक्साइटापासून (बॉक्साइटातील ॲल्युमिनियम हायड्रॉक्साइडापासून) केले जाते.
हवेत किंवा ऑक्सिजनात ॲल्युमिनियम तापविल्यावर किंवा तिचे हायड्रॉक्साइड किंवा नायट्रेट तापविल्यावर ॲल्युमिना तयार होते. नवीन तयार केलेली व तापविलेली ॲल्युमिना उभयधर्मी (अम्लीय व क्षारकीय हे दोन्ही गुण असणारी) असते. तिची अम्लांबरोबर विक्रिया होऊन लवणे व दाहक क्षाराबरोबर विक्रिया होऊन ॲल्युमिनिटे तयार होतात.
नवीन तयार केलेली ॲल्युमिना लालसर होईपर्यंत तापविल्यानंतर तिची अम्लाशी किंवा क्षारांच्या विद्रावांशी विक्रिया होत नाही. परंतु दाहक क्षाराबरोबर वितळविल्यावर मात्र ॲल्युमिनेटे तयार होतात. बॉक्साइटापासून किंवा इतर रीतींनी मिळालेले अस्फटिकी ॲल्युमिनियम हायड्रॉक्साइड विजेच्या भट्टीत सु. २,०००० से. तापवून वितळविल्यावर त्याच्यापासून मिळणारी आल्फा ॲल्युमिना शुभ्र स्फटिकमय व अतिशय कठीण असते. हिची कठिनता ९ असून अपघर्षक (खरवडून व घासून पृष्ठ गुळगुळीत करण्यासाठी वापरला जाणारा पदार्थ) म्हणून तिचा उपयोग होतो. ऑक्सि-हायड्रोजनाच्या ज्योतीत २,५००० से. पर्यंत तापविल्या- वर ॲल्युमिनेचे पारदर्शक स्फटिक तयार होतात. कृत्रिम रत्ने व घड्याळातील धारवे (फिरत्या भागांना आधार देणारे भाग, वेअरिंग) करण्यासाठी त्यांचा उपयोग करतात.
(२) ॲल्युमिनियम फ्ल्युओराइड: AlF3. फ्ल्युओरिनात ॲल्युमिनियम तापवून किंवा इतर रीतींनी ॲल्युमिनियम फ्ल्युओराइड तयार करतात. कृत्रिम क्रायोलाइट बनविण्यासाठी ते वापरले जाते.
(३) क्रायोलाइट : Na3AlF6किंवा 3NaF. AlF3. हे विरळाच सापडणारे खनिज असून ग्रीनलंडातील इव्हिगुट व रशियातील मियास्क या दोनच क्षेत्रांत त्याचे उपयुक्त साठे आहेत. ॲल्युमिनियम धातू तयार करण्याच्या भट्टीतील विद्युत् विच्छेद्य रसात अभिवाह ( एखादा पदार्थ कमी तापमानास वितळण्यासाठी मिसळलेला पदार्थ ) म्हणून ते आवश्यक असते. ते दुर्मिळ असल्यामुळे त्याच्याऐवजी कृत्रिम लवणही वापरतात. परंतु नैसर्गिक क्रायोलाइट काही प्रमाणात वापरावेच लागते.
(४) (अ) निर्जल ॲल्युमिनियम क्लोराइड: AlCl3किंवा Al2Cl6. शुद्ध लवण सफेद असते. पण व्यापारी मालाला हिरवट किंवा तपकिरी छटा असतात. हे चिघळणारे असून पाण्याशी होणारी त्याची विक्रिया स्फोटक असते. कार्बनी संयुगाचे संश्लेषण करण्यासाठी (मूळ घटकांपासून कृत्रिम रीतीने तयार करण्या-
साठी ), अल्किल प्रवेशन करण्यासाठी (CnH2n+1 हा ‘अल्किल गट’ आत घुसविण्यासाठी ) व खनिज तेलावर संस्कार करण्याच्या प्रक्रियांत याचा मोठ्या प्रमाणात वापर होतो. फ्रीडेलक्राफ्ट विक्रियेत उत्प्रेरक (विक्रियेत प्रत्यक्ष भाग न घेता ती जलद घडवून आणणारा पदार्थ) म्हणून निर्जल ॲल्युमिनियम क्लोराइडाचा उपयोग होतो [→ फ्रीडेल–क्राफ्ट विक्रिया]. मोडीतील ॲल्युमिनियम, ॲल्युमिना किंवा बॉक्साइट यांवर क्लोरीन किंवा हायड्रोक्लोरि अम्लाची विक्रिया करून ते तयार केले जाते.
(आ) सजल ॲल्युमिनियम क्लोराइड: याचे स्फटिक पिवळसर किंवा रंगहीन व चिघळणारे असतात, पण ते सामान्यत: विद्रावाच्या स्वरूपात वापरले जाते. याचा उपयोग मुख्यत: साबण तयार करण्यासाठी, पाणी निर्जंतुक व शुद्ध करण्यासाठी आणि थोड्या प्रमाणात लोकरीच्या धंद्यात होतो. निर्जल AlCl3 चे स्फटिक पाण्यात विरघळून किंवा सजल ॲल्युमिनेवर हायड्रोक्लारिक अम्लाची क्रिया करून याचे विद्राव तयार केले जातात.
(५) ॲल्युमिनियम सल्फेट: Al2(SO4)3. हे सामान्यत: सजल व Al2(SO4)3.18H2O असे संघटन असणाऱ्या स्फटिकांच्या रूपात मिळते. निर्जल किंवा सजल ॲल्युमिनेवर विरल सल्फ्यूरिक अम्लाची विक्रिया करून ते मिळते. बाजारात मिळणाऱ्या लवणांचे अंशत: निर्जलीकरण झालेले (पाणी निघून गेलेले) असते व त्याच्या दोन प्रती विकल्या जातात. एकात ०·५% किंवा त्याहून कमी लोह व दुसरी जवळजवळ लोहहीन असते. त्याच्या लाद्या, गोळे, पीठ किंवा विद्राव मिळतात. याचा सर्वांत मोठा उपयोग कागदाच्या धंद्यात पाणी स्वच्छ करण्यासाठी व साइझिंगसाठी (वस्तूची गुणवत्ता वाढविण्यासाठी वापरलेल्या पदार्थांना बंधक म्हणून) होतो. सांडपाण्यावर संस्कार करणे व पाणी स्वच्छ करणे त्याचप्रमाणे रंगस्थापन, अग्निरोधन यांसाठीही त्याचा उपयोग केला जातो.
(६) तुरटी: ही संयुगे ॲल्युमिनियम व पोटॅशियम सोडियम किंवा अमोनियम यांची द्विसल्फेटे आहेत. उदा., KAl (SO4)2·12H2O, NaAl (SO4)2·12H 2O, NH4Al (SO4)2·2H2O [→तुरटी].
(७) ॲल्युमिनियम नायट्रेट: Al(NO3)3. ॲल्युमियम हायड्रॉक्साइड व विरल नायट्रिक अम्ल यांच्या विक्रियेने हे संयुग तयार करतात. याच्या स्फटिकांचे रासायनिक संघटन Al(NO3)3·9H2O असे असते. स्फटिक अती विद्राव्य असतात. खनिज तेलाच्या उद्योगधंद्यात लागणारे उत्प्रेरक तयार करण्यासाठी हे मोठ्या प्रमाणात वापरले जाते. प्रदीप्त (उच्च तापमानास प्रकाश देणारे) तंतू तयार करण्यासाठी व कापडधंद्यात लाखेच्या रंगाचे स्थापक म्हणून त्याचा उपयोग होतो.
(८) ॲल्युमिनो सिलिकेटे: पृथ्वीच्या कवचाच्या खडकांत ही विपुल आढळतात. उदा., फेल्स्पारे.
(९) ॲल्युमिनियम ॲसिटेट : (CH3COO)3 Al. ॲसिर्टिक अम्लांत ॲल्युमिना विरघळून हे लवण मिळते. पाण्यातील विद्राव तापविल्यावर –त्याचे सहज जलीय विच्छेदन (पाण्याने विघटन) होते. रंगस्थापक म्हणून तसेच औषधांतही याचा उपयोग होतो.
ॲल्युमिनियमाच्या कोणत्याही लवणाचा पाण्यातील विद्राव घेतला, तर त्याच्यात [Al (H2O)6]3+ हा आयन (विद्युत् भारित अणुगट) असतो व त्याची विक्रिया दुर्बल अम्लासारखी असते.
ॲल्युमिनियम विविध संयुगांत धनायनी (विद्रावात विद्युत् प्रवाह सोडला असता धन अग्राकडे जाणारा अणुगट) वा ऋणायनी जटिल आयनांमध्ये असलेली आढळते. Al (OH)42–, Al Cl4– व Al F63– हे धनायनी जटिल आयन होत, तर [Al (H2O)6]3+ हे ऋणायनी जटिल आयनाचे उदाहरण होय.
उद्योगधंद्यात वापरली जाणारी संयुगे: ॲल्युमिनियमाच्या संयुगांचा वापर उद्योगधंद्यातील प्रक्रियांत फार मोठ्या प्रमाणात होतो. त्यांपैकी महत्त्वाची संयुगे पुढील होत :
ॲल्युमिना: ही निसर्गात मुख्यत: कुरुविंदाच्या स्वरूपात आढळते, पण उद्योगधंद्यात लागणारी ॲल्युमिना सामान्यत: बॉक्साइटापासून तयार केली जाते. ॲपल्युमिनेचे रासायनिक व भौतिक गुणधर्म, ती ज्याच्यापासून केली जाते त्या कच्च्या मालाच्या शुद्धाशुद्धतेवर व उत्पादनाच्या पद्धतीवर अवलंबून असतात व तिचे निरनिराळे प्रकार निरनिराळ्या कामांसाठी वापरले जातात. ॲल्युमिनेचे मुख्य प्रकार पुढील होत.
आल्फा ॲल्युमिना: ही मुख्यत: ॲल्युमिनियम धातू तयार करण्यासाठी वापरली जाते. ही तयार करण्यासाठी चांगल्या प्रतीचे व ज्याच्यात कमीत कमी ५२% ॲल्युमिनियम ऑक्साइड आहे व ज्याच्यात सिलिका (SiO2) ४·५% पेक्षा व फेरिक ऑक्साइड (Fe2O3) ६·५% जास्त नाही असे बॉक्साइट वापरावे लागते.
खाणीतून काढलेले बॉक्साइट दूर पाठवावयाचे असेल, तर त्याचा चुरा करून तो धुऊन त्याच्यातील माती काढून टाकली जाते त्यामुळे वाहतूक काटकसरीची होते. नंतर सामान्यत: बायर पद्धती वापरून त्याचे परिष्करण (शुद्धीकरण) केले जाते. या पद्धतीने मिळणारे ॲल्युमिनियम हायड्रॉक्साइड (Al2O3·3H2O) वाळवून ते भट्टीत भाजल्यावर शुद्ध ॲल्युमिना मिळते व तिच्यापासून धातू काढली जाते.
आल्फा ॲल्युमिनेचा कठीणपणा उच्च असल्यामुळे अपघर्षक म्हणूनही तिचा मोठ्या प्रमाणात उपयोग केला जातो. आल्फा ॲल्युमिनेची संरचना कुरुविंदासारखी, घनता ४ व वितळबिंदू २,०३०० से. असतो.
काही विशेष प्रकारच्या मिश्र पोलादाच्या वस्तूंवर उष्णता संस्कार करण्यासाठी, पोलादाच्या काही विशेष प्रकारच्या जाती वितळविण्यासाठी अभिवाह म्हणून, विशेष प्रकारची कमी प्रसरणशील काच बनविताना तिच्यातील एक घटक म्हणून व चिनी मातीच्या स्निग्ध लेपनाच्या पदार्थातील एक घटक म्हणून व इतर अनेक कामांत आल्फा ॲल्युमिनेचा उपयोग होतो.
चपटी ॲल्युमिना: बायर पद्धतीने मिळालेली अल्युमिना वितळबिंदूपेक्षा किंचित कमी तापमानास भाजल्यावर चपटी ॲल्युमिना तयार होते. सु. अडीच सेंमी. व्यासाच्या गोळ्यापासून ते चाळणीच्या ३०० क्रमांकाच्या चूर्णापर्यंत निरनिराळ्या आकारमानाची चपटी ॲल्युमिना मिळते. तिची स्फटिकी संरचना कुरुविंदासारखी असते. उच्च तापमानात टिकणारा, उच्चतापसह (उच्च तापमान सहन करणारा) पदार्थ म्हणून तिचा उपयोग मोठ्या प्रमाणात केला जातो. उच्चतापसह विटा, धातू वितळविण्याच्या भट्ट्यांच्या बांधणीचे घटक, काच वितळविण्याच्या टाक्या, ज्वालकांची तोंडे इत्यादींसाठी तिचा उपयोग केला जातो. रेडिओ उपकरणांतील विद्युत् निरोधक (प्रवाहाला अडथळा करणारे) भाग व ठिणगी गुडद्या (एंजिनातील इंधन पेटविण्यासाठी त्यात विद्युत् ठिणगी पाडणारे साधन, स्पार्क प्लग्ज) बनविण्यासाठी चपटी ॲल्युमिना वापरली जाते. उत्प्रेरक धारण करणारे चपट्या ॲल्युमिनेपासून बनविलेले भाग उच्च तापमानातही टिकून राहतात. उच्च तापमानात करावयाच्या प्रक्रियांतील उत्प्रेरकधारक बनविण्यासाठीही चपटी ॲल्युमिना वापरली जाते.
ॲल्युमिना जेल: ॲल्युमिनियम क्लोराइडच्या विद्रावात अमोनियाचा किंवा क्षाराचा विद्राव घातल्याने आकाराने अतिशय फुगीर व कलिल (अतिसूक्ष्म कण लोंबकळत असलेले विशिष्ट प्रकारचे द्रवमिश्रण) असा ॲल्युमिनियम हायड्रॉक्साइडाचा निक्षेप (साका) मिळतो. त्यात साधारण १०% पर्यंत ॲल्युमिना व बाकीचे पाणी असते व वाळविल्यावर त्याच्यापासून काचेसारखा कणीदार पदार्थ मिळतो. तापविल्यावर तो सक्रियित (अधिक क्रियाशील) होतो. अधिशोषक (पृष्ठभागावर शोषण करणारा) उत्प्रेरक किंवा उत्प्रेरकांना आधार म्हणून त्याचा उपयोग करतात.
सक्रियित ॲल्युमिना: ॲल्युमिनियम हायड्रेटातील संयुक्त पाणी इष्ट त्या प्रमाणात निघून जाईल, अशा रीतीने काळजीपूर्वक व नियंत्रित परिस्थितीत तापविल्यावर त्यांच्यापासून सक्रियित ॲल्युमिना तयार होते. ती सच्छिद्र व अधिशोषक असते. बाजारात तिचे निरनिराळ्या आकारमानांचे गोळे, खडे व चूर्णे मिळतात. विविध वायू आणि द्रव पदार्थांतील पाण्याचे शोषण करण्यासाठी त्याचप्रमाणे कार्बनी रसायनशास्त्रात भंजन, विहायड्रोजनीकरण (कार्बनी संयुगांतील हायड्रोजन काढून टाकणे) इ. प्रक्रियांत तिचा उपयोग होतो.
सक्रियित बॉक्साइट : बॉक्साइटाच्या निवडक जातीचे तुकडे नियंत्रित परिस्थितीत तापविल्यावर सक्रियित ॲल्युमिनेसारखा पदार्थ मिळतो. त्याचाही सक्रियित ॲल्युमिनेसारखा उपयोग केला जातो.
‘रेड लिकर’ किंवा ‘मॉर्डंट रूज’ या नावाचा एक पदार्थ बाजारात विकला जातो. तो मुख्यत: क्षारक ॲल्युमिनियम ॲसिटेट असतो. कापड जलाभेद्य करण्यासाठी त्याचा उपयोग होतो. हे ॲसिटेट व मेणाचे पायस (एकमेकांत न मिसळणाऱ्या दोन द्रवांचे मिश्रण, →पायस) यांचा एकत्रितपणे उपयोग करून व लेप देऊन पाण्याला दाद न देणारे जलप्रत्यपसारी (पाण्याला विरोध करणारे) सूत तयार करता येते.
आठवले, वि. त्र्यं.
उपयोग : चांदीची विद्युत् संवाहकता १००% धरल्यास तांब्याची ९४% व ॲल्युमिनियमाची ५३% भरते. चांदीची उष्णतासंवाहकता १००% धरल्यास तांब्याची ८९% व ॲल्युमिनियमाची ४८% येते. ॲल्युमिनियम तांब्यापेक्षा हलके असल्यामुळे व त्याची किंमतही कमी असल्याने विद्युत् प्रवाह वाहून नेण्यासाठी तांब्याऐवजी शुद्ध ॲल्युमिनियमाच्या तारांचा उपयोग वाढत आहे. विद्युत् उपकरणांचे काही लहानमोठे भाग बनविण्यासाठीही ॲल्युमिनियम वापरतात.
जमिनीवरील, सागरी तसेच हवाई वाहतूक यांच्या साधनांत ॲल्युमिनियमाचा फार मोठ्या प्रमाणात वापर होतो. आगगाड्यांचे प्रवासी डबे व त्यांचे आतले भाग, मालाचे डबे, विमानांच्या तसेच मोटारींच्या सांगाड्यांचे व एंजिनांचे भाग, मोठ्या जहाजांच्या वरच्या मजल्यांची बांधणी, लहान रक्ष नौका इत्यादींसाठी ॲल्युमिनियम व तिच्या मिश्रधातू वापरल्या जातात. खाणकामाची उपकरणे, कापड विणण्याच्या यंत्राचे भाग, इमारती व त्यांचे संरचनात्मक भाग बनविण्यासाठीही ॲल्युमिनियमाच्या मिश्रधातूंचा उपयोग होतो. ॲल्युमिनियमाची व तिच्या मिश्रधातूंची विद्युत् संवाहकता बरीच असल्यामुळे प्रेषणमार्गाच्या (विद्युत् प्रवाह वाहून नेण्याच्या मार्गाच्या) संवाहक तारा, धारित्रांच्या (विद्युत् भार साठविणाऱ्या साधनाच्या) पट्ट्या, केबलींची संरक्षक आवरणे इ. वस्तू बनविण्यासाठी तिचा उपयोग केला जातो. ॲल्युमिनियम विषारी आहे अशी पूर्वी कल्पना होती पण ती निराधार असल्याचे सिद्ध झाले आहे. त्यामुळे स्वयंपाकाची भांडी, अन्न साठविण्याचे साधे किंवा हवाबंद डबे, खाद्यपदार्थ गुंडाळण्यासाठी पातळ पत्रे किंवा वर्ख इ. तयार करण्या- साठीही तिचा उपयोग होतो. तिच्यावर पुष्कळ रासायनिक द्रव्यांचा परिणाम होत नाही. अशी रसायने (उदा., वाफाळ नायट्रिक अम्ल) ठेवण्यासाठी ॲल्युमिनिमाची पात्रे वापरली जातात. ॲल्युमिनियमाच्या पृष्ठावर निरनिराळ्या प्रकारचे रंगही देता येतात. त्यामुळे तिची उपयुक्तता वाढली आहे. चूर्णरूप ॲल्युमिनियम व व्हार्निश यांच्यापासून तयार केलेला रंगलेप गंज-प्रतिरोधक असून त्याचा खांब, जाळ्या इ. अनेक लोखंडी वस्तूंकरिता वापर करण्यात येतो.
तांबे, जस्त इ. धातू सापेक्षत:दुर्मिळ व महाग असल्यामुळे त्यांच्याऐवजी त्यांच्यापेक्षा अधिक स्वस्त अशा ॲल्युमिनियम किंवा तिच्या मिश्रधातूंचा उपयोग शक्यतो करण्याची प्रवृत्ती आता वाढत आहे. पोलादाच्या काही विशेष मिश्रधातू बनविण्यासाठी जस्त व मॅग्नेशियम यांच्या जोडीने ॲल्युमिनियम वापरतात. शुद्ध ॲल्युमिनियमाच्या गोळ्या व तुकडे विशिष्ट प्रकारचे ‘जित पोलाद’ बनविताना वापरतात. स्टिअरिक अम्ल- लेपित ॲल्युमिनियमाचे पातळ कपटे लाकूड व धातूंवर लेप देण्याच्या रंगांमध्ये वापरतात.
जागतिक उत्पादन: ॲल्युमिनियमाच्या उत्पादनासाठी लागणारे बॉक्साइट प्रामुख्याने जमेका, ब्रिटिश गियाना, रशिया, फ्रान्स, भारत व अमेरिकेची संयुक्त संस्थाने येथे सापडते. ॲल्युमिनियमाचे जागतिक उत्पादन १९६९ मध्ये सु. ९०·३० लक्ष टन होते. हे उत्पादन प्रामुख्याने अमेरिका (४२·१७), रशिया (११·०), कॅनडा (९·८७), फ्रान्स (३·७१), जर्मनी (५·३४), जपान (८·४९), नॉर्वे (५·११) या देशांत झाले. या आकडेवारीत खनिजापासून, तसेच मोडीपासून तयार करण्यात आलेल्या ॲल्युमिनियम धातूचा समावेश आहे.
भारतीय उत्पादन : भारतात लोहेतर धातू दुर्मिळ आहेत. लोहेतर धातूंपैकी ॲल्युमिनियम ही एकच अशी आहे की, जिचे उत्पादन भारतात मोठ्या प्रमाणात होऊ शकेल. भारतात २५ कोटी टनांहून अधिक बॉक्साइटाचे साठे आहेत. त्यांपैकी निदान अडीच कोटी टन बॉक्साइट उत्तम प्रतीचे आहे व अधिक साठे सापडण्याचा संभव आहे. हे साठे मुख्यत: बिहार, आंध्र, मध्य प्रदेश, महाराष्ट्र, गुजरात, कर्नाटक, ओरिसा व जम्मू-काश्मीर या राज्यांत आहेत. ॲल्युमिनियमाच्या उत्पादनासाठी लागणाऱ्या पदार्थांपैकी बॉक्साइट व दगडी कोळसा पुरेशा प्रमाणात उपलब्ध होणे शक्य आहे. तथापि दाहक सोडा, क्रायोलाइट, काजळी यांचे उत्पादन आज पुरेसे नाही. गुजरात, राजस्थान व मध्य प्रदेश यांच्यात आढळणाऱ्या फ्ल्युओराइटाचा उपयोग करून क्रायोलाइटाची गरज अंशत:भागविणे शक्य होईल.
दुसऱ्या महायुद्धाच्या प्रारंभापर्यंत ॲल्युमिनियम धातू काढण्याच्या भट्ट्या भारतात नव्हत्या. १९३७ मध्ये ॲल्युमिनियम कॉर्पोरेशन ऑफ इंडिया (लिमिटेड) या कंपनीची स्थापना झाली व १९४२ मध्ये धातूचे थोडे उत्पादन सुरू झाले. त्यानंतर लवकरच तीन खाजगी कंपन्या सुरू झाल्या. १९५० मध्ये भारतीय उत्पादन केवळ चार हजार टन होते, ते १९७१ मध्ये १७८ हजार टनांपर्यंत वाढले. अद्यापि भारतातील उत्पादन गरजेच्या मानाने बरेच कमी आहे व ॲल्युमिनियमाची आयात करावी लागते. १९७१ मध्ये हिराकूद (ओरिसा), अलवाई (केरळ), बेळगाव (कर्नाटक), रेणुकूट (उत्तर प्रदेश), मेत्तूर (तमिळनाडू) व जेकेनगर (पश्चिम बंगाल) येथील सहा भट्ट्यांतून ॲल्युमिनियम धातूचे उत्पादन झाले. या सर्व भट्ट्या खाजगी क्षेत्रात असून त्यांची एकूण उत्पादनक्षमता प्रतिवर्षी १,६७,००० टन आहे. कोयना (महाराष्ट्र, ५०,००० टन), कोर्बा (मध्य प्रदेश, १००,००० टन) आणि रत्नागिरी—चिपळूण (महाराष्ट्र) येथे सरकारी क्षेत्रात नवीन भट्ट्या उभारण्याच्या योजना आहेत.
निव्वळ धातूच्या उत्पादनाबरो बरच तिच्यावर घडाई करून तिचे पत्रे, तारा, सळया, वर्ख व विशिष्ट छेदाच्या इतर वस्तू तयार करण्याचे कारखाने काढणेही फायदेशीर पडते. इंडियन ॲल्युमिनियम कंपनीतर्फे महाराष्ट्रात ठाण्याजवळील कळवे येथे पातळ पत्रे व चूर्णरूपातील ॲल्युमिनियम बनविण्यात येते.
|
ॲल्युमिनियम धातू व तिच्यापासून तयार होणाऱ्या वस्तूंचे भारतीय उत्पादन (आकडे टनांमध्ये) |
|||||
|
वर्ष |
निव्वळ धातू |
पत्रे |
वर्ख |
तारेच्या सळया |
दाब सारणाने केलेल्या सळया व तर वस्तू |
|
१९६३ |
५३,३८६ |
२२,२४४ |
३,४४४ |
१७,९८८ |
३,९३६ |
|
१९६४ |
५४,५३९ |
२२,५०१ |
२,५४४ |
२०,२५६ |
३,२४० |
|
१९६५ |
५९,५१३ |
२३,५६८ |
२,८६८ |
२४,१४४ |
४,५९६ |
|
१९६६ |
६३,४३२ |
३१,३१८ |
३,५६४ |
२६,२५६ |
६,३७२ |
ॲल्युमिनियमावरील धातुकाम: विद्युत् विच्छेदनाने भट्टीत तयार झालेल्या ॲल्युमिनियमाचा रस साच्यात ओतून ठोकळे, लाद्या व कांबी बनवितात. त्यांच्यावर घडाई करून पत्रे, सळया, नळ्या, तारा इ. बनवितात किंवा त्या पुन्हा वितळवून ओतीव कामसुद्धा करतात. पत्रे बनविण्यासाठी सु. ५० ते १,००० किग्रॅ. वजनाच्या लाद्या, सळया बनविण्यासाठी २०० ते ३०० किग्रॅ. वजनाचे ठोकळे, तारा बनविण्यासाठी ३० ते ४० किग्रॅ. वजनाचे ठोकळे व ओतीव कामासाठी सु. ५ ते २५ किग्रॅ. वजनाच्या कांबी वापरतात.
वरील वस्तूंशिवाय द्रव धातूपासून सु. १ सेंमी. व्यासाच्या गोळ्याही करतात. चाळणीवाटे धातूच्या रसाची धार पाण्यात पाडून गार केल्यास धातूच्या गोळ्या तयार होतात. ॲल्युमिनियमाचे चूर्ण दोन प्रकारे करता येते. पहिला प्रकार, ॲल्युमिनियमाचा पातळ पत्रा कुटून व दुसरा प्रकार, टोकाशी सूक्ष्म छिद्र असलेल्या पिचकाऱ्यांतून द्रव धातूचे तुषार बाहेर पडत असताना त्यांच्यावर प्रचंड दाबाच्या हवेचा झोत सोडून.
औद्योगिक उत्पादन पद्धतीने मिळणारे ॲल्युमिनियम अगदी शुद्ध असत नाही. तिच्यात सिलिका, लोह, मॅग्नेशियम इत्यादींचा अल्पसा अंश असतो. त्यांच्यामुळे धातूंचे गुणधर्म बदलतात व गुणधर्मानुसार तिचा उपयोग करावा लागतो. ९९·९९, ९९·८०, ९९·५० व ९९ टक्के शुद्ध अशा ॲल्युमिनियमाच्या प्रती विकत मिळतात. शुद्ध धातूमध्ये इतर धातू हेतूपुरःसरही मिसळतात, कारण त्यामुळेही शुद्ध धातूचे गुणधर्म बदलतात. काही विशिष्ट कामांकरिता अधिक चांगली व विशिष्ट गुणधर्ण असणारी मिश्रधातू तयार व्हावी म्हणून अशी मिश्रणे बनविण्यात येतात.
ॲल्युमिनियमाचे बल तिच्या शुद्धतेवर आणि त्याचप्रमाणे कोणते औष्णिक व यांत्रिक संस्कार तिच्यावर झालेले आहेत यांवर अवलंबून असते. शुद्ध ॲल्युमिनियम (९९·९९६%) अगदी मऊ असते व तिच्या ओतीव किंवा अनुशीतन केलेल्या (तापवून थंड केलेल्या) वस्तूंचे ताणबल (ताणण्याच्या क्रियेला होणारा वस्तूचा विरोध) केवळ सु. ४५० किग्रॅ./चौ.सेंमी. असते. परंतु मिश्रण करून किंवा योग्य औष्णिक व यांत्रिक संस्कार करून ६७५ किग्रॅ./चौ.सेंमी. ताणबलाची मिश्रधातू मिळवता येते. शुद्ध धातूच्या मानाने घडाई व ओतकाम अधिक सोप्या रीतीने करता येईल अशाही मिश्रधातू बनविण्यात येतात.
मिश्रधातू : ॲल्युमिनियम मिश्रधातूंच्या वर्गीकरणाच्या एका प्रकारात (१) घडीव कामास योग्य व (२) ओतीव कामास योग्य असे वर्ग करतात. या प्रत्येकाचे उष्णता संस्करणास योग्य व अयोग्य असे उपवर्ग पडतात.
भारतीय मानक संस्थेने शुद्ध ॲल्युमिनियम व तिच्या मिश्रधातू यांसंबंधी वेगवेगळी मानके प्रसिद्ध केलेली आहेत. घडाईच्या मिश्रधातू, ओतीव कामाच्या मिश्रधातू, त्यांचे विशिष्ट उपयोग, रासायनिक संघटन, गुणधर्म इ. गोष्टींचा त्यात विस्तारपूर्वक विचार केलेला आहे व त्यांसंबंधी प्रमाणे ठरविली आहेत.
ॲल्युमिनियमाच्या मिश्रधातू बनविण्यासाठी तांबे, सिलिकॉन व मॅग्नेशियम ही मुख्यत: वापरली जातात. यांशिवाय जस्त, मँगॅनीज, टिटॅनियम, क्रोमियम, कथिल, निकेल व शिसे यांचाही उपयोग करतात. तसेच १३ ते २० टक्के सिलिकॉन असलेल्या ॲल्युमिनियमाच्या मिश्रधातूत अत्यल्प प्रमाणात सोडियम व फॉस्फरस मिसळून ओतीवांचे गुणधर्म सुधारता येतात.
ॲल्युमिनियमामध्ये तांबे मिसळून तयार होणाऱ्या मिश्रधातूचे ताणबल, शुद्ध ॲल्युमिनियमापेक्षा पुष्कळच वाढते व ही वाढ मिसळलेल्या तांब्याच्या प्रमाणावर अवलंबून असते. ॲल्युमिनियम व तांबे यांचे मिश्रण द्रव अवस्थेतून थंड हवेत घन अवस्थेत जाताना त्यातील ७%च्या वरील तांबे मूळ मिश्रणातून सुटे होऊन सूक्ष्म स्फटिकरूपाने बाहेर पडते व त्या प्रमाणात उरलेल्या मिश्रणाचे ताणबल कमी होते. हे बल परत मिळविण्या- साठी थंड झालेले मिश्रण एका विशिष्ट तापमानापर्यंत गरम करतात व त्या तापमानास बराच वेळ राहू देतात. या उष्णता उपचारामुळे स्फटिकरूपाने बाहेर पडलेले तांब्याचे कण पुन्हा मूळ मिश्रणात अंशतः शिरतात व त्यामुळे मिश्रणाचे एकंदर ताणबल पुष्कळच सुधारते [→ मिश्रधातू कासे].
ड्युराल्युमीन : ही ॲल्युमिनियमाची महत्त्वाची मिश्रधातू आहे. उष्णता संस्काराने या मिश्रधातूच्या ताणबलात व कठिनतेत वाढ होते असे आल्फ्रेड विल्म यांनी १९०६ मध्ये प्रथम सिद्ध केले. ड्युराल्युमिनामध्ये ४% तांबे, ०·५% मॅग्नेशियम, ०·५% मँगॅनीज व बाकीचे ॲल्युमिनियम असते. घडीव कामास योग्य अशी ही मिश्रधातू विमानाच्या बांधणीत व इतर बांधकामांमध्ये वापरतात. भारतीय मानक संस्थेच्या एच—१४ व एच—१५ या मिश्रधातूंचे गुणधर्म ड्युराल्युमिनाप्रमाणे आहेत.
४% तांबे, १·५% मॅग्नेशियम, २% निकेल व बाकीचे ॲल्युमिनियम असलेली उष्णता-संस्कारास योग्य अशी मिश्रधातू ओतकामास योग्य आहे. ए—१४ ह्या क्रमांकाची मिश्रधातू दट्ट्या, सिलिंडर टोपण इत्यादींच्या ओतकामात वापरतात.
हिंदालियम: हिंदुस्थान ॲल्युमिनियम कंपनीने तयार केलेल्या व पेटंट घेतलेल्या हिंदालियम या मिश्र- धातूमध्ये सुमारे १% मॅग्नेशियम आहे. भांडी बनविण्यासाठी हिंदालियमाचे १·६ मिमी. जाडीचे पत्रे वापरतात. या भांड्यांना चकाकी चांगली येते व त्यांच्यावर संरक्षक लेप चांगल्या प्रकारे देता येतो. ही मिश्रधातू क्रियेमध्ये कठीण होणाऱ्या प्रकारची असल्याने तिची भांडी जास्त टिकाऊ व मजबूत होतात.
घडाई: लोखंड, तांबे वगैरेंसारख्या धातूंप्रमाणेच ॲल्युमिनियमावर व तिच्या मिश्रधातूंवरही सर्व तऱ्हेची घडाई करता येते. उष्णघडण व शीतघडण हे घडाईचे दोन्ही प्रकार ॲल्युमिनियमाच्या घडाईत वापरता येतात. साधारणतः इतर धातूंप्रमाणेच ॲल्युमिनियमाच्या सर्व प्रकारांत या दोन्ही पद्धतींतील खबरदाऱ्या घ्याव्या लागतात व घडाईचे परिणाम सारखेच दिसून येतात. ॲल्युमिनियमाच्या घडाईत लाटण, दाबसारण (धातू गरम असताना योग्य साच्यामधून घणाने ठोकून सळया—नळ्या बनविण्याची किर्या), कर्षण (ओढणे), घडणकाम आणि वाकविणे या क्रियांचा समावेश होतो [→घडाई, धातूंची].
लाटण क्रियेने ॲल्युमिनियमाचे जरूरीप्रमाणे कमीअधिक जाडीचे पत्रे बनविता येतात. हेच पत्रे पुन्हा लाटून सुमारे ०·१५ मिमी. जाडीचे बनविल्यास त्याला वर्ख म्हणतात. यासाठी मुख्यतः ९९ ते ९९·९९ टक्के शुद्ध ॲल्युमिनियम वापरतात. या वर्खाला ‘चांदी’ असेही नाव प्रचलित आहे. दाबसारण पद्धतीने ॲल्युमिनियमाच्या सळया, नळ्या व भरीव वा पोकळ रचनेचे भाग बनविता येतात. विविध व्यासांच्या तारा व नळ्या बनविण्या- साठी कर्षण पद्धती वापरतात. आघाती घडाईने ॲल्युमिनियमापासून पाने, हातपकडी यांसारख्या साध्या वस्तू घडविता येतात. ॲल्युमिनियमाचे पत्रे वाकवून किंवा त्यांच्यावर ठराविक आकाराची मुद्रा दाबून विविध आकारांची भांडी बनवतात [→ धातुपत्राकाम].
ओतकाम : ॲल्युमिनियम व तिच्या मिश्रधातूंच्या ओतकामासाठी साधे वा वाळूतील, मुद्रांतील व दाबसहित मुद्रांतील या तिन्ही पद्धती वापरतात. ओतकामात ॲल्युमिनियम-मॅग्नेशियम या मिश्रधातूत चिरांचे प्रमाण ॲल्युमिनियम-सिलिकॉन या मिश्रधातूपेक्षा जास्त असते. ओतकामासाठी फक्त कांबी वापरल्यास मिश्रधातूंचे गुणधर्म, वायूंशी होणाऱ्या प्रक्रिया इ. मर्यादेत ठेवता येतात. परंतु मोडीचे सामान, ओतकामात उरलेले तुकडे इ. वापरल्यास त्यांच्यात समाविष्ट झालेल्या ऑक्सिजनाचे व मिश्रधातूतील घटकांचे प्रमाण व अपद्रव्ये यांचा काळजीपूर्वक विचार करावा लागतो. ओतकामासाठी वितळविलेल्या धातूवर जमणाऱ्या ऑक्साइडाचे मान कमी करण्यासाठी क्रायोलाइटासारख्या द्रव्यांचा थर द्रवधातूच्या पृष्ठभागावर कायम राहील अशी व्यवस्था करतात [→ ओतकाम].
उष्णता संस्करण: ॲल्युमिनियमाच्या मिश्रधातूंचे गुणधर्म उष्णता संस्करणांनी बदलता येतात. यासंबंधी विल्म या संशोधकाचे कार्य महत्त्वाचे आहे. १९०६ मध्ये त्यांनी ड्युराल्युमीन ही मिश्रधातू बनविली. तीत ४% तांबे, ०·५% मँगॅनीज आणि ०·५% मॅग्नेशियम मिसळलेली होती. उष्णता संस्करणांनी तिचे ताणबदल व इतर गुणधर्म पुष्कळच चांगले झाले. उष्णता संस्करणांनी एखादी मिश्रधातू बहुविध क्षेत्रांत उपयोगी ठरेल असे करता येणेही शक्य असते [→ धातूंचे उष्णता संस्करण].
जोडकाम: ॲल्युमिनियमाचे जोडकाम नटबोल्टाने, रिव्हेटाने वा वितळजोडाने (वेल्डिंगने) करता येते.
ॲल्युमिनियम ही उष्णतेची शीघ्रवाहक असल्याने रिव्हेट जोडकाम करण्यासाठी एखादा भाग तापविताना उष्णता त्या भागापुरती मर्यादित राहत नाही. तसेच उष्णता संस्करणाने गुणधर्म बदलले जाणाऱ्या मिश्रधातूवर या उष्णतेचा अपायकारक परिणाम होतो म्हणून वस्तू गरम न करता रिव्हेटकाम केले जाते. ॲल्युमिनियमाचा वितळबिंदू पोलादाच्या मानाचे बराच कमी असला, तरी तिची उष्णता संवाहकता जास्त असल्याने ॲल्युमिनियमाच्या वितळजोडकामात जवळजवळ पोलादाच्या वितळजोडकामाला लागते तितकीच उष्णता पुरवावी लागते. वितळजोड करावयाचे भाग जर आधी गरम करून घेतले, तर उष्णतासंवहनाचा वेग कमी होऊन वितळजोड करणे सुलभ होते. वितळजोडासाठी शुद्ध ॲल्युमिनियमाची तार वापरतात. वायू, वीज व दाबासहित केलेले वितळजोड हे तिन्ही प्रकार ॲल्युमिनियमाच्या जोडकामात उपयोगी पडतात. यांशिवाय झाळाने किंवा क्षार सिलिकेट वा इतर चिकट पदार्थांचा उपयोग करूनही जोडकाम केले जाते.
यांत्रिक क्रिया: पोलादाशी तुलना करता पोलाद व ॲल्युमिनियम व तिचे मिश्रधातू यांच्यात पुढील फरक आढळतात.
(१) घनता पोलादाच्या १/३ पेक्षा कमी असल्याने मोठ्या आकाराच्या वस्तूही यंत्रावर घडविता येतात. (२) ॲल्युमिनियम ही उष्णतेची शीघ्रवाहक असल्याने तिचे पदार्थ लवकर गरम होत नाहीत. (३) काठिण्य कमी असल्याने तिच्यावर यांत्रिक क्रिया जलद होतात. (४) ॲल्युमिनियमाचा प्रत्यास्थतेचा (स्थितिस्थापक- तेचा) मापांक पोलादाच्या सु. १/३ असल्याने प्रमाणाबाहेर दाब दिल्यास यांत्रिकी क्रियांत तिच्या वस्तू वाकतात. (५) शरण-बल (पदार्थात विकृती निर्माण होण्यास लागणारे बल) कमी असल्याने ॲल्युमिनियमा- च्या वस्तूत अभिघटनीय (वस्तूच्या आकार व मांडणीत) विकृती होण्याची शक्यता असते.
यांत्रिक क्रियांच्या सौकर्याच्या दृष्टीने ॲल्युमिनियमाच्या मिश्रधातूंचे खालीलप्रमाणे वर्गीकरण करता येते : (१) शुद्ध ॲल्युमिनियम व ॲल्युमिनियम-मॅग्नेशियम मिश्रधातू : यांचे काठिण्य ७० ब्रिनेलपेक्षा [कठिनता मोजण्याचे एकक, → कठिनता] कमी असल्याने यांत्रिक क्रिया करताना हत्यारांच्या टोकांना कोन वाढवावा लागतो. कर्तनात निघणाऱ्या वळ्या चिवट असल्याने धातू नरम असूनही कर्तनक्रिया सोप्या नसतात.
(२) ॲल्युमिनियम—सिलिकॉन मिश्रधातू : उष्णता संस्करण केलेल्या व ५ ते ८ टक्के सिलिकॉन असलेल्या मिश्रधातू यांत्रिक क्रिया करण्यास सोप्या असतात. १ ते २ टक्के शिसे घालून ही सुकरता वाढविता येते. सिलिकॉनाचे प्रमाण १० ते १३ टक्के असल्यास कर्तन हत्याराची झीज जास्त होते. म्हणून कठीण तुकडे बसविलेले हत्यार किंवा हिरकणीयुक्त हत्यारे या कामी वापरतात.
छिद्रण, चक्रीकर्तन इ. नेहमीच्या क्रिया ॲल्युमिनियमावर करता येतात. शाणन (घासून स्वच्छ करण्या- ची) क्रिया फारशी प्रचारात नाही. पण त्यासाठी कुरुविंदाचे व हिरकणीयुक्त चक्र वापरल्यास चकाकी चांगली येते. पोलादावर चालणारी कानस ॲल्युमिनियमावर निरुपयोगी ठरते, कारण तिच्यात चुरा अडकून बसतो. दात्यांतील अंतर जास्त असलेल्या व गोलाकार दातांच्या कानसी ॲल्युमिनियमासाठी वापराव्या लागतात.
संरचनात्मक गुणधर्म : ॲल्युमिनियम व तिच्या मिश्रधातूंचे ओतकाम, जोडकाम वा यांत्रिकी क्रिया करून तयार केलेल्या वस्तूंचा बांधकामासाठी उपयोग करताना त्यांचे ताणबल लक्षात घ्यावे लागते. त्याचप्रमाणे संरचनेतील ज्या भागांवर बदलते जोर, ताण आणि दाब येतात, त्या ठिकाणी हे बदलते जोर सहन करण्याची शक्ती अजमावावी लागते.
ॲल्युमिनियम ही सापेक्षतः क्रियाशील आहे, पण तिच्या किंवा तिच्या मिश्रधातूंच्या पृष्ठावर जो सलग व चिवट असा ऑक्साइडाचा पातळसा थर तयार होतो त्याच्यामुळे ॲल्युमिनियमापासून बनविलेल्या पदार्थाची गंज-प्रतिरोधशक्ती वाढते व त्यामुळे त्यांना औद्योगिक महत्त्व प्राप्त झाले आहे. मॅग्नेशियम असलेल्या मिश्र- धातूंच्या वस्तू पाण्यात किंवा दमट हवेत चांगल्या टिकतात.
पृष्ठभागावरील संस्करण : हे संस्करण ॲल्युमिनियमाच्या वस्तू स्वच्छ व चकचकीत करण्यासाठी, ऑक्साइडाचा थर पृष्ठावर देऊन गंजण्यास प्रतिरोध करण्यासाठी, उष्णता व प्रकाश परावर्तनशक्ती वाढविण्यासाठी किंवा शोभेच्या वस्तूंचा पृष्ठभाग चांगला, रंगीत व आकर्षक दिसण्यासाठी केले जाते. प्रथम ब्रशाने घासून किंवा यांत्रिकी क्रियांनी वस्तू स्वच्छ केल्या जातात. उंचसखल भाग असलेल्या वस्तू क्षाराच्या विद्रावात किंवा अम्लामध्ये बुडवून रासायनिक पद्धतीने स्वच्छ करतात. सामान्यतः घडीव किंवा ओतकामा- नंतर आलेला ऑक्साइडाचा थर गंज-प्रतिरोधक असतो. कृत्रिम रीत्या त्याची जाडी वाढवून गंज-प्रतिरोध-शक्ती वाढविता येते. फॉस्फेट-लेपन, क्रोमेटीभरण (क्रोमेट वा डायक्रोमेट या संयुगांचा संस्कार करणे वा ती घुसविणे) इ. रासायनिक प्रक्रिया करून पदार्थावरील ऑक्साइडाचा थर वाढतो. विद्युत् विच्छेदनाचे तत्त्व वापरून ॲल्युमिनियमाच्या पृष्ठभागावर संरक्षक लेप चढविण्याच्या क्रियेला औद्योगिक महत्त्व आले आहे. ॲल्युमिनियमाच्या वस्तू एखाद्या रंगात बुडवून ऑक्साइडाला पाहिजे तो रंग देता येतो. याखेरीज इतर धातूंचे मुलामे देणे, आकाचन (एनॅमलाचा थर देणे) इ. संस्कार ॲल्युमिनियमावर व तिच्या मिश्रधातूंवर करता येतात. गंज-प्रतिरोधासाठी पोलादावर जस्ताऐवजी ॲल्युमिनियमाचा मुलामा देण्याचा प्रघात वाढत आहे.
ॲल्युमिनियमाची भांडी: निरनिराळ्या प्रकारची लहानमोठी भांडी, टाक्या, पात्रे इ. बनविण्यासाठी शुद्ध ॲल्युमिनियमाचा किंवा तिच्या मिश्रधातूंचा उपयोग करतात. खाण्याच्या पदार्थांसाठी वापरली जाणारी भांडी किमान ९९% शुद्धतेच्या व जिच्यात तांब्याचे प्रमाण ०·०५% पेक्षा जास्त नसते, अशा ॲल्युमिनियमापासून बनवितात. रासायनिक उपयोगासाठी वापरावयाच्या पात्रांच्या धातूत तांबे याहूनही कमी म्हणजे ०·०२% किंवा कमी असावे लागते. तांब्यामुळे ॲल्युमिनियमाची गंजप्रतिरोधक शक्ती कमी होते. ॲल्युमिनियमाची भांडी मुख्यतः लाटणाने तयार केलेल्या पत्र्यांपासून बनवितात. ॲल्युमिनियमाची भांडी तयार करण्यासाठी योग्य त्या जाडीचा व आकारमानाचा पत्रा कापून घेऊन तो पत्रा चातीवर फिरवून किंवा दीर्घ कर्षण करून त्याला इष्ट तो आकार दिला जातो. ह्या दोन्ही पद्धती शीत घडणाच्या आहेत. या पद्धतींखेरीज ओतकाम करूनही भांडी बनवितात व ओतीव वस्तूवर यांत्रिक क्रिया करतात. पत्र्यांचे वितळजोडकाम किंवा इतर जोडकाम करूनही भांडी बनवितात.
वरील कोणत्याही पद्धतीने तयार केलेल्या भांड्यांचा पृष्ठभाग घासून व यांत्रिक क्रिया करून चकचकीत करतात. शिवाय पृष्ठावर कृत्रिम ऑक्साइडाचा थर देणे, आकाचन, इतर धातूंचे मुलामे देणे इ. संस्कारही आवश्यक तर करता येतात. अशा संस्कारांमुळे भांड्याची गंज-प्रतिरोधक शक्ती वाढते.
परदेशातून आयात केलेल्या पत्र्यांपासून भांडी बनविण्याची सुरुवात भारतात १९२९ साली झाली. त्यानंतर मुंबई, कलकत्ता व इतर कित्येक शहरांत ॲल्युमिनियमाची भांडी बनविण्याचे कारखाने निघालेले आहेत [→ भांडी, धातूंची].
दामले, ज. वि.
संदर्भ : 1. CSIR, The Wealth of India, Raw Materials and Industrial Products, Delhi, 1948.
2. Mellor, J. W. A Comprehensive Treatise on Inorganic and General Chemistry, Vol.V, London, 1961.
“