डायाझो संयुगे : (डाय-ॲझो संयुगे). ज्यांच्या संरचनेत (रेणूतील अणूंच्या मांडणीत) – N=N–हा गट असून त्यापैकी एक नायट्रोजन अणू हायड्रोकार्बनाच्या वा त्याच्या अनुजाताच्या (त्यापासून बनविलेल्या दुसऱ्या संयुगाच्या) कार्बन अणूला व दुसरा कार्बनेतर अणूला अथवा अणुगटाला जोडलेला किंवा न जोडलेला आहे, अशी कार्बनी संयुगे.
उदा., बेंझीन डायाझोनियम क्लोराइड C6H5–N=N–Cl, पोटॅशियम बेन्झीन डायाझोटेट C6H5–N=N·OK, डायाझोमिथेन CH2=N2.
ॲरोमॅटिक डायाझो संयुगे : प्राथमिक ॲरोमॅटिक अमाइनांवर नायट्रस अम्लाची विक्रिया करून ही बनविता येतात. या पद्धतीने पीटर ग्राइस यांनी १८५८ मध्ये या वर्गातील पहिले संयुग बनविले. या प्रक्रियेला ⇨ डायाझोटीकरण म्हणतात.
C6H5NH2 + HNO2 + HCl ⟶ C6H5N2Cl + 2H2O
येते. प्रतिष्ठापित प्राथमिक ॲरोमॅटिक अमाइनांचे (ज्यांच्या वलयातील हायड्रोजन अणूंच्या जागी इतर अणू अथवा अणुगट आहेत अशांचे) डायाझोटीकारण करण्यासाठी प्रक्रियेच्या तपशिलात काही बदल करावे लागतात.
गुणधर्म : ही लवणे वर्णहीन व स्फटिकी असून हवेत काळवंडतात. कोरड्या स्थितीत तापविल्याने अथवा आघात केल्याने त्यांचा स्फोट होतो. ती पाण्यात विरघळतात, पण ईथर व इतर कार्बनी विद्रावकांत अविद्राव्य (विरघळणारी) आहेत. झिंक क्लोराइड, स्टॅनिक क्लोराइड, फ्ल्युओबोरिक अम्ल इत्यादींबरोबर त्यांची कमी विद्राव्य व स्थिर जटील लावणे बनतात म्हणून त्या रूपात ती विद्रावापासून वेगळी करता येतात. प्रबल अम्लांची लवणे पाण्यात पूर्णपणे विगमन (रेणूचे तुकडे होऊन विद्युत् भारित खंड म्हणजे आयन बनण्याची क्रिया) पावतात. ती ArN2·OH या प्रबळ क्षारकापासून (अम्लाशी विक्रिया झाल्यास लवण देणाऱ्या पदार्थापासून) बनलेली आहेत (Ar = ॲरोमॅटिक वलय). हा क्षारक विद्रावात असतो, पण वेगळा केलेला नसतो. रासायनिक दृष्टीने ती फार विक्रीयाशील आहेत. त्यांच्या काही महत्त्वाच्या विक्रिया पुढीलप्रमाणे आहेत.
C6H5N·NCl + CH3․CH2 ․OH → C6H6 + CH3·CHO + HCl + N2
(२) दुसरीमध्ये पुढे दाखविल्याप्रमाणे फिनिल ईथर निष्पन्न होते. उदा.,
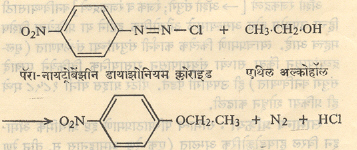
यांपैकी कोणती विक्रिया होईल हे डायाझो लवणामध्ये असलेल्या गटांवर अवलंबून असते.
(३) पाण्याच्या विक्रियेने फिनॉले बनतात. उदा.,
बनलेल्या फिनॉलाची डायाझो लवणाशी विक्रिया होत असल्यामुळे फिनॉलाचा उतारा उच्च नसतो पण विक्रिया मिश्रणाचे बाष्प-उर्ध्वपातन (मिश्रणातून वाफ जाऊ देऊन नंतर ती थंड करून पदार्थ मिळविण्याची प्रक्रिया) करून फिनॉल निर्माण झाल्याबरोबर वेगळे काढले, तर उतारा सुधारतो.
(४) डायाझोनियम लवणाचा विद्राव आणि हॅलोजनी अम्लात विरघळविलेले क्युप्रस हॅलाइड यांची विक्रिया केल्याने डायाझो गटाच्या जागी हॅलोजनाचा अणू येतो. उदा.,
(अ)
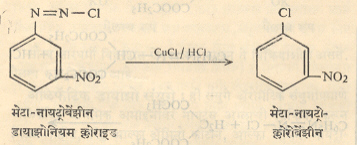
(आ)

या विक्रीयांना सँडमायर विक्रिया म्हणतात.
अशाच विक्रिया क्युप्रस लवणांच्या ऐवजी ताम्रचूर्ण वापरल्यानेही घडून येतात (गॅटरमन विक्रिया). उदा.,
(इ)

पोटॅशियम आयोडाइडाच्या जलीय विद्रावाबरोबर डायाझोनियम लवण तापविले, तर डायाझो गट जाऊन त्या जागी आयोडिनाचा अणू येतो. उदा.,
(ई) C6H5N․NCl + KI → C6H5I + KCl + N2
बेंझीन डायाझोनियाम क्लोराइडाच्या विद्रावात बोरोफ्ल्युओरिक अम्ल मिसळले, तर बेंझीन डायाझोनियम बोरोफ्ल्युओराइड अवक्षेपित (साका म्हणून तळाशी बसणे ) होते. ते वेगळे करून व वाळवून सौम्य प्रकारे तापविले, तर फ्ल्युओरोबेंझीन मिळते.
(५) डायाझोनियम लवण आणि जलीय पोटॅशियम सायनाइडात विरघळंविलेले क्युप्रस सायनाइड यांच्या विक्रियेने डायाझो गटाच्या जागी सायनोजन गट येतो. अशीच विक्रिया ताम्रचूर्ण आणि पोटॅशियम सायनाइड वापरूनही घडविता येते. उदा.,
|
C6H5N·NCl |
CuCN/KCN ⟶ |
C6H5 CN |
+ |
N2 |
|
बेंझीन डायाझोनियम क्लोराइड |
सायनोबेंझीन |
|||
(६) सोडियम आर्सेनाइटच्या विक्रियेने बेंझीन डायाझोनियम क्लोराइडापासून फिनिल आर्सॉनिक अम्ल बनते. उदा.,
C6H5N․NCl + NA3AsO3 → C6H5AsO3․Na2 + N2 + NaCl
बेंझीन डायाझोनियम क्लोराइड सोडियम आर्सेनाइट सोडियम फिनिल आर्सेनेट
|
C6H5AsO3.Na2 |
HCl → |
C6H5AsO3H2 |
+ |
2NaCl |
|
सोडियम फिनिल आर्सेनेट |
फिनिल आर्सॉनिक अम्ल |
|||
(७) क्युप्रस ऑक्साइडाच्या उपस्थितीत नायट्रस अम्लाच्या विक्रीयेने डायाझो गटाची जागा नायट्रो गट घेतो. उदा.,
आतापर्यंत वर्णिलेल्या विक्रियांत N2 गट निघून जाऊन विक्रिया झाली पण कित्येक विक्रिया अशा आहेत कि, ज्यांमध्ये तो कायम राहतो. अशा विक्रियांपैकी काही पुढे दिल्या आहेत.
फिनिल हायड्रॅझीन हा एक महत्त्वाचा विक्रियाकारक असून आल्डिहाइडे व कीटोने यांपासून स्फटिकरूप अनुजात बनविण्यासाठी तो उपयोगी पडतो. शर्करांच्या संशोधनात एमील फिशर यांनी याचा पुष्कळ वापर केला.
संयुग्मीकरण : डायाझो संयुगांची फिनॉले व अमाइने यांच्यावर जी विक्रिया होते, तिने ही संयुगे जोडली जातात म्हणून तिला संयुग्मीकरण अशी संज्ञा आहे. अशा विक्रियेमध्ये फिनॉलातील OH गटाच्या व अमाइनातील NH2 गटाच्या पॅरा स्थानी असलेला हायड्रोजन डायाझोनियम गटाने प्रतिष्ठापित होतो आणि ॲझो संयुग बनते.उदा.,
![]()
![]()
फिनॉलातील किंवा अमाइनातील पॅरा स्थान अगोदरच प्रतिष्ठापित झालेले असेल, तर संयुग्मीकरण ऑर्थो स्थानी होते पण पॅरा आणि ऑर्थो स्थाने प्रतिष्ठापित असतील, तर विक्रिया होत नाही. उदा.,
OH
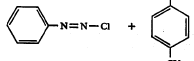
CH3
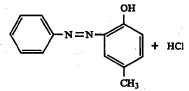
प्राथमिक व द्वितीयक अमाइनांबरोबर पुढीलप्रमाणे विक्रिया होऊ शकते.
![]()
![]()
खनिज अम्लांच्या योगाने डायझोॲमिनोबेंझीनाचे पॅरा-ॲमिनो-ॲझोबेंझीन बनते.
![]()
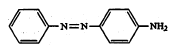
संयुग्मीकरण विक्रिया किंचित अम्लधर्मी किंवा क्षारधर्मी (अल्कलाइन) विद्रावात घडून येतात.

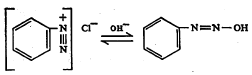
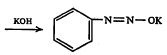
हे आंतरपरिवर्तन संपूर्ण नसते, तर त्यामध्ये समतोल असतो. तो विद्रावाचे pH मूल्य [ → पीएच मूल्य], संहती व ज्या मूळ संयुगापासून ते निर्माण झाले यावर अवलंबून असतो. डायाझोटेटे ऐलस्थ(द्विबंधांनी जोडलेल्या दोन नायट्रोजन अणूंच्या एकाच बाजूला अणुसमुच्चय असलेले) आणि पैलस्थ(अणुसमुच्चय विरुद्ध बाजूला असलेले) अशा दोन त्रिमितीय रूपांत अस्तित्वात राहू शकतात. उदा.,

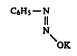
सौम्य क्षारधर्मी विद्रावात ऐलस्थ रूप असून ते विक्रियाशील असते. पैलस्थ रूप निष्क्रिय आहे.
(p) CH3 — C6H4 — SO2—N (CH3) — NO + KOH →
पोटॅशियम पॅरा-टोसिल सल्फोनेट डायाझो मिथेन
डायाझो मिथेनाची संरचना CH2 = N+ = N:— अशी दर्शविली जाते.
1. Fieser, L. F. Fieser, M. Organic Chemistry, Bombay, 1962.
2. Krauch, H. Kunz, W. Organic Name Reactions, London, 1964.
3. Richter, G. H. Textbook of Organic Chemistry, London, 1959.
“