कार्बन : चिन्ह C; घनरूप अघातवीय मूलद्रव्य; अणुक्रमांक (अणुकेंद्रातील प्रोटॉनांची संख्या) ६; अणुभार १२⋅०११; आवर्त सारणी (मूलद्रव्यांची विशिष्ट पद्धतीने केलेली कोष्टकरूप मांडणी) गट ४; वितळबिंदू ३,५००° से.; उकळबिंदू ३,९००° से.; विद्युत् विन्यास (अणुमधील इलेक्ट्रॉनांची मांडणी) २ व ४; वि. गु. हिऱ्याचे ३·५२, ग्रॅफाइटाचे २·२५; समस्थानिक (तोच अणुक्रमांक पण भिन्न अणुभार असलेले त्याच मूलद्रव्याचे प्रकार) १०, ११, १२, १३, १४, १५ व १६; किरणोत्सर्गी (कण वा किरण बाहेर फेकण्याचा गुणधर्म असणारे) समस्थानिक १०, ११, १४, १५ व १६; स्थिर समस्थानिक १२ व १३; पृथ्वीच्या कवचातील प्रमाण ०·०३२% ; मुख्य संयुजा [अणूची संयोग पावण्याची क्षमता, →संयुजा ] ४.
उपस्थिती : हिरा, ग्रॅफाइट व दगडी कोळसा या स्वरूपांत कार्बन भूकवचात अनेक ठिकाणी विखुरलेला आहे. तसेच वनस्पती, प्राणी व खनिज तेले यांचा कार्बन हा महत्त्वाचा घटक आहे. धातवीय खनिजांत ते कार्बोनेटे या रूपाने आढळते.
गुणधर्म : आवर्त सारणीच्या चौथ्या गटातील इतर मूलद्रव्यांप्रमाणे कार्बनही बहुरूपता (एखादे मूलद्रव्य दोन वा अधिक घन, द्रव वा वायुरुप अवस्थेत असण्याचा गुणधर्म) दाखविते. हिरा व ग्रॅफाइट ही त्याची स्फटिकी बहुरूपे होत व लोणारी कोळसा, काजळी, गॅस कार्बन ही अस्फटिकी रूपे आहेत असा समज होता, परंतु हे प्रकार म्हणजे अशुद्ध ग्रॅफाइटच आहे आणि त्याचे स्फटिक अपूर्णावस्थेत असून इतर द्रव्यांशी मिसळलेले असतात, असे दिसून आलेले आहे. कार्बनाच्या बहुरूपांचे भौतिक गुणधर्म (उदा.घनता) निरनिराळे असले तरी सर्वांचे रासायनिक गुणधर्म मात्र एकच आहेत. कोणत्याही बहुरूपात हे मूलद्रव्य असले तरी ते जाळल्यावर त्यापासून कार्बन मोनॉक्साइड आणि कार्बन डाय-ऑक्साइड तयार होतात [→कार्बन डाय-ऑक्साइड; कार्बन मोनॉक्साइड].
कार्बनाच्या विद्युत् विन्यासात शेवटच्या कक्षेत चार इलेक्ट्रॉन असल्यामुळे, त्याचा अणू दूसऱ्या मूलद्रव्याच्या अणूपासून इलेक्ट्रॉन घेऊन किंवा देऊन, शेवटच्या कक्षेतील इलेक्ट्रॉनांचा आठ हा इष्टांक पूर्ण करू शकत नाही. कारण एक इलेक्ट्रॉन घेणे (किंवा देणे) जितके कठीण, त्यापेक्षा दोन इलेक्ट्रॉन घेणे जास्त कठीण आणि तीन हे त्याहीपेक्षा कठीण असते, याचे कारण येणाऱ्या इलेक्ट्रॉनांची संख्या जसजशी वाढते तसतसा वाढत्या ऋण विद्युत् भारामुळे त्यांना होणारा प्रतिकारही वाढतो. पण कार्बनाचे अणू दुसऱ्या मूलद्रव्यांच्या अणूंचे इलेक्ट्रॉन स्वतःच्या इलेक्ट्रॉनांसह समाईक ठेवून आठ हा इष्टांक पूर्ण करू शकतात व या रीतीने इतर मूलद्रव्यांशी संयोग पावू शकतात. दोन किंवा अधिक कार्बन अणूही अशाच रीतीने एकमेकांस साखळीसारखे किंवा वलयासारखे जोडले जाऊन अगणित संयुगे तयार होतात, हे कार्बनाचे वैशिष्ट्य होय. फक्त कार्बन व हायड्रोजन यांची बनलेली दहा लाखांहून अधिक संयुगे माहित आहेत. संश्लेषणाने (कृत्रिम रीत्या बनवून) त्यात सतत भर पडत आहे.
कार्बन हे मूलद्रव्य पाण्यात, विरल अम्लात, क्षारकात (आम्लाशी विक्रिया होऊन लवणे देणाऱ्या पदार्थात) आणि कार्बनी विद्रावकात (विरघळविणाऱ्या पदार्थात) विरघळत नाही. नायट्रिक अम्ल किंवा पोटॅशियम नायट्रेट यांसारख्या ऑक्सिडीकारकांची [→ऑक्सिडीभवन] विक्रिया होऊन उष्ण परिस्थितीत मिलिटिक अम्ल [C6(COOH)6] मिळते. हॅलोजनांपैकी फक्त प्ल्युओरिनाशी सरळ विक्रीया होऊन कार्बन टेट्राप्ल्युओरॉइड (CF4) मिळते. उच्च तापमानात कार्बनाची पुष्कळ धातूंशी विक्रिया होऊन कार्बाइडे मिळतात [→कार्बाइडे]. कार्बन क्षपणकारक [→क्षपण] पदार्थ आहे. हाच या मूलद्रव्याचा महत्त्वाचा गुण होय.
कार्बन डायसल्फाइड (CS2) हे त्याचे एक महत्त्वाचे अकार्बनी संयुग होय [→कार्बन डायसल्फाइड]. त्याची टेट्राहॅलाइडे उपलब्ध आहेत [→कार्बन टेट्राक्लोराइड].
हवेचा पुरवठा भरपूर असताना कार्बन जाळल्यास कार्बन डायऑक्साइड निर्माण होतो. हवेचा पुरवठा अपुरा असेल तर कार्बन मोनॉक्साइड बनतो. हे दोन्ही वायू औद्योगिक दृष्ट्या महत्त्वाचे आहेत. यांशिवाय कार्बन सब-ऑक्साइड या नावाचे त्याचे आणखी एक ऑक्साइड आहे. त्याचे सूत्र C3O2 असे आहे. मॅलॉनिक अम्लातून, फॉस्फरस पेंटॉक्साइडाने १४०°–१५०° से. तापमानास निर्वात अवस्थेत पाणी काढून टाकून ते मिळविता येते.
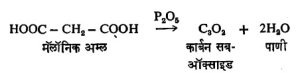
ते वायुरूप असून त्याला विशिष्ट वास येतो व त्यामुळे गुदमरल्यासारखे वाटते. या संयुगात दुसऱ्या दोन्हीही ऑक्साइडांच्या मानाने ऑक्सिजनाचे प्रमाण कमी आहे म्हणूनच त्याला सब-ऑक्साइड म्हणतात. त्याची रेणू रचना O =C = C = C = O अशी आहे.
किरणोत्सर्गी कार्बन (१४) व कालगणना : कार्बनाचा कार्बन (१४) हा समस्थानिक किरणोत्सर्गी असून वातावरणात नायट्रोजनावर विश्वकिरणांची (बाह्य अवकाशातून पृथ्वीवर येणाऱ्या अतिशय भेदक किरणांची) विक्रिया होऊन तयार होतो. वनस्पती व प्राणी जिवंत असताना त्यांच्या शरीरातील कार्बन (१२) व वातावरणातील कार्बन (१४) यांची देवघेव होत असून कार्बन (१४) चे प्रमाण अत्यल्प असले तरी निश्चित व स्थिर असते. मरणोत्तर कार्बनांची ही देवघेव थांबते व मृत शरीरातील कार्बन (१४) चे प्रमाण कमी कमी होत जाते. ५,७०० वर्षांनी ते मूळच्या प्रमाणाच्या निम्मे होते. या तत्त्वाचा उपयोग करून प्राचीन कालातील अवशेषांमधील कार्बन (१४) चे प्रमाण निश्चित करून प्राचीन कालातील अवशेषांमधील कार्बन (१४) चे प्रमाण निश्चित करून त्यावरून त्या अवशेषाचा काल ठरविण्याची एक पद्धती लिबी आणि त्यांचे सहकारी यांनी शोधून काढली आहे [→किरणोत्सर्गी कार्बन कालनिर्णय पद्धति; खडकांचे वय; पुरातत्त्वविद्या].
कार्बनाचे अस्तित्व सिद्ध करण्याची पद्धती : एखाद्या संयुगातील कार्बनाचे अस्तित्व दाखविण्यासाठी त्याचा थोडासा नमुना भुकटी रूपात घेऊन त्याच्या वजनाच्या साधारणपणे आठपट वजनाइतक्या क्युप्रिक ऑक्साइडामध्ये मिसळतात. हे मिश्रण परीक्षानळीत घेऊन तापवितात. परीक्षा नळीत तयार होणारा वायू वाकड्या नळीने चुन्याच्या निवळीत सोडतात. चुन्याची निवळी दुधी झाल्यास तो वायू कार्बन डाय-ऑक्साइड होय, म्हणून मूळ पदार्थात कार्बन आहे हे सिद्ध होते.
पहा : काजळी; कार्बनी रसायनशास्त्र; कोळसा, दगडी; कोळसा, लोणारी; ग्रॅफाइट; हिरा.
संदर्भ : Parkes, G. D., Ed. Mellor’s Modern Inorganic Chemistry, London, 1961.
शहा, ज. रा.