संयुजा : जेव्हा एक मूलद्रव्य दुसऱ्या मूलद्रव्यांशी संयोग पावते तेव्हा त्याच्या या शक्तीला संयुजा म्हणतात. ही शक्ती सामान्यत: अंकात मोजतात. या अंकाप्रमाणे संयुजा बंधांनीही दाखविता येते.
दुसऱ्या मूलद्रव्याशी तुलना केली असता हायड्रोजनाची संयोगशक्ती किमान आहे. म्हणून त्याची संयुजा एक धरतात. दुसऱ्या मूलद्रव्याची संयुजा त्याच्या अणूचा सामान्यत: किती हायड्रोजन अणूंबरोबर संयोग होतो, ते पाहून ठरवितात. उदा., हायड्रोफ्ल्युओरिक अम्ल (HF), पाणी (H2O), अमोनिया (NH3), मिथेन (CH4) या संयोगांचे परीक्षण केले असता हायड्रोजनाची संयुजा एक धरली तर, फ्ल्युओरिनाची संयुजा एक, ऑक्सिजनाची दोन, नायट्रोजनाची तीन तर कार्बनाची संयुजा चार आहे असे आढळते. कोणत्याही स्थायी (स्थिर) संयोगांचे सूत्र मांडताना त्यातील मूलद्रव्यांची संयुजा समतोल ठेवावी लागते. संयुजांना दिशा असतात असे मानण्यात येते. पाण्याच्या रेणूमधील प्रत्येक OH अंतर ९.५७ नॅनोमीटर (एक अब्जांश मीटर) आणि HOH बंधाचा कोन १०४° २७’ असतो.
सामान्यत: प्रत्येक मूलद्रव्याची एक ठराविक संयुजा असते पण काही मूलद्रव्यांच्या दोन किंवा अधिक संयुजाही आढळतात. उदा., लोखंडाची संयुजा FeO मध्ये दोन आहे, Fe2O3 मध्ये तीन आहे तांब्याची संयुजा CuO मध्ये दोन असते, तर Cu2O मध्ये एक आहे. असे असले तरी १८६९ मध्ये ⇨ दमित्री इव्हानव्ह्यिच मेंडेलेव्ह यांनी आवर्त सारणी प्रसिद्ध करून मूल-द्रव्यांच्या गुणधर्मावरून त्यांच्या भिन्नभिन्न संयुजांपैकी स्थिर संयुजा कोणत्या हे निश्चितपणे सांगितले आहे.
रेणूतील मूलद्रव्यांच्या संयुजा ठरविताना रेणवीय संरचना सूत्रांची माहिती असणे आवश्यक असते. उदा., H2O (पाणी) या सूत्रावरून ऑक्सिजनाची संयुजा दोन धरली, तर H2O2 मध्ये (हायड्रोजन पेरॉक्साइडामध्ये) ती एक आहे असे वाटते पण त्याचे संरचना सूत्र H—O—O—H असे प्रयोगाने सिद्ध झाले आहे, म्हणून त्यांची ही संयुजा दोनच होय. तसेच ॲसिटिलीन C2H2 मधील कार्बनाच्या संयुजेची चार ही किंमत ⇨ फोन श्ट्राडोनिट्स फ्रिड्रिख आउगुस्ट केकूले यांनी त्याची
अशी रचना मांडून कायम ठेवली; पण आता त्याच्या संरचना सूत्रात मुक्तबंधाऐवजी त्रिबंध आहे हे माहीत झाल्याने ते H—CΞC—H असे लिहितात. संयुजा म्हणजे अणु-संख्या न समजता अणुबंध असे म्हणण्याची पद्धत आहे. नायट्रोजनाचा रेणू NΞN असा लिहितात. नायट्रोजन किंवा ॲसिटिलीन यामधील संयुजांना सहसंयुजा किंवा सहबंध म्हणतात याच्या उलट मिठातील सोडियमाच्या संयुजेला आयनी संयुजा अथवा इलेक्ट्रॉनीय बंध म्हणतात. सामान्यत: हे जरी खरे असले, तरी कार्बोनिल, कार्बाइड व नायट्राइड अशासारख्या अणुबंधांमधील संयुजा स्पष्टपणे सांगणे कठीण आहे. ⇨ लायनस कार्ल पॉलिंग यांच्या भाषेत सांगायचे तर ‘ ज्या आंतर-आणवीय शक्तीमुळे दोन किंवा अधिक अणू स्वतंत्र किंवा एकत्रित स्थिरतेने राहतात, तिला संयुजा किंवा रासायनिक बंध म्हणावे.’
द्विमूलक उपपत्ती : संशोधकांनी परिस्थितीप्रमाणे संयुजेच्या निरनिराळ्या उपपत्ती सांगितलेल्या आढळून येतात. १८०७ मध्ये ⇨ सर हंफी डेव्ही यांनी दोन विरूद्ध कणांच्या परस्पर आकर्षणामुळे संयुग बनते, असे प्रतिपादिले तर १८१२ मध्ये ⇨ यन्स याकॉप बर्झीलियस यांनी रेणूंमधील काही अणूंमध्ये धन विद्युत् भार जास्त असतो, तर काहींमध्ये ऋण विद्युत् भार जास्त असतो आणि रेणूमधील धन व ऋण विद्युत् भार एकमेकांना आकर्षित करीत असतात म्हणून रेणू स्थिर असतो, असे प्रतिपादिले. अशा प्रकारे संयुजांची द्विमूलक उपपत्ती पुढे आली पण १८३९ मध्ये ⇨ झां बातिस्त आंद्रे दयूमा यांनी असे सिद्ध केले की, कार्बनी संयुगात ऋण विद्युत् भारित क्लोरीन अणू हा धन विद्युत् भारित हायड्रोजन अणूच्या जागी, रेणूमध्ये जोडता येतो. अशा प्रकारच्या कार्बनी संयुगांच्या रासायनिक विकियांमुळे द्विमूलक उपपत्ती मागे पडली.
⇨ सर एडवर्ड फँकलंड यांनी १८५२ मध्ये अणूला एकमात्र व निर्णायक संयोजक शक्ती असते व त्यावरून तो अन्य किती अणूंशी संयोग पावू शकतो हे ठरविता येते असे सांगितले. त्यांनी त्या शक्तीला ॲटॉमिसिटी (अणुता) हा शब्द वापरला. त्यालाच १८६५ मध्ये ⇨ आउगुस्ट व्हिल्हेल्म फोन होफमान यांनी कंबाइनिंग कपॅसिटी (संयोग शक्ती), तर १८६८ मध्ये विचेलहाऊस यांनी व्हॅलन्स (संयुजा) हा शब्द वापरला.
रचना उपपत्ती : संयुजेची रचनात्मक मांडणी केकूले व कूपर यांनी १८५८ साली कार्बन रेणूच्या संदर्भात मांडली. कार्बनाच्या चार संयुजा असतात आणि त्यांचे चार बंध अणू एकमेकांना जोडू शकतात, असे त्यांनी प्रतिपादिले. ⇨ स्तानीझ्लाओ कान्नीद्झारो यांनी ऑक्सिजनाचा अणुभार १६ धरून अणुभारांतील चुका दुरूस्त केल्या होत्या. त्या लक्षात घेऊन १८६६ मध्ये केकूले यांनी बेंझिनाचे प्रथम स्थिर व नंतर गतिमान संरचना सूत्र प्रतिपादिले.
ताण सिद्धांत : मेंडेलेव्ह यांची आवर्त सारणी प्रसिद्ध झाल्यावर लवकरच ⇨ याकोबस हेंड्नीकस व्हांट-हाफ यांनी १८७४ मध्ये व जे. ए. ल बेल यांनी १८७२ मध्ये कार्बनाच्या अणूची त्रिमितीय संरचना व तिच्यातील प्रत्येक कडेवरील संयुजांच्या वाटणीवर भर दिला. लगेच १८८५ मध्ये ⇨ आडोल्फ फोन बेयर यांनी ताण सिद्धांत मांडून असे म्हटले की, काही संयुजा बंधांत ताण निर्माण होतो व अशा संयुगांना हा त्रिमितीचा नियम लागू पडेलच असे नाही.
जटिल संयुग : ⇨ आल्फेट व्हेर्नर यांनी १८९२ मध्ये जटिल संयुगांची सहसंबद्ध बंधाची उपपत्ती मांडली. CoCl3.6NH3 या संयुगाचे नेहमीच्या संयुजा पद्धतीने ‘ संरचना सूत्र ’ मांडता येत नाही. म्हणून त्यांनी सहसंबद्ध बंधाची कल्पना पुढे आणली. कोबाल्टासारख्या (Co) काही अणूंमध्ये आयनी संयुजा पूर्ण वापरल्यावरही, आयनी नसलेल्या काही संयुजा शिल्ल्क असतात. सहसंबद्ध संयुग बनण्याचे हे कारण असावे, असे त्यांचे म्हणणे होते. काही मूलद्रव्यांच्या बाबतीत त्यांनी अशा सहसंबद्ध बंधांची संख्याही ठरविली होती.
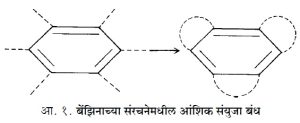
आंशिक संयुजा :⇨ योहानेस थील यांनी १८९९ मध्ये आंशिक संयुजा उपपत्ती मांडली. त्यांच्या मताप्रमाणे दोन बंध अगदी सारखे नसतात.
म्हणजे एखादया बंधात दुसऱ्यापेक्षा संयुजा शक्ती जास्त असते म्हणून संयुजा पूर्णपणे वापरली जात नाही. शिलकी संयुजेला त्यांनी आंशिक (अंश) संयुजा असे नाव दिले. अंश संयुजेने केकूले यांचे बेंझीन सूत्र बेंझिनाच्या गुणधर्माशी जुळते आहे, हे दाखविण्याचा त्यांनी प्रयत्न केला. त्यांच्या उपपत्तीप्रमाणे बेंझिनाचे संरचना सूत्र आकृती १ मध्ये दाखविल्याप्रमाणे आहे. (ठिपक्यांनी दाखविलेल्या रेषा हे अंश संयुजेचे बंध होत)
इलेक्ट्रॉनीय उपपत्ती : डब्ल्यू. सी. राँटगेन यांचे १८९५ मधील क्ष-किरण अनुसंधान, त्यानंतर आंत्वान आंरी बेकेल यांचे किरणोत्सर्गी, जे. जे. टॉमसन यांचे इलेक्ट्रॉनीय, माक्स प्लांक यांचा १९०० सालातील कांतिकारक पुंज सिद्धांत, १९०५ मधील ॲल्बर्ट आइन्स्टाइन यांचा सापेक्षता सिद्धांत, १९१० मधील फेडेरिक सॉडी यांनी प्रतिपादिलेले साध्या मूलद्रव्यातही असणारे वेगवेगळे समस्थानिक (अणुकमांक तोच पण भिन्न अणुभार असलेले त्याच मूलद्रव्याचे प्रकार) अणू व त्याची टॉमसन यांनी केलेली सिद्धता, तसेच १९११ मधील अर्नेस्ट रदरफर्ड यांनी सिद्ध केलेले अणुकेंद्रात धन व ऋण विद्युत् भारित कणांचे एकत्रित अस्तित्व, तसेच एच्. जी. मोझली (मॉस्ली) यांचे अणुकमांक व वस्तुमान यांचे परस्परसंबंधांविषयी संशोधन व शेवटी १९३२ मध्ये न्यूट्रॉन कणांचे अस्तित्व या सर्व गोष्टींमुळे संयुजेच्या इलेक्ट्रॉनीय उपपत्तीत सारखा बदल होत गेला.
गिल्बर्ट न्यूटन ल्यूइस व डब्ल्यू. कोसेल यांनी १९१६ मध्ये अणूमधील इलेक्ट्रॉन व संयुजा यांचे अन्योन्य संबंध दाखवून संयुजाविषयक उपपत्ती मांडली. कोसेल यांच्या मते त्यांचे इलेक्ट्रॉन अणुकेंद्राभोवती फिरतात, तर ल्यूइस यांच्या मते ते घनाकृतीच्या कोपऱ्यावर स्थिर असतात तरी पण दोघांची मांडणी अक्रिय वायूंच्या अणुरचनेवर आधारलेली आहे. त्या रचनेत हीलियम वगळून इतर वायूंच्या शेवटच्या कवचात आठ इलेक्ट्रॉन असतात व अणुरचना अशा स्थितीत स्थायी असते असे समजण्यात येते. उदा., हीलियम २ निऑन २,८ आर्गॉन २,८,८ किप्टॉन २,८,१८,८ अशी अक्रिय वायूंची अणुकवचे दाखवितात [→ अक्रिय वायु]. जेव्हा मूलद्रव्यांच्या शेवटच्या कवचात आठ इलेक्ट्रॉनांपेक्षा कमी किंवा जास्त इलेक्ट्रॉन असतात, तेव्हा इलेक्ट्रॉन कणांची देवाण-घेवाण करून अणू स्थायी होतात. उदा., फ्ल्युओरिनाची अणुरचना २,७ असून शेवटच्या कवचात ७ इलेक्ट्रॉन आहेत तर सोडियमाची अणुरचना २,८,१ अशी असून शेवटच्या कवचात १ इलेक्ट्रॉन आहे. या दोघांपासून बनलेल्या सोडियम फ्ल्युओराइड संयुगामधील सोडि-यमाच्या शेवटच्या कवचातील १ इलेक्ट्रॉन, फ्ल्युओरिनाच्या शेवटच्या कवचात जातो. अशा रीतीने दोन्ही मूलद्रव्यांच्या शेवटच्या कवचात आठ-आठ इलेक्ट्रॉन होऊन प्रत्येक अणू स्थायी होतो. या उपपत्तीने आवर्त सारणीतील अक्रिय वायूंच्या जवळ असलेल्या मूलद्रव्यांच्या संयुगांचे स्पष्टीकरण करता येत असले, तरी इतरांचे सहज होत नाही.
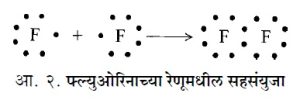
यानंतर अर्विंग लँगम्यूर यांनी कधीकधी एक इलेक्ट्रॉन दोन अणुकेंद्रा-भोवती फिरू शकतो अशी उपपत्ती मांडली. उदा., फ्ल्युओरिनाचा रेणू.
या फ्ल्युओरिनाच्या रेणूमधील शेवटच्या कवचात दोन इलेक्ट्रॉन फ्ल्युओरिनाच्या दोन्ही अणूंना सामायिक आहेत. म्हणजे ते दोन्ही अणूंच्या केंद्राभोवती फिरतात. याला लँगम्यूर ‘ सहसंयुजा ’ म्हणतात. ‘ अणू , रेणू व आयन (विद्युत् भारित अणू , रेणू वा अणुगट) यांचे ऑक्सिडीभवन म्हणजे इलेक्ट्रॉन गमाविणे आणि क्षपण म्हणजे त्यात अधिक इलेक्ट्रॉन सामाविणे ’ असे ल्यूइस यांनी प्रतिपादिले आहे. संयुजेची इलेक्ट्रॉनीय उपपत्ती समजण्यास प्रत्येक अणूची संपूर्ण इलेक्ट्रॉनीय माहिती असणे आवश्यक असते [→ अणु व आणवीय संरचना]. अणूच्या प्रत्येक कवचात निरनिराळे इलेक्ट्रॉन असतात पण फक्त शेवटच्या कवचातील इलेक्ट्रॉन हे संयुजा- इलेक्ट्रॉन म्हणून ओळखले जातात.
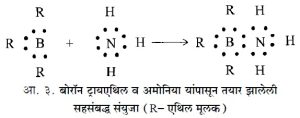
नेव्हिल व्हिन्सेंट सिज्विक यांनी १९२७ साली भौतिकशास्त्रासाठी लिहिलेल्या पुस्तकात एका अणूमधील किंवा मूलकामधील इलेक्ट्रॉनांची जोडी दुसऱ्या अणूंत किंवा मूलकात विशिष्ट परिस्थितीत विभागणे कसे शक्य आहे, हे दाखविले. या प्रकारच्या संयुजांना सहसंबद्ध संयुजा म्हणतात. उदा., बोरॉन ट्रायएथिल व अमोनिया.
अमोनियामधील नायट्रोजनाचे दोन्ही इलेक्ट्रॉन संयुग तयार होताना दोन्ही अणूंना सज्ञमायिक असतात. पोटॅशियम फेरोसायनाइड K4 [ Fe(CN)6] किंवा कोबाल्टिक अमाइन [ Co (NH3)6] Cl3 यांसारख्या जटिल संयुगातील NH3, CN गट यात इलेक्ट्रॉनांची एकेक जोडी क्रियाशील नसते. Fe व Co यांच्या सामान्य संयुजा उपयोगात येऊनही जी संयुजा शिल्ल्क राहते, तिच्याशी या जोडया सहसंबद्ध बंधाने बांधल्या जातात.
पुंज सिद्धांत : वरील इलेक्ट्रॉनीय संयुजेची उपपत्ती काही वस्तुस्थितींचे स्पष्टीकरण करण्यास अपुरी पडते. सहसंयुजा का आढळतात ? बेंझिनाच्या रेणूमधील सहा C—C बंध भौतिकीय व रासायनिक दृष्टया समान का ? हे अदयाप प्रयोगावरून सिद्ध केले गेले नाही. C—C मधील बंधापेक्षा H—H मधील बंध जास्त बलवान व स्थिर का ? CO2 हा एकघाती रेणू आणि H2O हा नैकघाती रेणू का असतो ? तसेच सहसंयुजेमुळे रेणूमधील इलेक्ट्रॉन उभय-रेणूत असल्यामुळे स्थायी असतात असे जरी मानले, तरी रेणु-स्थायिकतेचा उगम कोठे व कशात असतो ? त्याचप्रमाणे ती उपपत्ती व्यापक व परिमाणात्मक नाही. रेणवीय गुणधर्मांचे परस्परसंबंध व भविष्य तिने सांगता येत नाही.
या उणिवांमुळे संयुजेचा पुंज सिद्धांत एर्व्हिन श्रोडिंजर यांनी १९२० मध्ये प्रसिद्ध केलेल्या सिद्धांतावर आधारलेला आहे. माक्स प्लांक व नील्स बोर यांच्या प्रयोगांवरून इलेक्ट्रॉन व इतर कण कधीकधी तरंगाप्रमाणे वागतात असे दिसते. वास्तविक कवचामध्ये फिरणारा इलेक्ट्रॉन कालांतराने शक्तिपात होऊन प्रोटॉनांमध्ये जाऊन पडावा पण पुंज सिद्धांताने त्याचे का पतन होत नाही हे सांगता येते, ते असे की अणुकेंद्राभोवतीच्या अणुक्षेत्रातून तो बाहेर पडलेला असतो.[→ पुंज सिद्धांत].
पुंज सिद्धांत, आवर्त सारणी व अणूंचे इलेक्ट्रॉन पूर्वीप्रमाणे असले, तरी पूर्वी इलेक्ट्रॉनीय परिभ्रमण बोर कक्षेने ओळखीत, ते आता इलेक्ट्रॉनाच्या कक्षकाने (परिकक्षाने, ऑर्बिटलने) ओळखतात. या गोष्टीने इलेक्ट्रॉनांचा मार्ग व अवकाशातील निरनिराळ्या ठिकाणी असलेला इलेक्ट्रॉनीय तरंगांचा परमप्रसर दाखविला जातो. इलेक्ट्रॉन फक्त दोनच मार्गांनी गरगर फिरतात असे मानले जाते. तेव्हा आवर्त सारणीविषयीचा सामान्य नियम असा की, ‘ तेच परिभ्रमण व तेच परिवलन असलेले दोन इलेक्ट्रॉन एका अणूत नसतात.’
रासायनिक बंधात नेहमी गतिज व स्थितिज ऊर्जा बदलत असतात. विशेष अनुकूलता असेल, तर इलेक्ट्रॉनयुग्म एकाच अणूमध्ये फिरण्याऐवजी दोन अणूंमध्ये सामायिक रीतीने फिरण्याची शक्यता अधिक असते. आणवीय आकर्षणाच्या दृष्टीने तितकेच अंतर असलेल्या एका अणुकेंद्रातील क्षेत्रापेक्षा, दोन अणुकेंद्रांतील क्षेत्र स्थितिज ऊर्जेला जास्त अनुकूल असते. प्रतिबंधित क्षेत्रात फिरणाऱ्या अणूत गतिज ऊर्जेला अनुकूल परिस्थिती नसते पण बंध तयार झाला की, स्थितिज ऊर्जा वरचढ होते. साधा सहसंयुजी बंध, हा दोन निरनिराळ्या अणूंच्या कक्षांचा होतो असे म्हणण्यापेक्षा दोन इलेक्ट्रॉन एकाच रेणवीय कक्षेत आहेत असे म्हणणे जास्त सयुक्तिक होईल, कारण त्या इलेक्ट्रॉनांना परस्पर विरूद्ध परिवलनांमुळे अपवर्तनी तत्त्व[सारख्याच प्रकारचे दोन फेर्मियॉन (येथे इलेक्ट्रॉन) एकाच वेळी त्याच पुंजस्थितीत असू शकत नाहीत हे तत्त्व]लागू पडते.
पुंज सिद्धांताने रेणूची स्थिरता व इतर गुणधर्म परिमाणात्मक रीतीने स्पष्ट करणे शक्य झाले आहे. उदा., नीच ऊर्जांचे आणवीय कक्षक असलेले दोन अणू जवळ येऊन त्यांनी एकमेकांना व्यापले आणि त्यांतील दोन इलेक्ट्रॉन उपलब्ध असले, तर ऊर्जा उत्पन्न होऊन बंध तयार होण्यासाठी अनुकूल परिस्थिती असते. जुना संयुजांचा मूलभूत नियम तो हाच होय. ‘ अणूची संयुजा म्हणजे इलेक्ट्रॉनयुग्मांची संख्या होय.’
आणवीय कक्षकांचे एकमेकांना व्यापणे जितके जास्त शक्य असते, तितकी बंधांची शक्ती जास्त असते. रेणवीय आकारमान ठरविण्यासाठी ही परिस्थिती उपयोगी पडते. ऊर्जांची तुलना करता येईल अशा दोन किंवा अधिक कक्षकांची (उदा., 2s व 2p) युती होऊन त्या क्षेत्रात एका दिशेने जाणारे कक्षक तयार होतात. अशा कक्षकांमुळे ठराविक दिशा असणारे बंध उत्पन्न होतात. उदा., कार्बन अणूमधील 2s व 2p उपकवचांतील इलेक्ट्रॉन स्थितिज इलेक्ट्रॉन होत. 2s मधील दोन इलेक्ट्रॉन युग्मित असल्यामुळे त्यांतील एक, 2p कक्षकातील रिकाम्या असलेल्या जागी चार बंधांची पूर्तता होण्यास जाणे आवश्यक आहे. यामुळेच कार्बनामधील चार बंधांना निरनिराळ्या दिशा असणे शक्य होते.
तरंगयामिकी उपपत्ती : संयुजेच्या तरंगयामिकी उपपत्तीत संयुजा व रासायनिक संयोग यांचा परिमाणात्मकाने संबंध दाखविता येतो. हाइटलर – लंडन व हुंड – म्यूलिकेन यांनी एकाच तत्त्वावर पण प्रत्येकाने निरनिराळ्या पद्धतीच्या उपपत्ती मांडलेल्या आहेत व[→ पुंज रसायनशास्त्र].
हाइटलर – लंडन उपपत्तीत रासायनिक विक्रिया चालू असताना, अणूपासून येणारे विशिष्ट इलेक्ट्रॉन व इतर इलेक्ट्रॉन यांत फरक आहे असे मानून विवेचन केले आहे. हुंड – म्यूलिकेन उपपत्तीत संपूर्ण रेणू एकच आहे असे मानून, सर्व इलेक्ट्रॉनांचा साकल्याने विचार केलेला आहे, तसेच तीत इलेक्ट्रॉनांच्या एकमेकांवर व धन अणुकेंद्रांवर होणाऱ्या परिणामांचे विवेचन केलेले आहे. या दोन पद्धतींत फरक असला तरी अंतिम निर्णयात फरक पडत नाही. गणन पद्धतीने तरंग समीकरणांचे उत्तर काढणे अवघड आहे म्हणून हायड्रोजन रेणू व हायड्रोजन आयन यांसारख्या फक्त सोप्या विक्रियांची उदाहरणे सोडविली आहेत.
हाइटलर-लंडन उपपत्तीप्रमाणे अणूमधील शेवटच्या कवचातील इलेक्ट्रॉनांच्या अजोड ध्रूवणामुळे संयुजा उत्पन्न होते. ज्याचा ध्रूवण – पुंजांक + किंवा – असून ज्याला जोडीदार म्हणून विरूद्ध ध्रूवणाचा दुसरा इलेक्ट्रॉन अणूत नसतो, त्याला अजोड ध्रूवणाचा इलेक्ट्रॉन म्हणतात. एकमेकांविरूद्ध ध्रूवण असलेली इलेक्ट्रॉनांची जोडी अणूत असते, तेव्हा ते रासायनिक संयोगासाठी उपलब्ध नसतात. अजोड इलेक्ट्रॉनाची विरूद्ध ध्रूवण असलेल्या इलेक्ट्रॉनाबरोबर युती करण्याच्या व इलेक्ट्रॉन-ध्रूवण समतोल साधण्याचा प्रवृत्तीमुळे संयुजा व रासायनिक संयोग निर्माण होतात. या गोष्टीवरून ल्यूइस यांची सहसंयुजा असलेली इलेक्ट्रॉन जोडी म्हणजेच दोन विरूद्घ ध्रूवण असलेल्या इलेक्ट्रॉनांची जोडी अशी कल्पना येते आणि त्यांच्या उपपत्तीचे स्पष्टीकरण मिळते.
हाइटलर – लंडन उपपत्ती इलेक्ट्रॉनाच्या जोडबंधावर म्हणजेच सहसंयुजे-वर अवलंबून असते म्हणूनच तिला एकध्रूवीय पद्धती म्हणतात. हुंड – म्यूलिकेन ही रेणवीय कक्षक पद्धती आहे. यातील तरंग – समीकरणात एकध्रूवीय पदे असून आणखी आयनी बंधांची अनुरूप पदे असतात. रेणूंच्या समीकरणात जेव्हा एकध्रूवीय पदांचे मूल्य आयनी पदांपेक्षा बरेच जास्त असते, तेव्हा ते बंध प्रामुख्याने सहसंयुजी बंध असतात. उलट पक्षी जेव्हा ते आयनी पदांचे एकध्रूवीय पदावर प्रभुत्व असते, तेव्हा ते इलेक्ट्रॉनीय संयुजा बंध असतात. या दोहोंमधील बंध मिश्रपद्धतीचे असतात. मिश्रबंध असलेल्या संयुगात कायमचे द्विध्रूवीय रेणू असतात. या दोन उपपत्तींमधील आणखी एक फरक हा आहे की, एकध्रूवीय पद्धतीत एकमेकांविरूद्ध ध्रूवणाच्या इलेक्ट्रॉन जोडीवर विशेष भर असतो, तर रेणवीय कक्षक पद्धतीत बंधीय, प्रतिबंधीय व अबंधीय असे रेणूमधील इलेक्ट्रॉनांचे वर्गीकरण केलेले आहे. रेणवीय स्थिरता आणणाऱ्या इलेक्ट्रॉनांना ‘ बंधीय ’ व अस्थिरता आणणाऱ्यांना ‘ प्रतिबंधीय ’ आणि स्थिरता आणण्यात उदासीन असणाऱ्यांना ‘ अबंधीय ’ असे म्हणतात. रेणूमध्ये बंधीय इलेक्ट्रॉन अधिक असतील, तर तो रेणू स्थिर असतो. उलट पक्षी प्रतिबंधीय इलेक्ट्रॉन जास्त असतात तेव्हा तो अस्थिर असतो.
अनुस्पंदन : तरंगयामिकी उपपत्तीची पुढची पायरी म्हणजेच अनुस्पंदन किंवा ऊर्जाविनिमय होय. याच्या स्पष्टीकरणासाठी दोन हायड्रोजन अणूंपासून रेणू कसा उत्पन्न होतो हे पाहू. हायड्रोजनाच्या प्रत्येक अणूमध्ये एक इलेक्ट्रॉन असतो. प्रत्येक अणूचा इलेक्ट्रॉन त्याच केंद्राशी संलग्न असतो असे प्रथमदर्शनी समजतात परंतु इलेक्ट्रॉन आपली कक्षा बदलू शकतात असे गृहीत धरले, तर त्याची रचना (अणू १ + इलेक्ट्रॉन१) व (अणू २ + इलेक्ट्रॉन२) अशी एकच न राहता म्हणजे (अणू १ + इलेक्ट्रॉन२) व (अणू २ + इलेक्ट्रॉन१) अशी बदलू शकेल आणि या रचना स्थिर न राहता सारख्या बदलणाऱ्या असू शकतील. तरंगयामिकी असे दर्शविते की, जेव्हा इलेक्ट्रॉनविनिमय होतो तेव्हा अशा अनुस्पंदित रचनेची ऊर्जा ही विनिमय नसलेल्या रचनेपेक्षा कमी असते, म्हणून अनुस्पंदन किंवा ऊर्जाविनिमय यामुळे रचनेस स्थिरता प्राप्त होते. [→ पुंज रसायनशास्त्र].
संयुजा व आवर्त सारणी : मेंडेलेव्ह यांनी १८६९ मध्ये आवर्त सारणी प्रसिद्घ केली. यामुळे रसायनशास्त्रात अणुकमांकाप्रमाणे मूलद्रव्यांची सुसूत्र मांडणी केली गेली व त्यांच्या श्रेणी तयार झाल्या. या श्रेणींतील मूलद्रव्यांच्या संयुजा नियमितपणे बदलतात व त्यांची गुणधर्मांनुसार पुनरावृत्ती होते. एखादया मूलद्रव्याला एकापेक्षा जास्त संयुजा असल्या तरी त्यांपैकी एक संयुजा आवर्त सारणीत गुणांप्रमाणे व्यवस्थित बसते. विशेषत: १८९४ मध्ये जॉन विल्यम स्ट्रट रॅली व सर विल्यम रॅम्झी या दोघांनी निष्क्रिय वायूंचे संशोधन केल्यानंतर, त्या वायूंच्या अक्रिय गुणधर्मांवरूनच आवर्त सारणी पूर्ण केली गेली. त्यांनी अक्रिय वायूंना शून्य संयुजा दिली. त्यानंतर आवर्त सारणीतील पुष्कळ रिकाम्या जागा नव्या मूलद्रव्यांच्या संशोधनाने पूर्ण झाल्यावर १९२३ मध्ये हाफ्नियम, १९२५ मध्ये ऱ्हीनियम व १९४० नंतर कृत्रिम युरेनियमोत्तर मूलद्रव्यांच्या शोधाने सारणीतील रिकाम्या जागांपेक्षा जास्त मूलद्रव्यांचा शोध लागला.[→ आवर्त सारणी].
इ. स. १९३० पासून संयुजा अनुसंधानात सारखी भर पडत आहे आणि रसायनशास्त्रातील समस्या उलगडणे सुकर होत आहे. भौतिकीत उपयोगात आणलेली परिभाषा आता रसायनशास्त्रात येत आहे. नवे पदार्थ व नव्या प्रकारचे बंध आढळत आहेत. उदा., फेरोसीन (१९५१ मध्ये पहिली ‘ रेणवीय दामटी ’ म्हणजेच सँडविच) रेणूंच्या भौतिकीय पद्धतीने केलेल्या सखोल अभ्यासामुळे ‘ लोहचुंबकीय अनुस्पंदना ’ सारखी नवीन तंत्रे उपयोगात येत आहेत. १९६० पासून अंकीय संगणकांचा उपयोग करून संयुजाविषयक कूट प्रश्न सोडविण्याचा प्रयत्न होत आहे.
पाहा : घन अवस्था रसायनशास्त्र; त्रिमितीय रसायनशास्त्र; पुंज रसायनशास्त्र; मूलद्रव्ये; रासायनिक संरचना; रेणवीय भौतिकी.
संदर्भ : 1. Gray, H. Electrons and Chemical Bonding, 1964.
2. Klein, D. J. Trinajstic, N., Eds., Valence Bond Theory and Chemical Structure, 1990.
3. O’Dwyer, M. F. Kent, J. E. Brown, R. D. Valency, 1989.
4. Pauling, L. The Nature of the Chemical Bond and the Structure of Molecules and Crystals, 1960.
कारेकर, न. वि.