समतोलावस्था आकृत्या : घन, द्रव अथवा वायू रूपातील एक वा अधिक पदार्थांच्या मिश्रणावर तापमान, दाब,विद्राव्यता (विरघळ-ण्याची क्षमता) यांपैकी एका किंवा अधिक गोष्टींचा स्थिर स्वरूपी परिणाम दाखविणाऱ्या आलेखांना ‘ समतोलावस्था आकृत्या ’ असे म्हणतात. या आकृत्यांच्या अनुरोधाने बनविलेल्या पदार्थांची परीक्षा क्ष-किरण विवर्तन, शीतलन वक, क्ष-किरण फोटोइलेक्ट्नॉन वर्णपटलेखन, इलेक्ट्नॉन सूक्ष्मदर्शक, अगर इलेक्ट्नॉन वर्णपटलेखन व इलेक्ट्नॉन प्रोब सूक्ष्मविश्लेषण यांच्या साहाय्याने करता येते. तथापि, प्रकियेतील शुद्ध गतिकी व दीर्घकाळ वापराने घडणारा ओस्टव्हाल्ट पक्वन परिणाम या आकृत्यांवरून समजू शकत नसल्याने त्यांचा वापर करताना सावधानता बाळगावी लागते.
प्रयोगशाळेमध्ये ऊर्ध्वपातनाने अथवा स्फटिकीकरणाने मिश्रणातून पदार्थ वेगळे करताना काच, मिश्रधातू , हरतृहेचे पोलाद, उच्च् तापमानास टिकणाऱ्या वेगवेगळ्या मातीच्या विटा, विद्युत् निरोधक पदार्थ इत्यादींचे आणि भूकवचातील व चंद्रावरील वा अशनींतील खडकांचे विश्र्लेषण करण्यासाठी समतोलावस्था आकृत्यांचा फार महत्त्वाचा सहभाग असतो.
एकोणिसाव्या शतकात ⇨ऊष्मागतिकी चा उदय झाल्यानंतर व विशेषत: १८७६ मध्ये जोसिआ विलर्ड गिब्ज यांनी ⇨प्रावस्था नियम सूत्ररूपाने सिद्घ केल्यानंतर अनेक धातु-धातू , धातु-अधातू व संयुगे यांच्या समतोलावस्था आकृत्या प्रयोगांव्दारे मांडल्या जाऊ लागल्या व पोलादा- सारख्या मिश्रधातूंसाठी उष्णता संस्करण करून गुणवर्धनासाठी त्यांचा उपयोग केलेला आढळतो. त्यांव्दारे पदार्थांचे ⇨घन विद्राव, आंतरधातवीय संयुग यांसंबंधी माहिती मिळते. मिश्रधातूंचे द्वि-अंगी, त्रि-अंगी अथवा बहुअंगी (जटिल) असे वर्गीकरण करता येते.
अ आणि ब या काल्पनिक धातूंचा ( व्दिअंगी ) मिश्रधातू विचारात घ्या. अ आणि ब यांच्यांत विविध प्रकारे संयोग होऊ शकेल. ब हा अ मध्ये विरघळून त्यांचा घन विद्राव तयार होऊ शकेल. साखर पाण्यात जशी विरघळते व विद्राव बनतो, तसाच मिश्रधातूंचा विद्राव घन अवस्थेत तयार होऊ शकतो. अ आणि ब यांच्यात आंतरधातवीय संयुग तयार होऊ शकेल तसेच एखादया मिश्रधातूमध्ये घन विद्राव व संयुग यांचे मिश्रण असू शकेल. घन विद्राव, संयुग इ. स्वरूपांत मिश्रधातूच्या प्रावस्था असतात. मिश्रधातू ही एकापेक्षा अधिक धातूंची किंवा प्रावस्थांची मिळून बनलेली असते. मिश्रधातूच्या संघटनाचा अभ्यास म्हणजेच या प्रावस्थांची माहिती होय.
मिश्रधातूचे संघटन व तिच्यातील प्रावस्था या मुख्यत्वेकरून दोन गोष्टींवर अवलंबून असतात : (१) धातु-घटकांचे प्रमाण वा संघटन आणि (२) मिश्रधातूचे तापमान. द्विअंगी मिश्रधातूंच्या बाबतीत संघटन व तापमान या अक्षांच्या साहाय्याने मिश्रधातूंचे स्थिर संघटन आलेखाच्या ( आकृतीच्या ) स्वरूपात मांडता येते. या आलेखास समतोलावस्था आकृत्या ( संतुलन – आलेख ) असे म्हणतात. समतोलावस्था आकृती म्हणजे मिश्र-धातूच्या स्थिर संघटनाचे संयुग व तापमान या अक्षांवर केलेले चित्रण होय. समतोलावस्था आकृतीचे काही महत्त्वाचे प्रकार पुढीलप्रमाणे सांगता येतात.
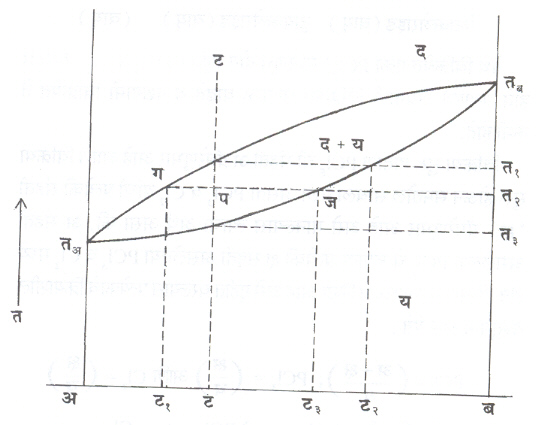
घन विद्राव : (आ.१). अ आणि ब या धातू वितळबिंदूपेक्षा अधिक तापमानास नेल्या असता द्रव अवस्थेत व थंड करताना घन अवस्थेत विरघळत असतील, तर या तृहेची आकृती तयार होऊ शकते.
आ. १ प्रमाणे अ आणि ब यांचा ‘ य ’ हा घन विद्राव तयार होतो. तअ व तब हे बिंदू शुद्ध अ व शुद्ध ब यांचे वितळबिंदू दाखतावित. अशी समतोलावस्था आकृती तीन क्षेत्रे दाखविते : द्रव ( द ) : द्रव विद्राव अधिक घन विद्राव ( द + य ) आणि घन विद्राव ( य ). येथे य मध्ये ब चे प्रमाण ०% ते १००% पर्यंत कोणतेही असू शकते.
‘ ट ’ या संघटनाची मिश्रधातू द्रवावस्थेपासून सावकाश थंड केली, तर तिच्यात होणारे बदल आकृतीच्या साहाय्याने सांगता येतील. टट या पृथक् रेषेप्रमाणे त१ या तापमानापर्यंत ही मिश्रधातू द्रवावस्थेत राहते. त१ या
तापमानापासून घनीभवनापासून घनीभवनास सुरूवात होते आणि प्रथमतयार होणारे ‘ य ’ घन स्फटिक त२ या संघटनाचे असतात. त१ पासून त३ पर्यंत घनीभवन चालू राहते व यादरम्यान घन स्फटिक व द्रव विद्राव यांचे
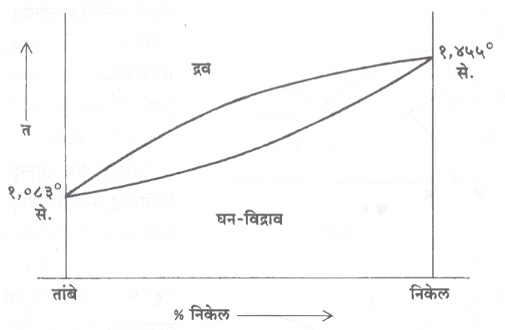
संघटन व प्रमाण बदलत जाते. उदा., त२ या तापमानास घन स्फटिक ट३ या संघटनाचे असतात व उरलेला द्रव विद्राव ट१ या संघटनाचा असतो. या तापमानास घन विद्राव व द्रव विद्राव या प्रावस्थांचे भार या प्रमाणात असतात. त१ पासून त३पर्यंत सावकाश थंड होत असताना द्रव विद्रावाचे प्रमाण कमी होत जाते व त३ ला ‘ ट ’ संघटनाचे घन स्फटिक तयार होतात. असे मंद शीतलन चालू असताना मिश्रधातू हळूहळू अनेक समतुल्य अवस्थांतून जाते. आ. २ मध्ये तांबे व निकेल यांची समतोलावस्था आकृती दाखविली आहे. घन विद्राव आकृतीचे हे एक महत्त्वाचे उदाहरण होय.
अ व ब यांच्यात घन अवस्थेत अपूर्ण विद्राव्यता असेल, तर घन विद्रावाची विद्राव्यता-रेषा समतोलावस्था आकृतीवर दर्शविली जाते. त्यातून तयार होणाऱ्या समतोलावस्था आकृत्यांचे काही प्रकार खाली दिलेले आहेत.

द्रवण कांतिक : ( आ. ३ ). धातू/संयुगांच्या मिश्रण प्रणालीमध्ये मिश्रणाचा वितळबिंदू हा मूळ धातू/संयुगाच्या वितळबिंदूपेक्षा कमीकमी होत जाताना दिसतो व एका विशिष्ट मिश्रणामध्ये तो नीचतम बनतो. अशा मिश्रणाला द्रवण कांतिक मिश्रण म्हणतात. प्रणालीमध्ये असे मिश्रण फक्त एकच असते. फक्त तांबे-मॅग्नेशियम या अपवादात्मक प्रणालीत अशी अधिक मिश्रणे दिसतात. ह्या मिश्रणांचे वैशिष्टय म्हणजे यांची सूक्ष्म संरचना तंतुमय किंवा पटलांच्या स्वरूपाची असते. त्यामुळे उभय पदार्थांतील बंधन दृढ होऊन त्यांचे यांत्रिक बल उच्च्तम राहते. व्यवहारामध्ये असे द्रवण कांतिक मिश्रण पितळ, कासे ( बाँझ ), वितळजोडधातू यांत आढळते.
आ. ३ मधील आकृतीत ‘ अ ’ व ‘ ब ’ या धातूंमध्ये द्रवावस्थेत पूर्ण विद्राव्यता असते पण घन अवस्थेत विद्राव्यता अपूर्ण असते. ब हा अ मध्ये विरघळून ‘ य ’ घन विद्राव तयार होतो आणि अ हा ब मध्ये विरघळून ‘ ख ’ घन विद्राव तयार होतो. य व ख यांची संरचना निरनिराळी असते व त्यांची विद्राव्यताही तापमानाप्रमाणे बदलते. तअ व तब हे शुद्ध धातूंचे घनीभवन बिंदू आहेत. ‘ अ ’ मध्ये ‘ ब ’ मिसळल्याने घनीभवन बिंदू तअस या आलेखाप्रमाणे कमी होत जातो, तसेच ‘ ब ’ मध्ये ‘ अ ’ मिसळल्यानेघनी-भवन बिंदू तबस या आलेखाप्रमाणे कमी होत जातो. तअस आणि तबस या आलेखांना द्रवालेख म्हणतात व हे आलेख घनीभवनाची सुरूवात दर्शवितात. ‘ स ’ हा द्रवण कांतिक बिंदू होय. या संघटनाच्या मिश्रधातूमध्ये तस या तापमानाला द्रव स्थितीतून य व ख घन विद्रावांचे एकत्रित घनीभवन होते.
‘ ट ’ या संघटनाच्या मिश्रधातूमध्ये द्रवावस्थेपासून मंद-शीतलन करीत असता होणारे बदल टट या पृथक् रेषेच्या साहाय्याने समजतील. घनीभवन त१ ला सुरू होते व तस ला पूर्ण होते. त१ ला प्रथम तयार होणारे ‘ य ’ चे घन स्फटिक ग१ या संघटनाचे असतात. शीतलन चालू असताना घन स्फटिकाचे संघटन ग१गस या रेषेप्रमाणे व द्रवाचे संघटन ज१स या रेषेप्रमाणे बदलत जाते. त२ या तापमानाला मिश्रधातूचे संघटन असे : ग२ संघटनाचा ‘ य ’ घन विद्राव, ज२ संघटनाचा द्रव विद्राव आणि या दोहोंचा भार या प्रमाणात आहे.
|
भार |
पज२ ग २ प |
मंद-शीतलन होत असताना पस या बिंदूवर मिश्रधातू आल्यावर घनीभवन न झालेल्या ( ‘ स ’ संघटनाचे ) द्रवामध्ये संघनीभवन होते आणि य व ख यांचे सूक्ष्म मिश्रण असलेला घन तयार होतो. यानंतर मिश्रधातूचे संघटन ‘ य + ख ’ असे राहते.
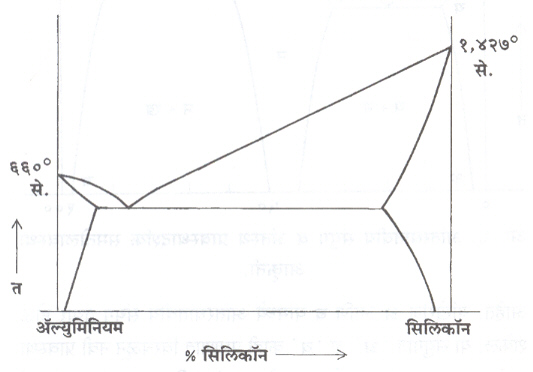
आ. ४ मध्ये अल्युमिनियम व सिलिकॉन यांची समतोलावस्था आकृती दर्शविली आहे. हे द्रवण कांतिक आकृतीचे उदाहरण होय.
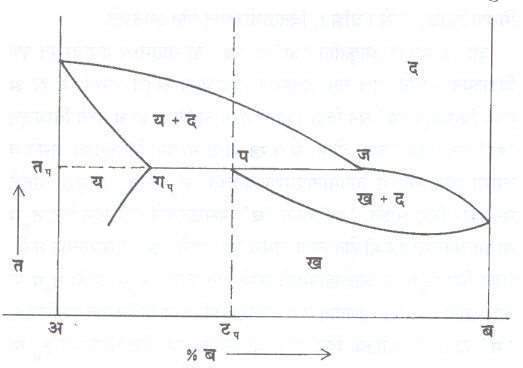
परिघनीभवन : ( आ. ५). या प्रकियेमध्ये एक घन विद्राव व द्रव यांपासून दुसरीच घन विद्राव प्रावस्था तयार होते. टप या संघटनाच्या धातूचे मंद-शीतलन विचारात घ्या. ‘ प ’ या बिंदूच्या आधी मिश्रधातूचे संघटन गप या संघटनाचा विद्राव य आणि ज या संघटनाचा द्रव ‘ द ’ असे सांगता येते. ‘ तप ’ या तापमानास परिघनीभवन ही प्रक्रिया घडते व द्रव ‘ द ’ आणि ‘ य ’ यांपासून ‘ ख ’ हा नवा घन विद्राव तयार होतो. टप हून कमी प्रमाणात ‘ ब ’ असलेल्या मिश्रधातूमध्ये तप च्या आधी परिघनीभवनास जरूर असलेल्या भागापेक्षा अधिक प्रमाणात ‘ य ’ विद्राव असतो. त्यामुळे परिघनीभवनानंतर ‘ य + ख ’ असे त्यांचे संघटन राहते. गप ते ज पर्यंतच्या सर्व मिश्रधातूंमध्ये तप ला परिघनीभवन प्रक्रिया घडते. तांबे-जस्त, तांबेकथिल इ. अनेक मिश्रधातूंच्या आकृतीत ही प्रक्रिया दिसून येते. याचा गुणधर्म वृद्धीगत करण्यासाठी खास उपयोग होत नाही तथापि संरचना बदलल्याचे आढळून येते.
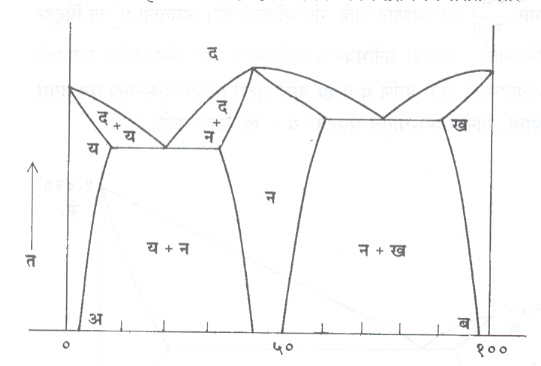
आंतरधातवीय संयुग व अंतस्थ प्रावस्था : ( आ. ६). वर सांगितलेल्या आकृतीत य व ख हे प्राथमिक घन विद्राव विचारात घेतले आहेत. यांखेरीज अ आणि ब यांमध्ये आंतरधातवीय संयुग तयार होऊ शकेल. या संयुगात ‘ अ ’ वा ‘ ब ’ काही प्रमाणात विरघळून नवी प्रावस्था ( अंतस्थ प्रावस्था ) तयार होऊ शकते. ‘ अ ’ आणि ‘ ब ’ यांच्यात अपूर्ण घन विद्राव्यता असेल व अ-ब संयुगातून तयार झालेली ‘ न ’ ही अंतस्थ प्रावस्था आणि ‘ य ’ वा ‘ ख ’ यांच्यात घनीभवन घडत असेल, तर आ. ६ प्रमाणे समतोलावस्था आकृती तयार होईल. अशा प्रावस्था तांबे- अल्युमिनियम, जस्त-अँटिमनी, अल्युमिनियम-मॅग्नेशियम या समतोलावस्था आकृत्यांत आढळून येतात.
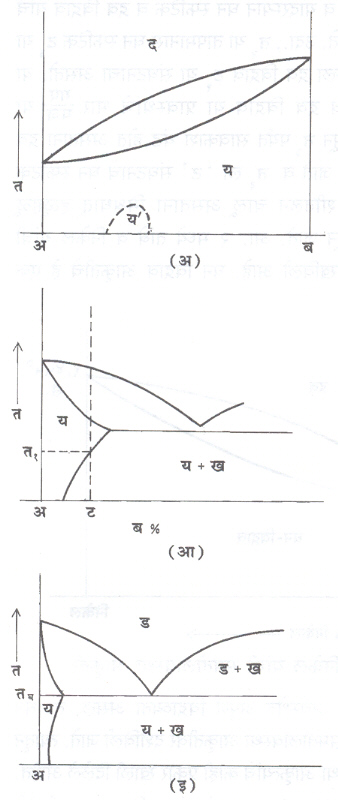
घन-अवस्थेतील अनियमित संकमणे : काही मिश्रधातूंचे शीतलीकरण होताना कमवार घनीकरण न होता काही अणू स्थानभष्ट होऊन एकाच प्रकारचे दोन अणू जवळ येतात व कम बदलतात. यामुळे अणूंच्या जालकांत थोडी विकृती येण्याचीही शक्यता असते. यास अनियमित संकमण म्हणतात. क्ष-किरण विवर्तन किंवा इलेक्ट्नॉन विवर्तन पद्धतीने अवलोकन केले असता हे बदल दिसतात सम-तोलावस्था आकृत्यांत ही संकमणे पृथक् रेषेने दाख-वितात [आ. ७( अ) व (आ)]. या संकमणाचा परिणाम विद्युत् संवाहकता व विशिष्ट उष्णतेवर होतो, मात्र यांत्रिकी गुणधर्मांवर खास परिणाम होत नाही. लोखंड-मँगॅनीज, लोखंड–निकेल, तांबे-जस्त, मॅग्नेशियम-कॅडमियम अशा मिश्रधातूंमध्ये ही विशेषत: आढळते.
पोलाद, तांबे-अल्यु-मिनियम इ. काही मिश्रधातूं-मध्ये घन-व्दिस्फटिकीभवन घडते [आ. ७ ( इ )]. ‘ ड ’ घन विद्रावात तघ या तापमानास परिवर्तन होऊन ‘ य ’ आणि ‘ I’ या घन प्रावस्था एकाच वेळी तयार होतात व सूक्ष्म मिश्रणाच्या स्वरूपात राहतात. पोलादाच्या उष्णता संस्करणामध्ये घन-व्दिस्फटिकीभवनाला फार महत्त्व आहे, कारण त्याचा पोलादाच्या यांत्रिक शक्तीवर तसेच चुंबकीय गुणधर्मांवर परिणाम होतो.
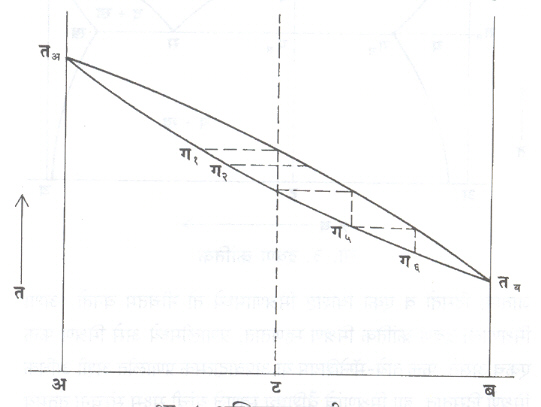
अस्थिरावस्था-शीतलन : समतोलावस्था आकृती तयार करताना मिश्रधातू द्रवावस्थेपासून अत्यंत मंद गतीने थंड केलेला आहे, असे गृहीत धरले जाते. मंद-शीतलनाने सर्व प्रक्रिया स्थिरावस्थेस ( समतोलावस्थेस ) जातात व मिश्रधातूचे संघटन नक्की सांगता येते. उदयोगधंद्याच्या व्यवहारात इतके सावकाश शीतलन शक्य नसते. त्यामुळे मिश्रधातूंतील प्रक्रिया आकृती क. ८ प्रमाणे तंतोतंत घडत नाहीत. त्यांत थोडे बदल घडून येतात. आ. ८ मध्ये ‘ ट’ या मिश्रधातूत पहिले स्फटिक ग१ या संयुगाचे, त्यानंतर ग२ संयुगाचे, शेवटचे ग५ व ग६ या संयुगांचे तयार होतात. सर्व स्फटिकांमध्ये समान संयुग तयार होण्यास पुरेसा वेळ मिळत नाही. अशी मिश्रधातू सूक्ष्मदर्शकाखाली पाहिली, तर तिच्यातील स्फटिक झाडाच्या फांदयांसारखे दिसतात व त्यांच्यात घटक पदार्थांचे प्रमाण निरनिराळे असते.
या स्फटिकांना वृक्षाभ स्फटिक व रासायनिक विषमतेला वृक्षाभ विषमता असे म्हणतात. ( आ. ९). अशा मिश्रधातूचे गुणधर्म कमी प्रतीचे असतात व काही विषमता घालविण्यासाठी मंद-शीतलन करावे लागते.
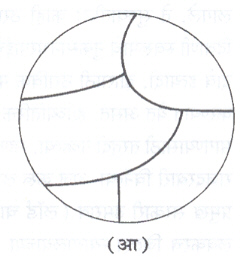
मंद-शीतलनानंतर वृक्षाभ स्फटिक जाऊन बहुभुजाकृती स्फटिक तयार होतात व गुणधर्म सुधारतात.
पहा : ऊष्मागतिकी घन विद्राव धातूंचे अवक्षेपण कठिनीकरण पितळ पोलाद प्रावस्था नियम मिश्रधातु.
संदर्भ : 1. Barrow, G. M. Physical Chemistry, 1988.
2. Ginell, R. Associa-tion Theory : The Phases of Matter and Their Transformations, 1979.
3. Levine, N. Physical Chemistry, 1994.
4. Wetrmore, F. E. LeRoy, D. J. Principles of Phase Equilibria, 1951.
खानगांवकर, प. रा.